Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
A novel coronavirus (SARS-CoV-2) and COVID-19
By the end of 2019 the first cases of severe pneumonia of unknown origin were reported in Wuhan, China. The causative agent was identified as a novel b-coronavirus SARS-CoV-2 and the disease was named COVID-19. Since the beginning of 2020, the infection has spread worldwide, which led the WHO to declare COVID-19 a public health emergency of international concern and to characterize the current situation as a pandemic.
The transmission occurs mainly via respiratory droplets and the incubation period ranges from 2 to 14 days. Most cases are mild, but some patients develop severe pneumonia with acute respiratory distress, septic shock and multi-organ failure. The most common symptoms include fever, dry cough, myalgia and shortness of breath. Characteristic laboratory findings are normal white blood cell count or mild leukopenia, marked lymphopenia, in severe cases elevated CRP, procalcitonin, LDH, and D-dimer are commonly found. Typical imaging findings include multifocal peripherally distributed ground-glass opacities or consolidations, interlobular septal thickening, crazy paving appearance and cystic changes. The overall case fatality rate is estimated to range from 1 to 3 %, however, it is dependent on age and underlying medical comorbidities. Current potential treatment options include hydroxychloroquine, remdesivir, lopinavir/ritonavir and convalescent plasma.
Keywords:
Coronaviruses – SARS-CoV-2 – COVID-19 – pneumonia
Autoři:
Milan Trojánek 1,2,3; Vyacheslav Grebenyuk 1,3; Kristýna Herrmannová 3; Tomáš Nečas 4; Jana Gregorová 5; Martin Kucbel 6; Robin Šín 7; Hana Roháčová 3; František Stejskal 1,3,8,9
Působiště autorů:
Klinika infekčních nemocí 2. LF UK a Nemocnice Na Bulovce, Praha
1; Katedra infekčního lékařství, IPVZ, Praha
2; Klinika infekčních, parazitárních a tropických nemocí, Nemocnice Na Bulovce, Praha
3; Pediatrické oddělení, Krajská nemocnice T. Bati, Zlín
4; Oddělení klinické farmacie, Nemocnice Na Bulovce, Praha
5; Radiodiagnostická klinika, Nemocnice Na Bulovce, Praha
6; Klinika infekčních nemocí a cestovní medicíny LF UK a FN Plzeň
7; Ústav imunologie a mikrobiologie 1. LF UK a VFN, Praha
8; Infekční oddělení, Krajská nemocnice Liberec
9
Vyšlo v časopise:
Čas. Lék. čes. 2020; 159: 55-66
Kategorie:
Přehledový článek
Souhrn
Koncem roku 2019 byly v čínském Wu-chanu popsány první případy závažně probíhající pneumonie nejasného původu. Bylo prokázáno, že původcem onemocnění je nově identifikovaný b-koronavirus, který byl označen jako SARS-CoV-2 a onemocnění jím vyvolané jako COVID-19 (coronavirus disease 2019). Počátkem roku 2020 došlo k významnému rozšíření nákazy do řady světových regionů, proto Světová zdravotnická organizace (WHO) 30. ledna vyhlásila stav ohrožení veřejného zdraví mezinárodního významu a 11. března šíření infekce označila za pandemii.
Nákaza se přenáší především kapénkovou cestou a její inkubační doba se uvádí mezi 2 a 14 dny. U většiny infikovaných probíhá onemocnění mírně, avšak u některých pacientů může dojít až k rozvoji závažně probíhající pneumonie, syndromu akutní respirační tísně (ARDS), septického šoku a multiorgánového selhání. Mezi nejčastější symptomy infekce patří horečka, dráždivý kašel, bolesti svalů nebo dušnost. Typické laboratorní nálezy zahrnují normální či mírně snížený počet leukocytů, lymfocytopenii, u závažně nemocných se zvyšuje hodnota LDH, D-dimerů, CRP, případně i prokalcitoninu. Mezi nejčastěji popisované radiologické nálezy patří multifokální periferně lokalizované opacity charakteru mléčného skla nebo konsolidace, zesílení sept, crazy paving či cystické změny. Smrtnost infekce je závislá na věku postiženého, jeho komorbiditách a obvykle bývá udávána mezi 1 a 3 %. V terapii se zvažuje podání hydroxychlorochinu, remdesiviru, lopinaviru/ritonaviru či rekonvalescentního séra.
Klíčová slova:
koronaviry – SARS-CoV-2 – COVID-19 – pneumonie
ÚVOD
Koronaviry představují významné původce akutních respiračních infekcí. Některé z nich (HCoV-229E, HCoV-OC43, HCoV-NL63 a HCOV-HKU1) se uplatňují jako původci běžných a obvykle nekomplikovaných infekcí horních či dolních cest dýchacích (1). Avšak počátkem tohoto století se ukázalo, že koronaviry mohou vyvolat i epidemie závažně probíhajících infekcí. V letech 2002–2003 proběhla epidemie onemocnění SARS (severe acute respiratory syndrome), která byla vyvolána novým vysoce patogenním koronavirem SARS-CoV. Celkem bylo Světové zdravotnické organizaci (WHO) hlášeno 8096 nakažených a nemoci podlehlo 774 z nich (smrtnost u hlášených případů 9,6 %). Na Blízkém východě byl v roce 2012 popsán výskyt další závažně probíhající koronavirové infekce MERS (Middle East respiratory syndrome) a do února letošního roku bylo diagnostikováno celkem 2519 případů, přičemž 866 pacientů zemřelo (smrtnost 34,4 %). Ukázalo se, že původními hostiteli obou těchto virů jsou netopýři, z nichž došlo k přenosu na další savce (cibetkovité šelmy v případě SARS-CoV a velbloudy v případě MERS-CoV) a teprve následně na člověka. U SARS došlo k epidemickému šíření mezi lidmi v období od listopadu 2002 do července 2004, ale přísnými karanténními opatřeními byla tato infekce eliminována. MERS se objevuje ve formě sporadických infekcí nebo malých epidemií především na Arabském poloostrově dosud (1, 2).
V prosinci 2019 byly ve Wu-chanu, hlavním městě čínské provincie Chu-pej, popsány první případy nového akutního a závažně probíhajícího respiračního onemocnění, pro které bylo typické postižení dolních cest dýchacích a jež bylo vyvoláno dosud neznámým virovým agens. Některé z prvních případů onemocnění měly spojitost s místním velkoobchodním tržištěm Chua-nan, na kterém se prodávaly desítky různých druhů živých zvířat a masa v různém stupni zpracování. Již v průběhu prosince bylo ve Wu-chanu hospitalizováno 27 pacientů, z toho 8 bylo v kritickém stavu. Dne 31. prosince byla o výskytu nové infekce informována čínská pobočka Světové zdravotnické organizace (WHO) a místními i státními orgány veřejného zdraví bylo zahájeno vyšetřování epidemiologických souvislostí (3, 4).
Jako původce onemocnění byl identifikován nový b-koronavirus, který byl nejprve označen 2019-nCoV (novel coronavirus) a později jej Mezinárodní výbor pro klasifikaci virů (ICTV) pojmenoval SARS-CoV-2. Onemocnění vyvolané tímto koronavirem bylo označeno jako COVID-19 (coronavirus disease 2019).
PREVALENCE
Koncem ledna bylo v Číně diagnostikováno celkem 7734 případů infekce a 90 dalších bylo hlášeno z 19 různých zemí. Dne 30. ledna 2020 byl WHO vyhlášen stav ohrožení veřejného zdraví mezinárodního významu. V průběhu února se epicentrum nákazy přesouvá do Evropy (5). První případy infekce COVID-19 v České republice byly diagnostikovány 1. března 2020, přičemž u všech došlo k nákaze pravděpodobně v Itálii (MZ ČR). Od konce prosince 2019 do 10. května 2020 bylo dosud celosvětově hlášeno celkem 4 097 158 případů onemocnění, z toho 282 495 nemocných infekci podlehlo (smrtnost u hlášených případů 6,9 %). Z celkového počtu případů je více než 1,48 milionu hlášeno z Evropy (z toho 560 tisíc zotavených a 142 tisíc úmrtí) a 1,36 milionu ze Spojených států amerických (z toho 210 tisíc zotavených a 80 tisíc úmrtí). V České republice bylo ke shodnému datu hlášeno celkem 8123 případů onemocnění (z toho 4482 vyléčených) a 280 úmrtí v souvislosti s COVID-19 (smrtnost 3,4 %). Vzhledem k dalšímu celosvětovému šíření infekce byl výskyt onemocnění COVID-19 dne 11. března 2020 Světovou zdravotnickou organizací označen za pandemii (6).
PŮVODCE ONEMOCNĚNÍ
Koronaviry jsou středně velké obalené viry (60–140 nm), jejichž genom je tvořen nesegmentovanou jednovláknovou RNA pozitivní polarity o velikosti 26–32 kb. Nukleokapsida bývá pleomorfní a obvykle sférického tvaru. Název celé čeledi je odvozen od typického vzhledu virionu v elektronovém mikroskopu, neboť povrchové S proteiny připomínají věnec či sluneční koronu při zatmění (z lat. corona = koruna, věnec).
Koronaviry se dělí do 4 rodů: a-, b-, g- a d-koronaviry, přičemž a- a b-koronaviry mohou infikovat savce, zatímco g- a d-koronaviry infikují savce i ptáky (1, 3). Dosud bylo identifikováno 7 různých lidských koronavirů, které náleží do dvou rodů. Mezi a-koronaviry patří HCoV-229E a HCoV-NL63, zatímco mezi b-koronaviry náleží HCoV-OC43, HCoV-HKU1, ale i SARS-CoV, SARS-CoV-2 a MERS-CoV. Genom nově popsaného viru je tvořen 29 891 nukleotidy a má 79,5% sekvenční homologii s virem SARS-CoV a asi 50% s MERS-CoV. SARS-CoV-2 a SARS-CoV jsou řazeny do podrodu Sarbecovirus, na rozdíl od MERS-CoV, který náleží do odlišného podrodu Merbecovirus (1–3).
K přenosu zvířecích koronavirů na lidskou populaci dochází při těsném kontaktu člověka se zvířaty, přičemž zcela ideální podmínky pro tento přenos byly v případě SARS-CoV-2 vytvořeny na tržišti v čínském Wu-chanu. Dosud není přesně jasné, který zvířecí druh byl mezičlánkem, od něhož došlo k přenosu infekce na člověka. Mezi nejbližší příbuzné nového koronaviru patří b-koronaviry izolované od netopýrů, přičemž s koronavirem RaTG-13, který byl izolován v roce 2013 v čínské provincii Yunan, má sekvenční homologii 96,2 % a s viry bat-SL-CoVZC45 a bat-SL-CoVZXC21, které byly zachyceny ve východní Číně v roce 2018, potom přibližně 88 %. Spekulovalo se, že k přenosu na člověka došlo z luskounů, avšak podrobnější molekulárně biologické analýzy zatím tuto teorii nepotvrdily (1–3, 7).
Při genomické analýze 103 kmenů SARS-CoV-2 bylo zjištěno, že v průběhu evoluce vznikly 2 genetické linie viru označovaných jako linie S a L. Poslední jmenována je evolučně mladší, virulentnější, vyvolává onemocnění závažnějšího průběhu a šíří se rychleji. Protiepidemická opatření však vedou k selekčnímu tlaku a vzájemné zastoupení linii se postupně mění ve prospěch méně agresivní linie S (8).
SARS-CoV-2 je tvořen 4 hlavními strukturálním proteiny: povrchovým (S), obalovým (E), transmembránovým (M) glykoproteinem a vnitřním fosforylovaným nukleokapsidovým proteinem (N). Genom viru dále kóduje celkem 16 nestrukturálních proteinů (nsp1-nsp16) a akcesorní proteiny. Hlavní faktor virulence však představuje především povrchový S (spike) glykoprotein, který je tvořen 2 podjednotkami S1 a S2. První z nich (S1) slouží k vazbě virionu na buněčné receptory a její struktura ovlivňuje buněčný a hostitelský tropismus viru, zatímco druhá (S2) se uplatňuje při fúzi viru s buněčnou membránou. Povrchový S protein vyvolává tvorbu specifických neutralizačních protilátek (1, 2, 7).
EPIDEMIOLOGIE
Onemocnění COVID-19, podobně jako většina jiných akutních virových respiračních infekcí, představuje kapénkovou nákazu. Hlavním zdrojem viru je infikovaný člověk, který jej vylučuje zejména respiračními sekrety při kašlání a kýchání. Takto vzniklé relativně velké kapénky o průměru > 5–10 mm se obvykle šíří pouze na krátké vzdálenosti (1–2 metry) a následně působením tíhy klesají k zemi a ulpívají na površích. K samotnému přenosu infekce dochází nejčastěji vdechnutím nebo přímým zasažením sliznic kapénkami při úzkém kontaktu s infikovanou osobu nebo nepřímo kontaktem s kontaminovanými předměty či povrchy (7, 9). Virus zůstává infekční na řadě povrchů, přičemž v laboratorním experimentu bylo prokázáno, že na plastech a nerezové oceli vydržel více než 72 hodin, na kartonu přibližně 24 hodin a na mědi 4 hodiny (10).
Infekční částice nemají tendenci přetrvávat ve vzduchu, na rozdíl od menších částeček (< 5 μm), které se uplatňují při přenosu tzv. vzdušných nákaz, mezi něž řadíme například spalničky či plané neštovice. V případě COVID-19 nebyl přenos vzdušnou cestou dosud prokázán, avšak zvažuje se, že by k němu teoreticky mohlo dojít při dlouhodobější expozici infekčnímu aerosolu v nemocničním prostředí. V laboratorních podmínkách bylo prokázáno, že virus zůstal infekční v aerosolu po dobu 3 hodin, což může mít význam při provádění úkonů, během kterých aerosol vzniká (např. orotracheální intubace, neinvazivní ventilace, bronchoskopie, stomatologické výkony nebo kardiopulmonální resuscitace) (7, 9, 10).
Při péči o pacienty se suspektním nebo prokázaným onemocněním COVID-19 doporučuje WHO zdravotnickému personálu používat osobní ochranné pomůcky (OOP), mezi které patří voděodolný plášť či zástěra, ochranné brýle nebo štít, chirurgická obličejová maska, přičemž u výkonů spojených s tvorbou aerosolu je nutno použit respirátor třídy FFP2 (filtering face piece) nebo FFP3 (9, 11). V prevenci přenosu infekce COVID-19 na zdravotnický personál s ohledem na možný nedostatek OOP doporučuje WHO podle míry rizika jejich následující užití (11):
- Triáž pacientů (dotazování, bezkontaktní měření teploty): užívání OOP není vyžadováno, je doporučován odstup min. 1 metr od pacientů, případně je doporučena chirurgická maska, ochrana očí a dostatečná hygiena rukou.
- Péče o pacienty se suspektní či prokázanou nákazou COVID-19, jež není spojená s výkony generujícími aerosol: doporučují se standardní OOP, chirurgická maska, plášť, rukavice, ochranné brýle či štít.
- Péče o pacienty spojená s výkony generujícími aerosol: jednoznačně doporučen respirátor třídy FFP2/FFP3 a další OOP včetně pláště, zástěry, rukavic a ochranných brýlí či štítu.
Standardní chirurgická rouška poskytuje ochranu horních dýchacích cest uživatele proti kapénkám a zároveň snižuje pravděpodobnost kontaminace sliznic při dotyku obličeje. Respirátor chrání před vdechnutím kapének i malých vzduchem přenosných částic, avšak na rozdíl od roušek je před užitím nutná zkouška přiléhavosti. Stupně protekce respirátorů se odvozují od účinnosti při filtraci částic a v prevenci přenosu SARS-CoV-2 při práci v prostředí s infekčním aerosolem se doporučují respirátory třídy FFP2 či FFP3 (9, 11). Doporučená doba používání respirátoru se pohybuje v rozmezí 3–8 hodin, avšak v podmínkách nedostatku ochranných pomůcek se může podle platného doporučení Centra pro kontrolu a prevenci nemocí (CDC) tato doba prodloužit (např. na celou dobu trvání pracovní směny personálu).
Jak již bylo uvedeno, hlavním zdrojem viru je infikovaný člověk. K vylučování dochází i u pacientů s asymptomatickým průběhem, u nemocných před rozvojem symptomů a virus rovněž zůstává detekovatelný v nosohltanu i po ústupu klinických obtíží. Medián doby, kdy lze virovou RNA prokázat ve vzorcích z nosohltanu, dosahuje 20 dnů, ale byly popsány rovněž případy, kdy tato doba byla více než dvojnásobná (4, 7, 12, 13). Dosud však není zcela zřejmé, jak dlouho zůstává pacient v rekonvalescenci infekční. V německé studii bylo prokázáno, že vylučování viru je nejvyšší během prvního týdne onemocnění a infekční virus se podařilo izolovat pouze v prvních 8 dnech od začátku obtíží, přestože virová RNA byla v nosohltanu přítomná podstatně déle. Autoři studie zároveň upozorňují, že se podařilo prokázat aktivní replikaci viru na sliznicích horních cest dýchacích a na rozdíl od SARS-CoV byla virová nálož ve vzorcích z nosohltanu podstatně vyšší a časněji průkazná, což zřejmě může vysvětlit snazší šíření viru (14). Virus byl u některých pacientů prokázán i ve stolici, přičemž delší vylučování bylo popsáno u dětí, avšak dosud není zcela zřejmé, zda se fekálně-orální přenos významněji uplatňuje při šíření infekce (4, 7, 12).
K nákaze jsou náchylné osoby všech věkových skupin, nezávisle na pohlaví či etnickém původu, přičemž bylo prokázáno, že u dětí a mladistvých infekce častěji probíhá subklinicky či zcela asymptomaticky, zatímco u seniorů je vyšší riziko závažnějšího průběhu. Obdobně jako u jiných infekcí případnou roli hraje i velikost infekční dávky. Při šíření infekce se budou uplatňovat především osoby s mírným či subklinickým průběhem, případně nemocní před rozvojem klinických obtíží nebo zcela asymptomatičtí jedinci (4, 7, 12, 15).
Pro správné pochopení epidemiologie onemocnění budou významná data ze séroprevalenčních studií, která přispějí k zjištění zastoupení infikovaných s asymptomatickým průběhem. Vzhledem k tomu, že epidemie stále probíhá a v řadě zemí ještě nedosáhla vrcholu, lze podíl osob, které infekci již prodělaly, obtížně stanovit. Studie finského zdravotního ústavu, která využila k diagnostice rychlotesty na detekci protilátek a virus neutralizační test k jejímu potvrzení a proběhla v Helsinkách a provincii Uusimaa na vzorcích krve získaných k jiným účelům v období od 23. 3. do 12. 4. 2020, prokázala, že séroprevalence na vzorku 442 osob stoupla z 0,7 % (13. týden) na 3,4 % (15. týden), přestože ve Finsku bylo k 18.4. celkem hlášeno pouze 63,2 případu/100 000 obyvatel. Celkové počty případů a úmrtí na 1 milion obyvatel jsou v Česku a ve Finsku přibližně stejné, přičemž u nás bylo provedeno asi o polovinu více testů na počet obyvatel (6).
Obdobně jako u SARS a MERS, byli i v případě infekce COVID-19 popsáni tzv. superšiřitelé, což jsou osoby, jež kvůli svým četným společenským kontaktům v době, kdy vylučují virus, mohou infekci přenést na řadu dalších osob (4, 12).
Inkubační doba onemocnění se dle většiny studií pohybuje v rozmezí 2–14 dní, s mediánem okolo 4–6 dní (4, 7, 12, 16). Jedny z posledních studií uvádějí shodně medián inkubační doby 5,2 dne, avšak liší se v konfidenčních intervalech (4,4–6,0 a 1,8–12,4) (17, 18). Autoři uvádějí, že u 97,5 % infikovaných se příznaky objeví do 10,5 dne, avšak upozorňují, že až u 64 z 10 000 infikovaných dojde k rozvoji onemocnění až po uplynutí obvykle udávaných 14 dnů (18). Sériový interval, který vyjadřuje čas mezi infekcí a přenosem na další osobu, bývá uváděn v rozmezí 4–8 dnů, avšak dosud nejrozsáhlejší studie uvádí rozmezí 4–5 dnů (16, 19).
Pro vyjádření dalšího šíření infekce v populaci je významný tzv. index nakažlivosti neboli základní reprodukční číslo (R0), což je epidemiologický parametr, který vyjadřuje předpokládaný počet osob, které jeden infikovaný člověk dále nakazí, pokud jsou k této infekci náchylní. Dostupné studie uvádí R0 v rozmezí 1,9–6,5. Ukazuje se však, že tento údaj se v jednotlivých studiích významně liší a souvisí s řadou společenských faktorů i zdravotních opatření v dané populaci (7, 15, 16).
DIAGNOSTIKA
WHO definuje suspektní případ následujícími způsoby:
- a) Pacient s akutním respiračním onemocněním (horečka + alespoň 1 respirační příznak, např. kašel či dušnost), u kterého nebyla prokázána jiná etiologie a ve 14 dnech před rozvojem příznaků pobýval v oblasti s lokálním přenosem infekce.
- b) Pacient s akutním respiračním onemocněním (horečka a alespoň 1 respirační příznak), který byl v 14 dnech před rozvojem příznaků v kontaktu s potvrzeným či pravděpodobným případem infekce COVID-19.
- c) Pacient se závažnou akutní respirační infekcí vyžadující hospitalizaci, u kterého nebyla prokázána jiná etiologie.
Potvrzený případ je pacient s laboratorně potvrzenou infekcí bez ohledu na symptomy či anamnézu a pravděpodobný případ je suspektní případ s nejednoznačným laboratorním výsledkem (6).
Zlatý standard v diagnostice infekce COVID-19 představuje detekce virové RNA pomocí RT-PCR (4, 7). Pro kvalitní diagnostiku je však zásadní správný odběr vhodného vzorku. Užívá se především vzorků z nosohltanu či respiračních sekretů z dolních cest dýchacích, avšak asi u 15 % hospitalizovaných pacientů s pneumonií byla virová RNA prokázána i v séru (20). Ve studii, která srovnávala záchyt virové RNA v různých vzorcích od 205 pacientů s COVID-19, bylo zjištěno, že nejvyšší pozitivita byla prokázána u vzorků z bronchoalveolární tekutiny (93 %), sputa (72 %), výtěru z nosu (63 %), naopak ve výtěru z hrdla (32 %) či v krvi (1 %) byl záchyt nízký (21). Obdobná zjištění poukazující na vyšší virovou nálož ve vzorcích z dolních cest dýchacích a v nose uvádí i další autoři. Studie provedená v čínském Šen-čenu rovněž prokázala, že virová RNA byla nejčastěji zachycena ve vzorcích sputa (74,4–88,9 %) a ve výtěru z nosu (53,6–73,3 %) v prvních 14 dnech infekce, avšak virová RNA byla přítomna i u nemocných, u kterých byl vzorek odebrán po více než 15 dnech od začátku symptomů (42,9–61,1 %). Naopak ve vzorcích z orofaryngu byl záchyt po > 8 dnech od začátku příznaků minimální (22).
Sérologická vyšetření v diagnostice infekce v její akutní fázi nemají zásadní roli, jejich význam spočívá především v retrospektivním průkazu infekce, případně v populačních séroprevalenčních studiích a při objasňování role asymptomatických jedinců. Na vzorku 39 pacientů bylo zjištěno, že protilátky (IgM i IgG) byly průkazné již od 5. dne od začátku infekce (23). Obdobná studie, která vyhodnotila vzorky od 173 pacientů uvádí, že senzitivita protilátkových testů v prvních 7 dnech byla pouze 38,3 %, avšak mezi 8. a 14. dnem již dosáhla 89,6 %, z čehož IgM protilátky byly přítomny v 73,3 % a IgG v 54,1 % (24). Autoři obou studií proto poukazují na vhodnost doplnění sérologického testu zejména při negativitě RT-PCR a u nemocných s delší dobou trvání symptomů (23, 24).
Zlatým standardem sérologické diagnostiky koronavirových nákaz je virus-neutralizační test, jenž umožňuje kvantifikaci titru protilátek s vysokou senzitivitou i specificitou. Omezením pro rutinní užití testu je jeho vysoká technická a časová náročnost. Dostupnější alternativou je ELISA, přičemž podobných výsledků dosahují jak různé in-house vyráběné soupravy, tak i komerčně distribuované kity. Zkřížená sérologická reaktivita s běžně cirkulujícími lidskými koronaviry je relativně nízká (25). Dle údajů Evropského centra pro kontrolu a prevenci nemocí (ECDC) je na evropském trhu v současné době k dispozici přes 60 rychlotestů na průkaz protilátek proti SARS-CoV-2 od různých výrobců a jejich nabídka se neustále rozšiřuje. Dosud nebyly publikované žádné validační studie a údaje o efektivitě všech komerčně dostupných rychlotestů jsou podloženy pouze prohlášením výrobce. Pozitivita rychlotestu neznamená ochranu proti infekci, rovněž tak nemůže sloužit ani jako důkaz pro neinfekčnost pacienta vzhledem k protrahované době vylučování viru (6).
PATOGENEZE ONEMOCNĚNÍ A IMUNITNÍ REAKCE
Patogeneze samotného onemocnění COVID-19 dosud není přesně známá, avšak pravděpodobné mechanismy budou obdobné jako v případě infekcí SARS a MERS (26). Pro vstup do buňky využívá nový koronavirus shodný receptor jako původce SARS – angiotenzin konvertující enzym 2 (ACE2). ACE2 je exopeptidáza exprimovaná na povrchu epitelových buněk plic, tenkého střeva a buňkami endotelu. Tento enzym snižuje krevní tlak tím, že konvertuje vazokonstrikčně působící angiotenzin II na vazodilatačně působící angiotenzin 1–7 (4, 7, 26). Podle některých studií provedených na zvířecích modelech bylo prokázáno, že u mladších jedinců je exprese tohoto enzymu významně vyšší než u starších a zároveň exprese tohoto enzymu snižuje riziko rozvoje závažného plicního poškození. Naopak dosud není zcela zřejmý efekt na průběh infekce při užívání inhibitorů ACE a sartanů, které expresi tohoto enzymu zvyšují. Spekuluje se o možném zvýšení rizika rozvoje komplikovaného průběhu, avšak otázkou zůstává, zda riziko komplikací nezvyšují samotné komorbidity, pro které jsou tyto léky pacienty užívány. V současné době rozhodně není doporučeno vzhledem k pandemii COVID-19 tyto léky vysazovat či upravovat chronickou medikaci pacientů (4, 12).
Po vstupu viru do buňky je jeho genom uvolněn do cytoplazmy buňky a dochází k translaci, která je následována samotnou replikací viru. Nově syntetizované povrchové glykoproteiny jsou obaleny membránou z endoplazmatického retikula či Golgiho komplexu. Nukleokapsida je vytvořena splynutím nukleokapsidového proteinu a virového genomu. Vzniklé viriony vyzrávají v tzv. ERGIC kompartmentu (endoplasmatic reticulum-Golgi intermediate compartment) a následně jsou po fúzi s cytoplazmatickou membránou uvolněny z buňky (1).
Při vstupu do buňky jsou antigeny viru prezentovány pomocí molekul MHC, především I. třídy, antigen prezentujícím buňkám a poté jsou rozpoznány virově specifickými cytotoxickými T lymfocyty. V případě infekcí SARS a MERS bylo prokázáno, že vybrané polymorfismy molekul HLA chrání jedince či zvyšují jeho náchylnost k infekci. Prezentace virových antigenů následně aktivuje pomocí virově specifických T a B lymfocytů humorální i buněčnou imunitu (12,26).
Protilátková imunitní reakce u SARS je obdobná jako u jiných virových respiračních infekcí a spočívá v tvorbě časných IgM, které mizí do 12. týdne, a pozdních IgG protilátek, které jsou specifické proti virovému S a N antigenu. Předpokládá se, že protilátková reakce bude obdobná i u COVID-19, avšak zatím nejsou k dispozici podrobná data. V případě buněčné imunity dochází k významnému poklesu CD4+, a především CD8+ T lymfocytů a NK buněk v periferní krvi, avšak zároveň byla pozorována jejich excesivní aktivace. Podobné nálezy byly popsány i u SARS (1, 12, 26).
Právě imunitní reakce se zřejmě významně uplatňuje i v samotné patogenezi onemocnění. Bylo prokázáno, že častou příčinou úmrtí pacientů se SARS, MERS, ale i COVID-19 je rozvoj syndromu akutní dechové tísně (ARDS) (27). Jednou z možných příčin rozvoje ARDS je cytokinová bouře způsobena dysregulovanou tvorbou prozánětlivých cytokinů (např. IFN-α, IFN-γ, IL-1β, IL-6, IL-12, IL-18, IL-33, TNF-α, TGF-β), respektive chemokinů (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10). Podobně jako u SARS bylo i u MERS prokázáno, že jedinci se závažným průběhem infekce měli významně zvýšené sérové hladiny IL-6, IFN-α, CCL5, CXCL8, CXCL10 v porovnání s nemocnými, u nichž byl průběh infekce mírný či středně závažný. Lze očekávat, že také u infekce COVID-19 bude právě dysregulovaná imunitní odpověď a její důsledky, kromě samotného působení viru, významným patofyziologickým podkladem závažného průběhu infekce (12, 26).
V nekroptických vzorcích plic je popisována deskvamace pneumocytů a přítomnost hyalinních membrán, jež odpovídají ARDS. V plicní tkání je dále nalézána infiltrace intersticia mononukleáry a v alveolech bývají přítomné vícejaderné velké buňky a atypicky zvětšené pneumocyty, které jeví změny vyvolané pravděpodobně virovým cytopatickým efektem. Obdobné nálezy byly popisovány rovněž u infekcí SARS a MERS (1, 12, 27).
Zajímavostí je, že vysoce patogenní koronaviry, SARS-CoV i MERS-CoV, využívají řadu mechanismů pro únik imunitnímu dozoru a modulaci imunitní odpovědi organismu, jako je např. snížení aktivity interferonových signálních kaskád, snížení exprese genů důležitých pro prezentaci antigenu a replikace uvnitř vezikul z membrány hostitelské buňky, která brání rozpoznání molekuly dsRNA hostitelskou buňkou (26).
KLINICKÝ OBRAZ
Mezi nejčastější iniciální příznaky u symptomatických pacientů patří dle dostupných studií horečka (88,7–98,6 %), suchý dráždivý či produktivní kašel (59,4–79,0 %), pocit celkové únavy až vyčerpanosti (23,0–75,0 %), dušnost (18,7–36,7 %) a bolesti kloubů nebo svalů (14,9–34,8 %). Naopak příznaky typické pro postižení horních cest dýchacích jako rýma či pocit ucpaného nosu (4,8 %) nebo bolesti v krku (13,9–17,4 %) jsou méně časté. Někteří z nemocných dále uváděli nauzeu či zvracení (4,0–17,3 %), průjem (3,8 - 10,1 %) a bolesti břicha (2,2–5,8 %) (7, 13, 28–30). Tato data potvrzuje i rozsáhlá metaanalýza, která hodnotila celkem 61 studií s celkovým počtem 59 254 pacientů, přičemž mezi nejčastěji uváděné symptomy patřily horečka (82 %), kašel (61 %), bolesti svalů a únava (shodně 36 %), dušnost (26 %), bolesti hlavy (12 %), bolesti v krku (10 %) a gastrointestinální obtíže (9 %) (31). V některých studiích bývá dále uváděn jako relativně častý symptom ztráta čichu (anosmie) či chuti (dysgeuzie) (32).
Přestože nákaza novým koronavirem probíhá u většiny osob mírně, či dokonce zcela asymptomaticky, u některých pacientů může dojít k rozvoji závažných komplikací. V této souvislosti byla zavedena klasifikace klinického průběhu onemocnění, která rozlišuje mírný, středně závažný, závažný a kritický průběh. Mírný průběh odpovídá akutní respirační infekci s klinickými symptomy, avšak bez radiologického nálezu zánětlivých změn na plicích. U pacientů se středně závažným průběhem jsou navíc přítomné radiologicky prokázané zánětlivé změny v plicním parenchymu. V případě závažného průběhu musí pacient navíc splňovat jedno ze 3 klinických kritérií: dechová frekvence > 30/min, saturace hemoglobinu kyslíkem < 93 % nebo respirační index (poměr PaO2/FiO2) < 300 mmHg. Kritickému průběhu odpovídá závažná pneumonie komplikovaná respiračním selháním vyžadujícím umělou plicní ventilaci, šokem či jiným druhem orgánového selhání vyžadující péči na jednotce intenzivní péče (9,15).
Podle údajů získaných v rozsáhlé studii, do které bylo zařazeno více než 72 tisíc nakažených, byl klinický průběh u 80,9 % pacientů mírný či středně závažný, u 13,8 % závažný a pouze 4,7 % pacientů splnilo kritéria pro kritický průběh (4,31). Zároveň ve studii, která hodnotila klinický průběh infekce u 1099 pacientů, bylo zjištěno, že mezi nejčastější komplikace patřil rozvoj ARDS (3,4 %), septického šoku (1,1 %) a akutního renálního selhání (0,5 %), přičemž celkem 56 z 1099 pacientů (5,1 %) vyžadovalo neinvazivní ventilaci, 25 (2,3 %) umělou plicní ventilaci a 5 (0,5 %) extrakorporální membránovou oxygenaci (ECMO). Mezi další uváděné komplikace patří myokarditida či kardiální postižení (28). Na rozdíl od řady jiných infekčních nemocí je pro COVID-19 charakteristický protrahovaný průběh, který vede k pozvolnému zhoršování respiračních funkcí. Uvádí se, že ke komplikacím dochází obvykle až ve 2. týdnu trvání obtíží, přičemž v kohortové studii se 41 pacienty byl medián doby od začátku onemocnění do rozvoje dušnosti 8 dnů a do zahájení umělé plicní ventilace 10,5 dne (20).
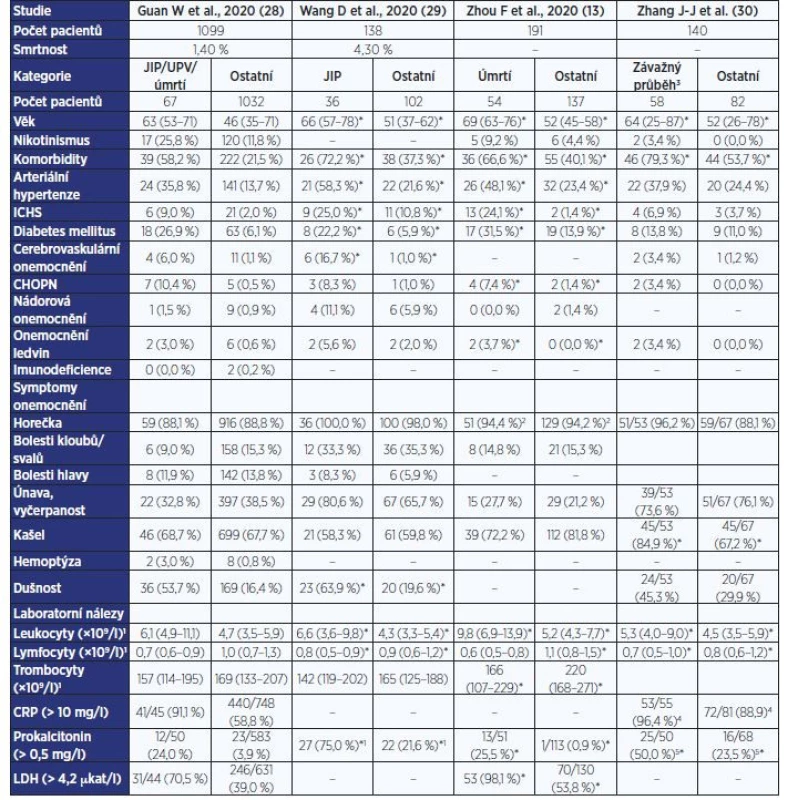
Mezi hlavní rizikové faktory pro komplikovaný průběh onemocnění podle výsledků prvních publikovaných studií patří vyšší věk a přítomnost vybraných interních komorbidit, zejména arteriální hypertenze, kardiovaskulární či cerebrovaskulární onemocnění nebo diabetes mellitus. Podrobné údaje srovnávající zastoupení jednotlivých komorbidit u pacientů s nekomplikovaným průběhem a u nemocných vyžadujících intenzivní péči či zemřelých uvádí tab. 1 (13, 28–30).
Retrospektivní kohortová studie z Wu-chanu identifikovala jako nezávislé rizikové faktory pro úmrtí pokročilý věk, vyšší vstupní skóre SOFA a elevaci D-dimerů. Autoři však dále v univariační analýze uvádí, že pacienti, kteří infekci podlehli, měli častěji tachykardii a tachypnoi, vyšší skóre qSOFA a CURB-65 (13). Obdobná studie jako rizikové faktory pro závažný průběh mimo věku a tachypnoe uvádí dále nikotinismus, vyšší vstupní tělesnou teplotu, zvýšenou hodnotu CRP a snížení albuminu (33).
LABORATORNÍ A RADIOLOGICKÉ NÁLEZY
Laboratorní nálezy
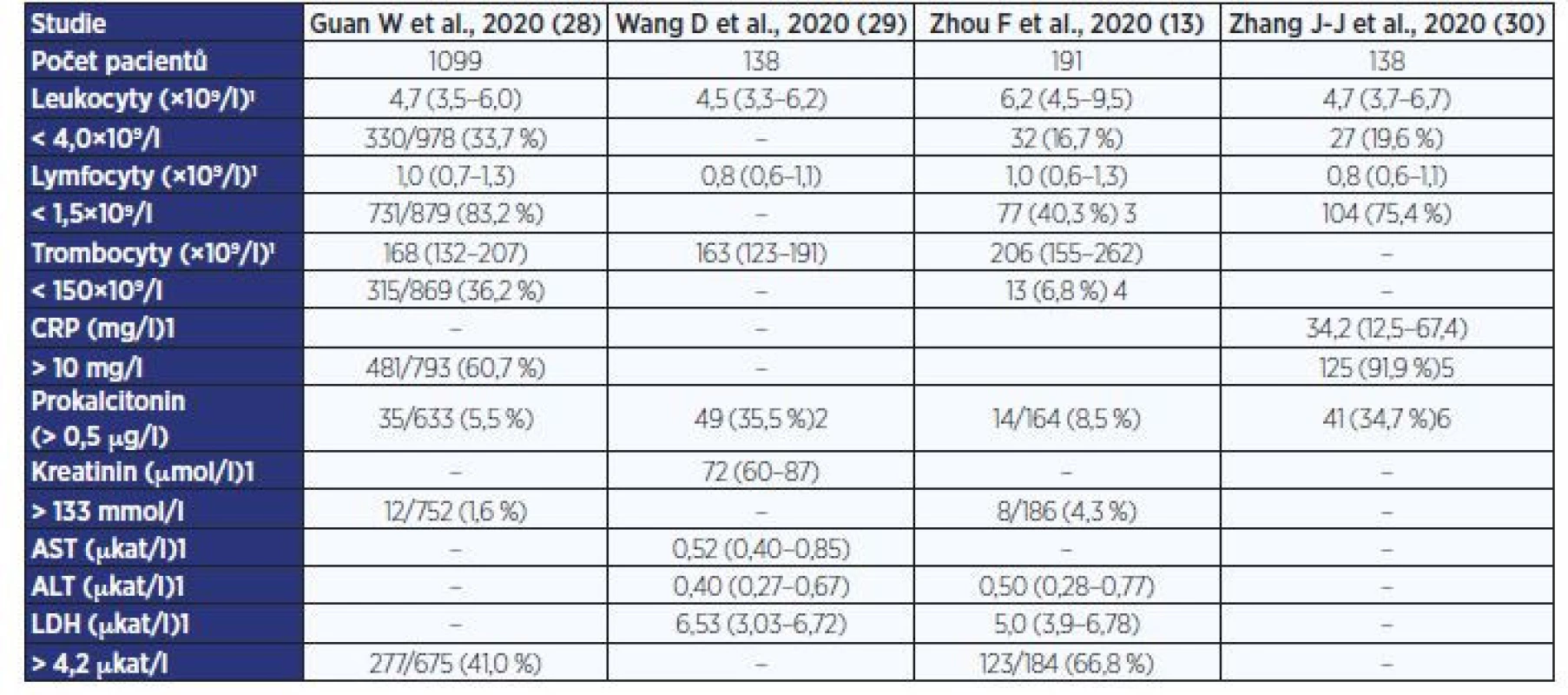
Mezi obvyklé hematologické nálezy u pacientů s COVID-19 patří normální počet leukocytů, případně asi u třetiny nemocných bývá mírná leukocytopenie, avšak v diferenciálním rozpočtu leukocytů je u většiny pacientů (32–83 %) přítomná lymfocytopenie a relativní neutrofílie (9, 13, 28–30). Leukocytóza a významnější lymfocytopenie je asociovaná s horší prognózou nemocných (13). Prognosticky nepříznivým hematologickým parametrem je rovněž elevace D-dimerů a koagulopatie. Biochemické nálezy obvykle závisejí na závažnosti průběhu a orgánově specifickém postižení. U většiny pacientů bývá zvýšená hodnota sedimentace, CRP a IL-6 (7, 13, 20, 28). Mírná elevace CRP v rozmezí 25–40 mg/l se vyskytuje u > 90 % nemocných, přičemž vyšší hodnota je prognosticky nepříznivá. Vstupní hodnoty prokalcitoninu bývají obvykle ve fyziologickém rozmezí, avšak zvyšují se u pacientů se závažným či kritickým průběhem. U pacientů s komplikovaným průběhem dochází k elevaci laktátdehydrogenázy (21–76 % infikovaných), zároveň v případě přidruženého jaterního a myokardiálního postižení bývá prokázáno zvýšení sérové aktivity aminotransferáz (22–38 %), kreatinkinázy a hodnot troponinu (12 %) s myoglobinem. V případě akutního renálního selhání dochází k vzestupu kreatininu a dusíkatých metabolitů (7, 9, 30, 31). Podrobná laboratorní data z dostupných studií uvádí tab. 2 (13, 28–30).
Zobrazovací metody
Prostý rentgenový snímek hrudníku není dostatečně citlivý v primárním záchytu změn v plicním parenchymu, jeho uplatnění je zejména ve sledování vývoje rozsáhlejších změn u pacientů s těžším průběhem. V primární diagnostice je nejvíce senzitivní metodou výpočetní tomografie (CT), přičemž bylo prokázáno, že senzitivita samotného CT vyšetření pro diagnostiku COVID-19 dosahovala až 95 %. Typické radiologické nálezy na CT hrudníku zahrnují především přítomnost opacit charakteru mléčného skla, které bývají lokalizované multifokálně či difuzně, převážně periferně, v zadních dolních plicních segmentech. V průběhu infekce se objevují nová ložiska opacit, dochází k jejich zvětšování a přeměně v ložiska konsolidací. Dále se objevuje zesílení sept, retikulace a typické změny charakteru tzv. crazy paving. Radiologické nálezy progredují obvykle kolem 10. dne od začátku obtíží. V průběhu onemocnění se dále popisují zesílení pleury, subpleurální pruhy a bronchiektázie. Méně časté jsou centrilobulární noduly, zesílení stěny bronchů, porušení architektury a pleurální výpotek (7, 9, 12, 13, 28–30).





COVID-19 U SPECIFICKÝCH SKUPIN
COVID-19 u dětí
Ve většině publikovaných souborů je u dětí popisován méně závažný průběh než u dospělých (4). V publikovaném souboru více než 72 tisíc pacientů z Číny bylo pouze 1 % dětí mladších 10 let a 1 % ve věku 10–19 let, úmrtí bylo potvrzeno u jednoho adolescenta bez uvedení dalších klinických údajů (4, 34). V České republice k 10. 5. 2020 tvořily děti ve věkové kategorii 0–14 let celkem 483 (6,1 %) ze 7975 laboratorně prokázaných případů (MZ ČR).
U dětí, jež onemocní, se projevy COVID-19 zdají být podobné projevům u dospělých, ale s nižší závažností. Z celkového počtu 2135 potvrzených a suspektních případů z Číny byla většina pediatrických pacientů asymptomatických nebo měla pouze mírný či středně závažný průběh (94,1 %). Avšak autoři upozorňují, že závažným a kritickým průběhem jsou potenciálně ohroženi kojenci (10,7 %) ve srovnání se staršími dětmi (4,1 % u dětí ve věku 11–15 let; 3,0 % u dětí ve věku 16–19 let) (35).
Nejčastější symptomy popisuje studie z dětské nemocnice ve Wu-chanu, která hodnotila celkem 171 pacientů: kašel (48,5 %), klinické známky faryngitidy (46,2 %), teplota > 37,5 °C (41,5 %). Ve studii byly popisovány i méně časté příznaky: průjem (8,8 %), únava (7,6 %), rýma (7,6 %) či zvracení (6,4 %). Dušnost při přijetí byla uvedena u 28,7 % dětí, hypoxie (saturace O2 < 92 %) u 2,3 % nemocných.
Patologický nález v plicním parenchymu byl na CT popsán u 64,9 % nemocných, z toho nejčastější byly opacity charakteru mléčného skla (32,7 %) (34). Nejčastější laboratorní nálezy byly hodnoceny v přehledové studii, do které byla zařazena data od 66 dětí z celkem 12 různých publikací. Většina pacientů měla fyziologický počet leukocytů (69,2 %), rovněž tak odchylky v diferenciálním rozpočtu leukocytů byly vzácné, přičemž neutrofilie byla popsána pouze u 4,6 %, neutropenie u 6,0 % a lymfocytopenie u 3 % nemocných. Elevace CRP nebo prokalcitoninu byla popsána u 13,6 % a 10,6 % pacientů (36). Většina dětských pacientů vyžaduje pouze symptomatickou léčbu (34).
COVID-19 u těhotných žen a novorozenců
U těhotných žen s COVID-19 není dle dostupných údajů pravděpodobně zvýšené riziko závažného průběhu onemocnění. Z metaanalýzy publikované na konci března 2020 vyplývá, že u 41 těhotných žen s prokázanou infekcí virem SARS-CoV-2 se vyskytly tyto komplikace: předčasný porod v < 37. g. t. (41,1 %), předčasný odtok plodové vody (PROM) (18,8 %) a preeklampsie (13,6 %). Celkem 8,7 % novorozenců muselo být přijato na novorozeneckou JIP, zemřel 1 novorozenec. V případě této metaanalýzy je třeba upozornit, že se v naprosté většině jednalo o pacientky s těžkým průběhem onemocnění a celkový počet případů byl relativně nízký (37).
Vertikální přenos SARS-CoV-2 z matky na plod je velmi nepravděpodobný a ve většině publikovaných souborů nebyl prokázán. Doposud byly popsány jednotky možných případů. U 1 dítěte byly krátce po porodu prokázány zvýšené hladiny specifických protilátek IgM proti SARS-CoV-2 a IL-6. Pět nazofaryngeálních stěrů provedených v dalších dnech života metodou PCR však bylo negativních a dítě bylo po celou dobu asymptomatické. Ve 3 dalších případech došlo i za důkladných hygienických opatření při porodu do 2 dnů k rozvoji pneumonie. Infekce SARS-CoV-2 byla prokázána z nazofaryngu a análních stěrů. Ani v jednom případě není možné vyloučit postnatální přenos infekce rodiči či personálem (38, 39).
V souboru 9 těhotných žen s prokázaným COVID-19 byla u všech žen vyšetřena pupečníková krev, placenta, mateřské mléko, amniová tekutina a byl proveden nazofaryngeální stěr novorozenci – v žádném vzorku nebyl virus prokázán. Rovněž v mateřském mléce nebyl SARS-CoV-2 zachycen (38). Podle doporučení CDC je kojení v případě pozitivních matek možné, avšak je nutné dodržovat bariérový režim (rouška, důkladná hygiena rukou).
TERAPIE
V současné době není k dispozici cílená léčba infekce COVID-19, základem terapie je proto symptomatická léčba podle tíže příznaků, a to při léčbě ambulantní, na standardních odděleních i intenzivních lůžkách. Symptomatická a podpůrná terapie zahrnuje antipyretika při teplotě > 38 °C (paracetamol, ibuprofen, metamizol), antitusika (kodein apod.), případně v kombinaci s expektorancii. Oxygenoterapie, nejlépe maskou, je indikovaná při saturaci hemoglobinu kyslíkem < 93 %. Je třeba dbát na adekvátní hydrataci a udržovat zvlhčené prostředí. Volbu symptomatické léčby a dávkování léčiva je třeba přizpůsobit stavu, komorbiditám a další medikaci pacienta.
Objevují se hypotézy, že některé léky, zejména nesteroidní antiflogistika (NSA, např. ibuprofen), mohou zhoršovat průběh infekce COVID-19. Nicméně dosavadní studie neposkytují žádné důkazy, které by toto prokázaly. Proto není důvod se NSA vyhýbat, pokud jsou indikovaná (40).
Specifika intenzivní péče u pacientů s COVID-19
Zásadním úkolem intenzivní péče je zajištění adekvátní ventilace. U pacientů s hypoxemickým respiračním selháním se doporučuje využití vysokoprůtokové nosní kanyly nebo vysokoprůtokové nosní oxygenoterapie. Tyto metody oxygenoterapie sice nesnižují riziko úmrtí, ale prokazatelně snižují potřebu invazivní umělé plicní ventilace. Jedná se o metody účinnější, než je neinvazivní plicní ventilace, jejich potenciální nevýhodou je zvýšené riziko přenosu infekce na zdravotnický personál. Velice žádoucí je včas rozpoznat nutnost převedení pacienta s vysokoprůtokovou oxygenoterapií na invazivní umělou plicní ventilaci, jelikož opožděná intubace zvyšuje riziko úmrtí (9, 41).
V případě nutnosti invazivní umělé plicní ventilace má svá specifika již samotná tracheální intubace. Ideální je její provádění na speciálním sále s podtlakovým režimem. Výkon by měl provádět zkušený anesteziolog nebo intenzivista s dostatečnou praxí, aby se minimalizovalo riziko přenosu infekce. Po provedení preoxygenace v délce trvání přibližně 5 minut se provádí intubace technikou rapid sequence intubation s nervosvalovou blokádou. Po intubaci se může ventilace zahájit až po nafouknutí manžety tracheální rourky. Nedoporučuje se ověřovat hloubku zavedení rourky fonendoskopem. Pacienty s onemocněním COVID-19 se doporučuje ventilovat postupy protektivní plicní ventilace s omezenou velikostí dechových objemů v rozmezí 4–8 ml/kg tělesné hmotnosti s cílem plató tlaku do 30 cmH2O. Při těžším ARDS se běžně používají vyšší hodnoty PEEP, kolem 15 cmH2O, s následnými úpravami dle vlivu ventilace na oxygenaci a hemodynamickou stabilitu. ECMO by mělo zůstat vyhrazeno pouze pro velmi těžké formy ARDS (9, 41).
U pacientů je často pozorována dehydratace, avšak s ohledem na zvýšený výskyt dysfunkcí myokardu u pacientů s těžkým průběhem COVID-19 je nutné provádět rehydrataci velice obezřetně, aby nedošlo k přetížení oběhu. K včasnému odhalení poruchy funkce myokardu je vhodné laboratorní sledování hodnot troponinu a BNP a využívání echokardiografie. Nutné je potom včas zahájit oběhovou podporu vazopresory a inotropiky (9, 40, 41).
Cílená farmakoterapie COVID-19
V době probíhající pandemie a medializace těžkých průběhů onemocnění COVID-19 rostou tendence zavádět do klinické praxe léčiva, jež sice mají potenciál onemocnění ovlivnit, ale u kterých zatím není dostatek důkazů podepřených kvalitními studiemi. Většina nyní publikovaných studií má řadu nedostatků, proto je třeba jejich pozitivní, ale i negativní výsledky hodnotit kriticky a nevyvozovat z nich předčasné závěry. Otázky, na něž bude nutno prostřednictvím probíhajících či plánovaných studií do budoucna odpovědět, jsou následující:
- Která léčiva skutečně ovlivňují průběh onemocnění?
- V jakých dávkách tato léčiva podávat?
- Komu a kdy je nasadit?
- Jak dlouho je podávat?
- Jaká mají tato léčiva rizika?
Cílenou terapii lze zvážit u hospitalizovaných pacientů se středně těžkým průběhem a rizikovými faktory (věk > 65 let, arteriální hypertenze, diabetes mellitus, obezita s BMI > 35, imunosuprese), s těžkým průběhem onemocnění a u kriticky nemocných.
Níže je uveden přehled léčiv, u nichž lze na základě jejich farmakologických vlastností a některých výsledků studií předpokládat potenciální pozitivní efekt u pacientů s onemocněním COVID-19. Použití těchto léčiv je doporučeno v rámci probíhajících studií. V individuálních případech u hospitalizovaných pacientů po zvážení poměru benefit/riziko lze zvážit podání některého z těchto léčiv i mimo rámec studií, a to s vědomím, že se jedná o off-label postup (4, 9, 12, 92). Informace k farmakoterapii COVID-19 se rychle mění, a je proto třeba sledovat aktualizace a podrobnější doporučení na webových stránkách odborných společností a Státního ústavu pro kontrolu léčiv: www.infekce.cz, www.csim.cz, www.coskf.cz, www.sukl.cz
Inhibitory RNA-dependentní RNA polymerázy (RdRp)
Remdesivir: Intravenózně aplikované nukleotidové léčivo, které je intracelulárně metabolizováno na analog adenosintrifosfátu, který inhibuje virovou RdRp. In vitro má široké spektrum účinnosti, mimo jiné proti filovirům, koronavirům a paramyxovirům.
Favipiravir: Perorálně podávané léčivo, které je intracelulárně fosforylací aktivováno na ribofuranosyl-trifosfát, analog adenosinu a guaninu, jenž poté inhibuje RdRp, čímž zabraňuje virové transkripci a replikaci. Byl vyvinut v Japonsku jako lék na chřipku a pokusy na zvířatech prokázaly účinnost i na jiné skupiny virů, mimo jiné flaviviry, pikornaviry a enteroviry.
Antimalarika se zvažovaným antivirovým účinkem
Hydroxychlorochin (a chlorochin): Perorální léčiva s komplexním mechanismem účinku. Koncentrují se v intracelulárních vezikulách. Zvyšují pH v endosomech, lyzosomech a Golgiho aparátu, přičemž endosomy jsou důležité v procesu vstupu viru do buňky. Současně narušují glykosylaci angiotenzin konvertujícího enzymu typu 2 (ACE2) – membránového proteinu, prostřednictvím něhož se virus váže na cílové buňky. Vstup viru do buněk tak blokují na dvou úrovních. Hydroxychlorochin vykazuje silnější imunomodulační efekt než chlorochin, snižuje expresi toll-like receptorů a jejich signální transdukci a snižuje produkci IL-6.
Inhibitory proteáz
Nejvíce studován je lopinavir/ritonavir. Lopinavir je inhibitor proteáz HIV-1 a HIV-2. Inhibice HIV proteázy brání štěpení gag-pol polyproteinu, které vede k tvorbě nezralého, neinfekčního viru. Ritonavir inhibuje metabolismus lopinaviru, a tím zvyšuje plazmatické hladiny lopinaviru.
Léčiva/léčivé přípravky s protizánětlivými a/nebo imunomodulačními účinky
Glukokortikoidy: V současné době se nedoporučuje rutinní používání kortikosteroidů u pacientů infikovaných virem SARS-CoV-2 (s COVID-19 pneumonií). U pacientů s ARDS v důsledku koronavirové pneumonie je doporučeno použití kortikosteroidů pouze v rámci klinických hodnocení.
Tocilizumab: Humanizovaná monoklonální protilátka. Předpokládaným mechanismem účinku u pacientů s COVID-19 je možné zmírnění zánětlivé reakce v plicích související s uvolněním IL-6, což je prozánětlivý cytokin produkovaný různými typy buněk včetně T a B lymfocytů, monocytů a fibroblastů. Tocilizumab se váže specificky jak na rozpustnou, tak i membranózní část receptorů IL-6. V posledních letech nalezl využití rovněž u pacientů se život ohrožujícím syndromem z uvolnění cytokinů.
Rekonvalescentní plazma: Plazma pacientů po prodělaném onemocnění COVID-19, která obsahuje dostatečné množství protilátek proti SARS-CoV-2 (4, 7, 9, 12, 40, 41).
ZÁVĚR
V prosinci 2019 byly v čínském Wu-chanu popsány první případy závažně probíhající pneumonie nejasného původu. Bylo prokázáno, že původcem onemocnění je nový b-koronavirus, který byl nazván SARS-CoV-2, a onemocnění, jež vyvolává, se označuje COVID-19. Počátkem roku 2020 došlo k rozšíření nákazy do řady světových regionů a rozvinula se jedna z největších a nejzávažnějších epidemií po 2. světové válce. Pandemie stálé probíhá a počet nových případů v mnoha zemích ještě nedosáhl vrcholu; k 10. květnu bylo na celém světě hlášeno přes 4 miliony případů a na 283 tisíc úmrtí. Zpomalení, popřípadě zastavení šíření epidemie ve většině postižených zemí bylo dosaženo až po zavedení přísných karanténních opatření. Přestože ve většině nejpostiženějších zemí nedošlo k plošnému rozšíření do všech oblastí a regionů, epidemie i v těch nejvyspělejších státech vyvolala enormní nároky na zdravotní systémy, které jsou na hranici udržitelnosti.
Průběh onemocnění byl na počátku epidemie přirovnáván k sezonní chřipce, potřebná epidemiologická opatření proti jejímu šíření nebyla včas doporučena a zahájena nevládními organizacemi (WHO), příslušnými orgány Evropské unie ani většinou evropských vlád. Přestože dosud přesně nevíme, jaké jsou mezi těmito dvěma respiračními infekcemi rozdíly v riziku přenosu a reprodukčním čísle, době infekčnosti, procentu asymptomatických infekcí, délce, charakteru a účinnosti navozené postinfekční imunity, je zřejmé, že smrtnost COVID-19, zvláště v rizikových skupinách, je výrazně vyšší a přesahuje i smrtnost pandemické chřipky A/H1N1 v letech 2009–2010.
Na rozdíl od infekce SARS, u níž bylo šíření včasnými přísnými karanténními opatřeními zcela zastaveno, a MERS, kde je výskyt omezen na nevelkou oblast, se infekce COVID-19 rozšířila do většiny zemí světa a její brzká eliminace není pravděpodobná. Velkou otázkou zůstává, jaké důsledky bude mít současná pandemie na chudé země tropických oblastí, kde je výskyt respiračních infekcí celoroční, se zvýšením počtu nákaz v době dešťů, případně jak dopadnou důsledky protiepidemických opatření na ekonomiku a společnost v postižených zemích světa. Rovněž tak není dosud zcela předvídatelný budoucí vývoj samotné epidemie. V tuto chvíli však lze uvést, že rychlé „promoření“ populace by znamenalo vysoký počet těžkých případů a úmrtí, respektive stav na hranici zvládnutí zdravotními systémy, takže asi jako jediná potenciální cesta se jeví postupné pomalé a regulované šíření infekce s tím, že existuje šance, že bude objeven účinný lék nebo vyvinuta účinná vakcína.
Seznam zkratek
- ACE angiotenzin konvertující enzym
- ARDS syndrom akutní dechové tísně dospělých
- BNP mozkový natriuretický peptid
- CCL chemokinový (C-C) ligand
- CoV koronavirus
- COVID-19 coronavirus disease 2019
- CRP C-reaktivní protein
- CURB-65 skórovací systém pro hodnocení závažnosti pneumonie (confusion, urea, respiratory rate, blood pressure, age > 65 years)
- CXCL chemokinový (C-X-C) ligand
- ECDC Evropské středisko pro kontrolu a prevenci nemocí
- ELISA enzyme-linked immunosorbent assay
- ERGIC endoplasmatic reticulum – Golgi intermediate compartment
- FFP filtering face piece
- g. t. gestační týden
- HCoV lidský koronavirus
- HLA lidský leukocytový antigen
- IFN interferon
- IL interleukin
- JIP jednotka intenzivní péče
- LDH laktátdehydrogenáza
- MERS Middle East respiratory sydrome
- MHC hlavní histokompatibilní komplex
- MZ ČR Ministerstvo zdravotnictví České republiky
- NSA nesteroidní antiflogistika
- Nsp nestrukturální protein
- OOP osobní ochranné pomůcky
- PaO2/FiO2 poměr parciálního arteriálního tlaku kyslíku a frakce inspirovaného kyslíku
- PEEP pozitivní tlak v dýchacích cestách na konci exspiria
- PROM předčasný odtok plodové vody
- qSOFA skórovací systém (quick sequential organ failure assessment)
- R0 základní reprodukční číslo
- RdRP RNA-dependentní RNA polymerázy
- RNA ribonukleová kyselina
- RT-PCR reverzní polymerázová řetězová reakce
- SARS severe acute respiratory syndrome
- SOFA skórovací systém (sequential organ failure assessment)
- TGF transformující růstový faktor
- TNF tumor nekrotizující faktor
- WHO Světová zdravotnická organizace
Adresa pro korespondenci:
MUDr. Milan Trojánek, Ph.D.
Klinika infekčních nemocí 2. LF UK a Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
Tel.: 266 083 197
e-mail: milan.trojanek@bulovka.cz
Zdroje
- Burrell CJ, Howard CR, Murphy FA (eds.). Fenner and White’s Medical Virology. Coronaviruses. Academic Press, 2016: 437–446.
- Ye Z-W, Yuan S, Yuen K-S et al. Zoonotic origins of human coronaviruses. Int J Biol Sci 2020; 16(10): 1686–1697.
- Zhu N, Zhang D, Wang W et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020; 382: 727–733.
- Singhal T. A review of coronavirus disease 2019 (COVID-19). Indian J Pediatr 2020; 87: 281–286.
- Sohrabi C, Alsafi Z, O’Neill N et al. World Health Organization declares global emergency: a review of the 2019 novel coronavirus (COVID-19). Int J Surg 2020; 76: 71–76.
- ECDC. COVID-19. Dostupné na: www.ecdc.europa.eu/en/covid-19-pandemic
- Han Q, Lin Q, Jin S et al. Recent insights into 2019-nCoV: a brief but comprehensive review. J Infect 2020 Apr; 80(4): 373–377.
- Tang X, Wu C, Li X et al. On the origin and continuing evolution of SARS-CoV2. Nat Sci Rev 2020; nwaa036, doi: 10.1093/nsr/nwaa036/5775463.
- Thomas-Rüddel D, Winning J, Dickmann P et al. Coronavirus disease 2019 (COVID-19): update for anesthesiologists and intensivists March 2020. Anaesthesist 2020 Mar 24; 1–10, doi: 10.1007/s00101-020-00760-3.
- van Doremalen N, Bushmaker T, Morris DH et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; 382: 1564–1567.
- WHO. Rational use of personal protective equipment for coronavirus disease 2019 (COVID-19) and considerations during severe shortages. Interim guidance. WHO, 2020. Dostupné na: www.who.int/publications-detail/rational-use-of-personal-protective-equipment-for-coronavirus-disease-(covid-19)-and-considerations-during-severe-shortages
- Rabi FA, Al Zoubi MS, Kasabeh GD et al. SARS-CoV-2 and coronavirus disease 2019: What we know so far. Pathogens 2020 Mar 20; 9(3): 231.
- Zhou F, Yu T, Du R et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China a retrospective cohort study. Lancet 2020 Mar 28; 395(10229): 1054–1062.
- Wölfel R, Corman VM, Guggemos W et al. Virological assessment of hospitalized cases of coronavirus disease 2019. Nature 2020 Apr 1, doi: 10.1038/s41586-020-2196-x.
- Cheng ZJ, Shan J. 2019 Novel coronavirus: where we are and what we know. Infection 2020 Apr; 48(2): 155–163.
- Park M, Cook AR, Lim JT et al. A systematic review of COVID-19 epidemiology based on current evidence. J Clin Med 2020; 9(4): E967.
- Zhang J, Litvinova M, Wang W et al. Evolving epidemiology and transmission dynamics of coronavirus disease 2019 outside Hubei province, China: a descriptive and modelling study. Lancet Infect Dis 2020 Apr 2, doi: 10.1016/S1473-3099(20)30230-9.
- Lauer SA, Grantz KH, Bi Q et al. The incubation period of 2019-nCoV from publicly reported confirmed cases: estimation and application. Ann Intern Med 2020 Mar 10, doi: 10.7326/M20-0504.
- Du Z, Xu X, Wu Y et al. The serial interval of COVID-19 from publicly reported confirmed cases. Emerg Infect Dis 2020 Mar 19; 26(6), doi: 10.3201/eid2606.200357.
- Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497–506.
- Wang W, Xu Y, Gao R et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA 2020 Mar 11; e203786.
- Yang Y, Yang M, Shen C et al. Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. medRxiv 2020 Feb 17, doi: 10.1101/2020.02.11.20021493v2.
- Zhang W, Du RH, Li B et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect 2020; 9: 386–389.
- Zhao J, Yuan Q, Wang H et al. Antibody Responses to SARS-CoV-2 in Patients of Novel Coronavirus Disease 2019. Clin Infect Dis 2020 Mar 28; ciaa344.
- Okba NMA, Muller MA, Li W et al. SARS-CoV-2 specific antibody responses in COVID-19 patients. Emerg Infect Dis 2020 Apr 8; 26(7), doi: 10.3201/eid2607.200841.
- Li X, Geng M, Peng Y et al. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020 Mar 5, doi: 10.1016/j.jpha.2020.03.001.
- Xu Z, Shi L, Wang Y et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med 2020 Apr; 8(4): 420–422.
- Guan W-J, Ni Z-Y, Hu Y et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020 Apr 30; 382(18): 1708–1720.
- Wang D, Hu B, Hu C et al. Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA 2020; 323 (11): 1061–1069.
- Zhang JJ, Dong X, Cao YY et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy 2020 Feb 19, doi: 10.1111/all.14238.
- Borges do Nascimento IJ, Cacic N, Abdulazeem HM et al. Novel coronavirus infection (COVID-19) in humans: a scoping review and meta-analysis. J Clin Med 2020 Mar 30; 9(4): E941.
- Lechien JR, Chiesa-Estomba CM, De Siati DR et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Otorhinolaryngol 2020 Apr 6; 1–11, doi: 10.1007/s00405-020-05965-1.
- Liu W, Tao Z-W, Wang L et al. Analysis of factors associated with disease outcomes in hospitalized patients with 2019 novel coronavirus disease. Chin Med J (Engl) 2020 May 5; 133 (9): 1032–1038.
- Lu X, Zhang L, Du H et al. SARS-CoV-2 infection in children. N Engl J Med 2020 Apr 23; 382: 1663–1665.
- Dong Y, Mo X, Hu Y et al. Epidemiological characteristics of 2143 pediatric patients with 2019 coronavirus disease in China. Pediatrics 2020, doi: 10.1542/peds.2020-0702.
- Henry BM, Lippi G, Plebani M. Laboratory abnormalities in children with novel coronavirus disease 2019. Clin Chem Lab Med 2020, doi: 10.1515/cclm-2020-0272.
- Di Mascio D, Khalil A, Saccone G et al. Outcome of coronavirus spectrum infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and meta-analysis. Am J Obstet Gynecol MFM 2020 Mar 25; 100107.
- Chen H, Guo J, Wang C et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet 2020 Mar 7; 395(10226): 809–815.
- Kimberlin DW, Stagno S. Can SARS-CoV-2 infection be acquired in utero? More definitive evidence is needed. JAMA 2020 Mar 26, doi: 10.1001/jama.2020.4868.
- Kümpel P, Holub M, Roháčová H, Plíšek S. Doporučený postup SIL ČLS JEP léčby pacientů s prokázanou infekcí COVID 19. Společnost infekčního lékařství ČLS JEP, 2020. Dostupné na: www.infekce.cz/Covid2019/DP-SIL-covid12p.pdf
- Phua J, Weng L, Ling L et al. Intensive care management of coronavirus disease 2019 (COVID-19): challenges and recommendations. Lancet Respir Med 2020 May; 8(5): 506–517.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistkaČlánek vyšel v časopise
Časopis lékařů českých

- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
Nejčtenější v tomto čísle
- Testování COVID-19 – co bychom měli mít na paměti
- Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
- Genetické mechanismy stárnutí
- Molekulárně genetický pohled na podstatu buněčné senescence v kontextu stárnutí organismu
