-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Genetické mechanismy stárnutí
Genetic mechanisms of aging
Aging is an extremely complex phenomenon that has many manifestations at the molecular, cellular, and whole-body levels, and in some form involves virtually all living beings. It is a process characterized by a general progressive deterioration of the physiological functions of the organism leading to increased susceptibility to diseases. This article summarizes the basic features and molecular hallmarks of aging and describes some of the genetic mechanisms of this phenomenon. It deals with the particular genes and molecular pathways involved in the regulation of aging as well as promising possibilities of interventions affecting this process.
Keywords:
Genetics – aging – longevity genes – sirtuins – Telomeres
Autoři: Lukáš Sourada; Petr Kuglík
Působiště autorů: Ústav experimentální biologie PřF MU, Brno
Vyšlo v časopise: Čas. Lék. čes. 2020; 159: 81-87
Kategorie: Přehledový článek
Souhrn
Stárnutí je nesmírně komplexním dějem, který má mnoho projevů na úrovni molekulární, buněčné i celého organismu a týká se v určité podobě prakticky všech živých bytostí. Jde o proces charakterizovaný všeobecným progresivním zhoršováním fyziologických funkcí organismu vedoucím ke zvýšené náchylnosti k nemocem.
Množství genů asociovaných s dlouhověkostí je určitým způsobem zapojeno do metabolismu. Sirtuiny a AMPK figurují v katabolických drahách, geny dráhy IIS a mTOR jsou zapojené do anabolismu. Intenzivně zkoumány jsou geny zapojené do oprav poškození DNA, geny regulující délku telomer, CETP, ACE, cytokiny IL-10 a IL-6, geny systému HLA, TP53, SOD3 a mnohé další.
Látky jako rapamycin, inhibující dráhu mTOR, resveratrol a další aktivátory sirtuinů (SRT1720, SRT2104) a metformin aktivující AMPK mají schopnost u modelových organismů prodloužit život a zpomalit stárnutí.
U člověka lze podobného účinku docílit i obyčejnou změnou životosprávy. Jde například o omezení příjmu energie, konzumaci košťálové zeleniny (obsahující flavonoidy a polyfenoly, jako je sulforafan a genistein) nebo o pravidelnou pohybovou aktivitu.
Klíčová slova:
genetika – stárnutí – geny dlouhověkosti – sirtuiny – telomery
ÚVOD
Stárnutí je téměř univerzálním, nesmírně komplexním jevem, který vykazuje u všech organismů hodně společných rysů, i když probíhá u jednotlivých druhů různou rychlostí. Jde o progresivní ztrátu funkce a struktury tkání provázenou hromaděním různých defektů na úrovni biomolekul, tkání i orgánů a zvýšenou náchylností k nemocem. Lze jej definovat i jako s časem se zvyšující pravděpodobnost smrti. Samotné zhoršování tělesných funkcí může také být chápáno jako primární rizikový faktor nejčastějších onemocnění včetně zhoubných nádorů, diabetu mellitu či kardiovaskulárních a neurodegenerativních chorob. I z tohoto důvodu je porozumění tomuto procesu velmi důležité.
Obrovskou komplexnost problematiky dokresluje skutečnost, že dosud nebyla vytvořena žádná sjednocující teorie týkající se molekulární podstaty stárnutí a již několik desetiletí vedle sebe koexistují dva hlavní směry teorií, hypotéz a modelů popisujících stárnutí, které se většinou vzájemně nevylučují. Jedná se o stochastické teorie, kladoucí důraz na vnější příčiny jevu, a vývojově-genetické teorie, vysvětlující stárnutí pomocí mechanismů endogenních či přímo jako součást genetického programu. V posledních letech nicméně výzkum v této oblasti zaznamenal obrovský pokrok a dnes již není pochyb o tom, že stárnutí je do určité míry kontrolováno genetickými mechanismy a specifickými molekulárními drahami. Stejně tak ale nelze ignorovat výsledky výzkumů, které popisují významnou roli faktorů prostředí, včetně stravovacích návyků a celkového životního stylu. I v případě tohoto procesu jde tedy zkrátka o souhru a spolupůsobení genetiky, epigenetiky a prostředí.
Problematika stárnutí musela fascinovat lidstvo odnepaměti, jelikož se týká každého z nás. Pokud jde o vědecký výzkum tohoto komplexního jevu, jeho kořeny sahají do konce 19. století, kdy August Weismann stárnutí definoval jako následek opotřebení (wear and tear) analogického procesům pozorovaným i v neživé přírodě (1). Od té doby je stárnutí zkoumáno hned na několika úrovních a každou chvíli vědci narazí na nějaký nový aspekt tohoto jevu (2; obr. 1).
Obr. 1. Projevy stárnutí na úrovni molekulární, buněčné i celého organismu. Na obrázku je znázorněno zejména hromadění senescentních buněk ve tkáních, vyčerpání kmenových buněk, vyhasínání mozkových funkcí, narůstající poškození jater a ledvin a také epigenetické změny provázející stárnutí (upraveno dle: 2).
Pozn.: 5mC = 5-metylcytosin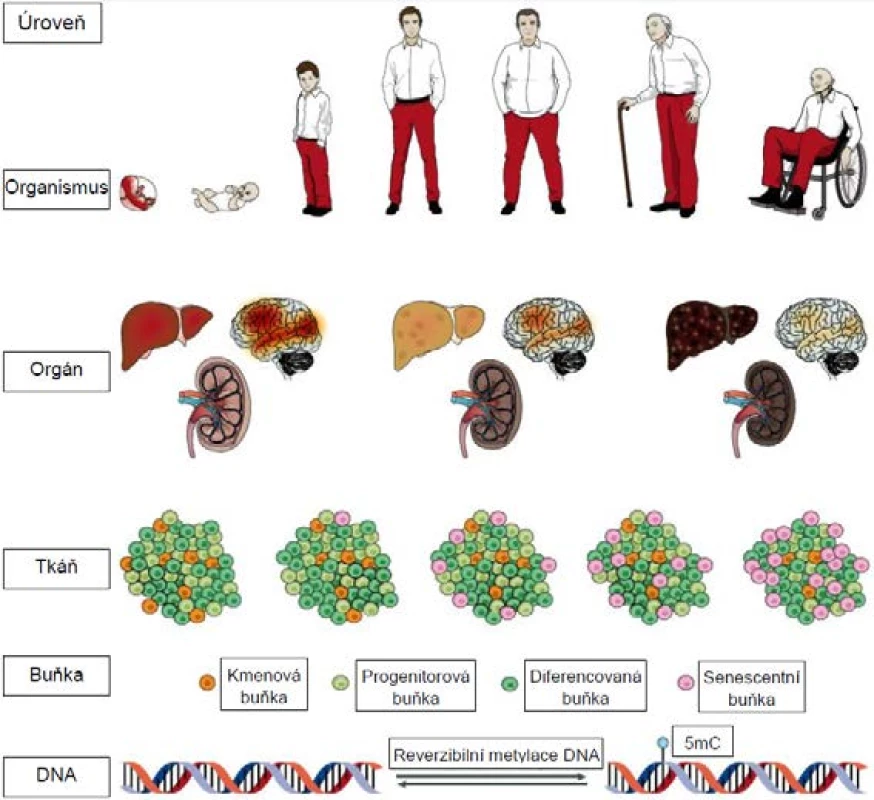
STÁRNUTÍ V ŽIVÉ PŘÍRODĚ
Ačkoliv stárnutí bývá označováno jako univerzální jev, neplatí to úplně bez výjimky. V posledních letech se objevilo hned několik studií, v nichž byly identifikovány organismy, které nestárnou, či dokonce mládnou v tom smyslu, že pravděpodobnost smrti se u nich s časem nezvyšuje (3). Typickým zástupcem takového živočicha je nezmar (Hydra magnipapillata), jehož někteří jedinci se mohou dle odhadů dožít až tisíce let (3).
Co se týče délky života, existuje v přírodě obecně obrovská rozmanitost mezi jednotlivými druhy (3). Mezi extrémy v říši živočichů lze zařadit například řád jepic (Ephemeroptera), jehož někteří zástupci žijí jako dospělci pouhých několik hodin či dní, a v případě druhu Dolania americana dokonce jen kolem 5 minut (4). Mezi rekordmany v opačném směru bychom vedle již zmíněného nezmara nalezli také některé druhy měkkýšů (3, 5).
Na úrovni druhu je rychlost stárnutí a s tím související maximální délka života naopak hodně podobná, což samo o sobě může naznačovat určité fyziologické limity daného druhu určené geneticky. Přesto i zde je samozřejmě stále obrovský prostor pro variabilitu danou faktory prostředí, a experimentálně tak lze délku života u množství modelových organismů ovlivnit (6, 7). Konkrétně u člověka je maximální délka života odhadována dle zdokumentovaných případů nejdéle žijících lidí (6). Dosud nejstarší oficiálně zaznamenanou osobou v historii byla Francouzka Jeanne Calmentová, která zemřela 4. srpna 1997 ve věku 122 let a 164 dní (8).
Zatímco průměrnou délku života, která je pouhou statistickou hodnotou, se zejména v průběhu posledních dvou století podařilo významně zvýšit vylepšováním hygienických podmínek, snížením novorozenecké úmrtnosti a celkovým zlepšením zdravotní péče, maximální délka života se jeví jako stabilní charakteristika druhu (6). Jinými slovy – strop se neposunuje, jen se zvyšuje počet lidí, kteří se mu přibližují.
BUNĚČNÉ A MOLEKULÁRNÍ ZNÁMKY STÁRNUTÍ
Ačkoliv každý intuitivně chápe, co se za pojmem stárnutí skrývá, není vůbec lehké jej jednoznačně definovat a časově ohraničit. Obecně se jedná o proces vedoucí k progresivnímu poklesu fyziologických funkcí, výkyvům homeostázy, opotřebení těla a vnitřních orgánů a zvýšené zranitelnosti organismu (9, 10). Na makroskopické úrovni se také projevuje ztrátou schopnosti obnovovat poškozené tkáně a účinně reagovat na environmentální podněty a ve výsledku končí rozvojem nemocí a smrtí – lze jej tedy definovat též jako s věkem se zvyšující pravděpodobnost smrti (10). Jelikož organismy jsou ze své podstaty otevřené systémy, je stárnutí podřízeno i termodynamickým zákonům. Živé organismy musejí po celou dobu své existence jít „proti proudu“ zvyšující se entropie neboli neuspořádanosti, aby udržely integritu buněk, tkání i celého těla (11).
Stárnutí tedy zahrnuje mnoho různých změn na mnoha úrovních, a právě pro jeho komplexnost je někdy jednodušší definovat jej prostě výčtem jednotlivých projevů či typických znaků. López-Otín et al., vycházející z dosavadních poznatků, definovali v roce 2013 celkem 9 znaků stárnutí na buněčné a molekulární úrovni (9; viz též obr. 2). Kromě toho, že jde o známky stárnoucího fenotypu, a tedy o patrný důsledek stárnutí, lze mnohé považovat rovněž za příčinu stárnutí, i když prokázat kauzalitu je vždy mnohem těžší než prokázat korelaci. Při detailnějším rozboru těchto 9 charakteristických rysů je navíc zřejmé určité propojení a komunikace mezi nimi:
- nestabilita genomu a akumulace poškození DNA související s klesající účinností opravných mechanismů
- zkracování telomer
- epigenetické změny zahrnující změny v methylačním statusu buněk a v uspořádání chromatinu
- ztráta proteostázy – snižující se schopnost udržovat správnou strukturu proteinů
- deregulace výživy a změny v rychlosti metabolismu
- akumulace poškození mitochondrií a produkce volných radikálů
- buněčná senescence – stresová odpověď buňky na různé podněty vedoucí k ireverzibilní zástavě buněčného cyklu (dělení buněk)
- postupné vyčerpání kmenových buněk vedoucí ke snížené schopnosti regenerace, tkáně, snížené krvetvorbě a zhoršené funkci imunitního systému
- změny v mezibuněčné komunikaci – např. změny hladin některých hormonů
Obr. 2. Devět buněčných a molekulárních známek stárnutí (upraveno dle: 9) 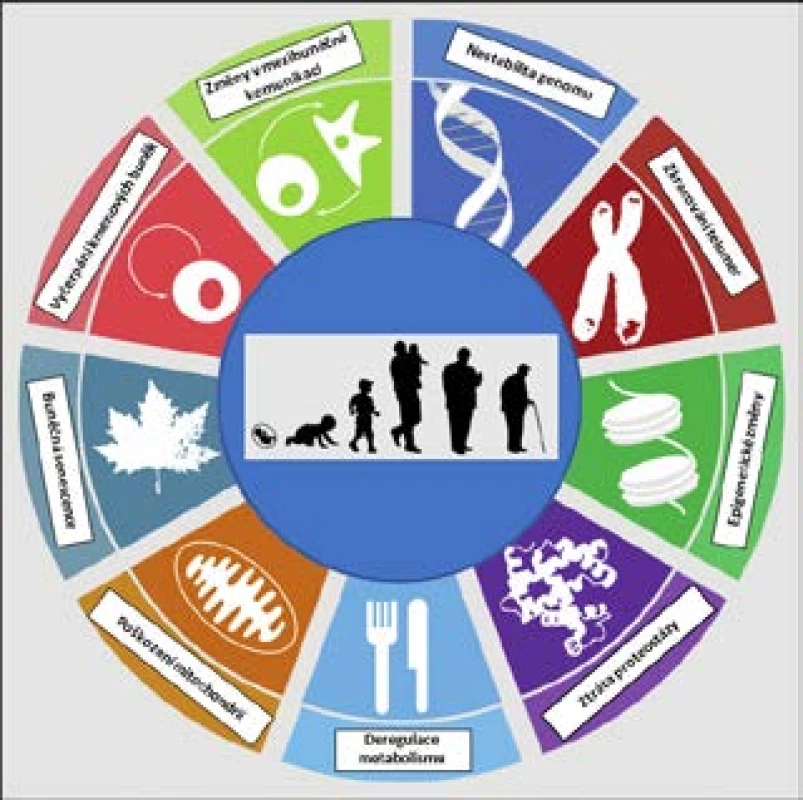
VÝZKUM STÁRNUTÍ
Nejčastěji používanými modelovými organismy v této oblasti výzkumu jsou Saccharomyces cerevisiae, Caenorhabditis elegans, Drosophila melanogaster a Mus musculus (5). Cílem použití těchto modelů je vyvodit některé obecné závěry o procesu stárnutí využitelné pro lidstvo. Organismy jsou vybírány specificky pro svou krátkou generační dobu, malé rozměry, rychlou reprodukci a v případě myší i pro relativní evoluční blízkost člověku. Jejich výzkum však s ohledem na jejich krátkou dobu života v porovnání s lidmi nemusí poskytovat všechny odpovědi, protože v současnosti převládá názor, že stárnutí dlouho žijících druhů je do určité míry odlišné od těch krátce žijících (12, 5). Není tedy jasné, zda můžeme všechny výsledky získané na modelových organismech extrapolovat i na člověka. Vzhledem k obrovské variabilitě v projevech stárnutí je podle některých vědců potřeba zahrnout do výzkumu stárnutí širší spektrum organismů, například některé hlodavce, jejichž délka života přesahuje 20 let (12). Diverzita modelových organismů tedy může být klíčová k dosažení úplného pochopení procesu stárnutí.
Vedle modelových organismů jsou ve výzkumu stárnutí důležité také demografické výzkumy spojené s genotypováním. V současnosti se hojně využívá tzv. celogenomových asociačních studií (GWAS – genome-wide association studies), v nichž se hledá asociace a korelace mezi alelami konkrétních genů, respektive polymorfismy v genech, a dlouhověkostí (13). Vedle výzkumu celých populací lidí jsou důležité studie zkoumající jedince starší 100 let, u nichž se předpokládá genetický základ jejich dlouhověkosti. Výzkumy zaměřené na příbuzné dlouhověkých lidí ukazují, že tito jedinci rovněž vykazují oproti obecné populaci delší život. Konkrétně Perls et al. (14) dospěli k závěru, že jedinci mající sourozence, který se dožil více než 100 let, mají až 8× větší šanci dožít se 100 let v porovnání s obecnou populací.
Odhady heritability (dědivosti) dlouhověkosti vychází ze studií dvojčat a z rozborů rodokmenů. Tyto výzkumy stanovily heritabilitu délky života na hodnotu okolo 0,15–0,25, což jinými slovy znamená, že genetické vlivy stojí za 15–25 % pozorované variability v délce života (15). Je zajímavé, že dlouhověcí lidé často ani nevedou zdravý životní styl, běžně se mezi nimi vyskytují kuřáci, obézní i lidé vyhýbající se fyzické aktivitě (16). Také ani zdaleka nemají perfektní genomy, spíše určité protektivní genotypy (16).
Stárnutí je dnes vnímáno jako neadaptivní vedlejší produkt biologických a evolučních procesů a ukazuje se, že jde o aktivně kontrolovaný proces, který je konzervovaný napříč spektrem druhů a je ovlivněn jak genetickými, tak environmentálními vlivy, přičemž propojení mezi nimi představuje epigenetika a v určitém smyslu také mikrobiom (5, 17).
Vědce již minimálně od 80. let 20. století láká představa, že by bylo možné zasáhnout do procesu stárnutí s pomocí objevů genů, které jej kontrolují. Tehdy se podařilo izolovat první dlouhověké mutanty C. elegans (18). Již delší dobu jsou tedy snahy vědců upřeny na hledání konkrétních „genů dlouhověkosti“, přičemž mezi průkopnické objevy genů regulujících délku života patří např. age-1, clk-1, daf-2, daf-16, daf-23 (z dauer formation; transkripční faktory spjaté s formováním specifického klidového larválního stadia háďátka – tzv. dauer larva – „věčná larva“) u C. elegans (7, 19) a SIR2 u kvasinek (20).
Které geny tedy mají podíl na stárnutí u lidí? Množství genů spojovaných s dlouhověkostí je různým způsobem zapojeno do metabolismu. Například sirtuiny (SIRT1–7), jejichž název je odvozen od prvního objeveného genu této rodiny u kvasinek (SIR2) a pochází z anglického silent information regulator (20, 21), jsou NAD+‑dependentní deacetylázy proteinů (včetně histonů), které se účastní modifikací různých intracelulárních substrátů (21). Figurují v katabolických reakcích a jejich aktivita je vázána na metabolickou aktivitu buňky v závislosti na poměru NAD+/NADH, který je zvýšený v případě nedostatku energie a živin v buňce, a právě na zvýšenou hladinu NAD+ sirtuiny reagují (21). Prospěšný efekt sirtuinů se projevuje vysoce komplexními mechanismy – zvyšují efektivitu metabolismu, mají podíl na udržování stability genomu a regulaci genové exprese a kontrolují i mitochondriální funkce (21). Důležitou molekulou katabolismu je také AMPK (AMP-activated protein kinase), která rovněž funguje jako senzor množství živin a energie v buňce (konkrétně dle poměru AMP/ATP) a svojí aktivitou přispívá k prodloužení života (9, 21).
Naopak do anabolismu jsou zapojeny geny dvou složitých molekulárních drah, IIS (insulin/IGF-1 signaling) a mTOR (mammalian target of rapamycin), které reagují na nadbytek živin – konkrétně glukózy, respektive aminokyselin.
Molekulární dráha IIS je aktivována po navázání IGF-1 (inzulinu podobného růstového faktoru 1) na příslušný buněčný receptor, což vyvolá obdobnou reakci jako na inzulin, spočívající obecně ve spuštění anabolických procesů (7, 9). Snížená aktivita IIS (obr. 3) je spojená s aktivitou transkripčních faktorů DAF-16, resp. FOXO (forkhead box, group O) a dále genů HSF-1 (heat‑shock transcription factor neboli transkripčního faktoru teplotního šoku) a SKN-1 (skinhead family member 1), jež regulují metabolismus, proteostázu, proliferaci, apoptózu, průběh buněčného cyklu a stresovou odpověď buňky a mají tak pozitivní efekt na dlouhověkost (7, 19). Kaskáda IIS nicméně vede k jejich inhibici, a to konkrétně přes kinázu PI3K (phosphatidylinositol-3-kinase). Na základě těchto skutečností je tedy zřejmé, že utlumení této vysoce konzervované dráhy by mělo vést k prodloužení života (22). Je tomu tak například v případě mutací narušujících funkci receptoru pro IGF, které se vyskytují častěji u starších lidí (22). Určité varianty genu pro inzulinový receptor byly rovněž dány do souvislosti s dlouhověkostí, stejně jako některé polymorfismy v genu FOXO3A (9, 22, 23). Tyto polymorfismy mohou například snižovat riziko úmrtí v důsledku onemocnění srdce a cév (23).
Obr. 3. Zjednodušená dráha IIS a její propojení a interakce s dalšími drahami a konkrétními molekulami regulujícími energetický metabolismus buňky.
Šipka odpovídá aktivaci jednotlivých komponent a naopak inhibice je naznačena kolmou příčkou (přepažením). Oranžově podbarvené komponenty přispívají ke stárnutí, zatímco světle zeleně podbarvené komponenty mají pozitivní efekt na dlouhověkost. V obrázku je také znázorněna intervence v podobě kalorické restrikce, jíž je možné docílit prodloužení života. Obrázek rovněž pěkně vystihuje skutečnost, že anabolické signální kaskády urychlují stárnutí, zatímco jejich inhibice a katabolické procesy do určité míry prodlužují délku života. Dráhy IIS a TOR totiž figurují v anabolických reakcích na nadbytek živin, zatímco AMPK a sirtuiny reagují na nedostatek živin a figurují v katabolických reakcích. IIS reaguje na zvýšené množství glukózy indikující nadbytek živin a mTOR vnímá nadbytek energie dle vyšší hladiny aminokyselin. Sirtuiny naopak vnímají stav nedostatku energie detekcí zvýšené hladiny NAD+ a AMPK reaguje na vyšší hladiny AMP indikující rovněž katabolické děje (upraveno dle: 9).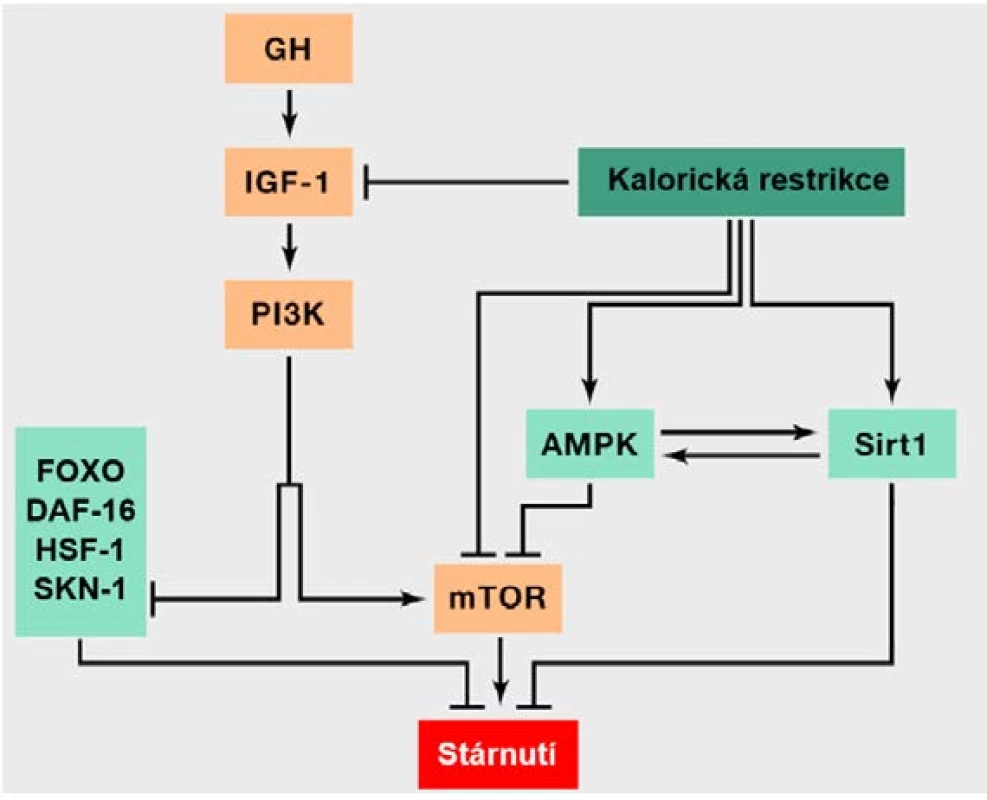
Pozn.: AMPK – AMP-activated protein kinase; DAF-16 – dauer formation factor 16; FOXO – forkhead box, group O; GH – growth hormone; HSF-1 – heat-shock transcription factor 1; IGF-1 – insulin-like growth factor 1; mTOR – mammalian (mechanistic) target of rapamycin; PI3K – phosphatidylinositol-3-kinase; Sirt1 – sirtuin 1; SKN-1 – skinhead family member 1. Multiproteinový komplex serin/threoninových kináz s názvem mTOR, kódovaný například geny TORC1 či TORC2, je součástí další podobné signální dráhy regulující prakticky všechny aspekty anabolismu (24, 25). V reakci na zvýšenou koncentraci aminokyselin, jež indikuje nadbytek živin, mTOR stimuluje růst a proteosyntézu a blokuje rozkladné procesy, jako je například autofagie (9, 25). Studie na modelových organismech ukázaly, že inhibice této dráhy rapamycinem prodlužuje život (24).
Při procesu stárnutí mají význam také produkty genů APOE (apolipoprotein E) a CETP (cholesteryl ester transfer protein). Účastní se totiž metabolismu lipidů a ovlivňují hladinu cirkulujícího cholesterolu (26, 27). Jsou známy 3 alely genu APOE (ε2, ε3, ε4) kódující 3 různé izoformy proteinu (27). Rozdílný genotyp se projevuje například na hladině cholesterolu a LDL cirkulujících v krvi, která je u jedinců s alelou ε4 vyšší a u nositelů alely ε2 naopak nižší v porovnání s ε3 (26, 27). S alelou ε4 bylo rovněž asociováno několik patologií, např. Alzheimerova či Parkinsonova nemoc nebo kardiovaskulární choroby (27). Dle očekávání pak alela ε4 genu APOE redukuje délku života, alela ε2 má naopak protektivní charakter.
Pokud jde o protektivní geny, nelze opomenout gen TP53 kódující proslulého „strážce genomu“, protein p53, který brání rozvoji nádorů, zajišťuje stresovou odpověď buňky na různé podněty, koordinuje opravy poškozené DNA a má ústřední úlohu v indukci apoptózy a senescence (28). Jeho asociace s dlouhověkostí by tedy neměla být překvapivá.
Velký význam mají i další geny zapojené do oprav poškození DNA a udržování architektury jádra (např. WRN, LMNA, PCNA, XRCC1, PARP1, RAD51, RAD52, BRCA1, BRCA2, ATM, ATR), jejichž mutace stojí například za syndromy předčasného stárnutí (progerie jako Wernerův a Hutchinsonův-Gilfordův syndrom) či za některými typy nádorů (29, 9). Vliv na délku života je dobře znám i v případě genu TERT (telomerase reverse transcriptase), kódujícího katalytickou podjednotku enzymu telomerázy, která prodlužuje telomery, jejichž zkracování je jedním z projevů stárnutí (30).
Velký význam v regulaci stárnutí mají rovněž cytokiny IL-10 a IL-6 (molekuly imunitního systému), jejichž polymorfismy vedoucí k utlumení zánětlivé reakce mají protektivní účinky (26, 31). Prvními geny asociovanými s dlouhověkostí u lidí (konkrétně roku 1987) byly další geny související s imunitním systémem, a sice geny kódující HLA (human leukocyte antigen), antigenní struktury přítomné na povrchu buněk (31). Do souvislosti s dlouhověkostí byl dán také jeden konkrétní polymorfismus v genu pro superoxiddismutázu SOD3, antioxidant chránící buňky před volnými radikály, a dále polymorfismus v genu ACE (angiotensin converting enzyme) regulujícím krevní tlak a hospodaření s minerály (31).
Seznam genů souvisejících se stárnutím je neustále doplňován díky GWAS, jež pokračují v odhalování obrovského množství nových genetických variant potenciálně zodpovědných za dlouhověkost (13). S ohledem na obrovské množství genů implikovaných v procesu stárnutí byl dokonce vytvořen i jejich katalog (GenAge database; dostupné na: http://genomics.senescence.info/longevity).
MOŽNOSTI ZÁSAHU DO PROCESU STÁRNUTÍ
S přibývajícími znalostmi o genetických a epigenetických mechanismech stárnutí se daří nacházet nadějné intervence schopné prodloužit délku života a zpomalit stárnutí u modelových organismů i u člověka.
Mezi látky, které prokazatelně prodlužují život, patří např. rapamycin inhibující dráhu mTOR (24). Působení rapamycinu imituje stav omezené dostupnosti živin (24). Také genetické manipulace oslabující signalizaci přes dráhu IIS prodlužují život C. elegans, D. melanogaster i M. musculus (22), stejně jako metformin aktivující AMPK, který však může působit i nepřímo přes střevní mikroflóru, konkrétně ovlivněním metabolismu folátu a methioninu u bakterií (32). Ovlivnění mikrobiomu obecně může představovat slibnou intervenci přispívající k dlouhověkosti (17, 32).
Nadějnou molekulou s pozitivním účinkem například na mitochondrie je bezesporu resveratrol, který figuruje jako aktivátor sirtuinů a je dobře prokázán jeho vliv na délku života u mnoha modelových organismů (9, 33). Klinické studie na lidských subjektech jsou velmi slibné, i když častým problémem z hlediska farmakokinetiky je u nich nízká biologická dostupnost, tedy množství látky v systémové cirkulaci (33). Také některé další aktivátory sirtuinů, jako je např. SRT1720 či SRT2104, prokazatelně prodlužují život (31).
Další zajímavou skupinou látek jsou tzv. senolytika čili sloučeniny schopné eliminovat senescentní buňky, jejichž příkladem může být navitoklax, kvercetin či dasatinib (34). Senolytika selektivně indukují apoptózu u senescentních buněk, a mají tak značný klinický potenciál v prevenci či zpomalení různých chorob asociovaných se stářím (34). Vedle odstranění nahromaděných senescentních buněk ale může pozitivní efekt přivodit naopak i jemné navození senescence vedoucí k supresi nádorů (9). V případě buněčné senescence tedy situace není tak jednoduchá a k prodloužení života mohou vést na první pohled protichůdné intervence.
Na změny mezibuněčné komunikace zase cílí různé tělu vlastní látky, jejichž účinky byly identifikovány při experimentech s tzv. heterochronickou parabiózou u myší, což je operativní spojení dvou jedinců, respektive jejich krevních oběhů (35). Velmi nadějnou molekulou vzešlou z těchto pokusů je GDF11 (též BMP-11; kostní morfogenetický protein 11) schopný regenerovat kosterní svalovinu i mozkovou tkáň a zlepšit tak motorické i kognitivní funkce (35).
Další možnosti jak zasáhnout do procesu stárnutí skýtají postupy jako např. transdukce telomerázy do buněk, genetické manipulace ovlivňující translaci, respiraci či proteostázu nebo indukce autofagie (7, 9).
Ukazuje se tedy, že organismy obecně mají potenciál žít déle, přičemž je třeba si uvědomit, že nemusí být nutné dramaticky zasahovat do genotypu jedince. Někdy stačí pouze modulovat faktory prostředí, což se týká i člověka. Podobného účinku jako v případě rapamycinu, metforminu či resveratrolu lze docílit i obyčejnou změnou životosprávy. Jde například o omezení příjmu energie (tzv. kalorickou restrikci [CR]), přičemž obvyklé je snížení příjmu potravy na 50–90 % hodnoty ad libitum, tedy ne nijak drasticky (36). Cílem je přitom snížit aktivitu anabolických signálních drah a zvýšit aktivitu katabolických drah (22). Odpověď na CR je dosažena prostřednictvím zapojení sirtuinů (36), dráhy IIS, mTOR i AMPK (22).
Z běžných složek potravy mají prokazatelný vliv na dlouhověkost (zejména prostřednictvím protinádorového působení) kupříkladu sulforafan či genistein a další flavonoidy a polyfenoly, tedy látky obsažené např. v zeleném čaji, košťálové zelenině či sójovém bobu (37). Rovněž dlouhodobější pravidelné užívání protizánětlivých látek, jako je například kyselina acetylsalicylová, může snížit riziko úmrtí na více typů nádorů (38).
Pozitivní vliv pravidelné pohybové aktivity a s tím mnohdy souvisejícího nižšího BMI na celkový zdravotní stav a dlouhověkost je dosti intuitivní. Moore et al. (39) zjistili, že nejvíce zvyšuje naději na dožití fyzická aktivita odpovídající alespoň 450 minutám svižné chůze za týden.
Uvedený výčet možných intervencí a konkrétních látek schopných zpomalit stárnutí a prodloužit délku života svědčí o tom, že lze v určité míře působit prakticky na každý aspekt stárnutí. Tuto skutečnost shrnuje obr. 4 znázorňující různé terapeutické strategie spolu s 9 rysy stárnutí dle Lópeze-Otína et al. (9).
Obr. 4. Slibné terapeutické intervence do procesu stárnutí ve vztahu k 9 charakteristickým rysům stárnutí (viz obr. 2) (upraveno dle: 9.) 
Pozn.: GDF-11 –růstový diferenciační faktor 11); iPSC – indukované pluripotentní kmenové buňky). ZÁVĚR
Vědecké bádání na poli biologie stárnutí nás přesvědčuje o tom, že ačkoliv každý intuitivně chápe, co se za pojmem stárnutí skrývá, není vůbec lehké je jednoznačně definovat a časově ohraničit. Rovněž na otázku, proč stárneme, nelze nalézt jednoduchou odpověď a označit něco za příčinu stárnutí nemusí být dle současných poznatků úplně přesné. Jinými slovy, daří se nacházet korelace, průkaz kauzality je však obvykle mnohem obtížnější. Bylo navrženo několik modelů vysvětlujících, jak organismy stárnou, a rovněž tento článek svým názvem „Genetické mechanismy stárnutí“ slibuje spíše odpověď na to, jak stárneme, nikoliv proč.
Bylo by velmi zjednodušující vnímat stárnutí čistě jako pokles vitality s věkem. Tento souhrn se snaží ukázat, že jde o komplexní a multifaktoriální proces, který je provázen změnami na mnoha úrovních, přičemž velký význam je přikládán vedle zkracování telomer, hromadění senescentních buněk a rostoucí nestability genomu rovněž epigenetickým změnám a zejména pak deregulaci výživy a změnám v rychlosti metabolismu.
Dnes není pochyb o tom, že stárnutí je do určité míry kontrolováno geneticky. Díky postupnému odhalování konkrétních genů, které mají podíl na stárnutí, se objevují mnohé slibné možnosti jak do procesu stárnutí zasáhnout. Jde například o ovlivnění aktivity specifických genů tak, abychom žili déle.
Mohlo by se zdát, že prodloužení života samo o sobě nic pozitivního nepřinese, tedy že lidé budou jenom delší dobu trpět určitými nemocemi. Výzkum stárnutí však jednoznačně prokázal dosti intuitivní provázanost mezi stárnutím jako takovým a výskytem široké škály patologií včetně maligních procesů, diabetu mellitu, neurodegenerativních a kardiovaskulárních chorob. V tomto ohledu bylo také doloženo, že mutace zpomalující stárnutí oddalují i propuknutí určitých nemocí. Obecně se tedy nabízí možnost vypořádat se s několika nemocemi naráz čistě zacílením na stárnutí, které představuje jejich primární rizikový faktor, a zlepšit tak i kvalitu života ve stáří. Je nepochybné, že před námi stojí nové možnosti, ale hlavně nové výzvy.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam zkratek
- ACE angiotenzin konvertující enzym
- AMPK proteinkináza aktivovaná adenosinmonofosfátem
- APOE apolipoprotein E
- BMP-11 kostní morfogenetický protein 11; též GDF11
- CETP cholesteryl ester transfer protein
- CR kalorická restrikce
- DAF dauer formation; transkripční faktory spjaté s formováním specifického klidového larválního stadia C. elegans
- FoxO třída O rodiny transkripčních faktorů Fox (forkhead box)
- GDF11 růstový diferenciační faktor 11; též BMP-11
- GWAS celogenomová asociační studie
- HLA lidský leukocytový antigen; systém antigenů hlavního histokompatibilního komplexu
- HSF-1 transkripční faktor teplotního šoku 1
- IGF-1 inzulinu podobný růstový faktor 1
- IIS signální dráha spuštěná mj. inzulinem či IGF-1
- mTOR mammalian target of rapamycin
- NAD+ nikotinamidadenindinukleotid
- NADH redukovaná forma nikotinamidadenindinukleotidu
- PI3K fosfatidylinositol-3-kináza
- SIR2 silent information regulator 2
- SKN-1 skinhead family member 1
- SOD superoxiddismutáza
- TERT telomerázová reverzní transkriptáza
Adresa pro korespondenci:
Bc. Lukáš Sourada
Ústav experimentální biologie PřF MU
Kamenice 753/5, 625 00 Brno
Tel.: 737 501 958
e-mail: 459739@muni.cz
Zdroje
- Weismann A. Über die Dauer des Lebens: ein Vortrag. G. Fischer, Jena, 1882.
- Horvath S, Raj K. DNA methylation-based biomarkers and the epigenetic clock theory of ageing. Nat Rev Genet 2018; 19 : 371–384.
- Jones OR, Scheuerlein A, Salguero-Gómez R et al. Diversity of ageing across the tree of life. Nature 2014; 505 : 169–173.
- Sweeney BW, Vannote RL. Population synchrony in mayflies: a predator satiation hypothesis. Evolution 1982; 36 : 810–821.
- Cohen AA. Aging across the tree of life: The importance of a comparative perspective for the use of animal models in aging. BBA-Mol. Basis Dis 2018; 1864 : 2680–2689.
- Dong X, Milholland B, Vijg J. Evidence for a limit to human lifespan. Nature 2016; 538 : 257–259.
- Kenyon C. The genetics of ageing. Nature 2010; 464 : 504–512.
- Robine JM, Allard M. The oldest human. Science 1998; 279 : 1834–1835.
- López-Otín C, Blasco MA, Partridge L et al. The hallmarks of aging. Cell 2013; 153 : 1194–1217.
- Strehler BL. Aging research: current and future. J Invest Dermatol 1979; 73(1): 2–7.
- Lenart P, Bienertová-Vašků J. Keeping up with the Red Queen: the pace of aging as an adaptation. Biogerontology 2017; 18 : 693–709.
- Gorbunova V, Bozzella M, Seluanov A. Rodents for comparative aging studies: from mice to beavers. Age 2008; 30 : 111–119.
- Sebastiani P, Gurinovich A, Bae H et al. Four genome-wide association studies identify new extreme longevity variants. J Gerontol A Biol Sci Med Sci 2017;72 : 1453–1464.
- Perls TT, Wilmoth J, Levenson R et al. Life-long sustained mortality advantage of siblings of centenarians. Proc Natl Acad Sci U S A 2002; 99(12): 8442–8447.
- Kaplanis J, Gordon A, Shor T et al. Quantitative analysis of population-scale family trees with millions of relatives. Science 2018; 360 : 171–175.
- Rajpathak SN, Liu Y, Ben-David O et al. Lifestyle factors of people with exceptional longevity. J Am Geriatr Soc 2011; 59 : 1509–1512.
- Dato S, Rose G, Crocco P et al. The genetics of human longevity: an intricacy of genes, environment, culture and microbiome. Mech Ageing Dev 2017; 165 : 147–155.
- Klass MR. A method for the isolation of longevity mutants in the nematode Caenorhabditis elegans and initial results. Mech Ageing Dev 1983, 22 : 279–286.
- Murakami S, Johnson TE. A genetic pathway conferring life extension and resistance to UV stress in Caenorhabditis elegans. Genetics 1996; 143 : 1207–1218.
- Kaeberlein M, McVey M, Guarente L. The SIR2/3/4 complex and SIR2 alone promote longevity in Saccharomyces cerevisiae by two different mechanisms. Genes Dev 1999; 13 : 2570–2580.
- Morris BJ. Seven sirtuins for seven deadly diseases of aging. Free Radical Bio Med 2013; 56 : 133–171.
- Fontana L, Partridge L, Longo VD. Extending healthy life span: from yeast to humans. Science 2010; 328 : 321–326.
- Willcox B. J, Tranah G. J, Chen R et al. The FoxO3 gene and cause-specific mortality. Aging Cell 2016; 15 : 617–624.
- Harrison DE, Strong R, Sharp ZD et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature 2009; 460 : 392–395.
- Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell 2012; 149 : 274–293.
- Soerensen M, Dato S, Tan Q et al. Evidence from case–control and longitudinal studies supports associations of genetic variation in APOE, CETP, and IL-6 with human longevity. Age 2013; 35 : 487–500.
- Mahley RW. Apolipoprotein E: from cardiovascular disease to neurodegenerative disorders. J Mol Med 2016; 94 : 739–746.
- Bojesen SE, Nordestgaard BG. The common germline Arg72Pro polymorphism of p53 and increased longevity in humans. Cell Cycle 2008; 7 : 158–163.
- Debrabant B, Soerensen M, Flachsbart F et al. Human longevity and variation in DNA damage response and repair: study of the contribution of sub-processes using competitive gene-set analysis. Eur J Hum Genet 2014; 22 : 1131–1136.
- Rode L, Nordestgaard BG, Bojesen SE. Peripheral blood leukocyte telomere length and mortality among 64 637 individuals from the general population. J Natl Cancer Inst 2015; 107: djv074.
- Morris BJ, Willcox BJ, Donlon TA. Genetic and epigenetic regulation of human aging and longevity. BBA-Mol Basis Dis 2019; 1865 : 1718–1744.
- Cabreiro F, Au C, Leung KY et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism. Cell 2013; 153 : 228–239.
- Berman AY, Motechin RA, Wiesenfeld MY et al. The therapeutic potential of resveratrol: a review of clinical trials. NPJ Precis Oncol 2017; 1 : 35.
- Kirkland JL, Tchkonia T, Zhu Y et al. The clinical potential of senolytic drugs. J Am Geriatr Soc 2017; 65 : 2297–2301.
- Katsimpardi L, Litterman N. K, Schein PA et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors. Science 2014; 344 : 630–634.
- Cohen HY, Miller Ch, Bitterman KJ et al. Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase. Science 2004; 305 : 390–392.
- Daniel M, Tollefsbol TO. Epigenetic linkage of aging, cancer and nutrition. J Exp Biol 2015; 218 : 59–70.
- Rothwell PM, Fowkes FGR, Belch JFF et al. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. Lancet 2011; 377 : 31–41.
- Moore SC, Patel AV, Matthews ChE et al. Leisure time physical activity of moderate to vigorous intensity and mortality: a large pooled cohort analysis. PLoS Med 2012; 9: e1001335.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodemČlánek Za prof. Milanem Šamánkem
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
- Aktuální problematika COVID-19 z pohledu imunologa
- Testování COVID-19 – co bychom měli mít na paměti
- O lékařském tajemství (nejen) za časů koronaviru
- Genetické mechanismy stárnutí
- Molekulárně genetický pohled na podstatu buněčné senescence v kontextu stárnutí organismu
- Eutanázie v zajetí věcných omylů a falešných argumentačních strategií
- Za prof. Milanem Šamánkem
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Testování COVID-19 – co bychom měli mít na paměti
- Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
- Genetické mechanismy stárnutí
- Molekulárně genetický pohled na podstatu buněčné senescence v kontextu stárnutí organismu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



