-
Medical journals
- Career
PSC-IBD: specifický fenotyp idiopatického střevního zánětu asociovaný s primární sklerózující cholangitidou
Authors: Lukáš Bajer; Pavel Wohl; Pavel Drastich
Authors‘ workplace: Klinika hepatogastroenterologie IKEM, Praha
Published in: Vnitř Lék 2018; 64(6): 659-664
Category: Reviews
Overview
Primární sklerózující cholangitida (PSC) je progresivní chorobou žlučových cest a ve vyspělých zemích představuje jednu z nejčastějších indikací ortotopické transplantace jater (OLTx), která je zároveň jedinou doposud známou kurativní metodou. U přibližně 70 % pacientů je PSC doprovázena idiopatickým střevním zánětem (IBD). Ten je pro svoje četná klinická a etiopatogenetická specifika považován za samostatný fenotyp IBD, odlišný od lépe definovaných chorob: ulcerózní kolitidy (UC) a Crohnovy choroby (CD). V literatuře bývá onemocnění obvykle označováno jako „PSC-IBD.“ Ve většině případů se manifestuje jako klinicky mírná extenzivní kolitida s pravostrannou predominancí. Dalšími se zvýšenou frekvencí zastoupenými morfologickými znaky jsou „back-wash“ ileitida a „rectal-sparing“. Pacienti s PSC-IBD jsou ohroženi vysokým rizikem vzniku kolorektálních neoplazií s tendencí k rychlé progresi. Pankoloskopické vyšetření s chromoendoskopií či etážovým odběrem biopsií musí být u této skupiny nemocných prováděno v intervalu 1–2 let. Již při nálezu nízkého stupně dysplazie musí být zváženo provedení profylaktické kolektomie. Farmakologická léčba PSC-IBD se řídí obdobnými algoritmy jako terapie UC a CD, má však svoje specifika, která zohledňují především souběžnou chorobu jater. Metodou volby v léčbě chirurgické je proktokolektomie s ileo-pouch-anální anastomózou (IPAA). Pacienti s PSC-IBD a IPAA vykazují zvýšené riziko rozvoje pouchitidy. Průběh střevního zánětu po OLTx se může navzdory podávané imunosupresi významně zhoršit. U mnoha pacientů dokonce choroba vzniká až de novo po OLTx a může ovlivňovat riziko rekurence PSC v jaterním štěpu.
Klíčová slova:
idiopatický střevní zánět – primární sklerózující cholangitida – PSC-IBD
Úvod
Primární sklerózující cholangitida je progresivní cholestatická choroba jater charakterizovaná zánětem, fibrózou a stenózami malých a/nebo velkých větví žlučového stromu. Onemocnění může vést až k jaterní cirhóze, transplantaci jater či úmrtí. V rámci Evropy má PSC nejvyšší incidenci v severských zemích (1,3/100 000 obyvatel/rok v Norsku), zatímco v jihoevropských zemích je výskyt znatelně nižší (0,07/100 000 obyvatel/rok ve Španělsku). Téměř 2krát častěji se nemoc vyskytuje v mužské populaci [1–3]. Přesná data o výskytu v České republice k dispozici nejsou. Z bezmála 1 500 pacientů, kteří podstoupili transplantaci jater v pražském IKEM v letech 1995–2017, byl však přibližně každý 10. zařazen na čekací listinu právě z indikace pokročilé PSC.
U přibližně 70 % (dle různých studií 55–99 %) pacientů je PSC doprovázena idiopatickým střevním zánětem (inflammatory bowel disease – IBD) [4]. Tuto asociaci mezi onemocněními dvou různých orgánů zažívacího traktu popsal Warren již v roce 1966 [5]. Střevní zánět u PSC je v praxi ve více než 75 % případů kvalifikován jako ulcerózní kolitida (ulcerative colitis – UC), méně často pak jako Crohnova nemoc (Crohn´s disease – CD). Typické histologické znaky CD jsou však vyjádřeny jen velmi vzácně, postižení je vázáno téměř výhradně na tlusté střevo (CD se může vyskytovat v jakékoliv části trávicí trubice), a diagnóza tak často nakonec bývá překvalifikována na UC. Zejména starší literatura popisuje PSC jako extraintestinální (hepatobiliární) manifestaci IBD, především UC. Tato definice ale může být zavádějící, jelikož se PSC u přibližně poloviny pacientů vyvíjí často i mnoho let před IBD, v jiných případech naopak vzniká dlouho po provedení proktokolektomie [6–8].
Střevní zánět doprovázející PSC vykazuje četná patogenetická, morfologická a klinická specifika (tab). Genetický podklad je v porovnání s „klasickými“ fenotypy IBD (UC a CD) taktéž odlišný. V současné době je tedy toto střevní onemocnění považováno za zcela samostatný fenotyp IBD. V literatuře se většinou označuje jako „PSC-IBD“, případně jako „PSC-UC“ nebo „PSC-CD“ (dle toho, kterému z klasických fenotypů IBD se u daných pacientů více podobá) [9–11].
Tab. Nejčastěji zastoupené klinické a morfologické rysy PSC-IBD extenzivní kolitida (pankolitida) s pravostrannou predominancí mírný či zcela klidový klinický průběh back-wash ileitida rectal-sparing vysoké riziko vzniku kolorektálních neoplazií zvýšený výskyt pouchitidy u pacientů po proktokolektomii s IPAA zvýšené riziko krvácení z peristomálních varixů u pacientů s ileostomií 
Klinický obraz PSC a IBD
Diagnostika a klinický průběh PSC
V období předcházejícím rozmach moderních zobrazovacích a endoskopických metod byla PSC považována za zcela raritní onemocnění. Záchyt PSC však významně vzrostl s nástupem ERCP (endoskopická retrográdní cholangiopankreatografie) v 70. letech minulého století a posléze MRCP (magnetická rezonanční cholangiopancreatografie/Magnetic Resonance CholangioPancreatography) v 90. letech minulého století. V dnešní době je ERCP rezervována pro terapeutické účely a jako čistě diagnostický nástroj je preferována MRCP (obr. 1) [12]. Normální nález na cholangiogramu však s jistotou nevylučuje diagnózu PSC, tzv. „small-duct“ forma, tedy onemocnění malých žlučovodů, je totiž detekovatelná pouze na základě jaterní biopsie. Změny navíc mohou být vyjádřeny fokálně, a ani histologické vyšetření punktátu tak nemusí změny na drobných žlučovodech vždy zachytit [13]. V přibližně 10–20 % případů PSC koinciduje s autoimunitní hepatitidou (AIH). Tento stav, dříve označovaný jako „overlap-syndrome AIH/PSC“, má svoje diagnostická a léčebná specifika, z větší části diktovaná autoimunitní složkou choroby [14,15].
Image 1. Cholangiogram u pacienta s PSC. Typické změny zachycené při MRCP: vícečetné segmentální striktury a dilatace žlučového stromu s charakteristickým „korálkováním“ 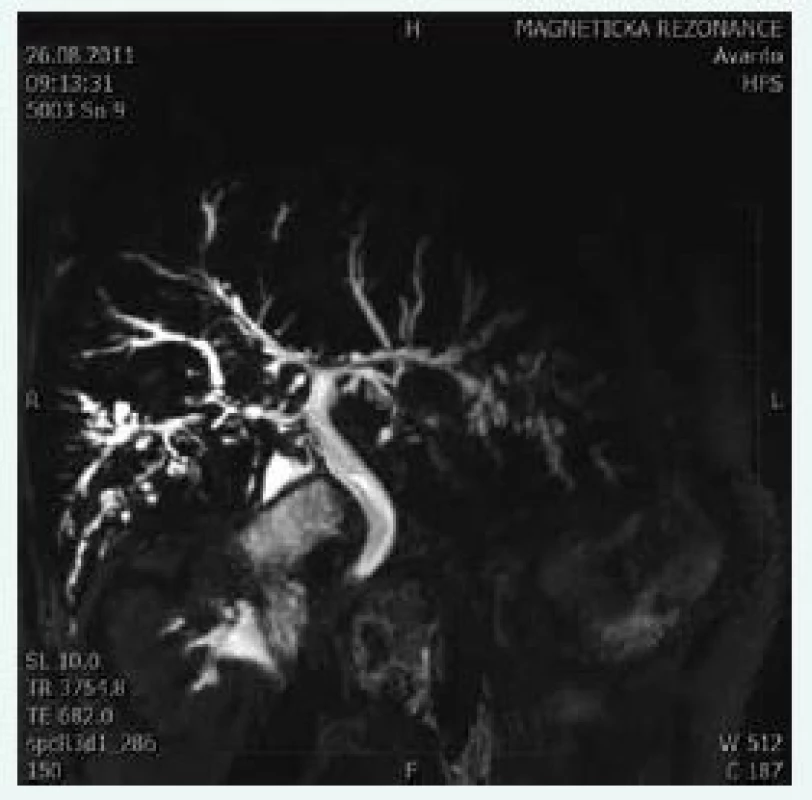
Tíže projevů spojených s PSC je variabilní, pohybující se od asymptomatické elevace ALP až k významnému ikteru, refrakternímu pruritu, cholangiogenní sepsi a plné paletě symptomů vyplívajících z jaterní dysfunkce a pokročilé portální hypertenze. Zmíněné těžké projevy choroby, vedoucí k nutnosti transplantační léčby nebo až k úmrtí, nastupují však zpravidla po mnoha letech jejího trvání [12,15].
Morfologie a aktivita PSC-IBD
PSC-IBD se v až 95 % případů manifestuje jako pankolitida. V rámci tohoto extenzivního postižení tračníku bývají morfologické změny často nejvíce vyjádřeny v pravostranném kolon (obr. 2). Někdy dokonce hovoříme o „pravostranné kolitidě“, což odlišuje tento fenotyp IBD od ulcerózní kolitidy. U té rozsah zánětu tradičně sleduje osu proktitida → levostranná kolitida → pankolitida, přičemž nejvýznamnější změny nacházíme zpravidla v rektu (a k posouzení aktivity zánětu tak mnohdy postačí sigmoideoskopie). U PSC-IBD bývá rektum naopak se zvýšenou frekvencí (u přibližně jedné třetiny pacientů) intaktní, hovoříme pak o tzv. rectal-sparingu. Dalším častěji zastoupeným morfologickým znakem PSC-IBD bývá „backwash-ileitida“, tedy reaktivní zánětlivé postižení terminálního ilea doprovázející inflamaci céka. Tento nález bývá přítomen v asi v 17 % případů.
Image 2. Endoskopický nález u PSC-IBD: extenzivní kolitida s pravostrannou predominancí zánětlivých změn. Aktivní zánět v céku (nahoře) s úbytkem inflamatorních změn distálním směrem (dole) 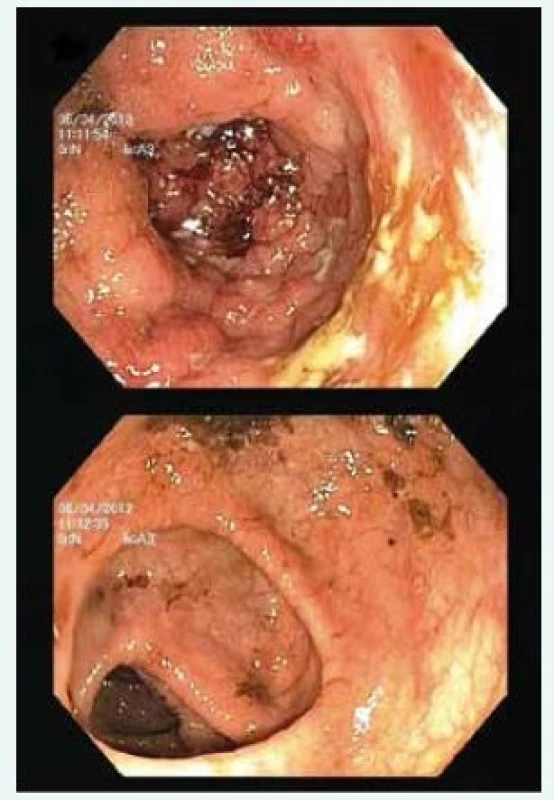
Navzdory vysoké prevalenci pankolitidy mívá PSC-IBD zpravidla mírný klinický průběh. Typické symptomy IBD (především průjmy, tenezmy, krvavá příměs ve stolici atp) buď zcela chybějí, nebo bývají ve většině případů taktéž relativně mírné. Relapsy choroby a nutnost kortikoterapie či hospitalizace nebývají u této skupiny pacientů s IBD obvyklé. Přesto může mít u části pacientů PSC-IBD refrakterní průběh, vyžadující nasazení agresivní farmakoterapie, nebo dokonce provedení proktokolektomie [10,11,14,16,17].
Specifika endoskopie a kolorektální neoplazie u PSC-IBD
Vzhledem k pravostranné predominanci a častému ušetření rekta by se endoskopie u pacientů s PSC neměla nikdy omezovat na sigmoideoskopické vyšetření. Protože nemusejí být zánětlivé změny při typicky mírném průběhu choroby vyjádřeny makroskopicky, je za účelem vyloučení PSC-IBD vždy nutné doplnit pankoloskopické vyšetření o biopsii ze všech anatomických částí tlustého střeva (cékum až rektum). U pacientů s PSC bez průkazu IBD lze při absenci symptomů za racionální interval pro zopakování koloskopie považovat 3–5 let [11].
Potvrzení diagnózy PSC-IBD bez ohledu na aktivitu zánětu a věk pacienta naopak implikuje pravidelné protokolární koloskopické vyšetření v intervalu 1–2 let [17]. Důvodem je vysoký výskyt kolorektálních (navíc často rychle progredujících) neoplazií u PSC-IBD. Kumulativní riziko vzniku kolorektálního karcinomu (ColoRectal Cancer – CRC) do 10 a 20 let od stanovení diagnózy je 7–14 % a 18–31 %. U UC jsou pro ilustraci tyto hodnoty podstatně nižší: 2 % a 7 %, byť i zde je oproti běžné populací riziko významně zvýšeno [18–20]. Neoplazie u PSC-IBD postihují ve více než 60 % případů pravostranné kolon, a provedení neodůvodněně inkompletní koloskopie je proto opět hrubou chybou [10,21]. Dle doporučení ECCO (European Crohn´s and Colitis Organisation) je preferováno vyšetření za použití chromoendoskopie (metoda využívající tkáňová barviva) s následnou cílenou biopsií suspektních úseků sliznice. Alternativou je koloskopie s etážovým odběrem kvadrantových biopsií (tzv. „random-biopsy“) každých 10 cm, doplněná o cílené biopsie všech suspektních strukturálních změn [17]. Již nález nízkého stupně dysplazie (low-grade – LGD) by měl vést k vážné úvaze o provedení profylaktické proktokolektomie (netýká se kompletně odstranitelných polypoidních lézí). 5leté riziko progrese LGD do vysokého stupně dysplazie (high-grade – HGD), nebo dokonce adenokarcinomu v tomto případě totiž dosahuje 33–54 %. Nález HGD by pak měl být k profylaktické proktokolektomii referován vždycky [22–24].
Léčba PSC-IBD a její specifika
Farmakoterapie u PSC-IBD
Medikamentózní terapie PSC-IBD se v zásadě řídí doporučeními platnými pro UC a CD, ovšem je při ní třeba pečlivě zohledňovat její dopad na průběh základní jaterní choroby [15]. Základním farmakem v terapii PSC-IBD je mesalazin. Vzhledem k většinou mírnému průběhu PSC-IBD postačuje mesalazin v monoterapii dlouhodobě u až 77 % pacientů. Navíc se předpokládá jeho chemopreventivní úloha v prevenci CRC [6,25]. Kortikosteroidy jsou k chronické udržovací terapii nevhodné a s ohledem na nízkou frekvenci relapsů u PSC-IBD není jejich užívání časté. U nemocných s PSC je k užití steroidů třeba přistupovat obezřetně vzhledem k riziku infekčních komplikací (cholangiogenní sepse) a zhoršení kostní choroby, která je v různé intenzitě přítomna u většiny pacientů s PSC [15,26]. Taktéž léčba imunosupresivy musí probíhat se zvýšenou opatrností. Známý hepatotoxický účinek azatioprinu může být u PSC-IBD až 10krát větší než u pacientů s UC. Jeho nasazení by vždy mělo předcházet vyšetření TPMT (thiopurin methyltransferáza). Léčba kortikoidy a imunosupresivy nicméně má své nezastupitelné místo u pacientů s překryvným syndromem AIH/PSC [15,27]. S podáváním biologické léčby u PSC-IBD je stále poměrně málo zkušeností. Terapie anti-TNF (tumor necrosis factor) preparáty (zejména infliximab a adalimumab) se jeví jako účinná, její vliv na průběh souběžné jaterní choroby však zatím není spolehlivě definován. Obzvláště léčba infliximabem může být vzácně spojena s těžkou hepatotoxicitou, a k její indikaci u PSC-IBD je tak třeba přistupovat s opatrností [6,28]. Vzhledem k provázaným patogenetickým mechanizmům PSC a IBD vzbudil velká očekávání vedolizumab, do klinické praxe recentně zavedená monoklonální antiintegrinová (anti-α4β7) protilátka. Dle aktuální multicentrické studie je vedolizumab bezpečnou a efektivní léčebnou modalitou u PSC-IBD (včetně pacientů po OLTx), jeho podávání však nevede k poklesu jaterních testů [29].
Role kyseliny urzodeoxycholové (UDCA) v prevenci vzniku a progrese kolorektálních neoplazií u PSC je stále předmětem diskuse a závěry různých studií se v tomto ohledu rozcházejí. Evropské odborné společnosti však pro možný chemopreventivní účinek UDCA její podávání u PSC-IBD doporučují. Optimální dávkování v této indikaci se pohybuje mezi 8–15 mg/kg/den, dávky vyšší mohou být naopak spojeny se zvýšeným rizikem vzniku CRC a rozvojem závažných nežádoucích účinků. Při léčbě samotné PSC byl prokázán efekt UDCA na zlepšení laboratorních parametrů, nikoliv však na tíži symptomů nebo výslednou dobu přežití [30–34].
Chirurgická léčba u PSC-IBD
Chirurgická léčba bývá u PSC-IBD obvykle indikována při refrakterním průběhu kolitidy nebo při detekci dysplazií a její načasování musí striktně zohledňovat stav přidruženého onemocnění jater. Metodou volby je ve většině případů proktokolektomie s IPAA [35]. Výkon zahrnující zhotovení ileostomie s sebou při pokročilém jaterním onemocnění nese riziko vzniku peristomálních varixů, které mohou být příčinou velmi těžko zvladatelného krvácení [36]. Ileorektální anastomóza se u PSC-IBD nepoužívá.
Nejčastější komplikací IPAA je pouchitida. Vyskytuje se u přibližně 60 % pacientů s PSC-IBD po IPAA. To je asi 2krát častěji v porovnání s pacienty s UC. Selhání pouche (typicky z důvodu refrakterní pouchitidy, neoplazie nebo zformování píštěle) se vyskytuje v 1,5–16,1 % případů, což zhruba odpovídá frekvenci u ostatních fenotypů IBD [37–39].
Transplantační léčba ve vztahu k PSC-IBD
Ortotopická transplantace jater (OLTx) je dodnes jedinou kurativní modalitou u PSC. Zejména v severních zemích Evropy a Ameriky, v nichž má choroba nejvyšší incidenci, je PSC jednou z nejčastějších indikací k OLTx. Vzhledem k progresivnímu charakteru choroby podstoupí OLTx do 10–20 let od stanovení diagnózy PSC více než 50 % pacientů [40]. Současná data naznačují, že tíže jaterní a střevní choroby mohou být do jisté míry protichůdné. Těžký průběh PSC vyžadující transplantaci jater je totiž většinou spojen s mírným průběhem IBD. Naopak u pacientů se stabilně málo pokročilou PSC byla pozorována tendence k vysoké aktivitě střevního zánětu [10,41]. Transplantace jater (a následné trvalé užívání imunosuprese) může být paradoxně spojena se zhoršením klinického průběhu IBD [42]. V až 31,3 % případů může navíc IBD vzniknout de novo po OLTx. Právě doba vzniku a aktivita IBD může mít zásadní vliv na riziko vzniku rekurence PSC po transplantaci (rPSC), a tím pádem i na přežití pacienta či jaterního štěpu [43]. Není proto s podivem, že je frekvence rPSC významně snížená u pacientů, kteří před transplantací prodělali kolektomii [44].
Závěr
PSC-IBD je dnes považován za samostatný fenotyp IBD, odlišný od UC a CD. Obvykle se projevuje jako klinicky mírná pankolitida. Onemocnění se vyznačuje vysokým výskytem a rychlou progresí kolorektálních neoplazií. Již při záchytu (nepolypoidní) LGD by proto měla být zvážena profylaktická kolektomie. Zánětlivé i neoplastické změny mají pravostrannou predominanci, kontrolní endoskopické vyšetření tedy musí probíhat v plném rozsahu tlustého střeva, a to v intervalu 1–2 let. K navození a udržení remise stačí u většiny pacientů PSC-IBD podávání mesalazinu. V chirurgické léčbě PSC-IBD je preferována proktokolektomie s IPAA. Při léčbě střevního zánětu u PSC je nutné kvalifikované zohlednění stavu přidruženého onemocnění jater.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-28064A.
MUDr. Lukáš Bajer
lukas.bajer@ikem.cz
Klinika hepatogastroenterologie IKEM, Praha
www.ikem.cz
Doručeno do redakce: 23. 2. 2018
Přijato po recenzi: 18. 4. 2018
Sources
- Schrumpf E, Abdelnoor M, Fausa O et al. Risk factors in primary sclerosing cholangitis. J Hepatol 1994; 21(6): 1061–1066.
- Escorsell A, Pares A, Rodes J et al. Epidemiology of primary sclerosing cholangitis in Spain. Spanish Association for the Study of the Liver. J Hepatol 1994; 21(5): 787–791.
- Molodecky NA, Kareemi H, Parab R et al. Incidence of primary sclerosing cholangitis: a systematic review and meta-analysis. Hepatology 2011; 53(5): 1590–1599. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.24247>.
- Alipour M, Zaidi D, Valcheva R et al. Mucosal Barrier Depletion and Loss of Bacterial Diversity are Primary Abnormalities in Paediatric Ulcerative Colitis. J Crohns Colitis 2016; 10(4): 462–471. Dostupné z DOI: <http://dx.doi.org/10.1093/ecco-jcc/jjv223>.
- Warren KW, Athanassiades S, Monge JI. Primary sclerosing cholangitis. A study of forty-two cases. Am J Surg 1966; 111(1): 23–38.
- Rojas-Feria M, Castro M, Suarez E et al. Hepatobiliary manifestations in inflammatory bowel disease: the gut, the drugs and the liver. World J Gastroenterol 2013; 19(42): 7327–7340. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v19.i42.7327>.
- Schaeffer DF, Win LL, Hafezi-Bakhtiari S et al. The phenotypic expression of inflammatory bowel disease in patients with primary sclerosing cholangitis differs in the distribution of colitis. Dig Dis Sci 2013; 58(9): 2608–2614. Dostupné z DOI: <http://dx.doi.org/10.1007/s10620–013–2697–7>.
- Sinakos E, Samuel S, Enders F et al. Inflammatory bowel disease in primary sclerosing cholangitis: a robust yet changing relationship. Inflamm Bowel Dis 2013; 19(5): 1004–1009. Dostupné z DOI: <http://dx.doi.org/10.1097/MIB.0b013e3182802893>.
- Bajer L, Kverka M, Kostovcik M et al. Distinct gut microbiota profiles in patients with primary sclerosing cholangitis and ulcerative colitis. World J Gastroenterol 2017; 23(25): 4548–4558. <http://dx.doi.org/10.3748/wjg.v23.i25.4548>.
- de Vries AB, Janse M, Blokzijl H et al. Distinctive inflammatory bowel disease phenotype in primary sclerosing cholangitis. World J Gastroenterol 2015; 21(6): 1956–1971. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v21.i6.1956>.
- Loftus EV Jr, Harewood GC, Loftus CG et al. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91–96. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.2004.046615>.
- Williamson KD, Chapman RW. Primary sclerosing cholangitis. Dig Dis 2014; 32(4): 438–445. <http://dx.doi.org/10.1159/000358150>.
- Naess S, Bjornsson E, Anmarkrud JA et al. Small duct primary sclerosing cholangitis without inflammatory bowel disease is genetically different from large duct disease. Liver Int 2014; 34(10): 1488–1495. Dostupné z DOI: <http://dx.doi.org/10.1111/liv.12492>.
- Williamson KD, Chapman RW. Primary sclerosing cholangitis: a clinical update. Br Med Bull 2015; 114(1): 53–64. Dostupné z DOI: <http://dx.doi.org/10.1093/bmb/ldv019>.
- Chapman R, Fevery J, Kalloo A et al. Diagnosis and management of primary sclerosing cholangitis. Hepatology 2010; 51(2): 660–678. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23294>.
- Palmela C, Peerani F, Castaneda D et al. Inflammatory Bowel Disease and Primary Sclerosing Cholangitis: A Review of the Phenotype and Associated Specific Features. Gut Liver 2018; 12(1): 17–29. Dostupné z DOI: <http://dx.doi.org/10.5009/gnl16510>.
- Magro F, Gionchetti P, Eliakim R et al. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders. J Crohns Colitis 2017; 11(6): 649–670. Dostupné z DOI: <http://dx.doi.org/10.1093/ecco-jcc/jjx008>.
- Fevery J, Henckaerts L, Van Oirbeek R et al. Malignancies and mortality in 200 patients with primary sclerosering cholangitis: a long-term single-centre study. Liver Int 2012; 32(2): 214–222. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1478–3231.2011.02575.x>.
- Claessen MM, Vleggaar FP, Tytgat KM et al. High lifetime risk of cancer in primary sclerosing cholangitis. J Hepatol 2009; 50(1): 158–164. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2008.08.013>.
- Terg R, Sambuelli A, Coronel E et al. Prevalence of primary sclerosing cholangitis in patients with ulcerative colitis and the risk of developing malignancies. A large prospective study. Acta Gastroenterol Latinoam 2008; 38(1): 26–33.
- Broome U, Lofberg R, Veress B et al. Primary sclerosing cholangitis and ulcerative colitis: evidence for increased neoplastic potential. Hepatology 1995; 22(5): 1404–1408.
- Ullman TA, Loftus EV Jr, Kakar S et al. The fate of low grade dysplasia in ulcerative colitis. Am J Gastroenterol 2002; 97(4): 922–927. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2002.05610.x>.
- Connell WR, Lennard-Jones JE, Williams CB et al. Factors affecting the outcome of endoscopic surveillance for cancer in ulcerative colitis. Gastroenterology 1994; 107(4): 934–944.
- Zisman TL, Rubin DT. Colorectal cancer and dysplasia in inflammatory bowel disease. World J Gastroenterol 2008; 14(17): 2662–2669.
- Stolfi C, Pallone F, Monteleone G. Colorectal cancer chemoprevention by mesalazine and its derivatives. J Biomed Biotechnol 2012; 2012 : 980458. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/980458>.
- Angulo P, Batts KP, Jorgensen RA et al. Oral budesonide in the treatment of primary sclerosing cholangitis. Am J Gastroenterol 2000; 95(9): 2333–2337. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2000.02323.x>.
- Pallavicino F, Pellicano R, Reggiani S et al. Inflammatory bowel diseases and primary sclerosing cholangitis: hepatic and pancreatic side effects due to azathioprine. Eur Rev Med Pharmacol Sci 2013; 17(1): 84–87.
- Ghabril M, Bonkovsky HL, Kum C et al. Liver injury from tumor necrosis factor-alpha antagonists: analysis of thirty-four cases. Clin Gastroenterol Hepatol 2013; 11(5): 558–564. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2012.12.025>.
- Christensen B, Micic D, Gibson PR et al. Vedolizumab in patients with concurrent primary sclerosing cholangitis and inflammatory bowel disease does not improve liver biochemistry but is safe and effective for the bowel disease. Aliment Pharmacol Ther 2018; 47(6): 753–762. Dostupné z DOI: <http://dx.doi.org/10.1111/apt.14525>.
- Van Assche G, Dignass A, Bokemeyer B et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 3: special situations. J Crohns Colitis 2013; 7(1): 1–33. Dostupné z DOI: <http://dx.doi.org/10.1016/j.crohns.2012.09.005>.
- [European Association for the Study of the Liver]. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol 2009; 51(2): 237–267. <http://dx.doi.org/10.1016/j.jhep.2009.04.009>.
- Lindor KD. Ursodiol for primary sclerosing cholangitis. Mayo Primary Sclerosing Cholangitis-Ursodeoxycholic Acid Study Group. N Engl J Med 1997; 336(10): 691–695. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199703063361003>.
- Wang R, Leong RW. Primary sclerosing cholangitis as an independent risk factor for colorectal cancer in the context of inflammatory bowel disease: a review of the literature. World J Gastroenterol 2014; 20(27): 8783–8789. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v20.i27.8783>.
- Singh S, Khanna S, Pardi DS et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis 2013; 19(8): 1631–1638. Dostupné z DOI: <http://dx.doi.org/10.1097/MIB.0b013e318286fa61>.
- Treeprasertsuk S, Bjornsson E, Sinakos E et al. Outcome of patients with primary sclerosing cholangitis and ulcerative colitis undergoing colectomy. World J Gastrointest Pharmacol Ther 2013; 4(3): 61–68. Dostupné z DOI: <http://dx.doi.org/10.4292/wjgpt.v4.i3.61>.
- Wiesner RH, LaRusso NF, Dozois RR et al. Peristomal varices after proctocolectomy in patients with primary sclerosing cholangitis. Gastroenterology 1986; 90(2): 316–322.
- Mathis KL, Benavente-Chenhalls LA, Dozois EJ et al. Short - and long-term surgical outcomes in patients undergoing proctocolectomy with ileal pouch-anal anastomosis in the setting of primary sclerosing cholangitis. Dis Colon Rectum 2011; 54(7): 787–792. Dostupné z DOI: <http://dx.doi.org/10.1007/DCR.0b013e318217eea7>.
- Block M, Jorgensen KK, Oresland T et al. Colectomy for patients with ulcerative colitis and primary sclerosing cholangitis – what next? J Crohns Colitis 2014; 8(5): 421–430. Dostupné z DOI: <http://dx.doi.org/10.1016/j.crohns.2013.10.008>.
- Gorgun E, Remzi FH, Manilich E et al. Surgical outcome in patients with primary sclerosing cholangitis undergoing ileal pouch-anal anastomosis: a case-control study. Surgery 2005; 138(4): 631–637; discussion 637–639. <http://dx.doi.org/10.1016/j.surg.2005.07.014>.
- Hirschfield GM, Karlsen TH, Lindor KD et al. Primary sclerosing cholangitis. Lancet 2013; 382(9904): 1587–1599. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(13)60096–3>.
- Marelli L, Xirouchakis E, Kalambokis G et al. Does the severity of primary sclerosing cholangitis influence the clinical course of associated ulcerative colitis? Gut 2011; 60(9): 1224–1228. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.2010.235408>.
- Moncrief KJ, Savu A, Ma MM et al. The natural history of inflammatory bowel disease and primary sclerosing cholangitis after liver transplantation – a single-centre experience. Can J Gastroenterol 2010; 24(1): 40–46.
- Hildebrand T, Pannicke N, Dechene A et al. Biliary strictures and recurrence after liver transplantation for primary sclerosing cholangitis: A retrospective multicenter analysis. Liver Transpl 2016; 22(1): 42–52. Dostupné z DOI: <http://dx.doi.org/10.1002/lt.24350>.
- Lindstrom L, Jorgensen KK, Boberg KM et al. Risk factors and prognosis for recurrent primary sclerosing cholangitis after liver transplantation: a Nordic Multicentre Study. Scand J Gastroenterol 2018; 53(3): 297–304. Dostupné z DOI: <http://dx.doi.org/10.1080/00365521.2017.1421705>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 6-
All articles in this issue
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu
- Terapie peptického vředu
- Historie celiakie
- Celiakie v roce 2018
- Diagnostika poruch motility gastrointestinálního traktu
- Divertikulární choroba: diagnostika a léčba
- Familiární adenomatózní polypóza: komplexní péče o pacienty
- Konvenční a biologická terapie idiopatických střevních zánětů
- Péče o IBD pacienty v terénní praxi
- PSC-IBD: specifický fenotyp idiopatického střevního zánětu asociovaný s primární sklerózující cholangitidou
- Možnosti terapeutické manipulace se střevní mikrobiotou
- Prokinetika a jejich využití v gastroenterologii
- Screening kolorektálního karcinomu
- Terapeutická digestivní endoskopie I
- Terapeutická digestivní endoskopie II
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prokinetika a jejich využití v gastroenterologii
- Divertikulární choroba: diagnostika a léčba
- Diagnostika poruch motility gastrointestinálního traktu
- Současné trendy v diagnostice a léčbě refluxní nemoci jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

