Prokinetika a jejich využití v gastroenterologii
:
Jiří Dolina 1; Aleš Hep 1; Lumír Kunovský 1,2; Štefan Konečný 1
:
Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice
1; Chirurgická klinika LF MU a FN Brno, pracoviště Bohunice
2
:
Vnitř Lék 2018; 64(6): 673-678
:
Reviews
Poruchy motility trávicího traktu se promítají do klinické medicíny nejen prostřednictvím funkčních poruch, ale rovněž i jako primární organické jednotky nebo v podobě sekundárních projevů jiných nemocí a fyzikálně-chemických vlivů. Sofistikované diagnostické metody posledních let a bazální výzkum na poli motility trávicího traktu zaznamenávají významný rozvoj. Kauzální léčba poruch motility prokinetiky je však stále v pozadí. Řada nových účinných preparátů byla stažena z trhu pro svoje výrazné nežádoucí účinky, u dalších je jejich působení omezeno jednotlivým oddílem trávicího traktu (GIT), např. pouze na žaludek nebo střevo. V článku je uveden přehled indikací prokinetik s účinkem u vybraných patologických stavů. Kromě izolovaného podávání prokinetik se mohou uplatnit rovněž v kombinacích s dalšími léky, např. v rámci léčby refluxní choroby jícnu s inhibitory protonové pumpy. V současné době neexistuje prokinetikum tzv. zlatého standardu, které by globálně terapeuticky a při tom kauzálně zasáhlo tak složitý patofyziologický řetězec dysmotility GIT. Stále jsou hledána nová farmaka s příznivým efektem na poruchy propulzní aktivity, která by při zachování prokinetického efektu po celé délce GIT zároveň nevykazovala vedlejší nebo nežádoucí účinky. Přístup k nemocným je i v tomto případě nutný individualizovat dle prokázaného typu poruchy motility.
Klíčová slova:
dysmotilita trávicího traktu – gastroparéza – obstipace – refluxní nemoc jícnu – syndrom střevní pseudoobstrukce
Úvod
Orgánové systémy v lidském těle zabezpečují regulaci některých fyzikálních parametrů s cílem udržet normální buněčnou homeostázu. Trávicí trakt štěpí a vstřebává všechny přijaté živiny a z větší části trávení dokončí i bez ohledu na potřeby jedince. Na optimalizaci chemických podmínek pro enzymatické i neenzymatické trávení se podílí velké množství regulačních mechanizmů. Základním aspektem tohoto složitého procesu je koordinovaný pohyb bolusu potravy trávicí trubicí, který je ovlivněn řadou negativních zpětnovazebných mechanizmů.
Ačkoliv je motilita gastrointestinálního traktu (GIT) a její poruchy studovány více než století, nadále je její vyšetření a ovlivnění pro klinickou praxi velmi obtížné. Jelikož je motorická aktivita trávicího traktu velmi dobře skryta a mnohdy samotnou poruchu překrývají velmi pleomorfní symptomy, jsou i naše režimová a farmakologická doporučení pacientům zatížena značnou měrou empirie a ars medici. Na stranu druhou je nutné konstatovat, že využití modernějších metod vyšetření – manometrie, scintigrafie apod může svým pozitivním nálezem mylně odvést lékaře od stanovení správné diagnózy a pouhé soustředění se na izolovaný patologický nález a argumentací tímto nálezem pacientovi odvést od primární etiologie nemoci.
Existuje řada dělení dysmotilit, klasifikačních schémat a evidence-based doporučení týkajících se dysmotlity GIT. Obecně je racionální tyto poruchy dělit anatomicky-systémově na poruchy motility jícnu, žaludku, biliární, tenkostřevní, tlustostřevní a anorektální. Orientačně lze dále poruchy motility dělit dle dosahovaných tranzitů stravy na poruchy se zpomalenou evakuací, zrychlenou evakuací a střídavý typ. Dále na dysmotility s etiologií primárně v GIT – organické, sekundární (u onemocnění mimo GIT – např. vegetativní dysautonomii, diabetes mellitus, tyreopatie, polékové, psychiatrické nebo psychomotorické apod). Stále více se prosazuje koncept neurogastroenterologický se svým vnímáním unicity enterálního nervového systému GIT, ovlivňovaného do určité míry kortexem a dále autonomním nervovým systémem. Jedná se o koncept velmi se progresivně vyvíjející a závislý na moderních vyšetřovacích metodách MRI, navíc z našeho gastroenterologického pohledu většinou spadající do sekundární etiologie [1]. Další komentář k této oblasti je však zcela mimo rámec sdělení. Následující přehled se bude věnovat farmakologickému ovlivnění motility trávicího traktu.
Přehled prokinetik
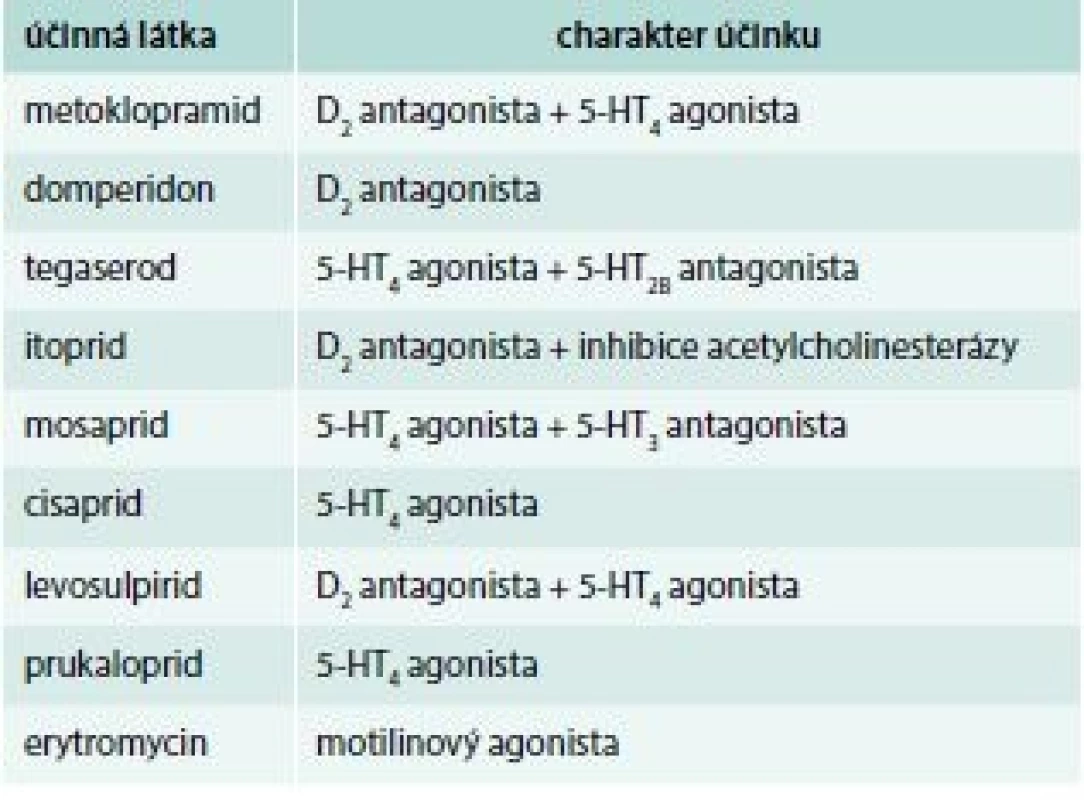
Jako prokinetika jsou označovány léky a léčivé přípravky modulující motilitu GIT většinou s efektem akcelerujícím trávicí pohyby – peristaltiku. Dosažení decelerace pohybů trávicího traktu je stále vnímáno pouze okrajově, i když de facto urychlená evakuace žaludku s překotným a nekoordinovaným vyprázdněním žlučníku vede k průjmům ať cholagenním nebo sekrečním. Prokinetika, tedy léky stimulující motilitu trávicího traktu, jsou uvedena v tab. 1.
V současnosti v ČR nejužívanějšími prokineticky působícími léky jsou metoklopramid a itoprid, dále uvádíme přehled prokinetik, jejichž podávání bylo zastaveno nebo jsou dostupná pouze v rámci mimořádného dovozu do ČR.
Metoklopramid
Metoklopramid je prokainamidový derivát s prokinetickým a antiemetickým účinkem ze skupiny blokátorů centrálních i periferních dopaminových receptorů (blokace D2 a mírný 5-HT4 agonista a 5-HT3 antagonista). Účinek na žaludek je dán zvýšením tonu žaludku, amplitud žaludečních kontrakcí, relaxací pyloru a stimulací antrální peristaltiky.
Nežádoucí účinky jsou spojeny s přechodem přes hematoencefalickou bariéru a u 20–40 % pacientů při dlouhodobém podávání se vyskytuje extrapyramidový syndrom a hyperprolaktinemie. Potenciace vedlejších účinků je možná alkoholem a neuroleptiky. Dávkování je individuální, výhodou tohoto preparátu je fakt, že jako jediný je aplikován injekčně. Optimálně se podává parenterální cestou 4krát 10 mg, při perorálním podání 3–4krát 10 mg asi 15 min před jídly. Doporučená délka podání však nemá přesahovat 5 dnů, nutno však pamatovat na rychlý rozvoj tolerance při dlouhodobém užívání, který se popisuje již po 2 týdnech medikace [2].
Domperidon
Domperidon je antagonista dopaminergních receptorů. Tento preparát má stejný mechanizmus účinku jako metoklopramid, ale výhodou je nižší přechod přes hematoencefalickou barieru. Méně frekventní jsou nežádoucí účinky, ale i jeho antiemetický potenciál. Nežádoucí účinky jsou popisovány u 2–7 % léčených pacientů. Pro riziko náhlé smrti zřejmě cestou prodloužení QT intervalu je stahován z trhu v EU. Doporučené dávkování je 10 mg před každým jídlem, s možností podávání až 3krát 20 mg denně [2].
Sulpirid – levosulpirid
Sulpirid – levosulpirid je atypické neuroleptikum, léčivo s bifázickým účinkem presynaptické blokády D2 a D3 dopaminergních receptorů, ve vyšších dávkách blokace D2 postsynaptických receptorů. Tím jsou objasněny účinky u schizofrenie, deprese a rovněž tak periferní účinky v GIT. Efekt levosulpiridu je obdobný jako u metoklopramidu a domperidonu, a to urychlení evakuace žaludku, některé studie udávaly dokonce zvýšení tonu dolního jícnového svěrače. Jeho indikace jsou však spíše spjaty s onemocněními funkčního charakteru, např. funkční dyspepsií apod než v „klasických“ indikačních skupinách prokinetik. Nežádoucí účinky medikace jsou rovněž obdobné. Bolesti hlavy, extrapyramidové příznaky, hyperprolaktinemie a galaktorea [3].
Itoprid
Jedná se o prokientikum s duálním efektem (blokace D2 receptorů a acetylcholinesterázy), bez metabolického vztahu a interakci s látkami metabolizovanými cytochromem p450, rovněž nebyl prokázán vliv na převodní systém srdeční. V dalších studiích nebyly prokázány významné nežádoucí účinky při dlouhodobém podávání preparátu, není však vhodný v těhotenství a během laktace. Ve svých účincích by měl zvyšovat peristaltiku jícnu, stimulací žaludeční a střevní motility zrychlit evakuaci žaludku a dalších částí GIT. Ve studiích byl jeho největší promotilitní účinek lokalizován do žaludečního antra. V současné době je v ČR nejužívanějším prokinetikem, avšak jeho efekt u řady nemocí je malý. Podávání itopridu je nejčastější v těchto indikacích:
- funkční dyspepsie, zvláště typ tzv. chabého žaludku dle Mařatky nebo tzv. dysmotilitě podobný typ dle Rome IV
- léčba gastroparézy diabetické nebo idiopatické
- poresekční stavy žaludku
- doplňková léčba refluxní choroby jícnu, zvláště u vyšetřené a prokázané poruchy evakuace žaludku [4,5]
Tegaserod
Tegaserod je parciální agonista 5-HT4 a 5-HT2B antagonista receptorů enterického nervového systému střeva, stimuluje gastrointestinální motilitu. FDA byl stažen v roce 2007 pro možné nežádoucí kardiovaskulární účinky a byl ponechán pouze na zcela výjimečné a opodstatněné použití (restricted distribution program) u IBS-C (subtyp dráždivého tračníku s převažující symptomatologií obstipace) [2–4].
Erytromycin
Jedná se sice o dobře známé antibiotikum, ale rovněž je známý jeho prokinetický efekt, jakožto agonisty motilinových receptorů, avšak nejedná se o pouze jeden účinek. Nadále je studován efekt erytromycinu, který nelze vysvětlit pouze agonistickým účinkem motilinových receptorů. Předpokládá se efekt na neuromuskulární transmisi a buněčnou elektrickou aktivitu s jistými známkami rozpojení elektrické kontrolní aktivity v proximálních částech tenkého střeva (možný efekt na cholinergní neurony). Efekt na žaludek je dán zvýšením frekvence a amplitud kontrakcí, vedoucí k urychlení evakuace žaludku, dále vykazuje prokinetický efekt na střevní peristaltiku. Z obávaných nežádoucích účinků jsou zásadní účinky kardiogenní a to ovlivnění QT intervalu s provokací ventrikulární tachykardie typu torsade de pointes. Užití erytromycinu cestou i.v. podání (dávka 3 mg/kg pomalou 30minutovou infuzí à 8 hod denně) na výjimečný dovoz je vhodné u monitorovaných pacientů – postoperační stavy gastroplegické – gastroparetické, zvláště u předpokládané druhotně vyvolané gastroparézy diabetické a např. u Ogilvieho syndromu. S dlouhodobým per os podáním erytromycinu nejsou rozsáhlé zkušenosti, spíše na úrovni kazuistik a jeho použití je nutné zvážit individuálně a nejlépe po kardiologickém vyšetření. Dostupný je v ČR na mimořádný dovoz v parenterální i tabletové formě [6].
Prukaloprid
Prukaloprid je selektivní agonista serotoninových 5-HT4 receptorů s vysokou afinitou, ve studiích bez významného ovlivnění QT intervalu oproti placebu a bezpečnější než tegaserod. Indikací je symptomatická chronická zácpa dospělých, u nichž laxativa neposkytují adekvátní úlevu. Dávkovat lze 2 mg denně, zvyšování denní dávky nezvyšuje účinnost preparátu, v případě nedostatečného účinku po 4 týdnech léčby by se měl přehodnotit přínos pro pokračování terapie. Preparát je v ČR k dispozici pouze na mimořádný dovoz [3,4].
Trimebutin
Trimebutin je parciální agonista opioidních receptorů μ a κ a antagonistou receptorů δ, což způsobuje uvolnění gastrointestinálních peptidů – motilinu, dále ovlivnění VIP, gastrinu a glukagonu. Ve studiích urychloval žaludeční vyprazdňování a moduloval střevní peristaltiku. Hlavní indikací preparátu je však dráždivý tračník. Dávkování je 100–200 mg 3krát denně. V současnosti není registrován v ČR, dostupný pouze na mimořádný dovoz [3].
Cisaprid
Podávání cisapridu u pacientů s refluxní nemocí jícnu bylo po uvedení inhibitorů protonové pumpy pouze aditivní. Ve všech studiích, které byly provedeny, byl vždy dominantním účinkem efekt na evakuaci žaludku a nikoliv na základní patogenetický mechanizmus refluxu – přechodné relaxace dolního jícnového svěrače (transient lower esophageal sphincter relaxation – TLESR). I tento efekt však, ve srovnání s H2 blokátory a placebem, znamenal vyšší procento vyléčených pacientů.
Významnou indikační skupinou pro cisaprid byli pacienti s gastroparézou a funkční dyspepsií – zvláště tzv. dysmotilitě podobný subtyp dyspepsie. U těchto pacientů cisaprid upravoval poločasy porušené evakuace žaludku, rovněž byl monitorován příznivý vliv na úpravu elektrické aktivity v nárůstu procenta slow waves žaludečního pacemakeru.
Třetí velkou skupinou pacientů, u kterých byl cisaprid podáván, byli pacienti v pooperační době – pro prevenci střevní atonie a dále pacienti s obstipací – typ tzv. zpomaleného tranzitu (slow-transit obstipace). U pacientů s dráždivým tračníkem byl cisaprid podáván s efektem sporným a mnohdy jen přechodným. Zvláště účinný byl u skupiny obstipační nebo smíšené. Od roku 2000 je stažen z trhu a nedostupný pro nežádoucí kardiogenní účinky – ovlivnění QT intervalu [2,7].
Nové farmakologické možnosti
Ghrelinoví agonisté
Jedná se především o studovanou molekulu TZP101. Je známo, že ghrelin je ligand pro GHS-R (growth hormone secretagogue receptor) a je lokálně produkován mukózou trávicího traktu, dále byl zjištěn v plicích, ledvinách, placentě, testes, hypotalamu a podvěsku mozkovém. Zajímavý je přesah ghrelinu do oblasti obezitologie, endokrinologie a neurologie. Ghrelin a motilin se svými receptory jsou strukturálně obdobné. Ve studii Ejskjaera et al v roce 2009 byl agonista ghrelinového receptoru TZP101 shledán účinným u skupiny pacientů se střední až těžkou gastroparézou při diabetes mellitus a prokázal zlepšení žaludeční evakuace. Spornou otázkou studie zůstává fakt, že nebyl shledán rozdíl v symptomatologii oproti skupině s placebem, což potvrdila i další studie Lamba a Camilleriho v roce 2014. Dále je popisováno, že jeho aplikace vedla k zvyšování GH (růstový hormon – growth hormone), avšak prozatím nejsou dostatečné známky klinické konsekvence tohoto zpětněvazebního efektu. Limitujícím faktorem je i aplikační cesta – subkutánní 2krát denně.
V další studii Acosta et al prokazovali efekt relamorelinu – agonisty ghrelinu – na scintigraficky měřený transit GIT u pacientů s chronickou obstipací. V očekávání jsou další studie a jistě bude třeba daleko větších souborů pacientů včetně hodnocení efektu dlouhodobého podávání [8,9].
Použití prokinetik dle jednotlivých onemocnění
Nejčastěji se s prokineticky účinnými léčivy setkáme v následujících klinických jednotkách a onemocnění: u refluxní nemoci jícnu, zpomalené evakuace žaludku, biliární dyskinezy včetně zpomalené evakuace žlučníku, skupiny funkčních nemocí (funkční dyspepsie, dráždivý tračník), obstipace, syndrom střevní pseudoobstrukce – akutní a chronické.
Refluxní nemoc jícnu
Je zřejmé, že i tak chronicky známá jednotka, jako je refluxní choroba jícnu, je extrémně heterogenní skupinou onemocnění, jež mají společný základ pouze ve faktu, že se trávicí šťáva ze žaludku dostává v nesprávný okamžik na nesprávné místo (do jícnu). Komplexnost problému je ještě více patrna u heterogenní symptomatologie onemocnění a je zjevná potřeba individualizovaného přístupu k terapii. Orientačně lze rozdělit pacienty s refluxními potížemi na 4 skupiny – pacienti s pocitem bolesti (pálení žáhy, bolesti za sternem), pacienti s pocity regurgitace tekutin nebo solidní stravy, pacienti s převahou symptomatologie extraezofageální – ORL oblasti a pacienti s atypickou symptomatologií ruminace, říhání apod. Toto rozdělení pacientů se odráží i v odlišné léčebné strategii a samozřejmě v účinnosti a efektivitě léčby. Právě nerespektování této fenotypické odlišnosti GERD může vést, při použití jednotného schématu léčby, k vysokým počtům pacientů se selháním léčby.
O podílu HCl na rozvoj klinické symptomatologie refluxní choroby není třeba široké diskuse. Nutno však připomenout, že léčba zaměřená pouze na supresi produkce HCl je stále symptomatická, byť účinná a efektivní, avšak nikoliv kauzální. Logickou příčinnou léčbou by byla konzervativní léčba zaměřená na redukci přechodných relaxací dolního jícnového svěrače (TLESR) a posílení peristaltické aktivity jícnu. V minulosti používaný cisaprid a mosaprid byly účinné v řadě aspektů, avšak nikdy se jejich účinnost nepřiblížila efektivitě kombinace s inhibitory protonové pumpy (proton pump inhibitors – PPI). Cisaprid vykazoval podobný účinek ve srovnání s H2 blokátory při léčbě lehkých forem refluxní ezofagitidy, hodnocení dlouhodobé léčby však bylo v roce 2000 přerušeno jeho stažením z trhu pro ovlivnění QT intervalu. Léky více méně experimentálního použití – jako sildenafil a baklofen – v současné praxi nelze uplatnit pro další vedlejší nežádoucí účinky. Užití metoklopramidu je indikováno pouze v režimu on-demand, není doporučováno pro nežádoucí účinky k dlouhodobé léčbě. V dřívějších studiích zmiňovaná porucha evakuace žaludku u pacientů s refluxní nemocí jícnu je při současných metodách vyšetření potvrzována méně často, než se myslelo, a tudíž i ordinace dostupných prokinetik pro dlouhodobé užívání (itoprid) je spíše kosmetickým doplňkem základní léčby inhibitory protonové pumpy i přes fakt, že reflux takto léčených pacientů přetrvává, jen pouze má jinou pH charakteristiku (posun od pH pod 4 na refluxy tzv. slabě kyselé s pH mezi 4–7). Tuto skutečnost doplňují zjištění o efektivitě, respektive inefektivitě léčby PPI u skupiny pacientů s extraezofagálním refluxem, ústup symptomatologie je po nasazení PPI pouze do 30 %, jelikož léčba není kauzální [7,10,11].
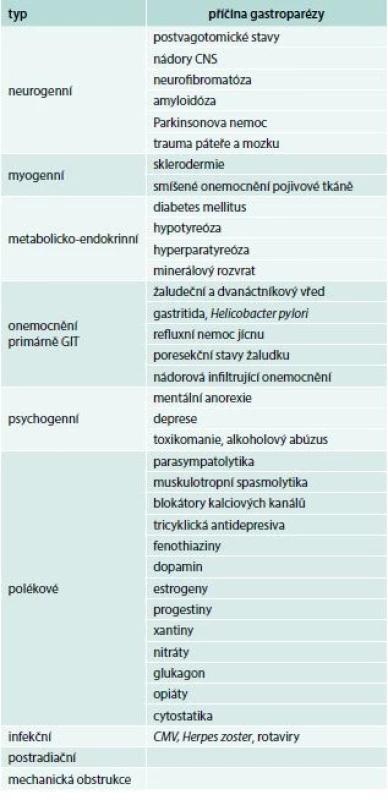
Zpomalená evakuace žaludku – gastroparéza
Gastroparéza je motorická dysfunkce žaludku a duodena s typickou postprandiální symptomatologií časné sytosti, nauzey, zvracení a vzedmutí břicha, kterou lze dělit na idiopatickou a sekundární. Příčiny sekundární gastroparézy jsou uvedeny v tab. 2.
Léčba zpomalené žaludeční evakuace – gastroparézy
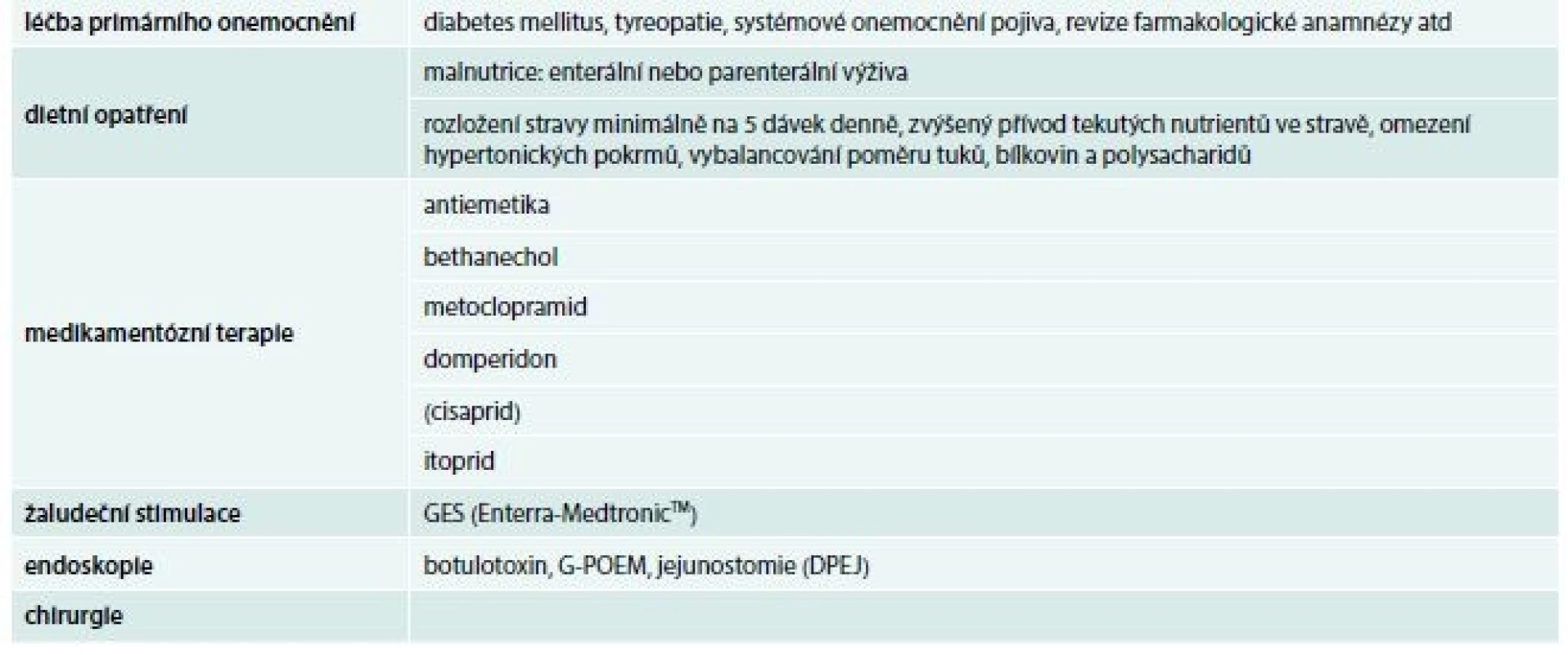
Možnosti léčby poruch evakuace žaludku zobrazuje tab. 3. Mezi konzervativní medikamentózní postupy léčby poruch žaludečního vyprazdňování řadíme dietní a režimová patření, z prokinetik nejdostupnější metoklopramid, ale pro nevhodnost dlouhodobého podávání je spíše volbou itoprid v minimální dávce 3krát 1 tbl p.o. Z dalších možností je na mimořádný dovoz erytromycin (i.v. podání 3 mg/kg à 8 hod pomalou 30minutovou infuzí, s možností pokračovací léčby p.o.), Nově studované preparáty, např. agonisté 5-HT1 receptorů, donory NO molekul apod, v současnosti nenacházejí klinické uplatnění a na výsledky studií se stále čeká. Moderní endoskopické přístupy – aplikace botulotoxinu intrapyloricky, perorální endoskopická pyloromyotomie žaludku (Gastric Peroral Endoscopic pyloroMyotomy – G-POEM) jsou velmi progresivní přístupy a v blízké budoucnosti jsou očekávány výsledky hodnocení dlouhodobého efektu miniinvazivních přístupů oproti klasickým chirurgickým – laparoskopickým. V současnosti endoskopické zavedení jejunostomie tzv. DPEJ (Direct Percutaneous Endoscopic Jejunostomy) má určité technické limitace s úspěšností provedení kolísající od 68 % do 92 %. Gastrická elektrická stimulace (Gastric electrical stimulation, Enterra-MedtronicTM – GES) je rovněž perspektivní terapeutický přístup vyžadující již ale chirurgickou intervenci a pro vyšší nákladovost je i jeho větší použití dosti výrazně limitováno [2,12].
Obstipace a prokinetika
Obstipace je ubikvitární zdravotní problém postihující všechny věkové skupiny. Její etiologie je značně heterogenní, diagnostika nesnadná i vzhledem k faktu velké rozšířenosti v populaci s mnohdy podceňovaným přístupem k řešení. Pro základní orientaci v problematice obstipace je racionální dělení na obstipaci se zpomaleným tranzitem, obstipaci spojenou nebo i vyvolanou syndromem obstruktivní defekace a subtyp funkční – tedy dráždivý tračník – spastický nebo obstipační typ. Ke každé variantě obstipace je třeba přistupovat individuálně, a to jak z pohledu diagnostiky, tak z pohledu terapie. Kromě klasického přístupu ke změnám dietních a režimových opatření, vyloučení medikace vedoucí k obstipaci, vyloučení metabolicko-endokrinních příčin a dalších, je přístup k obstipaci typu syndromu obstruktivní defekace převážně cestou dlouhodobé rehabilitace a biofeedbacku, zatímco pacienti s obstipací se zpomaleným tranzitem tlustým střevem profitují z nasazení prokinetik nebo laxativ.
Z dostupných laxativ se doporučují objemová laxativa. Osmotická laxativa jsou rovněž vyhledávanou alternativou, avšak kvalitní studie efektu dlouhodobé léčby chybí. Preparáty lubiproston (v terapii zácpy navozené opiáty u chronické nenádorové obstipace) a linaklotid uváděný v doporučeních jako 2. nebo 3. volba léčby zácpy vlivem agonizmu luminálního receptoru s guanylátcyklázou, což vyvolává zvýšenou propustnost pro chloridové ionty a bikarbonát, a tímto efektem se zvýší podíl vody ve stolici a její četnost, nejsou v ČR dostupné. Mezi klasicky působící prokinetika u obstipace je třeba jmenovat cholinomimetikum neostigmin, který je pro vysoké procento nežádoucích účinků efektu stimulace muskarinových receptorů – salivace, pocení, tremor, cefalea – zcela nevhodný při chronickém podávání. Tegaserod – parciální agonista 5-HT4 receptorů, byl vzhledem ke kardiovaskulárním komplikacím stažen z trhu, dále prukaloprid – selektivní agonista 5-HT4 receptorů, účinný v léčbě chronické zácpy, upravující střevní tranzit, je v ČR dostupný pouze na mimořádný dovoz, metoklopramid – s jedinou výhodou – dostupnost v parenterální formě, i když účinnost na střevní tranzit je diskutabilní a pro nežádoucí účinky při dlouhodobém podávání nevhodný. Itoprid – minimálně účinný na střevní peristaltiku, erytromycin – rovněž dostupný v parenterální a perorální podobě, je v ČR pouze na mimořádný dovoz a spojen s možností ovlivnění QT intervalu [4,13].
Akutní syndrom střevní pseudoobstrukce – Ogilvieho syndrom
Charakterizován je dilatací céka a pravého kolon bez prokázané mechanické obstrukce s vysokým rizikem spontánní perforace (3–15 %) a mortalitou okolo 50 %. Léčba je možná např. aplikací neostigminu za pečlivé monitorace kardiorespiračního stavu, při projevech toxicity je lékem volby atropin. Je méně studií dokazujících možný efekt léčbou erytromycinem, metoklopramidem a cisapridem, který byl stažen z trhu.
Chronický syndrom střevní pseudoobstrukce
Je popisován jako dilatace tenkých kliček a tlustého střeva, bez zjevné mechanické příčiny. Může se jednat o stav sekundární nebo idiopatický, s histopatologicky zjevnou nižší denzitou Cajalových buněk intersticia sloužících jakožto pacemaker.
V léčbě byl uváděn opět cisaprid (stažen z trhu), erytromycin 3 mg /kg à 8 hod, s možným využitím parenterální cesty podání při akutní exacerbaci. Metoklopramid – nevhodný pro dlouhodobé podávání, pro akutní přechodný stav možno podat s variabilním efektem léčby. Oktreotid v dávce 50 μg s.c. na noc byl popsán jako účinný u pacientů se sklerodermií. U neostigminu chybí data u chronického onemocnění, je známo podání pouze u akutní exacerbace. Ve sledování efektu léčby je tegaserod a proukaloprid.
Závěr
Léková skupina prokinetik je dlouhodobě známá a diskutovaná součást léčby dysmotility trávicího traktu. K pacientovi je vždy nutno přistupovat individuálně a při tom velmi komplexně řešit, pokud možno, jeho širokou etiopatogenezi problému. Značným oslabením této skupiny byl zákaz dalšího podávání cisapridu. Současně dostupná prokinetika mají většinou pouze aditivní efekt k další léčbě. Řada dostupných preparátů jsou v ČR dostupná pouze na mimořádný dovoz a administrativní proces lékaře v praxi významně odrazuje od jejich používání. Slibnou a stále ještě nedostupnou skupinou jsou léky s účinkem na motilinové receptory nebo ghrelinoví agonisté. Vývoj preparátů a klinická hodnocení jsou dosti náročná na hodnocení a interpretace výsledků nebývají jednoznačné. Dokladem složitosti dané problematiky je konstatování: „je obtížné definovat lékařsky poruchu v nepřítomnosti biologických zlatých standardů.“
MUDr. Lumír Kunovský, Ph.D.
Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice
Doručeno do redakce: 21. 12. 2017
Přijato po recenzi: 18. 4. 2018
Sources
- Wingate D, Hongo M, Kellow J et al. Disorders of GIT motility: Towards a new classification. J Gastroenterol Hepatol 2002; 17(Suppl): S1-S14.
- Sanjeevi A. Gastric motility. Curr Opin Gastroen 2007; 23(6): 625–630. Dostupné z DOI: <http://dx.doi.org/10.1097/MOG.0b013e3282f0957c>.
- Juřica J, Kroupa R. Farmakoterapie dráždivého tračníku. Prakt lékáren 2017; 13(2): 52–59.
- Lacy BE, Mearin F, Chang L et al. Bowel Disorders. Gastroenterology 2016; 150: 1393–1407.
- Mařatka Z et al. Gastroenterologie. Karolinum: Praha 1999. ISBN 80–7184–561–2.
- Catnach SM, Faurclough PD. Erytromycin and the gut. Gut 1992; 33(3): 397–401.
- Pehlivanov N, Sarosiek I, Whitman R et al. Effect of cisapride on nocturnal transient lower oesophageal sphincter relaxations and nocturnal gastro-oesophageal reflux in patients with oesophagitis: a double-blind, placebo- controlled study. Aliment Pharmacol Ther 2002; 16(4): 743–747.
- Elskjaer N, Vestergaard ET, Hellstrom PM et al. Ghrelin receptor agonist (TZP -101) accelerates gastric emptying in adults with diabetes and symptomatic gastroparesis. Aliment Pharmacol Ther 2009; 29(11): 1179–1187. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2009.03986.x>.
- Lembo A, Camilleri M, McCallum RW et al. A phase 2, randomised, double blind, placebo-controlled study to evaluate the safety and efficacy of RM-131 in patients with diabetic gastroparesis. Gastroenterology 2014; 146(5 Suppl 1): S158-S159. Dostupné z DOI: <https://doi.org/10.1016/S0016–5085(14)60565–5>.
- Vaezi MF, Pandolfino JE, Vela MF et al. White Paper AGA: Optimal Strategies to Define and Diagnose Gastroesophageal Reflux Disease. Clin Gastro Hepatol 2017; 15(8): 1162–1172. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2017.03.021>.
- Kahrilas PJ, Shaheen NJ, Vaezi MF. American Gastroenterological Association Medical Position Statement on the Management of Gastresophageal Reflux Disease. Gastroenterology 2008; 135(4): 1383–1391, 1391.e1–5. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2008.08.045>.
- Pasricha PJ, Camilleri M, Hasler WL et al. White paper AGA: Gastroparesis: Clinical and Regulatory Insights for Clinical Trials. Clin Gastroenterol Hepatol 2017; 15(8): 1184–1190. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2017.04.011>.
- Weinberg DS, Smalley W, Heidelbaugh JJ et al. American Gastroenterological Association Institute Guideline on the pharmacological management of irritable bowel syndrome. Gastroenterology 2014: 147(5): 1146–1148. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2014.09.001>. Erratum in Gastroenterology 2015; 148(2): 455.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 6
Most read in this issue
- Prokinetics and their use in gastroenterology
- Diverticular disease: diagnosis and treatment
- Diagnosis of gastrointestinal motility disorders
- Current trends in the diagnosis and treatment of gastroesophageal reflux disease