-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteomalacie
Osteomalacia
Osteomalacia with characteristic histomorphometric, radiographic, laboratory and clinical features is a prominent syndrome of disturbed bone mineralisation in adulthood.
From an etiological point of view, osteomalacia is usually caused by substrate (calcium, phosphate) deficiency, presence of excess mineralization inhibitors or deficiency or ineffectivness of mineralization facilitator (vitamin D).
In proportion to the high number of congenital and acquired causes of osteomalacia, its clinical and laboratory picture is heterogeneous and rarely fully expressed.
The treatment of a particular case is determined by the cause of osteomalacia and may (but does not necessarily) include correction of the underlying disease, administration of calcium and various forms of vitamin D, as well as orthopaedic interventions. For some of the hereditary forms, biological or replacement therapy is prospectively available.
The article attempts to cover the whole range of osteomalacia variants, mentioning a fact discussed only in recent years – the occurrence of oligosymptomatic, incompletely expressed forms.
Keywords:
osteomalacia – bone matrix – bone mineral – mineralization – osteoid
Autoři: Jan Rosa
Působiště autorů: Osteocentrum Affidea Praha, Lékařská fakulta Univerzity Karlovy v Hradci Králové
Vyšlo v časopise: Vnitř Lék 2023; 69(4): 254-260
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2023.048Souhrn
Osteomalacie s charakteristickými histomorfometrickými, rentgenovými, laboratorními a klinickými rysy je vyjádřeným syndromem narušené mineralizace kostní hmoty v dospělém věku.
Z etiologického hlediska příčinou osteomalacie bývá nedostatek substrátu (kalcium, fosfáty), nadměrné uplatnění inhibitorů mineralizace nebo deficit či nemožnost uplatnění facilitátoru mineralizace (vitamin D).
Úměrně vysokému počtu vrozených i získaných příčin osteomalacie je heterogenní i její klinický a laboratorní obraz, který spíše výjimečně bývá plně vyjádřen.
Léčba konkrétního případu je určena příčinou osteomalacie a může (ale nutně nemusí) zahrnovat korekci základního onemocnění, aplikaci vápníku a různých forem vitaminu D, ale také ortopedické zákroky. Pro některé z hereditárních forem je výhledově k dispozici biologická či substituční léčba.
Článek se pokouší pokrýt celou šíři variant osteomalacie, přičemž zmiňuje skutečnost diskutovanou až v posledních letech – totiž výskyt oligosymptomatických, neúplně vyjádřených forem.
Klíčová slova:
kostní matrix – kostní minerál – mineralizace – osteoid – osteomalacie
Fyziologie a složení kosti
Kost v živočišném organismu plní několik funkcí. Zajišťuje lokomoci (skelet končetin), ochranu důležitých orgánů (kostra hrudníku, páteře a lebky), prostředí pro krvetvornou tkáň (v dospělosti především těla obratlů). Je rezervoárem vápníku a fosforu a, jak se v posledních letech ukazuje, plní i funkci orgánu s parakrinní i typicky endokrinní funkcí (1).
Kostní tkáň sestává ze složky bílkovinné (osteoid, kostní matrix), tvořené převážně kolagenem typu I a dalšími tzv. nekolagenními proteiny. Kostní hmota je v procesu kostní novotvorby produkována osteoblasty jako trojšroubovice kolagenu, který plní strukturální funkci. Do osteoidu se velmi rychle (5–10 dní po jeho depozici) začíná ukládat kostní minerál. Jde o kalciumfosfátové soli, v čisté podobě krystaly hydroxyapatitu Ca10(PO4)6(OH)2. Za fyziologických okolností trvá rychlá fáze, během níž se osteoid nasytí minerálem z 50 % své kapacity (primární mineralizace), zhruba 3 měsíce. Na fázi primární mineralizace navazuje pomalejší fáze mineralizace sekundární, jež může trvat až léta a hypoteticky vést až ke 100 % nasycení osteoidu kalciumfosfátem. Ve skutečnosti k dosažení maxima obsahu kostního minerálu nedochází, protože kost je průběžně remodelována. Proces kostní remodelace se odehrává v hranicích mikroskopických kostních mnohobuněčných (remodelačních) jednotek (Bone Multicellular Unit – BMU, Bone Remodelling Unit – BRU). Je zahajován kostní resorpcí, kdy úseky starší kostní tkáně jsou degradovány osteoklasty a nahrazovány osteoblasty vytvořeným osteoidem, jenž je následně mineralizován. U zdravého dospělého jsou ročně aktivovány 3–4 miliony BMU, z čehož zhruba 1 milion BMU je právě aktivní. Kostní tkáň je mozaikou různě „zralé“ kostní hmoty s různým stupněm mineralizace kostní matrix. Fyziologická heterogenita mineralizace kosti, tj. různý stupeň kostní mineralizace (Degree of Mineralization of Bone tissue, DMB), je důležitou složkou odolnosti kosti vůči vnějšímu násilí (2). Kontinuální proces kostní remodelace zajišťuje náhradu staré, vysoce mineralizované kostní tkáně s akumulovaným mikropoškozením, novou, biomechanicky kompetentní tkání. Vedle toho se proces kostní remodelace podílí na udržování homeostázy vápníku a fosforu a adaptaci mikro - i makrostruktury kosti na změněné biomechanické poměry.
Kostní mineralizace
Zatímco v jiných pojivových tkáních je depozice krystalů kalciumfosfátu patologickým jevem (dystrofické a jiné kalcifikace měkkých tkání, kalcifikace cévní stěny), v kostní tkáni jde o proces zcela fyziologický a nezbytný pro její normální funkci. Vedle vláken kolagenu typu I schopných vázat krystalickou strukturu hydroxyapatitu tento proces vyžaduje vysokou lokální koncentraci kalcia a fosfátů a nízkou koncentraci inhibitorů mineralizace. Z nekolagenních proteinů kostní matrix se na podpoře mineralizace podílí kostní sialoprotein, osteokalcin a osteopontin. Mineralizace kosti je možná pouze za přítomnosti dostatečných koncentrací substrátů – vápníku a fosforu – a dále D‑hormonu (synonymicky dihydroxyvitaminu D, kalcitriolu, 1,25/OH/2 kalciferolu). Nezbytným předpokladem mineralizace kosti je nízká koncentrace přirozených inhibitorů mineralizace (jejichž přítomnost v jiných tkáních je naopak absolutně nezbytná a brání depozici nežádoucích kalcifikací). Klíčovou roli v procesu kostní mineralizace hraje enzym alkalická fosfatáza (ALP), resp. její kostní izoenzym (bALP), exprimovaná v povrchové membráně diferencovaných osteoblastů. Kostní ALP štěpí anorganický pyrofosfát (PPi), který je silným inhibitorem mineralizace, na anorganický fosfát (Pi), jenž je naopak pro normální průběh mineralizace nezbytný. Další proteiny podílející se na procesu kostní mineralizace zahrnují fosfatázu PHOSPHO1, ANK a další transmembránové transportéry v osteoblastech a endonukleotidovou pyrofosfatázu/fosfodiesterázu 1 (ENPP1) osteocytů (3).
Homeostáza vápníku a fosforu je regulována parathormonem (PTH), D‑hormonem a fibroblastovým růstovým faktorem 23 (FGF - 23). Pokles kalcemie stimuluje sekreci PTH. V renálních tubulech PTH zvyšuje reabsorpci vápníku a tlumí reabsorpci fosfátů. Stimulací renální 1α‑hydroxylázy PTH zvyšuje syntézu kalcitriolu, jenž stimuluje střevní absorpci vápníku. V kosti PTH stimuluje osteoklastogenezu, což vede ke zvýšené osteoresorpci, a tedy i uvolňování kalcia a fosfátů z kostního kompartmentu. Vzestup sérových fosfátů je podnětem pro zvýšenou produkci FGF-23 v osteocytech a osteoblastech. Hlavním cílovým orgánem FGF-23 jsou ledviny, v nichž působí fosfaturicky (potlačením tubulární reabsorpce fosfátů) a zvýšením syntézy kalcitriolu. Účinek kalcitriolu na kost není plně prozkoumán. Je však zásadní pro normální diferenciaci a funkci osteoblastů a nezbytný pro normální průběh mineralizace skeletu. Podporuje funkci osteoblastů a působí protektivně na kostní mikrostrukturu (4). Kalcitriolem stimulovaná tubulární reabsorpce vápníku je méně významná. Kalcitriol receptorovým mechanismem ovlivňuje buňky příštítných tělísek a přímo inhibuje transkripci genu pro PTH. Indukcí transportního proteinu pro vápník calbindinu v tenkém střevě zvyšuje kalcitriol střevní absorpci vápníku, jak je zmíněno výše. Uvedenými mechanismy kalcitriol zvyšuje hladinu kalcia v séru.
Porucha kteréhokoli z uvedených regulačních systémů nebo deficit uvedených živin mohou vést k narušení mineralizace kostní hmoty (5) s příslušným klinickým obrazem.
Definice osteomalacie
Termín osteomalacie, doslova tedy měkká kost či měknutí kostí, je tradičně používán pro kostní onemocnění s vyjádřenými typickými klinickými, laboratorními, radiologickými a histologickými rysy. Jeho histologickou podstatou je narušená mineralizace osteoidu. Za nepřítomnosti charakteristických radiografických změn by v ideálním případě diagnóza měla být stanovena histomorfometrickým vyšetřením kostního vzorku získaného biopsií z lopaty kosti kyčelní (ideálně po dvojitém značení tetracyklinem). Osteomalacie je histomorfometricky definována jako objem osteoidu vůči objemu kosti (OV/BV) > 5 %, tloušťka osteoidu ≥ 15 μm a zpoždění mineralizace > 100 dní (6, 7). V praxi je histomorfometrická diagnostika problematická. Kostní biopsie je bolestivá invazivní metoda a pracovišť schopných správného odběru, zpracování a odečtu vzorku je celosvětově nedostatek. Navržená neinvazivní diagnostická kritéria, založená na kombinaci klinických (difuzní bolesti kostí a svalová slabost), zobrazovacích (snížená BMD, Looserovy zóny nebo difuzní zvýšená akumulace radiofarmaka při vyšetření kostní scintigrafií) a biochemických známek (8), nebyla dosud rigorózně validována.
Řada analýz i zkušenost z klinické praxe ukazují, že mezi zcela normální mineralizací kostní hmoty a vyjádřenou osteomalacií s radiologickými známkami, případně prokázanou histomorfometricky, existuje plynulý přechod charakterizovaný nespecifickou klinickou symptomatologií, hraničními laboratorními odchylkami a sníženým množstvím kostní hmoty, případně zlomeninami (9, 10). Dichotomické třídění na osteomalatickou a normálně mineralizovanou kost je zkreslující. Toho by si klinici měli být vědomi; tím spíše, že v praxi se u dospělých setkáváme daleko častěji s nekompletně vyjádřenými klinickými i laboratorními obrazy.
Epidemiologie
Protože rostoucí skelet je na nedostatek vápníku a vitaminu D citlivější než skelet dospělých, porucha mineralizace se manifestuje častěji před uzavřením růstových plotének jako rachitis (křivice). Tu poprvé zmínil Daniel Whistler v roce 1645 (11). Klasický popis onemocnění poskytl Francis Glisson pět let poté (12). Anglie 2. poloviny 17. století totiž zaznamenává první vlnu výskytu poruch mineralizace, která se kryje s první fází urbanizace a masivního využití černého uhlí (13). Další nárůst výskytu podmíněný deficitem vápníku a vitaminu D u chudých dětí v industriálních centrech se datuje do počátku 20. století. Příčiny zahrnovaly nedostatečnou expozici UV záření (městské prostředí, smog, celodenní pobyt v uzavřených továrních prostorách), výživu bez vitaminu D a s nízkým podílem vápníku (vyšší podíl moučných výrobků na úkor mléka) (14).
Osteomalacie s jasně vyjádřenými klinickými projevy byla zřejmě vždy relativně vzácná (15). Přesně je epidemiologie osteomalacie zdokumentována u některých hereditárních forem (viz níže). U X‑vázané hypofosfatemické rachitidy je udávaná incidence 3,9 na 100 000 živě narozených dětí, resp. prevalence 4,8 na 100 000 dětí i dospělých (16). Prevalence klinicky zjevných forem hypofosfatázie je zhruba 1 na 100 000 (17), prevalence lehčích forem, které jsou diagnostikovány až v dospělém věku, může být vyšší.
I přibližnou prevalenci osteomalacie způsobené nedostatkem vitaminu D je obtížné určit. Tento stav je ve většině případů asymptomatický, zejména pokud jde o starší osoby. V celosvětovém měřítku je však nedostatek vitaminu D nepochybně zdaleka nejčastější příčinou osteomalacie. Lze předpokládat, že osteomalacie je poměrně častá v těch částech světa, kde je běžná nutriční křivice. V poslední době, kdy dochází k migraci ze zemí Blízkého východu do zemí průmyslového severu, se objevuje další problém. I přes nedostatek vitaminu D v potravě, hojné sluneční záření v zemích původu zajišťuje normální hladiny vitaminu D. Po přesunu do zemí Evropy a Severní Ameriky s nižší úrovní UV záření se u osob s tmavší pigmentací kůže (melanin působí jako účinný filtr UV‑B fotonů), která ostatně bývá z velké části, především u žen, zahalována, rychle vyvíjí deficit vitaminu D (18, 19).
Podcenění skutečné prevalence poruch kostní mineralizace dokládá několik studií zahrnujících kostní biopsie. Histomorfometrickým vyšetřením 78 kostních vzorků u pacientů po fraktuře proximálního konce kosti stehenní (68 žen a 10 mužů) bylo zjištěno, že prevalence osteomalatických změn se zvyšuje s věkem. U osob starších 90 let histomorfometrická kritéria osteomalacie splnilo 29 % pacientů (20). Další údaje poskytla rozsáhlá histomorfometrická studie ze severního Německa na kadaverózním materiálu. U 675 zemřelých z různých příčin (byly vyloučeni zemřelí se známými osteopatiemi a chorobami ovlivňujícími skelet) byla provedena biopsie z lopaty kosti kyčelní. Výsledky ukázaly nečekaně vysokou prevalenci poruch mineralizace. Na základě obecně akceptované histomorfometrické definice osteomalacie byla osteomalacie přítomna ve 4,89 % případů (33 z 675). U 7 případů (1,04 %) objem nemineralizovaného osteoidu překročil dokonce 10 % (10). Téměř tři čtvrtiny (73,1 %) kostních vzorků indických pacientů po zlomenině proximálního femuru jevily známky osteomalacie (21).
Etiologie a klasifikace osteomalacie
Terminologie a klasifikace pochopitelně odráží vývoj poznání jednotlivých příčin osteomalacie. Od identifikace role vitaminu D v homeostáze kostního minerálu ve 20. letech 20. století se postupně oddělila skupina osteomalacií, jež bylo možno více či méně úspěšně léčit aplikací vitaminu D. Do protikladu k těmto formám byly stavěny vitamin D – rezistentní formy, které odolávaly i vysokým dávkám vitaminu D (22), mezi nimiž byly postupně identifikovány i různé hereditární formy (23). Různé varianty dělení osteomalacií dle odezvy na vitamin D přetrvávají v literatuře do dnešních dní, přestože současná znalost už umožňuje logickou a přehlednou etiopatogenetickou klasifikaci (Tab. 1).
Tab. 1. Příčiny osteomalacie 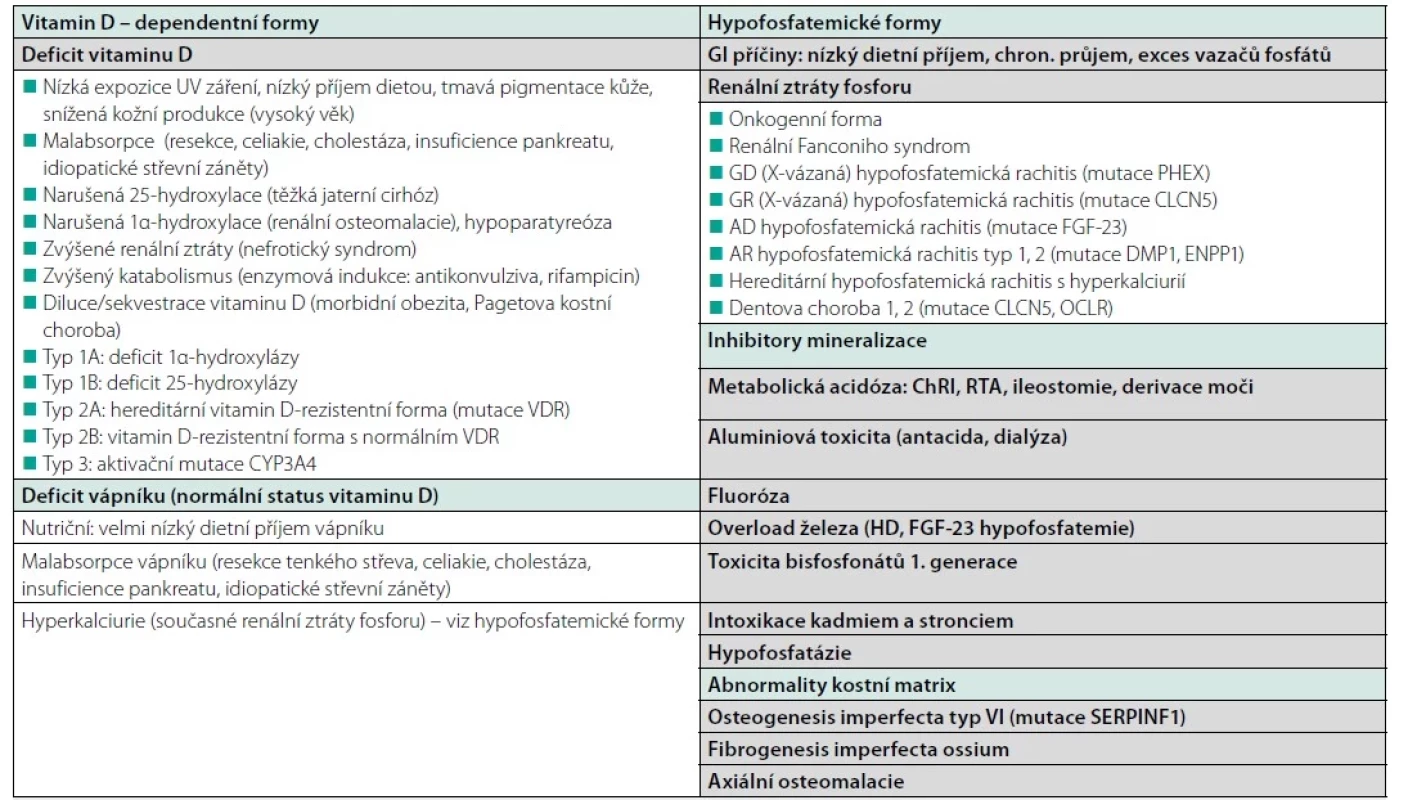
Upraveno podle Laurent et al. Rickets and Osteomalacia. V: Primer on the metabolic bone diseases and disorders of mineral metabolism. 9th Edition, ASBMR 2019, ISBN: 978-1-119-26656-3 a Minisola S, Coangelo L, Pepe J, et al. Osteomalacia and Vitamin D Status: A Clinical Update 2020. JBMR® Plus (WOA) 2021;5:e10447. U hereditárních forem existuje terminologický překryv pojmů rachitis a osteomalacie. S ohledem na dětský věk manifestace onemocnění se převážně užívá pojmu „hereditární rachitis“, ale protože vysoký podíl dětských nemocných se dožívá dospělosti, u dospělých nemocných se setkáváme i s označením „hereditární osteomalacie“. U hypofosfatemických hereditárních forem se tento terminologický problém někdy obchází používáním diagnózy zdůrazňující prominentní patogenetický laboratorní rys – hypofosfatemii (např. X‑vázaná hypofosfatemie).
V principu lze rozlišit 4 patogenetické mechanismy rozvoje osteomalacie: deficit vitaminu D či rezistence vůči jeho účinkům, deficit vápníku, deplece fosfátů a inhibice mineralizace jako toxické působení různých agens (24).
Nejčastější a nejjednoduší na diagnostiku a léčbu jsou varianty způsobené nedostatkem nebo nedostatečnou dostupností vápníku a/nebo vitaminu D (kalcipenické a vitamin D-penické). Jejich příčinou může být nutriční deficit uvedených živin (často kombinovaný). V našich podmínkách přichází nejčastěji u špatně živených seniorů. Ti většinou mívají i nedostatečnou expozici slunečnímu záření, takže nutriční deficit vitaminu D nemůže být ani částečně kompenzován fotochemickou syntézou vitaminu D3 z kožního 7-dehydrocholesterolu.
Jak je zmíněno výše, v západním světě je vysoký výskyt osteomalacie u imigrantů z blízkovýchodních oblastí, především u žen, v důsledku zahalování výrazněji pigmentované kůže a nižší intenzity slunečního záření.
Dalším okruhem příčin jsou malasimilační syndromy podmíněné chorobami trávicího traktu, v současnosti nejčastěji jako důsledek celiakální sprue či bariatrických a jiných resekčních operací, případně těžkých forem idiopatických střevních zánětů postihujících tenké střevo. Osteomalacie v důsledku malabsorpce vitaminu D může dominovat klinickému obrazu u dospělých pacientů s cystickou fibrózou (25). Osteomalacie může být následkem těžké hepatopatie, v důsledku narušení hydroxylace kalciferolu na 25. uhlíku, tj. prvního metabolického kroku nezbytného ke konverzi vitaminu D (kalciferolu) na aktivnější metabolit (25-hydroxykalciferol) v kombinaci s malasimilací živin. Snížená aktivita 1α‑hydroxylázy, enzymu proximálního tubulu katalyzujícího finální metabolický krok konverze 25-hydroxykalciferolu na plně účinný 1,25-dihydroxykalciferol, může být zodpovědná za složku osteomalacie v rámci renální kostní choroby u pacientů s chronickým onemocněním ledvin (CKD‑MBD).
Další skupinou jsou vitamin‑D dependentní nebo rezistentní formy podložené hereditárními enzymatickými defekty či mutacemi klíčových prvků signální cesty vitaminu D, které se zpravidla manifestují v dětském věku.
Zcela jinou etiologii mají hypofosfatemické formy, které se rozvíjejí v důsledku nedostatku fosfátů jako substrátu mineralizace. V rámci této skupiny se etiologie jednotlivých typů zásadně liší. Velmi vzácnou příčinou je nedostatečný dietní příjem fosfátů nebo patologie trávicího traktu narušující jejich absorpci. Heterogenní skupinu představují osteomalacie podmíněné zvýšenými renálními ztrátami fosforu, způsobené primárním či sekundárním nárůstem hladin fibroblastového růstového faktoru 23 (FGF-23) či dalších fosfatoninů (FGF-23 snižuje reabsorpci fosfátů v proximálním renálním tubulu, což při jeho nadbytku způsobuje hypofosfatemii). Řadí se mezi ně spektrum geneticky podmíněných poruch. V případě těchto i dříve zmíněných hereditárních forem platí, že jde o choroby zpravidla diagnostikované v dětském věku. Za 80 % familiálních hypofosfatemií (hypofosfatemických rachitid resp. hypofosfatemických osteomalacií) odpovídá X‑vázaná hypofosfatemie (XLH), gonozomálně dominantně dědičné onemocnění způsobené mutací PHEX genu vedoucí ke zvýšené expresi FGF-23 (26). Tumorem indukovaná osteomalacie (TIO) je velmi vzácný, ale pravděpodobně také často nediagnostikovaný paraneoplastický syndrom způsobený tumorózní nadprodukcí FGF-23. Tumory způsobující TIO jsou zpravidla drobné, velmi pomalu rostoucí meenchymální útvary lokalizované v měkkých tkáních, sinusech a kosti (27, 28). S rozvojem osteomalacie může být spojen renální Fanconiho syndrom, který se může rozvíjet u pacientů se Sjögrenovým syndromem, renální tubulární acidózou, gamapatiemi, při léčbě HIV antiretrovirovými preparáty (zvl. tenofovirem) a při dlouhodobé terapii chronické hepatitidy B virostatiky (adefovir dipivoxil). Příčinou osteomalacie u Fanconiho syndromu je vedle hypofosfatemie i relativní nedostatek kalcitriolu. Samostatnou kapitolou jsou osteomalacie vznikající uplatněním inhibitorů mineralizace, zpravidla iatrogenního původu. Do této skupiny lze ovšem řadit i hypofosfatázii, geneticky podmíněnou poruchu, při níž deficit alkalické fosfatázy vede k lokálnímu nadbytku pyrosfosfátu, který působí jako inhibitor mineralizace (29).
Symptomatologie
Věk manifestace, klinické symptomy i laboratorní odchylky jsou, stejně jako příčiny osteomalacie, extrémně heterogenní.
Klinickému nálezu může dominovat základní onemocnění trávicí trubice, jater nebo ledvin, případně známky cystické fibrózy. V popředí klinického obrazu může být patologie gastrointestinálního traktu (symptomatologie celiakie vč. kožních změn, st.p. bariatrických zákrocích, idiopatické střevní záněty) vedoucí k malasimilaci živin nezbytných pro normální průběh mineralizace. Na narušené schéma mineralizace může upozornit přítomnost chondrokalcinózy. Metastazující karcinom prostaty, malobuněčný karcinom či mnohočetný myelom z lehkých řetězců jako možné příčiny narušené mineralizace osteoidu v důsledku hypofosfatemie zpravidla diagnostické problémy nečiní. Vyvinutý klinický obraz osteomalacie zahrnuje bolesti dlouhých kostí, patologické zlomeniny typu „insufficiency“ zlomenin (často nesprávně označovaných jako stresové fraktury). Bolesti a hypotonie pletencového svalstva může být příčinou kolébavé chůze. Hereditární formy, často u jedinců s pozitivní rodinnou anamnézou, jsou charakterizovány poruchami růstu a dentinogeneze i více či méně charakteristickými deformitami skeletu.
Na narušení procesu kostní mineralizace upozorní odchylky v laboratorním obrazu (viz Tab. 2). Ty mohou zahrnovat snížení hladin sérového kalcia, odchylky v hladině fosfátů i aktivitě alkalické fosfatázy oběma směry. Hypokalcemie se vyskytuje u vitamin D‑deficitních a kalcipenických forem, nepravidelně u hypofosfatemických a onkogenních forem. Kalcemie je normální u hypofosfatázie a toxicit těžkých kovů. Hypofosfatemie je pochopitelně patognomonická u hypofosfatemických forem osteomalacie. Vyskytuje se i u vitamin D‑deficitních forem s výjimkou nefropatií (u nich se naopak vyskytuje hyperfosfatemie). U hypofosfatázie je fosfatemie normální nebo zvýšená, může být přítomna hyperkalciurie; laboratorní obraz hypofosfatázie doplňují zvýšené hladiny vitaminu B6. Hyperparatyreóza se objevuje u vitamin D‑deficitních i kalcipenických forem a výrazně pak u pokročilých stadií chronického selhání ledvin. Častým zjištěním je elevace aktivity alkalické fosfatázy. Ta je však v případě hyposfosfatázie výrazně suprimována. Součástí vyšetření je i stanovení kalcidiolu (25OHD), jež jako příčinu může odhalit deficit vitaminu D či poruchu jaterní konverze kalciferolu na 25-hydroxykalciferol.
Tab. 2. Laboratorní nálezy u jednotlivých typů osteomalacie 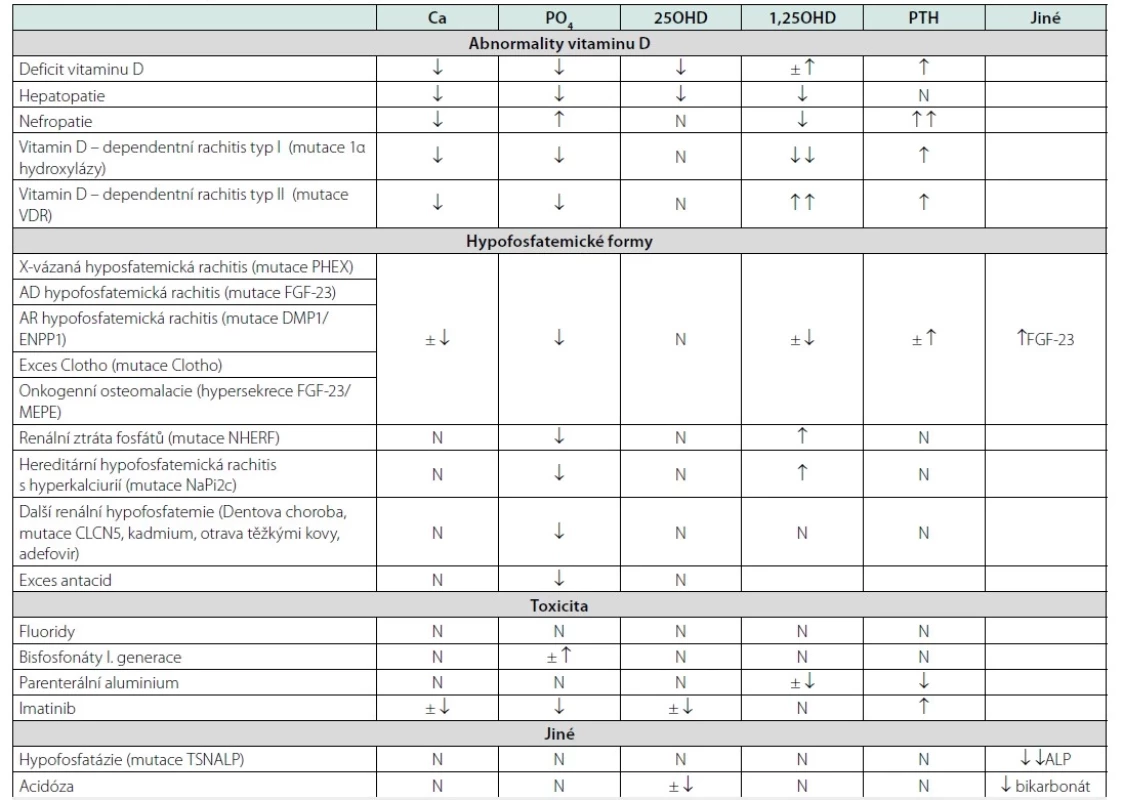
Ca – sérový vápník; PO4 – sérové fosfáty; 25OHD – 25-hydroxyvitamin D; 1,25OHD – 1,25-dihydroxyvitamin D; PTH – parathormon; FGF-23 – fibroblastový růstový faktor 23; ALP – alkalická fosfatáza
Podle Ott S., Osteomalacia and rickets. https://courses.washington.edu/bonephys/hypercalU/opmal2.html)Laboratorní obraz nejčastější formy osteomalacie v důsledku nedostatku vitaminu D se vyvíjí ve třech fázích. Počáteční stadium je charakterizováno normálními sérovými hladinami vápníku a fosfátu a zvýšenými hladinami alkalické fosfatázy a PTH, jehož vyšší hladiny ještě dokáží udržet normokalcemii. Ve druhé fázi se hladina sérového vápníku a často i fosfátů snižuje (hyperkalcemizující efekt PTH již nepostačuje k udržení normální kalcemie, naopak se projevuje jeho fosfaturický efekt) a hodnoty PTH i alkalické fosfatázy v séru se dále zvyšují. Hodnota 25OHD dále klesá úměrně nárůstu PTH. V závěrečné fázi se s další progresí sekundární hyperparatyreózy vždy objevuje hypokalcemie a hypofosfatemie. Hlavní cirkulující formou vitaminu D je kalcidiol (25OHD), který je nejvhodnějším indikátorem saturace vitaminem D. Hladiny kalcitriolu, tj. 1,25(OH)2D, neodrážejí rezervy vitaminu D; jeho stanovení je někdy nezbytné k diagnostice získaných a vrozených poruch metabolismu kalcidiolu a fosfátů, vč. CKD‑MBD, hereditárních hypofosfatemií, vitamin‑D rezistentních rachitid, TIO, případně granulomatózních onemocnění spjatých s hyperprodukcí kalcitriolu (sarkoidóza, některé lymfomy) (30). Ve studii u jedinců bez anamnézy kostního onemocnění, jež kombinovala histomorofmetrická vyšetření kosti a hladiny 25OHD, nebyla patologická akumulace osteoidu zjištěna u žádného z jedinců s hodnotami 25(OH)D > 75 nmol/l (9). Sérový parathormon je adekvátně suprimován při hladinách 25(OH)D > 50 nmol/l. Od hodnot 25(OH)D mezi 75 a 100 nmol/l se udržuje nízké riziko nevertebrálních zlomenin (31). V histomorfometrickém obrazu lze u nutričně podmíněných osteomalacií pozorovat spektrum změn od obrazu hyperparatyreózy (stadium 1), jež se může vyvinout v defekty mineralizace (stadium 2), resp. progredovat do typického obrazu osteomalacie (stadium 3), kterým je obraz hyperosteoidózy a opožděné mineralizace (viz Definice osteomalacie). Při diferenciálně diagnostickém procesu se doporučuje provést rtg vyšetření pánve, stehenních kostí, tibií, případně skeletu rukou, žeber a lopatek. V těchto částech skeletu je možné zachytit tzv. Looserovy zóny kostní přestavby (označované též jako pseudofraktury nebo kortikální infrakce či Milkmanovy linie, viz Obr. 1), nejčastěji na stydkých a sedacích kostech a krčku femuru. V rtg obraze imponují jako široká transverzální projasnění se sklerotickými okraji, v různé míře zasahující do kortikální kosti, většinou kolmo k jejímu povrchu, často symetricky (Obr. 1). Histologicky se jedná o oblasti hypomineralizovaného osteoidu ohraničené sklerotickými okraji. Vyšetření kostní scintigrafií poskytuje obraz difuzně zvýšené akumulace, patologicky akcentovaný v místech Looserových zón.
Obr. 1. Looserovy zóny kostní přestavby obou bérců u pacienta s dekompenzovanou Bylerovou chorobou (progresivní familiární intrahepatální cholestáza). Chronická malabsorpce vedoucí k osteomalacii 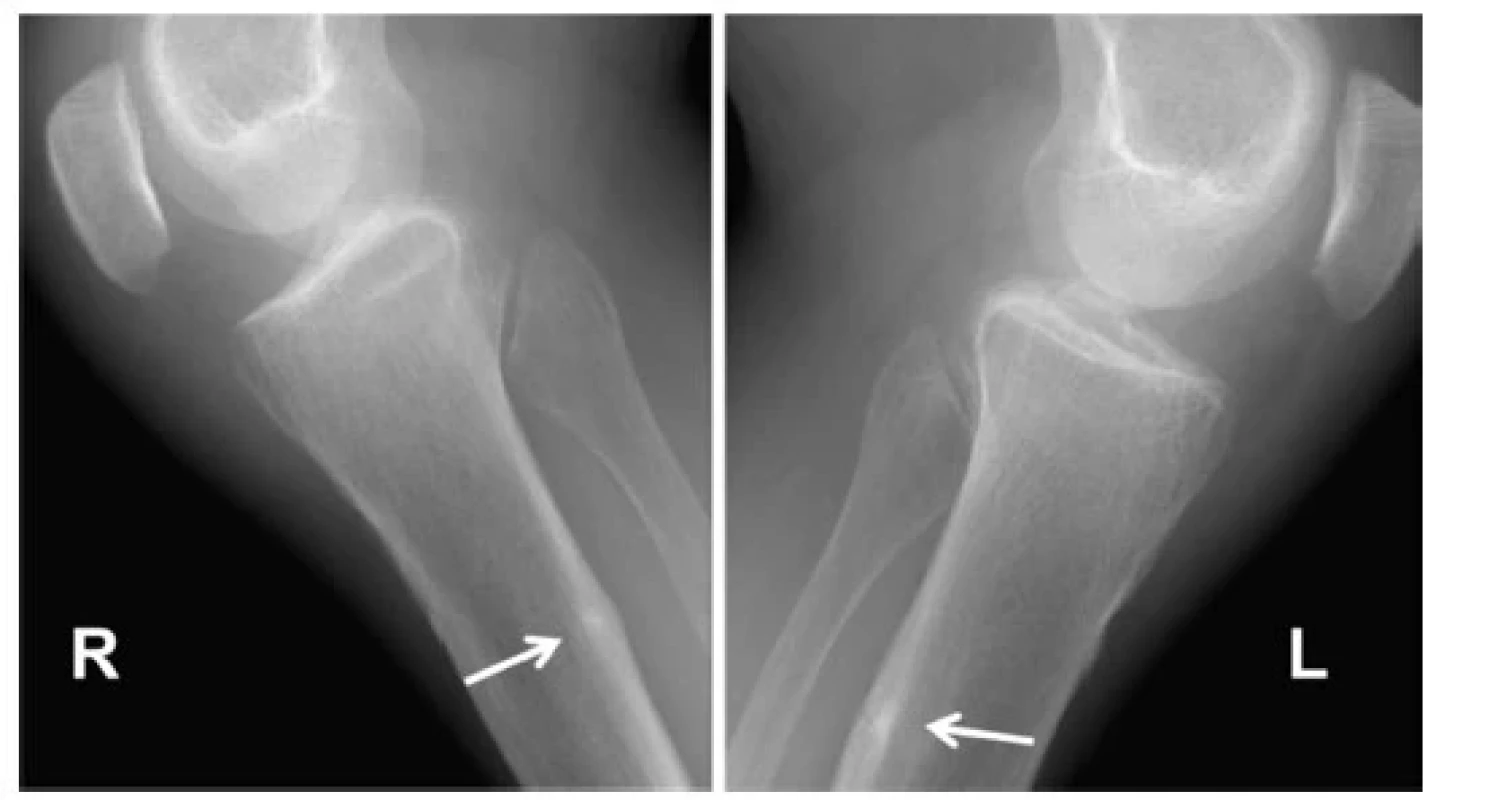
Podle Tarazi M et al. International Journal of Surgery Case Reports. 2016; 19:150- 153, se souhlasem autorů i vydavatele Oblasti skeletu s akumulací hypomineralizovaného osteoidu představují locus minoris resistentiae. Looserovy zóny tak mohou zcela atraumaticky progredovat do obrazu tzv. „insufficency“ zlomenin (tedy zlomenin vznikajících působením normálních sil na patologicky změněnou kostní tkáň). Komprese obratlových těl jsou méně časté, ale byly popsány i těžké kyfoskoliotické deformity páteře u pacientů s dlouhodobou neléčenou osteomalacií (32).
U pacientů s významnou hypofosfatemií nejasné etiologie je zpravidla nezbytné použít celé spektrum zobrazovacích metod k lokalizaci suspektního mezenchymálního tumoru, vč. pozitronové emisní tomografie (PET) za použití izotopu galia 68 s DOTA peptidy (68Ga‑DOTA).
Diferenciální diagnostika
Úvodní diferenciální diagnostika může být v dospělosti, s ohledem na rozmanitost klinických symptomů, velmi rozsáhlá. Anamnéza, klinické vyšetření, zobrazovací metody a především výsledky laboratorních vyšetření zpravidla zúží výběr na metabolické osteopatie, které zahrnují metastatické postižení skeletu, primární hyperparatyreózu a renální kostní chorobu.
Osteoblastické kostní metastázy mohou vykazovat obdobný laboratorní obraz i nález na kostní scintigrafii. Mnohočetný myelom, projevující se často podobnými subjektivními obtížemi (bolesti kostí, svalová slabost), odliší přítomnost lytických lézí při rtg vyšetření a anémie, přičemž je nezbytné správně interpretovat případné známky nedostatečnosti ledvin.
Primární hyperparatyreóza může imitovat osteomalacii zvýšenou alkalickou fosfatázou, hypofosfatemií a scintigrafickým obrazem. Pravidelně přítomná hyperkalcemie je však pro osteomalacii netypická. Pro renální kostní nemoc je pak spíše než hypofosfatemie typická hyperfosfatemie.
Pomineme‑li možnost lehké elevace celkové ALP (na vrub kostního izoenzymu) u pacientů s vystupňovanou kostní remodelací, je pro osteoporózu typický zcela normální laboratorní obraz kalciumfosfátového metabolismu. DXA kostní denzitometrie stanovuje denzitu kostního minerálu (Bone Mineral Density, BMD), která je kompozitním parametrem. BMD je jednak funkcí absolutního objemu kostní hmoty (proto je diagnostickým kritériem osteoporózy), jednak stupně její mineralizace (DMB). U pacientů s osteomalacií se – zcela logicky – pravidelně zjišťují hluboké poklesy BMD do pásma „osteoporózy“ (33). Příčina těchto poklesů ovšem nemusí spočívat v poklesu absolutního objemu kostní hmoty a o osteoporózu se tedy vůbec nemusí jednat. Opakovaně bylo prokázáno, že u seniorů, tedy v populaci nejnáchylnější k deficitu vitaminu D i vápníku, suplementace vitaminem D i v relativně nízkých dávkách má z krátkodobého hlediska pozitivní efekty na BMD (34, 35) a dokonce snižuje incidenci nevertebrálních zlomenin (36, 37). Suplementace vápníkem a vitaminem D nemá žádný nebo minimální vliv na úroveň kostní remodelace (38), jejíž ovlivnění je jinak nezbytným předpokladem vzestupu BMD a snížení rizika zlomenin. Pozitivní vliv suplementace vápníkem a vitaminem D na BMD i riziko zlomenin u seniorů lze tedy z velké části vysvětlit úpravou subklinické poruchy mineralizace kostní matrix. Významné poklesy BMD v seniorské populaci tedy mohou znamenat přítomnost osteoporózy, je však pravděpodobné, že často i s různě vyvinutým podílem hypomineralizace kostní matrix. Příznakový komplex osteomalacie u těchto pacientů nemusí být zdaleka plně vyjádřen, resp. u polymorbidních pacientů ve vyšším věku může být přehlédnut. V této souvislosti není na škodu opakovaně zdůrazňovat, že samotný pokles BMD automaticky neznamená diagnózu osteoporózy; vždy je nezbytné vyloučit jinou osteopatii, vč. podílu osteomalacie.
Terapie
Léčba osteomalacie je v principu určena její příčinou.
Je‑li to možné, tak by měla především zahrnovat korekci základního onemocnění nebo alespoň potlačení jeho aktivity a zmírnění jeho dopadu na skelet.
Léčba osteomalacie v různé míře zahrnuje aplikaci vitaminu D v perorální či, je‑li to nezbytné, v parenterální formě.
Udržovací dávky vitaminu D v rozmezí 1 000–2 000 IU denně, doporučované v prevenci a terapii osteoporózy, u pacientů s prokázaným laboratorním deficitem nepostačují. Jsou nicméně vhodné u pacientů s osteomalacií, pokud není její příčinou deficit vitaminu D. U pacientů s hladinami 25OHD < 25 nmol/l lze k rychlejšímu dosažení cílových hladin 25OHD použít režim aplikace 50 000 IU vitaminu D 1× týdně po dobu 8–12 týdnů následovaný udržovacími dávkami (39, 40) či perorálních dávek 6 000 IU denně po dobu tří měsíců (40). Alternativně lze použít úvodní nasycovací dávku 100 000 IU (24). Platí, že potřeba vitaminu D je individuální a vyšších dávek je zpravidla třeba u pacientů s velmi nízkými hladinami 25OHD, starších, obézních (velký distribuční objem), uživatelů antikonvulziv, glukokortikoidů, antimykotik na bázi ketokonazolu a při léčbě AIDS (30).
Za cílovou, tj. minimální hodnotu i u pacientů se zjištěnými poruchami mineralizace osteoidu, lze považovat hladinu 25OHD 75 nmol/l. Účinnost podávané dávky je vhodné zkontrolovat stanovením hladiny 25OHD za 1–1,5 měsíce po zahájení léčby. Po dosažení cílové hladiny je vhodný přechod na udržovací dávky. Terapeutické okno vitaminu D je velice široké. O riziku intoxikace lze spekulovat až po dlouhodobé aplikaci vitaminu D v dávkách 4 000-10 000 IU denně nebo při hladinách 25OHD > 375 nmol/l (40), k čemuž může docházet i za bizarních okolností, např. po nekontrolovaném užití výživových doplňků s obsahem vitaminu D určených jiným živočišným druhům (v době šíření covidu-19 a zdůrazňování nezbytnosti saturace vitaminem D) (41). Schémata aplikace vitaminu D podle různých vstupních podmínek lze dohledat v recentní publikaci (40).
V indikovaných případech (selhání přirozeného vitaminu D, porucha jeho konverze na aktivní metabolity) lze zvolit aplikaci aktivních metabolitů vitaminu D (alfakalcidiolu při narušené konverzi v ledvinách a zachované konverzi v játrech či kalcitriolu u těžších hepatálních lézí).
Aplikaci vitaminu D musí vždy doprovázet podávání vápníku. Ve většině případů postačuje aplikace 1 000 mg elementárního vápníku denně rozdělená do 2 dávek (střevní absorpce vápníku je lineární až do jednorázové dávky 500 mg, při podání vyšších dávek se transportní mechanismus saturuje a účinnost absorpce klesá). Vyšší denní dávky vápníku (2 000–3 000 mg) ovšem mohou být nezbytné u pacientů s malabsorpcí a po bariatrických zákrocích (24). V případě těžkých malasimilací může stav někdy vyžadovat parenterální výživu.
Dosavadní léčba hereditárních hypofosfatemií zahrnovala aplikaci kalcitriolu a frekventní suplementaci fosfáty, jež klinický stav pacientů vylepšovala, ovšem za cenu četných nežádoucích účinků. Od r. 2018 je pro léčbu X‑vázané hypofosfatemie registrována (24) monoklonální protilátka proti FGF-23 burosumab (Crysvita®). Jde o přelomovou léčbu, která zasahuje první metabolický krok rozvoje tohoto onemocnění a prakticky normalizuje klinický i laboratorní obraz postižených.
Podaří‑li se lokalizace mezenchymálního tumoru jako zdroje TIO, je indikováno jeho chirurgické odstranění. Není‑li tumor prokázán/ lokalizován nebo je‑li tumor inoperabilní, léčba se neliší od přístupu u hereditárních hypofosfatemií, spočívající v aplikaci fosfátů a aktivního metabolitu vitaminu D. Registrace burosumabu zahrnuje i TIO s těžkou hypofosfatemií, kterou nelze řešit chirurgicky.
Na použití burosumabu u dospělých se v ČR momentálně bohužel nevztahuje úhrada zdravotními pojišťovnami.
Klasická léčba hypofosfatázie je zatížena rizikem rozvoje hyperparatyreózy a ektopických kalcifikací. Proto je nezbytné k suplementaci vápníkem a vitaminem D přistupovat opatrně. Příznivých výsledků lze dosáhnout off‑label aplikací teriparatidu (42, 43). Zásadní změnu v léčbě hypofosfatázie přinesla až dostupnost substituční léčby chybějícího enzymu: asfotáza α (Strensiq®) (44) aplikovaná v injekční formě 3× týdně, která je v EU registrována pro použití u pacientů, u nichž se první příznaky onemocnění objevily do 18 let věku.
Závěr
Poruchy kostní mineralizace představují velmi heterogenní skupinu onemocnění.
Na vzácnější poruchy může někdy upozornit kombinace anamnézy, klinického obrazu, odchylek v laboratorním vyšetření. Rentgenové vyšetření může vést k definitivní diagnóze.
Nespecifické obtíže a – často náhodně – zjištěná odchylka v laboratorním vyšetření může umožnit odhalení nejen osteomalacie, ale i základního onemocnění, které k rozvoji poruchy kostní mineralizace vedlo.
Deficit vápníku a vitaminu D, především u seniorů, může mít za následek poruchu kostní mineralizace. Ta je nepochybně příčinou významného podílu nevertebrálních zlomenin. U všech pacientů se zřejmou osteoporózou, ať už dle DXA vyšetření, nebo na základě běžného radiogramu, je vždy nezbytné vyloučit jiné metabolické osteopatie, vč. porušené mineralizace osteoidu.
Článek přijat redakcí: 6. 3. 2023
Článek přijat po recenzích: 3. 5. 2023
MUDr. Jan Rosa
Osteocentrum Affidea Praha, Lékařská fakulta Univerzity Karlovy v Hradci Králové
Zdroje
1. Zhou, R, Guo Q, Xiao Y, et al. Endocrine role of bone in the regulation of energy metabolism. Nature Bone Research. 2021;9 : 25.
2. Boivin G, Meunier PJ. The mineralization of bone tissue: a forgotten dimension in osteoporosis research. Osteoporos Int. 2003;14(Suppl 3):S19-S24.
3. Yadav MC, Simão AMS, Narisawa S, et al. Loss of skeletal mineralization by the simultaneous ablation of PHOS‑PHO1 and alkaline phosphatase function: a unified model of the mechanismsof initiation of skeletal calcification. J Bone Miner Res. 2011;26 : 286-297.
4. Hinson J, Raven P, Chew S. Hormonal regulation of plasma calcium and calcium metabolism. In: The Endocrine System (Second Edition). 2010;147-159.
5. Jannin A, Kerlan V, Desailloud R. Endocrinology of bone mineralization: An update. Annales d’Endocrinologie. 2022;83 : 46-53.
6. Bhan A, Qiu S, Rao SD. Bone histomorphometry in the evaluation of osteomalacia. Bone Rep. 2018;8 : 125-134.
7. Dempster DW, Compston JE, Drezner MK, et al. Standardized nomenclature, symbols, and units for bone histomorphometry: a 2012 update of the report of the ASBMR Histomorphometry Nomenclature Committee. J Bone Miner Res. 2013;28 : 2-17.
8. Fukumoto S, Ozono K, Michigami T, et al. Pathogenesis and diagnostic criteria for rickets and osteomalacia–proposal by an expert panel supported by the Ministry of Health, Labour and Welfare, Japan, the Japanese Society for Bone and Mineral Research, and the Japan Endocrine Society. J Bone Miner Metab. 2015;33 : 467-473.
9. Finch PJ, Ang L, Eastwood JB, Maxwell JB. Clinical and histological spectrum of osteomalacia among Asians in south London. Q J Med. 1992;302 : 439-448.
10. Priemel M, von Domarus C, Klatte TO, et al. Bone Mineralization Defects and Vitamin D Deficiency: Histomorphometric Analysis of Iliac Crest Bone Biopsies and Circulating 25-Hydroxyvitamin D in 675 Patients. J Bone Mineral Res. 2010; 25 : 305-312.
11. Smerdon GT. Daniel Whistler and the English Disease: A Translation and Biographical Note. J Hist Med Allied Sci. 1950;5 : 397-415.
12. Dunn PN. Francis Glisson (1597–1677) and the „discovery“ of rickets. Arch Dis Child Fetal Neonatal Ed. 1998;78:F154-F155.
13. Newton G. Diagnosing Rickets in Early Modern England: Statistical Evidence and Social Response. Soc History Medicine. 2021;35 : 566-588.
14. Wheeler BJ, Snoddy AM, Munns C, et al. A Brief History of Nutritional Rickets. Front Endocrinol. 2019;10 : 795.
15. Stoddard CS. Osteomalacia. California State Journal of Medicine. 1905;3 : 155-156.
16. Padidela R, Nilsson O, Makitie O, et al. The international X‑linked hypophosphataemia (XLH) registry (NCT03193476): rationale for and description of an international, observational study. Orphanet Journal of Rare Diseases. 2020;15 : 172.
17. Conti F, Ciullini L, Pugliese G. Hypophosphatasia: clinical manifestation and burden of disease in adult patients. Clin Cases Mineral Bone Metabol. 2017;14 : 230-234.
18. Lips P, de Jongh RT. Vitamin D deficiency in immigrants. Bone Reports. 2018;9 : 37-41.
19. Yousef S, Manuel D, Colman I, et al. Vitamin D Status among First‑Generation Immigrants from Different Ethnic Groups and Origins: An Observational Study Using the Canadian Health Measures Survey. Nutrients. 2021;13 : 2702.
20. Hordon LD, Peacock M. Osteomalacia and osteoporosis in femoral neck fracture. Bone Miner. 1990;11 : 247-59.
21. Kumar K, Bhayana H, Vaiphei K, et al. Coexistence of Osteomalacia in Osteoporotic Hip Fractures in More Than 50 Years Age Group. Indian Journal of Orthopaedics. 2021;55 : 614-620.
Další literatura u autora
a na www.casopisvnitrnilekarstvi.cz
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Novinky v diabetologii 2022
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 4- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Ultrazvuk ve vnitřním lékařství – zaostřeno na Point‑of‑Care ultrasonografii
- Point-of-Care ultrasonografie ve vnitřním lékařství
- Point‑of‑Care ultrasonografie – spolehlivost, vzdělávání
- Kolik POCUS pro všechny české internisty?
- Zkušenost s výcvikem Point‑of‑Care ultrazvukového vyšetření srdce ve Fakultní nemocnici v Hradci Králové
- Implementace Point‑of‑Care ultrazvukového vyšetření ve všeobecném praktickém lékařství
- Stanovisko expertního diskusního panelu I. odborné konference Point-of‑Care ultrasonografie
- Hluboká žilní trombóza – postavení ultrazvuku v diagnostice a dalším sledování pacientů
- V prevenci demence je třeba se zaměřit na časnou a důslednou léčbu hypertenze
- Osteomalacie
- Dapagliflozin v léčbě srdečního selhání se zachovalou ejekční frakcí
- Prvé použitie podkožného C1 inhibítora v profylaxii atakov hereditárneho angioedému u tehotných pacientok na Slovensku
- Novinky v diabetologii 2022
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Point-of-Care ultrasonografie ve vnitřním lékařství
- Osteomalacie
- Hluboká žilní trombóza – postavení ultrazvuku v diagnostice a dalším sledování pacientů
- Point‑of‑Care ultrasonografie – spolehlivost, vzdělávání
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



