-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
Levothyroxine suppressive therapy in differentiated thyroid cancer treatment
Levothyroxine therapy in management of diferentiated thyroid carcinoma (DTC) has been common practice for decades. Levothyroxine is being administered to patiens with DTC after total thyreoidectomy (with or without postopreative radioiodine treatment) not only to restore euthyroidism but to suppress the production of thyroid-stimulating hormone (TSH) as well because TSH is considered as a growth factor for thyroid follicular cells. However there has been a downside to this threatment recently. The main concerns are the known risks related to iatrogenic subclinical or even mild but clinicaly overt iatrogenic hyperthyroidism. Therefore individualized treatment approach aiming to balance between the risk of tumor recurence and the risks related to hypertyhroidism in view of pateints age, risk factors and comorbidities is essential. Close folow-up is therefore necessary with frequent dose adjustments according to target TSH values published in American Thyroid Association guidelines.
Keywords:
Thyroid – levothyroxine – differentiated thyroid cancer – TSH suppression
Autoři: Jan Drugda 1; Jan Čáp 1; Mikuláš Kosák 2; Filip Gabalec 1
Působiště autorů: Fakultní nemocnice Hradec Králové a Univerzita Karlova, Lékařská fakulta v Hradci Králové 1; Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 2
Vyšlo v časopise: Vnitř Lék 2023; 69(2): 128-131
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2023.020Souhrn
Terapie levothyroxinem je součástí léčby diferencovaného karcinomu štítné žlázy již po desetiletí. Levothyroxin je podáván pacientům po totální tyreoidektomii (s nebo bez následné aplikace radiojodu) nejen k navození eutyreózy, ale také k potlačení produkce thyreotropního hormonu (TSH), protože TSH je považován za růstový faktor pro folikulární buňky štítné žlázy. Hlavní nevýhodou této léčby jsou známá rizika spojená s iatrogenně navozenou subklinickou či až klinickou hypertyreózou. Proto je nezbytný individuální přístup s porovnáním rizika rekurence onemocnění a rizika nežádoucích účinků supresní terapie v korelaci s komorbiditami a celkovým stavem pacienta. Časté a důsledné sledování pacientů s adekvátní úpravou dávky levothyroxinu k udržení TSH v cílovém rozmezí dle doporučení Americké tyroidální asociace (ATA) je zcela klíčové.
Klíčová slova:
štítná žláza – karcinom štítné žlázy – levothyroxin – TSH suprese
Úvod
Léčba levothyroxinem je součástí managementu pacientů s diferencovaným karcinomem štítné žlázy již přes 80 let. Ve většině případů následuje tyreoidektomii, která je společně s aplikací radiojodu léčebnou metodou první volby. Principem této léčby je podávání hormonů štítné žlázy (levothyroxinu) s cílem substituovat chybějící hormony a v některých případech navíc také suprimovat produkci tyreotropního hormonu (TSH), který je považován za růstový faktor tyreoidálních buněk (1), ve snaze zabránit tak progresi či recidivě onemocnění. Tento efekt je sice nesporný, avšak benefit této terapie v klinické praxi je na základě publikovaných studií poměrně rozporuplný. Již zde je třeba připomenout, že k dosažení suprese TSH je nutno často použít vyšší než substituční dávky hormonů štítné žlázy, čímž udržujeme pacienta v iatrogenně navozené subklinické nebo klinické hypertyreóze se všemi jejími potencionálními nežádoucími účinky. Je proto důležité u každého pacienta individuálně zhodnotit, zda riziko případných nežádoucích účinků nepřevažuje nad potencionálním přínosem této léčby. Za tímto účelem byla vypracována doporučení Americké tyroidální asociace (ATA) (2), která pomáhají stratifikovat nemocné s karcinomem štítné žlázy do skupin dle výše rizika rekurence, z čehož by pak mělo vyplynout rozhodnutí o míře suprese TSH.
TSH jako růstový faktor
Působení TSH na buňky štítné žlázy je komplexní. Kromě regulace produkce a uvolňování tyreoidálních hormonů se například také podílí na diferenciaci buněk expresí genů, které vedou k transkripci natrium‑iodidovéhosymportéru (NIS) (3), jehož up‑regulace vede ke zvýšenému vychytávání jodu do buněk štítné žlázy, čehož se úspěšně využívá před aplikací radiojodu. Vazbou cirkulujícího TSH na TSH receptor se navíc aktivuje kaskáda cyklické AMP, která prokazatelně vede ke zvýšené proliferaci (4). Tento efekt je podmíněný přítomností TSH receptoru, tudíž ho lze předpokládat jen u dobře diferencovaných karcinomů štítné žlázy (DTC). Možnou roli TSH jako růstového faktoru naznačují i studie potvrzující mírně zvýšenou incidenci karcinomů štítné žlázy u pacientů s autoimunitní tyreoiditidou spojenou s dlouhodobě vyšší hladinou TSH (Hashimoto či atrofická tyroeiditida) či vyšším titrem TSH receptor stimulujících protilátek (Graves) (5). Některé studie také naznačují, že vstupně vyšší hladina TSH u pacientů s uzlovou přestavbou štítné žlázy může sloužit jako nezávislý prediktor malignity (6). V in vitro pokusech je také prokázán stimulační vliv TSH na produkci vaskulárního endoteliálního růstového faktoru (VEGF), což může také přispívat ke zvýšené proliferaci nádorových buněk (7).
Klinická účinnost
Starší studie a metaanalýzy sahající až do 30. let minulého století (8) potvrzují vliv TSH suprese na období do progrese a na mortalitu spojenou s nádorem u pacientů s DTC, nicméně tyto studie často zahrnují případy z doby, kdy bylo použití ultrazvuku či citlivých metod k detekci sérového tyreoglobulinu velmi omezené či nemožné. Výsledky recentních studií již tak přesvědčivé nejsou. Za zmínku zcela jistě stojí ta, kterou provedli Sugitani a Fujimoto na 433 pacientech s DTC (9). Mezi randomizovanými pacienty v této studii, u kterých bylo TSH suprimováno pod 0,01 μU/l, a těmi, u kterých bylo TSH udržováno v normálním fyziologickém rozmezí, nebyl prokázán signifikantní rozdíl v přežití bez progrese. K obdobnému výsledku došla také Klubo‑Gwiezdzinska a kolektiv (10), kteří analyzovali 867 pacientů s DTC. Tato analýza nebyla koncipována tak, aby byla schopna porovnat celkové přežití pacientů se supresí či bez suprese TSH, nicméně přežití bez progrese po 3 a 5 letech se opět signifikantně nelišilo. Zajímavé výsledky z poslední doby přináší zejména studie, které již operují se stratifikací pacientů dle rizika rekurence onemocnění, které se víceméně shodují v tom, že efekt TSH supresní terapie u pacientů s nízkým a středním rizikem není signifikantní, ale pacienti s vysokým rizikem včetně pacientů s distančními metastázami DTC z této terapie zcela jistě profitují (11–13). Například Diesslová a kol. retrospektivně analyzovala 157 pacientů s metastatickým DTC a zjistila, že medián přežití byl signifikantně vyšší (15 : 8 oproti 7 : 1 let) u pacientů s TSH udržovaným pod 0,1 mU/l oproti těm s nesuprimovaným TSH, nicméně hlubší suprese pod 0,03 mU/l prokazatelně další benefit pro pacienty nepřinesla (13). Nadále lze konstatovat, že dostupnost dat týkajících se této problematiky je poměrně omezená a chybí větší dobře designované randomizované studie, navíc většina těchto poznatků platí pro pacienty s papilárním karcinomem. U pacientů s folikulárním či onkocytárním karcinomem existují ještě omezenější data, a proto je v těchto případech supresní terapie indikována čistě na základě observačních poznatků a empirie lékařů.
Nežádoucí účinky
Jak již bylo zmíněno, největší riziko TSH supresní terapie spočívá zejména v exogenní subklinické či klinické hypertyreóze. Tíže těchto nežádoucích účinků je závislá hlavně na cílové hladině TSH, nicméně v některých případech hraje významnou roli i délka trvání léčby. Proto bychom měli být velmi obezřetní zejména u vysoce rizikových pacientů, u kterých musí být iniciální míra suprese poměrně agresivní, ale také u těch indikovaných k dlouhodobé supresní léčbě, nezávisle na míře námi navozené hypertyreózy. U nízce rizikových či výrazně komorbidních pacientů s cílovým TSH 0,5–2mU/l (Tab. 3) se jedná v podstatě o léčbu, substituční a nežádoucí účinky se jich pochopitelně netýkají. Mezi nejčastější a nejzávažnější komplikace supresní léčby patří hlavně ty kardiovaskulární a kostní. Dlouhodobý exces tyreoidálních hormonů vede k rozvoji (byť často jen velmi mírné) hyperkinetické cirkulace a chronickému hemodynamickému přetížení kardiovaskulárního systému. To má za následek snížení elasticity stěny zejména velkých, ale částečně i menších cév (14) a následně také remodelaci myokardu s hypertrofií levé komory s potencionálním narušením nejprve diastolické, a později i systolické funkce myokardu (14–15). Důsledkem pak může být rozvoj arteriální hypertenze, srdečního selhání a arytmií, zejména pak fibrilace síní. Hormony štítné žlázy navíc ovlivňují i iontové kanály na membráně síňových kardiomyocytů (zejména vápníkové kanály typu L), což má za následek zkrácení akčních potenciálů a potencuje to arytmogenní efekt nadbytku hormonů štítné žlázy (16). Auer a kolektiv zkoumali výskyt fibrilace síní u 23 638 jedinců (17) a prevalence byla signifikantně vyšší u pacientů s klinickou hyperfunkcí štítné žlázy (13,3 %) oproti těm s normální funkcí (2,3 %). U pacientů se subklinickou hyperfunkcí byla prevalence 12,7 %, což potvrzuje předchozí tvrzení, že i tito pacienti jsou ve větším riziku. Existuje také celá řada studií, které zkoumají vliv TSH supresní terapie na kostní metabolismus, zejména pak na kostní denzitu. Výsledky těchto studií se mírně liší v závislosti na typu studie, počtu a typu pacientů a délce sledování. Proto zde pro zjednodušení vycházíme z metaanalýz těchto studií, které se povšechně shodují na tom, že významný vliv na riziko rozvoje osteoporózy a fraktur existuje pouze u postmenopauzálních žen, u ostatních skupin pacientů nebyl tento efekt prokázán (18–19). V neposlední řadě byl také observován negativní psychosociální vliv chronické hypertyreózy s vyšším výskytem úzkostných, depresivních a kognitivních poruch, které mohou výrazně ovlivnit kvalitu života nemocného (20).
Management terapie
Z výše uvedeného vyplývá, že přístup ke každému pacientovi s DTC po úvodní chirurgické terapii (event. s následnou aplikací radiojodu) by měl být individuální a rozhodnutí o zahájení a míře TSH suprese by mělo vyplynout z porovnání rizika rekurence onemocnění a rizika rozvoje komplikací supresní léčby. Samotné vedení supresní terapie pak spočívá ve dvou krocích. Prvním z nich je zahájení terapie dle iniciálního rizika (Tab. 1) a druhým je vedení dlouhodobé terapie dle léčebné odpovědi (Tab. 2). V obou krocích máme k dispozici doporučené postupy (2), které nám pomohou se stratifikací pacientů do jednotlivých rizikových skupin a poměrně jasně určují cílové TSH v dané situaci (Tab. 3). Doporučené postupy byly vypracovány na podkladě konsenzu odborníků, síla důkazů vyjma pacientů s vysokým rizikem není příliš velká, a proto i tyto doporučené postupy dávají v některých situacích prostor pro individuální přístup. Terapii typicky zahajujeme supresní dávkou 2–2,2 μg/kg, kterou pak dále upravujeme dle kontrolních hodnot TSH. Dosáhnutí stabilní cílové hladiny TSH nebývá vždy snadné. V potaz musíme vzít i další faktory ovlivňující léčbu, mezi které patří například biologická dostupnost levothyroxinu, lékové interakce a nezanedbatelná může být také nonkompliance pacienta. Zvláštní postavení zaujímají mikrokarcinomy štítné žlázy (< 10 mm v největším rozměru), které jsou se zdokonalujícími se zobrazovacími metodami stále častějším problémem. I u mikrokarcinomů je vhodná iniciální stratifikace dle ATA, naprostá většina z nich připadne do kategorie nízkého rizika. V takovém případě je léčbou volby většinou lobektomie či totální thyreoidektomie bez následného podání radiojódu a TSH lze udržovat nesuprimované v dolní polovině fyziologického rozmezí.
Tab. 1. Vstupní stratifikace rizika dle ATA 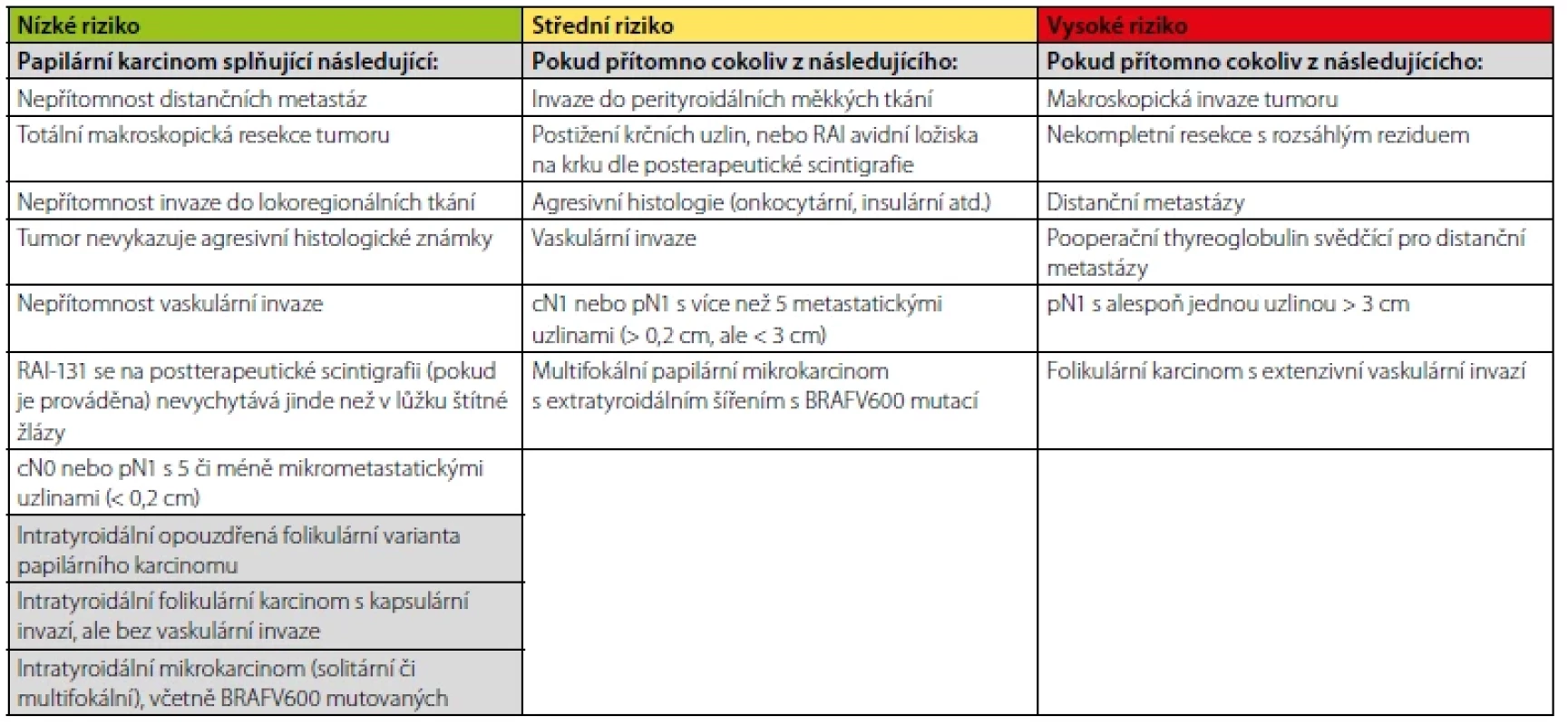
Tab. 2. Klasifikace léčebné odpovědi 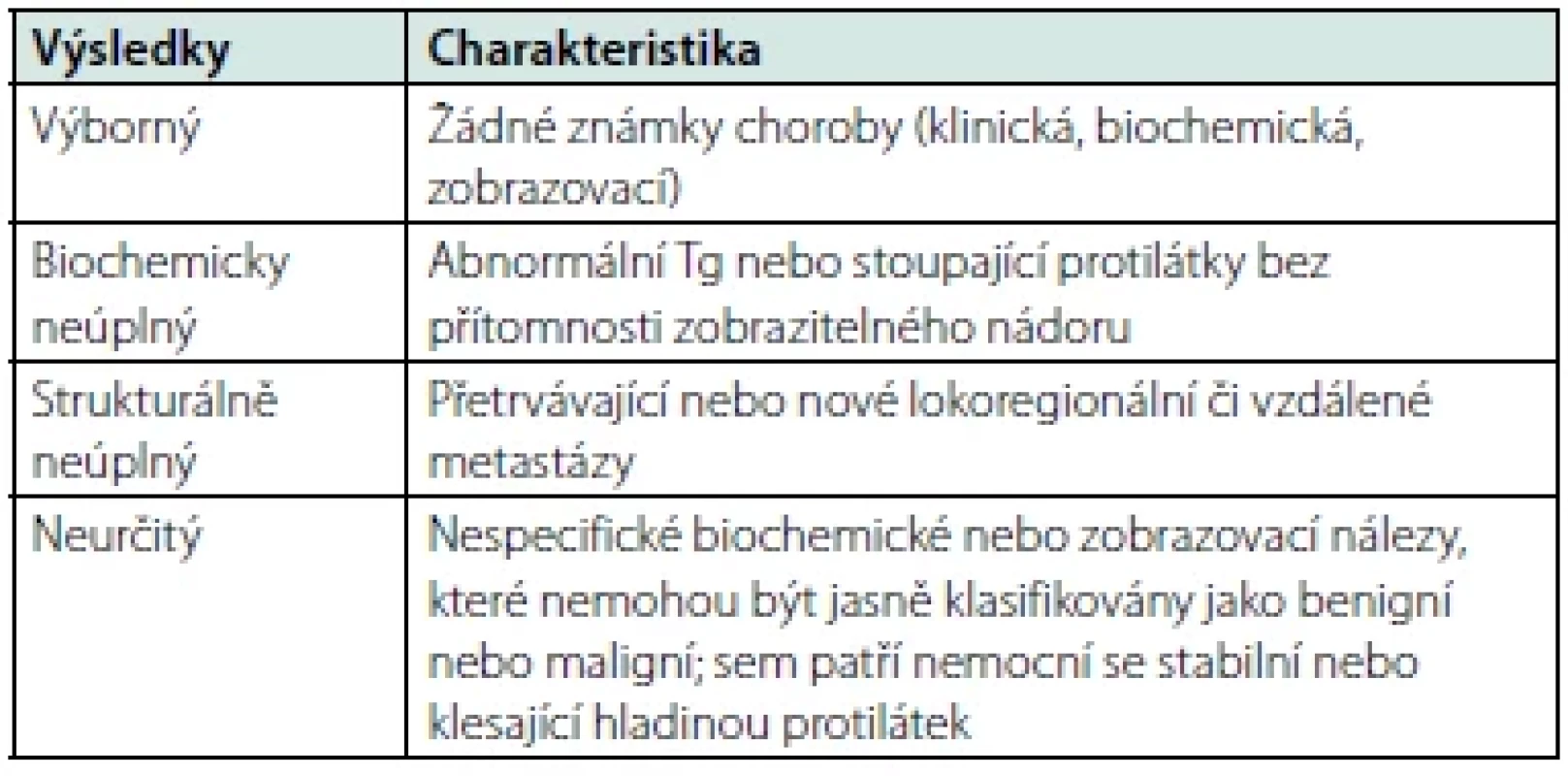
Tab. 3. Cílová suprese TSH dle léčebné odpovědi a rizikových faktorů pacienta 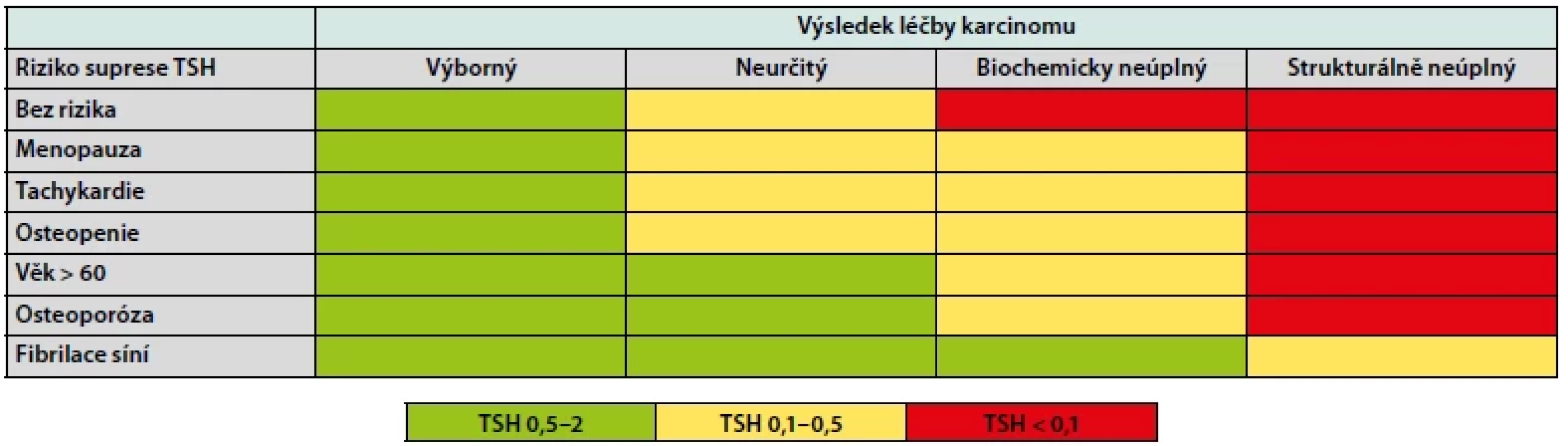
Závěr
Přestože je supresní terapie levothyroxinem v klinické praxi používána již přes 80 let, chybí přesvědčivé důkazy o jejím vlivu na přežití u pacientů s DTC s nízkým a středním rizikem, u pacientů s vysokým rizikem. Naproti tomu u pacientů s vysokým rizikem je její role v pooperačním managementu zcela jistě nesporná. S ohledem na potenciální komplikace této léčby je o to důležitější vstupní stratifikace pacientů s DTC a následně uvážená indikace supresní terapie. Pokud je indikována, pak by měl být při následném sledování pacienta kladen důraz na časté a precizní přehodnocování léčebné odpovědi se snahou o maximální možnou redukci dávky levothyroxinu a zkrácení doby, po kterou udržujeme supresi TSH. Před zahájením léčby je vždy nutno zhodnotit preexistující komorbidity pacienta a během léčby cíleně pátrat po možných nežádoucích účincích. Léčebná strategie by pak měla být založena na těchto faktorech a flexibilním, individualizovaném přístupu k pacientovi.
MUDr. Jan Drugda
Fakultní nemocnice Hradec Králové a Univerzita Karlova, Lékařská fakulta v Hradci Králové
jan.drugda@fnhk.cz
Cit. zkr: Vnitř Lék. 2023;69(2):128-131Článek přijat redakcí: 31. 1. 2023
Článek přijat po recenzích: 13. 3. 2023
Zdroje
1. Kimura T, Van Keymeulen A, Golstein J, et al. Regulation of thyroid cell proliferation by TSH and other factors: a critical evaluation of in vitro models. Endocr Rev. 2001;22(5):631 - 56. Available from: DOI:<https://doi.org/10.1210/edrv.22. 5. 0444>.
2. Haugen BR, Alexander EK, Bible KC, et al. 2015 AmericanThyroidAssociation Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. Available from: DOI:<https://doi. org/10.1210/edrv.22. 5. 0444>.
3. Bruno R, Ferretti E, Tosi E, et al. Modulation of thyroid‑specific gene expression in normal and nodular human thyroid tissues from adults: an in vivo effect of thyrotropin. J. Clin. Endocrinol. Metab. 2005;90(10):5692-7. Available from: DOI:<https://doi.org/10.1210/jc.2005 - 0800>.
4. Biondi B, Filetti S, Schlumberger M. Thyroid‑hormone therapy and thyroid cancer: a reassessment. Nat. Clin. Pr. Endocrinol.Metab. 2005;1(1):32-40. Available from: DOI:<https:// doi.org/10.1038/ncpendmet0020>.
5. Ferrari SM, Fallahi P, Elia G, et al. Thyroid autoimmune disorders and cancer. Seminars in Cancer Biology 2020;64 : 135-146. Available from: DOI:<https://doi.org/10.1016/j.semcancer. 2019. 05. 019>.
6. Boelaert K, Horacek J, Holder RL, et al. Serum Thyrotropin Concentration as a Novel Predictor of Malignancy in Thyroid Nodules Investigated by Fine‑Needle Aspiration. J Clin Endocrinol Metab. 2006;91(11):4295-301. Available from: DOI:< https://doi.org/10.1210/ jc.2006-0527>.
7. Soh EY, Sobhi SA, Wong MG, et al. Thyroid‑stimulating hormone promotes the secretion of vascular endothelial growth factor in thyroid cancer cell lines. Surgery. 1996;120(6):944 - 7. Available from: DOI:<https://doi.org/10.1016/S0039-6060(96)80038-9>.
8. McGriff NJ, Csako G, Gourgiotis L, et al. Effects of thyroid hormone suppression therapy on adverse clinical outcomes in thyroid cancer. Ann Med. 2002;34(7-8):554-64. Available from: DOI:<https://doi.org/10.1080/078538902321117760>.
9. Sugitani I, Fujimoto Y, Does postoperative thyrotropin suppression therapy truly decrease recurrence in papillary thyroid carcinoma? A randomized controlled trial. J Clin Endocrinol Metab. 2010;95(10):4576-83. Available from: DOI:<https://doi.org/10.1210/jc.2010-0161>.
10. Klubo‑Gwiezdzinska J, Auh S, Gershengorn M, et al. Association of thyrotropin suppression with survival outcomes in patients with intermediate – and high‑risk differentiated thyroid cancer. JAMA Netw Open. 2019;2(2):e187754. Available from: DOI:<https://doi. org/10.1001/jamanetw orkopen.2018.7754>.
11. Cooper DS, Specker B, Ho M, et al. Thyrotropins uppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid. 1998;8(9):737-44. Available from: DOI:< http:// doi.org/10.1089/thy.1998. 8. 737>.
12. Diessl S, Holzberger B, Mader U, et al. Impact of moderate vs stringent TSH suppression on survival in advanced differentiated thyroid carcinoma. Clin Endocrinol (Oxf). 2012;76(4):586-92. Available from: DOI:<https://doi.org/10.1111/j.1365-2265.2011.04272.x>.
13. Ito Y, Masuoka H, Fukushima M, et al. Prognosis and prognostic factors of patients with papillary carcinoma showing distant metastasis at surgery (M1 patients) in Japan. Endocr J. 2010;57(6):523-31. Available from: DOI:<https://doi.org/10.1507/endocrj.K10E-019>.
14. Shargorodsky M, Serov S, Gavish D, et al. Long‑term thyrotropin‑suppressive therapy with levothyroxine impairs small and large artery elasticity and increases left ventricular mass in patients with thyroid carcinoma. Thyroid. 2006 Apr;16(4):381-6. Available from: DOI:<https://doi.org/10.1089/thy.2006. 16. 381>.
15. Biondi B, Fazio S, Cuocolo A, et al. Impaired cardiac reserve and exercise capacity in patients receiving long‑term thyrotropin suppressive therapy with levothyroxine. J Clin Endocrinol Metab. 1996;81(12):4224-8. Available from: DOI:< https://doi.org/10.1210/ jcem.81. 12. 8954019>.
16. Watanabe H, Ma M, Washizuka T, et al. Thyroid hormone regulates mRNA expression and currents of ion channels in rat atrium. Biochem Biophys Res Commun. 2003 Aug 29;308(3):439-44. Available from: DOI:<https://doi.org/10.1016/S0006-291X(03)01420-7>.
17. Auer J, Scheibner P, Mische T, et al. Subclinical hyperthyroidism as a risk factor for atrial fibrillation. AmHeart J. 2001;142(5):838-42. Available from: DOI: <https://doi.org/10.1067/ mhj.2001.119370>.
18. Brancatella A, Marcocci C. TSH suppressive therapy and bone. Endocr Connect. 2020;9(7):R158-R172. Available from: DOI: <https://doi.org/10.1530/EC-20-0167>.
19. Yoon BH, Lee Y, Oh HJ, et al. Influence of Thyroid‑stimulating Hormone Suppression Therapy on Bone Mineral Density in Patients with Differentiated Thyroid Cancer: A Meta‑analysis. J Bone Metab. 2019;26(1):51-60. Available from: DOI:<https://doi.org/10.11005/ jbm.2019. 26. 1.51>.
20. Tagay S, Herpertz S, Langkafel M, et al. Health‑related quality of life, anxiety and depression in thyroid cancer patients under short‑term hypothyroidism and TSH‑suppressive levothyroxine treatment. Eur J Endocrinol. 2005;153(6):755-63. Available from: DOI:<https:// doi.org/10.1530/eje.1.02047>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hlavní téma – kardiologieČlánek Novinky v imunologii
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Dopady nekontrolované hypertenze na CNS
- Dávkování základní farmakoterapie a jeho vliv na prognózu pacientů hospitalizovaných pro srdeční selhání
- Možnosti léčby bolesti u osteoartrózy
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
- Novinky v imunologii
- Hlavní téma – kardiologie
- Kam kráčí preventivní kardiologie?
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v diagnostice a léčbě kardiomyopatií
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Novinky v diagnostice a léčbě kardiomyopatií
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v imunologii
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



