-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní poškození ledvin vlivem antimikrobiální terapie
Acute kidney injury due to antimicrobial therapy
One of the common causes of acute kidney injury (AKI) is drug nephrotoxicity. A large group of drugs associated with AKI includes a considerable number of antimicrobials. Clinical manifestations range from mild forms of tubular damage to significant deterioration of renal function requiring renal replacement therapy. Several mechanisms have been described, although the most common are acute interstitial nephritis, acute tubular necrosis, crystalic nephropathy or proximal/distal tubulopathy with electrolyte abnormalities. General risk factors for antimicrobial-induced AKI include pre-existing chronic kidney disease and concomitant use of drugs with nephrotoxic potential. Prevention and early recognition of AKI are the standard approach to mitigate AKI and avoid morbidity.
Keywords:
Vancomycin – antibiotics – acute kidney injury – aminoglycosides
Autoři: Viktor Klementa 1; Naděžda Petejová 2; Josef Zadražil 1; Pavel Horák 1; Jitka Prošková 3; Olga Klementová 4
Působiště autorů: III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc 1; Interní a kardiologická klinika LF a FN Ostrava 2; oddělení klinické biochemie FN Olomouc 3; Klinika anesteziologie, resuscitace a intenzivní medicíny LF UP a FN Olomouc 4
Vyšlo v časopise: Vnitř Lék 2022; 68(4): 227-233
Kategorie: Přehledové články
Souhrn
Jednou z častých příčin akutního poškození ledvin (AKI – acute kidney injury) je léková toxicita. Do široké skupiny léků spojených s AKI se řadí také velká část antimikrobiálních látek. Klinické projevy sahají od mírných forem tubulárního poškození až po významné zhoršení funkce ledvin vyžadující akutní náhradu jejich funkce. Z patogenetického hlediska se nejčastěji jedná o akutní intersticiální nefritidu, akutní tubulární nekrózu, krystalovou nefropatii či proximální/distální tubulopatii s abnormalitami v elektrolytovém hospodářství. Obecné rizikové faktory pro AKI vyvolané antimikrobiálními látkami zahrnují již existující chronické onemocnění ledvin a současné užívání léků s nefrotoxickým potenciálem. Prevence a včasné rozpoznání časných stadií poškození ledvin představují standardní přístup ke zmírnění progrese AKI a snížení morbidity.
Klíčová slova:
antibiotiká – akutní poškození ledvin – vankomycin – aminoglykosidy
Úvod
S akutním poškozením ledvin (AKI – acute kidney injury) se v klinické praxi setkáváme relativně často. Ve smyslu akutní komplikace různého stupně závažnosti doprovází jiné klinické stavy napříč mnoha obory klinické medicíny. Je to dáno především tím, že ledviny jsou náchylné k poškození vzhledem k jejich fyziologické funkci, kdy jimi protéká kolem 25 % srdečního výdeje (1). To znamená, že jsou ve velké míře vystaveny celé řadě léků a výrazně se v nich zvyšuje farmakologická dostupnost ve srovnání s ostatními tkáněmi. Téměř čtvrtina akutních renálních poškození je způsobena polékově (2). Za významnou část mohou antibiotika. Dále se ukazuje, že iatrogenní polékové poškození ledvin může za prodloužení doby hospitalizace, zvýšení mortality a celkový nárůst léčebných nákladů (3). Proto je velmi důležité dodržování nefroprotektivních opatření, mezi která řadíme dostatečnou hydrataci, pravidelné kontroly renálních funkcí, měření sérových hladin léků s případnou úpravou jejich dávky. Pokud je to možné, snažíme se vyvarovat zejména kombinace potenciálně nefrotoxických léků.
Akutní poškození ledvin je charakterizováno náhle vzniklou sníženou schopností ledvin odstraňovat produkty metabolismu, následkem čehož dochází k retenci dusíkatých metabolitů, minerálovým dysbalancím a hromadění přebytečné tekutiny v organismu. Jedná se o relativně častý klinický stav, který vede k výraznému zhoršení mortality a morbidity především u kriticky nemocných pacientů.
Diagnostika a klasifikace AKI
Poškození ledvin obecně klasifikujeme jako AKI, které vzniká do 7 dní od inzultu, anebo AKD (acute kidney disease) vznikající do 90 dní. Pokud dojde k přechodu do chronického stadia, označujeme toto poškození jako CKD (chronic kidney disease). Pro hodnocení AKI v klinické praxi používáme několik klasifikačních schémat, přičemž nejvíce využívaným je klasifikace dle AKIN (Acute Kidney Injury Network), podle které je AKI definováno jako zvýšení sérového kreatininu o 26,5 μmol/l (≥ 0,3 mg/dl) během 48 hodin nebo zvýšení sérového kreatininu 1,5× ve srovnání s výchozí hodnotou, která není starší než 7 dní nebo jako snížení množství moči pod 0,5 ml/kg/hod po dobu 6 hodin. Dle tíže poté dělíme AKI do tří stupňů (4).
Etiologie a epidemiologie akutního polékového poškození ledvin
Akutní poškození ledvin dělíme podle patogeneze na prerenální (snížení renálního perfuzního tlaku), intrarenální (patologické změny na úrovni cév, glomerulů nebo tubulů a intersticia) a postrenální (obstrukce urotraktu), mnohdy však dochází ke kombinaci jednotlivých příčin. Z epidemiologického hlediska se AKI dělí na komunitně získané, v nemocnici získané a na poškození ledvin u kriticky nemocných. U všech těchto typů může také dojít k polékovému AKI.
Incidence AKI u kriticky nemocných pacientů se pohybuje kolem 20–30 %, přičemž podávání nefrotoxické terapie je odpovědné až za čtvrtinu těchto případů (5). Léčivé přípravky mohou způsobit poškození ledvin přímým účinkem na cévy, glomeruly, tubulární epitelie nebo intersticium. Patologický mechanismus však může být také nepřímý, kdy dochází k ovlivnění průtoku krve ledvinami a hemodynamických poměrů v glomerulech. Nejzávažnější formou poškození ledvin je akutní tubulární nekróza (ATN). Můžeme se však setkat také s akutní intersticiální nefritidou (TIN), krystalovou nefropatií či osmotickou nefrózou. Vzhledem k tomu, že u antibiotik, jejichž nefrotoxický potenciál je závislý na dávce (glykopeptidy, aminoglykosidy, polymyxiny) lze předejít potencionálnímu poškození ledvin s případnými nezvratnými komplikacemi, musíme svou pozornost věnovat komplexní péči včetně pečlivého a opakovaného stanovení renálních funkcí na základě měření sérového kreatininu a diurézy a vyvarování se kombinací s jinými látkami s možným nefrotoxickým potenciálem. V klinické praxi je etiologie AKI často multifaktoriální, kombinující více rizikových faktorů, které společně přispívají k dalšímu progredujícímu zhoršování ledvinných funkcí. Mezi nejčastější rizikové faktory řadíme pokročilý věk pacientů, hypovolemii, srdeční a jaterní onemocnění, malignity, diabetes mellitus, intoxikace, lékovou toxicitu, anémii a chirurgické výkony. Navíc značná část pacientů podstoupí i radiologické zobrazovací metody s použitím jodové kontrastní látky. Z výše uvedeného vyplývá, že etiologických činitelů může být přítomno více současně, proto je důležité jejich co nejčasnější odhalení.
Tab. 1. Klasifikace akutního poškození ledvin podle AKIN, upraveno dle KDIGO Clinical Practice Guideline for Acute Kidney Injury 2012 (4) 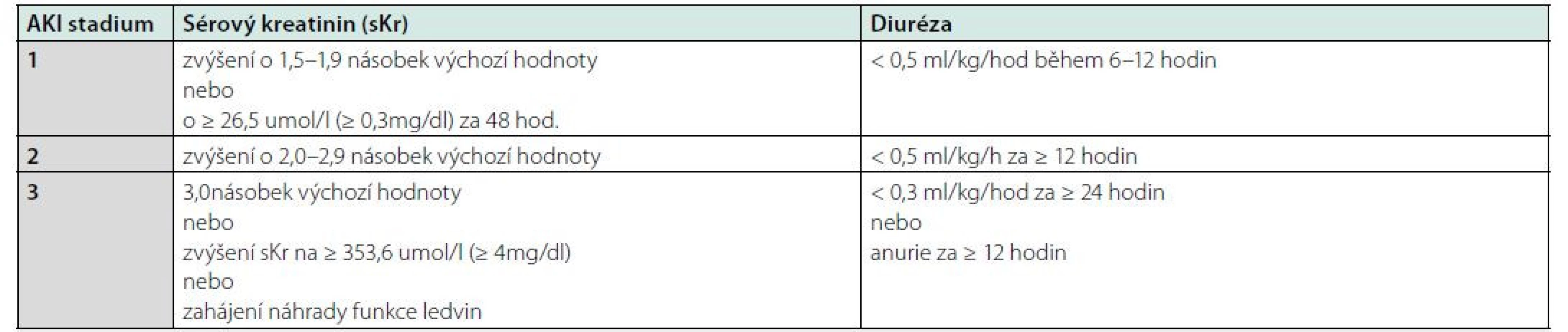
AKI – akutní poškození ledvin, sKr – sérový kreatinin Polékové akutní poškození ledvin
Poškození ledvin vyvolané léky se může projevit jen mírnou formou akutní tubulo‑intersticiální nefritidy, o něco závažnější glomerulonefritidou, krystalickou nefropatií nebo osmotickou nefrózou až těžkou poruchou renálních funkcí při akutní tubulární nekróze, v krajních případech s nutností využití mimotělních očišťovacích metod krve. Jedná se o relativně časný problém především při podávání nesteroidních antiflogistik, inhibitorů protonové pumpy a antimikrobiální terapie s tím, že největší zátěží pro ledviny jsou aminoglykosidy, vankomycin a polymyxiny. Tyto léky mohou v závislosti na dávce vést až ke vzniku akutní tubulární nekrózy anebo apoptózy, především při účasti dalších potenciálně rizikových faktorů pro nefrotoxicitu. Navíc celá řada léčiv užívaných v akutní péči může způsobit akutní TIN, dle některých studií se jedná až o 60–70 % ze všech případů akutních tubulointersticiálních nefritid (6).
Antimikrobiální terapie a AKI
Mezi antimikrobiální látky řadíme substance biologického nebo syntetického původu, které působí selektivně toxicky proti bakteriím, s výhodou je tedy používáme k léčbě infekcí. Podle účinku je lze dělit na baktericidní, které usmrcují mikroorganismy přímo nebo bakteriostatické, které znemožňují jejich růst a množení (7).
Velká část antibiotik užívaných v ambulantní praxi patří mezi relativně málo nefrotoxické, proto většinou není potřeba výraznější úprava jejich dávkování. Závisí však také na způsobu eliminace, přičemž některá antibiotika mohou při snížené glomerulární filtraci negativně působit i na jiné orgány (např. neurotoxicita, typicky u karbapenemů) (8). Naopak při přílišné redukci dávky je nutné myslet na případné riziko selhání terapie, což by mohlo mít pro pacienta závažnější následky způsobené rozvíjejícími se infekčními komplikacemi, zvláště u kriticky nemocných pacientů v septickém stavu. Z antibiotik, která nejčastěji používáme v ambulantním režimu je třeba myslet na riziko nefrotoxicity u sulfonamidů, které mohou vést při nedostatečné hydrataci k obturaci tubulů. Proto je nutné pacienty poučit o potřebě hojného příjmu tekutin. Mezi další antimikrobiální terapii, která může vést k poškození ledvin, řadíme zejména aminoglykosidy, glykopeptidy, polymyxiny. Méně toxické jsou karbapenemy, makrolidy anebo léky patřící do skupiny antituberkulotik.
Tab. 2. Formy polékového akutního poškození ledvin 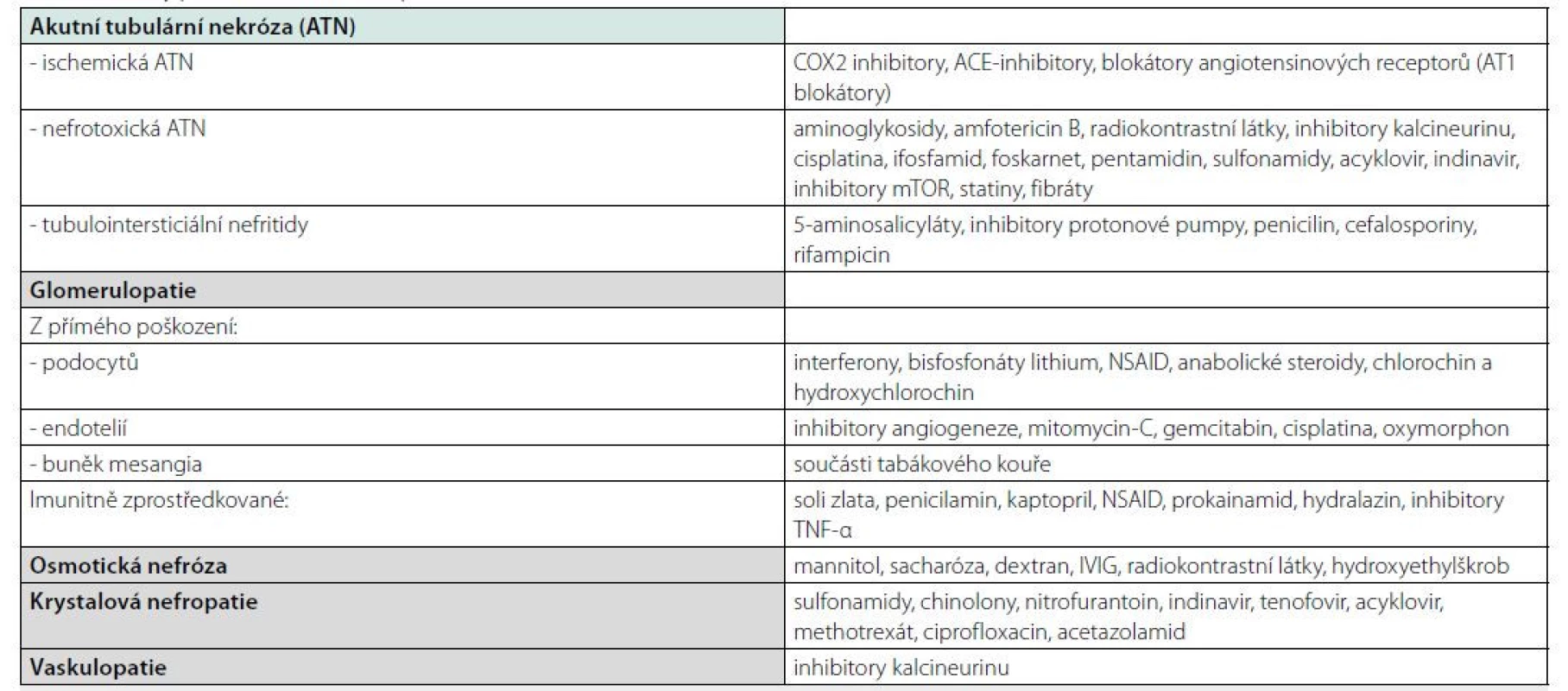
Přehled léčivy indukovaných patologických jednotek v renálním parenchymu, upraveno dle Kolečková M, Tichý T. Polékové poškození ledvin. Klin. Farmakol. Farm. 2018 Aminoglykosidy
Jedná se o skupinu látek, které velmi dobře fungují jako širokospektrá, na koncentraci závislá baktericidní antibiotika s účinkem převážně na gram – negativní patogeny, přičemž účinnost léčby je hodnocena podle farmakodynamického parametru - Cmax/MIC 8–10 : 1. Nejčastěji je používáme v kombinaci s jinou antibiotickou terapií pro jejich výhodný synergický účinek (např. s betalaktamovými antibiotiky) (9). Efektivita aminoglykosidů je dána jejich farmakologickými vlastnostmi, především post antibiotickým efektem, který trvá řádově několik hodin, a také účinností závislou na dávce, kdy dochází k efektivnější eliminaci patogenů s vyšší dávkou antibiotik. Maximální sérové koncentrace je dosaženo přibližně 30–60 minut po intravenózním podání. Přibližně 99 % podané dávky se vylučuje v nezměněné podobě močí, primárně glomerulární filtrací. U pacientů s normální renální funkcí je poločas vylučování kolem 2–3 hodin s tím, že je výrazně prodloužen u novorozenců, dětí a nemocných se sníženou renální funkcí (10). Vynikající účinnost aminoglykosidů je do jisté míry vykoupena nežádoucími účinky, mezi které patří hlavně ototoxicita a nefrotoxicita. Jednotlivé látky se liší stupněm nefrotoxicity, přičemž nejvíce toxický je neomycin, následně toxicita klesá od gantamicinu, tobramycinu, amikacinu až ke streptomycinu (11, 12). Patofyziologický účinek těchto antibiotik na renální tkáň spočívá v jejich akumulaci v mesangiu a v epiteliálních buňkách proximálního tubulu, kde zčásti podléhá tubulární resorpci při vazbě na receptory megalin a cubilin. Uvnitř buněk způsobují změny v jejich struktuře a funkci negativním vlivem na mitochondrie, lysozomy a endoplasmatické retikulum, což ve výsledku může vést až k akutní tubulární nekróze (13). Následkem toho dochází k dalším změnám včetně aktivace zánětu, které souvisí s postupně se snižující glomerulární filtrací a poškozením tubulů. K dalšímu poškození ledvin přispívá také aminoglykosidy vyvolaná vazokonstrikce (14). Celkově se jedná o velmi komplexní patofyziologický proces.
Jako nejúčinnější preventivní opatření ke snížení nefrotoxického působení uvedených léků lze využít úpravy aplikované dávky, případně prodloužení časového intervalu mezi jednotlivými dávkami. U pacientů s AKI je doporučováno dávkování aminoglykosidů 1×/24 hod. Velmi vhodné je také nepřekračovat celkovou dobu antibiotické terapie více, než je nezbytně nutné, a v neposlední řadě také pečlivě monitorovat sérové koncentrace aminoglykosidů. Vzhledem k tomu, že molekuly aminoglykosidů jsou relativně malé a v plazmě se minimálně váží na bílkoviny, lze je relativně efektivně odstranit hemodialýzou, přičemž za hodinu snížíme celkovou koncentraci v séru přibližně o 15 % (10). Doporučená dávka gentamicinu je 3–6 mg/kg u dospělých, amikacinu pak 15 mg/kg. Dávky u pacientů s pokročilou renální insuficiencí, případně u dialyzovaných pacientů je nutné redukovat, ideálně za měření jejich sérové koncentrace.
Glykopeptidy
Nejvýznamnější účinnou látkou z této skupiny je vankomycin. Jedná se o glykopeptidové baktericidní antibiotikum, které používáme při léčbě závažných infekcí způsobených převážně gram‑pozitivními mikroorganismy, včetně methicilin rezistentních kmenů Staphylococcus aureus (MRSA). Při perorálním podání se nevstřebává z gastrointestinálního traktu, působí jen lokálně, proto se vancomycin v této formě používá k terapii clostridiové enterokolitidy. Pro dosažení systémového účinku jej podáváme intravenózně. Distribuce vankomycinu je široká s uváděným distribučním objemem od 0,4 do 1,0 l/kg (15). Účinek vankomycinu je nezávislý na jeho koncentraci. Požadovaného baktericidního efektu lze dosáhnout, pokud se plocha pod 24hodinovou křivkou časové koncentrace vankomycinu k minimální inhibiční koncentraci patogenu (AUC/MIC) blíží nebo je vyšší než 400 mg/hod/l. Údaje in vitro navíc naznačují, že AUC < 400 mg/ hod/L potencuje vznik rezistence S. aureus vůči meticilinu (MRSA) a vankomycin‑intermediálních kmenů S. aureus (15). Eliminace léku probíhá primárně glomerulární filtrací s následnou renální exkrecí a její rychlost tedy závisí na stupni renální insuficience. Incidence akutního renálního poškození při této terapii může být až 40% (16). Hlavním patofyziologickým mechanismem negativně působícím na renální buňky je akutní tubulární poškození vyvolané oxidačním stresem. V současné době lze nalézt velké množství vědeckých prací zabývajících se nefrotoxicitou vankomycinu, nicméně řada z nich je limitována především nedostatečnou relevancí kontrolní skupiny. To vyplývá především z toho, že glykopeptidovou ATB terapii užíváme u pacientů často ve velmi závažném klinickém stavu, u kterých se na případném vzniku AKI většinou podílí další faktory, jako sepse, vyšetření pomocí zobrazovacích metod s využitím kontrastní látky. Dalším nedostatkem se zdá být sérová koncentrace vankomycinu, kterou často využíváme jako míru jeho toxicity s tím, že čím je vyšší, tím předpokládáme také větší lékovou toxicitu. Sérová koncentrace velmi závisí na glomerulární filtraci s tím, že asi 75–90 % vankomycinu se vyloučí do moči právě glomerulární filtrací. V klinické praxi vídáme případy, kdy poškození ledvin z jakékoli jiné příčiny vede k vyšším hladinám tohoto léku v séru a poté následně k nesprávným závěrům při hodnocení etiologie akutního poškození ledvin a vankomycinové nefrotoxicity. Z toho vyplývá ne zcela jasný průkaz, zda vyšší dávka tohoto antibiotika, případně jeho vyšší sérová koncentrace vede ke zvýšenému riziku AKI. V neposlední řadě ke složitosti hodnocení nežádoucích účinků glykopeptidů na ledvinné funkce přispívá multifaktoriální etiologie akutního poškození ledvin u pacientů, u kterých je právě vankomycin indikován (17). Z výše popsaného vyplývá, že nadále nejlepší prevencí glykopeptidové nefrotoxicity je pravidelný terapeutický monitoring léčiva (TDM) a dostatečná hydratace pacienta s pečlivým sledováním diurézy. Při závažném poškození ledvin etiologicky souvisejícím s vankomycinem lze využít hemodialyzační eliminační metody s využitím vysokopropustných tzv. high‑flux membrán (18). Pokud však chceme zachovat určité množství účinné látky, tak spíše preferujeme low‑flux (nízkopropustné) membrány, při jejichž použití nedochází k odstranění tak velkého množství antibiotika. Medián odstranění vankomycinu při nízkopropustné membránové dialýze je přibližně 17 % a při vysokopropustné membránové dialýze dosahoval až 31 % (19). Dle recentních studií, které se soustředily na toto antibiotikum, existuje střední síla důkazů, že terapie vede k většímu riziku akutního poškození ledvin, nicméně celkový význam není příliš velký ve srovnání s látkami, které jednoznačně vedou k poškození ledvin, jako aminoglykosidy nebo amfotericin B. Na druhou stranu u pacientů léčených vankomycinem, u kterých se současně vyvine AKI, se toto antibiotikum na jeho etiologii podílí přibližně z 50%. Úvodní dávkování vankomycinu je nejčastěji 20 - 25 mg/kg, nicméně nepodáváme více než 3 g, a to ani u velmi obézních pacientů. Současně musíme myslet na redukci dávky u pacientů s pokročilým stadiem chronické renální insuficience. Podrobnější informace lze nalézt v SPC (souhrn údajů o léčivém přípravku).
Polymyxiny
Z této skupiny antibiotik jsou nejznámější polymyxin B a polymyxin E (neboli kolistin). Jedná se polypeptidová baktericidní antibiotika, která se váží na fosfolipidy a lipopolysacharidy tvořící vnější buněčné membrány gramnegativních bakterií, následkem toho dochází k narušení buněčné stěny a lýze patogenů (20). Jejich nevýhodou je vyšší toxicita, proto nejsou indikována jako antibiotika první volby, s výhodou je však užíváme u polyrezistentních kmenů bakterií, kde selhává léčba ostatními antibiotiky, například při léčbě infekcí vyvolaných Pseudomonas aeruginosa nebo různými kmeny Enterobakterií (např. karbapenem - rezistentních). Mezi jejich nežádoucí účinky patří hypersenzitivní reakce, neurotoxicita a především nefrotoxicita. V nejtěžších případech může dojít až k akutnímu oligourickému renálnímu poškození na podkladě závažné ATN. Z tohoto důvodu je nutná pravidelná monitorace funkcí ledvin v průběhu léčby colistinem, eventuálně v případě dostupnosti použití TDM. Incidence nefrotoxicity se pohybuje od 20 do 60 % (21). Tento široký rozptyl je způsoben obtížným klinickým hodnocením toxicity těchto antibiotik u kriticky nemocných pacientů, u kterých se na renálním poškození spolupodílí často mnoho dalších faktorů. V případě, že zjistíme zhoršující se ledvinné funkce při terapii kolistinem, měli bychom redukovat podávané dávky. Nicméně vzhledem k tomu, že polymyxiny jsou indikovány u těžkých infekcí způsobených multirezistentními kmeny patogenů, je rozhodnutí o redukci dávky, případně o úplném vysazení těchto antibiotik vždy obtížné. Musíme postupovat individuálně a zvážit všechna rizika spojená s vysazením léčby na jedné straně a rozvojem akutního poškození ledvin na straně druhé.
Beta‑laktamová antibiotika
Jedná se o skupinu baktericidních antibiotik, do které řadíme peniciliny, cefalosporiny, monobaktamy a karbapenemy. Jejich společným znakem je přítomnost β - laktamového kruhu. Mechanismus účinku spočívá v jejich vazbě na bakteriální transpeptidázy či karboxypeptidázy podílející se na syntéze buněčné stěny bakterie s její následnou autolýzou a smrtí buňky (22). Tato antibiotika vykazují časově závislý účinek, což znamená, že antimikrobiální účinek je stejný jak u vysoké dávky, tak u dávek těsně nad hodnotou MIC. Proto je důležité udržovat jejich hladinu nad MIC, co možná nejdéle. Antimikrobiální spektrum účinnosti β‑laktamových antibiotik je ovlivněno fyzikálně‑chemickými faktory spojenými s jejich strukturou. Obecně platí, že lipofilita podporuje aktivitu vůči grampozitivním bakteriím, zatímco hydrofilita podporuje působení vůči bakteriím gramnegativním (22).
Nejčastějším nežádoucím účinkem beta‑laktamových antibiotik je rozvoj systémové alergické reakce s tím, že v ledvinách může vzniknout akutní TIN na podkladě na dávce nezávislé alergické imunitní reakce. K uvedenému jevu zpravidla dochází jen velmi vzácně, může se však projevit i s latenci po podání antibiotik. Pokud k rozvoji TIN přeci jen dojde, jeho prognóza je většinou dobrá, i když se jedná o závažný stav. V laboratorních odběrech nalézáme především zhoršení ledvinných funkcí s malou proteinurií, eosinofilurií a neglomerulární erytrocyturií. Klinický obraz bývá nespecifický s febriliemi, kožními změnami (rash) a někdy artralgiemi. Akutní TIN léčíme okamžitým vysazením vyvolávající antibiotické terapie s tím, že pacient by ji již nikdy neměl dostat. Pokud je efekt nedostatečný, je možné zvážit podání kortikoidů (23). Riziko nefrotoxicity u antibiotik s beta‑laktamovým kruhem klesá postupně v řadě: karbapenemy, cefalosporiny, peniciliny a monobaktamy. Z klinické praxe je důležitá informace, že se relativně často používá kombinované podání piperacilin/tazobactamu s vankomycinem. Podle výsledků z recentních experimentálních a klinických studií je zřejmé, že tato dvojkombinace vede ke zvýšenému riziku vzniku akutního poškození ledvin. (více než 16 %) (24, 25). Nejen, že je toto riziko přibližně 3× větší ve srovnání s dvojkombinací vankomycinu s cefepimem, ale také k ledvinnému poškození dochází rychleji (3 oproti 5dnům, P < 0,001) (26). Jednotlivé druhy antibiotik podle jejich farmakokinetických vlastností a typu metabolismu jsou v různé míře eliminovány hemodialýzou či jinou náhradou funkce ledvin.
Makrolidy
Makrolidy jsou skupinou bakteriostatických antibiotik, jež jsou s výhodou užívána především k léčbě komunitních respiračních infekcí včetně infekcí mykobakteriemi, mykoplasmaty či chlamydiemi. Bakteriostatický efekt spočívá ve vazbě na ribozomy patogenů, ve kterých vstupují do kaskády syntézy proteinů. Mezi novější substance řadíme azitromycin a klaritromycin, které jsou odvozené od staršího erytromycinu. Mají výhodnější farmakokinetické a farmakodynamické parametry včetně ulehčené perorální absorpce, prodlouženého účinku a lepšího průniku do patogenů. Jejich eliminace je převážně hepatálního typu. Z této skupiny antibiotik je popsáno možné poškození ledvin u azitromycinu, clarithromycinu, erythromycinu a roxithromycinu. Terapie makrolidy vede ke vzniku AKI relativně vzácně. V případě, že k tomuto nežádoucímu účinku dojde, jeho relativní záludnost spočívá v tom, že se AKI projeví až s odstupem 2–6 týdnů od dokončení ATB terapie (27, 28). Mechanismus poškození ledvin spočívá v imunitně zprostředkované hypersenzitivní reakci se vznikem akutní TIN (29). Při důvodném podezření na polékovou etiologii probíhajícího AKI je vhodné v těchto případech zvážit podání malé dávky kortikoidů (např. prednison 0,2–0,3 mg/kg) s postupnou pomalou detrakcí v průběhu několika týdnů (30). Pro klinickou praxi je navíc velmi důležité pamatovat na to, že průběh AKI u opakovaného podávání makrolidů může být závažnější než při prvním podání. Makrolidy mohou také negativně ovlivnit renální funkce, pokud jsou aplikovány v kombinaci s některými dalšími léky. Jde především o blokátory kalciových kanálů a statiny, kterým je vhodné se při léčbě makrolidy vyhnout (31, 32).
Fluorochinolony
Fluorochinolony jsou baktericidní ATB s širokým spektrem účinnosti a s přímou inhibicí syntézy bakteriální DNA. Cílovou strukturou jsou dva enzymy esenciální pro replikaci DNA, na které se fluorochinolony váží (DNA gyráza a DNA topoizomeráza), což způsobuje následný rozpad bakteriální DNA (33). Jde o velmi efektivní antibiotika s výhodnými farmakokinetickými vlastnostmi (vysoká biologická dostupnost při perorální aplikaci, velký distribuční objem a široké antibakteriální spektrum). V souvislosti s jejich častým užíváním však dochází k progresivnímu zvyšování bakteriální rezistence. Celkově se jedná o bezpečná antibiotika, u kterých vznikají nežádoucí účinky jen ojediněle. Mohou se projevit jako gastrointestinální příznaky s nevolností a zvracením, případně mohou potencovat rozvoj střevní infekce Clostridium difficile. Zřídka dochází k rozvoji mírné hepatopatie, tendinopatie (např. poškození Achillovy šlachy) a neuropatie, někdy také pokud jsou tyto ATB podávány u pacientů s dlouhodobou kortikoterapií. (34).
Fluorochinolony způsobují AKI zpravidla jen velmi zřídka a jejich potenciální nefrotoxicita klesá v pořadí ciprofloxacin, moxifloxacin a levofloxacin (35). Patogenetický mechanismus lze obecně popsat jako imunitně zprostředkovanou intersticiální nefritidu – akutní TIN (36). Vzhledem k tomuto faktu lze také ke zlepšení ledvinných funkcí použít kortikoidy. V některých případech může při podávání fluorochinolonů dojít také k AKI na podkladě krystalové nefropatie, především je‑li pH moči vyšší než 6,8. Tomuto stavu a pravděpodobně i nutnosti podání kortikosteroidů se v klinické praxi dá předejít dostatečnou hydratací pacienta (37).
Antituberkulotika
Mezi antituberkulotika první volby řadíme izoniazid, rifampicin, pyrazinamid, ethambutol a streptomycin. Obecné vedlejší účinky této terapie bývají relativně časté, včetně případného vzniku AKI, které může být v některých případech velmi závažné (38, 39). Uváděná incidence AKI po podání antituberkulotik může dosahovat až 7,1 % (40). U pacientů léčených antituberkulotiky by měl být monitorován kreatinin a ionty v séru zpočátku alespoň jedenkrát týdně, později alespoň jednou měsíčně. Optimální frekvence monitorování sérové koncentrace léčivých látek aplikovaných parenterálně není jednoznačně daná a často se provádí v intervalu 1× týdně v počáteční fázi léčby, po úpravě dávkování a kdykoli, dojde‑li ke změnám sérové koncentrace kreatininu (41). Patofyziologický mechanismus vzniku AKI navozeného antituberkulotiky spočívá ve tvorbě imunitních komplexů formujících se v depozita v glomerulech, tubulech i intersticiu, což vede ke vzniku akutní tubulární nekrózy a akutní intersticiální nefritidy. Mimo ledviny lze tyto imunitní komplexy nalézt také v dalších orgánech. Podle tíže jejich postižení se mohou objevit nespecifické příznaky, jako abdominální diskomfort, nevolnost, zvracení, průjmy nebo celková slabost. V klinické praxi při rozvíjejícím se poškození ledvin pozorujeme velmi dobrý efekt promptního vysazení, případně redukce dávky antituberkulotik. Většinou není ani nutné podávat další podpůrnou terapii (například kortikosteroidy). Z toho vyplývá důležitost včasně stanovené příčiny AKI a v tomto případě přerušení antituberkulotické léčby.
Tab. 3. Nefrotoxické působění antibiotik 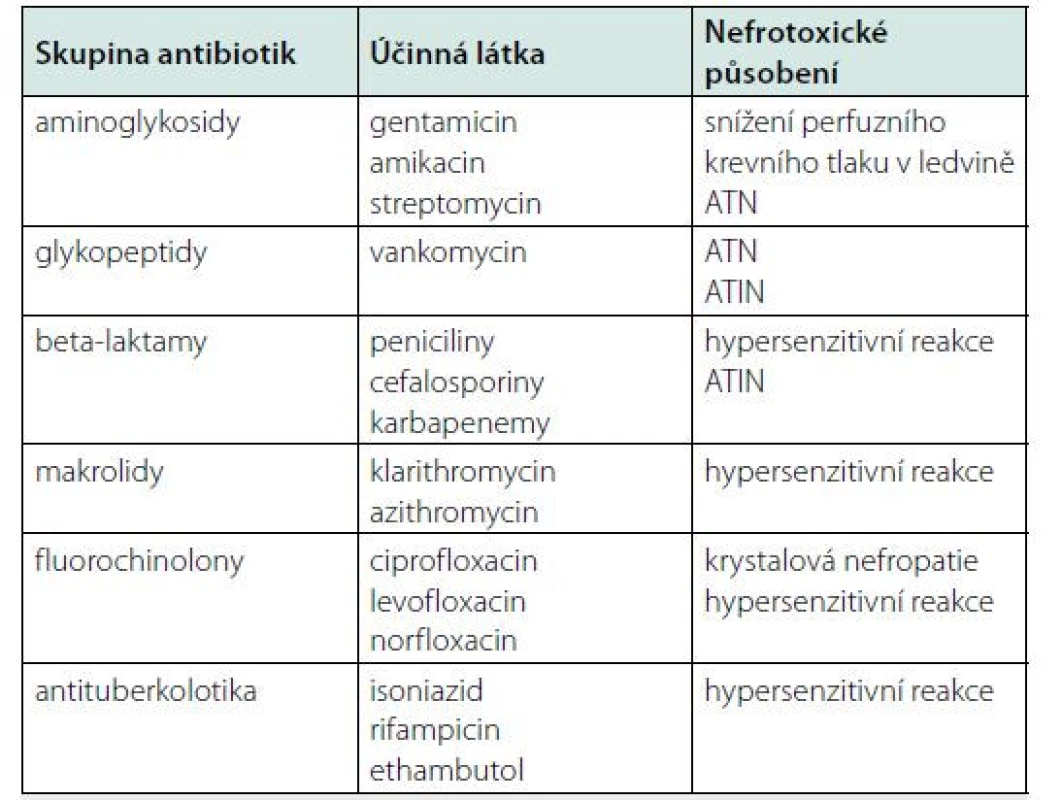
ATIN – akutní tubulointersticiální nefritida, ATN – akutní tubulární nekróza Prevence polékového AKI a možnosti terapeutického přístupu
Většinu antibiotik, včetně těch nefrotoxických, využíváme často k léčbě závažných septických stavů, které bývají spojeny s multiorgánovým selháváním. Jejich mortalita je velmi vysoká a pohybuje se přibližně v rozmezí 50–60 %. Proto dle aktuálních doporučení je nutné zahájit léčbu u kriticky nemocných pacientů v sepsi intravenózním podáním antimikrobiálních látek co nejdříve po rozpoznání sepse i septického šoku, ideálně do jedné hodiny (42). Doporučuje se empirická širokospektrá léčba jedním nebo více antimikrobiálním přípravkem, aby byly pokryty všechny pravděpodobné patogeny (včetně bakterií a potenciálně plísní nebo virů). Při výběru vhodné antimikrobiální terapie hraje roli také cesta podávání léčiva, alergie, případné lékové interakce, či lokalizace infekčního procesu. Jakmile je identifikován patogen a stanoven antibiogram a/nebo je zaznamenáno odpovídající klinické zlepšení, je vhodné empirickou antimikrobiální léčbu zúžit. U pacientů v kritickém stavu se také doporučuje optimalizovat strategii dávkování antimikrobiálních látek na základě přijatých farmakokinetických či farmakodynamických zásad a specifických vlastností léčiv. Musíme také myslet na potenciální možnost odstranění zdroje infekce (např. chirurgickým výkonem). Pro počáteční léčbu septického šoku je indikována empirická kombinovaná terapie (s použitím nejméně dvou antibiotik různých antimikrobiálních tříd) zaměřená na nejpravděpodobnější bakteriální původce s tím, že není vhodné rutinní použití kombinované léčby u ostatních závažných infekcí, včetně bakteriemie a sepse bez šoku. Pokud je u septického šoku zpočátku použita kombinovaná terapie, je doporučováno ji během několika prvních dnů přerušit v reakci na klinické zlepšení a/nebo důkazy o vymizení infekce. To platí jak pro cílenou (u kultivačně pozitivních infekcí), tak pro empirickou (u kultivačně negativních infekcí) kombinovanou léčbu. U většiny závažných infekcí spojených se sepsí a septickým šokem je dostatečná délka antimikrobiální léčby 7 až 10 dní. To však často neplatí pro dialyzované nebo transplantované pacienty, kteří jsou imunodeficientní, a proto je u nich vhodné terapii prodloužit. Delší léčba je vhodná také u pacientů s pomalou klinickou odpovědí, nedrénovatelnými ložisky infekce, bakteriemií S. aureus, některými plísňovými a virovými infekcemi nebo dalšími imunologickými deficity, včetně neutropenie. S tím souvisí nutnost denního hodnocení deeskalace antimikrobiální léčby. K podpoře zkrácení doby terapie je vhodné mimo jiné také měření hladin prokalcitoninu. U pacientů s těžkými zánětlivými stavy neinfekčního původu (např. těžká pankreatitida, popáleniny) se nedoporučuje trvalá systémová antimikrobiální profylaxe (42).
U kriticky nemocných v septickém stavu podáváme úvodní dávku antibiotika bez jeho redukce. Úvodní dávka léku závisí na požadované koncentraci ATB v séru, jeho distribučním objemu a na hmotnosti pacienta. Je třeba znát také maximální dávky léčiva u specifických stavů, např. pokud je pacient v terminálním stadiu chronické renální insuficience anebo léčen hemodialýzou. Udržovací dávka léčiva závisí zejména na funkci eliminačního orgánu, kterým jsou játra anebo ledviny, a u nefrotoxických antibiotik je nutné pravidelné monitorování jejich hladin v séru.
Prevence vzniku AKI u antimikrobiálních látek, jejichž nefrotoxicita je závislá na podané dávce, je tedy založena na terapeutickém monitoringu léčiva (TDM). Součástí obecných preventivních postupů je dále nezbytná dostatečná hydratace pacienta s kontrolou diurézy, renálních funkcí a hemodynamických parametrů. Udržování adekvátního středního arteriálního tlaku se zajištěním dostatečného perfuzního tlaku ledvin zvýší pravděpodobnost udržení jejich funkce a následné eliminace léčiva. Ve smyslu prevence nefrotoxicity je vhodné podávání aminoglykosidů podle doporučení KDIGO 2012 v intervalu 1× za 24 hodin s následným TDM. Podle možností bychom měli pravidelně monitorovat sérové koncentrace vankomycinu a vyvarovat se kombinace vankomycinu s piperacilin/tazobactamem. Nicméně obecně u kriticky nemocného pacienta je vhodné eliminovat možnosti vzniku kombinovaného renálního poškození, například vlivem opakovaného podání jodové kontrastní látky, prolongovaného šokového stavu, či nadměrně dlouhého operačního výkonu s použitím mimotělního oběhu.
Závěr
Antibiotická terapie patří mezi jednu z hlavních příčin akutního poškození ledvin. V okamžiku, kdy máme podezření na možnost AKI, je nutné pečlivě zkontrolovat všechny léky, které pacient aktuálně užívá a věnovat zvláštní pozornost těm, které jsou potenciálně nefrotoxické. Pokud takovou medikaci nalezneme, je nutné ji co nejdříve vysadit a nahradit jinými šetrnějšími léky, případně snížit dávkování, nebo v určitých případech, pokud je to možné, stanovit sérové koncentrace jednotlivých látek, včetně antibiotik. U těžkých septických stavů podáváme úvodní dávku antibiotika bez redukce, ale udržovací dávky potenciálně nefrotických antibiotik je nezbytné upravit podle renálních funkcí. Ve všech případech, kdy nemáme jinou možnost než použít antibiotikum s nefrotickým potenciálem, musíme každý individuální případ vyhodnotit samostatně a rozhodovat se dle celkového stavu se zvážením všech rizik a benefitů pro samotného pacienta.
Projekt je podpořen grantem:
Ministry of Health Czech Republic—conceptual development of research organization (01-RVO ‑ FNOs/2019), by the conceptual development of Technical University of Ostrava, Czech Republic – SP 2020/46 Applied statistics and probability theory, and by the Ministry of Health Czech Republic IGA_LF_2021_004 (911103221/31).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Viktor Klementa
III. Interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
I. P. Pavlova 6, 779 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(4):227-233
Článek přijat redakcí: 6. 4. 2022
Článek přijat po recenzích: 24. 5. 2022
Zdroje
1. Ogobuiro I, Tuma F. Physiology, Renal. [Updated 2021 Jul 26]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Available from: https://www.ncbi. nlm.nih.gov/books/NBK538339/
2. Pannu N, Nadim MK. An overview of drug ‑ induced acute kidney injury. Crit Care Med 2008;36(4 Suppl.):S216–S223.
3. Chertow GM, Burdick E, Honour M et al. Acute kidney injury, mortality, lenght of stay, and cost in hospitalized patients. J Am Soc Nephrol. 2005; 16 : 3365–3370.
4. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int. Suppl. 2012;2 : 1–138
5. Bentley ML, Corwin HL, Dasta J. Drug ‑ induced acute kidney injury in the critically ill adult: Recognition and prevention strategies. Crit Care Med 2010; 38(6 Suppl.): S169–S174
6. Perazella MA, Markowitz GS. Drug ‑ induced acute interstitial nephritis. Nat. Rev. Nephrol. 2010, 6, 461–470. [Google Scholar] [CrossRef] [PubMed]
7. Mulligan MJ, Cobbs CG. Bacteriostatic versus bactericidal activity. Infect Dis Clin North Am. 1989 Sep;3(3):389-98. PMID: 2671128.
8. Norrby SR. Neurotoxicity of carbapenem antibacterials. Drug Saf. 1996 Aug;15(2):87 - 90. doi: 10.2165/00002018-199615020-00001. PMID: 8884160.
9. Krause KM, Serio AW, Kane TR et al. Aminoglycosides: An Overview. Cold Spring Harb Perspect Med. 2016 Jun 1;6(6):a027029. doi: 10.1101/cshperspect.a027029. PMID: 27252397; PMCID: PMC4888811.
10. Drew R. Aminoglycosides, doi: https://www.uptodate.com/contents/aminoglycosides? c si=caef2e4f-8240-441a-9b16-ad0d 8542df77 & source=contentShare
11. Humes HD. Aminoglycoside nephrotoxicity. Kidney Int 1988; 33 : 900.
12. McWilliam SJ, Antoine DJ, Smyth RL, et. al. Aminoglycoside ‑ induced nephrotoxicity in children. Pediatr Nephrol. 2017;32 : 2015-25.
13. Denamur S, Boland L, Beyaert M et al. Subcellular mechanisms involved in apoptosis induced by aminoglycoside antibiotics: Insights on p53, proteasome and endoplasmic reticulum. Toxicol Appl Pharmacol. 2016;309 : 24-36.
14. Martinez‑Salgado C, Rodríguez‑Barbero A, Eleno N et al. Gentamicin induces Jun‑AP1 expression and JNK activation in renal glomeruli and cultured mesangial cells. Life Sci. 2005;77 : 2285-98.
15. Drew R, Sakoulas G. Vancomycin: Parenteral dosing, monitoring, and adverse effects in adults, doi: https://www.uptodate.com/contents/vancomycin‑parenteral‑dosing‑monitoring‑and‑adverse‑effects‑in‑adults? csi=aaaf3a27-9cc2-461e-9987 - b7c4170e7c41 & source=contentShare
16. Elyasi S, Khalili H, Dashti‑Khavidaki S et al. Vancomycin ‑ induced nephrotoxicity: mechanism, incidence, risk factors and special populations. A literature review. Eur J Clin Pharmacol. 2012;68 : 1243-55.
17. Sinha Ray A, Haikal A, Hammoud KA, Yu AS. Vancomycin and the Risk of AKI: A Systematic Review and Meta‑Analysis. Clin J Am Soc Nephrol. 2016 Dec 7;11(12):2132-2140. doi: 10.2215/CJN.05920616. Epub 2016 Nov 28. PMID: 27895134; PMCID: PMC5142072.
18. Sawada A, Kawanishi K, Morikawa S et. al. Biopsy‑proven vancomycin ‑ induced acute kidney injury: a case report and literature review. BMC Nephrol. 2018 Mar 27;19(1):72. doi: 10.1186/s12882-018-0845-1. PMID: 29587650; PMCID: PMC5872390.
19. Petejova N, Martinek A, Zahalkova J et. al. Vancomycin removal during low‑flux and high‑flux extended daily hemodialysis in critically ill septic patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2012 Dec;156(4):342-7. doi: 10.5507/bp.2012.002. Epub 2012 Jan 30. PMID: 22660225.
20. Cai Y, Lee W, Kwa AL. Polymyxin B versus colistin: an update. Expert Rev Anti Infect Ther. 2015;13(12):1481-97. doi: 10.1586/14787210.2015.1093933. Epub 2015 Oct 21. PMID: 26488563.
21. MacLaren G, Spelman D. Polymyxins: An overview, doi: https://www.uptodate.com/ contents/polymyxins‑an‑overview? csi=119451e1-13c2-436d-810c-7ec1fdfad5f1 & source= contentShare
22. Lima LM, Silva BNMD, Barbosa G et al. β ‑ lactam antibiotics: An overview from a medicinal chemistry perspective. Eur J Med Chem. 2020 Dec 15;208 : 112829. doi: 10.1016/j. ejmech.2020.112829. Epub 2020 Sep 16. PMID: 33002736.
23. González E, Gutiérrez E, Galeano C et al. Early steroid treatment improves the recovery of renal function in patients with drug ‑ induced acute interstitial nephritis. Kidney Int. 2008;73 : 940-6.
24. Burgess LD, Drew RH. Comparison of the incidence of vancomycin ‑ induced nephrotoxicity in hospitalized patients with and without concomitant piperacillintazobactam. Pharmacotherapy. 2014;34 : 670-6.
25. Gomes DM, Smotherman C, Birch A et al. Comparison of acute kidney injury during treatment with vancomycin in combination with piperacillin‑tazobactam or cefepime. Pharmacotherapy. 2014;34 : 662-9.
26. Navalkele B, Pogue JM, Karino S et al. Risk of Acute Kidney Injury in Patients on Concomitant Vancomycin and Piperacillin‑Tazobactam Compared to Those on Vancomycin and Cefepime. Clin Infect, DiS. 2017;64 : 116 - 23.
27. Mansoor GA, Panner BJ, Ornt DB. Azithromycin‑induced acute interstitial nephritis. Ann Intern Med 1993;119 : 636-7.
28. Persico C, Rocchi A, Edefonti A et. al. The acute interstitial nephritis induced by azithromycin. NDT Plus. 2011;4 : 218.
29. Woodruff AE, Meaney CJ, Hansen EA et. al. Azithromycin‑Induced, Biopsy‑Proven Acute Interstitial Nephritis in an Adult Successfully Treated with Low‑Dose Corticosteroids. Pharmacotherapy. 2015;35:e169-74.
30. Russell W, Smith W. Clarithromycin‑induced acute interstitial nephritis and minimal change disease. NDT Plus. 2009;2 : 382-3.
31. Gandhi S, Fleet JL, Bailey DG et. al. Calcium‑channel blocker‑clarithromycin drug interactions and acute kidney injury. JAMA. 2013;310 : 2544-53.
32. Mishima E, Maruyama K, Nakazawa T et. al. Acute Kidney Injury from Excessive Potentiation of Calcium‑channel Blocker via Synergistic CYP3A4 Inhibition by Clarithromycin Plus Voriconazole. Intern Med. 2017;56 : 1687-90
33. Drlica K, Zhao X. DNA gyrase, topoisomerase IV, and the 4-quinolones. Microbiol Mol Biol Rev. 1997 Sep;61(3):377-92. doi: 10.1128/mmbr.61. 3. 377-392.1997. PMID: 9293187; PMCID: PMC232616.
34. Bolon B. Mini‑Review: Toxic Tendinopathy. Toxicol Pathol. 2017 Oct;45(7):834-837. doi: 10.1177/0192623317711614. Epub 2017 May 28. PMID: 28553748.
35. Bird ST, Etminan M, Brophy JM, et. al. Risk of acute kidney injury associated with the use of fluoroquinolones. CMAJ. 2013;185:E475-82.
36. Muriithi AK, Leung N, Valeri AM et al. Biopsy‑proven acute interstitial nephritis, 1993 - 2011: a case series. Am J Kidney, DiS. 2014;64 : 558-66.
37. Khan M, Ortega LM, Bagwan N et. al. Crystal ‑ induced acute kidney injury due to ciprofloxacin. J Nephropathol. 2015;4 : 29-31.
38. Li Y, Zhu Y, Zhong Q et al. Serious Adverse Reactions From Anti‑tuberculosis Drugs Among 599 Children Hospitalized for Tuberculosis. Pediatr Infect Dis J. 2017;36 : 720-5.
39. Wortham JM, Goggin M, Mora C et. al. Acute kidney injury during treatment for latent tuberculous infection with rifampin. Int J Tuberc Lung, DiS. 2017;21 : 596-7.
40. Chang CH, Chen YF, Wu VC et al. Acute kidney injury due to anti‑tuberculosis drugs: a five‑year experience in an aging population. BMC Infect, DiS. 2014;14 : 23.
41. Drew R, Sterling T. Antituberculous drugs: An overview, doi: https://www.uptodate. com/contents/antituberculous‑drugs‑an‑overview? search=antimyco bacterials & source= - search_result & selectedTitle=1~150 & usage_type=default & display_rank=1
42. Rhodes A, Evans LE, Alhazzani W et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017 Mar;43(3):304-377. doi: 10.1007/s00134-017-4683-6. Epub 2017 Jan 18. PMID: 28101605.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hlavní téma – Pneumologie
- Covid-19 a post‑ covid – Jekyll a Hyde moderní medicíny
- Antifibrotická terapie a její indikace u intersticiální plicní fibrózy
- Neo/adjuvantní imunoterapie v léčbě nemalobuněčného plicního karcinomu
- Prevencia a liečba venózneho tromboembolizmu spojeného s malignitou – interdisciplinárny konsenzus
- Akutní poškození ledvin vlivem antimikrobiální terapie
- Vývoj doporučení pro použití venofarmak v léčbě chronického žilního onemocnění – kde je jejich místo a kde jsou slabiny
- Kyselina acetylsalicylová v primární prevenci kardiovaskulárních onemocnění
- Zlepšili sme starostlivosť o pacientov s artériovou hypertenziou v roku 2021?
- Urapidil: neznámé / známé antihypertenzivum
- Hlavní teze směřování interny v příštích letech
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vývoj doporučení pro použití venofarmak v léčbě chronického žilního onemocnění – kde je jejich místo a kde jsou slabiny
- Antifibrotická terapie a její indikace u intersticiální plicní fibrózy
- Urapidil: neznámé / známé antihypertenzivum
- Kyselina acetylsalicylová v primární prevenci kardiovaskulárních onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



