-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kostní nemoc při selhání ledvin – renální i non-renální komponenta
Bone disesase in end-stage kidney disease – renal and non-renal components
Metabolic bone disease in chronic kidney disease and end-stage renal failure represents one of the most severe clinical complication in kidney patients, namely those on maintenance dialysis. Traditionally, bone changes are induced by secondary hyperparathyroidism. The CKD-MBD concept reflects the link between bone and cardiovascular disease in these patients. Studies documented also other bone pathological pathways in renal patients, such as osteoporosis, as in kidney and dialysis patients its risk factors are present as well as in general population. Resulting bone disease in renal disease and failure is far more complex than previously seen. However, the secondary hyperparathyroidism still represents the main pathological pathway.
Keywords:
Parathyroid hormone – dialysis – secondary hyperparathyroidism – chronic kidney disease – FGF-23 – hyperphosphatemia – renal bone disease – osteoporosis in kidney disease
Autoři: Sylvie Dusilová Sulková 1; Anita Pokorná 1; Roman Šafránek 1; Ladislava Pavlíková 2; Vladimír Palička 2
Působiště autorů: Hemodialyzační středisko FN Hradec Králové a katedra interních oborů, Lékařská fakulta UK v Hradci Králové 1; Ústav klinické biochemie a diagnostiky, FN Hradec Králové 2
Vyšlo v časopise: Vnitř Lék 2021; 67(5): 258-263
Kategorie: Hlavní téma
Souhrn
Metabolická osteopatie při onemocnění a selhání funkce ledvin představuje jednu z nejzávažnějších klinických komplikací nefrologických a zejména dialyzovaných pacientů. V klasickém pojetí se jedná o kostní změny při sekundární hyperparathyreóze (SHPT). Stejné patogenetické mechanismy však poškozují i srdce a cévy, což zohledňuje koncept CKD-MBD. V současné době je stále větší pozornost věnována i jiným kostním změnám, zejména osteoporóze, neboť rizikové faktory osteoporózy se uplatňují i u nefrologických pacientů. Výsledné kostní postižení při selhání ledvin je mnohem komplikovanější, než se jevilo v minulosti. Sekundární hyperparathyreóza však zůstává hlavním patogenetickým faktorem.
Klíčová slova:
dialýza – chronické onemocnění ledvin – parathormon – FGF-23 – hyperfosfatemie – renální kostní nemoc – sekundární hyperparathyreóza – osteoporóza při onemocnění ledvin
Úvod
Chronické onemocnění ledvin (CKD) je spojeno s velkým počtem regulačních a metabolických změn, které vedou až k orgánovým poškozením. Nejvíce postiženi jsou pochopitelně pacienti se selháním ledvin (ESRD, end-stage renal disease), léčení v pravidelném dialyzačním programu (PDL).
Jednou z klinicky nejzávažnějších komplikací dialyzovaných pacientů je kostní nemoc. Ta v současném pojetí představuje jednu ze tří komponent minerálového a kostního postižení, označovaného jako CKD-MBD (chronic kidney disease – mineral and bone disorder, kostní a minerálová porucha spojená s chronickým onemocněním ledvin) (1, 2). Toto komplexní pojetí odráží skutečnost, že v důsledku stejné patogeneze, která stojí za vznikem a rozvojem renální kostní nemoci, jsou poškozeny i další orgány, zejména cévy a myokard.
Členění CKD-MBD na tři samostatné (byť navzájem propojené) okruhy (laboratorní změny, kostní nemoc a cévní kalcifikace) ukazuje, jak je tato problematika komplexní, rozsáhlá a složitá. V úzkém slova smyslu se renální kostní nemoc dělí podle histomorfometrických charakteristik na několik podskupin, s rozlišením podle změny kostního obratu (vystupňovaný je při fibrozní osteodystrofii při sekundární hyperparathyreóze; naopak nefyziologicky nízký je při adynamické formě), ale také podle objemu mineralizované kosti (osteomalacie jako další forma renální kostní nemoci). Častým histomorfometrickým nálezem jsou formy smíšené (mixed) (1). Kostní histomorfometrické vyšetření je sice podkladem přesného rozlišení podtypu kostních renálních změn, ale v klinické praxi se pro svou invazivní podstatu nevyužívá.
Tradiční pojetí považuje renální kostní nemoc za důsledek sekundární hyperparathyreózy, která selhání ledvin obligatorně doprovází (3). Hístomorfometricky nacházíme především urychlený kostní obrat (bone mineralization rate) a poruchu uspořádání kostních trámců (woven bone, plstěná, nikoliv trámčitá kost). Naopak, samotné uremické prostředí někdy vede paradoxně k velmi sníženému kostnímu obratu, k výše zmíněné adynamické kostní nemoci.
V posledních letech je však pohled na problematiku kostních změn výrazně širší. Pacient s onemocněním a selháním ledvin může mít osteopatii i z mnoha jiných, non-renálních příčin (4). Nejčastěji se pak setkáváme s osteoporózou. Dialyzovaní pacienti, stejně jako všichni ostatní, mohou mít osteoporózu spojenou s věkem, hormonálními změnami, léčbou kortikoidy a podobně, případně s dalšími „netradičními“ faktory (5, 6).
Fraktury u nefrologických pacientů, zejména pacientů dialyzovaných, jsou násobně zvýšeny ve srovnání s populací stejného věku a pohlaví (7). Recentní denzitometrické studie opakovaně doložily, že nízká kostní denzita sice nevypovídá o typu renální osteopatie (sekundární hyperparathyreóza může mít denzitometrický nález normální), ale stejně jako u osob s normální funkcí ledvin ukazuje na riziko fraktur. Vyšetření kostní denzity (DXA) se ukazuje jako velmi důležité a umožňuje nejen určit riziko fraktur, ale i směr terapie (7, 8, 9).
Odlišení non-renální složky kostního postižení od tradiční renální osteopatie podmíněné sekundární hyperparathyreózou není vůbec lehké a často ani není možné. Důvodem je komplikované a dlouhodobé prolínání renálních a mnoha non-renálních příčin. Účinná prevence a léčba pak vyžaduje hlubokou patofyziologickou znalost všech souvislostí a mezioborovou spolupráci (5, 6).
Hlavní podstatou kostních změn nefrologických pacientů, zejména dialyzovaných, však nadále zůstává SHPT. Léčba ostatních komponent je úspěšná jen tehdy, pokud je souběžně terapeuticky zvládnuta právě tato komplikace. Cílem textu je připomenout její patogenezi a možnosti i úskalí stávající moderní farmakoterapie.
Kostní a minerálová nemoc při chronickém onemocnění ledvin
Na přelomu tisíciletí se nahromadily doklady pro souvislost mezi kostní nemocí a kardiovaskulárními komplikacemi u dialyzovaných pacientů. Bylo zřejmé, že kostní nemoc jako taková má patofyziologický i klinický přesah do dalších systémů. V odpovědi na potřebu širšího přístupu vznikl koncept CKD-MBD (1, 2). Pro orientaci byly určeny tři jednotlivé komponenty, které jsou termínem CKD-MBD zastřešeny. Pro podrobnější informace odkazujeme na literaturu, zde budou zmíněny jen vybrané okruhy.
Laboratorní komponenta CKD-MBD
Laboratorní komponenta CKD-MBD je v detailech mimo rozsah textu. Zmíníme pouze zcela základní ukazatele, neboť jejich interpretace není tak jednoduchá, jak se může zdát. Velmi důležité je znát vztah mezi vybranými ukazateli spojenými s kostním metabolismem a časovým průběhem chronických nefropatií (Obr. 1).
Obr. 1. Sérové koncentrace ukazatelů kostního metabolismu v jednotlivých stadiích chronického onemocnění ledvin (CKD1–5) 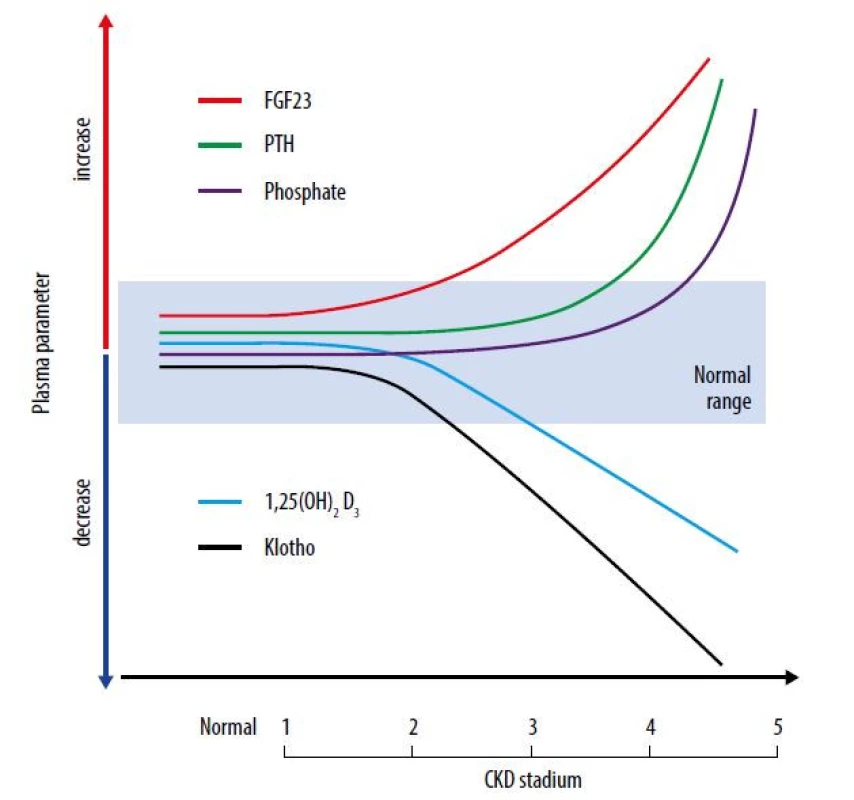
Osa x ukazuje průběh chronického onemocnění ledvin, resp. jednotlivá stadia CKD (CKD1-CKD5). Osa y ukazuje relativní hodnoty, resp. jejich změny (nárůst vs. pokles) jednotlivých markerů spojených se selháním ledvin a kostním metabolismem. Vidíme, že sérové koncentrace fosforu jsou dlouho v referenčním rozmezí, ačkoliv glomerulární filtrace je významně snížena. Normofosfatemie je dosažena díky vzestupu obou fosfatoninů, FGF-23 i PTH (viz dále). Všimněme si, že FGF-23 začíná stoupat dříve. Je patrný i pokles hladiny kalcitriolu (1,25D) a hladiny klotho, obojí zejména v důsledku zániku renálního parenchymu. V terminálním stadiu CKD se fosfatemie zvyšuje, neboť efekt fosfatoninů již nestačí, glomerulární filtrací je profiltrováno jen velmi málo fosforu i dalších katabolitů (33, 34) Koncentrace fosforu v séru
Sérová koncentrace fosforu je v průběhu CKD dlouho ve fyziologickém rozmezí (Obr. 1). Jak však uvedeno, v pozadí jsou regulační mechanismy, které inhibují zpětné vstřebávání fosforu z glomerulárního filtrátu zpět do organismu (10, 11). Ve svém důsledku jsou silně negativní. Právě vznik a rozvoj a progrese SHPT představuje základní krok k vysokoobratové metabolické osteopatii, která je pro CKD a ESRD pacienty typická (3).
Pokud v klinické praxi posuzujeme sérovou koncentraci fosforu, nelze se spokojit jen s tím, že je v referenčním rozmezí. Velmi užitečnou informaci podá stanovení frakční exkrece fosforu Fex_P. Fyziologická hodnota je do 0,2. Vyšší hodnoty již informují, že v pozadí námi zjištěné normofosfatemie je fosfaturický efekt obou fosfatoninů, FGF-23 a PTH.
Sérová koncentrace kalcia
Sérová koncentrace kalcia je u většiny pacientů s onemocněním i selháním ledvin lehce snížená nebo v normě. Z patofyziologického pohledu bychom očekávali (pokud již není pacient léčen kalciovými přípravky či vitaminem D) koncentraci sníženou, neboť chybí kalcitriol. Normokalcemie může již signalizovat hyperparathyreózu (3, 12).
Hyperkalcemie se při sekundární hyperparathyreóze nevyskytuje (chybí kalcitriol), a pokud ji detekujeme, je vždy třeba podrobná rozvaha o její příčině (léčba vitaminem D či přípravky s obsahem vápníku, ale i všechny jiné příčiny bez souvislosti s onemocněním ledvin). Někdy takto u pacientů s CKD objevíme i primární hyperparathyreózu, zmíníme však např. i mnohočetný myelom (s normální hodnotou PTH).
Koncentrace PTH při chronickém onemocnění a selhání ledvin
Koncentrace PTH v séru dialyzovaných pacientů, resp. pacientů se SHPT jsou vyšší než koncentrace při primární hyperparathyreóze (3, 12). Přesto jsou kostní změny méně vyjádřeny. Kost při selhání ledvin je jakoby oproti účinku PTH chráněna (neplatí však vždy). Tato „rezistence skeletu na PTH“ je dobře dokumentována, ale stále málo objasněna (13). Pro klinickou praxi je však její znalost velmi důležitá. Platí, že sérové koncentrace PTH u pacientů s pokročilým onemocněním a zejména selháním ledvin musí být cíleně vyšší než horní referenční rozmezí. Jinými slovy, není správné považovat mírně zvýšené koncentrace PTH (resp. koncentrace dvojnásobně vysoké než horní referenční rozmezí) za hyperparathyreózu, kterou je třeba léčit. Naopak, koncentrace PTH ve fyziologickém rozmezí je třeba u těchto pacientů považovat za známku sníženého kostního obratu a relativní hypoparathyreózu.
Podstata zmíněné „rezistence“ není dosud objasněna, opakovaně se zvažuje role indoxylsulfátu (uremický toxin s dosud nejvyšším popsaným rozdílem mezi fyziologickou a „uremickou“ koncentrací; prakticky nedialyzovatelný, produkovaný střevními bakteriemi a vstřebávaný do krve, kde při selhání retinován) (14, 15, 16).
Diskuze o tom, jaké je vlastně cílové rozmezí koncentrací PTH, jsou stále otevřené, a problematika je natolik složitá, že není možné ji zde podrobněji popisovat. Základem je vědět o nutnosti nesnižovat koncentrace dialyzovaných pacientů do referenčního rozmezí, a zejména sledovat jejich dynamiku v čase.
Alkalická fosfatáza a její kostní izoenzym
Zvýšená alkalická fosfatáza (ALP) spolu s hypokalcemií může být důsledkem chybění vitaminu D (fenotyp osteomalacie). Častěji však vidíme elevaci ALP (resp. jejího kostního izoenzymu) a souběžně normokalcemii. Zde je nutno zvažovat již vysoký kostní obrat při pokročilé SHPT. Vysoká koncentrace ALP ukazuje na vysokou tvorbu osteoidu v návaznosti na osteoresorpci. Platí totiž, že při selhání ledvin je zachováno fyziologické spřažení funkce osteoblastů a osteoklastů. Novotvořená kost však nemá fyziologické trámčité uspořádání. Může být plně mineralizována, ale je málo pevná.
Kostní nemoc, kostní komponenta CKD-MBD
Koncept CKD-MBD odráží poznatky souvislosti mezi kostní nemocí a dalším systémovým poškozením, zejména poškozením kardiovaskulárního systému, avšak nezahrnuje poznatky o prolínání non-renálních příčin do kostního postižení (1). Ty jsou relativně nové a jsou předmětem samostatných publikací (4, 5, 6, 7).
Zde zmíníme, že byť je SHPT při nemocech a selhání ledvin základní osteopatií, u některých pacientů nacházíme naopak kostní obrat snížený (tzv. adynamická kostní nemoc). Ke zvažovaným příčinám patří zánět a malnutrice, hypoparathyreóza z nejrůznějších příčin, ale také vliv indoxylsulfátu (15, 16). S dřívější hliníkem způsobenou adynamickou kostní nemocí se v našich podmínkách již nesetkáme.
Dále zmíníme vysoké riziko fraktur, které je u dialyzovaných pacientů až násobně vyšší. Příčiny jsou nejen ve ztrátě pevné kostní struktury při hyperparathyreóze (zachovaná mineralizovaná kost; avšak s nízkou kvalitou, kdy chybí trámčité uspořádání), ale i vlastní osteoporóza charakterizovaná nízkou kostní denzitou (7, 8).
Přes četné studie zaměřené na non-invazivní diagnostiku metabolických kostních změn nebyla stanovena žádná laboratorní ani jiná neinvazivní vyšetřovací metoda, která by sama o sobě, jednoznačně a spolehlivě rozlišila osteoporózu od jiné formy renální osteopatie. Přesná diagnostika je možná pouze histomorfometricky, neboli invazivně. Při znalostech podstaty onemocnění a patogenetických souvislostí však není nutná. Vždy je třeba komplexní zhodnocení více laboratorních a dalších nálezů a sledování jejich dynamiky v čase.
Cévní kalcifikace a jejich vztah ke kostnímu postižení
Pro CKD pacienty, zejména pro pacienty v dialyzačním programu, jsou typické patologické kalcifikace cévní stěny, resp. její hladké svaloviny (mediokalcinóza). Jsou úzce spjaty s poruchou minerálového metabolismu, zejména s hyperfosfatemií (17, 18, 19, 20, 21).
Je doloženo, že se nejedná o pouhý důsledek depozice vápníku a fosforu do cévní stěny vlivem jejich zvýšených koncentrací, ale o aktivní proces. Vlivem hyperfosfatemie se mění fenotyp buněk hladké cévní svaloviny cév na fenotyp podobný kostním buňkám. Ty poté produkují matrix, do které se soli kalcia a vápníku ukládají. Analogicky jsou postiženy například i srdeční chlopně. Tyto strukturální změny jsou příčinou velmi vysokého kardiovaskulárního rizika těchto pacientů.
Kalcifikační děj je přímo spojen s kostním metabolismem. Pokud je kostní obrat nefyziologicky nízký, či naopak vysoký, není prostor pro zabudování volného fosforu a vápníku do kostní tkáně. Jinými slovy, pro zabránění cévních kalcifikací je potřeba udržet fyziologickou rychlost kostního obratu. Jak již bylo zmíněno, pro normální kostní obrat je při selhání ledvin potřeba vyšší koncentrace PTH než u osob s normální funkcí ledvin.
V patogenezi mediokalcinózy se uplatňuje mnoho dalších dílčích mechanismů, příkladem je zánět či malnutrice. Hlavním cirkulujícím ochranným cévním faktorem je fetuin A, jeho koncentrace při selhání ledvin jsou významně nižší. Hlavním lokálním ochranným faktorem je matrix GLA protein v cévní stěně, který však je závislý na vitaminu K a při léčbě warfarinem se jeho dostupnost významně snižuje.
Vitamin D se většinou považuje za prokalcifikační, neboť zvyšuje dostupnost vápníku a fosforu. Na molekulární úrovni je však naopak vitamin D ochranný – snižuje expresi konkrétního membránového transportéru, kterým vstupuje fosfor do buněk (viz role vitaminu D jako regulačního transkripčního faktoru). Cévní kalcifikace dialyzovaných pacientů se vyskytují nejen při vysokých, ale také při nízkých koncentracích vitaminu D, viz tzv. „U“ křivka rizika (22).
Parathormon se účastní rozvoje a progrese kalcifikací nepřímo (po resorpci vápníku a fosforu z kosti dochází k jejich depozici do cévní stěny), ale i přímo v rámci své uremické toxicity.
V kontextu cévní mediokalciózy zmíníme, že tato komplikace může nastat nejen při hyperparathyreóze, ale i při příliš sníženém kostním obratu (relativní či absolutní hypoparathyreóze, ale opatrnost by měla být i při léčbě bisfosfonáty).
V nejvyšším riziku jsou pochopitelně pacienti se selháním ledvin, s diabetes mellitus a s těžkou nekorigovanou hyperparathyreózou, resp. hyperfosfatemií. Pokud jsou souběžně léčeni warfarinem, chtěli bychom upozornit na riziko tzv. kalcifylaxe (23). Tato mimořádně závažná a prognosticky nepříznivá komplikace, jejíž podstatou je nekróza podkoží, je naštěstí vzácná. Její řešení patří na specializovaná pracoviště.
Sekundární hyperparathyreóza
Jedná se o obligatorní komplikaci selhání funkce ledvin. V patogenezi se kombinuje chybějící vylučovací funkce (fosfor) a pokles a zánik funkce endokrinní (kalcitriol) (3, 12, 24). Vzájemné časové vztahy ukazuje obrázek 1. V textu připomeneme opět jen vybrané části, v ostatním odkazujeme na další literární zdroje.
Důležité patofyziologické souvislosti
Sérové koncentrace PTH se zvyšují již ve stadiu CKD3b, přitom sérové koncentrace Ca a P zůstávají v normě a klinicky je pacient asymptomatický. Vzestup aktivity příštítných tělísek je adaptací na potřebu močové eliminace fosforu při snížené glomerulární filtraci. Kromě zvýšení sérových koncentrací PTH se zvyšuje i hladina FGF-23 (fibroblastový růstový faktor 23), produkovaného zejména v kostech.
Parathormon i FGF-23 se řadí mezi fosfatoniny. V renálních tubulech inhibují zpětnou tubulární resorpci fosforu. Množství vyloučeného fosforu močí je významně vyšší, než by odpovídalo glomerulární filtraci. V praxi se o adaptivní aktivitě fosfatoninů můžeme snadno přesvědčit stanovením tzv. exkreční frakce fosforu (FEx_P; viz výše).
Oba fosfatoniny mají i další fyziologické funkce. Mimo jiné významně ovlivňují renální jedna-alfa-hydroxylázu neboli tvorbu kalcitriolu. Zatímco fosfaturický efekt je u FGF-23 i parathormonu identický, jejich vliv na renální hydroxylaci vitaminu D je odlišný: parathormon tvorbu kalcitriolu významně zvyšuje, zatímco FGF-23 ji tlumí. Výsledná koncentrace kalcitriolu v krvi při snížené funkci ledvin pak odpovídá nejméně třem okruhům: (i) dostupnosti prekurzoru pro tvorbu kalcitriolu (pozor na častý deficit vitaminu D při CKD a zejména při selhání ledvin, v současné době je však suplementace u nefrologických pacientů běžná), (ii) aktivitě příštítných tělísek a (iii) úrovni zvýšení hodnot FGF-23 v krvi.
Ledviny zodpovídají za tvorbu kalcitriolu na systémové úrovni. Při snížené funkci ledvin bychom očekávali paralelní pokles koncentrací kalcitriolu spolu se zánikem funkčního renálního parenchymu. Vzhledem k výše uvedeným i dalším regulačním vlivům na renální alfa-hydroxylázu se však u jednotlivých pacientů koncentrace liší. Často je koncentrace kalcitrolu nižší, než by odpovídalo stupni zániku renálního parenchymu, zřejmě v důsledku inhibičního efektu FGF-23 (zvyšuje se dříve a významněji než PTH). Deficit kalcitriolu je rovněž samostatnou linií příčin vzniku a rozvoje hyperparathyreózy.
Vstřebávání fosforu v zažívacím traktu je společným efektem všech forem vitaminu D, avšak intenzita tohoto vstřebávání je různá. Při zachování shodného efektu na potlačení tvorby parathormonu v buňkách příštítných tělísek, resp. regulaci transkripce genu pro parathormon, má nejnižší efekt na vstřebávání fosforu v zažívacím traktu synteticky vyrobený parikalcitol. Někdy se proto označuje jako selektivní inhibitor receptoru pro vitamin D (selektivní ve smyslu účinku na VDR v jaderném materiálu příštítných tělísek). Léky s touto látkou jsou v klinické praxi něco přes dvacet let a stále mají nezastupitelný význam. Používají se s cílem přímé inhibice tvorby PTH.
Obr. 2. Hnědý tumor. Kostní změny při vysoce vystupňované sekundární hyperparathyreóze. Žena ve věku 36 let, dialyzovaná 5 let, dlouhodobě hyperfosfatemie, zprvu non-compliance s dietou a vazači fosforu, v čase však již zřejmě ostreoresorpční (redistribuční) příčina hyperfosfatemie; 6/2021 podstoupila totální parathyreoidektomii, výkon bez komplikací, s úpravou koncentrace fosforu v séru. Zobrazení bércových kostí magnetickou rezonancí. Hnědý tumor v kostní tkáni (označen šipkou) 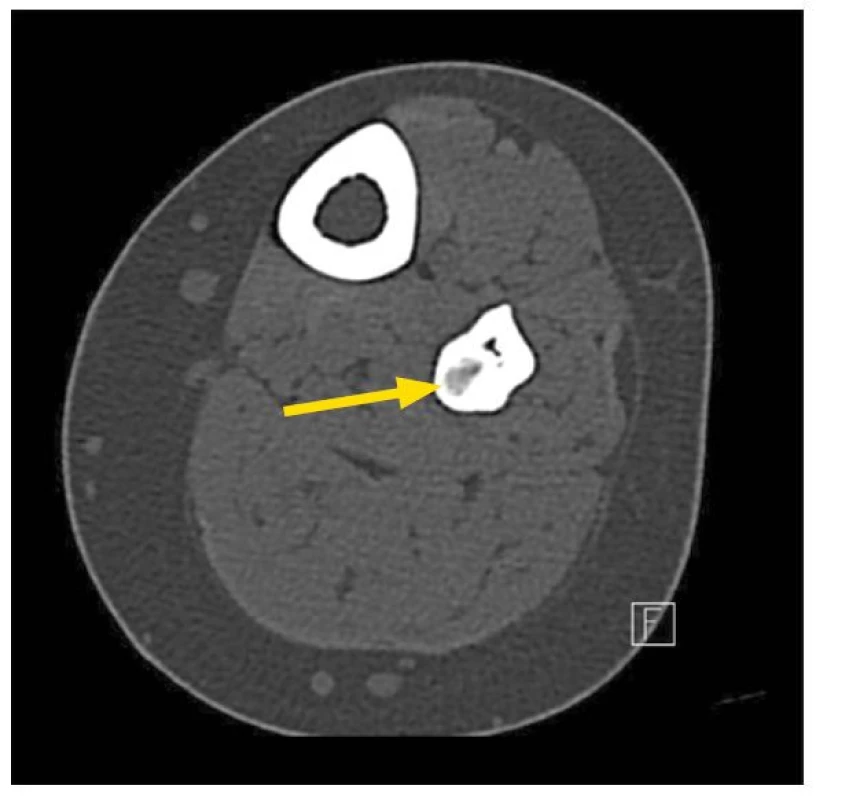
Obr. 3. Zlomenina kyčle. Žena ve věku 70 let, dialyzovaná nyní 12 let; léčena warfarinem dlouhodobě, s mediokalcinózou tepen. Koncentrace PTH dlouhodobě jen mírně vyšší než horní referenční mez. Fraktura femuru při minimálním úrazovém mechanismu. Velmi pravděpodobná souběžná osteoporóza. Na snímku jsou rovněž patrné výrazně kalcifikované stěny cév pánevní oblasti (označeno šipkou) 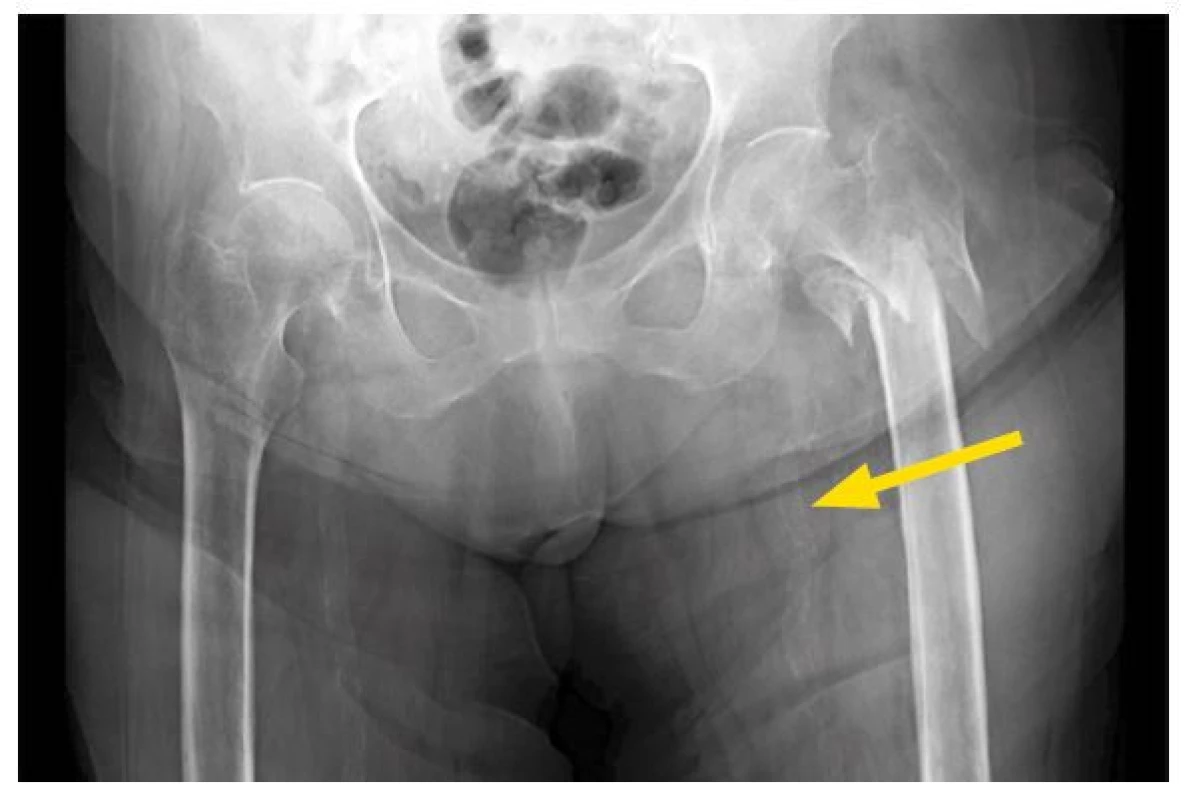
I přes sníženou zpětnou resorpci fosforu v průběhu CKD se sérová koncentrace při terminálním selhání ledvin zvyšuje. V té době však jsou oba původně adaptivní mechanismy, tedy i SPHT, nevratné a maladaptivní. Negativní účinky parathormonu u dialyzovaných pacientů zahrnují nejen postižení kosti, ale i postižení srdce, cév, imunitního systému a dalších orgánů. Parathormon je řazen mezi uremické toxiny (24). Rovněž nefyziologicky vysoké koncentrace FGF-23 působí v organismu negativně (25).
Moderní farmakoterapie SHPT, její možnosti a úskalí
Současné farmakoterapeutické postupy zahrnují léky pro snížení vstřebávání fosforu v zažívacím traktu, léky regulující tvorbu PTH, resp. úroveň genové transkripce (aktivní vitamin D, selektivní VDR aktivátory) a léky zasahující na úrovni receptoru pro kalcium (CaSR, calcium-sensing receptor). Všechny skupiny lze kombinovat. Podrobnější informace přináší literatura (26, 27). V dalším textu zmíníme některé z příčin, proč je tato problematika stále živá.
Vzhledem k závažným důsledkům pokročilé SHPT je třeba věnovat pozornost již iniciálním stadiím. Terapeuticky se zde vysloveně nabízí snížení fosforu v dietě, pochopitelně nikoliv za cenu snížení přívodu proteinu natolik, aby hrozila malnutrice. Lze předpokládat, že při nízkofosfátové dietě nenastanou intenzivní adaptivní procesy, nedojde k vysoké produkci FGF-23 ani k rozvoji (těžké) hyperparathyreózy. Jak je tomu však s příjmem fosforu v praxi?
Fosfor je v různém množství obsažen v bílkovinách, nejvíce v mléčných výrobcích, rybách a sýrech. Mnohem důležitější je však fosfor obsažený v aditivech, konzervantech, barvivech, tj. v tzv. potravinových „éčkách“ – tento fosfor je v zažívacím traktu prakticky stoprocentně vstřebán. Bohužel, tato jednoduchá terapeutická strategie, tj. vynechání potravinových „éček“ je mezi pacienty málo známá a podceňují ji i lékaři, resp. zdravotníci (28). Stojí za zmínku, že rostlinné bílkoviny obsahují fosfor v nevstřebatelné formě a jsou tedy vlastně pro nefrologické pacienty vhodnější. Existují podrobná vypracovaná doporučení a schémata ohledně obsahu fosforu ve stravě nefrologických pacientů. Příkladem je obrázková „fosfátová pyramida“ s rozdělením potravin podle obsahu fosforu, množství bílkovin a dostupnosti, resp. vstřebatelnosti fosforu (29). Edukace a motivace pacientů tímto směrem je dosud však nedostatečná.
Ani moderní farmakoterapie (kalcimimetika, aktivní vitamin D, resp. jeho syntetická analoga) nepostihuje patofyziologické procesy komplexně (26, 27). Jednak chybí zásah na receptor pro FGF-23 (viz dále), a také není dostatečná kontrola posttranskripčních dějů po přepisu genové informace pro PTH. Opět, i zde je důležitá role fosforu. Při hyperfosfatemii je životnost mRNA pro PTH prodloužena a při stejné intenzitě genového přepisu se vytvoří více PTH (3).
V souvislosti s neúplnou odpovědí SHPT na léčbu je vhodné zmínit i poruchu na receptorové úrovni: oba receptory, VDR i CaR, jsou totiž při selhání ledvin významně méně exprimovány. Efekt aktivního (metabolitu) vitaminu D na inhibici genové transkripce je pak nižší než očekávaný a léčba VDR aktivátory je nejen neúčinná, ale dokonce kontraproduktivní (hyperkalcemie a hyperfosfatemie; ale také „odbrždění“ původní „rezistence skeletu na PTH“, tj. akutní akcelerace kostních změn a jejích klinických projevů. V klinické praxi bývá problémem odlišení rezistence na léčbu od nevhodného dávkovacího schématu (13).
Suplementace kalcia u dialyzovaných pacientů musí být uvážlivá, neboť v mezidialyzačním období chybí eliminační možnosti a kalciová bilance je i během dialýzy pozitivní. Sérová koncentrace kalcia je jen málo vypovídající a vždy musíme zvažovat, zda podávané kalcium je zabudováno do kostí, či se ukládá spolu s fosforem do cévní stěny.
Ve vybraných, avšak dosud jen ojedinělých případech adynamické formy kostní nemoci při selhání ledvin se lze pokusit o léčbu rekombinantním parathormonem, který má potenciál obnovit kostní obrat; v detailech odkazujeme na literaturu (31).
Vitamin D, FGF-23 a klotho
Tyto tři jen volně spojené oblasti problematiku kostních změn při selhání ledvin významně doplňují. Každá z nich představuje velmi důležitou a rozsáhlou oblast, zde jsou zmíněny jen vybrané základní a stručné informace ve vztahu k SHPT.
Fibroblastový růstový faktor (FGF-23)
Fibroblastový růstový faktor 23 se tvoří v kostních buňkách, osteocytech a osteoblastech. Kost je zde vlastně aktivním endokrinním orgánem s úlohou adaptace na zátěž organismu fosfátem, avšak současně při nastalé maladaptivní extrémní syntéze FGF-23 se stává jedním z cílů orgánového poškození.
FGF-23 byl zmíněn v souvislosti se svým fosfaturickým účinkem a také jako významný inhibitor aktivity renální alfa-hydroxylázy. K jeho dalším fyziologickým účinkům patří mimo jiné i inhibice sekrece PTH po vazbě na svůj receptor na povrchu buněk příštítných tělísek. Mnohé regulační účinky, které FGF-23 prostřednictvím svého receptoru vykazuje, jsou však aktivní pouze za přítomnosti klotho (klotho je koreceptorem FGF-23 receptoru). Klotho se fyziologicky tvoří v ledvinách a při selhání ledvin chybí. Proto jsou příštítná tělíska pacientů se selháním ledvin na účinek FGF-23 rezistentní (viz dále).
Klotho
Klotho je protein vytvářený v ledvinách, má mnoho biologických funkcí, je spojen s výrazem „elixír mládí“. Mimo jiné zvyšuje fosfaturii, udržuje funkci ledvin a na molekulární úrovni inhibuje vstup fosforu do buněk hladké cévní svaloviny, čímž snižuje kalcifikaci mediální vrstvy cévní stěny (17). Jedním z důsledků chybění klotho při selhání ledvin je i rezistence cílových tkání na účinek FGF-23, v daném případě rezistence příštítných tělísek na rezistence na FGF-23 při nepřítomnosti klotho (viz výše).
Farmakologická či jiná možnost ovlivnění příštítných tělísek zásahem na klotho-FGF-23 receptorovém komplexu při selhání ledvin není známa, žádná farmakoterapie toto neumožní. Zřejmě i tato okolnost přispívá k tomu, že i přes nepochybné pokroky stále není možné farmakologicky SHPT plně kontrolovat. Teoreticky je jedinou možností velmi časná restrikce přívodu fosforu do organismu, aby k elevaci FGF-23 nedocházelo. Tvorbu FGF-23 však zvyšuje i hyperkalcemie a řada dalších faktorů.
Vitamin D
V současné době je suplementace nativního vitaminu D u nefrologických pacientů na většině pracovišť již samozřejmostí (30). V nefrologii je však potřeba cíleně rozlišit suplementaci od supresivní léčby aktivním vitaminem D s cílem léčby SHPT. Obě cesty, suplementaci i supresi, lze opatrně kombinovat (31).
Při zpětném ohlédnutí lze konstatovat, že podrobné a skutečně velmi početné studie mnoha vědeckých týmů nás přivedly k současným již velmi podrobným poznatkům o SHPT při selhání ledvin a jejích souvislostech včetně moderní farmakoterapie, a rozšířily poznatky o dalších kostních změnách, včetně těch, které se selháním ledvin nemusí nijak souviset. Přesto problém kostního onemocnění a jeho důsledků pro celý organismus přetrvává. K příčinám patří velmi složitá patogeneze i terapeutická úskalí a je nepochybné, že téma zůstává stále velmi aktuální.
Podpořeno programy MZ ČR – RVO
(FNHK, 00179906) a PROGRES Q40/14
Poděkování: Autoři děkují kolegům z Radiologické kliniky FN Hradec Králové za cenné vyšetření zobrazovacími metodami (přednosta prof. MUDr. Antonín Krajina, CSc.), kolegům z Kliniky otorinolaryngologie a chirurgie hlavy a krku za vynikající spolupráci v programu parathyreoidektomií (přednosta prof. MUDr. Viktor Chrobok, CSc., Ph.D.).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Sylvie Dusilová Sulková, DrSc.
Hemodialyzační středisko FN Hradec Králové a katedra interních oborů, Lékařská fakulta UK v Hradci Králové Sokolská 581, 500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2021; 67(5): 258–263
Článek přijat redakcí: 1. 7. 2021
Článek přijat po recenzích: 22. 7. 2021
Zdroje
1. Moe S, Drüeke T, Cunningham J et al. Kidney Disease: Improving Global Outcomes (KDIGO). Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69(11): 1945–1953.
2. Ketteler M, Block GA, Evenepoel P et al. Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder: Synopsis of the Kidney Disease: Improving Global Outcomes 2017 Clinical Practice Guideline Update. Ann Intern Med. 2018; 168(6): 422–430.
3. Cunningham J, Locatelli F, Rodriguez M. Secondary hyperparathyroidism: pathogenesis, disease progression, and therapeutic options. Clin J Am Soc Nephrol 2011; 6 : 913–921.
4. Cannata-Andía JB, Martín-Carro B, Martín-Vírgala J et al. Chronic Kidney Disease-Mineral and Bone Disorders: Pathogenesis and Management. Calcif Tissue Int 2021; 108 : 410–422.
5. Jørgensen HS, David K, Salam S. et al. European Renal Osteodystrophy (EUROD) workgroup, an initiative of the CKD-MBD working group of the ERA-EDTA. Traditional and Non-traditional Risk Factors for Osteoporosis in CKD. Calcif Tissue Int. 2021; 108 : 496–511.
6. Evenepoel P, Cunningham J, Ferrari S et al. European Renal Osteodystrophy (EUROD) workgroup, an initiative of the CKD-MBD working group of the ERA-EDTA, and the committee of Scientific Advisors and National Societies of the IOF. European Consensus Statement on the diagnosis and management of osteoporosis in chronic kidney disease stages G4-G5D. Nephrol Dial Transplant. 2021; 36 : 42–59.
7. Vilaca T, Salam S, Schini M et al. Risks of Hip and Nonvertebral Fractures in Patients with CKD G3a-G5D: A Systematic Review and Meta-analysis. Am J Kidney Dis. 2020; 76 : 521–532.
8. Hampson G, Elder GJ, Cohen-Solal M et al. Abrahamsen B. A review and perspective on the assessment, management and prevention of fragility fractures in patients with osteoporosis and chronic kidney disease. Endocrine. 2021 May 11. doi: 10.1007/s12020-021-02735-9.
9. Brunerova L, Palicka V, Dusilova Sulkova S. Commentary on Management of Osteoporosis in Advanced CKD: Common View of a Nephrologist and a Bone Specialist. Endocrine Practice 2019; 25 : 193–196.
10. Blaine J, Chonchol M, Levi M. Renal control of calcium, phosphate, and magnesium homeostasis. Clin J Am Soc Nephrol 2015; 10 : 1257–1272.
11. Tatsumi S, Miyagawa A, Kaneko I et al. Regulation of renal phosphate handling: inter - -organ communication in health and disease. J Bone Miner Metab. 2016; 34 : 1–10.
12. Ureña-Torres PA, Vervloet M, Mazzaferro S et al. ERA-EDTA CKD-MBD Working Group. Novel insights into parathyroid hormone: report of The Parathyroid Day in Chronic Kidney Disease. Clin Kidney J 2018; 12 : 269–280.
13. Bover J, Arana C, Ureña P et al. Hyporesponsiveness or resistance to the action of parathyroid hormone in chronic kidney disease. Nefrologia (Engl Ed). 2021; doi: 10.1016/j.nefro.2020.12.019.
14. Goto S, Fuji H, Hamada Y et al. Association between indoxyl sulphate and skeletal resistance in hemodialysis patients. Ther Apher Dial. 2010; 14 : 417–423.
15. Watanabe K, Tominari T, Hirata M et al. Indoxyl sulphate, a uremic toxin in chronic kidney disease, suppresses both bone formation and bone resorption. FEBS Open Bio. 2017; 20(7): 1178–1185.
16. Yamamoto S, Fukagawa M. Uremic Toxicity and Bone in CKD. J Nephrol. 2017; 30 : 623–627.
17. Hu MC, Shi M, Zhang J et al. Klotho deficiency causes vascular calcification in chronic kidney disease. J Am Soc Nephrol 2011; 22 : 124–136.
18. Graciolli FG, Neves KR, dos Reis LM et al. Phosphorus overload and PTH induce aortic expression of Runx2 in experimental uraemia. Nephrol Dial Transplant. 2009; 24 : 1416–1421.
19. Schlieper G, Schurgers L, Brandenburg V et al. Vascular calcification in chronic kidney disease: an update. Nephrol Dial Transplant 2015.
20. Graciolli FG, Neves KR, dos Reis LM et al. Phosphorus overload and PTH induce aortic expression of Runx2 in experimental uraemia. Nephrol Dial Transplant. 2009; 24 : 1416–1421.
21. Carrilo-Lopez N, Panizo S, Alonso-Montes C et al. High serum phosphate and parathyroid hormone distinctly regulate bone loss and vascular calcifications in experimental chronic kidney disease. Nephrol Dial Transplant 2018; 34 : 934–941.
22. Razzaque MS. The dualistic role of vitamin D in vascular calcifications Kidney Int. 2011; 79 : 708–714.
23. Dusilová Sulková S, Horáček J, Vykoukalová E et al. Parathyroidectomy in Hyperparathyroidism - Associated Calciphylaxis in End-Stage Renal Disease Should be Prompt and Radical – a Case Report with Two Original Therapeutic Modifications and Successful Outcome. Acta Medica (Hradec Kralove). 2017; 60 : 85–88.
24. Duque EJ, Elias RM, Moysés RMA. Parathyroid Hormone: A Uremic Toxin. Toxins (Basel). 2020; 12 : 189. doi: 10.3390/toxins12030189.
25. Silver J, Naveh-Many T. FGF-23 and secondary hyperparathyroidism in chronic kidney disease. Nat Rev Nephrol 2013; 9 : 641–649.
26. Ketteler M, Ambühl P. Where are we now? Emerging opportunities and challenges in the management of secondary hyperparathyroidism in patients with non-dialysis chronic kidney disease. J Nephrol. 2021; doi: 10.1007/s40620-021-01082-2.
27. Komaba H, Ketteler M, Cunningham J et al. Old and New Drugs for the Management of Bone Disorders in CKD. Calcif Tissue Int. 2021; 108 : 486–495.
28. Shutto Y, Shimada M, Kitajima M et al. Lack of awareness among future medical professionals about the risk of consuming hidden phosphate - containing processed food and drinks. PLoS One. 2011; 6: e29105.
29. D’Alessandro C, Piccoli GB, Cupisti A. The “phosphorus pyramid”: a visual tool for dietary phosphate management in dialysis and CKD patients. BMC Nephrol. 2015; 16 : 9.
30. Christodoulou M, Aspray TJ, Schoenmakers I. Vitamin D Supplementation for Patients with Chronic Kidney Disease: A Systematic Review and Meta-analyses of Trials Investigating the Response to Supplementation and an Overview of Guidelines. Calcif Tissue Int. 2021 Apr 25. doi: 10.1007/s00223-021-00844-1.
31. Sista SK, Arum SM. Management of adynamic bone disease in chronic kidney disease: A brief review. J Clin Transl Endocrinol 2016; 5 : 32–35.
32. Dusilová-Sulková S, Šafránek R, Vávrová J et al. Low-dose cholecalciferol supplementation and dual vitamin D therapy in haemodialysis patients. Int Urol Nephrol 2015; 47 : 169–176.
33. Hu MC, Kuro-o M, Moe OW. The emerging role of Klotho in clinical nephrology. Nephrol Dial Transplant 2012; 27(7): 2650–2657.
34. Drueke TB, Massy ZA. Changing bone patterns with progression of chronic kidney disease. Kidney Int 2016; 89(2): 289–302.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



