-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteoporóza u mužů: podceňovaná a neléčená
Osteoporosis in men: underappreciated and undertreated
Osteoporotic fractures of the vertebrae and the proximal end of the femur dramatically impair quality of life and increase morbidity and mortality. Although up to 40% of all osteoporotic fractures occur in men, physicians tend to underestimate the osteoporosis in men, and it remains underdiagnosed and undertreated. Though, there is no evidence that current approved osteoporosis medications work any less well in men than in women, insufficient awareness of the risk of fractures, fear of side effects of drugs and other barriers have made management challenging in men at risk for fracture. Our review provides updates on pathophysiology and current options for diagnosis and treatment of male osteoporosis.
Keywords:
management – Pathogenesis – fractures – male osteoporosis
Autoři: Vít Zikán
Působiště autorů: 3. interní klinika 1. lékařské fakulty UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2021; 67(5): 271-283
Kategorie: Hlavní téma
Souhrn
Osteoporotické zlomeniny obratlů a proximálního konce stehenní kosti dramaticky zhoršují kvalitu života a zvyšují morbiditu i mortalitu. I přesto, že téměř 40 % všech osteoporotických zlomenin vzniká u mužů, lékaři mají tendenci osteoporózu u mužů podceňovat a ta zůstává často nediagnostikovaná a není léčena ani po závažných zlomeninách. Byť nebylo prokázáno, že by současná farmakologická léčba osteoporózy byla u mužů méně účinná než u žen, nedostatečné vědomí o riziku zlomenin, strach z vedlejších účinků léčby a další překážky způsobují, že management osteoporózy u mužů s vysokým rizikem zlomenin je nedostatečný. Článek se zabývá patofyziologií a současnými možnostmi diagnostiky a léčby osteoporózy u mužů.
Klíčová slova:
patogeneze – zlomeniny – management – osteoporóza u mužů
Úvod
Osteoporóza je chronické systémové metabolické onemocnění skeletu charakterizované snížením mechanické odolnosti kosti a v důsledku toho zvýšeným rizikem zlomenin (1). Osteoporotické zlomeniny, zejména zlomeniny obratlových těl a proximálního femuru, vedou k invaliditě, závislosti postižených osob na pomoci druhých a k předčasnému úmrtí (2, 3). Osteoporóza zůstává dlouhou dobu asymptomatická a často uniká pozornosti až do vzniku první zlomeniny. Incidence osteoporotických zlomenin se u mužů významně zvyšuje po dosažení 70 let věku, tedy přibližně o 10 let později než u žen. Celoživotní riziko osteoporotických zlomenin u mužů starších 50 let je odhadováno na 13–25 % (4) a přibližně 30 až 40 % všech zlomenin spojených s osteoporózou se vyskytuje u mužů (5). Mortalita po zlomeninách kyčle a dalších závažných zlomeninách je u mužů dokonce vyšší než u žen (6). Rutinně doporučované screeningové programy pro vyhledávání osteoporózy jsou převážně zaměřeny na ženy po menopauze a většinou nezahrnují muže. I když jsou mnohá onemocnění, např. kardiovaskulární, u mužů běžně diagnostikována a léčena i častěji něž u žen, osteoporóza mezi ně nepatří a zůstává dlouhou dobu nediagnostikována a není léčena (5). Odhaduje se, že pouze 10 % mužů po nízkotraumatické zlomenině proximálního femuru dostane léčbu osteoporózy (7).
Klasifikace osteoporózy u mužů
Osteoporózu rozdělujeme u mužů, podobně jako u žen, na primární a sekundární (Tab. 1). Primární mužská osteoporóza zahrnuje osteoporózu idiopatickou a involuční (u mužů nad 70 let věku). Nízkotraumatické zlomeniny u mladých mužů (< 50 let) poukazují na špatnou kvalitu kosti a jsou nejčastěji důsledkem sekundární osteoporózy. Objasnění sekundárních příčin osteoporózy je klíčové pro volbu kauzálních léčebných opatření, která mohou významně snížit riziko zlomenin. Mezi častější sekundární typy osteoporózy u mladých mužů patří hypogonadismus, sekundární hyperparatyreóza při deficitu vitaminu D a léčba glukokortikoidy. Méně často je příčinou zlomenin nebo nízké BMD (bone mineral density) monogenní onemocnění s opožděnou manifestací v dospělosti (např. osteogenesis imperfecta), idiopatická osteoporóza nebo jiné metabolické nebo nádorové onemocnění skeletu. Samotná nízká BMD u mladých dospělých osob může souviset s tělesnou konstitucí nebo s nedosažením vrcholové kostní hmoty (PBM, Peak Bone Masss) a neznamená vždy zvýšené riziko zlomenin.
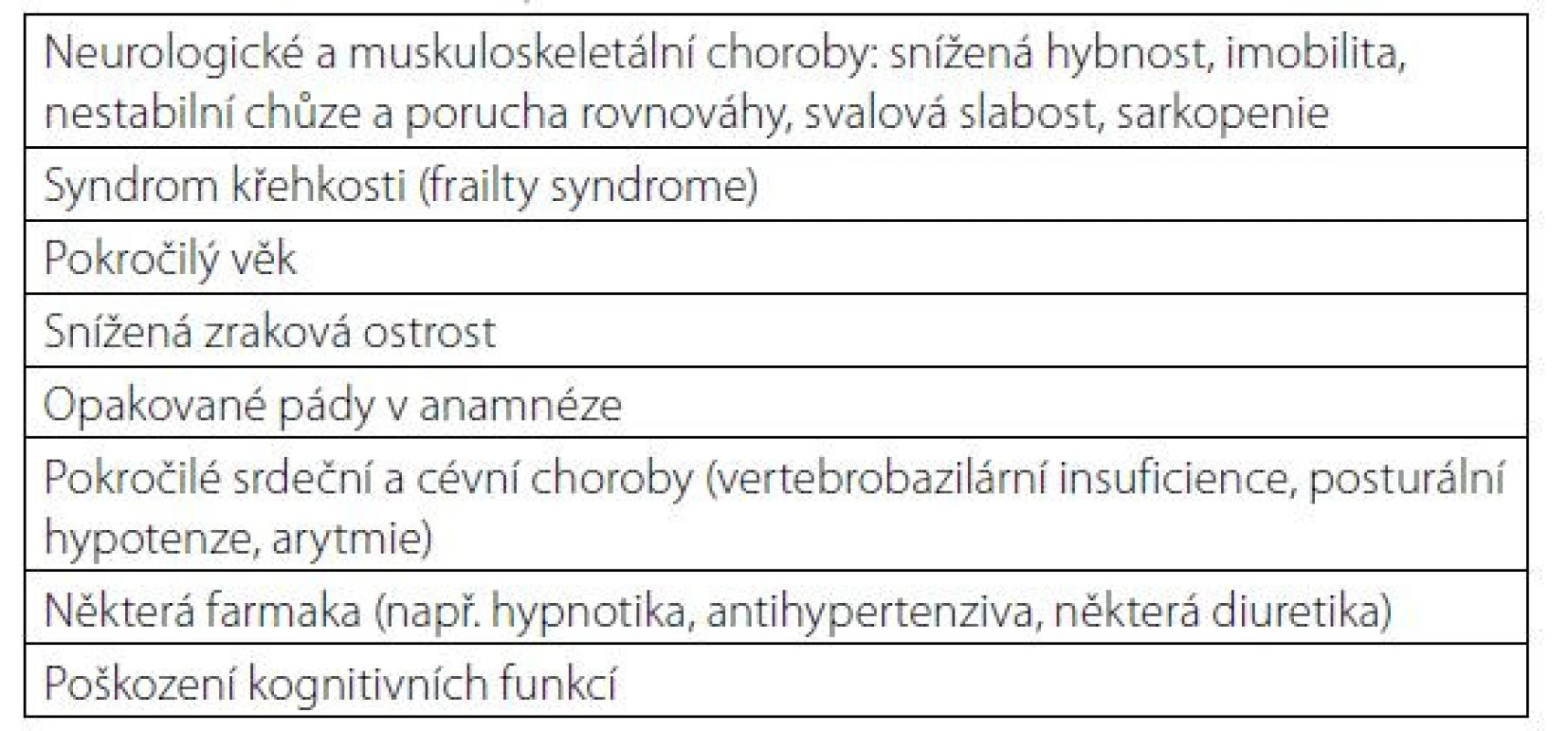
Tab. 1. Příčiny osteoporózy a zlomenin u mužů 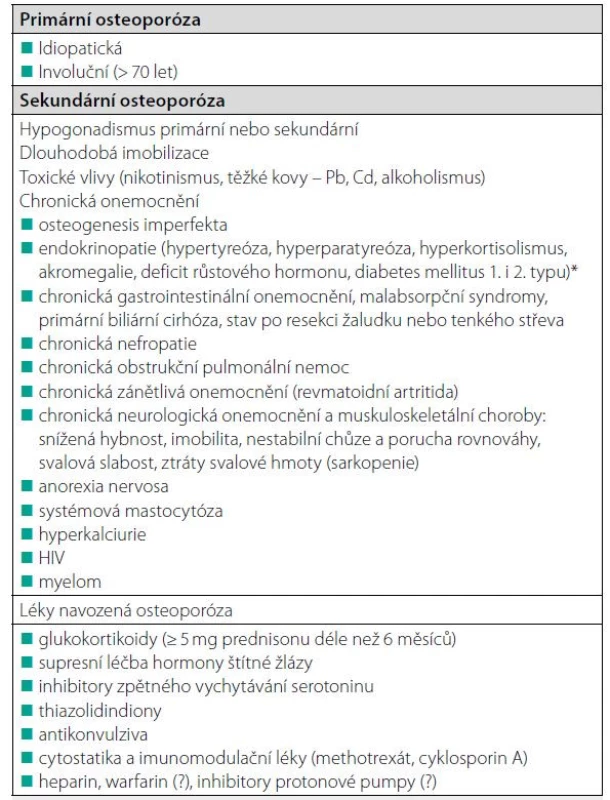
*k vyšší lomivosti kosti může dojít i při normální nebo nadprůměrné BMD v případě porušené kvality kosti např. při hypotyreóze, akromegalii nebo deficitu růstového hormonu, diabetes mellitus 2. typu, nebo u geneticky podmíněných chorob, jako je osteopetróza nebo hypofosfatázie Etiologie a patogeneze
Vývoj skeletu u mužů
Za pozdější nástup osteoporózy u mužů odpovídá jak odlišný vývoj kostry během puberty a dospívání, tak pomalejší úbytek kostní hmoty v dospělosti. U obou pohlaví se růst kostí dramaticky zrychluje s pubertou. Nárůst kostní hmoty (v g/cm3) je u mužů i u žen přibližně stejný, ale muži dosahují větších rozměrů kostí v důsledku větší periostální apozice, což je proces kostní modelace, který závisí také na účinku androgenů a IGF-1. Vývoj kostní hmoty a její determinanty jsou znázorněny na obrázku 1 (Obr. 1). Studie využívající periferní kvantitativní počítačovou tomografii (pQCT) prokazují až o 40 % větší plochu kosti u mladých dospělých mužů ve srovnání s ženami (8) a také rozdíly ve vývoji trámčité a kortikální kosti mezi dívkami a chlapci v průběhu pubertálního růstového spurtu. Během puberty se objemový podíl trámčité kosti a její tloušťka zvětšuje u chlapců, ale nikoliv u dívek. V tloušťce kortikální kosti nebo kortikální objemové BMD mezi chlapci a dívkami na konci puberty nebyly zjištěny rozdíly, ale periostální a endostální obvod se zvětšil více u chlapců než u dívek. K úbytku trámčité kostní hmoty dochází u obou pohlaví již kolem 3. dekády života a u žen se dále urychluje po menopauze. K urychlení úbytku trámčité kosti podobně jako u žen ale dochází i u mužů v případě hypogonadismu nebo při léčbě antiandrogeny. Během stárnutí se kostní trámce u mužů spíše ztenčují v důsledku snížené kostní novotvorby, na rozdíl od žen, kde se více uplatňuje zvýšená osteoresorpce (9) (Obr. 2). Úbytek kortikální kosti nabývá na významu u obou pohlaví po 65.–70. roce života. Ztráta kostní hmoty ve stáří (involuční osteoporóza) je pak důsledkem zejména zvýšené intrakortikální porozity. Nicméně u stárnoucích mužů přispívá k větší pevnosti kortikální kosti a k nižší incidenci neobratlových zlomenin pokračující periostální apozice kosti, která je u mužů větší než u žen (9).
Obr. 1. Vývoj kostní hmoty s věkem 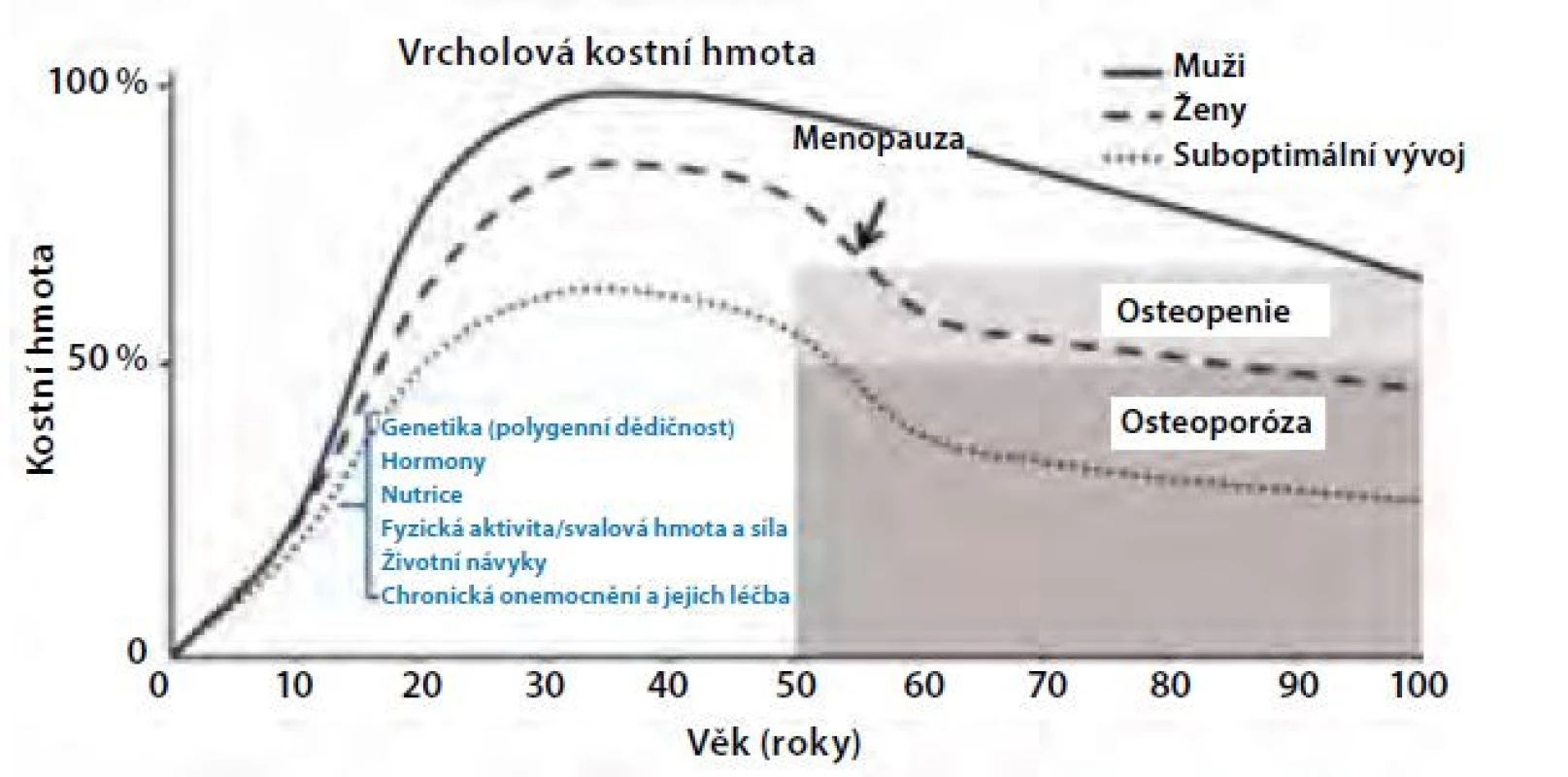
Determinanty vrcholové kostní hmoty: polygenní dědičnost, tedy aditivní účinky více genů a jejich polymorfismů, vysvětluje 50–80 % interindividuální variability vrcholové kostní hmoty; hormony (zejména gonadální steroidy a růstový hormon; nutrice (vápník, vitamin D, bílkoviny, dietní vzory); fyzická aktivita a svalová hmota a síla; škodlivé životní návyky (nikotinismus, abúzus alkoholu); chronická onemocnění nebo jejich léčba (např. glukokortikoidy) (Upraveno podle Weaver CM et al., 2016) Obr. 2. Rozdíly v úbytku kostní hmoty mezi muži a ženami 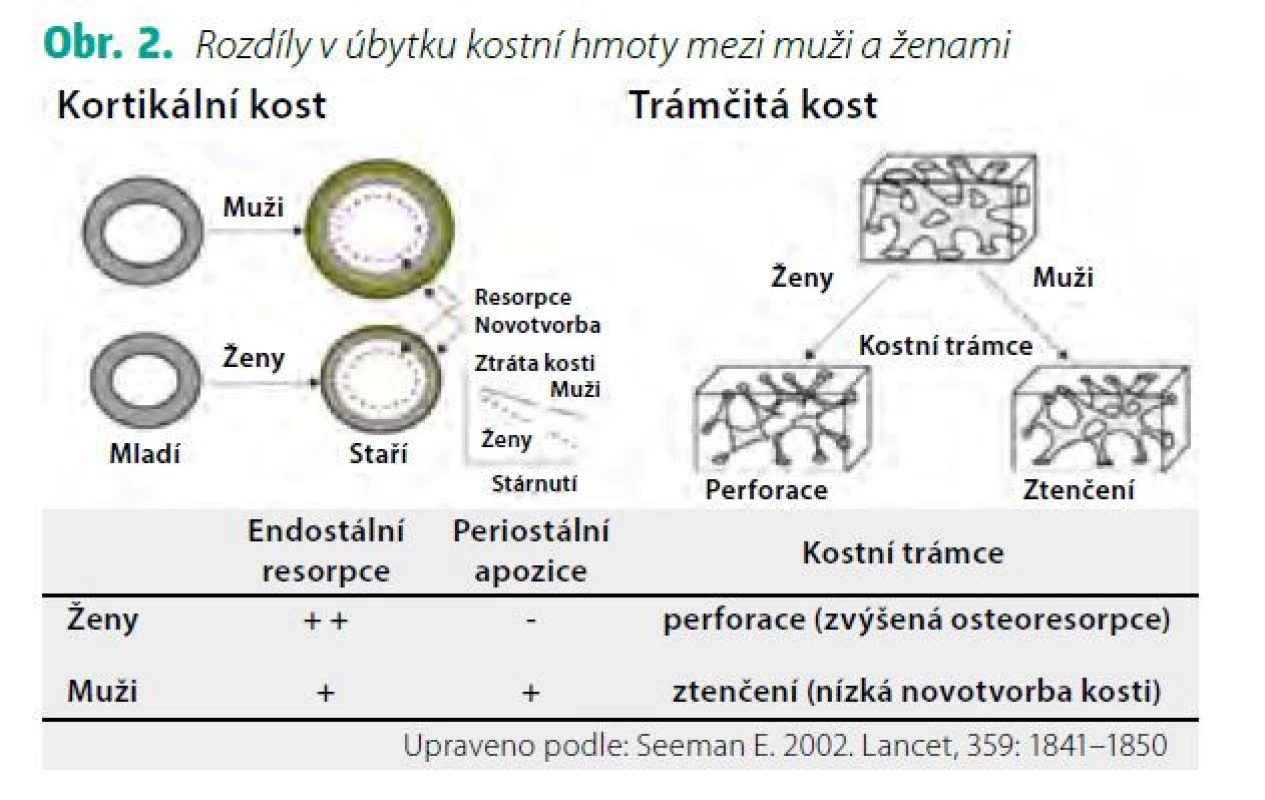
Patogeneze primární osteoporózy u mužů
Idiopatická osteoporóza (IOP) je vzácná metabolická osteopatie. Diagnóza IOP je stanovena per exclusionem až po vyloučení známých sekundárních nebo genetických příčin osteoporózy. Zlomeniny mohou být opakované, častěji byly dokumentovány zlomeniny obratlů. Nízkou BMD u konstitučně štíhlých osob bez prevalentních zlomenin nelze automaticky považovat za IOP, jelikož samotná nízká BMD může být důsledkem nedosažení PBM a souvisí s genetickou predispozicí a životosprávou nebo nemocemi během vývoje skeletu. U mužů byla dokumentována nižší tělesná hmotnost a snížená BMD v oblasti bederní páteře a také tenčí kortikální kost v oblasti dlouhých kostí. Zlomeniny obratlů, které jsou běžné u mužské IOP, byly spojeny se zvýšenou kortikální porozitou v oblasti lopaty kosti kyčelní. Většina mužů s IOP má poměrně typický klinický a histomorfometrický fenotyp. Prokazuje se zejména snížená kostní novotvorba pravděpodobně v důsledku dysfunkce osteoblastů a normální nebo mírně zvýšená resorpce kosti. Histomorfometrické změny, zejména snížení tloušťky kortikální kosti a zvýšení její porozity byly přitom výraznější u pacientů, kteří již prodělali zlomeninu obratle (10). Na zvýšené lomivosti kostí u mužů s primární osteoporózou se podílí zejména genetické faktory. Pro genetické faktory svědčí jak pozitivní rodinná anamnéza, tak studie, které ukazují na významný vliv dědičnosti pro dosažení maxima kostní hmoty. Bylo dokumentováno, že synové mužů trpících osteoporózou mají menší kosti a nižší objemovou BMD (11). Po objevu mutací genů pro aromatázu (CYP119A1), estrogenového receptoru alfa (ESR1) a LRP5 genů u vzácných syndromů spojených s přítomností osteoporózy a zlomenin u mladých mužů byly popsány také polymorfismy těchto genů, které asociovaly se zvýšeným rizikem IOP u mužů (12). Navíc nedostatek estrogenu v důsledku mutací aromatázy (gen CYP19A1) je u mužů spojen se sníženou BMD, bolestmi kostí, zvýšeným kostním obratem a častými zlomeninami. U mužů s IOP bylo dále častěji zaznamenáno zvýšení koncentrací SHBG (Sex hormone-binding globulin) a IGFBP (IGF-binding protein), což vede ke snížení koncentrace volných pohlavních hormonů a IGF-1 i v kosti.
Genetické (monogenní) příčiny osteoporózy a zlomenin
Nízkotraumatické zlomeniny u mladých dospělých osob mohou ve vzácných případech představovat pozdější projev monogenního onemocnění. Bylo popsáno již více než 400 monogenních poruch s kosterními projevy, včetně mutací souvisejících s vyšší lomivostí kostí. Častější monogenní choroby, které se manifestují zlomeninou, jsou uvedeny v tabulce (Tab. 2). U mladých mužů s opakovanými nízkotraumatickými zlomeninami (včetně zlomenin obratlů) a bez zjištěných sekundárních příčin by měly být vyloučeny zejména mírné formy osteogenesis imperfekta, hypofosfatázie (může být spojena s osteomalacií), syndrom osteoporózy s pseudogliomy, Marfanův syndrom a Ehlers-Danlosův syndrom, lysozomální onemocnění (Gaucherova a Pompeho choroba) a endokrinní syndromy (vč. hypogonadotropního hypogonadismu nebo mutací aromatázy).
Tab. 2. Vybrané monogenní choroby, které se manifestují zlomeninou 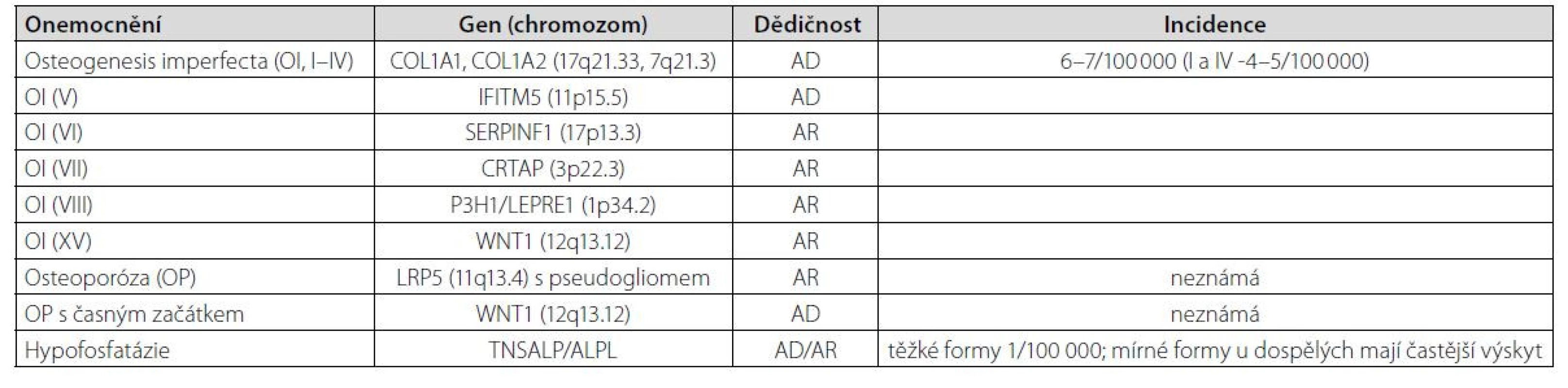
Involuční osteoporóza
Většina strukturálních změn trámčité a kortikální kosti u mužů trpících involuční osteoporózou má pravděpodobně souvislost se změnami endokrinního systému, zvláště s IGF-1 a pohlavními hormony (Obr. 3). Nízká kostní novotvorba může u mužů souviset s nízkými cirkulujícími hladinami IGF-1 a volného estradiolu a vyššími koncentracemi SHBG. U mužů se může uplatňovat nízká PBM a genetická predispozice (byly zjištěny např. polymorfismy genu pro LRP5). I když muži neprocházejí ekvivalentem menopauzy, hladiny estrogenů a androgenů, zejména jejich volné biologicky účinné frakce, klesají po 50.–60. roce života, zřejmě v důsledku komplexních změn v reprodukční fyziologii, vlivem změn životního stylu a prostředí a při zvýšení hladin SHBG. I když přímé androgenní účinky u mužů napomáhají v prevenci osteoporózy stimulací periostální apozice kortikální kosti a udržením svalové síly, existuje velké množství důkazů o tom, že u dospělých mužů má významnou úlohu rovněž aromatizace androgenů na estradiol (E2) prostřednictvím aktivity aromatázy (enzymu CYP19A1) (13, 14). Estradiol se váže na α a β receptory exprimované na osteoblastech, osteoklastech, osteocytech a stromálních buňkách kostní dřeně. Zvýšení koncentrací SHBG s věkem může být hlavní příčinou poklesu hladiny pohlavních steroidů u mužů, což vede k poklesu biologicky dostupného testosteronu a hladiny estrogenů. Předchozí práce prokázaly, že estrogeny sehrávají důležitou roli jak při regulaci kostní modelace a remodelace u mladých mužů, tak při úbytku kostní hmoty u starších mužů. Mellstrom a spol. (15) hodnotili výskyt zlomenin a analyzovali pohlavní hormony u 2 639 starších mužů ve Švédsku (průměrný věk 75 let, průměrná doba sledování 3,3 let) a zjistili, že estradiol a SHBG (nikoliv volný testosteron) nezávisle asociovaly s rizikem zlomenin. Byla nalezena významná inverzní asociace mezi hladinami volného estradiolu v séru a klinickými zlomeninami obratlů a neobratlovými zlomeninami včetně zlomenin kyčle. Kromě toho se ukazuje, že existuje práh estradiolu v séru, pod kterým je mužská kostra estrogen deficitní (16). Muži s hladinou estradiolu pod touto hranicí (~16 ng/l) vykazují zvýšení rizika zlomenin (16). Další hormonální změny, jako je deficit vitaminu D a sekundární hyperparatyreóza jsou spojeny s involučním úbytkem kostní hmoty a s rizikem zlomeniny u starších mužů. Typickým znakem stárnutí v rámci pohybového systému je nejen úbytek kostní hmoty, ale také ztráta svalové hmoty a svalové síly (pokles o 10 až 20 % na každých deset let po dosažení věku 50 let) (17). Ztráta kosterní svalové hmoty a síly se urychluje po dosažení věku 65 let a je spojena s poruchami hybnosti, zvýšeným rizikem pádů, ztrátou nezávislosti a se snížením průměrné délky života. Kromě toho je ztráta svalů úzce spojena se ztrátou kostní hmoty a její mechanické odolnosti (Obr. 3). Kombinace osteoporózy a sarkopenie zvyšuje riziko zlomenin také kvůli poruše rovnováhy, která usnadňuje pády. Na vzniku sarkopenie se podílí nejen věk a hypogonadismus, ale také mnoho dalších příčin, které u mužů vyvolávají osteoporózu.
Obr. 3. Patogeneze primární a hypogonadismem navozené osteoporózy u mužů 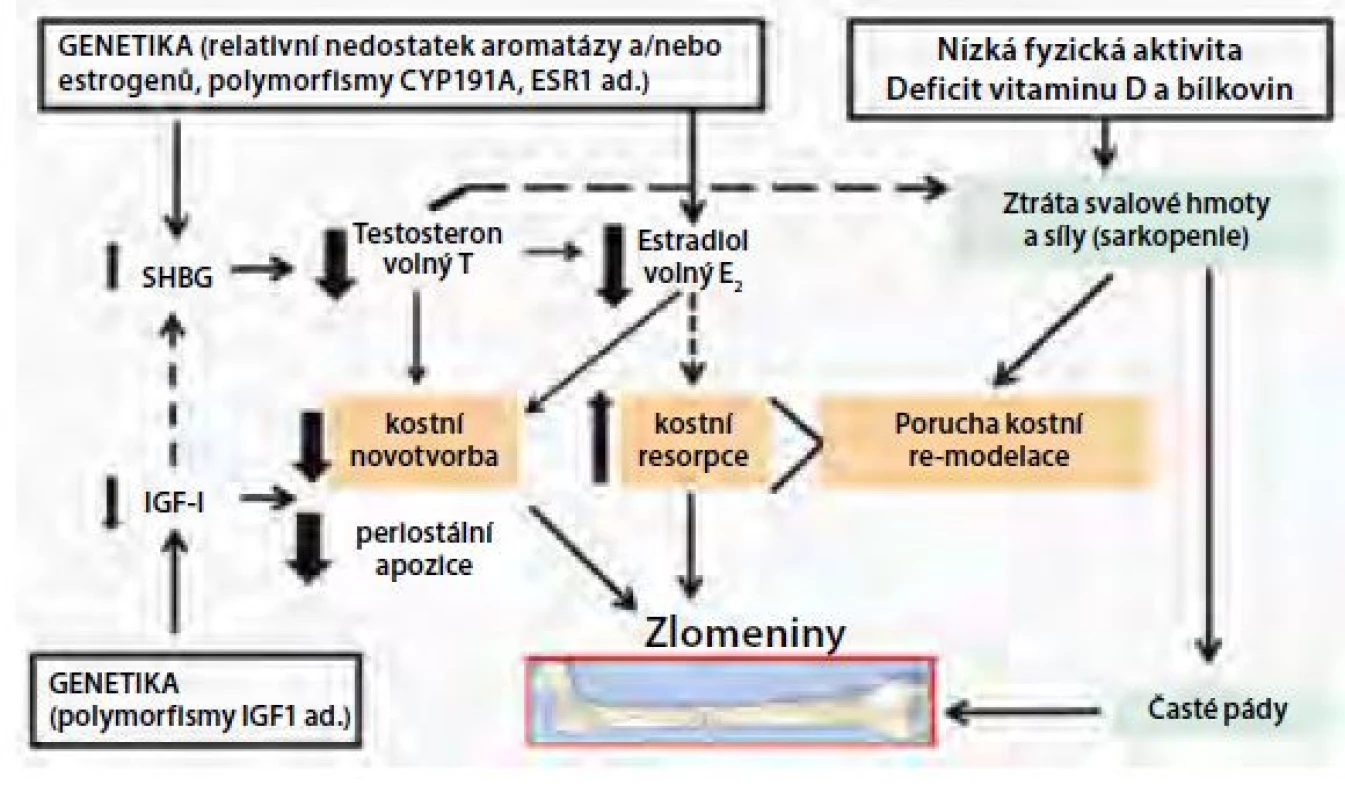
Sekundární osteoporóza
Kromě nízkého maxima kostní hmoty a úbytku kostní hmoty souvisejícího s věkem přispívá k rozvoji osteoporózy a zlomenin u mužů řada dalších faktorů (Tab. 3, 4). Příčinu osteoporózy lze identifikovat u 40 až 60 % mužů s osteoporotickou zlomeninou. Mezi nejčastější příčiny osteoporózy u mužů patří hypogonadismus, léčba glukokortikoidy, gastrointestinální onemocnění, nedostatek vitaminu D a sekundární hyperparatyreóza, antikonvulzivní léky, hyperkalciurie a abúzus alkoholu (Tab. 1). Dalším faktorem, který pravděpodobně přispívá ke změně kostního metabolismu, zejména u starších mužů, je snížená aktivita somatotropní osy s poklesem plazmatických hladin IGF1 s možnými nepříznivými účinky na kostní novotvorbu. Hypogonadismus je nejlépe charakterizovaným rizikovým faktorem pro osteoporózu u mužů. Průřezové studie ukazují, že BMD je snížena u mužů s primárním nebo sekundárním hypogonadismem, u mužů s konstitučním zpožděním puberty, idiopatického hypogonadotropního hypogonadismu a u androgenní necitlivosti. U mužů s hladinami testosteronu v séru pod přibližně 6,9 nmol/l se zvyšuje kostní obrat a klesá kostní denzita, pravděpodobně v důsledku současného poklesu hladin estradiolu v séru pod 16 ng/l (16). Bylo provedeno několik longitudinálních studií u mužů s rizikem osteoporózy v důsledku hypogonadismu. BMD klesá jak u mladých mužů s hypogonadismem, tak u starších mužů s pokročilým karcinomem prostaty, kteří podstupují androgenní ablační terapii (18). Zvýšení rizika zlomenin při léčbě androgenní deprivací (spíše než při orchiektomii) může být mírnější. To bylo ilustrováno v mnohem rozsáhlejší studii 50 613 mužů s diagnózou karcinomu prostaty; zlomeninu mělo 19 % z 6 650 mužů, kteří dostávali alespoň 5 let androgenní deprivační terapii (ve srovnání s 12 % z 20 035 pacientů, kteří nedostávali androgenní deprivační terapii) (19).
Tab. 3. Klinické rizikové faktory zlomenin u mužů 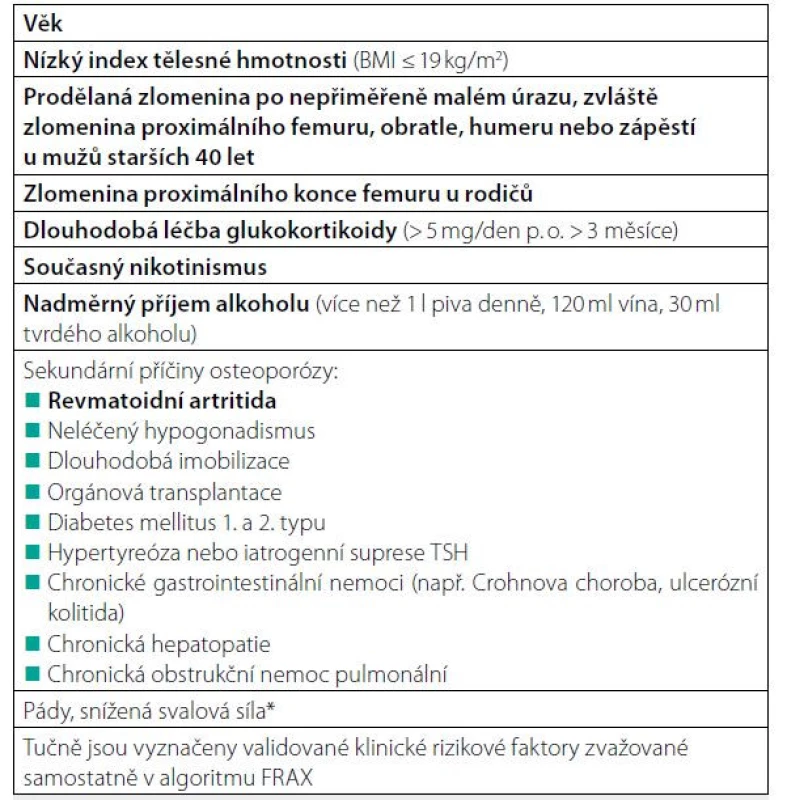
*Nejsou v současné době zahrnuté v algoritmu FRAX® Množství svalové hmoty lze určit pomocí DXA a svalovou sílu pomocí „hand-grip“ testu. Fyzickou výkonnost můžeme orientačně hodnotit pomocí testu rychlosti chůze (23) Tab. 4. Léky, které významněji ovlivňují kostní metabolismus a mohou zvyšovat riziko zlomenin při dlouhodobé léčbě 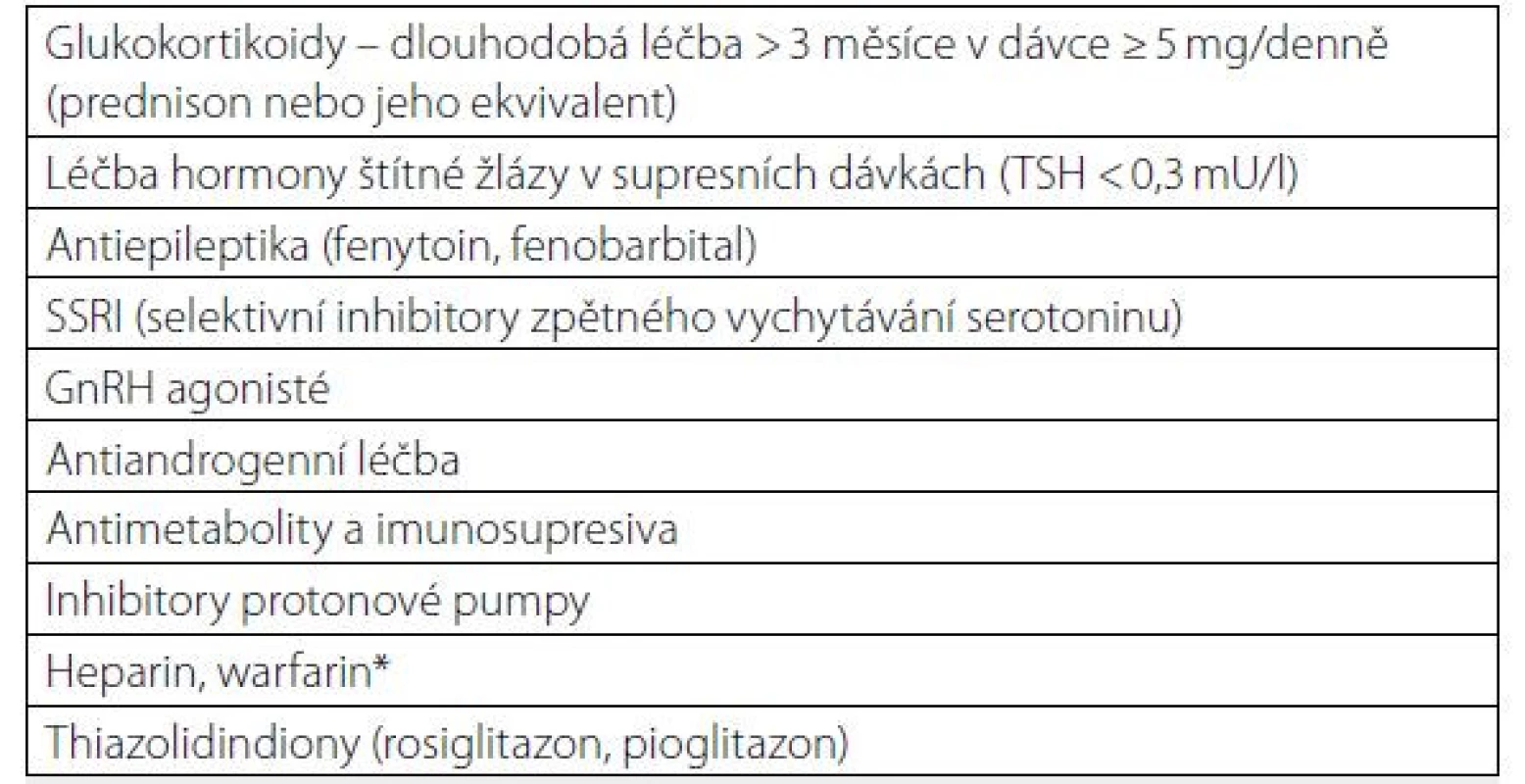
*nebylo jednoznačně prokázáno, u nových p. o. antikoagulačních léků zatím nepotvrzen negativní efekt na kost Diagnostika a diferenciální diagnostika osteoporózy
Osteologické vyšetření včetně dvouenergiové rentgenové absorptraumatickou zlomeninou nebo u chronických onemocnění a dalších stavů, které jsou spojeny s úbytkem a zhoršením kvality kostní hmoty (Tab 1). DXA vyšetření lze dále doporučit u všech mužů starších 70 let. U mladších mužů je vyšetření vhodné, pokud mají alespoň 1 významný rizikový faktor zlomenin (Tab. 3, 4).
Hodnocení množství kostní hmoty
Standardem pro diagnostiku osteoporózy je hodnocení BMD metodou dvouenergiové rentgenové absorpciometrie (DXA; Dual energy X-ray Absorptiometry) v oblasti krčku femuru, celkového proximálního femuru a bederní páteře (L1–L4) nebo distálního úseku radia (1/3 radius). Indikace k DXA vyšetření včetně hodnocení obratlových zlomenin – VFA (Vertebral Fracture Assessment) jsou uvedeny v tabulce (Tab. 5A, B). Osteoporóza je definována podle WHO jako snížení BMD alespoň o 2,5 směrodatné odchylky (SD) proti průměru u mladých dospělých osob (T-skóre ≤ -2,5 SD). Manifestovaná (těžká) osteoporóza je definována přítomností alespoň 1 osteoporotické zlomeniny. Pacienti s T-skóre v rozmezí mezi -1 až -2,5 SD se řadí do kategorie osteopenie, která znamená podprůměrný, ale ještě normální nález. Pacienti s osteopenií ale mohou mít vyšší riziko zlomenin, pokud je současně poškozená kvalita kosti. Uvedená kritéria WHO jsou platná pro postmenopauzální ženy a pro muže starší 50 let. Mezinárodní společnost pro klinickou denzitometrii (ISCD) i IOF (Mezinárodní nadace pro osteoporózu) doporučuje užívání jednotné referenční databáze bílých žen ve věku 20–29 let (NHANES III) pro hodnocení T-skóre u všech žen i mužů bez ohledu na etnikum (20). U mužů ≤ 50 let doporučuje ISCD pro hodnocení plošné BMD pomocí DXA užívat Z-skóre (srovnání s populací stejného pohlaví a odpovídajícího kalendářního věku). Hodnoty Z-skóre ≤ -2,0 se považují za „významně snížené vzhledem ke kalendářnímu věku“. Na rozdíl od ISCD IOF doporučuje u mladých osob s dosaženou PBM užívat k hodnocení BMD T-skóre, podobně jako u žen po menopauze (srovnání s populací mladých zdravých dospělých osob, pásmo osteoporózy odpovídá hodnotě BMD ≤-2,5 T-skóre). Pro spolehlivou diagnózu osteoporózy u mladých mužů je vyžadována jak nízká BMD (Z-skóre ≤ 2 SD nebo T-skóre ≤-2,5), tak současná přítomnost nízkotraumatických zlomenin nebo sekundárních faktorů a klinických stavů, které vedou k úbytku kostní hmoty a zvyšují riziko zlomenin. Opakované měření BMD je vhodné k vyloučení pokračující ztráty kostní hmoty a k identifikaci osob s vyšším rizikem zlomeniny.
Tab. 5. A. Indikace k vyšetření denzity kostního minerálu (BMD pomocí DXA) 
Tab 5B. Indikace k morfometrii obratlů (DXA-VFA nebo radiologické vyšetření páteře) u mužů 
DXA: dvouenergiová rentgenová absorpciometrie, VFA: Vertebral Fracture Assessment Osteologické vyšetření
V praxi by osteologické vyšetření mělo zahrnovat úplnou osobní, rodinnou a pracovní anamnézu a pečlivé fyzikální vyšetření (Tab. 6). Vzhledem k tomu, že 40–60 % mužů s diagnostikovanou osteoporózou má sekundární etiologii osteoporózy (Tab. 1), může být klinická diagnóza primární (involuční nebo idiopatické) osteoporózy určena až po pečlivé diferenciální diagnostice a vyloučení jiných příčin nízké BMD a/nebo zlomenin (Tab. 7). Důležité je zhodnotit anamnézu již prodělaných zlomenin, údaje o bolesti zad a fyzikální vyšetření se zaměřením na skelet a sekundární příčiny osteoporózy, měření tělesné výšky a hmothmotnosti a zaznamenání jejich změn. Klinické podezření na deformitu obratle vzrůstá při zjištění snížení tělesné výšky o více než 3 cm. K ověření deformity obratle je možné využít semi-kvantitativní hodnocení morfologie obratlových těl pomocí software při DXA vyšetření (tzv. VFA, vertebral fracture assessment), jehož výhodou je nízká radiační zátěž. Při nejistém nálezu provádíme standardní rentgenový snímek hrudní a bederní páteře v boční projekci. Důležité je nezapomenout i na možnost oligosymptomatického průběhu u některých onemocnění (např. u celiakie, Cushingova syndromu, primární hyperparatyreózy nebo systémové mastocytózy). Opakované měření BMD je vhodné k vyloučení pokračující ztráty kostní hmoty a k identifikaci osob s vyšším rizikem zlomenin. Biochemické markery kostního obratu (BTM) – jsou nápomocné při hodnocení aktivity kostního procesu v diferenciální diagnostice a také pro monitorování léčby osteoporózy. Standardně je doporučován sérový C-terminální telopeptid kolagenu typu 1 (βCTX-I) a propeptid prokolagenu I (PINP). Krev pro laboratorní vyšetření je nezbytné odebrat ráno nalačno. Nízká BMD a zvýšené BTM mohou svědčit pro zrychlený úbytek kostní hmoty. Zvýšení BTM může způsobit i recentní zlomenina (i na několik měsíců). Nízký kostní obrat, zejména nízké koncentrace plazmatického osteokalcinu, mohou svědčit pro hyperkortizolismus. U pacientů s osteogenesis imperfekta se zjišťují normální nebo snížené koncentrace PINP a ßCTX v séru, zatímco plazmatický osteokalcin bývá zvýšený. V indikovaných případech je doplněno zobrazovací vyšetření (scintigrafie skeletu, CT nebo MRI vyšetření). Ve vzácných případech může být nezbytná kostní biopsie za účelem objasnění etiologie kostního procesu a správné vedení léčby (vyloučení vzácné metabolické nebo nádorové osteopatie, osteomalacie nebo různých typů renální osteodystrofie).
Tab. 6. Anamnéza a fyzikální vyšetření při podezření na metabolické onemocnění skeletu 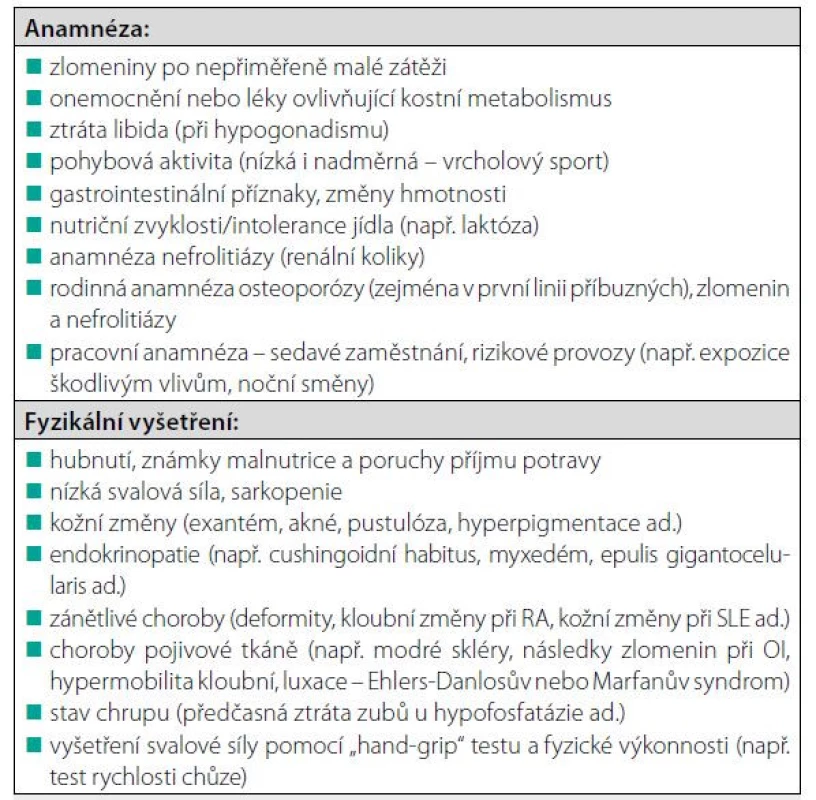
RA: revmatoidní artritida; OI: osteogenesis imperfecta, SLE: systémový lupus erytematodes Tab. 7. Základní a doplňující laboratorní vyšetření u mužů s nízkou BMD nebo nízkotraumatickou zlomeninou 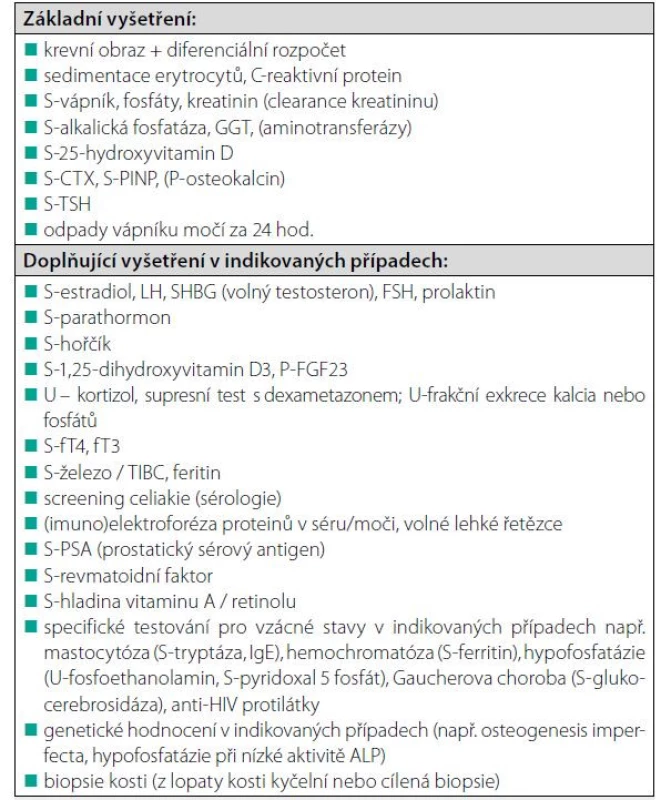
TSH: hormon stimulující štítnou žlázu; LH: luteinizační hormon; FSH: folikuly stimulující hormon; PTH: parathormon; TIBC: celková vazebná kapacita pro železo v séru, ALP: alkalická fosfatáza; FGF 23: fibroblastový růstový faktor 23 ; S-sérum; P-plazma Koho léčit?
V současné době neexistuje ověřená strategie pro terapeutické rozhodování u mužů. Podle současných doporučení se hodnocení BMD pomocí DXA obecně doporučuje u mužů ≥ 70 let a u mladších mužů v případě, že mají významné rizikové faktory nebo u pacientů s již prodělanou zlomeninou po nepřiměřeně malé zátěži. I když se diagnostika osteoporózy v současné době opírá zejména o hodnocení BMD, je vhodné mít na paměti, že nemoc znamená zvýšenou křehkost kosti a ne vždy nízkou BMD, která je jen jednou z mnoha změn, které vypovídají o riziku zlomenin. Diagnostická hranice pro osteoporózu neurčuje přesně terapeutický práh. I když BMD vysvětluje 75–90 % variability mechanické odolnosti kosti a snížení BMD o 1 T-skóre znamená přibližně zdvojnásobení rizika zlomenin, práh BMD, po jehož překročení je zlomenina nevyhnutelná, nebyl zjištěn. Většina zlomenin se navíc zjišťuje u osob, které mají podle denzitometrické klasifikace WHO jen osteopenii (BMD T-skóre > -2,5). Riziko zlomenin totiž závisí významně i na kvalitě kosti (např. mikroarchitektuře kosti, aktivitě kostních buněk), které v klinické praxi zatím neumíme neinvazivně hodnotit. Epidemiologické studie potvrdily, že výpověď BMD o riziku zlomeniny se může významně zlepšit, pokud budeme BMD zvažovat v kontextu s dalšími klinickými rizikovými faktory zlomenin (Tab. 3). Prodělaná osteoporotická zlomenina je významným rizikovým faktorem další zlomeniny. Pokud pacient ještě neutrpěl osteoporotickou zlomeninu, zůstává i její individuální riziko prodělat zlomeninu významně nižší. U pacientů bez prodělané osteoporotické zlomeniny, ale s dalšími validovanými rizikovými faktory zlomenin je doporučeno zhodnotit individuální pravděpodobnost prodělat během dalších 10 let některou z hlavních osteoporotických zlomenin (zápěstí, obratle, proximálního femuru nebo humeru) nebo pouze zlomeninu proximálního femuru pomocí nástroje FRAXTM, který integruje váhu jednotlivých klinických rizikových faktorů zlomenin bez anebo společně s BMD v krčku femuru (případně v celkovém proximálním femuru) (21). Pro výpočet je volně přístupný kalkulátor FRAX na webové adrese: http://www. shef.ac.uk/FRAX/. Výpočet FRAX závisí na věku (FRAX platí pro muže nad 50 let) a také na geografické oblasti (populační riziko zlomenin). Nástroj byl kalibrován i pro populaci v ČR (22). Pokud se do výpočtu FRAX nezadá hodnota BMD, lze zohlednit i vliv dalších rizikových faktorů, které částečně ovlivňují BMD, jako jsou další sekundární příčiny osteoporózy (Tab. 3, 4). Je zřejmé, že algoritmus pro výpočet individuálního rizika zlomenin se bude dále vyvíjet, jak budou validovány další rizikové faktory zlomenin. Nově algoritmus FRAX integruje hodnotu TBS (Trabecular Bone Score), která vypovídá nezávisle na BMD o riziku zlomenin. Hodnotu FRAX musíme vždy hodnotit v klinickém kontextu. FRAX např. podhodnocuje riziko zlomenin obratlů u mladších mužů, kteří mají ještě normální hodnoty BMD v krčku femuru, nebo riziko zlomenin u pacientů léčených glukokortikoidy. Z dalších rizikových faktorů se může uplatnit např. rychlost úbytku BMD. Oblast, která zasluhuje mnohem větší pozornost, je vliv svalové hmoty na kostní metabolismus a riziko pádů. Ztráta svalové hmoty a síly ovlivňuje přímo kostní metabolismus a také zvyšuje riziko pádů, a tedy i riziko zlomenin, zejména zlomenin kyčle. Významné je posouzení rizikových faktorů pádů (Tab. 8) a případně posouzení stupně sarkopenie (23).
Léčba osteoporózy je doporučena po diferenciálně diagnostickém vyšetření u mužů nad 50 let věku pokud mají vysokou pravděpodobnost prodělat zlomeninu. Napomoci mohou následující kritéria: 1) prodělaná osteoporotická zlomenina kyčle (bez ohledu na BMD nebo FRAX); 2) BMD s T-skóre ≤ 2,5 SD v oblasti páteře nebo kyčle; 3) osteopenie a prodělaná klinické zlomenina obratle, proximálního konce humeru, pánve (nebo v některých případech zlomenina distálního předloktí či morfometrická zlomenina obratle); 4) dlouhodobá terapie p. o. glukokortikoidy. Farmakologickou léčbu zvažujeme i u sekundární osteoporózy, pokud není kauzální terapie dostatečně účinná (pokračující úbytek BMD nebo zhoršující se kvalita kosti, např. při léčbě glukokortikoidy). Nástroj FRAX by mohl napomáhat k rozhodnutí koho léčit, ale v ČR zatím intervenční práh stanoven nebyl a farmakologická léčba je zahajována na základě kritérii BMD (T-skóre -2,5 SD) nebo při manifestované osteoporóze. Rozhodnutí, při jaké hodnotě FRAX zahajovat léčbu (intervenční práh), závisí na farmakoekonomických modelech a může se lišit mezi jednotlivými státy. Např. pro ženy i muže v USA je z hlediska získané kvality života ekonomicky výhodné podávat léčbu, pokud je pravděpodobnost prodělat hlavní osteoporotickou zlomeninu v dalších 10 letech vyšší než 20% a pro zlomeninu kyčle vyšší než 3%. FRAX může být ale vhodným nástrojem např. v ambulanci praktického lékaře pro identifikaci rizikových pacientů. Pokud je nízká pravděpodobnost prodělat zlomeninu podle FRAX, lze doporučit preventivní opatření. V případě vysoké pravděpodobnosti prodělat zlomeninu má být indikováno další vyšetření včetně BMD a u pacienta by měla být zvažována léčba.
Jak léčit?
Nutriční a nefarmakologická opatření
Pro zajištění geneticky determinovaného maxima kostní hmoty během dětství a dospívání a udržení zdravé kostní hmoty je nezbytná pravidelná a přiměřená fyzická aktivita a zdravá výživa s udržením normální tělesné hmotnosti (udržení svalové síly, normální poměr tukové a svalové tkáně, vyvarovat se extrémních dietních opatření a velkých výkyvů hmotnosti), normální hormonální stav a vyloučení škodlivých návyků, jako je nikotinismus nebo abúzus alkoholu a toxických vlivů prostředí (např. expozice těžkým kovům). Nikotinismus zrychluje ztrátu kostní hmoty (celoživotní kouření cigaret snižuje BMD o 5–10 %). Kouření také blokuje příznivý účinek estradiolu na kost. Negativní vliv má abúzus alkoholu (více než litr piva, 120 ml vína, nebo 30 ml tvrdého alkoholu denně). V prevenci osteoporózy doporučujeme dostatečný příjem vápníku a kvalitních bílkovin, zejména mléčné výrobky, které zajišťují kromě vápníku také proteiny, draslík, hořčík, a fermentované mléčné výrobky, rovněž prebiotika a probiotika (24, 25). Mléčné výrobky mohou zajišťovat až 65 % doporučeného denního příjmu vápníku a 20–28 % požadavků na příjem bílkovin (25). Doporučovaný denní příjem bílkovin u osob nad 50 let věku je 1,0 až 1,2 g/kg tělesné hmotnosti/den (26). Nedostatečný příjem bílkovin a nízký energetický příjem vede k úbytku jak svalové, tak kostní hmoty a zvyšuje riziko pádů a zlomenin. K udržení zdravé kostní hmoty jsou nezbytné i další složky stravy, zejména vitaminy D, K a C, esenciální mastné kyseliny, alkalizující složky stravy a vláknina (ovoce a zelenina). Nepříznivý vliv mají zpracované potraviny s nadměrným obsahem živočišných tuků, NaCl, fosfátů a jednoduchých cukrů. Škodlivé účinky mají některé stopové prvky (hliník, olovo, kadmium, kobalt), nadbytek vitaminu A, nikotin a nadměrný příjem alkoholu. Stravovací zvyklosti jsou ovlivněny řadou faktorů, např. únavou a stresem. To může vést k vyššímu příjmu energeticky bohatých tzv. „rychlých nebo pohodlných potravin“, které mají prozánětlivé účinky a přispívají k rozvoji střevní dysbiózy. Střevní mikrobiota je mimo jiné nezbytná pro tvorbu mastných kyselin s krátkým řetězcem, které posilují bariérové funkce střeva a působí protizánětlivě (přispívají k nárůstu regulačních T-lymfocytů). Byl dokumentován význam střevní mikrobioty pro absorpci vápníku a její vliv na kostní remodelaci. Řada studií dokumentuje, že úprava střevní mikrobioty, např. pomocí probiotik a prebiotik, může být slibnou cestou i v prevenci osteoporózy (27). V tomto kontextu byl již pozorován příznivý vliv fermentovaných mléčných výrobků na kost oproti nefermentovaným.
Vápník a vitamin D
U všech pacientů s osteoporózou nebo při vyšším riziku osteoporózy je vhodné zajistit dostatečný příjem vápníku a vitaminu D. U mužů nad 50 let je doporučený celkový příjem vápníku 1 000–1 200 mg vápníku denně (preferenčně mléčné výrobky a při nedostatečném příjmu umělé přípravky vápníku. Při negativní vápníkové bilanci (nízký denní příjem a/nebo snížená dostupnost vápníku) se rozvijí sekundární hyperparatyreóza a dochází k významnému úbytku kortikální kosti. Účinnost střevní absorpce vápníku klesá s věkem a v důsledku nedostatku estrogenů a vitaminu D nebo při nadbytku kortizolu (léčbě glukokortikoidy). V případě suplementace vápníkem je vhodné, aby jednotlivá porce elementárního vápníku nepřesahovala 500 mg (saturace aktivních transportních mechanismů). Pro střevní absorpci vápníku ze suplementů je důležitá současná přítomnost stravy. Dostupnost vápníku ze suplementů ve formě uhličitanu vápenatého bude omezená při užití nalačno, zejména při achlorhydrii (nebo při léčbě inhibitory protonové pumpy). Vápník se také dostatečně nevstřebává, pokud je přijímám současně potravinami s vyšším obsahem fosfátů, tuků, vlákniny a kyseliny fytové a šťavelové (vazba vápníku ve střevě). Vitamin D je nezbytný pro účinnou střevní absorpci vápníku a má rovněž přímé účinky na kostní a svalové buňky. S věkem významně klesá schopnost tvorby vitaminu D v kůži a zdroje vitaminu D jsou v ČR omezené (potraviny nejsou fortifikovány vitaminem D a z běžné stravy získáme maximálně 1/10 doporučené denní dávky). Nedostatkem vitaminu D trpí zejména v zimních a jarních měsících více než 60 % osob starších 65 let. V observačních studiích je nedostatek vitaminu D spojován s osteoporózou, špatnou fyzickou výkonností a zvýšeným rizikem zlomenin. Důkazy podporující přínos suplementace vápníku a vitaminu D u mužů s osteoporózou pocházejí převážně z prospektivních, randomizovaných, placebem kontrolovaných studií. Ačkoli řada studií uvádí příznivý účinek vápníku a vitaminu D na BMD u starších mužů, údaje o četnosti zlomenin jsou variabilnější. O zásobení organismu vitaminem D se nejlépe přesvědčíme změřením koncentrace 25-hydroxyvitaminu D v séru (25OHD), která by měla být v doporučeném rozmezí 50–150 nmol/l (optimální udávaná hladina je alespoň 75 nmol/l). Koncentrace nad 220 nmol/l jsou ale považovány za toxické (riziko vzniku hyperkalcémie a hyperkalciurie). Deficit vitaminu D je definován při hladinách 25OHD < 30 nmol/l a nedostatečnost (insuficience) při koncentraci 25OHD mezi 30–50 nmol/l. Doporučená denní dávka vitaminu D3 (cholekalciferolu) je u osob nad 50 let věku 800–1 000 IU (20–25 ug) podávaná denně, případně týdně (6 000 – 7 000 IU). V případě nedostatečného zásobení (insuficience) lze podat jednorázově 60 000 IU vitaminu D3 p. o. a pokračovat v doporučené denní suplementaci (800–1 000 IU), případně dávku 60 000 IU měsíčně opakovat až do dosažení optimální koncentrace 25(OH)D. V případě těžkého deficitu vitaminu D (< 30 nmol/l) doporučujeme užívat p. o. cholekalciferol v dávce 6 000 IU denně nebo 60 000 IU jedenkrát týdně po dobu 2 měsíců s následnou kontrolou 25(OH)D. U pacientů s gastrointestinálními chorobami a s malabsorpcí nebo u obézních musí být optimální dávkování suplementace vápníkem a vitaminem D stanoveno individuálně a léčba musí být pečlivě monitorována (riziko hyperkalciurie a hyperkalcemie). Intermitentní aplikace vysokých dávek vitaminu D (v ČR dostupný ergokalciferol v dávce 300 000 IU i. m.) ale není doporučena vzhledem k nežádoucím účinkům (zvýšení rizika pádů a zlomenin) (28). Zajištění doporučeného příjmu vápníku a optimálních hladin vitaminu D brání rozvoji sekundární hyperparatyreózy a vede ke snížení rizika zlomenin, zvláště u starších a institualizovaných osob. Farmakologická léčba osteoporózy je méně účinná u pacientů s deficitem vitaminu D a/nebo nedostatečným příjmem vápníku a v případě silné antiosteoresorpční léčby např. i. v. bisfosfonáty nebo denosumabem se může vyskytnout i symptomatická hypokalcemie. Farmakoterapie proto nemá být zahajována u pacientů s deficitem vitaminu D. Omezení příjmu vápníku a vitaminu D je nezbytné u pacientů s rizikem hyperkalcemie a hyperkalciurie, např. při primární hyperparatyreóze, idiopatické hyperkalciurii nebo při sarkoidóze (extrarenální tvorba kalcitriolu aktivovanými makrofágy). Při chorobách ledvin, kde je porušena hydroxylace 25(OH)D na kalcitriol, je vhodné zvažovat také užití aktivního metabolitu vitaminu D alfakalcidiolu (1α–hydroxycholekalciferol). Léčba aktivními metabolity vitaminu D ale vyžaduje pečlivou monitoraci. U pacientů s kalcium-oxalátovou urolitiázou není vhodné snižovat příjem vápníku potravou (kalcium váže oxaláty ve střevě a snížení příjmu vápníku naopak zvyšuje riziko urolitiázy).
Pravidelná fyzická aktivita a snížení rizika pádů
Nezbytnou podmínkou pro udržení pevnosti skeletu je i přiměřená fyzická zátěž. Dlouhodobě nízká fyzická aktivita nebo porucha hybnosti patří k významným rizikovým faktorům osteoporózy. V případě, že skelet (osteocyty) není dostatečně zatěžován, dochází ke stimulaci kostní resorpce a snižuje se novotvorba kostní hmoty (vyšší produkce sklerostinu při nízké fyzické aktivitě). Ztráta svalové hmoty a síly tak ovlivňuje přímo kostní metabolismus a také zvyšuje riziko pádů a tedy i riziko zlomenin, zejména zlomenin kyčle. Prokazuje se, že riziko zlomeniny je významně vyšší, pokud je současně přítomna sarkopenie nebo syndrom křehkosti (frailty) (23). Kostní a svalová tkáň je v úzkém vztahu, a proces stárnutí se podílí na ztrátě funkčnosti jak kostí, tak svalů. U mužů nad 50 let je doporučeno cvičit po dobu alespoň 30 minut nejméně třikrát týdně. Také pravidelná chůze alespoň 2 hodiny denně pomáhá udržet kostní a svalovou hmotu a snižuje riziko pádů a zlomenin, včetně nejzávažnějších zlomenin proximálního femuru. Vhodná jsou i cvičení, která nezatěžují skelet, ale vedou ke zlepšení svalové koordinace (např. plavání a cvičení ve vodě). U všech pacientů je vhodné zhodnotit riziko pádů (Tab. 8) a zvážit modifikaci rizikové farmakoterapie (např. hypnotika, hypotenziva, diuretika ad.). Kromě zlepšování fyzické kondice lze riziko pádů významně snížit zajištěním kvalitní obuvi a úpravou interiérů (odstranit překážky v bytě, protiskluzné podložky a opory, kvalitní osvětlení), případně užitím chráničů kyčlí.
Léčba sekundární etiologie osteoporózy
Léčba má být kauzální, tedy cílená podle etiologie a aktivity kostního procesu. U mladých mužů s nízkou BMD, ale bez zlomenin či známých sekundárních příčin osteoporózy a bez zrychleného úbytku BMD (hodnoty BTM jsou v pásmu referenčních hodnot) není farmakoterapie téměř nikdy indikována. Nízké hladiny testosteronu jsou spojeny s řadou klinických stavů, jako je androgen deprivační léčba (ADT), infekce HIV a její léčba, obezita, diabetes mellitus, jaterní a renální dysfunkce nebo chronická obstrukční plicní nemoc. Hypogonadismus je proto nutné vždy u mužů zvažovat, zvláště v případě nálezu osteoporózy. Léčba testosteronem u hypogonadálních mužů trpících osteoporózou příznivě ovlivňuje BMD. Substituční léčba je indikována u mladších mužů s hypogonadismem, a pokud nejsou zjištěna další rizika pro osteoporotickou zlomeninu, je dostačující opakované testování BMD (každé 2–3 roky). Léčba povede kromě nárůstu BMD také ke zlepšení kvality svalové hmoty. I když neexistují studie prokazující snížené riziko zlomenin u těchto mužů, je rozumné předpokládat, že normalizace sérového testosteronu významně sníží i riziko zlomenin. Současná doporučení endokrinologů zdůrazňují u starších mužů vzhledem k rizikům hormonální substituce užívání aminobisfosfonátů (BP) nebo jiných schválených nehormonálních léků i pro hypogonadální muže (29). Snížení BMD lze zjistit již po 6–9 měsících androgen-deprivační léčby. Výchozí měření BMD a pravidelné monitorování BMD v ročních intervalech během léčby je vhodné a v případě významného zhoršení BMD by měla být zvážena antiresorpční léčba BP nebo denosumabem. Léčbu testosteronem u mužů zajišťuje endokrinolog. Před zahájením je vyžadováno interní a urologické vyšetření a je nezbytné vyloučit riziko nádorového onemocnění prostaty.
Farmakologická léčba
Terapeutické přístupy k osteoporóze u mužů jsou méně dobře definované než u žen. Studie u mužů, obecně, neměly dostatečné počty pacientů pro zjišťování rizika fraktur a byly hodnoceny náhradní parametry účinnosti (tzv. „surrogates“), zejména změny BMD a biochemických markerů kostní remodelace. Tyto studie ale ukazují, že účinnost farmakologické antiosteoporotické léčby je u mužů pravděpodobně podobná jako u žen (30). Zůstává nejistota týkající se léčby idiopatické osteoporózy u mužů, která se vyznačuje spíše nízkou kostní novotvorbou než zvýšením kostního obratu. Léky, které byly testovány v klinických studiích u mužů, jsou uvedeny v tabulce 9. Farmakologická léčba by měla být užívaná vždy společně s nefarmakologickými opatřeními, zejména musí být zajištěn dostatečný příjem vápníku a vitaminu D.
Tab. 9. Účinnost a nežádoucí účinky farmakologické léčby osteoporózy u mužů 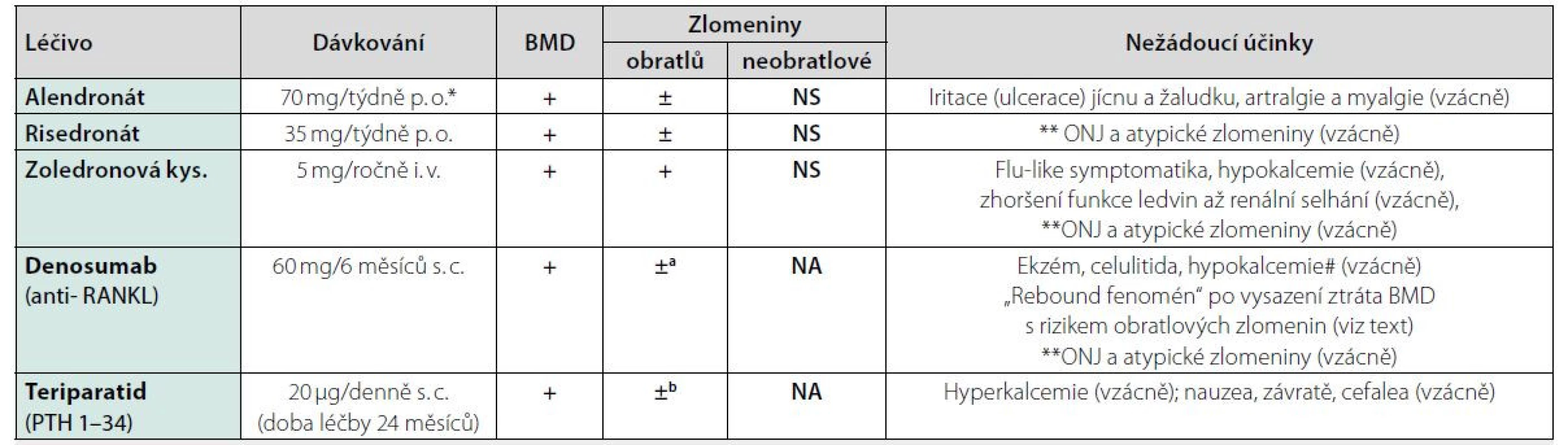
BMD: Bone Mineral Density; +: prokázaný účinek; ±: sekundární endpoint nebo metaanalýza ; NS: nesignifikantní, NA: nedostatek údajů; a) snížení rizika obratlových zlomenin u mužů s karcinomem prostaty na androgen deprivační léčbě; b) údaje získané z observační studie po 30 měsících sledování po ukončení léčby; *alendronát byl validován ve studiích jako denní orální dávka 10 mg, nyní se užívá jako týdenní orální dávka 70 mg, ekvivalence těchto dávkovacích režimů byla dokumentována u žen; RANKL: ligand pro receptor aktivující nukleární faktor kappa B
# Riziko i symptomatické hypokalcemie je zejména u pacientů s deficitem vitaminu D, chronickou nedostatečností ledvin, s malabsorpcí nebo s hypoparatyreózou. Nejnižší kalcemie se vyskytuje přibližně 7–10 dní po podání denosumabu. Pacienti s predispozicí k hypokalcemii (tj, při GF < 30 ml/min) by měli být kontrolováni a dostatečně suplementováni vitaminem D a vápníkem. **ONJ: osteonekróza čelisti. Riziko ONJ je při léčbě BP nebo denosumabem u pacientů léčených pro osteoporózu jen hraničně zvýšené oproti incidenci ONJ v běžné populaci. Etiologie ONJ je multifaktoriální a vliv BP nebo denosumabu je pouze jedním faktorem (útlum kostní remodelace a toxický účinek BP). Riziko ONJ ale narůstá (1–15 %) v závislosti na dávce BP u pacientů s metastazujícími karcinomy, kteří jsou léčeni vysokými dávkami i. v. BP nebo denosumabem. Léčbu BP, zejména parenterálními a denosumabem, se nedoporučuje podávat před invazivními stomatologickými výkony (extrakce, implantáty), případně léčbu odložit po zhojení. V případě již probíhající antiresorpční léčby je doporučeno výkon zajistit antibiotiky a dodržet zásady prevence ONJ během výkonu.** Za atypické zlomeniny se považují zejména subtrochanterické zlomeniny (nebo zlomeniny v diafýze femuru distálně od malého trochanteru), které vznikly po nepřiměřeně malém traumatu nebo atraumaticky u pacientů léčených dlouhodobě BP nebo denosumabem. Opatrnost je nutná zejména u pacientů s nízkou kostní přestavbou už před zahájením léčby, např. při léčbě glukokortikoidy. Bilaterální fraktury se uvádějí u více než 40 % pacientů s atypickou zlomeninou. Atypické zlomeniny mohou vznikat i v jiných místech skeletu (popisují se jako únavové či stresové zlomeniny s periostální reakcí). Hojení těchto zlomenin je opožděné. Až 2/3 pacientů s atypickou zlomeninou femuru uvádějí prodromální bolesti kosti trvající řadu měsíců. Podobné zlomeniny se popisují i u pacientů léčených glukokortikoidy nebo při osteopetróze a hypofosfatázii. Pokud se prokáže atypická zlomenina (podle morfologických kritérií), je to důvodem pro vysazení antiresorpční léčby.Aminobisfosfonáty
Aminobisfosfonáty (BP) jsou syntetická analoga pyrofosfátu, která jsou rezistentní vůči chemické i enzymatické hydrolýze, mají vysokou afinitu ke kostnímu minerálu a tlumí aktivitu a životnost osteoklastů. V závislosti na typu BP a dávkování tlumí BP v různém stupni také kostní novotvorbu (až o více než 90 % při léčbě alendronátem). Provedené prospektivní placebem kontrolované studie s p.o. užívanými aminobisfosfonáty alendronátem a risedronátem u mužů s primární nebo hypogonadální osteoporózou vedly k významnému nárůstu BMD v páteři i v krčku stehenní kosti. Byť tyto studie nebyly navrženy tak, aby měly dostatečnou statistickou sílu k hodnocení rizika zlomenin, bylo snížení výskytu zlomenin v některých studiích pozorováno jako sekundární end-point. Meta-analýza dvou randomizovaných studií hodnotících účinnost alendronátu (10 mg denně p. o.) ve srovnání s placebem u 375 mužů s primární osteoporózou nebo s osteoporózou při hypogonadismu prokázala snížení rizika zlomenin obratlů (31), ale nikoliv snížení rizika neobratlových zlomenin. Risedronát (35 mg p. o. týdně) byl hodnocen ve dvouleté dvojitě zaslepené randomizované studii v porovnání s placebem u 284 mužů s primární nebo hypogonadismem navozenou osteoporózou. Léčba risedronátem významně zvýšila BMD bederní páteře a krčku femuru (32). Léčba risedronátem v dávce 5 mg denně po dobu 2 let v otevřené randomizované studii u 316 mužů s primární nebo sekundární osteoporózou manifestovanou zlomeninami obratlů snížila výskyt nových obratlových zlomenin i neobratlových zlomenin ve srovnání s alfakalcidiolem (v dávce 1 ug denně) (33). Risedronát byl účinný i při léčbě úbytku BMD a v prevenci zlomenin kyčle u mužů > 65 let věku, kteří utrpěli cévní mozkovou příhodu (34). Pro léčbu osteoporózy u mužů je dostupná dále kyselina zoledronová, která se aplikuje nitrožilně v dávce 5 mg v 15minutové infúzi 1× ročně. Účinnost a bezpečnost kyseliny zoledronové byla ověřena ve velké placebem kontrolované studii, která hodnotila riziko zlomenin po recentně prodělané nízkotraumatické zlomenině proximálního femuru (v kombinované mužské a ženské populaci, 1 619 žen a 508 mužů, průměrný věk 74,5 let) (35, 36). Léčba významně snížila výskyt nových klinických zlomenin, klinických zlomenin obratlů i neobratlových zlomenin a také úmrtnost ve srovnání s placebem. Následná analýza potvrdila, že léčba zvyšuje BMD v podobném rozsahu u mužů i u žen. V další placebem kontrolované studii u 1 199 mužů ve věku 50–85 let, s primární nebo hypogonadismem navozenou osteoporózou, bylo po 2 letech léčby kyselinou zoledronovou dosaženo 65% snížení relativního rizika jedné nebo více nových morfometrických vertebrálních fraktur (37). Studie s různými BP u mužů ukázaly, že muži s nízkými koncentracemi testosteronu v séru odpovídali na léčbu BP obdobně jako muži s normální hladinou testosteronu. V současné době lze u mužů s osteoporózou (T-skóre ≤ -2,5 nebo nízkotraumatická zlomenina) podávat všechny p. o. aminobisfosfonáty a v základní úhradě i kyselinu zoledronovou. Kyselinu zoledronovou lze užít ve zvýšené úhradě u pacientů při kontraindikaci p. o. BP nebo u mužů se zvýšeným rizikem zlomenin užívajících p. o. glukokortikoidy (při T-skóre < -1,5).
Bezpečnost léčby
Provedené studie u mužů ani hlášení z klinické praxe nepřineslo jiné specifické nežádoucí účinky vzhledem k pohlaví. Léčba p. o. BP může způsobit dyspepsii, nauzeu, zvracení a bolesti břicha, zejména v epigastriu v důsledku lokální iritace nebo ulcerace jícnu a žaludku. Riziko je u pacientů s dysfagií, při onemocnění jícnu a gastroduodena. Riziko mohou zvyšovat současně podávaná nesteroidní antirevmatika. Léčba p. o. BP není vhodná u pacientů s anamnézou krvácení do GIT v posledním roce a při zvýšeném riziku tohoto krvácení např. při antikoagulační léčbě. U i. v. forem BP vzniká, zejména po 1. aplikaci tzv. reakce akutní fáze (horečka, bolest hlavy, nauzea, bolesti kostí, myalgie a artralgie) s ústupem do 1–3 dnů. Před aplikací BP je vždy nezbytné upravit případnou hypokalcemii, hypomagnezemii nebo hypovitaminózu D (vyloučit malabsorpci nebo hypoparatyreózu) a po celou dobu léčby BP zajistit dostatečný denní příjem vápníku a vitaminu D. Ojediněle byly hlášeny případy poškození funkce ledvin a akutní selhání ledvin po podání kys. zoledronové. Opatrnost je nezbytná především u pacientů s již existující renální nedostatečností a při současné léčbě diuretiky nebo nefrotoxickými léky. Podávání kys. zoledronové se nedoporučuje u pacientů se závažným poškozením funkce ledvin (clearance kreatininu < 35 ml/min). Pro nedostatek klinických zkušeností se nedoporučuje aplikovat ani p. o. BP u pacientů s hodnotami clearance kreatininu pod 30 ml/min (nebo kreatininu v séru nad 200 μmol/l). Před každou infuzí kyseliny zoledronové by měl být pacient dostatečně hydratován. Podání infuze kys. zoledronové by mělo trvat nejméně 15 minut. Riziko osteonekrózy čelisti (ONJ) je při léčbě BP nebo denosumabem u pacientů léčených pro osteoporózu jen hraničně zvýšené oproti incidenci ONJ v běžné populaci (38) (Tab. 9). Před zahájením léčby BP je doporučeno preventivní odborné ošetření chrupu (sanace infekčních ložisek), pravidelné preventivní kontroly u stomatologa a dodržování zásad dentální hygieny po celou dobu léčby.
Vzhledem k možnému negativnímu vlivu dlouhodobé léčby BP na kvalitu kosti (riziko vzniku atypických zlomenin) bylo navrženo dočasné přerušení nebo změna dlouhodobé léčby BP („drug holiday“). V současné době ale není shoda na tom, jak dlouho pokračovat v léčbě BP u mužů. Léčba BP by měla trvat kontinuálně nejméně 3–5 let. Doporučujeme léčbu BP dočasně přerušit u mužů, kteří užívali alendronát po dobu pěti let nebo kteří dostávali kyselinu zoledronovou jednou ročně po dobu tří let, pokud je jejich BMD stabilní a neměli po dobu léčby nízkotraumatické zlomeniny. Delší dobu léčby zvažujeme u pacientů s vysokým rizikem zlomenin a při užití BP s kratším poločasem v kosti (risedronát). Délka přerušení léčby je individuální (zvažujeme riziko zlomenin) a vyžaduje monitoraci k ověření trvání účinku léčby (BMD, markery kostní remodelace zpravidla po 1–2 letech). U pacientů s těžkou osteoporózou a s vysokým rizikem zlomenin je vhodné zvažovat sekvenční léčbu s teriparatidem.
Denosumab
Denosumab (60 mg 1x za 6 měsíců s. c.) je plně lidská monoklonální protilátka proti RANK ligandu (ligand pro Receptor Aktivující Nukleární faktor κB, který je nezbytný pro diferenciaci, aktivaci a přežívání osteoklastů). Léčba denosumabem brání tvorbě a aktivaci osteoklastů a inhibuje kostní resorpci kortikální i trámčité kosti. Denosumab, podobně jako BP, významně potlačuje nejen odbourávání, ale také kostní novotvorbu. Osteoresorpce zůstává snížena při léčbě osteoporózy po jedné aplikaci denosumabu minimálně 6 měsíců. Na rozdíl od účinků BP byl při léčbě denosumabem zjištěn nárůst BMD také v distálním úseku předloktí, což svědčí o dobrém průniku léku i do kortikální kosti (39). Denosumab byl schválen pro léčbu osteoporózy u mužů s vysokým rizikem zlomenin léčených androgen-deprivační terapií (ADT) pro nemetastazující karcinom prostaty, v návaznosti na pozitivní výsledky z velké randomizované kontrolované studie (40). U mužů s karcinomem prostaty s ADT léčených denosumabem došlo k významnému snížení výskytu nových zlomenin obratlů po 36 měsících léčby. Denosumab byl účinný také ve zvyšování BMD v bederní páteři i v proximálním femuru během 12 měsíců léčby v placebem kontrolované studii fáze 3 u mužů s nízkou BMD (41) i v jejím prodloužení o další rok (42). Léčba byla u mužů dobře tolerována. V návaznosti na tyto výsledky byl denosumab schválen i pro léčbu primární nebo hypogonadismem navozené osteoporózy u mužů s nízkou BMD nebo u mužů s již prodělanou osteoporotickou zlomeninou. Denosumab je v ČR hrazen u mužů s osteoporózou prokázanou celotělovým denzitometrem (T – skóre ≤ -2,5) a to: a) při osteoporotické fraktuře, nebo b) při prokázané neúčinnosti, kontraindikaci nebo nesnášenlivosti jiných antiresorpčních léčiv, nebo c) po dosažení věku 70 let.
Bezpečnost léčby
Denosumab není vylučován ledvinami, a proto úprava dávkování při renální insuficienci není nutná. Pacienti ale mohou být ohrožení hypokalcemií (k největšímu poklesu kalcemie dochází přibližně 7–10 dní po podání denosumabu), proto je před léčbou nezbytné vyloučit hypokalcemii, hypomagnezemii a nedostatek vitaminu D a během léčby trvale zajišťovat dostatečný denní příjem vápníku a vitaminu D. V registrační studii byl při léčbě denosumabem zaznamenán významně častěji výskyt ekzému a těžké celulitidy vyžadující hospitalizaci (0,3 % oproti < 0,1 %). Možné vzácné nežádoucí účinky zahrnují také potenciálně závažné hypersenzitivní reakce, osteonekrózu čelisti a atypické zlomeniny (Tab. 9). Na rozdíl od BP, jejichž účinky na kost přetrvávají i řadu let po vysazení, je působení denosumabu plně reverzibilní. Přerušení léčby denosumabem ale vede k rychlému vzestupu kostní resorpce (během 3–6 měsíců po přerušení léčby) s významnou ztrátou BMD (klesá během 12 měsíců) a s nárůstem rizika vícečetných zlomenin obratlů, zejména u pacientů s prevalentními zlomeninami obratlů. Pacient by měl být o tomto riziku informován již při zahájení léčby. Po přerušení léčby denosumabem je proto nezbytné navázat léčbou BP (43).
Osteoanabolická léčba
Tyto léky stimulují tvorbu nové kostní hmoty a mohou tak, na rozdíl od antiresorpčních léků, obnovit množství a kvalitu kostní hmoty. Z osteoanabolických léků je v ČR k dispozici teriparatid (rekombinantní N-terminální fragment PTH 1-34; 20 ug s. c.). Léčba teriparatidem po dobu 11 měsíců u mužů s primární nebo hypogonadismem navozenou osteoporózou zvýšila BMD prakticky ve stejném rozsahu jako léčba teriparatidem u žen (44). V souladu s osteoanabolickou aktivitou teriparatidu došlo k výraznému zvýšení biochemických markerů kostní novotvorby a to bez ohledu na gonadální stav, věk, výchozí BMD nebo BMI. Léčba teriparatidem (po dobu 18 měsíců) byla účinná i u mužů středního věku s idiopatickou osteoporózou a zlomeninami. Studie u postmenopauzálních žen prokázaly účinnost teriparatidu i ve snížení rizika obratlových i neobratlových zlomenin, provedené studie u mužů ale neměly dostatečný počet pacientů, aby prokázaly změny v incidenci zlomenin. Tuto informaci ale nepřímo přinášejí studie u mužů, kteří byli dále sledováni po ukončení léčby teriparatidem, stejně jako klinické studie u osteoporózy indukované glukokortikoidy, ve které byly zahrnuty ženy i muži (45). U pacientů s glukokortikoidy navozenou osteoporózou byla léčba teriparatidem lepší než léčba alendronátem, pokud jde o navýšení BMD i prevenci zlomenin (45). Meta-analýza observačních klinických studií (muži i ženy s osteoporózou) dokumentovala účinnost teriparatidu i ve snížení rizika zlomenin kyčle (snížení rizika o 56 %) (46). Po ukončení léčby teriparatidem je ale následná antiosteoresorpční léčba nezbytná, aby se zabránilo opětovné ztrátě kostní hmoty. Léčba teriparatidem je v ČR hrazena u mužů k léčbě glukokortikoidy navozené osteoporózy (i bez prevalentní zlomeniny) a u primární nebo sekundární osteoporózy až po selhání předchozí minimálně 2 roky trvající, spolehlivě dokumentované antiresorpční léčby, pokud je BMD bederní páteře nebo kyčle (při nemožnosti měření v oblasti bederní páteře) ≤ -2,5 SD a zároveň s více než jednou zlomeninou obratlového těla v anamnéze. Léčba teriparatidem je omezena na dobu 24 měsíců.
Bezpečnost léčby
Teriparatid je obecně dobře snášen. Monitorování kalcemie nebo kalciurie není vyžadováno, opatrnost je ale nutná u pacientů s urolitiázou. Léčba je kontraindikována u dětí a dospívajících, dále při hyperparatyreóze nebo hyperkalcemii, u primárních tumorů kostí, myelomu nebo při metastatickém postižení skeletu a u pacientů s vyšším rizikem osteosarkomu, tedy u Pagetovy kostní choroby a u pacientů, kteří prodělali léčebnou radiaci skeletu.
Adherence k léčbě a její monitorování
Údaje o adherenci k léčbě u mužské populace jsou omezené, ale odhaduje se, že až 2/3 mužů má nízkou adherenci k léčbě k p. o. BP a tedy i vyšší riziko nízkotraumatických zlomenin. U starších mužů s vysokým rizikem zlomenin může být preferovanou léčbou nitrožilní aplikace kyseliny zoledronové v ročním intervalu, která je s výhodou z hlediska zajištění plné účinnosti léčby, zejména u starších a hůře mobilních pacientů. Důležitou součástí léčby osteoporózy je i její monitorování, tedy ověření, zda pacient odpovídá na léčbu očekávaným způsobem, nebo naopak na léčbu neodpovídá a je nutné přehodnotit způsob léčby. V klinické praxi je nutné znát nejmenší významnou změnu měření (LSC, least significant change) pro hodnocení BMD v páteři a v proximálním femuru nebo vybraného biochemického markeru kostní remodelace (CTX β nebo PINP). Obecně platí, že BMD by při léčbě neměla významně klesat (více než LSC pro danou oblast měření). V případě antiosteoresorpční léčby by markery kostní remodelace měly zůstávat v rozmezí premenopauzálních hodnot a v případě osteoanabolické léčby teriparatidem sledujeme nárůst koncentrace markeru kostní novotvorby PINP v séru. Zhoršení BMD (více než LSC na daném přístroji a pracovišti) a/nebo nedostatečná změna biochemického markeru kostní remodelace je důvodem pro zjištění příčin (nízká compliance k léčbě, špatná indikace léku, špatná diagnóza, jiné příčiny úbytku BMD než osteoporóza) a zvážení změny léčby.
Závěr
Navzdory rostoucímu povědomí o závažnosti osteoporotických zlomenin u mužů i narůstajícím možnostem diagnostiky a léčby je osteoporóza u mužů stále nedostatečně diagnostikována a často není léčena ani po závažných osteoporotických zlomeninách. U mužů s anamnézou nízkotraumatické zlomeniny, zvláště po recentní zlomenině obratle nebo proximálního konce stehenní kosti, je bezprostřední riziko následných zlomenin velmi vysoké a léčba těchto pacientů by měla být prioritou. V klinické praxi jsou jako léky první linie doporučovány u mužů zejména BP risedronát nebo kyselina zoledronová, která má prokázanou účinnost z hlediska snížení rizika zlomenin. Nitrožilní aplikace kyseliny zoledronové v ročním intervalu je s výhodou z hlediska zajištění plné účinnosti, zejména u starších a hůře mobilních pacientů. Denosumab je vhodnou alternativou při vysokém riziku zlomenin u starších mužů, zejména při androgen deprivační léčbě nebo v případě kontraindikací pro BP. U pacientů s těžkou osteoporózou (po selhání předchozí antiresorpční léčby) nebo u osteoporózy navozené glukokortikoidy je vhodné volit osteoanabolickou léčbu teriparatidem (v sekvenčním režimu s navazující antiresorpční léčbou), která má potenciál obnovit poškozenou nebo ztracenou kostní tkáň. Předpokladem plné účinnosti každé farmakologické léčby je zajištění kvalitní výživy s úpravou mikrobioty a s dostatečným příjmem bílkovin, vápníku a vitaminu D. Pravidelná pohybová aktivita a další opatření k udržení svalové síly a koordinace a snížení rizika pádů jsou klíčová opatření pro prevenci zlomenin v každém věku. Osteoporózu lze včas diagnostikovat i léčit a utrpení i nákladná péče o zlomeniny nejsou neodvratitelné. Prevence i léčba osteoporózy ale nepochybně vyžaduje mezioborový přístup, tedy spolupráci jak praktických lékařů, tak lékařů dalších specializací s osteologickými pracovišti.
Publikace byla podpořena MZ ČR – RVO VFN64165.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Vít Zikán, Ph.D.
3. interní klinika 1. lékařské fakulty UK a VFN U Nemocnice 1, 128 00 Praha 2
Cit. zkr: Vnitř Lék 2021; 67(5): 271–283
Článek přijat redakcí: 21. 6. 2021
Článek přijat po recenzích: 30. 7. 2021
Zdroje
1. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001; 285 : 785–795.
2. Bliuc D, Nguyen ND, Milch VE et al. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA. 2009; 301 : 513–521.
3. Hernlund E, Svedbom A, Ivergård M et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporos. 2013; 8(1): 136.
4. Hopkins RB, Pullenayegum E, Goeree R et al. Estimation of the lifetime risk of hip fracture for women and men in Canada.Osteoporos Int. 2012; 23(3): 921–927.
5. Kaufman JM. Management of osteoporosis in older men. Aging Clin Exp Res. 2021; 33(6): 1439–1452.
6. Haentjens P, Magaziner J, Colón-Emeric CS et al. Meta-analysis: excess mortality after hip fracture among older women and men. Ann Intern Med. 2010; 152 : 380–390.
7. Binkley N, Adler R, Bilezikian JP. Osteoporosis diagnosis in men: the T-score controversy revisited. Curr Osteoporos Rep. 2014; 12(4): 403–409.
8. Riggs BL, Melton III LJ, Robb RA et al. A population-based study of age and sex differences in bone volumetric density, size, geometry and structure at different skeletal sites. J Bone Miner Res. 2004; 19 : 1945–1954.
9. Seeman E, Bianchi G, Khosla S et al. Bone fragility in men – where are we? Osteoporos Int. 2006; 17 : 1577–1583.
10. Ostertag A, Collet C, Chappard C et al. A case–control study of fractures in men with Idiopathic osteoporosis: fractures are associated with older age and low cortical bone density. Bone. 2013; 52 : 48–55.
11. Van Pottelbergh I, Goemaere S, Zmierczak H et al. Deficient acquisition of bone during maturation underlies idiopathic osteoporosis in men: evidence from a three generation family study. J Bone Miner Res. 2003; 18 : 303–311.
12. van Meurs JB, Trikalinos TA, Ralston SH et al. Large-scale analysis of association between LRP5 and LRP6 variants and osteoporosis. JAMA. 2008; 299 : 1277–1290.
13. Mohamad NV, Soelaiman IN, Chin KY. A concise review of testosterone and bone health. Clin Interv Aging. 2016; 11 : 1317–1324.
14. Khosla S, Oursler MJ, Monroe DG. Estrogen and the skeleton. Trends Endocrinol Metab. 2012; 23(11): 576–581.
15. Mellstrom D, Vandenput L, Mallmim H et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures. J Bone Miner Res. 2008; 23 : 1552–1560.
16. Finkelstein JS, Lee H, Leder B et al. Gonadal steroid-dependent effects on bone turnover and bone mineral density in men. J Clin Invest. 2016; 126(3): 1114.
17. Verschueren S, Gielen E, O‘Neill TW et al. Sarcopenia and its relationship with bone mineral density in middle-aged and elderly European men. Osteoporos Int. 2013; 24 : 87–98.
18. Mittan D, Lee S, Miller E, et al. Bone loss following hypogonadism in men with prostate cancer treated with GnRH analogs. J Clin Endocrinol Metab. 2002; 87(8): 3656.
19. Shahinian VB, Kuo YF, Freeman JL et al. Risk of fracture after androgen deprivation for prostate cancer. Goodwin JS SO N Engl J Med. 2005; 352(2): 154.
20. Watts NB, Leslie WD, Foldes AJ, Miller PD. 2013 International Society for Clinical Densitometry Position Development Conference: Task Force on Normative Databases. J Clin Densitom. 2013; 16(4): 472–481.
21. Kanis JA, Oden A, Johansson H et al. FRAX((R)) and its applications to clinical practice. Bone. 2009; 44 : 734–743.
22. Stepan JJ, Vaculik J, Pavelka K et al. Hip fracture incidence from 1981 to 2009 in the Czech Republic as a basis of the country-specific FRAX model. Calcif Tissue Int. 2012; 90(5): 365–372.
23. Dent E, Morley JE, Cruz-Jentoft AJ et al. International Clinical Practice Guidelines for Sarcopenia (ICFSR): Screening, Diagnosis and Management. J Nutr Health Aging. 2018; 22(10): 1148–1161.
24. Harvey NC, Biver E, Kaufman JM et al. The role of calcium supplementation in healthy musculoskeletal ageing: An expert consensus meeting of the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) and the International Foundation for Osteoporosis (IOF). Osteoporos Int. 2017; 28 : 447–462.
25. Rizzoli R. Dairy products, yogurts, and bone health. Am J Clin Nutr 2014; 99(5 Suppl): 1256s–1262s.
26. Rizzoli R, Stevenson JC, Bauer JM et al. ESCEO Task Force. The role of dietary protein and vitamin D in maintaining musculoskeletal health in postmenopausal women: a consensus statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Maturitas. 2014; 79 : 122–132.
27. Rizzoli R. Nutritional influence on bone: role of gut microbiota. Aging ClinExp Res. 2019; 31(6): 743–751.
28. Giustina A, Adler RA, Binkley N et al. Consensus statement from 2nd international conference on controversies in vitamin D. Rev Endocr Metab Disord 2020; 21 : 89–116.
29. Rochira V, Antonio L & Vanderschueren D. EAA clinical guideline on management of bone health in the andrological outpatient clinic. Andrology 2018; 6 : 272–285.
30. Kaufman JM, Reginster JY, Boonen S et al. Treatment of osteoporosis in men. Bone. 2013; 53 : 134–144.
31. Sawka AM, Papaioannou A, Adachi JD et al. Does alendronate reduce the risk of fracture in men? A meta-analysis incorporating prior knowledge of anti-fracture efficacy in women. BMC Musculoskelet Disord. 2005; 6 : 39.
32. Boonen S, Lorenc RS, Wenderoth D et al. Evidence for safety and efficacy of risedronate in men with osteoporosis over 4 years of treatment: results from the 2-year, open - -label, extension study of a 2-year, randomized, double-blind, placebo-controlled study. Bone. 2012; 51 : 383–388.
33. Ringe JD, Farahmand P, Faber H, Dorst A. Sustained efficacy of risedronate in men with primary and secondary osteoporosis: results of a 2-year study. Rheumatol Int. 2009; 29 : 311–315.
34. Sato Y, Iwamoto J, Kanoko T et al. Risedronate sodium therapy for prevention of hip fracture in men 65 years or older after stroke. Arch Int Med. 2005; 165 : 743–1748.
35. Lyles KW, Colón-Emeric CS, Magaziner JS, HORIZON Recurrent Fracture Trial, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007; 357 : 1799–1809.
36. Boonen S, Orwoll E, Magaziner J, HORIZON Recurrent Fracture Trial, et al. Once-yearly zoledronic acid in older men compared with women with recent hip fracture. J Am Geriatr Soc. 2011; 59 : 2084–2090.
37. Boonen S, Reginster JY, Kaufman JM et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012; 367 : 1714–1723.
38. Khan AA, Morrison A, Kendler DL et al. Case-Based Review of Osteonecrosis of the Jaw (ONJ) and Application of the International Recommendations for Management From the International Task Force on ONJ. J Clin Densitom. 2017; 20(1): 8–24.
39. Genant HK, Libanati C, Engelke K et al. Improvements in hip trabecular, subcortical, and cortical density and mass in postmenopausal women with osteoporosis treated with denosumab. Bone. 2013; 56 : 482–488.
40. Smith MR, Egerdie B, Hernández Toriz N. Denosumab HALT Prostate Cancer Study Group, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009; 361 : 745–755.
41. Orwoll E, Teglbjærg CS, Langdahl BL et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density. J Clin Endocrinol Metab. 2012; 97 : 3161–3169.
42. Langdahl BL, Teglbjærg CS, Ho PR et al. A 24-month study evaluating the efficacy and safety of denosumab for the treatment of men with low bone mineral density: results from the ADAMO trial. J Clin Endocrinol Metab. 2015; 100 : 1335–1342.
43. Tourdi E, Langdahl B, Cohen-Solal M et al. Discontinuation of denosumab therapy for osteoporosis: a systematic review and position statement by ECTS. Bone 2017; 105 : 11–17.
44. Orwoll ES, Scheele WH, Paul S et al. The effect of teriparatide (human parathyroid hormone (1–34)) therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003; 18 : 9–17.
45. Saag KG, Zanchetta JR, Devogelaer JP et al. Effects of teriparatide vs alendronate for treating glucocorticoid-induced osteoporosis: 36-month results of a randomized, double - -blind, controlled trial. Arthritis Rheum. 2009; 60 : 3346–3355.
46. Díez-Pérez A, Marin F, Eriksen EF et al. Effects of teriparatide on hip and upper limb fractures in patients with osteoporosis: A systematic review and meta-analysis. Bone. 2019; 120 : 1–8.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání