-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Overlap syndrome SLE – ANCA associated vasculitis
Incidence of ANCA antibodies in patients with systemic lupus erythematosus (SLE) is described in 24–31 %, but they are not related to the distribution and severity of organ involvement in SLE; the routine monitoring is not recommended. Overlap syndrome of systemic lupus erythematosus and ANCA associated vasculitis (AAV) is rare. The difficult diagnosis and treatment of this syndrome is described in this case report of the patient with SLE and severe kidney involvement resulting from AAV.
Keywords:
ANCA associated vasculitis – overlap syndrome – systemic lupus erythematosus.
Autoři: Martina Skácelová 1; Pavel Horák 1; Jana Janková 2
Působiště autorů: III. interní klinika – nefrologická, revmatologická a endokrinologická, FN a LF UP Olomouc 1; Ústav klinické a molekulární patologie, LF UP Olomouc 2
Vyšlo v časopise: Vnitř Lék 2021; 67(1): 58-61
Kategorie: Kazuistiky
Souhrn
Výskyt ANCA protilátek bývá u pacientů se systémovým lupus erytematodes (SLE) popisován asi ve 24–31 % případů, nemají však vztah k distribuci a tíži orgánového postižení u SLE a jejich rutinní monitoring se nedoporučuje. Overlap syndrom systémového lupus erytematodes s ANCA asociovanou vaskulitidou (AAV) bývá popisován zcela vzácně, následující kazuistika pacientky SLE s těžkým postižením ledvin v rámci AAV poukazuje na obtížnou diagnostiku a léčbu tohoto syndromu.
Klíčová slova:
ANCA asociovaná vaskulitida – overlap syndrom – systémový lupus erytematodes.
Úvod
U pacientů, kteří splňují kritéria jednoho autoimunního onemocnění, může být poměrně často pozorován překryv s dalším onemocněním. U systémového lupus erytematodes (SLE) je popisován překryv s revmatoidní artritidou, někdy také nazývaný jako „rhupus“ (1, 2); v rámci smíšeného onemocnění pojiva jsou pak kromě rysů SLE přítomny i známky systémové sklerodermie a polymyozitidy. Kromě revmatických onemocnění je popisována i koincidence s dalšími autoimunními chorobami, jako např. s autoimunní thyreoiditidou, roztroušenou sklerózou, celiakií, Crohnovou chorobou a podobně. Podle retrospektivní studie dat z registru BVC (Barbara Volcker Center for Women and Rheumatic Disease) mělo 68 % pacientů s diagnostikovaným autoimunním onemocněním splňujícím klasifikační kritéria dané choroby (SLE, Sjögrenův syndrom, antifosfolipidový syndrom, revmatoidní artritida) „čisté onemocnění“, ale u 32 % pacientů se vyskytl překryv s jednou či více dalšími autoimunními chorobami. U pacientů s primární diagnózou SLE se jednalo o 38 % sledované populace, u pacientů se Sjögrenovým syndromem se překryv s dalším autoimunním onemocněním vyskytl dokonce v 52 % případů (3). Asociace SLE s ANCA asociovanou vaskulitidou (AAV) je vzácná, ve světové literatuře jsou popsány malé soubory pacientů či ojedinělá kazuistická sdělení (4–6).
Kazuistika
Předkládáme kazuistiku 43leté ženy, která byla na revmatologické oddělení počátkem března 2020 přeložena ze spádového interního oddělení pro vysoce suspektní systémový lupus erytematodes s lupusovou nefritidou. Jednalo se o pacientku, která se doposud s ničím neléčila, asi 6 let nebyla u lékaře. Neužívala pravidelně žádnou medikaci, jen občas při teplotě paracetamol. Matka nemocné byla od 58 let věku dialyzována pro renální selhání nejasné etiologie, jinak byla rodinná anamnéza bez pozoruhodností, děti pacientka nemá. Od začátku roku 2020 paní pociťovala celkovou slabost, k večeru mívala subfebrilie kolem 37,1 °C, cítila se unavená a nevýkonná. Zvýšeně se zadýchávala při chůzi do kopce nebo do schodů, poslední 3 týdny před přijetím pozorovala otoky dolních končetin ke kolenům. Trpěla nechutenstvím, jedla cca poloviční porce, od počátku roku zhubla asi 10 kg. Praktickým lékařem byla odeslána k přijetí na interní oddělení.
Při příjmu byl nápadný bledý kolorit kůže, která byla bez patologických eflorescencí. Pacientka byla subfebrilní, měla sinusovou tachykardii, hypertenzi se vstupními hodnotami TK 180/90 mm Hg. Byly přítomny těstovité otoky dolních končetin ke kolenům, jinak byl fyzikální nález bez pozoruhodností. V laboratorním nálezu při přijetí dominovala významná normocytární anémie s hodnotami hemoglobinu 67 g/l, dále pak renální insuficience s hodnotami urey 11,5 mmol/l a kreatininu 173 µmol/l, GF 0,52 ml/s/1,73 m2 . Vstupně byly podány 4 TU erymasy a byl konzultován hematolog vyslovující podezření na mnohočetný myelom, amyloidosu či systémové onemocnění pojiva. Na celotělovém low‑dose CT však nebyly nalezeny osteolytické léze, v bioptickém materiálu získaném z biopsie rekta nebyl nalezen amyloid a vyšetření kostní dřeně nesvědčilo pro hematologickou malignitu. Po celou dobu hospitalizace trvaly febrilie až 39 °C, a to zejména v nočních a ranních hodinách, empiricky podaná antibiotika byla bez efektu. Pro progresi dušnosti a otoků dolních končetin byla zahájena diuretická terapie, korigována hypertenze, pro hyperurikemii byl nasazen alopurinol. Vzhledem k proteinurii 1,8 g/24 hodin, zvýšené echogenitě ledvin při USG vyšetření a pozitivitě ANA a anti ds‑DNA protilátek vzniklo podezření na lupusovou nefritidu a pacientka byla přeložena k další diagnostice a terapii na naše pracoviště.
Zde při přijetí v klinickém nálezu dominoval celotělový exantém a projevy vaskulitidy na DKK doprovázené otoky po kolena. Laboratorně byla potvrzena progrese renální insuficience (urea 15,4 mmol/l, kreatinin 204 µmol/l, GF 0,42 ml/s/1,73 m2 ), těžká hypalbuminemie (19,7 g/l, norma 35–52 g/l), v moči zaznamenána proteinurie, mikroskopická hematurie a pyurie, byla vysoká hladina NT‑proBNP a CRP, nevýrazně zvýšená hladina LDH (4,47 µkat/l, norma 2,25–4,20 µkat/l). Přetrvávala normocytární anémie, hladina hemoglobinu po předchozí transfuzní terapii dosahovala 97 g/l, počty trombocytů byly v normě (227 × 109 , norma 150–400 × 109 ), nově byla přítomna i výraznější lymfopenie 0,52 × 109 a pozitivita Coombsova testu bez známek aktivní hemolýzy (opakovaně bez záchytu schistocytů v krevních nátěrech, sérové hladiny haptoglobinu a volného hemoglobinu v normě). Pro klinicky zjevnou diagnózu systémového onemocnění pojiva byla zahájena terapie pulzními glukokortikoidy v celkové dávce 3 g, následně pak bylo přistoupeno k provedení biopsie ledviny. Na ultrazvukovém obraze byly ledviny velikosti při horní hranici normy (vpravo 126 × 48 mm, vlevo 126 × 54 mm) s vyšší echogenitou edématózního parenchymu. Překvapivě histologický obraz lupusové nefritidě neodpovídal, v nálezu byly přítomny nekrózy glomerulů s celulárními či fibrocelulárními srpky, části zachovalých glomerulů byly morfologicky prakticky normální, bez jednoznačných proliferativních změn. V imunofluorescenčním vyšetření nebyla nalezena depozita typická pro SLE (v některých glomerulech byly přítomny stopy IgA; IgG a IgM negativní, stopy C1 a C3, stopy kappa řetězců, lambda negativní). Nález dle morfologie a imunofluorescence svědčí pro pauciimunní nekrotizující glomerulonefritidu se srpky a obrazem výrazné tubulointersticiální nefritidy (Obr. 1, 2). Hodnotitelná muskulární arterie nebyla zastižena, v arteriolách byla vyjádřena fibrinoidní nekróza (Obr. 3). Na radiogramu hrudníku se nově objevily retikulonodulační změny plicního parenchymu, spirometrie prokázala středně těžké snížení transfer faktoru, na HRCT plic bylo popsáno zesílení interlobulárních sept, dilatace plicních cév a vpravo laterobazálně nevýrazný pruh konsolidace. Byly přítomny i bilaterální pleurální výpotky, při echokardiografickém vyšetření byl přítomen i perikardiální výpotek. Výsledky imunologického vyšetření potvrdily pozitivitu ANA (homogenní typ), vysoké titry anti ds‑DNA protilátek > 200 U/ml (norma 0–20 U/ml), anti ssDNA > 200 U/ml (norma 0–20 U/ml), antinukleosomálních protilátek > 200 U/ml (norma 0–20 U/ml), vysoké CIK (143 U, norma 0–50 U), konsumpci C3 (0,41 g/l, norma 0,98–1,97 g/l) a C4 (0,07 g/l, norma 0,12–0,40 g/l) složky komplementu. Pozitivní byly i anti Ro a anti La protilátky. Nebylo prokázáno lupus antikoagulans, rovněž tak i antikardiolipinové protilátky byly negativní. Zároveň byla hlášena i pozitivita ANCA protilátek, a to protilátek proti myeloperoxidáze (12,9 U/ml, norma do 5 U/ml). Pacientka tedy splňuje klasifikační kriteria EULAR/ACR z r. 2019 pro SLE (7, 8), rovněž tak je však jednoznačná i diagnóza ANCA asociované vaskulitidy s postižením ledvin s rychle progredující pauciimunní nekrotizující glomerulonefritidou se srpky. Bylo pokračováno v terapii vysokými dávkami glukokortikoidů, po ukončení pulzní terapie byla převedena na perorální podání s postupnou redukcí dávek. Vzhledem k závažnému postižení ledvin byla zahájena indukční léčba pulzy cyklofosfamidu v dávce 15 mg/kg v měsíčních intervalech, zahájena terapie hydroxychlorochinem v dávce 400 mg denně. Pro progresi nefrotického syndromu byly podány infuze s albuminem a furosemidem a ACE‑inhibitor. Pacientka byla ve stabilizovaném stavu propuštěna, postupně absolvovala celkem 6 pulzů cyklofosfamidu, po ukončení indukční terapie byla nasazena udržovací terapie mykofenolátem mofetilem v dávce 2 g denně. Při poslední ambulantní kontrole v lednu 2021 je pacientka nadále stabilizovaná, kromě větší únavnosti bez klinických potíží, laboratorní nálezy jsou stacionární, bez progrese.
Obr. 1. Glomeruly se segmentální nekrózou (červená šipka) a s celulárním srpkem (modrá šipka); barvení HE 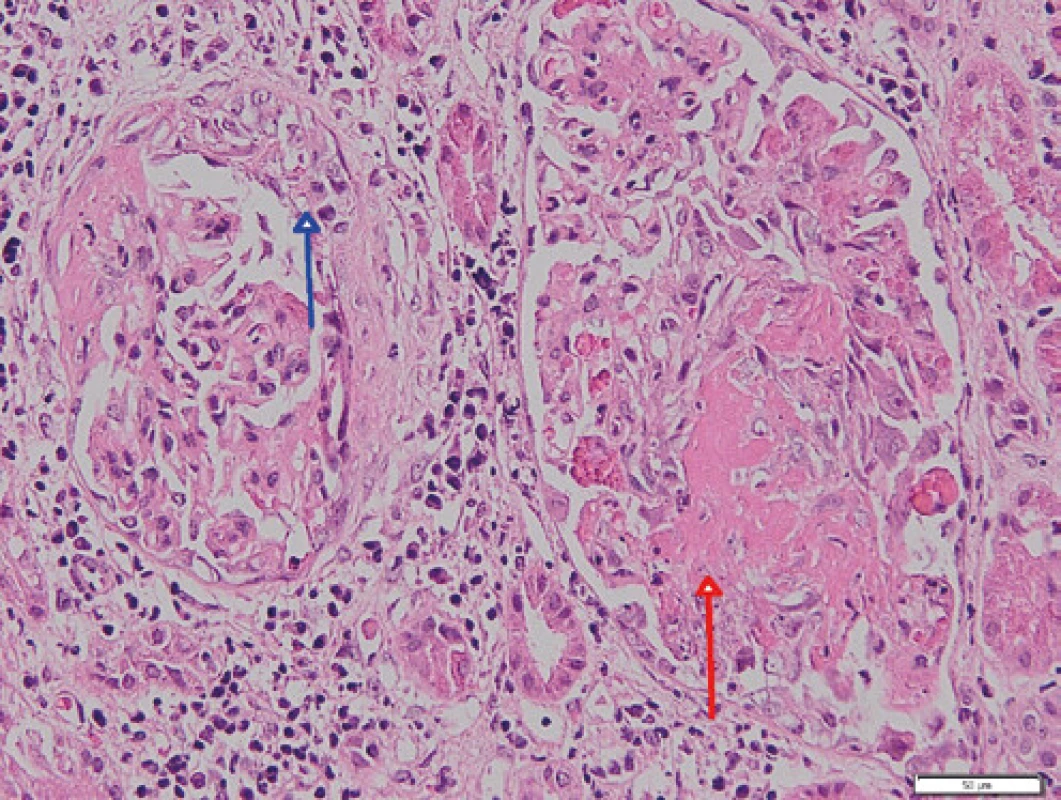
Obr. 2. Glomerulus s celulárním srpkem (červená šipka), v okolí glomerulu je v intersticiu intenzivní zánětlivý infiltrát; barvení HE 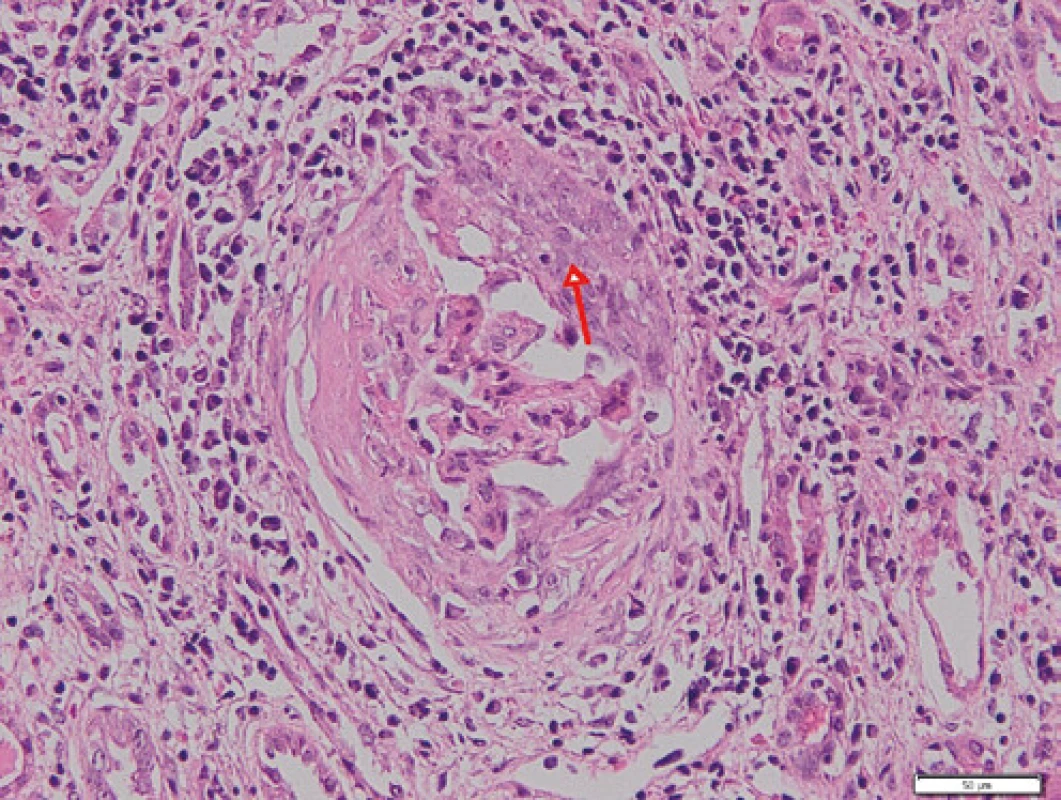
Obr. 3. Arteriola s fibrinoidní nekrózou (červená šipka); barvení HE 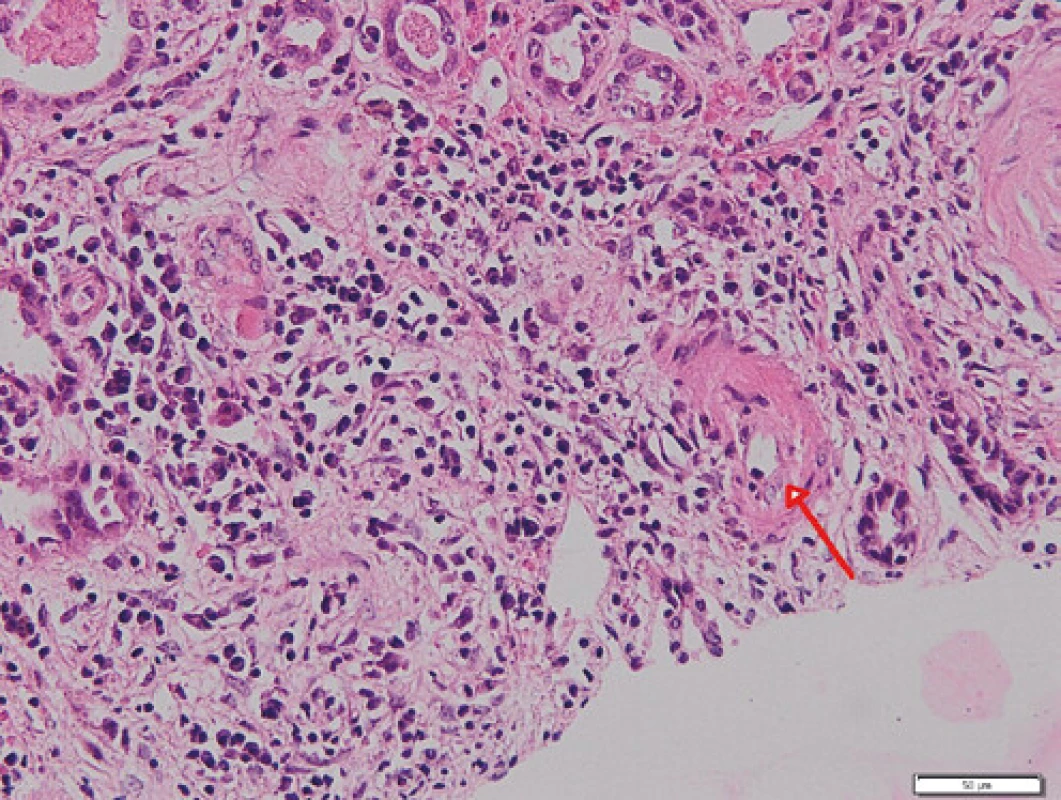
Diskuze
Systémový lupus erytematodes je autoimunní zánětlivé onemocnění, které je často charakterizované multiorgánovým postižením. U pacientů nacházíme celé spektrum orgánově nespecifických autoprotilátek, výskyt ANCA protilátek je u SLE poměrně častý, jejich přítomnost byla zaznamenána až u 24–31 % pacientů; v jedné ze studií u pacientů s biopticky verifikovanou lupusovou nefritidou byly ANCA protilátky přítomny dokonce u 37,3 % pacientů, a to s predominancí pANCA (54,5 %), ve všech případech byla zároveň přítomna i pozitivita ANA (9, 10, 11). Malá retrospektivní studie u 23 pacientů s proliferativní lupusovou nefritidou prokázala u 91 % pacientů vyšší hladiny pANCA protilátek již 1–4 roky před diagnózou ve srovnání s pacienty se SLE bez lupusové nefritidy (12).
Rutinní testování ANCA se však u pacientů se SLE nedoporučuje, nemají žádný význam v diagnostice SLE, jejich titry nekorelují vý ‑ znamně s distribucí a tíží orgánového poškození a rovněž tak nebyla ani prokázána asociace mezi titrem ANCA protilátek a aktivitou onemocnění. Data z recentní retrospektivní studie sledující 283 pacientů s lupusovou nefritidou, z nichž bylo 36 ANCA pozitivních, prokazují vyšší titry anti dsDNA protilátek, nižší hladiny sérového hemoglobinu a horší renální funkce u ANCA pozitivních jedinců. Tito také méně často než ANCA negativní pacienti dosahují remise onemocnění (76,1 % vs. 69,4 %, p < 0,001). ANCA pozitivita byla navíc nezávislým rizikovým faktorem úmrtí těchto pacientů (13). Pozitivita ANCA protilátek tedy může do jisté míry predikovat horší průběh lupusové nefritidy a zvyšovat riziko jejího rozvoje.
ANCA asociované vaskulitidy tvoří skupinu systémových vaskulitid postihujících malé a střední cévy. Klinicky rozlišujeme tři základní typy – granulomatózu s polyangiitidou (dříve známa jako Wegenerova granulomatóza), mikroskopickou polyangiitidu a eosinofilní granulomatózu s polyangiitidou (dříve známa jako syndrom Churgův‑Straussové). Jak již název napovídá, pro tuto skupinu chorob je typická pozitivita protilátek, které jsou namířeny proti cytoplazmatickým proteinům neutrofilních leukocytů (antineutrophil cytoplasmic antibodies – ANCA), nejčastěji proti myeloperoxidáze (MPO) a proteináze 3 (PR3). Pro PR3-ANCA je charakteristická cytoplazmatická fluorescence neutrofilů (cANCA), jsou přítomny u 85–95 % pacientů s granulomatózou s polyangiitidou, pro MPO‑ANCA je charakteristický perinukleární typ fluorescence (pANCA), jejich přítomnost je typická pro onemocnění mikroskopickou polyangiitidou (70 %) a eozinofilní granulomatózou s polyangiitidou (40–50 % případů) (14, 15). ANCA protilátky se mohou kromě AAV a dalších revmatických chorob vyskytovat i u dalších onemocnění, jako např. IBD či u některých infekčních onemocnění (TBC, endokarditidy).
Systémový lupus erytematodes i ANCA asociované vaskulitidy jsou relativně vzácná onemocnění, jejich vzájemná koincidence je popisována vzácně. Pacienti se SLE/AAV overlap syndromem jsou pře ‑ vážně ženy, nejčastějšími manifestacemi jsou kloubní, kožní a renální postižení, vaskulitida nejčastěji probíhá pod obrazem mikroskopické polyangiitidy (16). Ve velkém souboru pacientů se SLE a AAV, kteří měli mezi lety 1995–2014 provedenu renální biopsii, bylo celkem 8 pacientů s overlap syndromem SLE/AAV. Ve všech případech se jednalo o ženy, AAV se vyskytla jak před diagnózou SLE (n = 3), tak i po diagnóze SLE (n = 3), ve dvou případech byl výskyt současný, stejně jako u naší pacientky. Všichni pacienti měli prokázanou pozitivitu ANA protilátek, u 7 z nich byla přítomna pozitivita pANCA protilátek, 5 pacientů mělo biopticky prokázanou pauciimunní glomerulonefritidu, ve třech případech byla přítomna lupusová nefritida (II. a IV. typu). Kromě těchto pacientů bylo systematickým studiem literatury nalezeno dalších 31 pacientů s overlap syndromem SLE/AAV, jejichž charakteristika byla obdobná (4). I v dalších kazuistických sděleních pak bylo u pacientů s překryvným syndromem SLE/AAV popisováno téměř vždy postižení ledvin buď lupusovou nefritidou či pauciimunní glomerulonefritidou (17), často v kombinaci s postižením plic (18), těžkým kožním postižením (19) nebo s hematologickým postižením (trombotická trombocytopenická purpura) (6).
Terapie těchto stavů se řídí doporučeními pro léčbu systémového lupus erytematodes (20) a pro léčbu ANCA asociovaných vaskulitid (21), vždy je nutno brát v potaz nejzávažnější typ orgánového postižení. Léčba se rozděluje na fázi indukční směřující k navození kompletní či parciální remise choroby a léčbu udržovací charakterizovanou méně agresivní imunosupresí. Specifickou situaci pak představuje léčba relapsu aktivity nemoci. U obou chorob hraje stále významnou roli v indukční terapii podání intravenózního cyklofosfamidu, v případě AAV je jeho registrovanou alternativou podání rituximabu, zatímco u SLE představuje rituximab léčbu „off label“ podávanou při selhání klasické imunosuprese. I z těchto důvodů padla volba terapie v prezentované kazuistice na osvědčený cyklofosfamid. Neléčené nebo pozdě léčené onemocnění má vysokou morbiditu a mortalitu, pacienti mají zvýšené riziko kardiovaskulárních chorob, sekundárních infekčních komplikací a rozvoje malignit.
Prezentovanou kazuistikou vzácného overlap syndromu SLE/AAV, v tomto případě s dominujícím renálním postižením charakteru rychle progredující glomerulonefritidy, chceme poukázat na složitou diagnostiku tohoto vzácného překryvného syndromu. První příznaky choroby a výsledky laboratorních vyšetření svědčily spíše pro možnost systémového lupus erytematodes, konkomitantní diagnóza ANCA asociované vaskulitidy byla překvapením. Je však nutno vždy na možnost překryvného syndromu myslet, správná diagnostika těchto složitých stavů může ovlivnit léčebný přístup, byť v tomto prezentovaném případě se léčba obou stavů v této fázi zásadně neliší.
Podpořeno grantem IGA_LF_2020-05 a projektem Ministerstva zdravotnictví ČR Koncepčního rozvoje výzkumné organizace (FNOL-00098892)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martina Skácelová, Ph.D.,
III. interní klinika – nefrologická, revmatologická a endokrinologická,
FN a LF UP Olomouc,
I. P. Pavlova 6,
779 00 Olomouc
Cit. zkr: Vnitř Lék 2021; 67(1): 58–61
Článek přijat redakcí: 19. 5. 2020
Článek přijat po recenzích: 14. 1. 2021
Zdroje
1. Devrimsel G, Serdaroglu Beyazal M. Three Case Reports of Rhupus Syndrome: An Overlap Syndrome of Rheumatoid Arthritis and Systemic Lupus Erythematosus. Case Rep Rheumatol. 2018;2018 : 6194738. Published 2018 Jan 21. doi: 10.1155/2018/6194738
2. AlFadhli S., Nizam R. Rhupus: a crosswalk between lupus and rheumatoid arthritis. OA Arthritis. 2014; 2(1): p. 3.
3. Lockshin MD, Levine AB, Erkan D. Patients with overlap autoimmunedisease differ from those with‘pure’ disease. Lupus Science & Medicine 2015; 2: e000084. doi: 10.1136/ lupus-2015-000084.
4. Jarrot PA, Chiche L, Hervier B et al. Systemic Lupus Erythematosus and Antineutrophil Cytoplasmic Antibody‑Associated Vasculitis Overlap Syndrome in Patients With Biopsy‑Proven Glomerulonephritis. Medicine (Baltimore).2016; 95(22): e3748. doi: 10.1097/ MD.0000000000003748.
5. Hervier B, Hamidou M, Haroche J et al. Systemic lupus erythematosus associated with ANCA‑associated vasculitis: an overlapping syndrome? Rheumatol Int. 2012 Oct; 32(10): 3285-3290. Epub 2011 Jul 30.
6. Farshad S, Kanaan C, Savedchuk S et al. Systemic Lupus Erythematosus (SLE) with Acute Nephritis, Antineutrophil Cytoplasmic Antibody - (ANCA-) Associated Vasculitis, and Thrombotic Thrombocytopenic Purpura (TTP): A Rare Case Report with Literature Review. Case Rep Rheumatol. 2019 Dec 14; 2019 : 8750306. doi: 10.1155/2019/8750306. eCollection 2019.
7. Petri M, Orbai AM, Alarcón GS et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum. 2012; 64(8): 2677-2686. doi: 10.1002/art.34473.
8. Aringer M, Costenbader K, Daikh D et al. 2019 European League Against Rheumatism/ American College of Rheumatology Classification Criteria for Systemic Lupus Erythema ‑ tosus. Arthritis Rheumatol. 2019; 71(9): 1400–1412. doi: 10.1002/art.40930. Epub 2019 Aug 6.
9. Merkel PA, Polisson RP, Chang Y et al. Prevalence of antineutrophil cytoplasmic antibodies in a large inception cohort of patients with connective tissue disease. Ann Intern Med. 1997; 126(11): 866–873.
10. Fauzi AR, Kong NC, Chua MK et al. Antibodies in systemic lupus antineutrophil cytoplasmic erythematosus: prevalence, disease activity correlations and organ system asso ‑ ciations. Med J Malaysia. 2004; 59(3): 372–377.
11. Pradhan VD, Badakere SS, Bichile LS et al. Anti‑neutrophil cytoplasmic antibodies (ANCA) in systemic lupus erythematosus: prevalence, clinical associations and correlation with other autoantibodies. J Assoc Physicians India. 2004; 52 : 533–537.
12. Olson SW, Lee JJ, Poirier M et al. Anti‑Myeloperoxidase Antibodies Associate with Future Proliferative Lupus Nephritis. Autoimmune, DiS. 2017; 2017 : 1872846. doi: 10.1155/2017/1872846. Epub 2017 Dec 24.
13. Wang S, Shang J, Xiao J et al. Clinicopathologic characteristics and outcomes of lupus nephritis with positive antineutrophil cytoplasmic antibody. Ren Fail. 2020; 42(1): 244–254. doi: 10.1080/0886022X.2020.1735416.
14. Koh JH, Kemna MJ, Cohen Tervaert JW et al. Can an increase in anti‑neutrophil cytoplasmic autoantibody titer predict relapses in anti‑neutrophil cytoplasmic antibody asso ‑ ciated vasculitis? Arthritis Rheum 2016; 68 : 1571–1573.
15. Kitching AR, Anders HJ, Basu N et al. ANCA‑associated vasculitis. Nat Rev Dis Primers. 2020; 6(1): 71. Published 2020 Aug 27. doi:10.1038/s41572-020-0204-y
16. Jesmin T, Roy RR, Anjum MF, Akter M. Anti‑neutrophil cytoplasmic antibodies in systemic lupus erythematosus and lupus nephritis: an overlapping syndrome. IOSR Journal of Dental and Medical Sciences. 2017; 16(3): 6–8. doi: 10.9790/0853-1603050608.
17. Farah RI, Shahin NA, Alawneh M, Adwan M. Rapidly progressive glomerulonephritis due to systemic lupus erythematosus and ANCA‑associated vasculitis overlap. Lupus. 2020; 29(8): 983–986.
18. Itikyala S, Pattanaik D, Raza S. Systemic Lupus Erythematosus (SLE) and Antineutrophil Cytoplasmic Antibody‑Associated Vasculitis (AAV) Overlap Syndrome: Case Report and Review of the Literature. Case Rep Rheumatol. 2019; 2019 : 5013904. doi: 10.1155/2019/5013904. eCollection 2019.
19. Curtiss P, Liebman T, Khorolsky C, Brinster N, Beasley J, Lo Sicco K. Systemic lupus erythematosus and antineutrophil cytoplasmic antibody‑associated vasculitis: an emer ‑ ging overlap syndrome with cutaneous manifestations.
20. Fanouriakis A, Kostopoulou M, Alunno A et al 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Annals of the Rheumatic Diseases 2019; 78 : 736–745.
21. Yates M, Watts RA, Bajema IM et al EULAR/ERA‑EDTA recommendations for the management of ANCA‑associated vasculitis Annals of the Rheumatic Diseases 2016; 75 : 1583–1594.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Internista a pacient po ischemické CMP
- Následná péče po prodělaném covidu-19 a její úskalí
- Horečka nejasného původu
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kdy ukončit léčbu hepatitidy B?
- Kompetence pacienta a informovaný souhlas
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Je autoimunitní pankreatitida rizikovým faktorem adenokarcinomu pankreatu?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



