-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
Nutritional support in the early stage of critical illness – focused on energy and protein intake
The aim of this article is to emphasize the importance of taking into account the mechanism of host's response to insult when choosing a nutritional strategy in the early phase of a critical illness. At the same time, the article discusses the risks associated with early aggressive nutritional intervention for both energy and protein intake. Today, it seems that the most optimal choice of nutritional support during the first week of stay in the ICU is a gradual increase in both energy and protein intake. In numerical terms, this means a daily increase in energy dose of approximately 5 kcal/kg/day and a daily increase in protein dose of 0.2 g /kg/day. However, this only applies to patients admitted to the ICU with a normal body mass index, i.e. without malnutrition or without obesity. Both of these categories require special attention beyond the scope of this article.
Keywords:
critically ill – nutritional support – Hibernation – autophagy – overfeeding
Autoři: Roman Kula 1,2; Roman Kula Jr 3,4; Daniela Charwátová 4,5; Tatiana Sušková 6
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN Ostrava 1; Katedra intenzivní medicíny, urgentní medicíny a forenzních oborů LF OU Ostrava 2; Klinika dětské anesteziologie a resuscitace, LF MU a FN Brno 3; Fyziologický ústav LF MU Brno 4; Chirurgické oddělení, Nemocnice Vyškov 5; Oddelenie anesteziológie a intenzívnej medicíny, Nemocnica Humenné, Slovensko 6
Vyšlo v časopise: Vnitř Lék 2021; 67(1): 43-48
Kategorie: Dobrá rada
Souhrn
Cílem tohoto článku je zdůraznit respektování mechanismů odpovědi na inzult při volbě nutriční strategie v časné fázi kritického stavu. Současně článek pojednává o rizicích spojených s časnou agresivní nutriční intervencí, a to jak pro energetický, tak také pro proteinový příjem. Dnes se zdá, že nejoptimálnější volbou nutriční podpory v průběhu prvního týdne pobytu na jednotce intenzivní péče (JIP) je postupné navyšování dávky jak energie, tak i bílkovin. V číselném vyjádření to přibližně znamená vzestup dávky energie o 5 kcal/kg/den a vzestup dávky bílkovin o 0,2 g/kg/den. Platí to ovšem pouze u pacientů přicházejících na JIP s normální hodnotou body mass index, tedy bez malnutrice či obezity. Obě tyto kategorie vyžadují zvláštní pozornost přesahující rozsah tohoto článku.
Klíčová slova:
kriticky nemocný – nutriční podpora – hibernace – autofagie – překrmování
Úvod
Péče o kriticky nemocné pacienty řeší historicky tři hlavní okruhy problémů: jak dopravit k buňkám dostatek kyslíku, jak jim zajistit dostatek nutričních substrátů a konečně jak kvalitně podpořit funkci selhávajících orgánů. První a třetí oblast jsou dnes, zejména díky technologickému rozmachu, na vysoké úrovni (1). Je dostupná široká paleta možností měření a manipulace s hemodynamickými parametry a v případě, že krevní oběh selže úplně, lze kritické období překlenout pomocí mimotělní oxygenace. Funkci plic je možné podpořit sofistikovanými přístroji pro podpůrnou či řízenou plicní ventilaci a u těžkých forem selhání je k dispozici mimotělní výměna krevních plynů. Metody kontinuální a intermitentní hemodialýzy umožňují efektivně nahradit ledvinné funkce a v případě selhávání jater se nabízí možnost albuminové hemodialýzy. Všechny dostupné metody mimotělní orgánov podpory je možné navzájem kombinovat a klinici dnes stojí před otázkou nejen jak správně načasovat jejich použití, ale dokonce i jak vyřešit jejich vzájemnou nežádoucí interakci (tzv. „negative artificial organ crosstalk“) (1).
Přes obecně uznávané postavení byla nutriční podpora donedávna ve stínu vývoje výše popsaných intervencí. Za hlavní příčinu tohoto jevu lze pravděpodobně označit fakt, že nutriční intervence nepřinášejí obvykle tak atraktivní okamžitou změnu klinického stavu, kterou můžeme vidět například při manipulaci s hemodynamickými parametry nebo po napojení pacienta na řízenou plicní ventilaci. V průběhu posledních patnácti let však zájem kliniků o tuto problematiku stoupá. Souvisí to nejen s publikací elegantních klinických studií, které položily základ pro zásadní změnu pohledu na nutriční podporu v časné fázi kritického stavu (2, 3), ale také s dlouhodobým pozorováním nutričního stavu pacientů, kteří pobyt na jednotce intenzivní péče (JIP) přežili (4). Navzdory potěšujícímu nárůstu v počtu přeživších pacientů zůstává alarmující rozsah ztráty jejich tělesné hmotnosti včetně výrazného úbytku svalové hmoty. Společně s dalšími příznaky je tento jev komplexně označován jako „Post -Intensive Care Syndrome“ a zásadně limituje začlenění pacientů do normálního života, a to i dlouhou dobu po jejich propuštění z nemocnice (5, 6).
Cílem tohoto článku je přiblížit čtenářům současný názor na problematiku nutriční podpory v časné fázi kritického stavu což je období obvykle ohraničeno prvními sedmi dny pobytu na JIP. Současně jde o období, ve kterém došlo k zásadnímu posunu v nahlížení na nutriční podporu od polohy „more is better“ k poloze „less is more“ (7). Paradoxně tento posun znamená pouze jedno, a to návrat k Hippokratovu rčení „Si quis febricitanti cibum det, convalescenti quidem, robur: ægrotanti verò, morbus fit.“ (volný překlad: „Jídlo podávané nemocnému při ústupu choroby zvyšuje jeho sílu. Pokud však choroba přetrvává, potom jídlo chorobu zhorší.“) (8)
Energetická potřeba v časné fázi kritického stavu
Vliv zánětem indukované konverze organismu do nízkoenergetického stavu
Bez ohledu na etiologii (tj. infekční nebo neinfekční inzult) je časná fáze kritického stavu obvykle doprovázena excesivní zánětovou odpovědí. Její intenzitu je možné sledovat třeba pomocí sekvenčního vyšetření sérové koncentrace prozánětových cytokinů. V zásadě platí, že čím je větší inzult, tím je zánětová odpověď intenzivnější. Tento vztah však může být modifikován jak genetickými a pohlavními predispozičními faktory, tak také funkčností systémových protizánětových mechanismů (noradrenergní out -flow, aktivace HPA osy, cholinergní antiinflamatorní cesta). Primárním smyslem zánětové odpovědi je vždy obrana. Ve své podstatě jde o „válečný konflikt“ mezi buňkami imunitního systému a cizorodými elementy, který probíhá v tkáních, jejichž funkce je závislá na vitalitě strukturálních tkáňových buněk. Zásadním problémem zmíněného konfliktu je fakt, že jeho fyziologické mechanismy významně ohrožují právě životaschopnost těchto buněk (9). Třeba zánětovými mediátory indukovaná prekapilární vazodilatace se zpomalením kapilárního krevního toku je na jedné straně nevyhnutelná pro správnou interakci mezi polymorfonukleáry a endotelem, na druhé straně však ohrožuje strukturální tkáňové buňky poklesem perfuzního tlaku, a tím dodávkou kyslíku. Podobně pozdější prekapilární vazokonstrikce s otevřením arterio -venózních zkratů a postkapilární mikrotrombotizace jsou na jedné straně důležitými, zánět ohraničujícími mechanismy, na druhé straně však opět vedou k alteraci lokální dodávky kyslíku. Konečně intersticiální otok, který je typickou součástí zánětové odpovědi, může prodloužit difuzní dráhu pro kyslík a opět vystavit strukturální tkáňové buňky hypoxii. Mají -li tyto buňky přežít hypoxické důsledky konfliktu mezi imunitním systémem a cizorodými elementy, musí se konvertovat do stavu s nízkými nároky na kyslík a energii. Tento stav je znám jako hibernace a je zřejmě odpovědný za reverzibilní ztrátu funkce zánětem postižené tkáně, kterou Galen označil termínem „functio laesa“. Jinými slovy, zaplavení organismu mediátory, které produkují buňky imunitního sytému v rámci fyziologické odpovědi na inzult, může být spojeno s reverzibilní multiorgánovou hibernací, která se klinicky manifestuje jako adaptační multiorgánové selhávání (10–12). Je vcelku pochopitelné, že v této fázi minimálních energetických nároků nemusí být kaloricky „normální“ přívod energie právě optimálním. Naopak, podobně jako i další dobře míněné terapeutické intervence, může mít potenciálně nežádoucí důsledky (13, 14). Na nízký energetický výdej v časné fázi kritického stavu upozornily dnes již starší klinické studie, které ukázaly nepřímý vztah mezi tíží onemocnění a energetickým výdejem. Ten se navíc v průběhu prvního týdne stonání pohyboval v pásmu bazálního metabolismu (15, 16). Pro ilustraci, při použití klasické Harris -Benediktovy rovnice pro výpočet bazálního energetického výdeje u muže ve věku 60 let, o hmotnosti 80 kg a výšce 180 cm to představuje energetickou potřebu 1700 kcal/den, respektive 21 kcal/kg/den.
Vliv zánětem indukované změny způsobu získávání energie – „shift“ na endogenní zdroje
Zdravý jedinec má při nedostatku potravy fyziologický pocit hladu a energii pro udržení homeostázy získává spalováním endogenních tukových zásob. Sacharidy hrají v tomto procesu důležitou roli, neboť jsou zdrojem oxalacetátu a zajišťují tak dostatečnou kapacitu Krebsova cyklu pro oxidaci mastných kyselin. Tento proces se výstižně popisuje větou: „Tuky hoří v ohni cukrů.“, přičemž endogenní bílkoviny zůstávají nedotčeny. Při dostatku potravy se metabolismus vrací do normálního stavu, tedy k utilizaci exogenních sacharidů. Jedinec v kritickém stavu však potravu nepříjímá ani při jejím dostatku (pozn. autorů: „obranné nechutenství“) a také spaluje tukové zásoby. O pohon zmíněného ohně pro spalování tuků (myšleno Krebsův cyklus) se v tomto případě, na rozdíl od prostého hladovění, starají větvené aminokyseliny. Těch máme bohaté zásoby právě ve svalech. Jsou navíc tříuhlíkaté a stačí pouze jejich deaminace, aby z nich vznikly keto -kyseliny s možností zapojení do Krebsova cyklu. S glukózou pro pohon Krebsova cyklu organismus v této fázi šetří. Je totiž důležitým energetickým zdrojem pro neuroendokrinní a imunitní systém, tedy orgány, na jejichž funkci a vzájemné kooperaci závisí adekvátnost odpovědi organismu na inzult. Ve svalech obvykle běží pouze degradace glukózy na kyselinu pyrohroznovou, která se díky zánětem indukovanému snížení aktivity pyruvátdehydrogenázy mění na laktát. Ten funguje, mimo jiné, jako akceptor aminoskupiny z větvených aminokyselin za vzniku alaninu, který slouží v játrech opět pro syntézu potřebné glukózy.
Popsaný způsob získávání energie, jehož intenzita je nejvyšší v průběhu prvního týdne kritického stavu, je pochopitelně spojen s výrazným úbytkem svalové hmoty (17). Vzhledem k tomu, že ho nelze nijak ovlivnit exogenním přívodem energetických substrátů, je považován za „adaptační autokanibalismus“ (18, 19). Nemocný jedinec si tedy chtě nechtě tímto způsobem pokrývá až 50 % svých energetických potřeb v průběhu prvních dnů kritického stavu. V pozdější fázi stonání toto procento klesá.
Jaké jsou příčiny popsané změny způsobu získávání energie? Jednou z možných příčin může být evoluční tlak pudu sebezáchovy. Zraněný savec si není schopen chytit kořist, a pokud chce přežít, musí si najít jiné řešení – „shift“ metabolismu na získávání energie z vlastních rezerv. Tento stav mu navíc umožňuje ničím nerušený „fine -tuning“ neuroendokrinní a imunitní odpovědi na inzult. Organismus si dovede intenzitu těchto procesů efektivně regulovat pomocí množství endogenně vytvořeného či uvolněného energetického substrátu (pozn. autorů – paralela ve změně otáček motoru po sešlápnutí nebo uvolnění pedálu plynu v automobilu). Tímto substrátem je nejspíše glukóza. Stresová hyperglykemie je typickou součástí časné fáze kritického stavu a organismus si při ní vytváří právě tolik glukózy, kolik jí potřebuje pro regulaci intenzity odpovědi na inzult (20). Terapeutická kontrola glykemie do normálního pásma může být proto spojená s rizikem insuficientní odpovědi na inzult, a naopak exogenní přívod glukózy (a potravy vůbec) může tuto odpověď neúměrně zvyšovat (21, 22). To je zřejmě také jeden z důvodů, proč trpí nemocní savci fyziologickým nechutenstvím a kriticky nemocní pacienti časnou intolerancí enterální výživy. Na druhé straně právě díky této intoleranci nelze, na rozdíl od výživy parenterální, kriticky nemocného pacienta při enterální výživě v časné fázi kritického stavu energií předávkovat (23).
Jaký je praktický dopad popsané adaptační změny způsobu získávání energie v časné fázi kritického stavu na nutriční intervence? Pokud zvážíme dopad zánětem indukované hibernace na kalkulaci potřebného přívodu kalorií zvenku (energetická potřeba se rovná výpočtu podle prosté Harris -Benedictovy formule, tj. bez použití stresového indexu) a toto množství snížíme o 50 % z důvodu faktu, že organismus si v akutní fázi po inzultu pokrývá polovinu energetických potřeb z vlastních zdrojů, pak u jedince mužského pohlaví ve věku 60 let, o hmotnosti 80 kg a výšce 180 cm, dospějeme k číslu 850 kcal/den, respektive 11 kcal/kg/den.
Toto je množství exogenní energie, které je kriticky nemocný pacient schopen tolerovat v průběhu prvních třech dnů od inzultu. Energie přiváděná navíc je spojená s rizikem překrmování, a tím i neúměrnou stimulací zánětové odpovědi s negativním dopadem na průběh onemocnění. Kupříkladu u pacientů s ARDS (ARDS – „acute respiratory distress syndrome“, nosologická jednotka běžně spojená s excesivní zánětovou odpovědí) byla pozorována nižší úmrtnost, pokud pacienti v prvních dnech onemocnění dostávali nižší množství exogenní energie (v průměru 11 kcal/kg/den versus 18 kcal/kg/den) (24). Podobně ve smíšené populaci kriticky nemocných pacientů bylo pozorováno vyšší přežívání pacientů (70 % versus 57,5 %), pokud v akutní fázi onemocnění dostávali méně než 60 % z kalkulovaného energetického cíle, který byl stanoven přibližně na úroveň bazálního metabolismu (25). Konečně Zusman a spol. ve studii u pacientů v pozdější fázi pobytu na JIP (> 96 hodin) a měřeným energetickým výdejem pomocí nepřímé kalorimetrie zjistili, že energetický výdej se pohyboval v průměru kolem 24 kcal/kg/den. Překvapivě také zjistili nejvyšší přežívání, pokud pacienti dostali pouze 70 % ze změřeného množství vydané energie, tedy přibližně 17 kcal/kg/den (26). Zdá se tedy, že v akutní fázi onemocnění (první tři dny) je prostor pro exogenní přívod energie velice úzký (kolem 10 kcal/kg/den) a s ustupující neuroendokrinní a imunitní odpovědí na inzult se tento prostor zvolna rozšiřuje (v průběhu 4.–6. dne kolem 20 kcal/kg/den). Plné tolerance exogenního přívodu energie (tedy hodnoty rovné energetickému výdeji změřenému nepřímou kalorimetrií, respektive běžně doporučované, tj. > 25 kcal/kg/den) dosahuje pacient obvykle až na 7. den pobytu na JIP (4, 27). Nerespektování tohoto fyziologického a nepřímo úměrného vztahu mezi intenzitou odpovědi na inzult a prostorem pro exogenní přívod energie při nutriční podpoře je spojeno s horším průběhem stonání jak u dospělých, tak u dětských pacientů (2, 3, 28, 29). Riziko spojené s překrmováním pacientů se tak paradoxně stává problémem časné, a nikoliv pozdní fáze onemocnění. Pro ilustraci tohoto rizika, pokud je muž ve věku 60 let, o hmotnosti 80 kg a výšce 180 cm na řízené plicní ventilaci a k sedaci je použit propofol, pak při dávce anestetika 200 mg/hod jen touto cestou dostane denně až 60 % z množství energie, kterou je schopen zutilizovat v průběhu prvních třech dnů pobytu na JIP. S touto energií je nutno při kalkulaci nutriční podpory vždy počítat.
Role zánětem indukované autofagie
Posledním, avšak neméně důležitým faktorem, kterým se vysvětluje škodlivost časného zahájení plné nutriční podpory u kriticky nemocných pacientů, je inhibice autofagie (30). Autofagie (tj. „sebe -pojídání“) je známá již od roku 1960, kdy termín poprvé použil belgický vědec Christian de Duve. Její význam pro živé organismy v širším kontextu však objasnil až výzkum vedený profesorem Yoshinori Ohsumim, za který mu byla v roce 2016 udělena Nobelova cena (31). Jde o nitrobuněčný mechanismus, kterým se organismus sofistikovaně zbavuje vlastních poškozených organel, proteinových struktur a také mikroorganismů. Degradací vzniklé produkty slouží buď jako zdroj energie (tzv. „non-selective autophagy“) nebo jako substráty pro recyklaci (tzv. „selective autophagy“). Je to smysluplný, geneticky kódovaný úklidový mechanismus, který je aktivován hladem (mimo jiné se tím vysvětluje benefit krátkodobého půstu) či stresem a inhibován příjmem potravy (32). Jeho nefunkčnost je dnes spojována s procesem stárnutí či s celou řadou nemocí a není vyloučeno, že právě alterovaná autofagie může být příčinou protrahovaného průběhu stonání u kriticky nemocných pacientů (33). Kritický stav je totiž spojen s celou řadou buněčných stresorů (hypoxie, ischemie, zánět, oxidativní stres, poškození mitochondrií), které autofagii fyziologicky aktivují (34). Na druhé straně dnes dostupné studie u pacientů s protrahovaným multiorgánovým selháváním upozorňují, že autofagie u nich buď neprobíhá korektně nebo je její aktivace inhibována. Svědčí o tom například nadměrná akumulace autofagozomů (tj. nitrobuněčných struktur napěchovaných odpadovým materiálem určeným k destrukci v lysosomech) v jaterních buňkách a volných substrátů určených k autofagii v buňkách svalových (35, 36). Insuficientní autofagie, tedy „absence dokonalého úklidu nepořádku“ vzniklého v souvislosti s inzultem a odpovědí na inzult, koreluje také se svalovou slabostí kriticky nemocných pacientů, protrahovanou zánětovou odpovědí a rozsahem multiorgánového selhávání. Bohužel také koreluje s plným energetickým příjmem v časné fázi kritického stavu (33, 37). Zdá se tedy rozumné nechat následující proces: inzult –> odpověď na inzult (= „generuje nepořádek“) –> autofagie (= „zajišťuje úklid“) nerušeně proběhnout v uvedené posloupnosti a nebrzdit jej sice dobře míněnými, ale nevhodně načasovanými terapeutickými intervencemi. V této souvislosti je pacient připraven na plnou nutriční podporu až poté, co je celý proces zdárně ukončen (Obr. 1., 38).
Obr. 1. Trajektorie pacienta – inzult, zánětová odpověď, autofagie a nutriční podpora 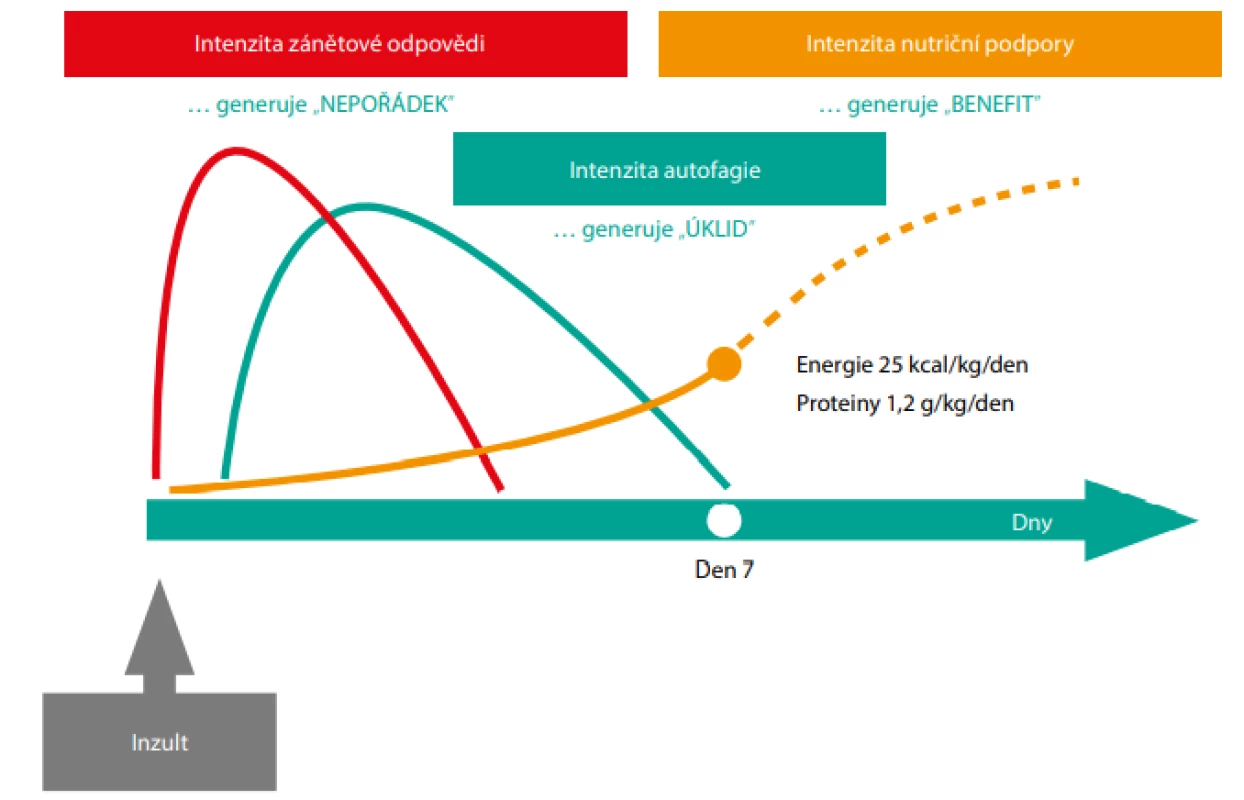
Inzult a zánětová odpověď vedou k celkové nestabilitě sytému s konverzí strukturálních tkáňových buněk do stavu s nízkou energetickou náročností a přechodnou ztrátou jejích funkce (adaptační multiorgánové selhání). Následná autofagie zajišťuje „úklid“, který je nevyhnutelný pro postupnou obnovu orgánových funkcí. Nutriční podpora založená na pozvolném nárůstu dávky energie a dávky proteinu s těmito procesy neinterferuje. Naopak plná dávka energie a plná dávka bílkovin v časné fázi kritického stavu potencují intenzitu zánětové odpovědi a inhibují autofagii. Obě tyto odchylky mohou přispět k protrahovanému průběhu stonání a horší prognóze kriticky nemocných pacientů. Potřeba bílkovin v časné fázi kritického stavu
Degradace svalových bílkovin je, jak již bylo popsáno, fyziologickou součástí časné fáze odpovědi organismu na inzult. Na druhé straně je stupeň této degradace úzce svázán s horší prognózou kriticky nemocných pacientů. Tudíž je celkem pochopitelná úvaha, že by vysoký exogenní přívod bílkovin (> 1,2 g/kg/den, respektive > 1,4 g/kg/den volných aminokyselin) v časné fázi kritického stavu mohl být spojen s lepším průběhem onemocnění. Tato marketingově velice atraktivní představa však nemá jednoznačnou oporu v existujících literárních datech (39). Prospektivní randomizované klinické studie, které testují vysoký versus nízký příjem bílkovin a zároveň respektují zásadu vyhnout se nadměrnému příjmu energie, zatím nejsou ukončeny. Retrospektivní analýzy starších studií nelze použít, protože jejich interpretace stran příjmu bílkovin je obvykle zatížená dříve běžně používaným energetickým překrmováním (40). Navíc je také nejasné, zda pozorování lepší prognózy u pacientů s vyšším příjmem bílkovin není jen obrazem toho, že pacienti byli v těchto studiích méně nemocní. S klesající tíží onemocnění totiž stoupá jak přežívání pacientů, tak i tolerance nutriční podpory, a oddělit tyto vlivy od sebe při interpretaci dat je často nemožné (41).
Na riziko spojené s nadměrným příjmem bílkovin v časné fázi kritického stavu poprvé upozornila post-hoc analýza výsledků studie EPaNIC. Ve skupině pacientů s lepší prognózou byl překvapivě zjištěn významně nižší průměrný denní příjem bílkovin v průběhu prvních sedmi dnů než u pacientů, kteří měli prognózu horší (14 g/den versus 47 g/den) (42). Nedávno publikované holandské studie PROTIVENT a PROCASEPT navíc ukázaly, že nejlepších výsledků lze dosáhnout postupným navyšováním příjmu bílkovin v průběhu prvních sedmi dnů pobytu na JIP (43, 44). V první zmíněné studii byla šestiměsíční úmrtnost pacientů nejnižší, pokud dostávali < 0,8 g bílkovin/kg/den v průběhu prvních dvou dnů pobytu na JIP, pak se v průběhu 3.–5. dne dávka navýšila na 0,8–1,2 g/kg/den a doporučené dávky bílkovin, tj. > 1,2 g/kg/den, bylo dosaženo až od 6. dne pobytu na JIP. Naopak pacienti, kteří měli příjem bílkovin v průběhu prvních tří dnů vyšší než 0,8 g/kg/den nebo od 4. do 7. dne nižší než 0,8 g/kg/den, měli šestiměsíční mortalitu významně vyšší. Podobně byla zjištěna vyšší šestiměsíční mortalita ve studii PROCASEPT, a to jak u septických pacientů, tak také u pacientů bez sepse, pokud dostávali v průběhu prvních sedmi dnů pobytu na JIP bílkoviny v dávce vyšší než 1,2 g/kg/den. Obě tyto studie přispěly ke změně názorů expertů na bezpečnost tzv. „high -protein, low -energy“ nutriční strategie v průběhu časné fáze kritického stavu (45–48). Dnes se zdá, že optimálním řešením bude, podobně jako u energetického příjmu, postupné navyšování dávky bílkovin (49).
V čem tedy tkví rizika zvýšeného proteinového příjmu v časné fázi kritického stavu? Kromě vzestupu nároků na kyslík v důsledku vzestupu oxidace aminokyselin (50) či nárůstu sérové koncentrace močoviny, se nejčastěji diskutuje zvýšení sérové koncentrace glukagonu, inhibice autofagie a ovlivnění chování střevní mikroflóry.
Glukagon je považován za hlavní katabolický hormon a jeho plazmatická koncentrace je v časné fázi po inzultu vždy zvýšená. Svým účinkem stimuluje glykogenolýzu a také jaterní glukoneogenezi z aminokyselin. Tím snižuje aminoacidemii s následným vzestupem aminokyselinového koncentračního gradientu mezi svaly a plazmou, což přispívá k degradaci svalových proteinů. Tento proces může být potencován exogenním přívodem bílkovin. Infuze aminokyselin u kriticky nemocných pacientů je spojená s dalším nárůstem sérové koncentrace glukagonu a jaterního katabolismu aminokyselin, což ve finále vede k amplifikaci již běžící proteolýzy ve svalech (45, 51).
Zvýšený příjem bílkovin v časné fázi kritického stavu působí na autofagii podobně jako neadekvátně vysoký energetický příjem. Oba autofagii inhibují. Mechanismus inhibice autofagie aminokyselinami (zejména leucinem) není příliš jasný a předpokládá se souvislost s aktivací mTOR („mamalian target of rapamycin“) signální cesty, která spouští proteosyntézu (52). V obecné rovině se zdá, že všechny aktivátory mTOR signalizace (aminokyseliny, inzulin, cvičení) autofagii inhibují, což by mohlo vysvětlit příčinu nepříznivého efektu časné doplňkové parenterální výživy ve studii EPaNIC, časné kontroly glykemie inzulinem ve studii NICE -SUGAR (53) nebo dokonce i časné rehabilitace u kriticky nemocných pacientů ve studii AVERT (54). Tyto poznatky opět signalizují potenciální škodlivost sice dobře míněných, nicméně vzhledem k právě probíhající autofagii neoptimálně načasovaných terapeutických intervencí.
Změna chování střevní mikroflóry po jakékoliv změně diety není překvapivá. Úprava jídelníčku na dnes populární „high-protein, low-energy“ dietu může mít nepříznivé důsledky. Střevní bakterie jsou zvyklé fermentovat zejména cukry a produkty této fermentace mají prospěšný vliv jak na normální složení střevního mikrobiomu, tak také na funkci enterocytů. V případě proteinové diety jsou bakterie nuceny fermentovat bílkoviny, což je spojeno s vzestupem produkce amoniaku, toxických aminů, přerůstání patogenní flory a zvýšením permeability sliznice gastrointestinálního traktu (55). Všechny tyty odchylky mohou nesporně přispět ke zhoršení průběhu stonání u kriticky nemocných pacientů a také ke zhoršení zdraví vůbec (56).
Závěr
Předepsat optimální příjem kalorií a bílkovin u kriticky nemocného pacienta v průběhu prvního týdne pobytu na JIP je pro každého intenzivistu veliká výzva. Pohybujeme se totiž v prostředí ne zcela přesně pochopeného metabolismu u kriticky nemocných pacientů, přičemž je zřejmé, že jak nedostatečná, tak také nadbytečná nutriční podpora mohou mít nepříznivé důsledky. Cílem tohoto článku bylo zdůraznit respektování odpovědi na inzult při volbě nutriční strategie a nastínit rizika spojená s časnou agresivní nutriční intervencí, a to jak pro energetický, tak také pro proteinový příjem. Dnes je zřejmé, že nejoptimálnější volbou nutriční podpory v průběhu prvního týdne pobytu na JIP je postupné navyšování dávky jak energie, tak i bílkovin. Chceme -li to vyjádřit číselně, pak tedy, po podrobné analýze dostupných údajů a grafických zobrazení v citovaných pracích, vzestup dávky energie o 5 kcal/kg/den a vzestup dávky bílkovin o 0,2 g/kg/den nejlépe vyhovuje strategii nutriční podpory pro prvních sedm dnů kritického stavu (Tab. 1). Platí to ovšem pouze u pacientů přicházejících na JIP s normální hodnotou body mass index, tedy bez malnutrice či obezity. Obě tyto kategorie pacientů vyžadují zvláštní pozornost přesahující rozsah tohoto článku.
Tab. 1. Příjem energie a bílkovin v průběhu prvního týdne pobytu na JIP u jedince s normálním BMI a hmotností 80 kg 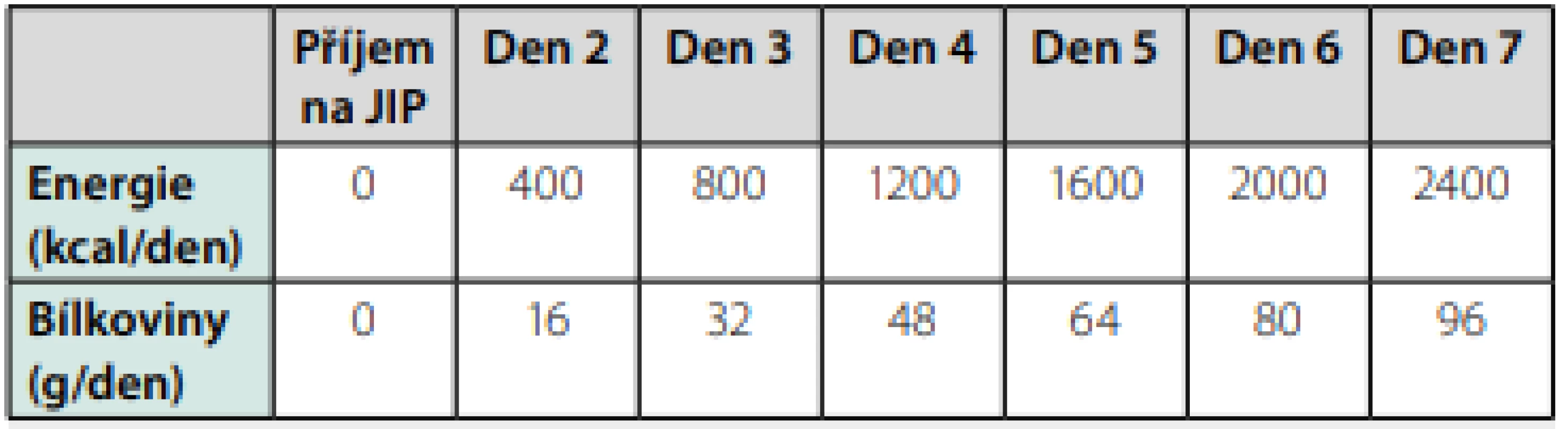
Kalkulace vychází z inkrementu 5 kcal/kg/den pro energii a 0,2 g/kg/den pro bílkoviny. Tato kalkulace již zahrnuje zánětem indukovaný nízkoenergetický stav organismu s konverzi na endogenní energetické zdroje KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Roman Kula, CSc.,
Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN Ostrava
17. listopadu 1790,
708 00 Ostrava-Poruba
Cit. zkr: Vnitř Lék 2021; 67(1): e43–e48
Článek přijat redakcí: 18. 5. 2020
Článek přijat po recenzích k publikaci: 19. 1. 2021
Zdroje
1. Ronco C, Ricci Z, Husain -Syed F. From Multiple Organ Support Therapy to Extracorporeal Organ Support in Critically Ill Patients. Blood Purif. 2019; 48(2): 99–105. doi:10.1159/000490694
2. Casaer MP, Mesotten D, Hermans G et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011; 365(6): 506–517. doi:10.1056/NEJMoa1102662.
3. Fivez T, Kerklaan D, Mesotten D et al. Early versus Late Parenteral Nutrition in Critically Ill Children. N Engl J Med. 2016; 374(12): 1111–1122. doi:10.1056/NEJMoa1514762.
4. Wischmeyer PE. Tailoring nutrition therapy to illness and recovery. Crit Care. 2017;21(Suppl 3):316. doi:10.1186/s13054-017-1906-8.
5. Wischmeyer PE. Are we creating survivors…or victims in critical care? Delivering targeted nutrition to improve outcomes. Curr Opin Crit Care. 2016; 22(4): 279–284. doi:10.1097/ MCC.0000000000000332.
6. Rawal G, Yadav S, Kumar R. Post -intensive Care Syndrome: an Overview. J Transl Int Med. 2017; 5(2): 90–92. doi:10.1515/jtim-2016-0016
7. Casaer MP, Van den Berghe G, Gunst J. New ESPEN Guidelines for Nutrition in the Critically Ill: Help, What Happened!? ICU Management & Practice 2019, 19 : 140–144
8. Hippocrates: The Aphorisms of Hippocrates. New York: The Classics of Medicine Library; 1982.
9. Kula R, Chylek V, Szturz P et al. A response to infection in patients with severe sepsis-do we need a „stage -directed therapy concept“?. Bratisl Lek Listy. 2009;110(8):459–464.
10. Singer M, De Santis V, Vitale D, Jeffcoate W. Multiorgan failure is an adaptive, endocrine-mediated, metabolic response to overwhelming systemic inflammation. Lancet. 2004; 364(9433): 545–548. doi:10.1016/S0140-6736(04)16815-3
11. Mongardon N, Dyson A, Singer M. Is MOF an outcome parameter or a transient, adaptive state in critical illness?. Curr Opin Crit Care. 2009; 15(5): 431–436. doi:10.1097/ MCC.0b013e3283307a3b.
12. Stanzani G, Tidswell R, Singer M. Do critical care patients hibernate? Theoretical support for less is more. Intensive Care Med. 2019;10.1007/s00134-019-05813-9. doi:10.1007/s00134-019-05813-9
13. Singer M, Glynne P. Treating critical illness: the importance of first doing no harm. PLoS Med. 2005; 2(6): e167. doi:10.1371/journal.pmed.0020167.
14. Kapadia FN, Kapoor R, Trivedi M. Can Less be More in Intensive Care?. Indian J Crit Care Med. 2017; 21(1): 1–5. doi:10.4103/0972-5229.198308.
15. Uehara M, Plank LD, Hill GL. Components of energy expenditure in patients with severe sepsis and major trauma: a basis for clinical care. Crit Care Med. 1999; 27(7): 1295–1302. doi:10.1097/00003246-199907000-00015.
16. Kreymann G, Grosser S, Buggisch P, Gottschall C, Matthaei S, Greten H. Oxygen consumption and resting metabolic rate in sepsis, sepsis syndrome, and septic shock. Crit Care Med. 1993; 21(7): 1012–1019. doi:10.1097/00003246-199307000-00015.
17. Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness [published correction appears in JAMA. 2014;311(6):625. Padhke, Rahul [corrected to Phadke, Rahul]]. JAMA. 2013; 310(15): 1591–1600. doi:10.1001/jama.2013.278481.
18. Cerra FB, Siegel JH, Coleman B, Border JR, McMenamy RR. Septic autocannibalism. A failure of exogenous nutritional support. Ann Surg. 1980; 192(4): 570–580. doi:10.1097/00000658 - 198010000-00015.
19. Hartl WH, Jauch KW. Metabolic self -destruction in critically ill patients: origins, mechanisms and therapeutic principles. Nutrition. 2014; 30(3): 261–267. doi:10.1016/j. nut.2013. 07. 019.
20. Losser MR, Damoisel C, Payen D. Bench -to -bedside review: Glucose and stress conditions in the intensive care unit. Crit Care. 2010; 14(4):231. doi:10.1186/cc9100.
21. Losser MR, Bernard C, Beaudeux JL, Pison C, Payen D. Glucose modulates hemodynamic, metabolic, and inflammatory responses to lipopolysaccharide in rabbits. J Appl Physiol (1985). 1997; 83(5): 1566–1574. doi:10.1152/jappl.1997. 83. 5.1566.
22. Marik PE, Bellomo R. Stress hyperglycemia: an essential survival response!. Crit Care. 2013;17(2):305. doi:10.1186/cc12514.
23. Elke G, van Zanten AR, Lemieux M et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta -analysis of randomized controlled trials. Crit Care. 2016; 20(1): 117. doi:10.1186/s13054-016-1298-1.
24. Peterson SJ, Lateef OB, Freels S, McKeever L, Fantuzzi G, Braunschweig CA. Early Exposure to Recommended Calorie Delivery in the Intensive Care Unit Is Associated With Increased Mortality in Patients With Acute Respiratory Distress Syndrome. JPEN J Parenter Enteral Nutr. 2018; 42(4): 739–747. doi:10.1177/0148607117713483.
25. Arabi YM, Tamim HM, Dhar GS et al. Permissive underfeeding and intensive insulin therapy in critically ill patients: a randomized controlled trial. Am J Clin Nutr. 2011; 93(3): 569–577. doi:10.3945/ajcn.110.005074.
26. Zusman O, Theilla M, Cohen J, Kagan I, Bendavid I, Singer P. Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study. Crit Care. 2016; 20(1): 367. doi:10.1186/s13054-016-1538-4.
27. Oshima T, Deutz NE, Doig G, Wischmeyer PE, Pichard C. Protein -energy nutrition in the ICU is the power couple: A hypothesis forming analysis. Clin Nutr. 2016; 35(4): 968–974. doi:10.1016/j.clnu.2015. 10. 016.
28. Al -Dorzi HM, Albarrak A, Ferwana M, Murad MH, Arabi YM. Lower versus higher dose of enteral caloric intake in adult critically ill patients: a systematic review and meta -analysis. Crit Care. 2016; 20(1): 358. doi:10.1186/s13054-016-1539-3.
29. Gunst J, Van den Berghe G. Intensive Care Nutrition and Post -Intensive Care Recovery. Crit Care Clin. 2018; 34(4): 573–583. doi:10.1016/j.ccc.2018. 06. 004.
30. Gunst J. Recovery from critical illness -induced organ failure: the role of autophagy. Crit Care. 2017; 21(1): 209. doi:10.1186/s13054-017-1786-y.
31. https://www.nobelprize.org/prizes/medicine/2016/press -release/.
32. de Cabo R, Mattson MP. Effects of Intermittent Fasting on Health, Aging, and Disease. N Engl J Med. 2019; 381(26): 2541–2551. doi:10.1056/NEJMra1905136.
33. Gunst J., Vanhorebeek I, Van den Berghe G. The role of autophagy in recovery from critical illness. ICU Management & Practice 2017; 17 : 134–136.
34. Kroemer G, Mariño G, Levine B. Autophagy and the integrated stress response. Mol Cell. 2010; 40(2): 280–293. doi:10.1016/j.molcel.2010. 09. 023.
35. Watanabe E, Muenzer JT, Hawkins WG et al. Sepsis induces extensive autophagic vacuolization in hepatocytes: a clinical and laboratory -based study. Lab Invest. 2009;89(5):549 – 561. doi:10.1038/labinvest.2009.8.
36. Vanhorebeek I, Gunst J, Derde S et al. Insufficient activation of autophagy allows cellular damage to accumulate in critically ill patients. J Clin Endocrinol Metab. 2011; 96(4): E633 – E645. doi:10.1210/jc.2010-2563.
37. Hermans G, Casaer MP, Clerckx B et al. Effect of tolerating macronutrient deficit on the development of intensive -care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med. 2013; 1(8): 621–629. doi:10.1016/S2213-2600(13)70183-8.
38. Casaer MP, Mesoltten D. Nutritional Failure: An Adaptive Response to Critical Illness? ICU Management & Practice 2013, 13 : 98–101.
39. Arabi YM, Al -Dorzi HM, Sadat M. Protein intake and outcome in critically ill patients. Curr Opin Clin Nutr Metab Care. 2020; 23(1): 51–58. doi:10.1097/MCO.0000000000000619.
40. Hoffer LJ. Protein requirement in critical illness. Appl Physiol Nutr Metab. 2016; 41(5): 573–576. doi:10.1139/apnm-2015-0551.
41. Rooyackers O, Sundström Rehal M, Liebau F, Norberg Å, Wernerman J. High protein intake without concerns?. Crit Care. 2017;21(1):106. doi:10.1186/s13054-017-1699-9.
42. Casaer MP, Wilmer A, Hermans G, Wouters PJ, Mesotten D, Van den Berghe G. Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med. 2013;187(3):247–255. doi:10.1164/rccm.201206-0999OC.
43. Koekkoek WACK, van Setten CHC, Olthof LE, Kars JCNH, van Zanten ARH. Timing of PROTein INtake and clinical outcomes of adult critically ill patients on prolonged mechanical VENTilation: The PROTINVENT retrospective study. Clin Nutr. 2019; 38(2): 883–890. doi:10.1016/j.clnu.2018. 02. 012.
44. de Koning MLY, Koekkoek WACK, Kars JCNH, van Zanten ARH. Association of PROtein and CAloric Intake and Clinical Outcomes in Adult SEPTic and Non -Septic ICU Patients on Prolonged Mechanical Ventilation: The PROCASEPT Retrospective Study. JPEN J Parenter Enteral Nutr. 2020; 44(3): 434–443. doi:10.1002/jpen.1663.
45. Preiser JC, Wernerman J. Provision of Nutrients to the Acutely Ill. Introducing the „Baby Stomach“ Concept. Am J Respir Crit Care Med. 2017; 196(9): 1089–1090. doi:10.1164/rccm. 201705-0919ED.
46. Koekkoek KWAC, van Zanten ARH. Nutrition in the ICU: new trends versus old -fashioned standard enteral feeding?. Curr Opin Anaesthesiol. 2018; 31(2): 136–143. doi:10.1097/ ACO.0000000000000571.
47. Heyland DK, Stapleton R, Compher C. Should We Prescribe More Protein to Critically Ill Patients?. Nutrients. 2018;10(4):462. doi:10.3390/nu10040462.
48. Preiser JC. High protein intake during the early phase of critical illness: yes or no?. Crit Care. 2018; 22(1): 261. doi:10.1186/s13054-018-2196-5.
49. De Waele E, Malbrain MLNG, Spapen H. Nutrition in Sepsis: A Bench -to -Bedside Review. Nutrients. 2020; 12(2): 395. Published 2020 Feb 2. doi:10.3390/nu12020395.
50. Greig PD, Elwyn DH, Askanazi J, Kinney JM. Parenteral nutrition in septic patients: effect of increasing nitrogen intake. Am J Clin Nutr. 1987; 46(6): 1040–1047. doi:10.1093/ajcn/46. 6. 1040.
51. Thiessen SE, Derde S, Derese I et al. Role of Glucagon in Catabolism and Muscle Wasting of Critical Illness and Modulation by Nutrition. Am J Respir Crit Care Med. 2017; 196(9): 1131–1143. doi:10.1164/rccm.201702-0354OC.
52. Meijer AJ. Amino acid regulation of autophagosome formation. Methods Mol Biol. 2008;445 : 89–109. doi:10.1007/978-1-59745-157-4_5.
53. NICE -SUGAR Study Investigators, Finfer S, Chittock DR, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009; 360(13): 1283–1297. doi:10.1056/NEJMoa0810625.
54. AVERT Trial Collaboration group. Efficacy and safety of very early mobilisation within 24 h of stroke onset (AVERT): a randomised controlled trial. Lancet. 2015; 386(9988): 46 – 55. doi:10.1016/S0140-6736(15)60690-0.
55. Rist VT, Weiss E, Eklund M, Mosenthin R. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review. Animal. 2013;7(7):1067–1078. doi:10.1017/S1751731113000062.
56.http://main.poliquingroup.com/ArticlesMultimedia/Articles/Article/2646/Three_Situations_In_Which_A_High -Protein_Diet_Is_A_Bad_Idea.aspx.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Internista a pacient po ischemické CMP
- Následná péče po prodělaném covidu-19 a její úskalí
- Horečka nejasného původu
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kdy ukončit léčbu hepatitidy B?
- Kompetence pacienta a informovaný souhlas
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Je autoimunitní pankreatitida rizikovým faktorem adenokarcinomu pankreatu?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



