-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
Taxane‑induced polyneuropathy – current possibilities of prediction and management
Peripheral neurotoxicity is the most typical non-haematological adverse effect of taxanes. Symptoms are dominated by sensory peripheral neuropathy, the incidence and degree of which depend on the cumulative dose level. The impact of neurotoxicity on the patient´s quality of life is significant, therefore it is necessary to consider the selection of therapy and the patient´s pre-existing risk factors for developing neuropathy and to get acquainted with current management options, including genetic prediction of polyneuropathy. This review article reports on a very common complication of cancer therapy that can be encountered at each internist´s outpatient dispensary.
Keywords:
paclitaxel – polyneuropathy – paresthesia – risk factors – duloxetine
Autoři: Magdaléna Jablonická 1; Lucia Žideková 2; Beata Mladosievičová 3
Působiště autorů: Onkologická klinika SZU, FNsP F. D. Roosevelta, Banská Bystrica 1; Oddelenie genetiky, Medirex, a. s., Bratislava 2; Oddelenie klinickej patofyziológie, Lekárska fakulta UK, Bratislava 3
Vyšlo v časopise: Vnitř Lék 2021; 67(1): 26-31
Kategorie: Přehledové články
Souhrn
Periférna neurotoxicita predstavuje najtypickejší nehematologický nežiaduci účinok taxánov. Z príznakov dominuje senzorická periférna neuropatia, ktorej výskyt a stupeň závisia na výške kumulatívnej dávky. Dopad neurotoxicity na kvalitu života pacienta je značný, preto je nevyhnutné zohľadňovať selekciu terapie a preexistujúce rizikové faktory pacienta k rozvoju neuropatie a oboznamovať sa s aktuálnymi možnosťami jej manažmentu vrátane genetickej predikcie polyneuropatie. Tento prehľadový článok informuje o veľmi častej komplikácii onkologickej terapie, s ktorou je možné sa stretnúť v ambulancii každého internistu.
Klíčová slova:
paklitaxel – polyneuropatia – parestézia – rizikové faktory – duloxetín
Úvod
Protinádorová aktivita taxánových cytostatík bola objavená v 60. rokoch počas skríningového programu, ktorý skúmal potenciálny antitumorózny efekt u tisícov druhov rastlín (1).
Ich širokospektrálny účinok robí z taxánov strategický liek v prvo a druholíniovej liečbe mnohých malignít akými sú napríklad karcinóm vaječníka, prsníka, maternice, pľúc, hlavy a krku, prostaty alebo žalúdka. Paklitaxel a docetaxel boli prvými prototypmi taxánov uvedenými do praxe a sú doteraz tými najpoužívanejšími z tejto skupiny. Neustále prebiehajúci výskum priniesol do praxe aj novšie preparáty druhej generácie, ako napríklad nab -paklitaxel (nanopartikulový na albumín viazaný paklitaxel) a kabazitaxel, semisyntetický derivát docetaxelu.
Profil toxicity paklitaxelu a docetaxelu zahŕňa hypersenzitívne reakcie, periférnu neurotoxicitu, hematotoxicitu a dermatotoxicitu. Prípady centrálnej neurotoxicity sú vzácne. Príčinou hypersenzitívnej reakcie je vehikulum Cremophor EL, ktoré zaisťuje rozpustnosť paklitaxelu a možnosť jeho intravenózneho podania. Cremophor cestou diftalátov vedie k uvoľňovaniu histamínu a iných mediátorov, klinické prejavy reakcie zahŕňajú návaly tepla, urtikáriu, opresie na hrudníku, tachykardiu, hypotenziu a angioedém. Podanie paklitaxelu preto vyžaduje premedikáciu antihistaminikami a kortikoidmi (2). Pri docetaxeli je pôvodcom hypersenzitívnych reakcií polysorbát 80. Môže spôsobiť aj retenciu tekutín, ktorú do určitej miery redukuje premedikácia dexametazónom (3).
Hematotoxicita taxánov je vďaka rastovým faktorom pomerne dobre zvládnuteľná, ale polyneuropatia stále zostáva veľmi ťažko manažovateľným problémom tohto typu cytostatika a môže viesť k redukciám dávok, predčasnému ukončeniu terapie a perzistujúcim neurologickým zmenám, ktoré limitujú kvalitu života pacienta. Ďalším nežiaducim účinkom paklitaxelu je paravazácia, ktorá je charakterizovaná chemickou iritáciou s možným rozvojom chemickej nekrózy (4).
Epidemiológia a patofyziológia taxánmi‑indukovanej polyneuropatie (TIPN)
Incidencia všetkých stupňov TIPN u pacientov liečených paklitaxelom varíruje od 57–83 %, z toho 2–33 % prípadov je závažných. Podobne aj u docetaxelu sú incidencie TIPN vysoko variabilné: celkovo 11–64 %, z toho 3–14 % závažných (5). V rámci porovnávania toxicity ukázali výsledky metaanalýzy nižšie percento výskytu senzorickej neuropatie grade III v skupine pacientov s paklitaxelom podávaným týždenne oproti skupine s paklitaxelom v trojtýždňovej administrácii (6). Štúdia fázy III porovnávala účinnosť a bezpečnosť docetaxelu 75 mg/m2 à 3 týždne versus docetaxelu 35 mg/m2 à týždeň po dobu 3 týždňov s následnou týždňovou pauzou u pacientov s metastatickým ochorením, ktorí boli predliečení jednou a viacerými líniami chemoterapie. Trojtýždňový režim vykazoval vyššiu celkovú mieru odpovede (36 vs. 20 %; P = NR), podobný medián prežívania bez progresie (5,7 vs. 5,5 mesiaca; P = NS) ako aj podobné celkové prežívanie (18,3 vs. 18,6 mesiaca; P = NS), ale v porovnaní s týždňovým režimom aj vyššie percento neuropatie grade 3/4 (10 vs 5 %; P = NR) (7).
V štúdii fázy III u pacientok s metastatickým karcinómom prsníka, ktoré sprogredovali na antracyklínovom režime, bol z hľadiska neurotoxicity porovnávaný paklitaxel 175 mg/m2 à 3 týždne versus docetaxel 100 mg/m2 à 3 týždne. V skupine s docetaxelom bol sledovaný vyšší výskyt senzorickej neuropatie grade 3/4 (7 vs. 4 %; P =.08), neuromotorickej toxicity grade 3/4 a tiež celkového počtu pacientov s neurosenzorickou (64 vs. 59 %; P = NR) a neuromotorickou (28 vs. 13 %; P = NR) toxicitou všetkých stupňov (8).
Presný patomechanizmus TIPN nie je známy. Najširšie akceptovaná teória je založená na inhibícii tubulínovej depolymerizácie a excesívnej tvorbe atypických zhlukov mikrotubulov, ktoré sa hromadia v bunke a poškodzujú jej funkcie. Zmeny v cytoskelete narúšajú mitózu, čo je aj princípom protinádorového účinku taxánov. Intaktné mikrotubuly sú nevyhnutné pre axonálny transport a tým aj pre prežitie neurónu. Taxánmi navodená zvýšená stabilita axonálnych mikrotubulov môže viesť cez poruchu mitochondriálnej funkcie a axonálneho transportu k strate integrity axónu, v horšom prípade k jeho degenerácii. Najzraniteľnejšou časťou podliehajúcou týmto zmenám sú periférne nervy, z čoho aj vyplýva typická klinická manifestácia TIPN (9, 10). Paklitaxel spôsobuje tiež zvýšenú senzitivitu na bolesť prostredníctvom zvýšenej expresie kanálov TRP (transient receptor potential channels). V experimentoch s vyradením génu pre receptory TRPV sa dosiahlo zlepšenie neuropatickej bolesti (11).
Klinický obraz TIPN
U pacientov, ktorí podstúpili terapiu taxánmi, boli pozorované dva typy periférnej neurotoxicity: akútna, často pri vysokodávkovej chemoterapii a krátkych infúziách, ktorá je prechodná, ale pre pacienta stresujúca, a subakútna toxicita, ktorá má tendenciu perzistovať. Cytostatikami navodená polyneuropatia patrí k najčastejším algickým syndrómom a podobne ako iné neuropatické bolesti môže a nemusí závisieť od rozličných stimulov.
Akútny algický syndróm sa pri paklitaxele a docetaxele objavuje až u 70% pacientov, najčastejšie 1–3 dni po chemoterapii v podobe difúznej myalgie alebo arthralgie s tendenciou spontánnej regresie do 1 týždňa (12, 13). TIPN má tendenciu byť progresívna a môže byť diagnostikovaná aj po vyliečení onkologického ochorenia. Pre taxány sú typické distálne symetrické parestézie až pálivé bolesti končatín, ktoré sú najskôr tranzientné a neskôr perzistentné, so spontánnym zlepšovaním sa mesiace až roky po ukončení terapie. Predilekčne je postihnutá plantárna oblasť nôh a končeky prstov na končatinách. Bežnými sú aj senzorické symptómy zahŕňajúce tŕpnutie a zníženú citlivosť na teplo a dotyk. Pre postihnutého pacienta sú obzvlášť nepríjemné ťažkosti pri bežných úkonoch vyžadujúcich jemnú motoriku. Ďalšie manifestácie v podobe postihnutia motorických alebo autonómnych nervových vlákien sa prejavujú skôr u pacientov s preexistujúcimi rizikovými faktormi alebo pri koadministrácii iného neurotoxického agens v kombinácii s taxánmi (predovšetkým platinových derivátov).
Závažnosť neuropatie je v úzkom vzťahu s jednotlivou ale aj kumulatívnou dávkou taxánov. Pri vysokých dávkach sa môže objaviť motorické postihnutie a poruchy chôdze. Symptómy spojené so zmenami v autonómnych funkciách ako arytmie a ortostatická hypotenzia navodené paklitaxelom sú zriedkavé, ale musí sa im venovať osobitná pozornosť (14). The National Cancer Institute (NCI), ECOG a WHO kvantifikujú neuropatiu do 4 stupňov (Tab. 1). Napriek tomu, že TIPN je v pomerne vysokej miere reverzibilná, dlhodobé štúdie s rozsiahlym follow -upom odhalili významnú mieru perzistencie neuropatie, zvyčajne dobre tolerovanej (15).
Tab. 1. Rôzne systémy kvantifikujúce chemoterapiou – indukovanú polyneuropatiu 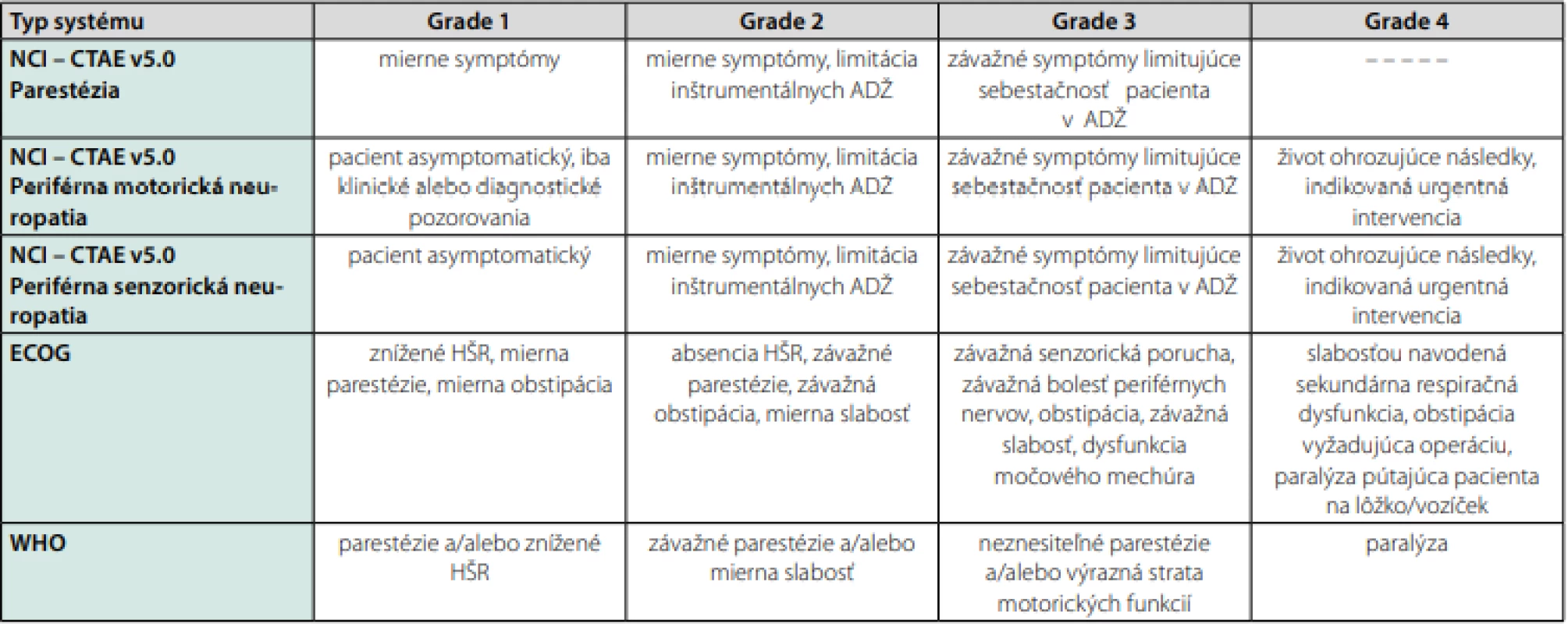
ADŽ – aktivity denného života, HŠR – hlboké šľachové reflexy, CTCAE – Common Terminology Criteria for Adverse Events Rizikové faktory a prediktory vzniku TIPN
Vo výskyte neuropatie existuje u pacientov liečených taxánmi výrazná interindividuálna variabilita, a to aj pri uniformných režimoch s identickým dávkovaním. Dôvody tejto odlišnosti sú známe len čiastočne a vhodné prediktívne biomarkery pre zvýšené riziko polyneuropatie neboli doteraz presne identifikované. Diagnostika a zhodnotenie symptómov TIPN v dennej praxi sú komplexné a často náročné. Práve preto by sa malo pred zahájením terapie taxánmi ku každému pacientovi pristupovať osobitne.
Medzi rizikové faktory súvisiace s liečbou patrí výška jednotlivých dávok taxánov a ich kumulatívna dávka. Neuropatiu rôzneho stupňa môžu vyvolať už dávky od 100–300 mg/m2 pri paklitaxele a 75–100 mg/m2 pri docetaxele (16). V randomizovanej štúdii fázy III bola u pacientok s metastatickým karcinómom prsníka stredná kumulatívna dávka vedúca k periférnej neurotoxicite grade 2 pri docetaxele 371 mg/m2 a pri paklitaxele 715 mg/m2 (17).
Výskyt TIPN stúpa s počtom podaných cyklov chemoterapie a predpokladá sa tiež vyššia predispozícia u pacientov s preexistujúcou polyneuropatiou inej etiológie. Diabetes mellitus a vysoký vek sú nezávislými prediktívnymi faktormi. Pomerne zaujímavé je, že anamnéza autoimunitnej choroby bola asociovaná s nižším výskytom neuropatie (18).
Koadministrácia dvoch neurotoxických agens v onkológii je veľmi častým javom pri viacerých typoch malignít a pri podaní paklitaxelu s cisplatinou sa u väčšiny pacientov rozvinie periférna polyneuropatia. Efekt je pravdepodobne skôr synergický ako aditívny (19).
K významným prediktorom vzniku neuropatie patria génové polymorfizmy (SNP, single nucleotide polymorphisms), detegovateľné na molekulovej úrovni. Gény zapojené do metabolickej dráhy taxánov môžu značne ovplyvniť farmakokinetiku liečiva v organizme. Gén CYP3A4 kóduje oxidačný enzým katalyzujúci reakcie zahrnuté do metabolizmu liečiv. Polymorfizmy v géne CYP3A4 sú asociované s dvojnásobne častejším výskytom TIPN pri karcinóme prsníka (20). Génový produkt ABCB1 slúži ako väzbový proteín ATP pre aktívny transport látok. Bodový polymorfizmus C3435T (rs1045642) má dvojnásobne vyššie riziko vzniku neuropatie v porovnaní s genotypom TC, príp. CC. Analýza bola realizovaná na súbore 219 pacientok s karcinómom prsníka na adjuvantnej terapii taxánmi (21).
Taktiež dva bodové polymorfizmy v géne CYP2C8, ktoré značne znižujú metabolizovanie taxánových liečiv, sú spojené so signifikantnou pravdepodobnosťou vzniku neuropatií (22).
FGD4 gén sa podieľa na regulácii aktínového cytoskeletu a myelinizácii buniek a jeho polymorfizmy sú asociované s TIPN. Celogenómová asociačná štúdia bola realizovaná na európskej populácii v celkovom počte 859 pacientov (23). EPHA5 gén sa v organizme podieľa na vývinových procesoch v nervovom systéme a jeho polymorfizmus c. 2895G>A (rs7349638) by mohol byť vhodným biomarkerom na predikciu toxicity taxánovej liečby (20).
Prevencia a terapia TIPN
Napriek realizácii viacerých štúdií a testovaniu početných potenciálnych terapeutík sa doteraz nepodarilo etablovať ani jeden jednoznačne efektívny liek na prevenciu akútneho algického syndrómu asociovaného s taxánmi alebo dlhodobej TIPN. V rámci prevencie sa skúmal efekt celej škály nutraceutík, neuroprotektív a antioxidantov, ako sú vitamíny B a E, kyselina alfa -lipoová, glutamín, glutathion, L -karnitín, avšak s veľmi otáznym alebo negatívnym výsledkom štúdií (24). V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u pacientok s karcinómom prsníka počas adjuvantnej terapie bolo pri užívaní acetyl-L-karnitínu pozorované po 24 týždňoch zhoršenie chemoterapiou indukovanej polyneuropatie (CIPN). Jednalo sa o prvú štúdiu, ktorá dokázala, že výživový doplnok zhoršuje CIPN a pacienti by preto nemali užívať suplementy bez dokázanej účinnosti (25). Lokálne chladenie rúk a nôh počas administrácie paklitaxelu imponuje ako potenciálne vhodný prístup v prevencii TIPN – incidencia TIPN grade 2 alebo viac bola 5–9% vs. 20–32% v kontrolnej skupine (26).
Potenciálne efektívny preparát na samotnú liečbu TIPN by mal byť zameraný na určitú skupinu cytostatík v závislosti od mechanizmu ich toxicity bez narušenia ich protinádorového účinku. Cieľom liečby je zmiernenie pozitívnych senzitívnych znakov a ťažkostí, akými sú parestézie a neuropatická bolesť. Súčasný prístup k zvládaniu neurotoxicity zahŕňa zmenu, respektíve modifikáciu chemoterapeutického režimu v zmysle redukcie dávky, trvania taxánovej infúzie a symptomatickej farmakologickej terapie. S výnimkou duloxetínu doteraz publikované štúdie jednoznačne nepreukázali signifikantnú účinnosť štandardných liečiv, ktoré sú v súčasnej klinickej praxi etablované na terapiu neuropatie. Napriek rozporuplnosti štúdií a nedostatku dát je však možné niektoré z nich vzhľadom na limitované možnosti aktuálnej terapie aplikovať (Tab. 2). Na liečbu neuropatickej bolesti možno použiť opioidy, z ktorých je najvhodnejší oxycontin (27).
Tab. 2. Prehľad niektorých štúdií zaoberajúcimi sa terapiou TIPN 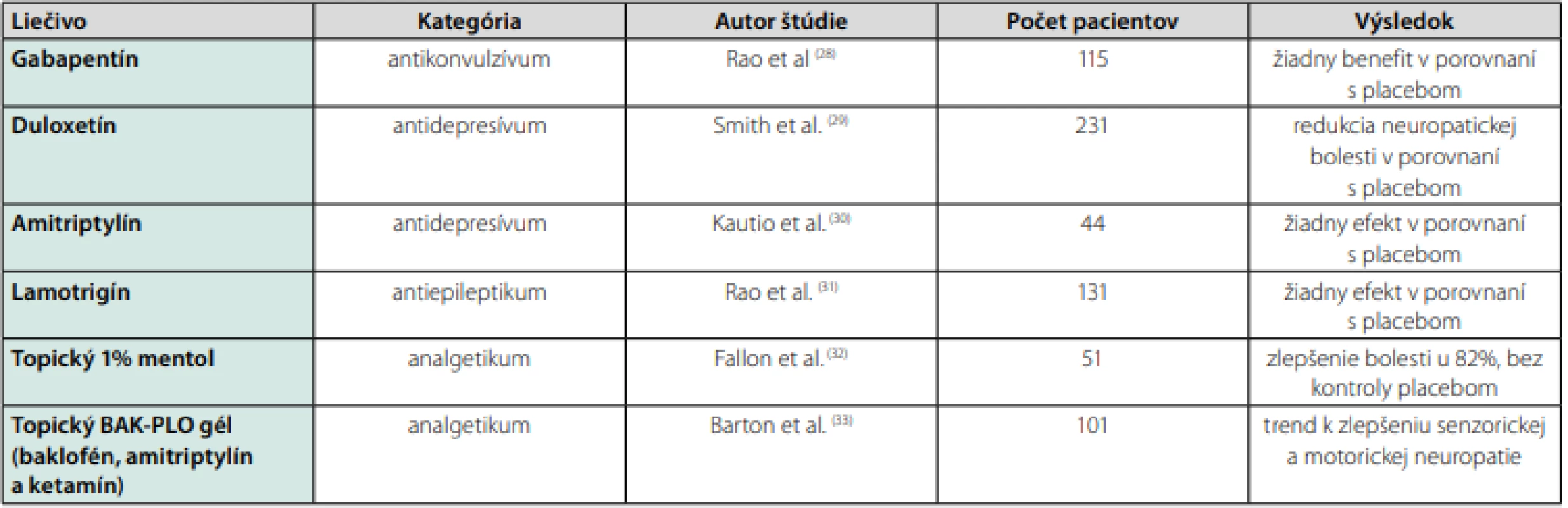
28. Rao et al. Efficacy of gabapentin in the management of chemotherapy-induced peripheral neuropathy: a phase 3 randomized, double-blind, placebo-controlled, crossover trial (N00C3). Cancer. 2007; 110(9): 2110–2118. 29. Smith et al. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial. JAMA. 2013; 309(13): 1359–1367. doi: 10.1001/jama.2013.2813. 30. Kautio et al. Amitriptyline in the treatment of chemotherapy-induced neuropathic symptoms. J Pain Symptom Manage. 2008; 35(1): 31–39. Epub 2007 Nov 5. 31. Rao RD, Flynn PJ, Sloan JA, Wong GY, Novotny P, Johnson DB, Gross HM, Renno SI, Nashawaty M, Loprinzi CL (2008) Efficacy of lamotrigine in the management of chemotherapy-induced peripheral neuropathy: a phase 3 randomized, double-blind, placebo-controlled trial, N01C3. Cancer 112(12): 2802–2808. doi:10.1002/cncr.23482 32. Fallon MT, Storey DJ, Krishan A, et al. Cancer treatment-related neuropathic pain: proof of concept study with menthol–a TRPM8 agonist. Support Care Cancer. 2015; 23: 2769–2777. 33. Barton et al. A double-blind, placebo-controlled trial of a topical treatment for chemotherapy-induced peripheral neuropathy: NCCTG trial N06CA. Support Care Cancer. 2011; 19(6): 833–841. Americká asociácia pre klinickú onkológiu (ASCO) doteraz neodporúča predpisovanie iných terapeutík okrem duloxetínu. V rámci prevencie dokonca neodporúča žiadne liečivá. Duloxetín je duálny selektívny inhibítor spätného vychytávania serotonínu a noradrenalínu a okrem TIPN sa používa aj v terapii depresívneho syndrómu, stresovej inkontinencie a diabetickej polyneuropatie. Veľká multicentrická, dvojito zaslepená štúdia fázy III z roku 2014 so súborom 231 pacientov, ktorí dostávali taxánový alebo platinový režim bola randomizovaná do dvoch ramien – v prvej skupine dostávali pacienti duloxetín v dávke 30 mg denne 1. týždeň a 60 mg denne ďalšie 4 týždne oproti skupine s 5-týždňovým placebom. Výsledky štúdie ukázali, že celkovo 59 % pacientov uviedlo akékoľvek percentuálne zníženie bolesti v prvej skupine oproti 38 % v placebo skupine. Nepreukázala sa superiorita 120 mg dávky voči 60 mg dávke (34).
Mimoriadne zaujímavé výsledky priniesla randomizovaná, dvojito-zaslepená, placebom kontrolovaná štúdia s gangliozidom GM1 (monosialotetrahexosylgangliozid) u pacientok s karcinómom prsníka, ktorej výsledky boli publikované v januári 2020. GM1 ovplyvňuje mechanizmy plasticity a opravy neurónov a funguje ako neuroprotektívny faktor. Pre svoju rolu v reparačných mechanizmoch je GM1 súčasťou mnohých výskumov v oblasti neurodegeneratívnych ochorení. Do štúdie pod vedením Su et al. bolo zaradených 206 pacientok s karcinómom prsníka vo včasnom štádiu, u ktorých bolo v pláne podávanie chemoterapie na báze taxánov s follow -upom v trvaní viac ako jedného roka.
Pacientky boli randomizované do 2 skupín, kde dostávali buď GM1 alebo placebo. Primárnym cieľom bolo vyhodnotenie stavu pacientok po 4 cykloch chemoterapie podľa skórovacieho systému FACT -Ntx (Functional Assessment of Cancer Treatment), v podškále neurotoxicity. Sekundárny cieľ predstavoval vyhodnotenie neurotoxicity podľa systémov NCI -CTAE v4.0 a ECOG. V závere mala podľa hodnotiaceho systému FACT -Ntx skupina s GM1 lepšie výsledky ako skupina s placebom (P <.001). Podľa hodnotenia systému NCI -CTAE v4.0 mala periférna neurotoxicita grade 1 alebo vyššia štatisticky signifikantne nižší výskyt v skupine s GM1 (14,3% vs. 100,0 %, P <.001). Okrem toho bol v skupine s GM1 pozorovaný nižší výskyt neurotoxicity grade 1 a vyššej aj podľa skórovacieho systému ECOG v podškále so senzorickou neuropatiou (26,4 % vs. 97,8 %, P <.001) a taktiež aj v podškále s motorickou neuropatiou (20,9 % vs 81,5 %, P <.001). Liečba pomocou GM1 teda viedla k zníženiu závažnosti TIPN po 4 cykloch chemoterapie na báze taxánov u pacientok s karcinómom prsníka (35).
Z nefarmakologických prístupov by sa v prevencii a liečbe TIPN mohlo ukázať ako účinné pravidelné cvičenie. Hoci v doteraz prebehnutých štúdiách je úroveň dôkazov nízka, nové údaje by mohli byť prínosné (36). Autori Stevinson et al. ukázali na súbore 259 pacientok s karcinómom ovária, že pacientky, ktoré po prekonaní ochorenia dodržiavali režim pravidelnej pohybovej aktivity, udávali priaznivejšie výsledky týkajúce sa periférnej polyneuropatie, únavy, spánku a psychosociálnej kvality života (37).
Zaujímavými boli tiež výsledky recentnej pilotnej štúdie z roku 2019 publikovanej v Journal of Clinical Oncology, kde v skupine 71 pacientov, ktorí dostávali neurotoxickú chemoterapiu, aplikovali štandardizovanú švédsku masážnu techniku na dolné končatiny. Pokles počtu pacientov s dlhodobou CIPN až do 6 týždňov po skončení terapie bol pozorovaný v skupine s intenzívnejším režimom (3 masáže za týždeň v trvaní jedného mesiaca). Na potvrdenie úlohy a efektivity onkologickej masáže pri CIPN bude nutná ešte ďalšia, rozsiahlejšia štúdia (38).
Ako v prevencii, tak aj v liečbe TIPN je potrebný ďalší rozsiahly výskum na väčších súboroch pacientov, s dlhodobým follow -upom a štandardizovaným vyhodnocovaním výsledkov. Na výročnom stretnutí Multinational Association of Supportive care in Cancer/Internation Society of Oral Oncology (MASCC/ISOO) v roku 2019 Dr. Loprinzi diskutoval o nových, na mechanizme pôsobenia založených prístupoch k liečbe (39). Ako príklad možno uviesť liečivá namierené na organické anión-transportujúce polypeptidy (organic anion transporting polypeptides, OATPs), ktoré sú využívané taxánmi na prestup cez bunkovú membránu. Organické polypeptidy transportujúce anión sú utilizované taxánmi. Preklinické štúdie ukázali, že transportom sprostredkované vychytávanie chemoterapie do dorzálnych koreňových ganglií spôsobuje senzorické poškodenie neurónov. U myší genetické alebo farmakologické vyradenie OATP1B2 v dorzálnych gangliách chránilo pred periférnou neuropatiou vyvolanou paklitaxelom, oxaliplatinou a vinkristínom. Skríning dostupných liečiv, ktoré by mohli u človeka blokovať tieto transportéry ukázal, že sú nimi niektoré inhibítory tyrozínkináz. V súčasnosti prebieha intervenčná štúdia fázy Ib/II, ktorá hodnotí účinok nilotinibu u pacientok s karcinómom prsníka na liečbe paklitaxelom (40).
Záver
TIPN býva u mnohých onkologických pacientov závažným, neraz aj chronickým problémom, ktorý vedie k zníženej kvalite, príp. ohrozeniu života s rizikom poranení a pádov. V ostatnom období prešla problematika TIPN viacerými zmenami.Výrazný pokrok sa dosiahol v poznaní patogenetických mechanizmov pôsobenia taxánov na nervový systém. Detailnejšie preštudované sú najmä rizikové faktory TIPN a genetické polymorfizmy, ktoré sa na vzniku tohto ochorenia po liečbe taxánmi môžu podieľať. Avšak tieto poznatky sú v súčasnosti ešte stále limitované na to, aby sa implementovali do rutinnej klinickej praxe a v tejto oblasti prebieha ďalší výskum. Je zrejmé, že u pacienta s predispozíciou k TIPN je potrebné starostlivo zvážiť nutnosť indikácie neurotoxickej chemoterapie a prípadne selektovať menej toxický režim. So zvyšovaním sa počtu pacientov v dlhodobej kompletnej remisii sa nastolila otázka ako optimálne manažovať perzistujúce následky polyneuropatie. S pribúdajúcim počtom preživších onkologických pacientov a s predlžovaním ich života sa čoraz väčšia pozornosť venuje nielen prechodnej, ale aj perzistujúcej TIPN, ktorá môže sprevádzať pacienta aj niekoľko rokov. Spôsob, ako optimálne manažovať prechodnú aj dlhodobú neurotoxicitu taxánov je predmetom viacerých štúdií. Dnes máme k dispozícii viaceré navrhované farmakologické aj nefarmakologické postupy, ktoré v mnohých klinických štúdiách potvrdili zmiernenie symptómov TIPN. Z doteraz skúšaných preparátov sa podľa medicíny založenej na dôkazoch za najvhodnejší považuje duloxetín. Z hľadiska nastolenia stratégií a vhodných dizajnov štúdií, ktoré sa budú venovať prevencii a liečbe TIPN je nutné ďalšie upresnenie prediktívnych biomarkerov. Aj keď niektoré z predklinických štúdií na animálnych modeloch vyzerali sľubne, doteraz sa iba niekoľko poznatkov z nich prenieslo do klinického skúšania. Veríme, že predkladaný článok prispeje k lepšej orientácii v tejto stále aktuálnej a komplexnej problematike, s ktorou sa stretávajú nielen onkológovia, neurológovia, algeziológovia, ale aj internisti.
Publikácia vznikla s čiastočnou podporou grantu M SR VEGA 01/0610/18.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Magdaléna Jablonická
Onkologická klinika SZU, FNsP
F. D. Roosevelta,
Banská Bystrica
Cit. zkr: Vnitř Lék 2021; 67(1): e26–e31
Článek přijat redakcí: 27. 4. 2020
Článek přijat po recenzích k publikaci: 10. 1. 2021
Zdroje
1. Rowinsky EK. The development and clinical utility of the taxane class of antimicrotubule chemotherapy agents. Annu. Rev. Med. 1997; 48 : 353–374. Dostupné z DOI: .
2. Gelderblom H, Verveij J, Nooter K, et al. The drawbacks and advantages of vehicle selection for drug formulation. Eur J Cancer. 2001; 37 : 1590–1598. Dostupné z DOI: .
3. Barilla R, Šálek T. Nanopartikulové technológie, nab-paklitaxel a nové možnosti v liečbe vybraných nádorových chorôb. Onkológia (Bratisl.), 2014; 9(4): 253–256.
4. Adam Z, Vorlíček J, Sedláčková Š. Přehled protinádorové farmakologické léčby. Praktické Lékárenství 2005; 2 : 76–80
5. Rivera E, Cianfrocca M. Overview of neuropathy associated with taxanes for the treatment of metastatic breast cancer. Cancer Chemother. Pharmacol. 2015; 75 : 659–670. Dostupné z DOI: .
6. Huang TC, Campbell TC. Comparison of weekly versus every 3 weeks paclitaxel in the treatment of advanced solid tumors: a meta -analysis. Cancer Treat Rev. 2012; 38 (6): 613 – 617. Dostupné z DOI: .
7. Rivera E, Mejia JA, Arun BK, Adinin RB, Walters RS, Brewster A, Broglio KR, Yin G, Esmaeli B, Hortobagyi GN, Valero V. Phase 3 study comparing the use of docetaxel on an every-3-week versus weekly schedule in the treatment of metastatic breast cancer. Cancer. 2008; 112 : 1455–1461.Dostupné z DOI: .
8. Jones SE, Erban J, Overmoyer B, Budd GT, Hutchins L, Lower E, Laufman L, Sundaram S, Urba WJ, Pritchard KI, Mennel R, Richards D, Olsen S, Meyers ML, Ravdin PM. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer. J Clin Oncol. 2005; 23 : 5542–5551. Dostupné z DOI: .
9. Hagiwara H, Sunada Y. Mechanism of taxane neurotoxicity. Breast Cancer. 2004; 11(1): 82–85. Dostupné z DOI: .
10. Cavaletti G, Cavalletti E, Montaguti P, Oggioni N, de Negri O, Tredici G. Effect on the peripheral nervous system of the short -term intravenous administration of paclitaxel in the rat. Neurotoxicology 1997; 18 : 137–145.
11. Addington J, Freimer M. Chemotherapy -induced peripheral neuropathy: an update on the current understanding. F1000Res. 2016; 5. pii: F1000 Faculty Rev-1466. Dostupné z DOI: .
12. Loprinzi, CL, Reeves BN, Dakhil SR, Sloan JA, Wolf SL, Burger KN, Kamal A, Le -Lindqwister NA, Soori GS, Jaslowski AJ et al. Natural history of paclitaxel -associated acute pain syndrome: Prospective cohort study NCCTG N08C1. J. Clin. Oncol. 2011; 29 : 1472–1478. Dostupné z DOI: .
13. Tofthagen C, McAllister RD, Visovsky C. Peripheral neuropathy caused by paclitaxel and docetaxel: An evaluation and comparison of symptoms. J. Adv. Pract. Oncol. 2013; 4 : 204–215.
14. Jerian SM, Sarosy GA, Link CJ, Fingert HJ, Reed E, Kohn EC. Incapacitating autonomic neuropathy precipitated by taxol. Gynecol. Oncol. 1993; 51 : 277–280. Dostupné z DOI: .
15. Hershman DL, Weimer LH, Wang A, Kranwinkel G, Brafman L, Fuentes D, Awad D, Crew KD. Association between patient reported outcomes and quantitative sensory tests for measuring long -term neurotoxicity in breast cancer survivors treated with adjuvant paclitaxel chemotherapy. Breast Cancer Res. Treat. 2011; 125 : 767–774. Dostupné z DOI: .
16. Stubblefield MD, Burstein HJ, Burton AW, Custodio CM, Deng GE, Ho M, Junck L, Morris GS, Paice JA, Tummala S, et al. NCCN task force report: Management of neuropathy in cancer. J. Natl. Compr. Cancer Netw. 2009; 7 (suppl. 5), S1–S26. Dostupné z DOI: .
17. Jones SE, Erban J, Overmoyer B, Budd GT, Hutchins L, Lower E, Laufman L, Sundaram, S, Urba WJ, Pritchard KI, et al. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer. J. Clin. Oncol. 2005; 23 : 5542–5551. Dostupné z DOI: .
18. Hershman DL, Till C, Wright JD, Awad D, Ramsey SD, Barlow WE, Minasian LM, Unger J. Comorbidities and Risk of Chemotherapy -Induced Peripheral Neuropathy Among Participants 65 Years or Older in Southwest Oncology Group Clinical Trials. J Clin Oncol. 2016; 34(25): 3014–3022. Dostupné z DOI: .
19. Hilkens PH, Verweij J, Vecht CJ, Stoter G, van den Bent MJ. Clinical characteristics of severe peripheral neuropathy induced by docetaxel (Taxotere). Ann. Oncol. 1997; 8 : 187 – 190. Dostupné z DOI: .
20. Lee JS, Cheong HS, Kim LH, Kim JO, Seo DW, Kim YH, Chung MW, Han SY, Shin HD: Screening of Genetic Polymorphisms of CYP3A4 and CYP3A5 Genes. 17(6): 479–484, 2013. Dostupné z DOI: .
21. Kus T, Aktasi G, Kalender ME, Demiryurek AT, Ulasli M, Oztuzcu S, Sevinc A, Kul A, Camci C: Polymorphism of CYP3A4 and ABCB1 genes increase the risk of neuropathy in breast cancer patients treated with paclitaxel and docetaxel. 9 : 5073–5080, 2016. Dostupné z DOI: .
22. Lam SW, Frederiks CN, Straaten T, Honkoop AH, Guchelaar HJ, Boven E: Genotypes of CYP2C8 and FGD4 and their association with peripheral neuropathy or early dose reduction in paclitaxel -treated breast cancer patients. British Journal of Cancer. 115 : 1335–1342, 2016. Dostupné z DOI: .
23. Baldwin RM, Owzar K, Zembztsu H, Chhibber A, Kubo M, Jiang C, Watson D, Eclov RJ, Mefford J, McLeod HL, Friedman PN, Hudis CA, Winer EP, Jorgensen EM, Witte JS, Shulman LN, Nakamura Y, Ratain MJ, Kroetz DL: A Genome -Wide Association Study Identifies Novel Loci for Paclitaxel -Induced Sensory Peripheral Neuropathy in CALGB 40101. 18(18): 5099 – 5109, 2012. Dostupné z DOI: .
24. Schloss JM, Colosimo M, Airey C, Masci PP, Linnane A.W., Vitetta L. Nutraceuticals and chemotherapy induced peripheral neuropathy (CIPN): a systematic review. Clin Nutr. 2013; 32(6): 888–893. doi: 10.1016/j.clnu.2013. 04. 007. Epub 2013 Apr 13. Dostupné z DOI: .
25. Hershman DL, Unger JM, Crew KD, Minasian LM, Awad D, Moinpour CM, Hansen L, Lew DL, Greenlee H, Fehrenbacher L, Wade JL 3rd, Wong SF, Hortobagyi GN, Meyskens FL, Albain KS. Randomized Double -Blind Placebo -Controlled Trial of Acetyl -L-Carnitine for the Prevention of Taxane -Induced Neuropathy in Women Undergoing Adjuvant Breast Cancer Therapy. J Clin Oncol. 2013; 31(20): 2627–2633. Dostupné z DOI: .
26. Sato J, Mori M, Nihei S, et al. The effectiveness of regional cooling for paclitaxel-induced peripheral neuropathy. J Pharm Health Care Sci. 2016; 2 : 33. DOI: .
27. Bednařík J, Ambler Z, Opavský J, Keller O, Rokyta R, Mazanec R, Lejčko J, Kozák J, Suchý M, Pátá M, Kožený M. Klinický standard pro farmakoterapii neuropatické bolesti. Cesk Slov Neurol N 2012; 75/108(1): 93–101.
28. Rao RD, Michalak JC, Sloan JA, Loprinzi CL, Soori GS, Nikcevich DA, Warner DO, Novotny P, Kutteh DA, Wong GY. Efficacy of gabapentin in the management of chemotherapy-induced peripheral neuropathy: a phase 3 randomized, double -blind, placebo -controlled, crossover trial (N00C3). Cancer. 2007 Nov 1; 110(9): 2110–2118. Dostupné z DOI: .
29. Smith EM, Pang H, Cirrincione C, Fleishman C, Paskett ED, Ahles T, Bressler LR, Fadul CE, Knox C, Le -Lindqwister N, Gilman PB, Shapiro CL. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy -induced painful peripheral neuropathy: a randomized clinical trial. JAMA. 2013; 309(13): 1359–1367. Dostupné z DOI: .
30. Kautio AL, Haanpää M, Saarto T, Kalso E. Amitriptyline in the treatment of chemotherapy-induced neuropathic symptoms. J Pain Symptom Manage. 2008; 35(1): 31–39. Epub 2007 Nov 5. Dostupné z DOI: .
31. Rao RD, Flynn PJ, Sloan JA, Wong GY, Novotny P, Johnson DB, Gross HM, Renno SI, Nashawaty M, Loprinzi CL (2008) Efficacy of lamotrigine in the management of chemotherapy-induced peripheral neuropathy: a phase 3 randomized, double -blind, placebo -controlled trial, N01C3. Cancer 112(12): 2802–2808. Dostupné z DOI: .
32. Fallon MT, Storey DJ, Krishan A, et al. Cancer treatment -related neuropathic pain: proof of concept study with menthol–a TRPM8 agonist. Support Care Cancer. 2015; 23 : 2769 – 2777. Dostupné z DOI: .
33. Barton DL, Wos EJ, Qin R, Mattar BI, Green NB, Lanier KS, Bearden JD 3rd, Kugler JW, Hoff KL, Reddy PS, Rowland KM Jr, Riepl M, Christensen B, Loprinzi CL. A double -blind, placebo-controlled trial of a topical treatment for chemotherapy -induced peripheral neuropathy: NCCTG trial N06CA. Support Care Cancer. 2011; 19(6): 833–841. Dostupné z DOI: .
34. Smith EM, Pang H, Cirrincione C, Fleishman S, Paskett ED, Ahles T, Bressler LR, Fadul CE, Knox C, Le -Lindqwister N, Gilman PB, Shapiro CL; Alliance for Clinical Trials in Oncology. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy -induced painful peripheral neuropathy: a randomized clinical trial. JAMA. 2013; 309(13): 1359–1367. Dostupné z DOI: .
35. Su Y, Huang J, Wang S, Unger JM, Arias -Fuenzalida J, Shi Y, Li J, Gao Y, Shi W, Wang X, Peng R, Xu F, An X, Xue C, Xia W, Hong R, Zhong Y, Lin Y, Huang H, Zhang A, Zhang L, Cai L, Zhang J, Yuan Z. The Effects of Ganglioside -Monosialic Acid in Taxane -Induced Peripheral Neurotoxicity in Patients with Breast Cancer: A Randomized Trial. J Natl Cancer Inst. 2020; 112(1): 55–62. Dostupné z DOI: .
36. White CM, Pritchard J, Turner -Stokes L. Exercise for people with peripheral neuropathy. Cochrane Database Syst Rev 2004; (4): CD003904. Dostupné z DOI: .
37. Stevinson C, Steed H, Faught W, Tonkin K, Vallance JK, Ladha AB, Schepansky A, Capstick V, Courneya KS. Physical activity in ovarian cancer survivors : associations with fatigue, sleep, and psychosocial functioning. Dostupné z DOI: .
38. Lopez D, Eng C, Overman MJ, Liu W, Cohen L, Ramirez DL, Beinhorn CM, Sumler PA, Chen M, Bruera E, Prinsloo S, Li Y. A pilot study of oncology massage to treat chemotherapy - -induced peripheral neuropathy (CIPN). Journal of Clinical Oncology 37,no. 15_suppl. Dostupné z DOI: .
39. Loprinzi C: Novel therapeutics for chemotherapy -induced neuropathy. 2019 MASCC/ ISOO International Symposium on Supportive Care in Cancer. Abstract eP720. Presented June 21, 2019. 40. https://clinicaltrials.gov/ct2/show/NCT04205903
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Internista a pacient po ischemické CMP
- Následná péče po prodělaném covidu-19 a její úskalí
- Horečka nejasného původu
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kdy ukončit léčbu hepatitidy B?
- Kompetence pacienta a informovaný souhlas
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Je autoimunitní pankreatitida rizikovým faktorem adenokarcinomu pankreatu?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



