-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Srdcové zlyhávanie ako prejav akromegálie
Heart failure as a manifestation of acromegaly
Acromegaly is a rare disease with incidence of 3–4 patients per 1 000000 per year, which is mainly caused by benign tumour of the pituitary gland. Long-term presence of elevated growth hormone (GH) and insulin like growth factor 1 (IGF-1) levels accompanying this disease is associated with rheumatologic, cardiovascular, pulmonary and metabolic complications. Cardiovascular complications of acromegaly include a cardiomyopathy, arterial hypertension, arrhytmias, valvulopathy as well as endothelial dysfunction. Cardiovascular diseases are the leading cause of mortality in patients with acromegaly. An early diagnosis of acromegaly significantly influences both morbidity and mortality of patients suffering from this disease. We describe a 39-year-old patient with undiagnosed acromegaly presented with acute heart failure caused by acromegalic cardiomyopathy.
Keywords:
cardiomyopathy – acromegaly – v growth hormone – heart failure
Autoři: Ivana Ságová 1; Milan Dragula 2; Daniela Kantárová 2; Anton Vaňuga 1,3; Peter Vaňuga 1
Působiště autorů: Endokrinologické oddelenie, Národný endokrinologický a diabetologický ústav Ľubochňa, Slovenská republika 1; II. interná klinika JLF UK a UN Martin, Slovenská republika 2; Alphamedical, s. r. o., Slovenská republika 3
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 82-86
Kategorie: Kazuistika
Souhrn
Akromegália je zriedkavé ochorenie s ročnou incidenciou 3–4/1 milión obyvateľov, ktorého najčastejšou príčinou je adenóm hypofýzy. V dôsledku dlhodobej elevácie rastového hormónu (RH) a inzulínu podobného rastového faktora 1 (IGF1) pri tomto ochorení dochádza k rozvoju reumatologických, kardiovaskulárnych, pľúcnych a metabolických komplikácií. Medzi kardiovaskulárne komplikácie akromegálie patrí kardiomyopatia, artériová hypertenzia, poruchy srdcového rytmu, chlopňové chyby ako aj endotelová dysfunkcia. Kardiovaskulárne ochorenia predstavujú u akromegalikov hlavnú príčinu mortality. Včasná diagnostika akromegálie je jedinou možnosťou v ovplyvnení morbidity a mortality pacientov trpiacich týmto ochorením. V našej kazuistike popisujeme prípad 39-ročného pacienta s dovtedy nediagnostikovanou akromegáliou, ktorá sa prezentovala akútnym srdcovým zlyhávaním na podklade akromegalickej kardiomyopatie.
Klíčová slova:
akromegália – kardiomyopatia – rastový hormón – srdcové zlyhávanie
Úvod
Akromegália je zriedkavé ochorenie vznikajúce v 99 % na podklade adenómu hypofýzy. Ochorenie je charakterizované nadmernou sekréciou IGF-1 vyvolanou nadprodukciou rastového hormónu (1). Medzi najčastejšie príznaky a symptómy akromegálie patrí zvýšené potenie, parestézie, dysmorfia (prominujúca mandibula, zhrubnutie pier a nosa, makroglosia, rozostup zubov, zhrubnutie hlasu), artralgie, cefalea, slabosť a syndróm karpálneho tunela. Pacienti mávajú často sprievodné ochorenia ako artériovú hypertenziu, porušenú glukózovú toleranciu prípadne diabetes mellitus, syndróm spánkového apnoe a polypózu hrubého čreva (1). Akromegalická kardiomyopatia je charakterizovaná špecifickými štrukturálnymi zmenami s hypertrofiou myocytov, intersticiálnou fibrózou komôr ako aj funkčnými zmenami, a to diastolickou dysfunkciou, po ktorej nasleduje systolická dysfunkcia vedúca ku kongestívnemu srdcovému zlyhávaniu. Kardiomyopatia u akromegálie sa vyvíja v 3 fázach. V počiatočnom štádiu je prítomná zvýšená kontraktilita myokardu, znížená periférna vaskulárna rezistencia a zvýšený srdcový výdaj. Prechodná fáza je charakterizovaná srdcovou hypertrofiou. Dochádza pri nej k proliferácii fibrózneho tkaniva myokardu v dôsledku zápalovej reakcie, čo vedie k progresívnej intersticiálnej prestavbe a zhoršovaniu diastolickej a systolickej funkcie srdca. Neskoré štádium akromegalickej kardiomyopatie sa vyznačuje dilatáciou srdcových komôr s ťažkou systolickou a diastolickou dysfunkciou, s kompenzačným zvýšením periférnej vaskulárnej rezistencie, ktorá v konečnom dôsledku vedie k kongestívnemu srdcovému zlyhávaniu (2, 3). Valvulopatia je pri akromegalickej kardiomyopatii bežná, v čase diagnostiky postihuje 75 % pacientov (4). V dôsledku degenerácie interstícia chlopňového tkaniva vzniká aortálna a mitrálna insuficiencia (5). Tento stav sa označuje ako myxomatózna valvulopatia. Chlopňové chyby sú o to dôležitejšie, že perzistujú aj po úspešnej liečbe, na rozdiel od zmien na myokarde, ktoré minimálne do určitej miery regredujú (5). Akromegalickú kardiomyopatiu často sprevádzajú aj artymie. Táto komplikácia je dôsledkom intersticiálnej fibrózy, myofibrilárnej poruchy a srdcovej hypertrofie vedúcim k anatomickým zmenám v kardiomyocytoch a tým k abnormalitám v prevodom systéme myokardu (6, 7). Arytmie sú prítomné až u 89 % pacientov s akromegáliou, medzi najčastejšie patria supraventrikulárne a ventrikulárne extrasystoly, paroxyzmálna supraventrikulárna tachykardia, paroxyzmálna fibrilácia predsiení, blokády ramienok, sicksinus syndróm a v extrémných prípadoch aj komorová tachykardia (4, 8). Medzi najdôležitejšie negatívne prognostické faktory u pacientov s akromegáliou patrí artériová hypertenzia (AH). Nadprodukcia RH vedie k inzulínovej rezistencii, stimulácií rastu hladkej svaloviny a tým k zvýšeniu vaskulárnej rezistencie s rozvojom AH. V patomechanizme AH sa uplatňuje aj vplyv RH na zvýšenú resorbciu sodíka s následnou zvýšenou retenciou tekutín (9).Trvanie hormonálne aktívnej akromegálie má pri rozvoji akromegalickej kardiomyopatie rozhodujúcu úlohu, nakoľko koreluje s prevalenciou artériovej hypertenzie (10), diabetes mellitus (11) a srdcových komplikácií vrátane valvulopatií (12), arytmií (13, 14), diastolickej a systolickej dysfunkcie (10), čo naznačuje potenciálny kumulatívny účinok dlhodobého nadbytku RH.
Kazuistika
Uvádzame prípad 39-ročného muža (narodený v roku 1979) s dlhodobou anamnézou artériovej hypertenzie a exogénnou obezitou, prijatého na interné oddelenie pre akútne srdcové zlyhávanie. Pacient bez predchorobia vírusového ochorenia, nefajčiar, abstinent. Subjektívne pri príjme prítomné kľudové dyspnoe (anamnesticky námahové dyspnoe v trvaní 3 mesiace, poslednú noc pred hospitalizáciou kľudové dyspnoe a intolerancia horizontálnej polohy), bez bolestí na hrudníku a palpitácií, udáva zvýšené potenie v trvaní asi 1 roku. Objektívne (telesná výška:193 cm, telesná hmotnosť: 150 kg, BMI: 40,5 kg/m2, TK: 140/95 mm Hg) prítomné akromegaloidné črty (zvýraznené nadočnicové oblúky, mierne prominujúca mandibula, rozostup zubov a zväčšený nos), auskultačne prítomné bilaterálne do 1/2 pľúc neprízvučné chropky, srdcové ozvy boli ohraničené, bez šelestu, dolné končatiny s perimaleolárnymi edémami. Na EKG prítomný sínusový rytmus s frekvenciou 66/min, bez prítomnosti čerstvých ischemických zmien. RTG hrudníka s nálezom rozšíreného srdcového tieňa s akcentovanou bronchovaskulárnou kresbou až škvrnitého vzhľadu s maximom perihilózne a parakardiálne vpravo. V úvode hospitalizácie bola nasadená komplexná liečba srdcového zlyhávania. Realizované echokardiografické vyšetrenie s nálezom dilatácie srdcových oddielov, hypertrofie interventrikulárneho septa (IVS 17 mm), s difúznou poruchou kinetiky stien ľavej komory (ĽK) s významne redukovanou ejekčnou frakciou (EF) 22 %, reštrikčný typ plnenia ĽK, bez významnej chlopňovej chyby (Obr. 1). Koronarograficky bez nálezu hemodynamicky významných stenóz na epikardiálnych srdcových tepnách. Laboratórne zápalové parametre boli v norme. Úvodne bol stav hodnotený ako akútne srdcové zlyhávanie pri zanedbanej artériovej hypertenzii, event. bola zvažovaná diagnóza hypertrofickej kardiomyopatie. Na komplexnej liečbe došlo u pacienta k zlepšeniu klinického stavu (pri demitácií funkčne v štádiu NYHA II). Počas hospitalizácie na internom oddelení bez záchytu závažnejších porúch rytmu. Pre suspektnú akromegáliu bol následne pacient prijatý na endokrinologické oddelenie Národného endokrinologického ústavu v Ľubochni, kde boli realizované laboratórne vyšetrenia so záchytom zvýšenej hladiny rastového hormónu, inzulínu podobného rastového faktora 1 (IGF-1) a IGF viažúceho proteínu 3 (IGFBP3) (Tab. 1). Doplnený orálno -glukózový tolerančný test s RH bez adekvátnej supresibility (Tab. 2). Na základe uvedeného bola potvrdená diagnóza akromegálie. Realizované USG abdomenu s nálezom hepatomegálie a denzitometrické vyšetrenie s kostnou denzitou v norme pre daný vek a pohlavie. Následne realizované MR hypofýzy s nálezom ložiskového zväčšenia adenohypofýzy vs. makroadenómu hypofýzy (Obr. 2 a 3). Hypofýza – veľkosti 14 × 14 × 12 mm, konvexného až naznačeného bikonvexného tvaru pre prominenciu kraniálneho okraja do supraselárnej oblasti, zväčšená adenohypofýza rozširuje turecké sedlo. V T1WI aj v T2WI je celá hypofýza homogénne izosignálna, vo ventrálnej časti adenohypofýzy je drobný vaskulárny okrsok priemeru 3 mm, infundibulum bez deviácie, chiazma opticum je nerozšírená. Postkontrastne sa celá adenohypofýza už v arteriálnej fáze nehomogénne stredne intenzívne vysycuje. Vzdialenosť zrakovej dráhy od makroadenómu hypofýzy je 0,5 mm. Doplnený bol perimeter bez výpadku v zornom poli. U pacienta bola v súčasnosti zahájená liečba somatostatínovými analógmi (SSA) lanreotid v dávke 120 mg každých 28 dní. Od transfenoidálneho operačného riešenia makroadenómu hypofýzy bolo vzhľadom ku kardiálnemu nálezu t.č. upustené. Z endokrinologického hľadiska je v prípade nedostatočného efektu SSA na aktivitu ochorenia ako aj vplyvu na kardiomyopatiu v pláne pridanie Pegvisomantu do liečby. Z kardiologického hľadiska je v pláne doplnenie MR srdca za účelom rozšírenia diferenciálnej diagnostiky a následne v prípade neúspechu liečby akromegálie implantácia kardioverter -defibrilátora (ICD) s konzultáciou transplantačného centra.
Obr. 1. Echokardiogram 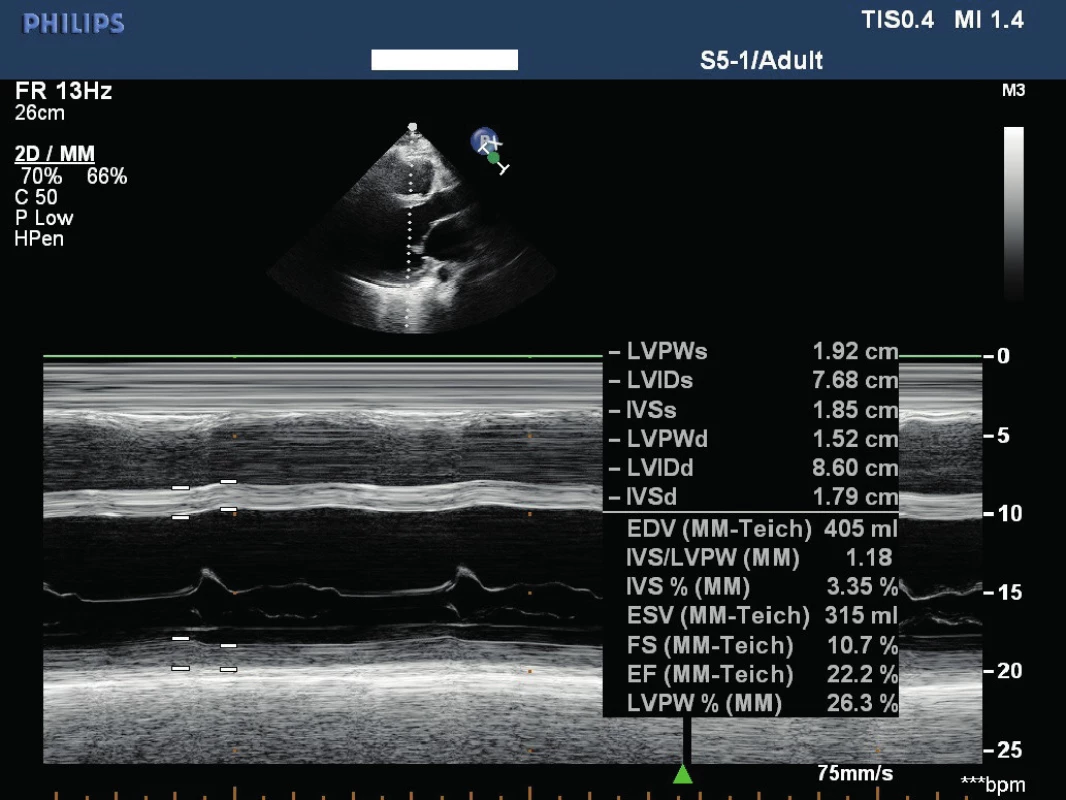
LVPWs – hrúbky zadnej steny ĽK v end systole, LVIDs – rozmer dutiny ľavej komory v systole, IVSs – hrúbka interventrikulárneho septa v systole, LVPWd – hrúbky zadnej steny ĽK v end diastole, LVIDd – rozmer dutiny ľavej komory v diastole, IVSd – hrúbka interventrikulárneho septa v diastole, EDV – koncový diastolický objem, ESV – koncový systolický objem, FS – frakčné skrátenie, EF – ejekčná frakcia Obr. 2. MR hypofýzy T2 tse HIRes v koronárnej rovine 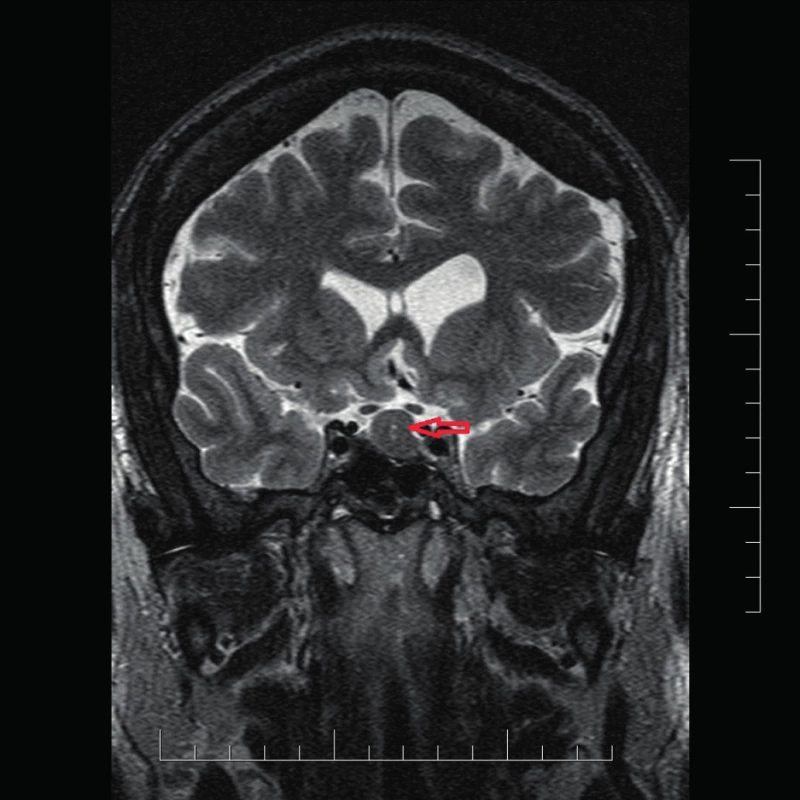
Červená šípka označuje adenóm hypofýzy Obr. 3. MR hypofýzy: (a) T1VO mpr v sagitálnej rovine, (b) T2 VO tse v transverzálej rovine, (c) FLAIR tra v transverzálej rovine, (d) T1VO mpr v sagitálnej rovine postkontrastne 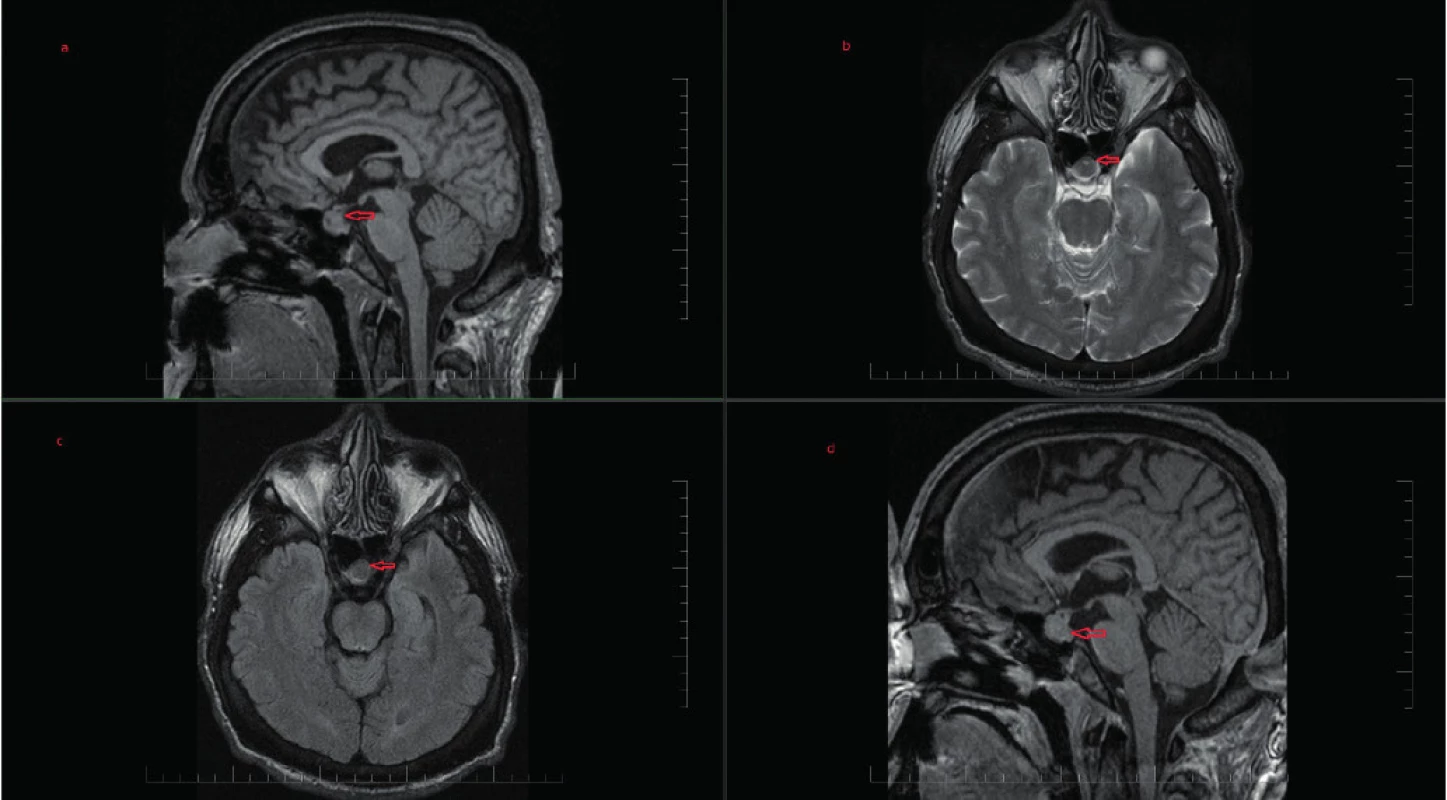
Červená šípka označuje adenóm hypofýzy Tab. 1. Výsledky laboratórnych vyšetrení 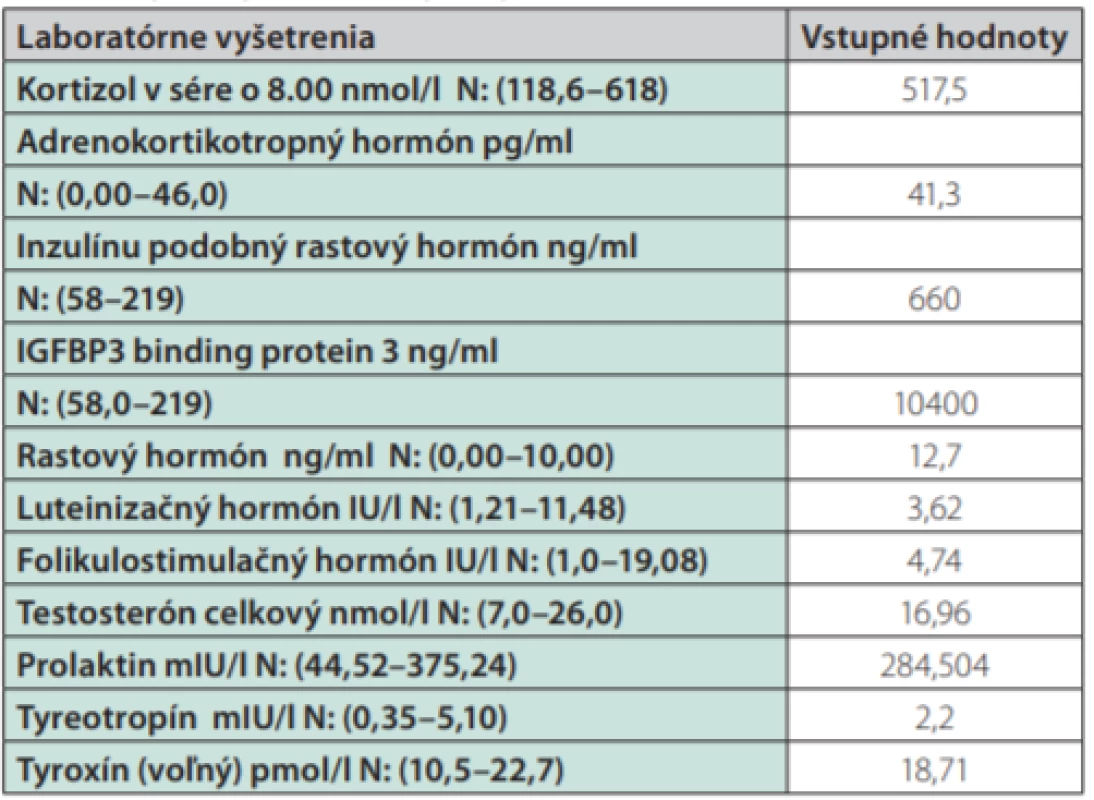
Tab. 2. Výsledok oGTT s RH (po 75 g glukózy p.o.) 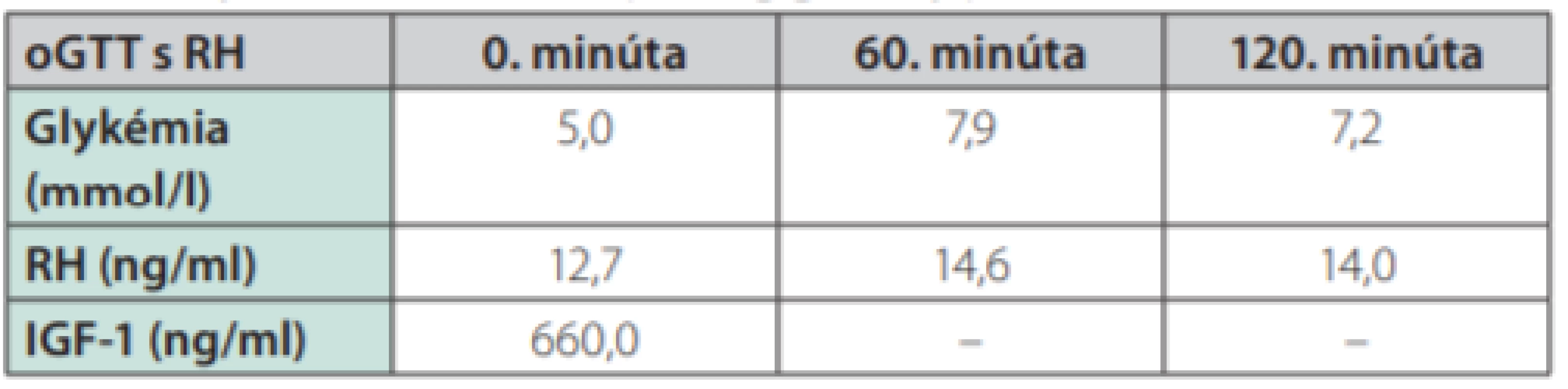
Diskusia
Akromegália je ochorenie, ktoré je asociované s typickou kardiomyopatiou charakterizovanou biventrikulárnou hypertrofiou. Artériová hypertenzia, valvulopatie, arytmie a endoteliálna dysfunkcia predstavujú u akromegálie ďalšie relevantné kardiovaskulárne komplikácie, ktoré spolu s respiračnými a metabolickými komplikáciami prispievajú k rozvoju ochorenia srdca a zvýšeniu kardiovaskulárneho rizika. Pre úplnosť uvádzame ďalšie možné príčiny kardiomyopatií (Tab. 3). V patogenéze akromegalickej kardiomyopatie sa uplatňuje priamy účinok nadbytku RH a IGF-1 na srdce ako aj nepriame mechanizmy, ktorými nadbytok RH a IGF-1 vedie k vzniku artériovej hypertenzie, poruche metabolizmu glukózy a lipidov, čoho výsledkom je srdcová glukotoxicita a lipotoxicita, s následnou srdcovou remodeláciou a hypertrofiou (15,16). RH/IGF-1 ovplyvňuje 3 hlavné aspekty kardiovaskulárneho systému: rast a štruktúru myocytov, kontraktilitu srdca a vaskulárnu funkciu. Hlavné procesy ovplyvňujúce rast myocytov sú zvýšenie absorpcie aminokyselín/syntéza proteínov, zväčšenie veľkosti kardiomyocytu a zvýšenie expresie génov srdcového svalu. Nadmerná expresia IGF-1 nezávisle zvyšuje transkripciu hlavných génov špecifických pre srdcové svaly vrátane troponínu, ľahkého reťazca myozínu, α -aktínu a IGF-1 viažuceho proteínu, čo vedie k fibróze myokardu (17). Okrem iného IGF-1 podporuje aj samotnú syntézu kolagénu fibroblastmi, zatiaľ čo RH zvyšuje rýchlosť ukladania srdcového kolagénu (17). Dochádza k intersticiálnej remodelácii, zhoršuje sa komorová relaxácia, čo má za následok počiatočnú diastolickú dysfunkciu a následnú systolickú dysfunkciu. U menej ako 3 % pacientov sa akromegalická kardiomyopatia v neskorších štádiách prejaví ako kongestívne srdcové zlyhávanie (18). Efektívna liečba akromegálie má významný vplyv na zlepšenie kardiovaskulárneho ochorenia s možnosťou zotavenia do normálu a to hlavne u mladých pacientov s krátkou dobou trvania ochorenia (18). U akromegalikov, u ktorých dôjde k vzniku srdcového zlyhania na podklade dilatácie srdca, je možné krátkodobé zlepšenie vplyvom liečby, avšak dlhodobá prognóza je horšia ako u pacientov so srdcovým zlyhaním z iných príčin. Pri liečbe adenómov produkujúcich RH je prvolíniovou terapiou transsfenoidálna chirurgia. Kurabilný efekt transfénoidálnej chirurgie u akromegalikov je 85–90 % pri mikroadenómoch a 65 % pri makroadenómoch hypofýzy (19). Na Slovensku a v Českej republike sú podľa údajov z registra sellárnych tumorov (RESET) výsledky horšie. U 81 % celkovo operovaných pacientov bola normalizácia hladín IGF-1 po 3 mesiacoch prítomná v 54,5 % u mikroadenómov a v 42,4 % u makroadenómov (20). Úspešná chirurgická liečba u akromegálie významne zlepšuje artériovú hypertenziu, srdcovú hypertrofiu, diastolickú a systolickú dysfunkciu (21) ako aj dysfunkciu endotelu (22). Z medikamentóznej liečby sú pre pacientov s akromegáliou prvou líniou somatostatínové analógy (SSA). Ich predoperačné podávanie môže zvýšiť úspešnosť samotného chirurgického zákroku (23). Liečba SSA je doporučená ako primárna u pacientov s kontraindikáciou chirurgického výkonu (24). Efekt liečby SSA na normalizáciu hladín RH a IGF-1 sa značne líši medzi jednotlivými štúdiami v rozmedzí 20–70 % (25). V nedávnej metaanalýze bol publikovaný účinok SSA na normalizáciu hladín RH u 55 % liečených pacientov a na normalizáciu hladín IGF-1 u 56 % liečených pacientov, bez významného rozdielu medzi jednotlivými typmi SSA (26). Pri liečbe SSA dochádza vplyvom normalizácie hladiny hormónov k pomerne rýchlej redukcii hypertrofie ĽK (27–29) ako aj zlepšeniu diastolickej a systolickej funkcie (30). Štúdie preukázali závislosť redukcie hypertrofie ĽK ako aj zlepšenia systolickej a diastolickej dysfunkcie nielen od vplyvu normalizácie hormonálneho statusu, ale aj od veku pacienta (21, 31), trvania ochorenia (27, 31) a kontroly metabolických komorbidít (27). Dosiahnutie kontroly ochorenia vplyvom 12 mesačnej liečby SSA viedlo k normalizácií hmotnosti ĽK u 100 % mladých pacientov a 50 % pacientov v strednom veku a k zlepšeniu EF došlo u 80 % mladých pacientov a 50 % pacientov v strednom veku (27). Chirurgická liečba alebo 12-mesačná prvolíniová liečba SSA mali porovnateľný vplyv na zlepšenie hypertrofie ĽK a diastolickej funkcie, zatiaľ čo zlepšenie systolickej funkcie bolo významnejšie u pacientov liečených SSA v porovnaní s pacientmi liečenými chirurgicky (21). 5-ročná prvolíniová liečba SSA viedla k významnému zníženiu prevalencie artériovej hypertenzie, hypertrofie ĽK, diastolickej a systolickej dysfunkcie, prevalencie arytmií, dyslipidémie a miernemu poklesu v prevalencii porúch metabolizmu glukózy (28, 32). Ďalšou možnosťou liečby u pacientov rezistentných alebo slabo reagujúcich na liečbu SSA je antagonista receptora pre rastový hormón pegvisomant (PEG). V pilotných štúdiách bola dosiahnutá normalizácia hladín IGF-1 až u 95 % pacientov užívajúcich pegvisomant v dávke 40 mg denne (33, 34). Pegvisomant zlepšuje citlivosť na inzulín a dlhodobé sledovanie ukázalo významné zníženie hladiny glukózy nalačno, čím pôsobí protektívne na rozvoj diabetes mellitus (35). Liečba pegvisomantom vedie k zníženiu krvného tlaku u pacientov s artériovou hypertenziou (36), redukcii arytmií (37) a k zlepšeniu vaskulárnej endotelovej dysfunkcie (38). Dlhodobá monoterapia PEG preukázala zlepšenie akromegalickej kardiomyopatie a to zmenšením srdcovej hypertrofie, znížením diastolického tlaku a zlepšením systolickej funkcie (39). Kuhn et al vo svojej štúdií potvrdili významne zlepšenie ejekčnej frakcie ĽK u pacientov, ktorých východisková EF bola ≤ 60 % pri dlhodobej liečbe pegvisomantom (viac ako 10 rokov). Taktiež u pacientov s vysokým hmotnostným indexom ĽK preukázali okrem významného zlepšenia EF aj zníženie hmotnostného indexu ĽK (40). Agonisti dopamínu (DA) majú v liečbe akromegálie doplnkový účinok, najmä pri súčasnej sekrécií prolaktínu. Dlhodobá kombinovaná liečba SSA a pegvisomantom u pacientov s akromegalickou kardiomyopatiou viedla k zlepšeniu EF ĽK, k zmenšeniu hypertrofie a zníženiu diastolickej dysfunkcie (41). Na posúdenie vplyvu rádioterapie na kardiovaskulárny systém u pacientov s akromegáliou nie je doposiaľ realizované dostatočné množstvo štúdií. Môže to byť spôsobené oneskoreným efektom liečby ako aj sprievodným rizikom hypopituarizmu, ktoré neumožňuje spoľahlivú analýzu jeho priaznivých vplyvov na kardiovaskulárne riziko (42). Medikamentózna liečba srdcového zlyhávania na podklade akromegalickej kardiomyopatie sa v podstate nelíší od liečby srdcového zlyhávania z iných príčín. Pozostáva z inhibítorov angiotenzín konvertujúceho enzýmu (ACEi), prípadne blokátorov angiotenzínových receptorov (ARB), betablokátorov, diuretík a event. antagonistov aldosterónových receptorov. Inhibítory angiotenzín konvertujúceho enzýmu (ACEi) a β -adrenergní antagonisti špecificky priaznivo ovplyvňujú fibrotickú remodeláciu srdca (43). Nedávna predbežná štúdia preukázala pozitívny efekt liečby ACEi/ARB na konečné diastolické a endsystolické objemy u akromegalikov (44). Závažnejšie srdcové zlyhávanie si môže vyžadovať inotropné látky, parenterálne diuretiká, angiotensin receptor -neprilysin inhibítor, alebo srdcovú resynchronizačnú terapiu, hoci použitie týchto intervencií sa pri zlyhávaní srdca na podklade akromegalickej kardiomyopatie dostatočne neskúmalo. Dlhodobá prognóza srdcového zlyhávania na podklade kardiomyopatie u pacientov s akromegáliou zostáva nepriaznivá; úmrtnosť je približne u 25 % po 1 roku a viac ako 35 % po 5 rokoch (45).
Tab. 3. Príčiny kardiomyopatie a asociované ochorenia (46) 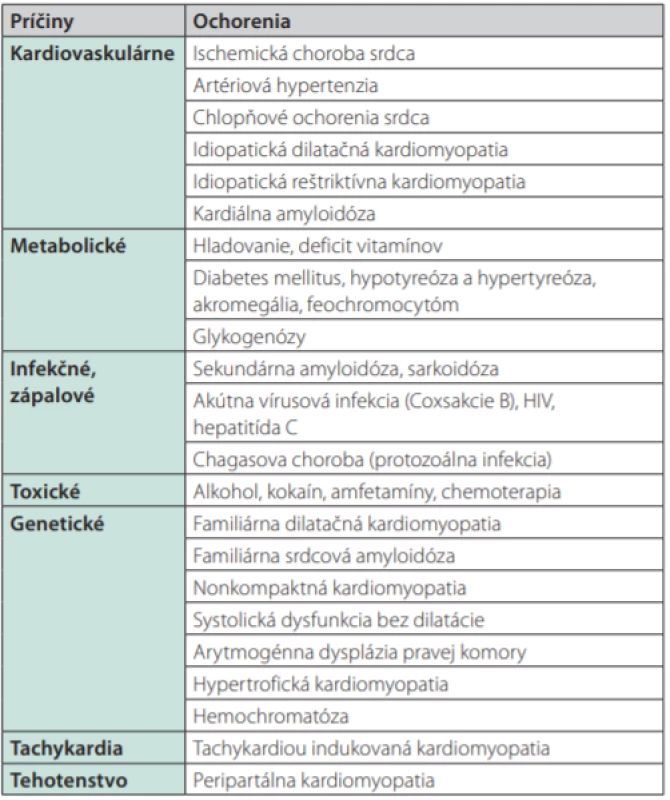
Záver
Kardiovaskulárne ochorenia predstavujú hlavnú príčinu mortality u akromegalikov. V rámci diferenciálnej diagnostiky srdcového zlyhávania na podklade kardiomyopatie netreba zabúdať aj na možnú endokrinnú príčinu a to nielen na poruchu funkcie štítnej žľazy, ale aj akromegáliu. Včasná diagnostika a liečba akromegálie je jedinou možnosťou v ovplyvnení morbidity a mortality pacientov trpiacich týmto ochorením.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Ivana Ságová, PhD.,
Národný endokrinologický a diabetologický ústav n.o.,
Kollárová 282/3,
034 91 Ľubochňa,
Slovenská republika
Cit. zkr:Vnitř Lék 2020; 66(2): e46–e50
Článek přijat redakcí: 1. 7. 2019
Článek přijat k publikaci: 3. 11. 2018
Zdroje
1. Capatina C, Wass JH 60 Years Of Neuroendocrinology: Acromegaly. J Endocrinol 2015; 226 : 141–160.
2. Sharma MD, Nguyen AV, Brown S et al. Cardiovascular disease in acromegaly. Huostonmethodist.org/debakey -journal 2007; 2 : 64–67.
3. Matta MP, Caron P Acromegalic cardiomyopathy: a review of the literature. Pituitary 2003; 6 : 203–207.
4. Kršek M Endokrinni choroby a jejich vliv na KV system. Medical Tribune 2015; XXX: 17.
5. Mosca S, Paolillo S, Colao A et al. Cardiovascular involvement inpatients affected by acromegaly: an appraisal. Int J Cardiol 2013; 167 : 1712–1718.
6. Kahaly G, Olshausen KV, Mohr -Kahaly S et al. Arrhythmia profile in acromegaly. Eur Heart J 1992; 13 : 51–56.
7. Vitale G, Pivonello R, Lombardi G et al. Cardiacabnormalities in acromegaly. Pathophysiology and implicationsfor management. Treat Endocrinol 2004; 3 : 309–318
8. Warszawski L, Kasuki L, Sá R et al. Low frequencyof cardiac arrhythmias and lack of structural heart disease inmedically -naďve acromegaly patients: a prospective study atbaseline and after 1 year of somatostatin analogs treatment. Pituitary 2016; 19 : 582–589.
9. Roca E, Mattogno PP, Porcelli Tet al. Plurihormonal ACTH -GH Pituitary Adenoma: Case Report and Systematic Literature Review. World neurosurgery 2018; 114 : 158–164.
10. Colao A, Pivonello R, Grasso LF et al. Determinants of cardiac disease in newly diagnosed patients with acromegaly: results of a 10 year survey study. Eur J Endocrinol 2011; 165 : 713–721.
11. Jayasena C, Comninos A, Clarke H et al. The effects of long term GH and IGF -I exposure on the development of cardiovascular, cerebrovascular and metabolic co -morbidities in treated patients with acromegaly. Clin Endocrinol 2011; 75 : 220–225.
12. Colao A, Spinelli L, Marzullo P et al. Highprevalence of cardiac valve disease in acromegaly: an observational, analytical, case -control study. J Clin Endocrinol Metab 2003; 88 : 3196–3201.
13. Pereira AM, van Thiel SW, Lindner JR et al. Increased prevalence of regurgitant valvular heart disease in acromegaly. J Clin Endocrinol Metab 2004; 89 : 71–75.
14. van der Klaauw AA, Bax JJ, Roelfsema F et al. Uncontrolled acromegaly is associated with progressive mitral valvular regurgitation. Growth Horm IGF Res 2006; 16 : 101–107.
15. Colao A, Marzullo P, Di Somma C et al. Growth hormone and the heart. Clin Endocrinol 2001; 54 : 137–154.
16. Isgaard J, Tivesten A, Friberg P et al. The role of the GH/IGF -I axis forthe cardiac function and structure. Horm Metab Res 1999; 31 : 50–54.
17. Castellano G, Affuso F, Conza P Di et al. The GH/IGF-1 Axis and Heart Failure. Curr Cardiol Rev 2009; 5 : 203–215.
18. Mendoza E, Malong CL, Tanchee -Ngo MJ et al. Acromegaly With Cardiomyopathy, Cardiac Thrombus and Hemorrhagic Cerebral Infarct: A Case Report of Therapeutic Dilemma With Review of Literature. Int J Endocrinol Metab 2015; 13 : 1–4.
19. John jr. AJ, Laws ER Surgical Treatment of Pituitary Adenomas. Dostupné z https:// www.ncbi.nlm.nih.gov/books/NBK278983/.
20. Hána V, Švancara J, Bandúrová L et al. Registry of sellar tumors - RESET: Diagnostic and therapy of acromegaly in Czech and Slovak republics in the 21st century. Diabetes, metabolizmus, endokrinologie a výživa 2013; 16 : 219–224.
21. Colao A, Pivonello R, Galderisi M et al. Impact of treating acromegaly first with surgery or somatostatin analogs on cardiomyopathy. J Clin Endocrinol Metab 2008; 93 : 2639–2646.
22. Sakai H, Tsuchiya K, Nakayama C et al. Improvement of endothelial dysfunction in acromegaly after transsphenoidal surgery. Endocr J 2008; 55 : 853–859.
23. Melmed S New therapeutic agents for acromegaly. Nat Rev Endocrinol 2016; 12 : 90–98.
24. Katznelson L, Laws EL, Melmed S et al. Acromegaly: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2014; 99 : 3933–3951.
25. Zahr R, Fleseriu M Updates in Diagnosis and Treatment of Acromegaly. European Endocrinology 2018; 10 : 57–61.
26. Carmichael JD et al. Acromegaly clinical trial methodology impact on reported biochemical efficacy rates of somatostatin receptor ligand treatments: a meta -analysis. J Clin Endocrinol Metab 2014; 99 : 1825–1833.
27. Colao A, Marzullo P, Cuocolo A et al. Reversal ofacromegalic cardiomyopathy in young but not in middle -agedpatients after 12 months of treatment with the depot long acting somatostatin analogue octreotide. Clin Endocrinol 2003; 58 : 169–176.
28. Annamalai AK, Webb A, Kandasamy N et al. A comprehensive study of clinical, biochemical, radiological, vascular, cardiac, and sleep parameters in an unselected cohort of patients with acromegaly undergoing presurgical somatostatin receptor ligand therapy. J Clin Endocrinol Metab 2013; 98 : 1040–1050.
29. Colao A, Marzullo P, Ferone D et al. Cardiovascular effects of depot long -acting somatostatin analog Sandostatin LAR in acromegaly. J Clin Endocrinol Metab 2000; 86 : 3132–3140.
30. Colao A, Cuocolo A, Marzullo P et al. Effects of one -year treatment with octreotide on cardiac performance in patients with acromegaly. J Clin Endocrinol Metab 1999; 84 : 17–23.
31. Akutsu H, Kreutzer J, Wasmeier G et al. Acromegaly per se does not increase the risk for coronary artery disease. Eur J Endocrinol 2010; 162 : 879–886.
32. Colao A, Auriemma RS, Galdiero M et al. Effects of initial therapy for five years with somatostatin analogs for acromegaly on growth hormone and insulin -like growth factorI levels, tumor shrinkage, and cardiovascular disease: a prospective study. J Clin Endocrinol Metab 2009; 94 : 3746–3756.
33. Trainer PJ, Drake WM, Katznelson L et al. Treatment of acromegaly with the growth hormone -receptor antagonist pegvisomant. N Engl J Med 2000; 342 : 1171–1177.
34. van der Lely AJ, Hutson RK, Trainer PJ et al. Long -term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001; 358 : 1754–1759.
35. van der Lely AJ, Biller BM, Brue T et al. Long -term safety of pegvisomant in patients with acromegaly: comprehensive review of 1288 subjects in ACROSTUDY. J Clin Endocrinol Metab 2012; 97 : 1589–1597.
36. Colao A, Pivonello R, Auriemma RS et al. Efficacy of 12-monthtreatment with the GH receptor antagonist pegvisomant inpatients with acromegaly resistant to long -term, high-dosesomatostatin analog treatment: effect on IGF -I levels, tumor mass, hypertension and glucose tolerance. Eur J Endocrinol 2006; 154 : 467–477.
37. Auriemma RS, Pivonello R, De Martino MC et al. Treatment with GH receptor antagonist in acromegaly: effect on cardiac arrhythmias. Eur J Endocrinol 2012; 168 : 15–22.
38. De Martino MC, Auriemma RS, Brevetti G et al. The treatment with growth hormone receptor antagonistin acromegaly: effect on vascular structure and function in patients resistant to somatostatin analogues. J Endocrinol Invest 2010; 33 : 663–670.
39. Pivonello R, Galderisi M, Auriemma RS et al. Treatment with growth hormone receptor antagonist in acromegaly: effect on cardiac structure and performance. J Clin Encocrinol Metab 2007; 92 : 476–482.
40. Kuhn E, Maione L, Bouchachi A et al. Long -term effects of pegvisomant on comorbidities in patients with acromegaly: a retrospective single -center study. Eur J Endocrinol 2015; 173 : 693–702.
41. Auriemma RS, Grasso LF, Galdiero M et al. Effects of long -term combined treatment with somatostatin analogues and pegvisomant on cardiac structure and performance in acromegaly. Endocrine 2016; 55 : 872–884.
42. Baldwin A, Cundy T, Butler J et al. Progression of cardiovascular disease in acromegalic patients treated by external pituitary irradiation. Acta Endocrinol 1985; 1 : 581–587.
43. Sninčák M Srdcové zlyhávanie v roku 2016 - novinky v odporúčaniach, súčasný stav, trendy. Via practica 2016; 13 : 163–167.
44. Thomas J, Dattani A, Zemrak F et al. Renin -Angiotensin System. Blockade Improves Cardiac Indices in Acromegaly Patients. Exp Clin Endocrinol Diabetes 2017; 125 : 365–367.
45. Bihan H, Espinosa C, Valdes -Socin H et al. Long -term outcome of patients with acromegaly and congestive heart failure. J Clin Endocrinol Metab 2004; 89 : 5308–5313.
46. Silvermann CB, Baran A Dilated and Restrictive Cardiomyopathies. http://www.clevelandclinicmeded.com/medicalpubs/diseasemanagement/cardiology/dilated -restrictive -cardiomyopathy/
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Mikroskopická polyangiitídaČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibróza
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



