-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pacient po transplantaci ledviny v ambulanci internisty
Patient after kidney transplantation in outpatient internal clinic
Kidney transplantation is the first-choice treatment of the end-stage kidney disease. By increasing the number of kidney transplants and by improving the care for these patients, there is increasing number of patients with a functional graft, who need adequate follow-up and treatment. It is advisable to feasibly transfer some portion of the care to the doctors based outside transplant centres and so it is necessary to make them familiar with these issues. That is also the purpose of this article, which is focused on some of those frequent medical problems associated with kidney transplantations, which are in competence of internal medicine doctors. These are namely arterial hypertension, present in majority of patients after transplantation, frequently caused by persisting renal dysfunction of various degree and effect of immunosuppressants, post transplant diabetes mellitus, dyslipidaemia, which is our focus because chronic kidney disease is considered a coronary heart disease risk equivalent, and anaemia.
Keywords:
arterial hypertension – diabetes mellitus – anaemia – dyslipidaemia – kidney transplantation – PTDM
Autoři: Tomáš Rohá
Působiště autorů: Klinika nefrologie, Transplantcentrum, IKEM Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 42-46
Kategorie: Přehledové články
Souhrn
Transplantace ledviny je metodou volby pro léčbu konečného stadia renálního onemocnění. Zvyšováním počtů transplantací a zlepšováním péče o tyto pacienty narůstá počet pacientů s funkčním štěpem ledviny, kterým je potřeba zabezpečit adekvátní sledování a léčbu a je žádoucí část této péče přenášet na lékaře mimo transplantační centra, a je tedy potřeba je s touto problematikou seznamovat. To je i cílem tohoto článku, který pojednává o několika častých zdravotních komplikacích souvisejících s transplantací ledviny a spadajících do kompetence internistů, jmenovitě arteriální hypertenze, která je přítomna u většiny pacientů po transplantaci i s ohledem na různou míru přetrvávající renální dysfunkce, a vliv imunosupresiv, potransplantační diabetes mellitus, dyslipidemie, na kterou se zaměřujeme z pohledu toho, že chronické onemocnění ledvin je bráno jako ekvivalent ischemické choroby srdeční, a anémie.
Klíčová slova:
anémie – arteriální hypertenze – diabetes mellitus – dyslipidemie – PTDM – transplantace ledviny
Úvod
Transplantace ledviny je metodou volby léčby konečného stadia ledvinového onemocnění u velké části pacientů. Aktivitou transplantačních center a zlepšující se zdravotní péčí počet pacientů přežívajících s funkčním štěpem rok od roku narůstá, dle Statistické ročenky České nefrologické společnosti žilo v České republice k 31. 12. 2016 4 692 pacientů s funkčním štěpem ledviny (1). Pacienti jsou po úspěšné transplantaci ledviny obvykle propuštěni z hospitalizace během 2. týdne po operaci a další standardní péče je vedena téměř výhradně ambulantní cestou. Přestože je velká část péče, zejména v období časně po transplantaci, zabezpečována transplantačními centry, i z praktického hlediska nelze o pacienty po transplantaci pečovat pouze v nich a péče o tyto pacienty se přenáší i do ambulancí v místě bydliště pacienta, přestože primárně nefrologických. Obor interního lékařství je široký, v tomto přehledném článku zmíním některé z oblastí, se kterými může internista přijít do styku u transplantovaného pacienta, resp. o kterých je dobré mít vědomost. K tomu, co je základem potransplantačního sledování, tedy sledování renální funkce, což není primárním tématem tohoto článku, pouze důležitá poznámka: v případě zhoršení renální funkce je kromě jiných potenciálních příčin, které se v principu neliší od netransplantovaných pacientů, nutno myslet na rejekci, tedy proces odhojování štěpu, který vyžaduje časnou bioptickou verifikaci a adekvátní léčbu v transplantačním centru. Na rejekci je potřeba myslet vždy, pokud není zřejmá jiná příčina vysvětlující zhoršení renální funkce.
Arteriální hypertenze
Arteriální hypertenze (AH) je významně spojena s chronickým onemocněním ledvin a je přítomna u většiny pacientů podstupujících dialyzační terapii, ale i u asi 80 % pacientů po transplantaci ledviny (2). Mezi hlavní příčiny morbidity a mortality pacientů po transplantaci patří kardiovaskulární komplikace, na kterých se etiologicky podílí i AH. AH je nezávisle spojena jak se zvýšeným rizikem úmrtí, tak se zvýšeným rizikem ztráty štěpu (každých 10 mm Hg systolického tlaku zvyšovalo riziko o 12, resp. 18 %) (3). Transplantací ledviny se AH může u pacienta změnit, a to v obou směrech, záleží na více faktorech. Faktory spojené s vyšším výskytem AH po transplantaci ledviny jsou zmíněny v Tab. 1. V časném pooperačním období jistě přispívá k hypertenzi také ob ‑ vykle podávaná volumexpanze. Používáním nižších dávek kortikoidů a rychlejší redukcí jejich dávkování v současných imunosupresivních režimech není vliv glukokortikoidů na dlouhodobou kompenzaci AH tak významný jako v minulosti. Pokud jde o kalcineurinové inhibitory (CNI – calcineurin inhibitors), ty jsou pevnou součástí většiny stávajících léčebných protokolů a jsou důležitým faktorem AH. Způsobují systémovou vazokonstrikci (zejména cyklosporin) kromě jiného zvýšenou produkcí endotelinu (4), také ale působí retenci sodíku (5). Stenóza renální arterie je zmiňována i z důvodu, že se jedná o potenciálně řešitelný stav, mezi nezávislé faktory asociované se stenózou renální tepny patří infekce CMV a opožděný rozvoj funkce štěpu ledviny. Incidence je popisována v širokém rozpětí (1–23 % pacientů) (6), z vlastní zkušenosti bych se ve smyslu incidence významné stenózy prezentující se typickými projevy (dlouhodoběji dekompenzovaná hypertenze, náhlé plicní edémy, náhlé zhoršení kompenzace krevního tlaku) klonil k dolní hranici. Diagnostika se obvykle provádí v prvním kroku sonograficky, případně pak angiograficky, léčba je ve většině případů angioplastikou s případným zavedením stentu.
Tab. 1. Rizikové faktory pro výskyt arteriální hypertenze po transplantaci ledviny. Upraveno podle (2) 
Léčba AH vede k lepšímu přežívání štěpů i pacientů, což bylo prezentováno na velké skupině pacientů z registru Collaborative Transplant Study (přes 24 000 pacientů). U těch, kteří měli v roce po transplantaci systolický krevní tlak > 140 mm Hg, ale měli ho kontrolovaný < 140 mm Hg do 3 let po transplantaci, bylo významně lepší přežívání štěpů v porovnání s pacienty s trvající AH i 3 roky po transplantaci (RR – relative risk 0,79, 95% CI – confidence interval 0,73–0,86) (7).
Pro doporučení cílového krevního tlaku neexistují pro pacienty po transplantaci ledviny randomizované kontrolované studie. Jednotlivá doporučení se liší, iniciativa KDIGO z roku 2012 uvádí < 130/80 mm Hg, sílu doporučení a kvalitu důkazů ale zrcadlí stupeň doporučení 2D, tedy nejnižší možný (8). Autoři UpToDate navrhují 140/90 mm Hg u pacientů bez diabetu nebo proteinurie a < 130/80 mm Hg u pacientů s diabetem nebo proteinurií (2). Nová evropská doporučení z roku 2018 speciální doporučení pro transplantované neuvádějí.
Kromě režimových opatření, kde je potřeba zdůraznit omezení příjmu soli zejména u pacientů užívajících CNI, může v rámci terapie pomoci redukce dávky CNI, případně změna imunosuprese na kombinaci bez CNI, v praxi ale úpravu imunosuprese provádíme obvykle pouze se zřetelem k imunologickému stavu pacienta a tato úprava patří do kompetence transplantologa.
V praxi jsou používány prakticky všechny třídy antihypertenziv, vhodnost jejich použití se mění s dobou od transplantace. Přednost je obvykle dávána blokátorům kalciových kanálů s ohledem na jejich účinnost a mechanismus účinku, který působí proti vazokonstrikci působené CNI. Dle metaanalýzy COCHRANE z roku 2009 lze kalciové blokátory preferovat jako antihypertenzivum 1. volby (9), při známkách převodnění je namístě podávání diuretik, z hlavních tříd jsou běžně podávány betablokátory. Pokud jde o ACE inhibitory a sartany, důkazy pro jejich benefit v tvrdších výstupech chybí, poslední randomizovaná kontrolovaná studie s ramiprilem nepotvrdila, že by jeho podávání významně snížilo výskyt zdvojnásobení sérového kreatininu, chronického renálního selhání nebo úmrtí pacientů po transplantaci ledviny s proteinurií (10). Při podávání non‑dihydropyridinových kalciových blokátorů je nutné vzít do úvahy jejich významnou interakci s imunosupresivy (CNI a mTOR inhibitory) a neupravovat dávku bez následné časné kontroly hladiny imunosupresiv.
NODAT/PTDM
NODAT (New Onset Diabetes After Transplantation), tedy nově vzniklý diabetes po transplantaci, resp. nyní doporučované označení PTDM (PostTransplantation Diabetes Mellitus), tedy potransplantační diabetes mellitus, je další významnou komplikací s dopadem na přežívání štěpů i pacientů. Protože je v 1. týdnech po transplantaci hyperglykemie přítomna u asi 90 % pacientů (11), doporučuje konsenzuální dokument diagnózu PTDM hodnotit až s odstupem několika týdnů při stabilní udržovací imunosupresivní léčbě (12). Jinak jsou kritéria pro diabetes mellitus stejná jako u jiných pacientů, glykovaný hemoglobin není doporučeno používat k vyloučení PTDM v prvních 3 měsících po transplantaci, protože výsledek nemusí být validní, než dojde ke glykaci hemoglobinu v nových podmínkách (13) (renální funkce, imunosuprese), nicméně zejména u vysokých hodnot je pravděpodobnost falešné pozitivity nízká (12). Protože je orální glukózový toleranční test pro praxi méně praktický, obvykle se používá lačná glykemie a glykovaný hemoglobin. Asi 1/3 původně nediabetických pacientů má 6 měsíců po transplantaci poruchu glukózového metabolismu, přičemž rok po transplantaci je prevalence PTDM dle amerického registru 5 % (14). Potenciální rizikové faktory pro rozvoj PTDM jsou znázorněny na Obr. 1 (15).
Obr. 1. Potenciální rizikové faktory pro rozvoj PTDM dle (15) 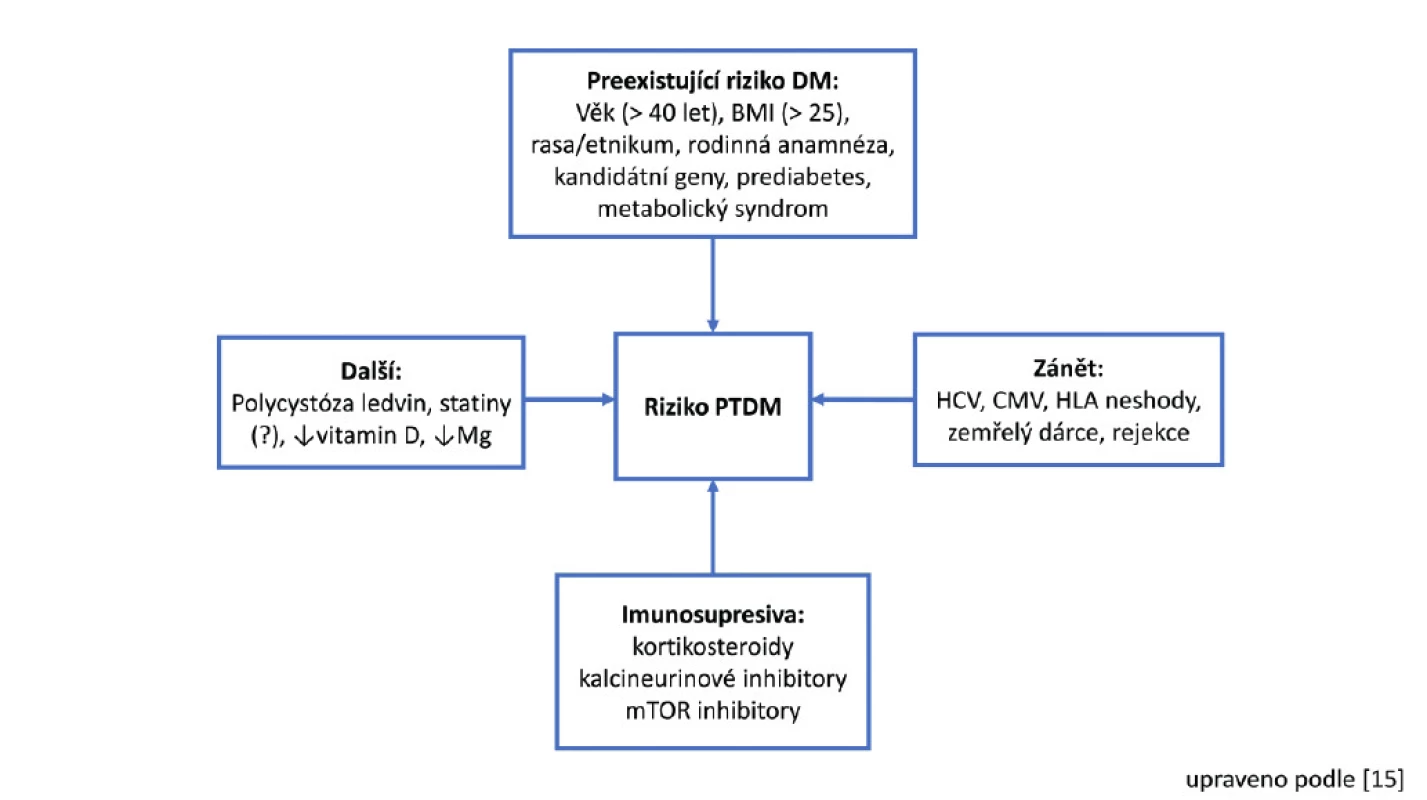
Glukokortikoidy způsobují hyperglykemii různými mechanismy a v závislosti na dávce, vyšší dávky jsou v dnešní době podávány pouze v rámci indukční léčby, během 2–3 měsíců jsou pacienti na udržovací dávce obvykle 5 mg prednisonu/den. V randomizované studii publikované v roce 2015 mezi pacienty s úplným vysazením kortikoidů a s ponechanou nízkou udržovací dávkou nebyl významný rozdíl ve výskytu PTDM 5 let po transplantaci, více pacientů s ponechanými kortikoidy ale vyžadovalo podávání inzulinu (16).
Jak cyklosporin, tak ještě ve větší míře takrolimus jsou diabetogenní, opět v závislosti na dávce. Působí zejména snížením sekrece inzulinu, ale pravděpodobně i zvýšením inzulinové rezistence. S PTDM byl asociován i sirolimus. Z infekčních agens je známá souvislost mezi PTDM a infekcí viry HCV a CMV. Z některých studií je popsána i asociace polycystózy ledvin se vznikem PTDM. Pro komplexnější výklad jednotlivých rizikových faktorů a příslušné reference odkazuji na podrobný recentní přehledový článek od Shivaswamyho et al (15).
PTDM je asociován s vyšší mortalitou a také s vyšším rizikem ztráty štěpu, které je ale zejména spojeno právě s úmrtím s funkčním štěpem (13). Etiologicky se jedná většinou o kardiovaskulární příhody (17). Také je spojen s vyšším výskytem infekcí a ostatními diabetickými komplikacemi (13).
V rámci terapie jsou samozřejmě namístě režimová opatření. Případnou úpravu chronické imunosuprese (redukce dávek CNI, verze z takrolimu na cyklosporin) je potřeba vážit s ohledem na imunologické riziko pacienta a patří do rukou transplantologa. Úplné vysazení malé dávky kortikoidů není doporučeno (13).
Hyperglykemie časně po transplantaci během hospitalizace obvykle korigujeme podáváním inzulinu. Při podávání pulzních kortikosteroidů a rychlých změnách renální funkce nezbývá, než glykemie intenzivně monitorovat a upravovat dávky inzulinu. Dle tíže poruchy glukózového metabolismu je ve spolupráci s diabetologem pacient event. vybaven glukometrem a edukován o inzulinoterapii. V případě potřeby nízkých dávek inzulinu jsou pacienti případně již před propuštěním převedeni na perorální terapii. Z perorálních antidiabetik obvykle volíme deriváty sulfonylurey (v naší praxi nejčastěji gliquidon, který lze podávat i při pokročilé renální insuficienci), případně repaglinid, bezpečné a účinné se jeví i podávání gliptinů, byť jsou data pro léčbu PTDM zatím z menších skupin pacientů (15). Výhodou linagliptinu je absence potřeby upravovat dávku při renální insuficienci. Ještě méně dat máme pro inkretinová mimetika, kde je potenciálním problémem významnější dopad na vyprazdňování žaludku a tím pádem absorpci perorální medikace (15). S rostoucím užíváním gliflozinů se objevují i zkušenosti s jejich podáváním u pacientů po transplantaci ledviny, na více dat o jejich účinnosti a bezpečnosti ale ještě budeme muset počkat. Podávání metforminu není v praxi u pacientů po transplantaci ledviny pro riziko laktátové acidózy běžné, přestože u pacientů s dobrou a stabilní funkcí štěpu je za pravidelné monitorace jeho podávání možné. Část pacientů vyžaduje pro nedostatečný efekt perorální terapie podávání inzulinu, tito pacienti jistě patří do péče diabetologa.
Glykovaný hemoglobin by měl být u pacientů monitorován každé 3 měsíce, cílové hodnoty jsou navrhovány do 53–58 mmol/mol a spíše se vyhnout hodnotám pod 42 mmol/mol (18).
Dyslipidemie
Ve snaze zlepšovat přežívání pacientů po transplantaci se v rámci snižování kardiovaskulárního rizika pozornost kromě hypertenze a diabetu zaměřuje i na dyslipidemii. Dyslipidemie je po transplantaci ledviny velmi častou odchylkou. Ve starší studii je její výskyt popisován až u asi 80 % pacientů (19), v recentnější studii byla 6 měsíců po transplantaci ledviny hladina LDL‑cholesterolu nad 2,6 mmol/l u 455 z 935 (45 %) pacientů, přičemž statinem bylo léčeno 41 % pacientů (20). Příčinou dyslipidemie může být jak medikace, tak sekundární příčiny, které je potřeba zvážit – nefrotický syndrom, hypotyreóza, diabetes mellitus, vysoký příjem alkoholu, obezita a chronické onemocnění jater (21). Z imunosupresiv se na dyslipidemii podílejí kortikoidy, CNI a mTOR inhibitory. Kortikosteroidy zvyšují inzulinovou rezistenci, následná hyperinzulinemie vede k zvýšenému vychytávání volných mastných kyselin v játrech, kde jsou hlavním substrátem pro tvorbu VLDL částic, dochází rovněž ke zvýšené syntéze VLDL. Inzulinová rezistence vede také ke snížení clearance triglyceridů. Kortikoidy také zvyšují přeměnu VLDL na LDL‑cholesterol, downregulují expresi LDL receptorů a zvyšují aktivitu 3-hydroxy-3-metylglutaryl koenzymu A (22). Cyklosporin interferuje s navázáním LDL‑cholesterolu na LDL receptor, čímž snižuje jeho clearance, interferencí s produkcí žlučových kyselin rovněž vede k downregulaci LDL receptorů. U takrolimu se předpokládá podobný metabolický efekt, nicméně je asociován s menší mírou hyperlipidemie (22). Pro původní studie opět odkazuji do podrobnějších článků (21, 22). mTOR inhibitory zvyšují hladinu cholesterolu a triglyceridů snížením katabolismu apolipoproteinu B100 a inhibicí signálů inzulinu a inzulinu podobnému růstovému faktoru (blokáda lipoproteinové lipázy) (23).
U všech pacientů s chronickým onemocněním ledvin včetně transplantovaných je doporučeno vyšetření lipidového profilu (24), vhodné je vyšetření nalačno (24), první vyšetření po transplantaci provést asi po 2–3 měsících (25). KDIGO doporučení následující vyšetřování lipidového profilu nedoporučují s ohledem na indikaci léčby statinem dle kardiovaskulárního rizika, které je u pacientů po transplantaci ledviny vysoké, a ne dle lipidogramu jako takového. Přesto ho v praxi používáme k ověření odpovědi na léčbu a compliance pacientů a kontrolujeme alespoň 1× ročně, případně i dříve kupř. v případě změny imunosuprese, jejího dávkování nebo vzniku nového stavu, který se může na dyslipidemii podílet.
Přestože kauzální asociace dyslipidemie a kardiovaskulárního rizika u této populace nebyla dokázána, je stav pacienta po transplantaci ledviny považován za ekvivalent ischemické choroby srdeční, a i proto je cílem dyslipidemii diagnostikovat a léčit (21, 26).
V rámci medikamentózní terapie jsou na prvním místě statiny. Doposud byla provedena pouze 1 randomizovaná kontrolovaná studie statinu proti placebu, je to studie ALERT. Podávání 40 mg fluvastatinu během 5 let vedlo k významně nižšímu výskytu kardiální smrti a nefatálních infarktů myokardu, což byl ale pouze sekundární outcome, v primárním výstupu významných nežádoucích kardiálních událostí významný rozdíl nebyl (27). Iniciativa KDIGO doporučuje na základě této studie terapii statiny u všech pacientů po transplantaci ledviny s tím, že u pacientů mladších 30 let (kteří nebyli do studie zařazeni) je ke zvážení poměr malého přínosu a potenciálního rizika (24). Terapie se posunula od doporučení konkrétních cílových hodnot k terapii na základě kardiovaskulárního rizika. Doporučené dávkování u nás běžně podávaných statinů je uvedeno v Tab. 2, v praxi nejčastěji používáme atorvastatin, pro vyšší bezpečnost lze začít dávkami polovičními. Při kombinaci s cyklosporinem dochází z důvodu interakce k významnému zvýšení expozice statinu, proto se obvykle dávka nenavyšuje, není doporučeno podávání simvastatinu v kombinaci s cyklosporinem.
Tab. 2. Doporučené dávkování statinů (mg/den) u dospělých pacientů s CKD. Upraveno podle (24) 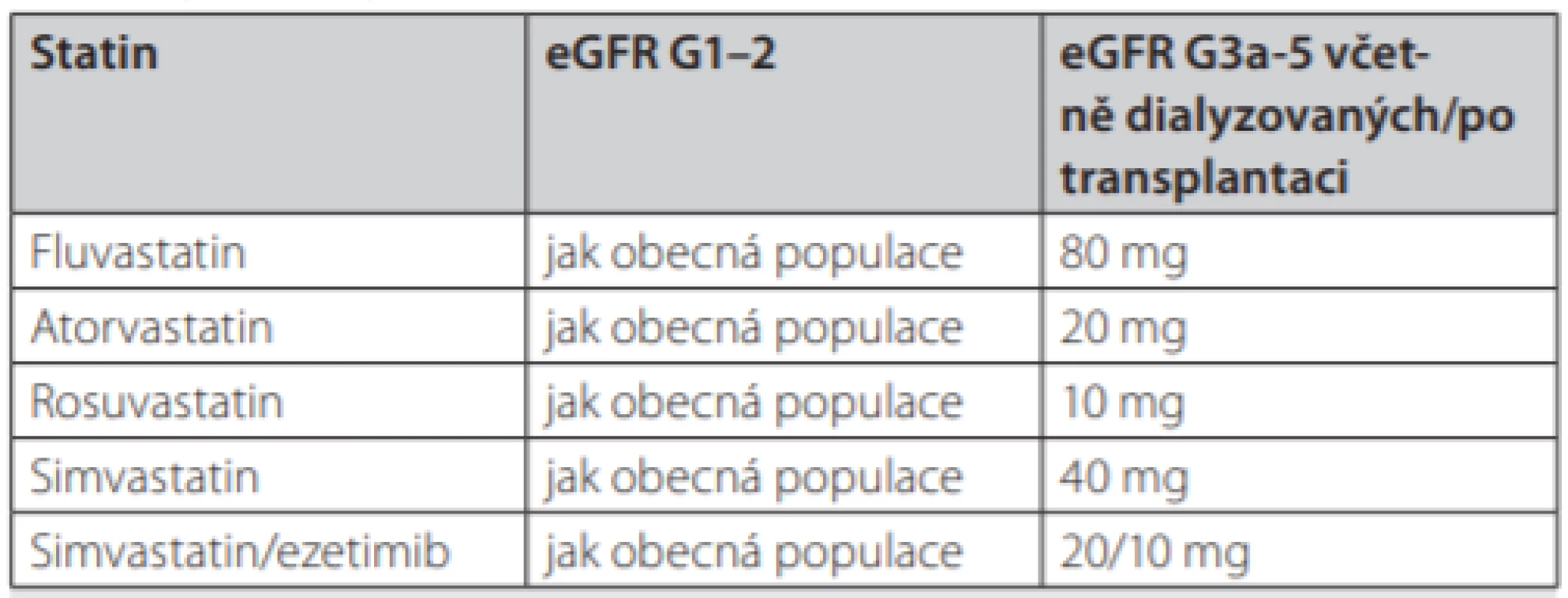
Dávka rosuvastatinu 40 mg není u CKD G1–2 doporučena pro riziko nežádoucích renálních událostí. Podávání cyklosporinu vede v důsledku inhibice metabolismu některých statinů ke zvýšení hladin Vzhledem k důkazům většího klinického benefitu statinů není léčba fibráty u pacientů po transplantaci ledviny doporučována, rovněž z důvodu vyššího rizika nežádoucích účinků není doporučována kombinace statinu a fibrátu. V případě intolerance nebo nedostatečného efektu statinu se jako vhodná druhá volba jeví ezetimib, tento je možné použít i u pacientů s přetrvávající významnou hypertriglyceridemií, pokud režimová opatření a léčba sekundárních příčin nevede ke snížení hladiny pod 5,65 mmol/l (21). Podávání kyseliny nikotinové (niacin) není dle KDIGO pro nedostatek dat doporučováno, sekvestranty žlučových kyselin můžou interferovat s absorpcí imunosuprese (21).
Anémie
Dalším stavem, se kterým se internista může běžně u pacienta po transplantaci ledviny setkat, je anémie. Po transplantaci ledviny se vyskytuje asi v 30–40 % případů (28), výskyt se mění dle časovém úseku ve vztahu k transplantaci. Téměř všichni pacienti přicházejí k transplantaci v různé míře anemičtí z důvodu snížené produkce erytropoetinu či nedostatečné odezvy na něj, také z důvodu nedostatku železa. V časném potransplantačním období se na anémii podílejí peroperační krevní ztráty a také frekventní krevní odběry, případně přetrvávající dysfunkce štěpu. S rozvojem funkce štěpu a stabilizací stavu dochází během 3–6 měsíců k normalizaci anémie, která nicméně u části pacientů přetrvá (29). 6 měsíců po transplantaci má anémii asi polovina pacientů, 12 měsíců po transplantaci 10–40 % pacientů (30).
Příčiny anémie po transplantaci lze rozdělit do 3 skupin – snížená produkce, zvýšená destrukce a ztráty erytrocytů (28). Jednotlivé příčiny jsou uvedeny v Tab. 3.
Tab. 3. Příčiny anémie po transplantaci ledviny. Upraveno podle (28) 
Krevní obraz vyšetřujeme u pacientů po transplantaci v rámci rutinního sledování při každé návštěvě. V rámci diagnostiky etiologie anémie bereme do úvahy možnosti, které se týkají přednostně pacientů po transplantaci, ale stejně tak mohou být příčinou stavy způsobující anémii v obecné populaci. Proti vyšetřením u netransplantovaných může být obtížná interpretace parametrů zásob železa – vyšší hodnoty ferritinu mohou být ovlivněny probíhajícím zánětem, případně rejekcí (30), saturace transferinu rovněž není spolehlivým ukazatelem funkčního deficitu železa, lepší známkou deficitu železa je vyšší procento hypochromních erytrocytů (31). Včas pomýšlíme na polékovou etiologii anémie, a to i s delším odstupem od transplantace, podobně na virovou etiologii. Nízký počet retikulocytů může ukazovat na infekci parvovirem B19, resp. aplastickou anémii v důsledku protilátek proti erytropoetinu (28). Data o dopadu anémie na prognózu pacientů se mezi jednotlivýmibstudiemi liší, nelze s jistotou říci, že je anémie asociována se zvýšenou mortalitou nebo horší prognózou štěpu, resp. že je způsobuje (28).
Pokud jde o léčbu, za předpokladu, že známe příčinu anémie, zaměřujeme se na ni (kupř. léčba infekce, případně úprava medikace – tu je potřeba dělat uvážlivě s ohledem na poměr přínosu a rizika, zejména pokud jde o úpravu imunosuprese). Pokud jde o terapii železem, resp. ESA, není k dispozici dostatek dat, která by určila přesnou strategii, resp. doporučení, v zásadě tedy postupujeme jako u pacientů s chronickým onemocněním ledvin, kteří nejsou po transplantaci. V případě nedostatku železa zahajujeme jeho substituci, v běžných ambulantních podmínkách obvykle perorálně, v případě nedostatečného efektu, případně intolerance, parenterálně. Stran cílových hladin hemoglobinu autoři z UpToDate doporučují nezahajovat léčbu ESA, dokud hemoglobin neklesne pod 100 g/l a cílové hodnoty pak 100–110 g/l (30).
Závěr
V tomto článku jsem prezentoval některé ze zdravotních komplikací, se kterými se po transplantaci běžně setkáváme, řešíme je v transplantačních ambulancích, a které spadají do oblasti interního lékařství. Lepší obeznámení internistů s danou problematikou pomáhá jednak v péči o jednotlivého pacienta, kterému se dostane adekvátní léčby blíže domovu, případně je do transplantačního centra včas referován, jednak pak umožní lékařům transplantačních center věnovat více času a prostoru pacientům, které mimo transplantační centra za stávající situace adekvátně léčit nelze.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Tomáš Roháľ,
Transplantcentrum,
IKEM Praha,
Vídeňská 1958/9,
140 21 Praha 4
Cit. zkr: Vnitř Lék 2020; 66(4): e17–e21
Článek přijat redakcí: 29. 9. 2018
Článek přijat k publikaci: 15. 11. 2019
Zdroje
1. Statistická ročenka dialyzační léčby v České republice v roce 2016. Česká nefrologická společnost. (cit. 2018–09–25). Dostupné z WWW: .
2. Vella J, Brennan DC. Hypertension after renal transplantation. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. (cit. 2018–09–25). Dostupné z WWW: .
3. Kasiske BL, Anjum S, Shah R, et al. Hypertension after kidney transplantation. Am J Kid ‑ ney Dis 2004; 43 : 1071–1081.
4. Takeda Y, Miyamori I, Furukawa K, et al. Mechanisms of FK 506-induced hypertension in the rat. Hypertension 1999; 33 : 130–136.
5. Curtis JJ, Luke RG, Jones P, et al. Hypertension in cyclosporine‑treated renal transplant recipients is sodium dependent. Am J Med. 1988; 85 : 134–138.
6. Audard V, Matignon M, Hemery F, et al. Risk factors and long‑term outcome of transplant renal artery stenosis in adult recipients after treatment by percutaneous transluminal angioplasty. Am J Transplant 2006; 6 : 95–99.
7. Opelz G, Dohler B. Improved Long‑Term Outcomes After Renal Transplantation Associated with Blood Pressure Control. Am J Transplant 2005; 5 : 2725–2731.
8. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDI ‑ GO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int Suppl 2012; 2 : 337–414.
9. Cross NB, Webster AC, Masson P, et al. Antihypertensive treatment for kidney transplant recipients. Cochrane Database Syst Rev 2009; 3.
10. Knoll GA, Fergusson D, Chassé M, et al. Ramipril versus placebo in kidney transplant patients with proteinuria: a multicentre, double‑blind, randomised controlled trial. Lancet Diabetes Endocrinol 2016; 4 : 318–326.
11. Chakkera HA, Weil EJ, Castro J, et al. Hyperglycemia during the immediate period after kidney transplantation. Clin J Am Soc Nephrol 2009; 4 : 853–859.
12. Sharif A, Hecking M, de Vries APJ, et al. Proceedings From an International Consensus Meeting on Posttransplantation Diabetes Mellitus: Recommendations and Future Directions. Am J Transplant 2014; 14 : 1992–2000.
13. Tobin GS, Klein CL, Brennan DC. New‑onset diabetes after transplant (NODAT) in renal transplant recipients. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. (cit. 2018–09 – 25). Dostupné z WWW: .
14. Matas AJ, Smith JM, Skeans MA, et al. OPTN/SRTR 2013 Annual Data Report: Kidney. Am J Transplant 2015; 15 : 1–34.
15. Shivaswamy V, Boerner B, Larsen J. Post‑transplant diabetes mellitus: Causes, Treatment, and Impact on Outcomes. Endocr Rev 2016; 37 : 37–61.
16. Pirsch JD, Henning AK, First MR, et al. New‑onset diabetes after transplantation: Results from a double‑blind early corticosteroid withdrawal trial. Am J Transplant 2015; 15 : 1982–1990.
17. Wauters RP, Cosio FG, Suarez Fernandez ML, et al. Cardiovascular consequences of new‑onset hyperglycemia after kidney transplantation. Transplantation 2012; 94 : 377–382.
18. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009; 9: (Suppl. 3): S1-S157.
19. Gonyea JE, Anderson CF. Weight Change and Serum Lipoproteins in Recipients of Renal Allografts. Mayo Clin Proc 1992; 67 : 653–657.
20. Gaston RS, Kasiske BL, Fieberg AM, et al. Use of cardioprotective medications in kidney transplant recipients. Am J Transplant 2009; 9 : 1811–1815.
21. Brennan DC, Lentine KL. Lipid abnormalities after renal transplantation. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. (cit. 2018–09–26). Dostupné z WWW: .
22. Agarwal A, Prasad GVR. Post‑transplant dyslipidemia: Mechanisms, diagnosis and management. World J Transplant 2016; 6 : 125.
23. Kasiske BL, De Mattos A, Flechner SM, et al. Mammalian target of rapamycin inhibitor dyslipidemia in kidney transplant recipients. Am J Transplant 2008; 8 : 1384–1392.
24. Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney Int Suppl 2013; 3 : 259–305.
25. Knoll GA, Blydt‑Hansen TD, Campbell P, et al. Canadian Society of Transplantation and Canadian Society of Nephrology commentary on the 2009 KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Kidney Dis 2010; 56 : 219–246.
26. Kidney Disease Outcomes Quality Initiative (K/DOQI) Group: K/DOQI clinical practice guidelines for management of dyslipidemias in patients with kidney disease. Am J Kidney Dis 2003; 41: S11-S91.
27. Holdaas H, Fellström B, Ag J, et al. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo‑controlled trial. Lancet 2003; 361 : 2024–2031.
28. Yabu JM, Winkelmayer WC. Posttransplantation anemia: Mechanisms and management. Clin J Am Soc Nephrol 2011; 6 : 1794–1801.
29. Mix TCH, Kazmi W, Khan S, et al. Anemia: A Continuing Problem Following Kidney Transplantation. Am J Transplant 2003; 3 : 1426–1433.
30. Coyne DW, Brennan DC. Anemia and the renal transplant recipient. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. (cit. 2018–09–28). Dostupné z WWW: .
31. Lorenz M, Kletzmayr J, Perschl A, et al. Anemia and iron deficiencies among long‑term renal transplant recipients. J Am Soc Nephrol 2002; 13 : 794–797.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Mikroskopická polyangiitídaČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibróza
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



