-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Krvácení do GIT při portální hypertenzi
Bleeding in portal hypertension
Liver cirrhosis is the most common reason of clinically significant portal hypertension in the western countries. Portal vein or hepatic veins thrombosis is less common. Variceal bleeding is the most severe life threatening complication of portal hypertension. Appropriate treatment includes initial general management, fluid replacement and hemosubstitution, antibiotic prophylaxis, vasoactive medication and endoscopic treatment. Transjugular intrahepatic portosystemic shunt (TIPS) is standard option in case of first line treatment failure. Dedicated esophageal metal stent or balloon tamponade could be used as a bridge to the TIPS or in case of TIPS contraindication. Non selective beta-blockers and endoscopic therapy are used in primary and secondary prophylaxis.
Keywords:
bleeding – portal hypertension – treatment
Autoři: Tomáš Fejfar 1; Tomáš Vaňásek 1; Petr Hůlek 1,2
Působiště autorů: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Katedra interních oborů LF OU Ostrava 2
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 32-41
Kategorie: Přehledové články
Souhrn
Klinicky významná portální hypertenze v západních zemích vzniká nejčastěji na podkladě jaterní cirhózy. Méně často při trombóze portální žíly nebo žil jaterních. Krvácení do gastrointestinálního traktu je jednou z nejzávažnějších a potenciálně smrtících komplikací portální hypertenze. Adekvátní léčebný postup sestává ze zajištění nemocného volumexpanzí a hemosubstitucí, antibiotické profylaxe a zejména podávání vazoaktivní léčby spolu s endoskopickým ošetřením. V případě selhání léčby první linie je obvykle indikována transjugulární intrahepatální portosystémová spojka (TIPS). Jako most k TIPS‑u či v případě jeho kontraindikace se zavádí dedikovaný jícnový stent (Danis) nebo balónková sonda. V primární a sekundární profylaxi se uplatňuje léčba neselektivním betablokátorem a endoskopická léčba.
Klíčová slova:
krvácení – léčba – portální hypertenze
Úvod
Syndrom portální hypertenze
Portální hypertenze představuje syndrom, který vzniká v souvislosti se zvýšením tlaku v řečišti portální žíly (v. portae). Portální žíla shromažďuje krev z nepárových orgánů dutiny břišní, tedy ze žaludku, střeva, slinivky a sleziny, jaterním hilem ji přivádí do jater a svými větvemi ji rozvádí do jaterního parenchymu. Ke zvýšení tlaku v portální žíle dochází v důsledku zvýšeného odporu mezi portální žilou a pravou srdeční síní (1). Klinický význam nemá absolutní hodnota tlaku v portální žíle, ale portosystémový gradient (PSG), tedy tlakový gradient mezi portální žilou a pravou srdeční síní nebo jaterními žílami za stavu, kdy není zřejmá porucha jejich průchodnosti. Přesné měření tohoto tlaku je možné pouze invazivním způsobem. Nejdostupnější je změření tlaku katétrem ve volné jaterní žíle (free hepatic venous pressure – FHVP) a poté v zaklíněné (wedged hepatic venous pressure – WHVP) s výpočtem rozdílu – gradientu (hepatic venous pressure gradient – HVPG). Měření skutečného PSG je možné jen přímo, např. při transhepatální punkci portální žíly. Normální hodnoty portosystémového gradientu se pohybují okolo 2–3 mm Hg. Portální hypertenze je pak definována jako zvýšení tohoto gradientu (nebo HVPG) nad 5 mm Hg. Klinického významu však nabývá většinou až v případě vzestupu na hodnoty vyšší než 10–12 mm Hg.
V Evropě je u 85–90 % nemocných příčinou portální hypertenze jaterní cirhóza. Méně časté příčiny jsou extrahepatální obstrukce portální žíly (EHPVO), obstrukce jaterních žil při Buddově‑Chiariho syndromu (hepatic venous outflow tract obstruction – HVOTO) nebo levostranná portální hypertenze, která je nejčastěji spojena s chorobami slinivky břišní a způsobená izolovanou trombózou slezinné žíly. Tyto stavy se mohou u některých nemocných vyskytovat současně. Zejména v případě jaterní cirhózy se v klinické manifestaci spolu s tvorbou portosystémových kolaterál přidává i riziko rozvoje jaterní encefalopatie, ascitu, hepatorenálního syndromu nebo méně časté oběhové komplikace ve smyslu hepatopulmonálního syndromu či portopulmonální hypertenze.
Varixy
Syndrom portální hypertenze vede k významným změnám na úrovni splanchnického i systémového řečiště a tvorba varixů jako portosystémových spojek je jedním z jejích hlavních projevů (1). Z patofyziologického pohledu jsou varixy či varikózní pleteně dilatované již preexistující či nově utvářené portosystémové spojky, které v oblasti submukózy trávicí trubice vznikající na podkladě tlakového gradientu mezi systémovým a portálním řečištěm. K jejich tvorbě dochází nejčastěji v oblasti distálního jícnu v povodí v. coronaria ventriculi nebo v oblasti žaludečního fundu v povodí v. gastricae breves. Kolaterály můžeme ale nalézt, i když méně často, i v oblasti tenkého a tlustého střeva a rekta.
U nemocných s kompenzovanou jaterní cirhózou endoskopicky nalézáme varixy v době diagnózy ve 30–40 %. Při dekompenzaci již ale téměř u 2/3 nemocných. Pravděpodobnost rozvoje varixů během jednoho roku u nemocných, kteří varixy v době diagnózy jaterní cirhózy neměli, je udávána v rozmezí 7–8 % (2, 3). Odhad progrese velikosti varixů v čase je přitom poměrně obtížný. Rychlost progrese varixů je ovlivněna jak etiologií a dynamikou jaterního onemocnění, zejména mírou kompenzace základního jaterního onemocnění, tak stadiem jaterní cirhózy, které obvykle vyjadřujeme Childovou‑Pughovou klasifikací (2–4). Riziko krvácení i jeho recidivy výrazně stoupá u nemocných ve skupině B a C podle Childa‑Pugha.
Riziko krvácení z varixů je přímo úměrné jejich velikosti. Při zvětšování velikosti varixu roste napětí stěny násobkem poloměru, dochází k oslabování cévní stěny a narůstá riziko ruptury s rozvojem masivního krvácení do gastrointestinálního traktu. Známkou zeslabování cévní stěny varixů je tvorba červených skvrn nebo pruhů (red spots) na vrcholcích varixů, které jsou dobře patrny v rámci endoskopického vyšetření a patří k významným prediktorům rizika (2–4). Proto je nutné jejich přítomnost či nepřítomnost spolu s velikostí varixů v rámci endoskopie popisovat. Smyslem popisu a zařazení do klasifikace není jen morfologicky popsat tvar, velikost, lokalizaci a vzhled varixů, ale především odhadnout riziko krvácení a správně tak indikovat preventivní léčebný zásah. U všech nemocných v době diagnózy chronického pokročilého jaterního onemocnění je proto indikována diagnostická horní endoskopie (2–6). K popisu nálezu dnes používáme častěji třístupňovou klasifikaci (7) (Tab. 1). Třístupňovou klasifikaci lze v klinické praxi nahradit i dělením na varixy velké (signifikantní – střední a velké podle NIEC) a malé (nesignifikantní – malé podle NIEC) a k popisu použít škálu dvoustupňovou (Tab. 1). Dalším významným ukazatelem míry rizika progrese velikosti varixů a krvácení je již zmiňovaná hodnota portosystémového gradientu, který je obvykle měřen jako rozdíl tlaků ve volné a zaklíněné jaterní žíle – HVPG. Riziko krvácení i recidivy významně stoupá při hodnotách HVPG > 16–20 mm Hg (2, 4, 5). I toto určení rizika má zásadní význam zejména při rozhodování o formě sekundární nebo primární prevence.
Tab. 1. Klasifikace jícnových varixů a rozdělení podle rizika. Upraveno dle (2, 3) 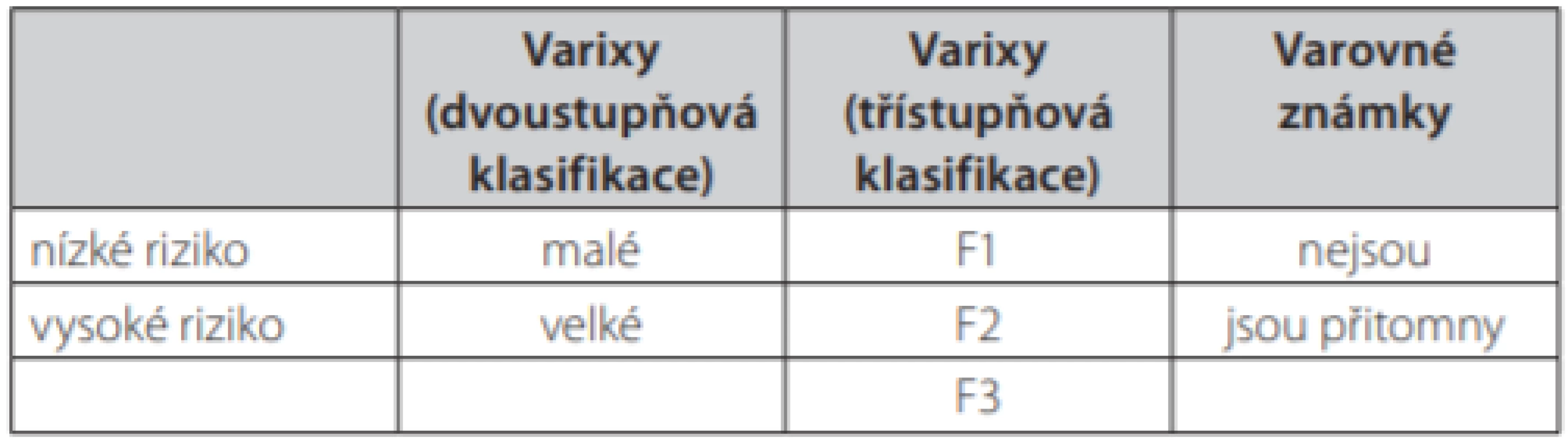
V současné době je krvácení v důsledku portální hypertenze 3. až 4. nejčastější příčinou krvácení do horní části trávicí trubice (5, 6) a stále její nejzávažnější a život ohrožující akutní komplikací. Spolu s rozvojem ascitu patří i mezi komplikace nejčastější. Letalita akutní ataky je stále vysoká (10–15 %) (2). Vyšší bývá zejména u nemocných s dalšími znaky dekompenzace, zejména s ascitem a u nemocných se současnou bakteriální infekcí a/nebo akutním postižením ledvin (8, 9).
V populaci nemocných s dosud kompenzovanou jaterní cirhózou je roční riziko krvácení kolem 4 %. U nemocných s již diagnostikovanými významnými varixy (F2–F3) ale přesahuje 10–15 % a v závislosti na již zmíněných faktorech může dosahovat 80 % (3, 7). Úmrtnost na akutní varikózní krvácení v posledních 2 desetiletích klesá (10). První ataka krvácení má stále vysokou letalitu (15–20 %), přičemž 2/3 nemocných, kteří v důsledku krvácení zemřou, zemře časně v prvních 24 hod. Krvácení je spojeno též s vysokým rizikem recidivy (4), a to zejména v prvních 5 dnech, kdy dosahuje 40 %. Riziko recidivy v následujících 6 týdnech postupně klesá. Na druhou stranu je udáváno, že 40–50 % krvácení ustane spontánně (5, 6). Nejčastějším zdrojem krvácení bývají varixy v oblasti jícnu a žaludku, méně často varixy ektopické. Krvácení při portální hypertenzní gastropatii nebo kolopatii bývá příčinou hemodynamicky významného krvácení vzácně a spíše bývá zdrojem chronických krevních ztrát.
Léčebné postupy zahrnují jak opatření k prevenci první ataky krvácení, tj. primární prevenci, tak léčbu probíhajícího krvácení a také prevenci recidivy, to znamená sekundární prevenci. Jsou standardizované do algoritmu podle aktuálních vědeckých poznatků a pravidelně aktualizovány (2–4).
Léčba akutní ataky krvácení
Léčba akutní ataky krvácení má probíhat na lůžku oddělení intenzivní péče a vždy vyžaduje multidisciplinární přístup za účasti intenzivisty, endoskopického týmu a radiologa. Základní léčba sestává z komplexního zabezpečení nemocného na lůžku intenzivní péče, podání vazoaktivních léků, které je nutno podat u každého nemocného s podezřením na varikózní krvácení již v přednemocniční péči, endoskopického ošetření a podání antibiotik. V případě selhání léčby lze indikovat TIPS či k překlenutí kritického období použít jícnový stent nebo balónkovou tamponádu.
Přístup k nemocnému v prvním kontaktu
V rámci anamnézy současně se zajišťováním nemocného s podezřením na krvácení do zažívací trubice na podkladě portální hypertenze cílíme otázky na dobu prvních příznaků, charakter a významnost krvácení. Pátráme po známkách chronického jaterního onemocnění a portální hypertenze. Zjišťujeme případné předchozí stavy dekompenzace (krvácení, ascites, jaterní encefalopatie) (3).
Za stálého sledování vitálních funkcí se při fyzikálním vyšetření zaměřujeme i na známky jaterní cirhózy a portální hypertenze (hepatomegalie, splenomegalie, pavoučkovité névy, palmární erytém, projevy jaterní encefalopatie) (3).
Ve vyhodnocení pokročilosti jaterního onemocnění pokračujeme i v dalším průběhu. Se znalostí základních laboratorních parametrů provádíme kalkulaci Child‑Pugh a MELD skóre k přesnějšímu určení prognózy a rizika selhání léčby. Vyhodnocení skóre je nutné i při zvažování dalšího postupu jak při případném zvažování TIPS, tak transplantace jater.
Zajištění nemocného
Základním opatřením po zajištění adekvátního žilního vstupu je volumová resuscitace pomocí krystaloidů s následnou hemosubstitucí. Přístup k hemosubstituci je v současné době konzervativní s cílem udržení hodnot hemoglobinu v rozmezí 70–80 g/l (hematokrit – HTK 0,21–0,24), vyjma nemocných s pokračujícím krvácením (4–6). U nemocných s přidruženými kardiovaskulárními chorobami a vysokým rizikem ischemických komplikací je vhodnější cílová hodnota hemoglobinu kolem 100 g/l. Substituce na vyšší hodnoty je dle dostupných dat naopak spojena s vyšším rizikem recidivy krvácení (11). Korekce protrombinového času/INR pomocí čerstvě mražené plazmy nebo rekombinantního faktoru VII (rVIIa) není v současné době standardně doporučována (2–4), i když existují data z 2 randomizovaných studií ukazující benefit podání rVIIa u nemocných ve vyšším riziku recidivy krvácení (Child‑Pugh skóre > 8 a aktivní krvácení v době endoskopie) (12, 13). Pro doporučení substituce trombocytů u nemocných s krvácením nejsou v současné době přesvědčivá data.
Antibiotická profylaxe
Velmi častou komplikací u nemocných s portální hypertenzí na podkladě jaterní cirhózy jsou systémové infekce. Je prokázané, že systémová infekce (spontánní bakteriální peritonitida, pneumonie, infekce močových cest) je jedním ze spouštěcích faktorů krvácení a podílí se na selhání léčby i vyšší úmrtnosti (14). U všech nemocných je proto indikováno podání širokospektrého antibiotika, které zvyšuje úspěšnost zástavy krvácení, snižuje riziko jeho recidivy i celkovou úmrtnost (15–17). ATB léčba má být zahájena již v úvodu, pokud možno ještě před endoskopickým ošetřením. Nejvyšší průkaz je pro podání chinolonů a cefalosporinů III. generace (ceftriaxon) (2, 4–6). Podání cefalosporinu volíme v případě předchozí terapie chinolony nebo nepříznivé epidemiologické situace v příslušném zdravotnickém zařízení (2–6).
Vazoaktivní léčba
Základem léčby akutního krvácení při portální hypertenzi, a to v případě všech možných zdrojů, jsou léky ovlivňující splanchnickou perfuzi. V současné době jsou dostupné a v klinické praxi používané: terlipresin, somatostatin a octreotid (Tab. 2). Vazoaktivní lék má být podán při podezření na krvácení z varixů ještě před endoskopickým ošetřením a pokud možno již při prvním kontaktu s nemocným v přednemocniční péči (2–4). Dále má být podáván po dobu 5 dnů (2–6, 18, 19). V současnosti se vede diskuze o možnosti pouze 3denního podání u nízkorizikových nemocných (2).
Tab. 2. Vazoaktivní léky v terapii varikózního krvácení a jejich dávkování 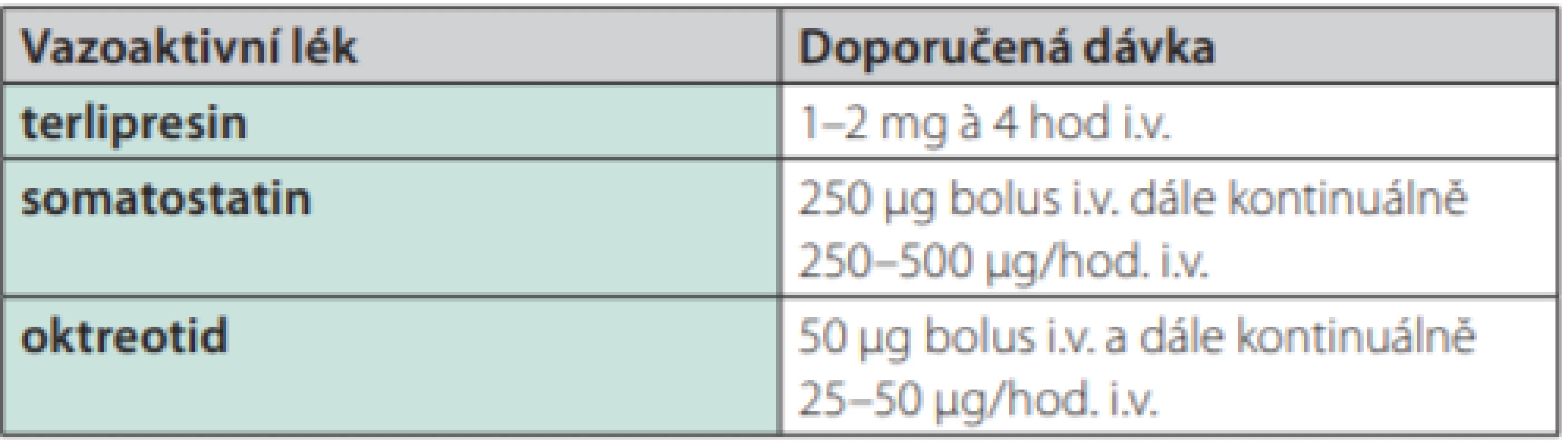
U nás nejdéle používaným a v klinických studiích prověřeným lékem je terlipresin. Terlipresin je syntetický analog vazopresinu, selektivní V1 agonista (N‑triglycyl-8-lysin‑vazopresin). Působí splanchnickou vazokonstrikci s výrazným snížením portálního tlaku a průtoku v portosystémových kolaterálách (20, 21). Jeho biologický poločas (3,5 hod.) umožňuje bolusové intermitentní podávání po 4 hod. Dávka 1–2 mg signifikantně snižuje portální průtok a průtok ve v. azygos. K zástavě krvácení vede ve vysokém procentu (75–83 %) a dle prospektivních studií prokazatelně snižuje letalitu i riziko recidivy krvácení (22, 23). Pozitivní je i snížení rizika rozvoje hepatorenálního syndromu (5). Nežádoucí účinky nejsou příliš časté. Kontraindikace je ale nutno mít vždy na paměti (ischemická choroba srdeční, těžší hypertenze). Opatrnosti je třeba i u nemocných ve vyšším věku. Nejzávažnější komplikací může být periferní i myokardiální ischemie udávané u 3 % pacientů. Méně závažnou, ale poměrně častou komplikací bývá diluční hyponatremie, která je častěji pozorována u méně pokročilých pacientů (24). Jen v menším procentu případů je však příčinou ukončení terapie. Nicméně sledování hladin sodíku v plazmě je nutnou součástí monitorování léčby (2, 4).
Druhým lékem, který můžeme použít v první volbě nebo v případě kontraindikace nebo výskytu nežádoucích účinků po podání terlipresinu, je somatostatin. Stejně jako terlipresin v bolusovém i kontinuálním podání vede u nemocných s portální hypertenzí ke snížení HVPG (25). Jeho účinek je dán patrně inhibicí sekrece glukagonu, který u nemocných s cirhózou způsobuje vazodilataci, snížením krevního objemu, snížením hyperemie zažívacího traktu po požití potravy i přímým působením na splanchnickou cirkulaci cestou S1–5 receptorů. Somatostatin signifikantně snižuje nejen portální tlak, ale i průtok žaludeční sliznicí, což může být obzvlášť důležité při krvácení z kongestivní gastropatie. Nevýhodou je velmi krátký biologický poločas (1–3 min), což vyžaduje podávání v kontinuální infuzi. Léčbu krvácení zahajujeme podáním bolusu 250 μg s následným kontinuálním podáváním 250–500 μg/hod. (Tab. 2) (2–6). Podávání vyšší dávky (500 μg/hod.) je spojeno s lepší kontrolou krvácení a přežitím u nemocných s aktivním krvácením v době endoskopie (26). Výskyt nežádoucích účinků je malý, nejčastěji to jsou dyspeptické potíže a změny glykemie.
Podobné farmakologické účinky jako somatostatin má jeho analog oktreotid. V porovnání se somatostatinem je pro klinické použití výhodný jeho delší poločas (90–120 min) a především podstatně delší farmakologické působení (8–12 hod.). Stejně jako somatostatin signifikantně snižuje portální tlak (4–6). V léčbě je podáván v úvodu bolusově (50 μg) s následným infuzním podáním (25–50 μg/hod) (2, 4). V současné době však není na českém trhu dostupný.
I když účinnost terlipresinu v placebem kontrolovaných studiích je dokumentována nejlépe a některé srovnávací práce ukazují větší účinnost terlipresinu na snížení HVPG (27), podle současných doporučení (2–4) a metaanalýz (23, 28) je použití všech 3 léků, jak po stránce zástavy krvácení, prevence recidivy, tak i ovlivnění letality srovnatelné.
Endoskopické ošetření
Endoskopická léčba krvácení je spolu s farmakoterapií vazoaktivní látkou základním terapeutickým postupem. Vzhledem k tomu, že až 30 % nemocných s portální hypertenzí a krvácením má nevarikózní zdroj krvácení, je endoskopické vyšetření nezbytné také k potvrzení zdroje a etiologie krvácení (29). Vysoký terapeutický efekt podané vazoaktivní léčby (30, 31) umožňuje přistoupit k endoskopii po komplexním zajištění a stabilizaci nemocného. Načasování endoskopie je doporučeno nejpozději do 12, lépe do 6 hod. od přijetí do nemocnice (2–4, 6). V České republice je tento interval ale obvykle i významně kratší. U rizikového nemocného (masivní krvácení, obtížný výkon, jaterní encefalopatie, nespolupracující nemocný) je k zajištění dýchacích cest před výkonem obvykle nutná orotracheální intubace. Pro zlepšení přehledu během endoskopie je Evropskou endoskopickou společností (ESGE) (32) i Evropskou asociací pro jaterní onemocnění (EASL) (2, 4) doporučováno 30–120 min před endoskopií intravenózní podání erytromycinu (250mg). V této indikaci se využívá silného účinku erytromycinu na žaludečních motilitu.
Za endoskopickou léčebnou metodu volby akutního krvácení v oblasti jícnu je dnes považována ligace jícnových varixů (2–6), která má v porovnání se sklerotizační léčbou vyšší účinnost a signifikantně nižší výskyt komplikací (33, 34). Nejčastěji provádíme ošetření pomocí multiligátorů a kromě krvácejícího varixu ligujeme i další varixy, a tak zahajujeme již i sekundární profylaxi. Skleroterapii pomocí 1–3% polidokanolu (35) lze použít v případě, že ligace není technicky možná. Problematika varixů žaludečních a ektopických je probrána v textu dále.
Další terapie
Krvácení je velmi často spojeno s rozvojem nebo zhoršením jaterní encefalopatie. Léčba v případě manifestní encefalopatie u akutního krvácení je stejná jako v ostatních situacích a sestává zejména z podávání laktulózy (15–30 ml à 8–12 hod. k dosažení 2–3 stolic denně), případně v kombinaci s rifaximinem (36, 37). U rizikových nemocných může být tato léčba indikována i preventivně (2, 4). Současně musíme dbát na dostatečnou korekci hypovolemie a minerálových dysbalancí. V léčbě se vyhýbáme nefrotoxickým (aminoglykosidy, NSAID) a vazodilatačním lékům (2). V době ataky krvácení u nemocných s ascitem neprovádíme velkoobjemové paracentézy a léčbu neselektivním betablokátorem zahajujeme až po stabilizaci nemocného a zvládnutí akutní příhody, nejčastěji od 5. dne.
Kombinace farmakoterapie a endoskopické léčby přináší v současnosti nejlepší kontrolu akutního krvácení a snižuje riziko časné recidivy (38). Dnes je považována za léčbu první linie.
Selhání léčby
V rámci komplexního sledování nemocného je nutno identifkovat faktory predikující možnost selhání terapie, ke kterým patří zejména známky šoku při přijetí, pokročilost jaterního onemocnění (podskupina B a C dle Childov‑Pughovy klasifikace, MELD skóre > 18), renální insuficience, aktivní krvácení v době endoskopie, s jaterní cirhózou asociovaná trombóza portální žíly, hepatocelulární karcinom a zejména vysoký portosystémový gradient (HVPG > 16–20 mm Hg) (39–41).
Selhání léčby znamená, že výše uvedená terapie nevedla k zástavě krvácení a krvácení pokračuje nebo po úspěšné hemostáze v úvodu došlo k časné recidivě krvácení, a to do 5 dnů od 1. ataky krvácení. V prvním případě by dalším krokem mělo být dočasné zavedení plně potahovaného metalického jícnového stentu (Danišův stent) nebo balónkové tamponády nebo provedení urgentní transjugulární portosystémové spojky.
V případě časné recidivy je u jícnových varixů indikováno druhé endoskopické ošetření (2–4). Pokud byla první ataka krvácení závažnějšího charakteru nebo je nemocný ve vysokém riziku další recidivy krvácení, je třeba primárně zvážit zavedení TIPS‑u (2–4).
Balónková sonda
Balónkovou tamponádu pomocí trojcestné dvoubalónkové Sengstakenovy‑Blakemorovy sondy lze ke kompresi krvácejícího jícnového varixu použít v případě selhání léčby první linie nebo k zajištění nemocného k transportu k definitivnímu ošetření. Technicky správné zavedení sondy a její následné udržování vyžaduje erudovaný personál a není jednoduché. Tlak v balónku musíme udržovat nad hodnotou předpokládaného tlaku v portální žíle. Správným zavedením a adekvátní insuflací vzduchem lze dosáhnout hemostázy v 60–90 % případů. Po desuflaci je však riziko recidivy krvácení poměrně veliké (až 50 %). Použití sondy je spojeno i s vysokým rizikem komplikací (10–15 %). Hrozí především aspirace, proto je k zajištění dýchacích cest často nutná současná orotracheální intubace. Při technicky nesprávném použití hrozí i lacerace jícnu. Maximální doba insuflace takto zavedené sondy je 12–24 hod. (4–6). Při delším intervalu je vysoké riziko nekrózy jícnu (42).
Jícnový stent
Dedikovaný jícnový stent (SX‑Ella stent Danis®) k zástavě nekontrolovatelného krvácení využívá svou expanzní sílu, kterou komprimuje krvácející varix a působí proti portálnímu tlaku. Tím dochází k zástavě krvácení. Jeho zavedení během současné terapeutické endoskopie je díky speciálnímu zavaděči poměrně snadné. Zástavu krvácení dosahuje v 90–100 % (43, 44). Uváděné komplikace jsou poměrně málo závažné. Nejčastěji se jedná o migraci stentu a otlakové ulcerace při horním a dolní okraji hrdla stentu (43–45). Na základě dosud publikovaných dat je použití dedikovaného jícnového stentu lepší metodou v porovnání s balónkovou sondou, zejména z důvodu menšího výskytu komplikací (4, 46).
Záchranný TIPS
Transjugulární intrahepatální portosystémová spojka (TIPS), jako side to side portosystémová anastomóza, nejlépe pomocí ePTFE potaženého stentu, je preferenčně indikována při selhání metod první linie jako definitivní terapeutické řešení (2–4). Kombinace snížení portálního tlaku vytvořeným zkratem a endovaskulární uzavření zdroje krvácení tkáňovým lepidlem bez nutnosti operační zátěže vede k okamžité zástavě krvácení u 91–100 % nemocných (47, 48). Třicetidenní recidivy se vyskytují v 7–30 % případů a jsou v převážné většině případů způsobeny akutní okluzí zkratu. Měsíční letalita je popisována mezi 28–55 % a je dána zejména závažností stavu, ve kterém nemocní k vytvoření urgentní spojky přicházejí. Velký význam má urgentní TIPS i u nemocných s krvácením ze žaludečních varixů (48), které hůře reaguje na endoskopickou léčbu a u nemocných s krvácením z portální gastropatie. I TIPS má však své kontraindikace a limitace (49). Jsou dány jak anatomickými poměry, např. přítomností kavernomu portální žíly, tak i celkovou kondicí nemocného. Obzvláště u nemocných s významnou jaterní insuficiencí (Child‑Pugh skóre > 13) je úmrtnost po výkonu extrémní a TIPS u nich indikován není (2–4, 49). V tomto případě je možné indikovat zavedení jícnového stentu a dále pečlivě aplikovat metody první linie (3, 4). Prognóza těchto nemocných je ale vysoce nepříznivá.
Primární a sekundární prevence
Základní snahou při péči o nemocné s portální hypertenzí je, aby k atace krvácení nebo její recidivě nedošlo. Samozřejmou součástí je terapie základního onemocnění, která riziko dekompenzace a krvácení signifikantně ovlivňuje (4). Zásadní je řádná dispenzarizace nemocných a preventivní léčba. Horní endoskopie je u nemocných s jaterní cirhózou indikována vždy v době diagnózy. Intervaly dalších dispenzárních endoskopií by se měly řídit nejen předchozím endoskopickým nálezem, ale i stavem a kompenzací základního jaterního onemocnění (2–4).
Primární prevence
Léčebnou intervencí se u nemocného s portální hypertenzí snažíme, aby k varikóznímu krvácení (primární prevence) nebo v ideálním případě ani k rozvoji varixů (preprimární prevence) nedošlo nebo aby riziko příhody bylo alespoň sníženo. Účinná je farmakologická léčba neselektivními betablokátory i endoskopická eradikace varixů ligací. Volba jednoho nebo druhého léčebného postupu je do značné míry na domluvě mezi lékařem a pacientem, samozřejmě s ohledem na možné kontraindikace a přidružené choroby (3). Oba přístupy přinášejí srovnatelné výsledky z pohledu přežívání nemocných (50, 51). V prevenci krvácení je mírně účinnější endoskopická léčba (50). Z pohledu přežívání je tento rozdíl vyvážen pravděpodobně komplexními účinky NSBB (52). Pro kombinaci obou metod v primární prevenci nejsou relevantní data, ale v případě nemocného ve vysokém riziku první ataky ji můžeme zvážit.
Neselektivní betablokátory snižují HVPG snížením minutového srdečního výdeje a pravděpodobně i přímým působením na splanchnickou cirkulaci (53, 54). V hemodynamických studiích byl s pozitivním výsledkem na snížení HVPG testován efekt propanololu, nadololu, timololu, mepindololu a karvedilolu (52). Největší množství dat pochází ze studií s propranololem. Jako nejúčinnější na snížení portálního tlaku se dnes považuje karvedilol, neselektivní betablokátor působící i jako α1-antagonista (52, 55), který je účinnější i u vyššího procenta nemocných než propranolol (31 % vs. 43 %) (52). Jako další prospěšný efekt karvedilolu je popisován jeho antioxidační, antifibrotický a protizánětlivý účinek (56–58). Použití karvedilolu v klinické praxi je v porovnání s propranololem ale spojeno s vyšším rizikem nežádoucích účinků (59). Proto je doporučováno začít léčbu nízkou iniciální dávkou, 3,125 mg 2× denně a je doporučeno dávku zvyšovat velmi pozvolna dle tolerance s cílovou dávkou 6,25 mg 2× denně.
V klinické praxi se v indikaci betablokátoru řídíme jak pokročilostí jaterního onemocnění, přidruženými chorobami, snášenlivostí, tak i aktuálním endoskopickým nálezem.
U nemocných bez varixů (preprimární prevence) jsou názory na podání neselektivního betablokátoru rozporuplné a plošné podávání v současné době doporučeno není (2–4). U nemocných s malými varixy (F1) ještě bez přítomnosti dalších rizikových faktorů (červené známky na varixech, stadium C dle Child‑Pugh klasifikace) je benefit z profylaktické léčby neselektivním betablokátorem z části dokumentován a v současné době je akceptován jako spíše prospěšný (2–4). K terapii neselektivním betablokátorem jsou ale jednoznačně indikovaní nemocní s malými varixy a přítomností varovných známek na varixech nebo patřící do skupiny C dle Child‑Pugh klasifikace.
U nemocných se signifikantními varixy (F2–F3) je v současné době podávání neselektivního betablokátoru standardem. Léčba vede ke snížení rizika krvácení i snížení úmrtnosti (60). V případě použití propranololu je možným a částečným ukazatelem efektivnosti léčby dosažení bazální srdeční frekvence 55 pulzů za minutu či snížení klidové frekvence o 20 % proti vstupním hodnotám (3). U terapie karvedilolem tyto parametry přínosné nejsou. V případě plošné dostupnosti měření portosystémového gradientu (HVPG) by optimálním přístupem byla řízená terapie s ověřením efektu léčby invazivním měřením. Základním ukazatelem odpovědi na léčbu je průkaz poklesu HVPG pod 12 mm Hg nebo snížení alespoň o 20 % proti výchozím hodnotám. Poměrně velká část nemocných, to je 46–75 % podle zvoleného preparátu, ale na podání betablokátoru poklesem HVPG neodpoví (4–6, 60, 61). Vzhledem k vysokému výskytu nežádoucích účinků je problematická i spolupráce nemocných a adekvátní edukace hraje zásadní úlohu.
Endoskopická eradikace jícnových varixů ligací je jako alternativa k farmakoterapii indikována dle volby nemocného a lékaře nebo u nemocných s kontraindikací či intolerancí farmakoterapie a při jejím selhání. Data ukazují, že použití ligace snižuje riziko krvácení v průměru o 64 % (NNT 4), úmrtnost na krvácení o 80 % (NNT 7) i úmrtnost celkovou (NNT 5) (62). V metaanalýzách v porovnání s farmakoterapií je pak stejně efektivní ve snížení letality a spíše efektivnější ve snížení rizika krvácení (50) za cenu vyššího rizika závažnějších komplikací (4).
Sekundární prevence
Po první epizodě krvácení jsou nemocní v horizontu 2 let vystaveni riziku recidivy krvácení v 60–63 % (63). Sekundární prevence má být proto zahájena hned po zvládnutí akutní ataky. V sekundární prevenci se uplatňuje TIPS, endoskopická léčba i léčba neselektivním betablokátorem.
Časný TIPS
Indikace k časnému TIPS provedenému do 72 hod. od ataky krvácení by měla být s respektem ke kontraindikacím TIPSu racionálně zvážena u všech nemocných s vysokým rizikem recidivy krvácení. To jsou nemocní ve skupině C dle Childovy‑Pughovy klasifikace, případně ve skupině B s aktivním krvácením v době endoskopie navzdory současně podávané vazoaktivní terapii (2, 4). Toto doporučení se zakládá na datech prokazujících vysoké riziko recidivy krvácení u nemocných s vysokým portosystémovým gradientem a u nemocných s pokročilejším jaterním onemocněním. Za významné riziko je považován portosysténový gradient (HVPG) > 20 mm Hg naměřený do 72 hod. po atace krvácení. Časné snížení gradientu pomocí TIPS (do 72 hod.) v této podskupině nemocných vede k signifikantnímu snížení rizika recidivy krvácení a snížení jak časné tak roční úmrtnosti (64). V posledních 10 letech byly ve 2 multicentrických studiích jako rizikové podskupiny definovaní nemocí s krvácením ve funkční třídě Child‑Pugh C nebo nemocní Child‑Pugh B se současným aktivním krvácením v době endoskopie (65, 66). I u těchto nemocných byl prokázán pozitivní efekt časného TIPS‑u (s potahem z ePTFE) se zlepšeným přežíváním nemocných v horizontu 6 týdnů (97 % vs. 67 %, NNT 3,3) i jednoho roku (86 % vs. 61 %, NNT 4,0) (65) v porovnání s kombinovanou endoskopickou léčbou a léčbou NSBB. Je třeba ale zdůraznit, že těchto výsledků bylo dosaženo ve vysoce selektované skupině nemocných (65, 66). Indikace časného TIPS‑u je od roku 2010 (6) ve většině terciálních evropských centrech akceptována (2, 4).
V případě, že nemocný není kandidátem časného TIPS‑u, zahájíme sekundární profylaxi farmakoterapií neselektivním betablokátorem (karvedilol, propranolol, nadolol) v kombinaci s endoskopickou eradikací jícnových varixů (2–6).
Kombinovaná léčba
Farmakoterapie neselektivním betablokátorem v sekundární prevenci snižuje riziko recidivy krvácení v průměru z 60–63 % na 42 % spolu se signifikantním snížením letality (z 27 % na 20 %) (67). Optimální je kombinace s endoskopickou ligací jícnových varixů (67, 68). V případě, že nemocný nemůže být současně léčen betablokátorem, není dnes endoskopická léčba jako monoterapie doporučována (2, 4). V tomto případě by měla být na základě endoskopického nálezu, kdy není dosaženo eradikace varixů a dle pokročilosti jaterního onemocnění, zvážena indikace k TIPS (4). U nemocných ve skupině A a B dle Childa a Pugha případně posoudit možnost indikace k chirurgické portosystémové spojce (5, 6). U všech nemocných je také vždy nutné podle pokročilosti jaterního onemocnění zvážit transplantaci jater.
Problematická je skupina s pokročilejším jaterním onemocněním ve skupině Child‑Pugh B a C, zejména pak nemocní s refrakterním ascitem. Objevuje se stále více prací prokazujících u těchto nemocných i negativní efekt betablokátoru s rizikem zhoršení oběhových parametrů a zkráceným přežíváním (69–72). V případě, že je v rámci sekundární prevence indikována terapie NSBB, je u nemocných s refrakterním ascitem nutné velmi pečlivé monitorování hodnot krevního tlaku, sérového sodíku, kreatininu a v případě horšení těchto parametrů včas dávku betablokátoru redukovat, nebo léčbu NSBB ukončit (2, 4). V tomto případě by měla být opět primárně zvážena zejména indikace k transplantaci jater a u nemocných, kteří kandidáty nejsou pak indikace k TIPS‑u.
Žaludeční varixy
Žaludeční varixy se tvoří u 5–33 % nemocných s portální hypertenzí a zdrojem krvácení jsou v 5–10 % (25% riziko krvácení v horizontu 2 let) (73). U žaludečních varixů má prognostický význam kromě rozlišení velikosti varixu, pokročilosti jaterního onemocnění (Childova‑Pughova klasifikace) a přítomnosti varovných známek také lokalizace varixu (74, 75). K jejich popisu je v současné době nejčastěji užívána klasifikace dle Sarina (75) (Tab. 3). Z prognostického hlediska jsou nejzávažnějším nálezem izolované gastrické varixy v oblasti žaludečního fundu (IGV 2. typu), které jsou zdrojem krvácení z varixů žaludku až v 78 % (74, 76).
Tab. 3. Klasifikace žaludečních varixů dle Sarina, relativní výskyt, riziko krvácení (2, 75, 76) 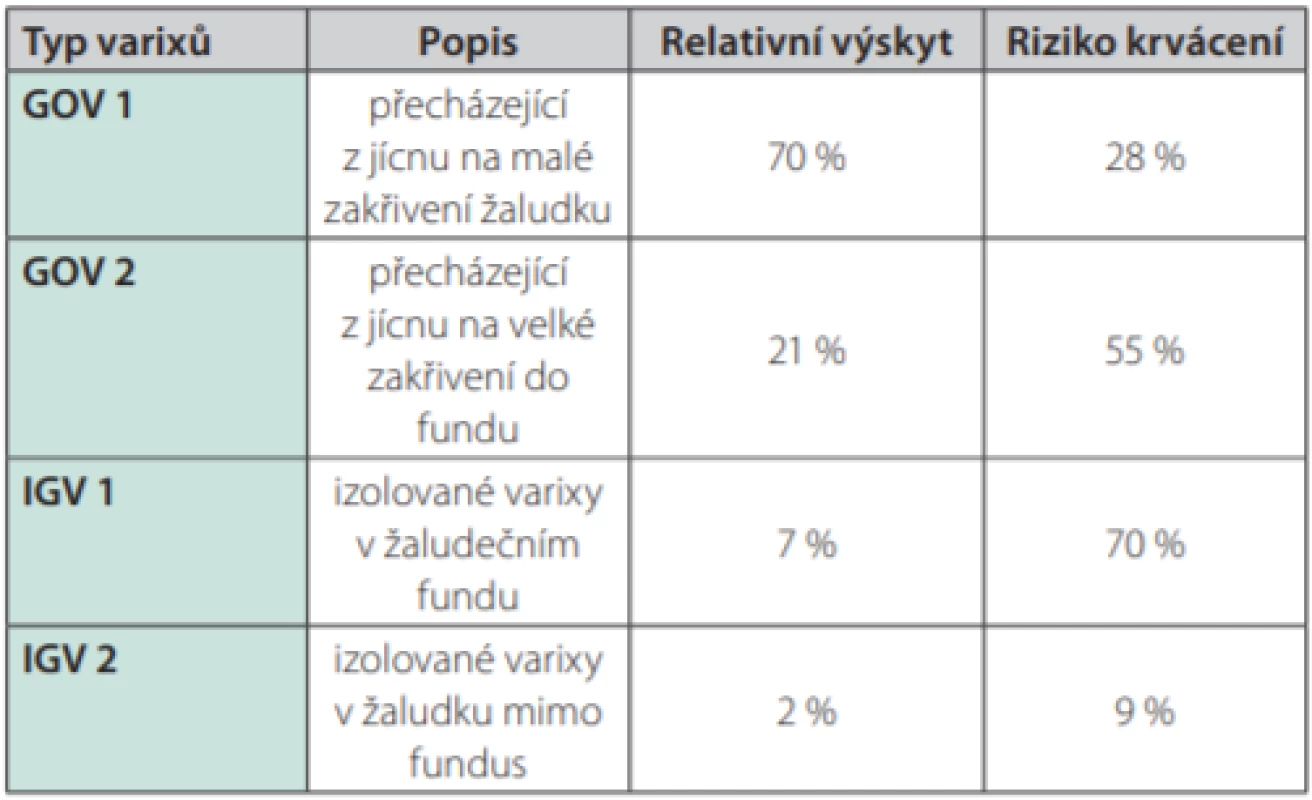
Léčba akutní ataky krvácení
V případě akutního krvácení z varixu žaludku je základní léčba včetně farmakoterapie identická jako u krvácení z varixů jícnových. Odlišná je léčba endoskopická, při které je za metodu volby u gastroezofagealních varixů 2. typu (GOV 2) a izolovaných žaludečních varixů (IGV) považováno použití okluze krvácejícího varixu syntetickým nebo přirozeným tkáňovým lepidlem (2, 4–6). Nejlépe zdokumentovaný efekt je při užití syntetického N‑butyl-2‑cyanoakrylátu (Histoacryl®) (77, 78). U gastroezofageálních varixů 1. typu (GOV 1) lze provést i ligaci. Použití jiných hemostatických metod, jako hemoklipů, polidokanolu, nebo endoloopu, není podpořeno dostatečnými daty.
Jako záchrannou léčbu nelze z podstaty problému použít dedikovaných jícnový stent nebo klasickou Blakemorovu‑Sengstakenovu balónkovou sondu, ale pouze sondu jednobalónkovou (Lintonova Nichlasova) s kompresí žaludečního fundu. V případě selhání léčby je indikován TIPS (2, 5, 79).
Primární a sekundární prevence
Doporučené postupy pro primární a sekundární prevenci jsou v případě žaludečních varixů založeny na méně obsáhlých důkazech než u varixů jícnových.
U GOV varixů 1. typu v primární prevenci můžeme volit mezi léčbou betablokátorem a léčbou endoskopickou. Po endoskopické léčbě jícnových varixů dochází v určitém procentu k vymizení často asociovaných GOV 1. typu (30–60 %) a GOV 2. typu (20 %). Proto je při souběhu těchto nálezů doporučováno začít eradikací varixů jícnových a v léčbě varixů žaludečních pokračovat až tehdy, pokud po 6 týdnech od ošetření nedojde k jejich vymizení. V sekundární prevenci volíme mezi farmakoterapií a endoskopií nebo TIPS (2–4, 6).
V případě GOV 2. typu a IGV v primární prevenci můžeme volit mezi léčbou endoskopickou s aplikací tkáňového lepidla a léčbou neselektivním betablokátorem (4). Existují povzbudivá data preferující endoskopický přístup, ale zatím nejsou přijata v obecných doporučeních (4). V sekundární prevenci je doporučováno zavedení TIPS, obvykle s endovaskulární obliterací varixů nebo pokračování v endoskopické eradikaci aplikací tkáňového lepidla (4). S ohledem na pokročilost jaterního onemocnění je třeba vždy zvažovat i možnost jaterní transplantace.
Rektální varixy
Portosystémové kolaterály v oblasti rekta jsou poměrně často opomíjeny a v různých sestavách nemocných je výskyt popisován od 3,6 % do 78 % (5). Nepatří k častým zdrojům krvácení, jsou ale popisovány i ataky masivního život ohrožujícího krvácení.
Rektální varixy jsou zásobovány z dolní mezenterické žíly cestou horní či střední rektální žíly do povodí vnitřní ilické žíly. Léčebná strategie není stále jednotná. V léčbě akutního krvácení byla s úspěchem použita léčba sklerotizační i endoskopická ligace. V případě nestavitelného krvácení je zde opět indikace k TIPS (4).
Ektopické varixy
Novotvoření varixů v oblasti neostomat trávicí trubice je poměrně časté a může být zdrojem fatálního krvácení. Při indikacích těchto operačních zákroků je třeba na toto riziko pomýšlet.
Poměrně často nalézáme u nemocných s portální hypertenzí i změny v tračníku ve formě portální kolopatie s podslizničními angiektaziemi či ektopickými varixy. Zdrojem hemodynamicky významného krvácení jsou však v nízkém procentu.
S novými vyšetřovacími metodami jsou stále častěji u nemocných s portální hypertenzí popisovány i varixy v tenkém střevě. V případě krvácení jsou tito nemocní kandidáty TIPS nebo chirurgické portokavální spojky. S přímým endoskopickým ošetřením nejsou v současné době dostatečné zkušenosti.
Portální hypertenzní gastropatie
Portální hypertenzní gastropatie (PHG) je chorobný stav vznikající na podkladě portální hypertenze a projevuje se typickým endoskopickým a histologickým nálezem v oblasti sliznice žaludečního těla a antra. Během endoskopie nalézáme typickou mozaikovou strukturu (políčkování) sliznice, v těžších případech až s tvorbou červených skvrn a slizničním krvácením. Tento makroskopický obraz není zcela specifický pouze pro portální hypertenzi a zejména musíme odlišit někdy podobné slizniční změny při gastrické antrální vaskulární ektazii (GAVE).
Portální hypertenzní gastropatii nalézáme u 11–80 % nemocných a poměrně těsně koreluje se závažností portální hypertenze. Není asociována s infekcí Helicobacter pylori. Riziko akutního krvácení je poměrně nízké (do 3 % v horizontu 3 let), ale velice často je příčinou chronických krevních ztrát.
V případě hemodynamicky významného krvácení je léčba identická jako u nemocných s krvácením z jícnových varixů vyjma endoskopické terapie a užití balonkové sondy (3, 4). V sekundární prevenci se též uplatňují neselektivní betablokátory.
Krvácení při prehepatální portální hypertenzi
Prehepatální portální hypertenze je méně častou příčinou tvorby portosystémových kolaterál (5–10 %). V současnosti rozlišujeme zejména extrahepatální obstrukci portální žíly (EHPVO), kdy je okluze lokalizována pouze v oblasti kmene portální žíly, a stavy další, ke kterým patří zejména segmentální portální hypertenze při obstrukci slezinné žíly.
Léčba se v základních principech neliší od nemocných s krvácením na podkladě jaterní cirhózy, i když data pro farmakologickou léčbu vazoaktivními látkami (terlipresin, somatostatin, oktreotid) jsou poměrně chudá. V doporučeních se tedy vychází jen z bohatých zkušeností s terapií varikózního krvácení provázejícího jaterní cirhózu (4–6). Taktéž endoskopická léčba akutní ataky se nikterak neliší. V sekundární prevenci (riziko recidivy krvácení je popisováno 0,11 epizody/měsíc po první atace) je užití betablokátoru vzhledem k nedostatku randomizovaných studií s určitým otazníkem, ale obecně je akceptováno. Za léčbu volby je tedy považována kombinace endoskopické eradikace (ligace) varixů a podávání NSBB. V primární prevenci je preferována spíše endoskopická ligace než dlouhodobé podávání betablokátoru i z určité obavy z dalšího snížení jaterní perfuze a prohloubení ischemického inzultu. U nemocných, u nichž selhává endoskopická terapie, a stejně tak u dětí s poruchou růstu, symptomatickou portální biliopatií či symptomatickým hypersplenismem je plně indikováno chirurgické řešení pomocí portokavální nebo portoportální spojky.
Data pro užití antikoagulační terapie při chronických stavech jsou opět poměrně chudá a kontroverzní.
V případě akutní trombózy je však nutné volit aktivní přístup s terapií nízkomolekulárním heparinem a kumariny. Jsou popisovány i sestavy úspěšného užití lokální trombolytické terapie se zavedením katétru transhepatální cestou, zejména v případě současných známek střevní infarzace. Obdobně byl popsán u nemocných s akutní trombózou kmene portální žíly uspokojivý efekt TIPS se zprůchodněním portální žíly a následnou antikoagulační terapií.
V případě izolované trombózy lienální žíly, kdy kmen portální žíly není postižen, hovoříme někdy o takzvané levostranné nebo segmentální portální hypertenzi (LPH). Tento stav je nejčastěji spojen s onemocněním pankreatu, akutní nebo chronickou pankreatitidou nebo karcinomem pankreatu. Asociovanou trombózu lze u těchto onemocnění nalézt v 7–20 % případů. Jistě vzácnější příčinou tohoto stavu mohou být předchozí operační zákroky (resekce žaludku, výkony v oblasti omentální burzy), retroperitoneální fibróza či lymfomová infiltrace.
Diferenciální diagnostika je založena na US a CT vyšetření. Při endoskopii nalézáme převážně varixy žaludeční, plněné z malých gastrických žil. Nejčastějším nálezem jsou IGV 1. a 2. typu. Riziko krvácení je u těchto nemocných v porovnání s pacienty s jaterní cirhózou poněkud nižší (4–5 % nemocných), avšak krvácení je stejně závažné.
Léčba akutní ataky krvácení se opět nikterak neliší od nemocných s portální hypertenzí při jaterní cirhóze či EHPVO. Chirurgické řešení (splenektomie, pankreatektomie) je indikováno u nemocných se symptomatickou chronickou pankreatitidou a asymptomatickou LPH, či naopak u pacientů s asymptomatickou pankreatitidou a symptomatickou LPH. Asymptomatičtí nemocní by měli být pravidelně sledováni.
Závěr
Krvácení na podkladě portální hypertenze stále patří k závažným a život ohrožujícím stavům. Léčba by v současnosti měla probíhat v souladu s aktuálními doporučeními. Je založena na multidisciplinárním přístupu a sestává zejména ze zajištění a stabilizace nemocného, podání volumexpanze, vazoaktivní léčby, širokospektrého antibiotika a endoskopické léčby. V případě selhání je indikováno použití dedikovaného jícnového stentu, balónkové tamponády nebo TIPS. V prevenci se uplatňuje léčba neselektivním betablokátorem a endoskopická léčba. U nemocných s jaterní cirhózou je vždy třeba zvažovat možnosti transplantace jater.
Souhrn současných doporučení pro léčbu akutního krvácení a prevenci (2–4)
Terapie akutního krvácení
- Zajištění cévních vstupů, komplexní péče o nemocného na lůžku intenzivní péče. Vyhodnocení závažnosti krvácení, pokročilosti jaterního onemocnění a dalších rizikových faktorů. Volumexpanze, hemosubstituce (na hodnoty Hb 70–80 g/l)
- Vazoaktivní léčba (celková doba podání 5 dnů):
- terlipresin 1–2 mg i.v. à 4 hod. (2 mg à 4 hod. prvních 48 hod.) nebo
- somatostatin: 250 μg bolus i.v. a dále kontinuálně 250–500 μg/ hod. i.v. nebo
- oktreotid: 50 μg bolus i.v. a dále kontinuálně 25–50 μg/hod. i.v.
- Podání širokospektrého antibiotika (ceftriaxone, chinolony)
- Endoskopické ošetření nejpozději do 6–12 hod. od přijetí
- jícnové varixy: preferenčně ligace, při technických potížích sklerotizace
- žaludeční varixy: GOV 2 a IGV: N‑butyl‑cyanoakrylát GOV 1: ligace nebo N‑butyl‑cyanoakrylát
- Terapie manifestní jaterní encefalopatie
Selhání léčby
Jícnové varixy
- Záchranná léčba:
- dedikovaný jícnový stent (Danis) nebo
- balónková tamponáda (max.12–24 hod.) jako most k dalšímu ošetření
- TIPS (ePTFE) Při časné recidivě (do 5 dnů): opakování endoskopického ošetření
- u rizikových nemocných TIPS (ePTFE)
Žaludeční varixy
- Záchranná léčba
- TIPS (ePTFE)
Sekundární prevence
Jícnové varixy
- Nemocný s vysokým rizikem (Child‑Pugh C nebo Child‑Pugh B s aktivním krvácením v době endoskopie):
- zvážení časného TIPS (ePTFE) do 72 hod. od ataky krvácení
- Nemocný s nižším rizikem:
- zahájení co nejdříve po atace krvácení
- kombinovaná léčba NSBB + eradikace endoskopickou ligací
- Pokud nelze podávat NSBB (nesnášenlivost, kontraindikace): TIPS, OLTx, u nemocných Child‑Pugh A a B ke zvážení chirurgická portosystémová spojka
Žaludeční varixy
- Nemocný s vysokým rizikem (Child‑Pugh C nebo Child‑Pugh B s aktivním krvácením v době endoskopie):
- zvážení časného TIPS (ePTFE) do 72 hod. od ataky krvácení
- Nemocný s nižším rizikem:
- IGV nebo GOV 2: endoskopická eradikace (N‑butyl‑cyanoakrylát) + NSBB nebo TIPS (ePTFE)
- GOV 1: NSBB + endoskopická ligace, nebo syntetické tkáňové lepidlo (N‑butyl‑cyanoakrylát)
- Při selhání sekundární prevence: TIPS (ePTFE), OLTx, u nemocných Child‑Pugh A a B ke zvážení chirurgická portosystémová spojka
Primární prevence
Jícnové varixy
- Nemocný bez varixů: sledování
- Malé (F1 varixy): možná léčba NSBB
- F2 a F3 varixy a F1 + varovné známky nebo Child‑Pugh C: NSBB nebo endoskopická eradikace varixů ligací
Žaludeční varixy
- GOV 2 a IGV:NSBB (karvedilol, propranolol) nebo endoskopická eradikace aplikací N‑butyl-2‑cyanoakrylátu
- GOV 1: možná navíc endoskopická ligace
Zkratky
- HVPG – hepatic venous pressure gradient, rozdíl mezi volným a zaklíněným tlakem v jaterní žíle
- SBP – spontánní bakteriální peritonitida
- TIPS – transjugulární intrahepatální portosystémová spojka
- NSBB – neselektivní betablokátory
- EVL – endoscopic variceal ligation – endoskopická ligace varixů
- ePTFE – expandovaný polytetrafluoroethylén (stent potažený ePTFE)
- NNT – number needed to treat – potřebný počet léčených pacientů
- HTK – hematokrit
- Hb – hemoglobin
- SVR – setrvalá virologická odpověď
- NIEC – North Italian Endoscopic Club
- LPH – levostranná portální hypertenze
KORESPONDENČNÍ ADRESA AUTORA:MUDr. Tomáš Fejfar, Ph.D.,II. interní gastroenterologická klinika LF UK a FN,Sokolská tř. 581,500 05 Hradec KrálovéCit. zkr: Vnitř Lék 2020; 66(2): e7–e16Článek přijat redakcí: 30. 10. 2018Článek přijat k publikaci: 17. 4. 2019
Zdroje
1. Šafka V. Portální hypertenze, patofyziologie portální hypertenze In: Hůlek P, Urbánek P (eds.). Hepatologie, 3. vydání. Praha: Grada 2018, 180–181.
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69 : 406–460.
3. Fejfar T, Vaňásek T, Brůha R, et al. Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze - aktualizace doporučených postupů ČHS ČLS JEP. Gastroent Hepatol 2017; 71 : 105–116.
4. De Franchis R, Baveno VI. Faculty Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol 2015 ;63 : 743–752.
5. De Francis R et al. Portal hypertension IV: Proceedings of the Fourth Baveno International Konsensus Workshop. Blackwell Publishing Ltd., 2006.
6. De Franchis R, et al. Portal Hypertension V: Proceedings of the Fifth Baveno International Consensus Workshop, 5th Edition. Wiley-Blackwell press. London; 2011.
7. North Italian Endoscopic Club for Study and Treatment of Esophageal Varices. Prediction of the first variceal haemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicentre study. N Engl J Med 1988; 319 : 983.
8. D’Amico G, Pasta L, Morabito A et al. Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients. Aliment Pharmacol Ther 2014; 39 : 1180–1193.
9. Augustin S, Muntaner L, Altamirano JT, et al. Predicting early mortality after acute variceal hemorrhage based on classification and regression tree analysis. Clin Gastroenterol Hepatol 2009; 7 : 1347–1354.
10. Carbonell N, Pauwels A. Sarfaty L, et al. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology 2004; 40 : 652–659.
11. Villanueva C, Colomo A, Bosch et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013; 368 : 11–21.
12. Bosch J, Thabut D, Albillos A et al. Recombinant factor VIIa for variceal bleeding in patients with advanced cirrhosis: A randomised, controlled trial. Hepatology 2008; 47 : 1604–1614.
13. Bendtsen F, D´Amico G, Rusch E, et al. Effect of recombinant Factor VIIa on outcome of acute variceal bleeding: an individual patient based meta-analysis of two controlled trials. J Hepatol 2014; 61 : 252–259.
14. Goulis J, Armonis A, Patch D, et al. Bacterial infection is independently associated with failure to control bleeding in cirrhotic patients with gastrointestinal hemorrhage. Hepatology 1998; 27 : 1207–1212.
15. Bernard B, Grange JD, Khac EN, et al. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology 1999; 29 : 1655–1661.
16. Soares-Weiser K, Brezis M, Tur-Kaspa R, et al. Antibiotic prophylaxis for cirrhotic patients with gastrointestinal bleeding. Cochrane Database Syst Rev 2002; 2: CD002907.
17. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev 2010; 8: CD002907.
18. Hůlek P, Krajina A (eds.). Current Practice of TIPS. Hradec Králové: Published by Olga Štambergová 2001
19. Brůha R, Mareček Z, Procházka V, et al. Double-Blind Randomized Multicenter Study Comparing the Efficacy and Safety of 10-Day to 5.Day Terlipressin Treatment of Bleeding Esophageal Varices. Hepato-Gastroenterology 2009; 56 : 390–394.
20. Merkel C, Gatta A, Bolognesi M, et al. Hemodynamic changes of systemic, hepatic and splenic circulation following triglycyl-lysin-vasopressin administration in alcoholic cirrhosis. Dig Dis Sci 1988; 33 : 1103–1109.
21. Møller S, Hansen EF, Becker U, et al. Central and systemic haemodynamic effect of terlipressin in portal hypertensive patients. Liver 2000; 20 : 51–59.
22. Ioannou G, Doust J, Rockey DC. Terlipressin for acute esophageal variceal hemorrhage. Cochrane Database Syst Rev 2003; 1: CD002147.
23. Wells M, Chande N, Adams P. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012; 35 : 1267–1278.
24. Yim SY, Seo YS, Jung CH, et al. Risk Factors for Developing Hyponatremia During Terlipressin Treatment: A Retrospective Analyses in Variceal Bleeding. J Clin Gastroenterol 2015; 49 : 607–612.
25. Cirera I, Feu F, Luca A, et al. Effects of bolus injections and continuous infusions of somatostatin and placebo in patients with cirrhosis: a double-blind hemodynamic investigation. Hepatology 1995; 22 : 106–111.
26. Moitinho E, Planas R, Banares R et al. Multicenter randomised controlled trial comparing different schedules of somatostatin in the treatment of acute variceal bleeding. J Hepatol 2001; 35 : 712–718.
27. Vilanueva C, Planella M, Arycil C, et al. Hemodynamic effects of terlipressin and high somatostatin dose during acute variceal bleeding in nonresponders to the usual somatostatin dose. Am J Gastroenterol 2005; 100 : 624–630.
28. Seo YS, Park SY, Kim MY, et al. Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Hepatology 2014; 60 : 954–963.
29. Svoboda P, Konečný M, Martínek A, et al. Acute upper gastrointestinal bleeding in liver cirrhosis patients. Biomedical Papers 2012; 165 : 266–270.
30. D'Amico G, Pietrosi G, Tarantino I, et al. Emergency sclerotherapy versus vasoactive drugs for variceal bleeding in cirrhosis: a Cochrane meta-analysis. Gastroenterology 2003; 124 : 1277–1291.
31. D’Amico G, Pagliaro L, Pietrosi G, et al. Emergency sclerotherapy versus vasoactive drugs for variceal bleeding in cirrhotic patients: a Cochrane meta-analysis. Cochrane Database Syst Rev 2010; 3: CD002233.
32. Gralnek IM, Dumonceau JM, Kuipers JE, et al. Diagnosis and management of nonvariceal uppergastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47 : 1–46.
33. Lo GH, Lai KH, Cheng JS, et al. Emergency banding ligation versus sclerotherapy for the control of active bleeding from esophageal varices. Hepatology 1997; 25 : 1101–1104.
34. Villanueva C, Piqueras M, Aracil C, at al. A randomized controlled trial comparing ligation and sclerotherapy as emergency endoscopic treatment added to somatostatin in acute variceal bleeding. J Hepatol 2006; 45 : 560–567.
35. Vaňásek T. Endoskopické diagnostické a terapeutické metody. In: Hepatologie, 1. vydání. Praha: Grada Publishing 2010, 88–99.
36. American Association for the Study of Liver Diseases; European Association for the Study of the Liver. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. J Hepatol 2014; 61 : 642–659.
37. Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014; 60 : 715–735.
38. Banares R, Albilos A, Rincon D, et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis. Hepatology 2002; 35 : 609–615.
39. Abraldes JG, Vilanueva C, Banares R, et al. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48 : 229–236.
40. D´Amico G, de Franchis R. Upper digestive bleeding in cirrhosis. Posttherapeutic outcome and prognostic indicators. Hepatology 2003; 38 : 599–612.
41. Cardenas A, Gines P, Uritz J, et al. Renal failure after upper gastrointestinal bleeding in cirrhosis: incidence, clinical course, predictive factors and short-term prognosis. Hepatology 2001; 34 : 671–676.
42. Avgerinos A, Armonis A. Balloon tamponade technique and efficacy in variceal haemorrhage. Scand J Gastroenterol 1994; 29: (Suppl. 207): 11–16.
43. Zehetner J, Shamiyeh A, Wayand W, et al. Results of a new method to stop acute bleeding from esophageal varices: implantation of a self-expanding stent. Surg Endosc 2008; 22 : 149–152.
44. Wright G, Lewis H, Hogan B, et al. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center. Gastrointest Endosc 2010; 71 : 71–78.
45. Fejfar T, Šafka V, Jirkovský V, et al. Danišův jícnový stent v terapii varikózního krvácení. Gastroent Hepatol 2013; 67 : 98–103.
46. Escorsell À, Pavel O, Cárdenas A, et al Variceal Bleeding Study Group. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: A multicenter randomized, controlled trial. Hepatology 2016; 63 : 1957–1967.
47. Sanyal AJ, Freedman AM, Luketic VA, et al. Transjuglar intrahepatic portosystemic shunts for patients with active variceal hemorrhage unresponsive to sclerotherapy. Gastroenterology 1996; 111 : 138–146.
48. Chau TN, Patch D, Chan YW, et al. “Salvage“ transjugular intrahepatic portosystemic shunts: gastric fundal compared with esophageal variceal bleeding. Gastroenterology 1998; 114 : 981–987.
49. Krajina A, Hulek P, Fejfar T, et al. Quality improvement guidelines for Transjugular Intrahepatic Portosystemic shunt (TIPS). Cardiovasc Intervent Radiol 2012; 35 : 1295–1300.
50. Gluud LL, Krag A Banding ligation versus beta-blockers for primary prevention of oesophageal verices in adults. Cochrane Database Syst Rev 2012; 8: CD004544.
51. Drastich P, Lata J, Petrtýl J, et al. Endoscopic variceal band ligation compared with propranolol for prophylaxis of first variceal bleeding. Annals of Hepatology 2011; 10 : 142–149.
52. Tripathi D, Hayes PC. Beta-blockers in portal hypertension: new developments and controversies. Liv Intern 2014; 34 : 655–667.
53. Ohnishi K, Nakayama T, Saito M et al. Effects of propranolol on portal hemodynamics in patients with chronic liver disease. Am J Gastroenterol 1985; 80 : 132–135.
54. Mastai R, Bosch J, Navasa M, et al. Effects of alpha-adrenergic stimulation and beta -adrenergic blockade on azygos blood flow and splanchnic haemodynamics in patients with cirrhosis. J Hepatol 1987; 4 : 71–79.
55. Sinagra E, Perricone G, D´Amico M, et. al. Systematic review with meta-analysis: the haemodynamic effects of carvedilol compared with propranolol for portal hypertension in cirrhosis. Aliment Pharmacol Ther 2014; 39 : 557–568.
56. Akbas H, Ozden M, Kanko M, et al. Protective antioxidant effects of carvedilol in a rat model of ischaemia-reperfusion injury. J Int Med Res 2005; 33 : 528–536.
57. Hamdy N, Demerdash E. New therapeutic aspect for carvedilol: antifibrotic effects of carvedilol in chronic carbon tetrachloride-induced liver damage. Toxicol Appl Pharmacol 2012; 261 : 292–299.
58. Bakris GL, Fonseca V, Katholi RE, et al. Metabolic effects of carvedilol vs metoprolol in patients with type 2 diabetes mellitus and hypertension: a randomized controlled trial. JAMA 2004; 292 : 2227–2236.
59. Lo GH, Chen WC, Wang HM, et al. Randomized controlled trial of carvedilol versus nadolol plus isosorbide mononitrate for the prevention of variceal rebleeding. J Gastroentol Hepatol 2012; 27 : 1681–1687.
60. Vlachogiannakos J, Goulis J, Patch D, et al. Review article: primary prophylaxis for portal hypertensive bleeding in cirrhosis. Aliment Pharmacol Ther 2000; 14 : 851–860.
61. Groszmann RJ, Garcia-Tsao G, Bosch J, et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005; 353 : 2254–2261.
62. Imperiale T, Chalasani N. A meta-analysis of endoscopic variceal ligation for primary prophylaxis of esophageal variceal bleeding. Hepatology 2001; 33 : 802–807.
63. Grace N, Lo GH, Nevens F, et al. Preventing rebleeding in 2010. In: De Franchis R et al. Portal Hypertension V: Proceedings of the Fifth Baveno International Consensus Workshop, 5th Edition. Wiley-Blackwell press. London 2044 : 121–131.
64. Monescillo A, Martínez-Lagares F, Ruiz-del-Arbol L, et al. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology 2004; 40 : 793–801.
65. Garcia-Pagán JC, Caca K, Bureau C, et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362 : 2370–2379.
66. Garcia-Pagán JC, Di Pascoli M, Caca K et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol. 2013; 58 : 45–50.
67. Lo GH, Lai KW, Cheng JS, et al. Endoscopic variceal ligation plus nadolol and sucralfate compared with ligation alone for the prevention of variceal rebleeding: a prospective, randomised trial. Hepatology 2000; 32 : 462–465.
68. De la Pena J, Brullet E, Sanchez-Hernández E, et al. Variceal ligation plus nadolol compared with ligation for prophyla for prophylaxis of variceal rebleeding: a multicenter trial. Hepatology 2005; 41 : 572–578.
69. Sersté T, Francoz C, Durand F, et al. Beta-blockers cause paracentesis-induced circulatory dysfunction in patients with cirrhosis and refraktory ascites: a cross-over study. J Hepatol 2011; 55 : 794–799.
70. Sersté T, Melot C, Francoz C, et al. Deleterious effect of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology 2010; 52 : 1017–1022.
71. Krag A, Wiest R, Albillos A, et al. The window hypothesis: haemodynamic and non-haemodynamic effect of beta-blockers improve survival of patients with cirrhosis during a window in the disease. Gut 2012; 61 : 967–969.
72. Ge PS, Runyon BA. The changing role of beta-blocker therapy in patients with cirrhosis. J Hepatol 2014; 60 : 643–653.
73. Garcia-Tsao J, et al. AASLD Practice Guidelines. Prevention and Management of Gastroesophageal Varices and Variceal Hemorrhage in Cirrhosis. Hepatology 2007; 46 : 922–938.
74. Ryan BM, Stockbrugger RW, Ryan JM. A Pathophy¬siologic, Gastroenterologic and radiologic Approach to the Managament of gastric Varices. Gastroenterology 2004; 126 : 1175–1189.
75. Sarin SK, Lahoti D, Saxena SP, et al. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology 1992; 16 : 1343–1349.
76. Sarin SK, Kumar A. Gastric varices: profile, classification and management. Am J Gastroenterol 1989; 84 : 1244–1249.
77. Lo Gh, Lai Kh, Cheng JS, et al. A prospective randomized trial of butyl cyanoacrylate injection versus band ligation in the management of bleeding gastric varices. Hepatology 2001; 33 : 1060–1064.
78. Tan PC, Hou MC, Lin HC, et al. A randomized trial of endoscopic treatment of acute gastric variceal haemorrhage: N-butyl-2-cyanoacrylate injection versus band ligation. Hepatology 2006; 43 : 690–697.
79. Tripathi D, Therapondos G, Jackson E, et al. The role of the transjugular intrahepatic portosystemic stent shunt (TIPSS) in the management of bleeding gastric varices: clinical and haemodynamic correlations. Gut 2002; 51 : 270–274.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Mikroskopická polyangiitídaČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibróza
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Hyperurikemie z perspektivy nefrologického pacienta
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



