-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Uzávěr ouška levé síně systémem AtriClip
Closure of the left atrial appendage by means of the AtriClip System
Introduction:
Atrial fibrillation (AFib) is related to a high risk of stroke. The main role in etiopathogenesis is played by the left atrial appendage (LAA). As many as 95 % of thrombi in nonvalvular atrial fibrillation are located in the appendage. Prevention of stroke then consists in permanent anticoagulation which, however, has its limits and risks. An alternative method is the left atrial appendage occlusion. In our report, we would like to present a new possibility of the closure using the epicardial system AtriClip (AtriCure).Methodology:
In the period beginning in July 2012 – September 2015 we performed LAA closure in 101 patients. A mean age of 65 ± 6 years, 47 women, CHA2DS2 VASc (Ø) 2.47 (0–6). Monitoring 1 837 (Ø 18.5) months. A concomitant procedure was performed in 37 patients, endoscopic MAZE plus clip in 57 patients, and 7 patients underwent stand-alone implantation of the clip. The clip was implanted from full sternotomy, minitoracotomy or through thoracoscopy. Clip loading, residual recess and endoleak were assessed through endoscopic ultrasound according to the Cleveland criteria.Results:
The perioperative success rate of loading reached 98 %. The clip was loaded with a neck greater than 1 cm in 2 patients. No migration of the clip occurred, no endoleak was detected and no thrombus at the appendage base was detected. One case of periprocedural stroke was recorded. Within follow-up monitoring TIA occurred in 4 patients and no stroke was recorded.Conclusion:
Epicardial LAA occlusion using the AtriClip system is a safe and reproducible method of LAA occlusion and an important alternative in the prevention of stroke.Key words:
atrial fibrillation – occlusion of left atrial appendage – stroke
Autoři: Aleš Mokráček 1,2; Vojtěch Kurfirst 1; Alan Bulava 3; Jiří Haniš 3
Působiště autorů: Kardiochirurgické oddělení Nemocnice České Budějovice, a. s. 1; Zdravotně sociální fakulta Jihočeské univerzity České Budějovice 2; Kardiologické oddělení Nemocnice České Budějovice, a. s. 3
Vyšlo v časopise: Vnitř Lék 2017; 63(1): 31-35
Kategorie: Původní práce
Souhrn
Úvod:
Fibrilace síní (FS) je zatížena velkým rizikem cévní mozkové příhody (CMP). Zásadní roli v etiopatognezi hraje ouško (LAA) levé síně (LS). Až 95 % trombů u nevalvulární FS je lokalizováno v oušku. Prevence CMP pak spočívá v trvalé antikoagulaci, která ale má své limity a rizika. Alternativní metodou je okluze ouška LS. V našem sdělení bychom rádi prezentovali novou možnost uzávěru pomocí epikardiálního systému AtriClip (AtriCure).Metodika:
V období od července roku 2012 do září roku 2015 jsme uzavřeli ouško LS u 101 pacientů. Průměrný věk 65 ± 6 let, 47 žen, CHA2DS2 VASc (Ø) 2,47 (0–6). Sledování 1 837 (Ø 18,5) měsíců. Konkomitantní procedura byla provedena u 37 pacientů, endoskopický MAZE plus klip 57 u pacientů a izolovaně byl klip implantován u 7 pacientů. Klip byl naložen z plné sternotomie, minitorakotomie nebo torakoskopicky. Naložení klipu, zbytkový recesus a endoleak byly hodnoceny jícnovým ultrazvukem podle Clevelandských kritérií.Výsledky:
Perioperační úspěšnost naložení byla 98%. Klip byl naložen s více než 1cm krčkem u 2 nemocných. Nedošlo k žádné migraci klipu, nebyl detekován žádný endoleak, nebyl detekován žádný trombus v bázi ouška. Periprocedurálně jsme zaznamenali jednu CMP. V následném sledování se u 4 pacientů objevila TIA a nebyla zaznamenána CMP.Závěr:
Epikardiální okluze ouška LS systémem AtriClip je bezpečná a reprodukovatelná metoda uzávěru ouška LS a mohla by se stát důležitou alternativou v prevenci cévních mozkových příhod.Klíčová slova:
cévní mozková příhoda – fibrilace síní – uzávěr ouška levé síněÚvod
Fibrilace síní (FS) je srdeční arytmie, jejíž incidence neustále narůstá. Největší rizika s ní spojená jsou cévní mozkové příhody (CMP) a rozvoj srdečního selhání (SS). Podle některých dat je riziko CMP u nemocných s FS až 5krát větší než u populace bez fibrilace síní. Nejobvyklejším místem tvorby trombů v levé síni (LS) je pak její ouško [1]. Objem ouška LS je u nemocných s FS zhruba 3krát větší oproti zdravé skupině [2]. Chirurgické odstranění ouška LS je proto podle doporučení ECS/ESCTS indikováno u každého pacienta, který podstupuje chirurgickou léčbu FS. Jedinou podmínkou je, že nedojde k významnému navýšení operačního rizika [3–5].
Zavedenou prevencí tromboembolických (TE) komplikací FS je trvalá antikoagulace. U 14–44 % nemocných je ale trvalá antikoagulace spojena s komplikacemi nebo jinou svízelí [6,7]. V těchto případech je alternativní možností uzávěr ouška LS katetrizační nebo chirurgickou cestou. V naší práci prezentujeme zkušenosti s více než 100 nemocných léčených epikardiálním systémem AtriClip (AtriCure, West Chester, Ohaio, USA).
Materiál a metoda
V období od července roku 2012 do září roku 2015 jsme implantovali systém AtriClip na ouško levé síně celkem u 101 nemocných. Všechny aplikace proběhly pod kontrolou jícnového ultrazvuku (TEE) jednak k vyloučení trombu před aplikací a jednak pro kontrolu krčku a komunikace mezi LS a ouškem po naložení. AtriClip byl nakládán torakoskopicky během hybridní léčby fibrilace síní nebo izolovaně, případě z pravostranné minitorakotomie nebo sternotomií. V první fázi byl použit systém AtriClip a později AtriClip Pro. Rozdíl je pouze v zaváděcím systému, nikoli v samotném klipu.
Systém AtriClip je samosvorný epikardiální okluder ouška LS, který je zkonstruován z nitinolu, oceli a dakronu (obr.). Ocelové lišty vykazují lineární konstantní tlak na tkáň v rozsahu 2–8 psi. Klip je dodáván ve 4 standardních velikostech. Varianta zaváděcího systému Pro pak umožňuje před definitivním odpoutáním opakované uvolnění a naložení.
Obr. AtriClip PRO 
(AtriCure, West Chester, USA) Pro kritéria správného naložení aplikujeme Clevelandská kritéria – zbytkový krček do 1 cm a žádnou komunikaci mezi ouškem po naložení klipu a levou síní.
Sledování
Pacienti v rámci pooperačního sledování podstoupili TEE za 1 a 3 měsíce od aplikace. Následoval telefonický kontakt nebo ambulantní kontrola se zaměřením na nově vzniklou TIA/CMP, jakoukoliv krvácivou komplikaci a aktuální užívání antiagregační/antikoagulační terapie. U prvních 30 nemocných bylo provedeno i CT, které ale nepřinášelo oproti TEE více informací, a v dalším sledování jsme proto od tohoto vyšetření upustili.
Nemocným byl předoperačně podáván nízkomolekulární heparin. Periprocedurální podání antikoagulace se odvíjelo od typu výkonu (off-pump vs on-pump). V pooperačním období byl u všech nemocných s MAZE procedurou a u nemocných s výkonem na mitrální chlopni aplikován nízkomolekulární heparin a nemocní byli převedení na trvalou antikoagulaci s cílovými hodnotami INR 2–3. Po 3 měsících byla u pacientů se SR nebo u pacientů po plastice chlopně či biologické náhradě antikoagulace ukončena a nahrazena antiagregací. V případě jiné indikace – FS, vysoké CHA2DS2 VASc, dysfunkce LK apod – se v antikoagulaci pokračovalo podle doporučení. U zbylých nemocných, kde byl implantován izolovaně pouze klip a pacientům, kterým byla trvalá antikoagulace kontraindikována (indikací aplikace klipu byla většinou komplikace nebo vysoké riziko trvalé antikoagulace), byl periprocedurálně podáván nízkomolekulární heparin a po vertikalizaci a plné mobilizaci bylo pokračováno již jen v antiagregaci.
Výsledky
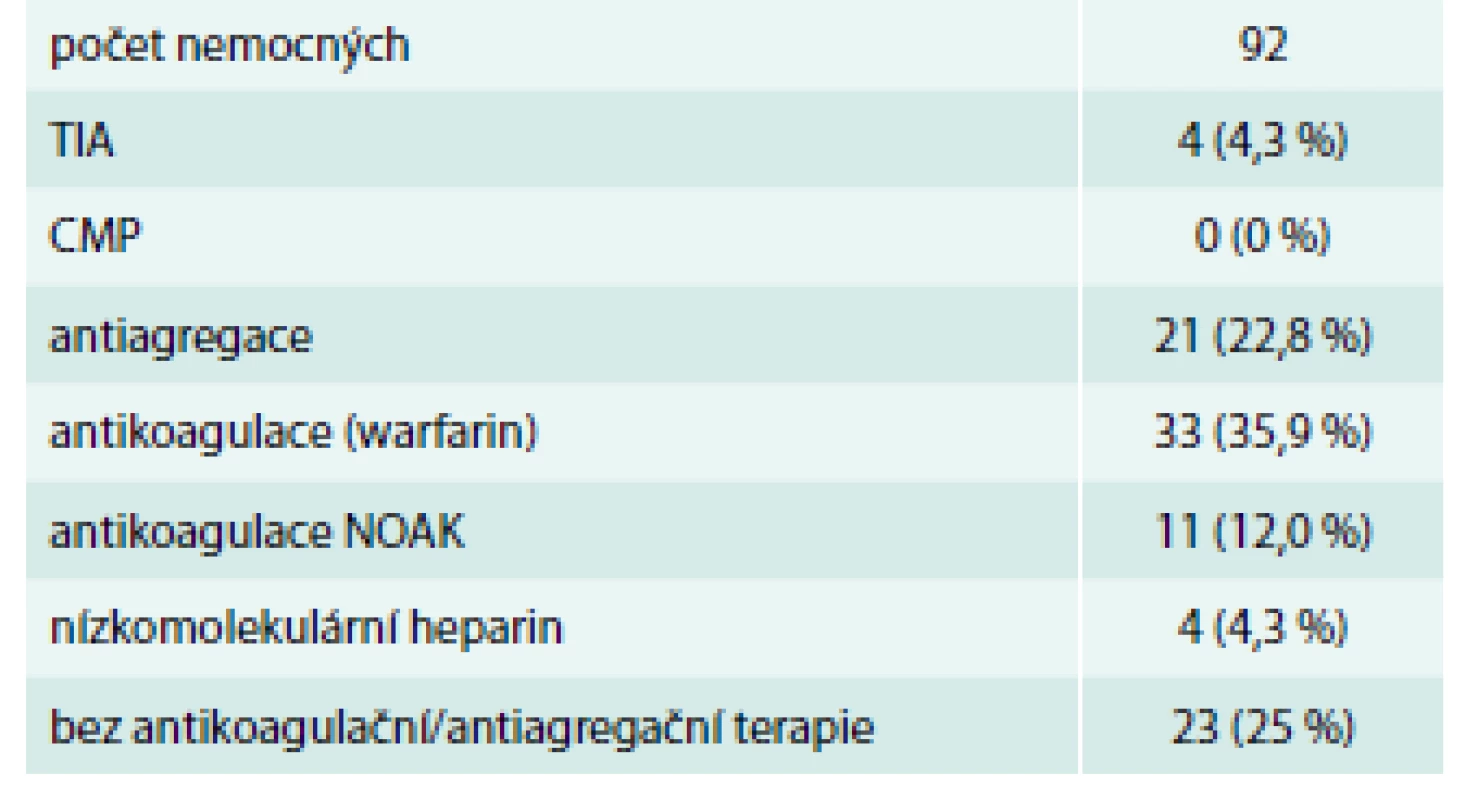
Celkem bylo aplikováno 101 klipů. Hospitalizační mortalita 8 nemocných, bez vztahu k aplikaci klipu (13, 21, 60, 21, 2, 10, 22 a 2 dny po operaci). Všechna úmrtí nastala v souvislosti s multiorgánovou dysfunkcí a systémovou zánětlivou reakcí organizmu. 1 nemocný zemřel 6 měsíců po operaci na pneumonii. Mužů bylo 63,4 % a průměrný věk byl 65,7 let. 20,8 % nemocných prodělalo TIA/CMP předoperačně a průměrné CHA2DS2-VASc skóre bylo 2,5 (tab. 1). 63,3 % nemocným byl klip aplikován torakoskopicky buď v rámci hybridní léčby FS (56,4 %) nebo izolovaně (6,9 %) bez použití mimotělního oběhu (tab. 2).
Tab. 1. Perioperační charakteristiky 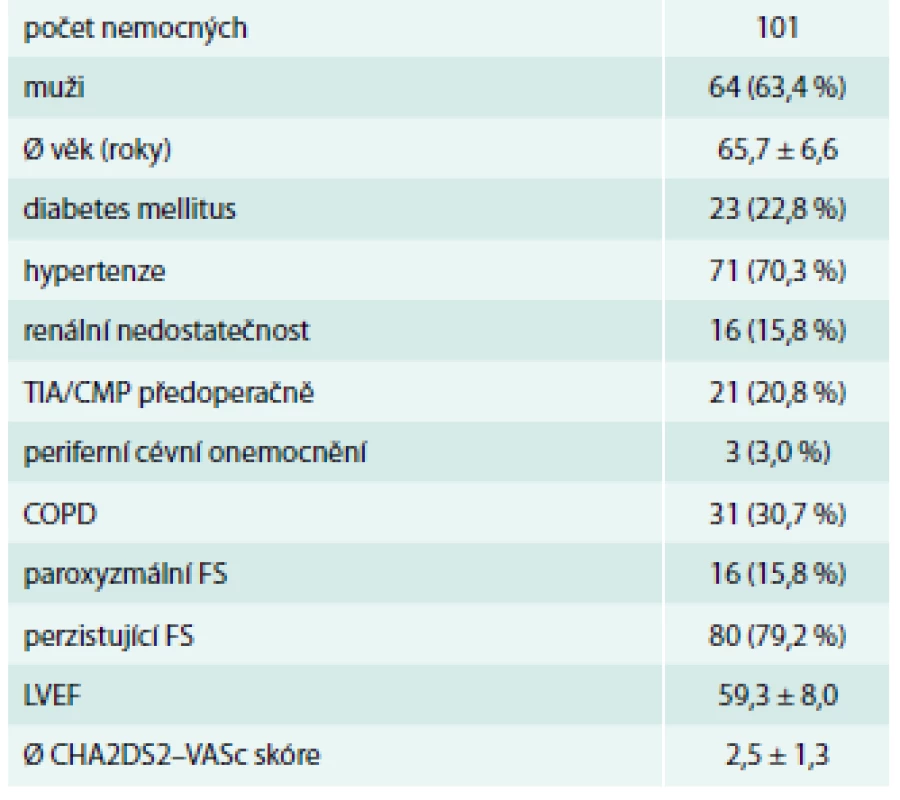
COPD – chronická obstrukční choroba plicní LVEF – ejekční frakce levé komory srdeční Tab. 2. Periperační charakteristiky 
Naložení klipu bylo úspěšné (žádný endoleak a zbytkový recesus do 1 cm) u 99 nemocných (98% úspěšnost). U 2 nemocných byl zbytkový recesus 18 resp. 15 mm. Oba tito nemocní byli mezi prvními 10 torakoskopickými aplikacemi. Žádný nemocný nebyl revidován pro krvácení z naloženého klipu nebo jeho následnou malpozici (tab. 3). Během hospitalizace jsme nezaznamenali žádnou TIA. U jednoho nemocného došlo periprocedurálně k rozvoji CMP vs embolizační etiologie. CHA2DS2-VASc skóre nemocného bylo 5, věk 73 let a šlo o kombinovaný výkon – koronární rekonstrukci, uzávěr foramen ovale patens a aplikaci klipu. Pooperační TEE bez známek trombů či ECHO kontrastu v LS. Tento pacient následně zemřel pod obrazem multiorgánového selhání (tab. 4).
Tab. 3. Periprocedurální úspěšnost 
Během sledování byly zaznamenány 4 TIA. První nemocný měl CHA2DS2-VASc score 4, měl SR a byla mu podávána antiagregancia. Další 2 nemocní měli CHA2DS2-VASc score 1, bylo jim podáváno antikoagulans (warfarin) a měli chronickou FS. 4. nemocný měl nesinusový rytmus na antikoagulační terapii s užitím NOAC (rivaroxaban) a CHA2DS2-VASc score 4. Podle dokumentace nebyla prokázána kardioembolizační etiologie. Poslední zmíněný nemocný měl nově prokázán steal syndrom pravé vertebrální arterie, což se vznikem TIA pravděpodobně souviselo. Doba následného sledování byla 1 873 pacient-měsíců s průměrem 18,5 ± 11,3 měsíce (tab. 5) bez vzniku CMP či zachycené krvácivé komplikace.
Jak vyplývá z našich výsledků, 53 % nemocných byla během sledování podávána antikoagulancia (chlopenní chirurgie, dysfunkce levé komory srdeční, FS). 47 % poté dostávali antiagregaci kyselinou acetylsalicylovou nebo byli zcela bez antiagregace/antikoagulace. CMP se během sledování nevyskytla ani jednou a TIA celkem 4krát. Z toho jednou v rámci „steal syndromu“. Průměrné CHA2DS2-VASc skóre ve sledovaném souboru pacientů bylo 2,5 ± 1,3.
Diskuse
Vyřazení ouška LS z krevního oběhu se u nemocných s FS jeví jako vhodná alternativa trvalé antikoagulace při prevenci CMP. Jako prevence tromboembolické příhody je, za určitých okolností, doporučena v Guidelines AACC/AHA/ESC z roku 2006 i v Guidelines ESC 2016 [21,22]. Jak vyplývá z výsledků některých studií, např. PROTECT AF s katetrizačním okluderem ouška LS, není okluze ouška LS inferiorní k antikoagulaci warfarinem v prevenci CMP, ale redukuje riziko krvácivých komplikací. Redukci některých komplikací (především intrakraniálního krvácení) spojených s užíváním warfarinu nabízí rovněž celá skupina léků NOAK, nicméně část problémů přetrvává.
Chirurgické odstranění ouška LS je teoreticky nejefektivnější – absolutní a řeší oba důležité aspekty ouška ve vztahu k FS – arytmogenní substrát i zdroj tromboembolizmu. Za zavedené chirurgické metody exkluze ouška LS se počítají ligace, sutura, resekce a stapler. Nově pak použití specializovaných pomůcek (AtriClip, Tigerpaw). Dosavadní zkušenost se standardními chirurgickými metodami jsou ale nepřesvědčivé. Kromě rizika operace samotné (úmrtí, krvácení, rané komplikace) je zde i relativně malá efektivita.
Soubornou práci porovnávající jednotlivé způsoby (resekce, stapler, sutura) prezentoval Kanderian et al z Cleveland Clinic [8]. Mimo jiné zde nastavují základní parametry „chirurgické“ efektivity vyřazení ouška z oběhu – žádný endoleak a jen minimální zbytkový recesus (do 1 cm), který by neměl být místem snadného vzniku nástěnné trombózy. Podle těchto kritérií bylo z celkového souboru 137 nemocných efektivně vyřazeno z oběhu jen 73 % resekcí, 23 % sutur a 0 % staplerů.
Gillinov et al [9] prezentují výsledky 222 nemocných s použitím stapleru. 10 % pacientů vyžadovalo dodatečnou suturu, což je např. pro endoskopické použití bez mimotělního oběhu limitující komplikací.
Katz et al [10] ve své práci prezentují 36 % endoleaků po uzávěru endokardiální suturou. Stejný autor, v jiné studii podložené ultrazvukovým vyšetřením, kontroloval 50 nemocných s výkonem na mitrální chlopni, u kterých zároveň ligoval ouško LS. 36 % z nich mělo ligaci inkompletní (18 nemocných). Z nich u 9 (50 %) byl detekován spontánní ECHO kontrast nebo trombus v oušku LS a 4 z těchto 18 pacientů s leakem prodělalo tromboembolickou příhodu [20].
Exkluze ouška systémem AtriClip se ale jeví významně lépe. Jak vyplývá nejen z prací Saltzberga a Ailawadiho [11,12], ale i z našich předchozích zkušeností [13], je aplikace klipu spojena s minimálním, téměř nulovým rizikem nejen migrace, ale i endoleaku. Nepublikovaná firemní aktualizovaná data ukazují, že po 77 000 aplikacích klipu celosvětově nebyl zdokumentován jediný endoleak. Vedle této mechanické „kvality“ je zde i elektrická izolace ouška zejména s ohledem na redukci rizika recidivy FS po ablaci [14–16]. DiBiase et al na souboru 987 nemocných, kteří podstoupili rekatetrizaci pro recidivu FS, prokázal, že u 27 % bylo zodpovědno za recidivu FS právě ouško LS [17].
Velkou výhodou tohoto systému je aplikovatelnost nejen ze standardního chirurgického přístupu (sternotomie), ale i miniinvazivně (minitorakotomie, torakoskopie). Tato miniinvazivita je spojena s velmi dobrou tolerancí operačního výkonu, rychlou rehabilitací a v neposlední řadě lepším kosmetickým výsledkem. Z našeho souboru jsme takto aplikovali celkem 64 klipů jak izolovaně, tak v rámci hybridní léčby fibrilace síní. Nezaznamenali jsme žádnou komplikaci v kontextu aplikace klipu s výjimkou „learning curve“ u prvních pacientů, u nichž byl systém dvakrát naložen s větším než centimetrovým krčkem. U těchto pacientů ještě nebyla standardně prováděna kontrola TEE při aplikaci klipu, což se v současné době děje a představuje jeden z důležitých faktorů zlepšující efektivitu implantace.
Velkou výhodou AtriClipu je i možnost opakovaného naložení. Protože báze ouška je ve velmi intimním vztahu ke koronárním arteriím, může po naložení dojít k omezení průtoku. Tato situace se nám jednou přihodila a její řešení je velmi elegantní – pouhé přesazení klipu o pár milimetrů distálně, vše pod kontrolou UZ a EKG, tuto situaci vyřešilo. I z tohoto úhlu pohledu můžeme mluvit v případě AtriClipu o velmi bezpečné metodě okluze ouška LS.
Nepřítomnost syntetického materiálu uvnitř srdce je pak teoretickou výhodou při riziku trombózy a infekční endokarditidy, ale tento předpoklad bude nutno ještě potvrdit.
Jak bylo již zmíněno výše, největší zkušenosti z katétrovými okludery ouška LS jsou se systémem Watchman. Ten byl testován proti antikoagulaci warfarinem mj. ve studii PROTECT AF. Úspěšně implantováno bylo 349 pacientů s primárně 463 nemocných zařazených do intervenční větve. Riziko CMP, systémové embolizace a kardiovaskulární nebo nevysvětlitelné smrti bylo 1,9 na 100 pacient-roků, riziko excesivního krvácení při zavedení a riziko ostatních závažných periprocedurálních komplikací bylo 1,5 na 100 pacient-roků. Za efektivní okluzi ouška byl považován i výsledek – přetrvával endoleak s ústím menším než 0,5 cm, což se v ročním sledování neprokázalo jako významné riziko tromboembolie. Je otázkou, co ukáže delší sledování [18,24].
Chirurgické zkušenosti s nekompletním uzávěrem ouška nejsou uspokojivé a tento endoleak je významným rizikovým faktorem CMP. Mj. to ve svém souboru 205 nemocných s výkonem na mitrální chlopni a ligací levého ouška prokázal Garcia-Fernandez et al. Nejmenší riziko CMP bylo u nemocných s kompletním uzávěrem ouška LS. Ale i tam, kde bylo levé ouško ponecháno intaktní, bylo riziko menší než u nemocných, kde zůstal endoleak [19]. Obdobnou zkušenost prezentoval Katz et al, kteří ultrazvukem kontrolovali 50 nemocných s podvazem ouška LS při výkonech na mitrální chlopni. 18 nemocných mělo endoleak a z těchto 18 u 9 byl detekován ve zbytku ouška ECHO kontrast nebo trombus. U 4 z nich došlo k rozvoji CMP [20].
Závěr
Naše vlastní zkušenost jen potvrzuje předpoklad bezpečnosti, stability a efektivity epikardiálního systému pro okluzi ouška LS AtriClip PRO. Pro velmi vysokou efektivitu okluze se klip jeví jako velmi vhodná alternativa k antikoagulační léčbě při FS u pacientů, u nichž farmakoterapie nemůže být bezpečně podávána. Tato vysoká efektivita je mezi ostatními možnostmi okluze/exkluze výjimečná.
Riziko chirurgických komplikací není podle našich zkušeností vysoké a zejména po zvládnutí learning curve jsou závažné komplikace spíše výjimečné. Určitým limitem přístupu může být v některých případech nutnost selektivní ventilace.
doc. MUDr. Aleš Mokráček, CSc.
a.mokracek@seznam.cz
Kardiochirurgické oddělení Nemocnice České Budějovice, a.s.
www.nemcb.cz
Doručeno do redakce 29. 10. 2016
Přijato po recenzi 14. 12. 2016
Zdroje
1. Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg 1996; 61(2): 755–759.
2. Shirani J, Alaeddini J. Structural remodelling left atrial appendage in patients with chronic non-valvular atrial fibrillation, implication for thrombus formation, systemic embolism and assessment by transesophageal echocardiography. Cardiovasc Patol 2000; 9(2): 95–101.
3. Camm AJ, Lip GIH, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. Eur Heart J 2012; 33(21): 2719–2747. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehs253>. Erratum in Eur Heart J 2013; 34(10): 790. Eur Heart J 2013; 34(36): 2850–2851.
4. Cox JL, Ad N, Palazzo T. Impact of the maze procedure on the stroke rate in patients with atrial fibrillation. J Thorac Cardiovasc Surg 1999; 118(5): 833–840.
5. Johnson WJ, Ganjoo AK, Stone CD. The left atrial appendage: our most lethal human attachment: Surgical implication. Eur J Cardiothoracic Surg 2000; 17(6): 718–722.
6. Brown MT, Bussel JK. Medication adherence: Who cares? Mayo Clinic Proc 2011; 86(4): 304–314. Dostupné z DOI: <http://dx.doi.org/10.4065/mcp.2010.0575>.
7. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran vs. Warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139–1151. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0905561>. Erratum in N Engl J Med 2010; 363(19):1877.
8. Kanderian AS, Gillinov AM, Pettersson G et al. Success of surgical left atrial appendage closure. JACC 2008; 52(11): 924–929. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.03.067>.
9. Gillinov MA, Pettersson G, Cosgrove DM. Stapled exciton of the left atrial appendage. J Thorac Cardiovasc Surg 2005; 129(3): 679–680.
10. Katz ES, Tsiamtsiouris T, Applebaum RM et al. Surgical left atrial appendage ligation is frequently incomplete: A transesophageal echocardiographic study. J Am Coll Cardiol 2000; 36(2): 468–471.
11. Salzberg SP, Plass A, Emmert MY et al. Left atrial appendage clip occlusion: early clinical results. J Thorac and Cadiovasc Surg 2010; 139(5): 1269–1274. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtcvs.2009.06.033>.
12. Ailawadi G, Gerdisch MW, Harvey RL et al. Exclusion of the left atrial appendage with a novel device: Early results of a multicenter study. J Thorac and Cadiovasc Surg 2011; 142(5): 1002–1009e1. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtcvs.2011.07.052>.
13. Mokráček A, Kurfirst V, Bulava A et al. Thoracoscopic occlusion of the left atrial appendage. Innovations 2015; 10(3): 179–182. Dostupné z DOI: <http://dx.doi.org/10.1097/IMI.0000000000000169>.
14. Starck CT, Steffel J, Emmert MY et al. Epicardial left atrial appendage clip occlusion also provides the electrical isolation of the left atrial appendage. Interactive CardioVascular and Thoracic Surg 2012; 15(3): 416–419. Dostupné z DOI: <http://dx.doi.org/10.1093/icvts/ivs136>.
15. Takahashi Y, Sanders P, Rotter M et al. Disconnection of the left atrial appendage for elimination of foci maintaining atrial fibrillation. J Cardiovasc Elecrophysiol 2005; 16(8): 917–919.
16. Stack CHT, Steffel J, Emmert MY et al. Epicardial left atrial appendage clip occlusion also provides the electrical isolation of the left atrial appendage. Interact Cardiovasc Thorac Surg 2012; 15(3): 416–418. Dostupné z DOI: <http://dx.doi.org/10.1093/icvts/ivs136>.
17. DiBiase LD, Burkhardt D, Mohanty P et al. Left atrial appendage. An underrecognised trigger site of atrial appendage. Circulation 2010; 122(2): 109–118. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.109.928903>.
18. Ostermayer SH, Reisman M, Kramer PH et al. Percutaneous left atrial appendage transcatheter occlusion (PLAATO) to prevent stroke in high-risk patients with non-rheumatic atrial fibrillation: results from the international multi-center feasibility trials. J Am Coll Cardiol 2005; 46(1): 9–14.
19. Garcia-Fernandez MA, Perez-David E, Quiles J et al. Role of left atrial appendage obliteration in patients with mitral valve prosthesis. J Am Coll Cardiol 2003; 42(7): 1253–1258.
20. Katz ES, Tsiamtsiouris T, Applebaum RM et al. Surgical left atrial appendage ligation is frequently incomplete. JACC 2000; 36(2): 468–471.
21. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation 2006; 114(7): e257-e354. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.106.177292>. Erratum in Circulation 2007; 116(6): e138.
22. 2016 ESC Guidelines for the management of the atrial fibrillation developed in collaboration with EACTS. European Heart J 37(38): 2893–2962.
23. Calkins H, Kuck KH, Cappato R et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: Recommendations for Patient Selection, Procedural Techniques, Patient Management and Follow-up, Definitions, Endpoints, and Research Trial Design. Heart Rhythm 2012; 9(4): 632–696.e21. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hrthm.2011.12.016>.
24. Alli O, Doshi S, Kar S et al. Quality of life assessment in the randomized PROTECT AF trial of patients at risk for stroke with nonvalvular atrial fibrillation. J Am Coll Cardiol 2013; 61(17): 1790–8. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2013.01.061>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Familiární hypercholesterolermie: z Čech a Moravy do celého světa – editorial
- Význam hodnocení ventilační efektivity VE/VCO2 slope u pacientů se srdečním selháním – editorial
- Progresivní multifokální leukoencefalopatie – editorial
- ScreenPro FH – projekt v oblasti screeningu zaměřený na familiární hypercholesterolemii ve střední, jižní a východní Evropě: základní epidemiologie
- Uzávěr ouška levé síně systémem AtriClip
- Léčba pacientů infikovaných virem hepatitidy C genotypu 2
- ScreenPro FH – projekt v oblasti screeningu zaměřený na familiární hypercholesterolemii ve střední, jižní a východní Evropě: odůvodnění a záměr
- Appendix diagnostica – Familial hypercholesterolemia diagnostic criteria
- Predátorské časopisy: praktiky jejich vydavatelů a jak se jim bránit
- Příspěvek k diferenciální diagnostice sklerozujících cholangitid
- Význam hodnocení ventilační efektivity VE/VCO2 slope u pacientů se srdečním selháním
- Progresívna multifokálna leukoencefalopatia spojená s rituximabom
- 2nd Prague European Days of Internal Medicine
- Spomienka na profesora MUDr. Karla Horkého, DrSc., FACP (Hon), FEFIM
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Uzávěr ouška levé síně systémem AtriClip
- Význam hodnocení ventilační efektivity VE/VCO2 slope u pacientů se srdečním selháním
- Progresívna multifokálna leukoencefalopatia spojená s rituximabom
- Příspěvek k diferenciální diagnostice sklerozujících cholangitid
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání