-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
Annual monitoring of side effects of administering sitagliptin in patients with type 2 diabetes mellitus
We present the results of an independent, drug company-unsupported follow-up of patients with type 2 diabetes mellitus (T2DM) treated with the dipeptidyl peptidase 4 inhibitor sitagliptin. 29 patients (16 men, 13 women) used sitagliptin 100 mg daily for one year as an add-on to their chronic antidiabetic therapy. 16 type diabetic patients formed a control group – they used their chronic antidiabetic therapy without sitagliptin. 10 additional patients (6 men and 4 women) were enrolled in the study and treated with sitagliptin for one month. Body weight, BMI, glycaemia, glycated hemoglobin (HbA1c), cholesterolemia, triacylglycerolemia and serum amylases were determined and abdominal ultrasonography was performed. Because significant changes in immunological tests had been found especially after one month of treatment, 10 additional patients (6 men and 4 women) were enrolled in the study and treated with sitagliptin for one month. Sitagliptin treatment led to a significant body weight loss of 1 kg per year. In the control group, no significant change was observed. Similar results were noticed in HbA1c level and fasting glycaemia – mild but statisticaly significant reduction in the sitagliptin group both after one month and one year (not in HbA1c), no difference in the control group. There was no change in cholesterolemia, or in triacylglycerolemia. In 33% of patients in the sitagliptin group, the level of liver steatosis decreased by ultrasonographic evaluation. This was not found in any of the patients case in the control group. The serum amylase levels increased slightly over the upper limit in two sitagliptin treated patients. In the other sitagliptin treated patients serum amylase remained within the laboratory limits, but slight, statistically significant elevation of serum amylases was observed in the intervened group. This result was not found in the control group. There were not differences in the frequency between occurence of mild respiratory infections in the sitagliptin and control group. Marginally significant decrease was observed in the intervened group.
Key words:
sitagliptin – type 2 diabetes mellitus – side effects
Autoři: Michal Anděl 1; Pavel Škrha 1; Pavel Kraml 1; Jana Potočková 1; Iva Hoffmanová 1; Elena Šilhová 1; Josef Fontana 1; Anna Richterová 3; Martin Gadiredi 4; Petr Bušek 2; Lucie Šromová 2; Aleksi Šedo 2
Působiště autorů: Diabetologické a nutriční centrum 3. LF UK a FN Královské Vinohrady, Praha, Centrum výzkumu diabetu, metabolizmu a výživy 3. LF UK v Praze 1; Ústav biochemie a experimentální onkologie 1. LF UK v Praze 2; Diabetologická ambulance, Praha 3; Diabetologická ambulance, Praha 4
Vyšlo v časopise: Vnitř Lék 2016; 62(6): 455-461
Kategorie: Přehledné referáty
Souhrn
Představujeme výsledky nezávislého, firemně nepodporovaného sledování diabetiků 2. typu léčených inhibitorem dipeptidylpeptidázy 4 sitagliptinem. Do studie bylo zařazeno 30 mužů a 24 žen, u nichž byl dříve diagnostikován diabetes mellitus 2. typu (DM2T) a byli léčeni metforminem, případně kombinací metforminu a derivátu sulfonylurey nebo glinidu. Sitagliptin v dávce 100 mg 1krát denně byl přidán ke stávající medikaci u 38 pacientů s DM2T zavzatých do studie. Menší kontrolní skupina (n = 16) pacientů s DM2T byla sledována ve stejných časových intervalech k posouzení dynamiky sledovaných parametrů při absenci podávání sitagliptinu. 43 pacientů bylo sledováno po dobu 1 roku (28 sitaglipitin/15 kontrolní skupina), 11 pacientů pouze po dobu 1 měsíce (10 sitagliptin/1 kontrolní skupina). Sledovány byly zejména hladiny glykemie, glykovaného hemoglobinu (HbA1c), cholesterolemie, triacylglycerolemie, hladina sérové amylázy a C-reaktivního proteinu. Provedena byla ultrasonografie jater. U pacientů užívajících sitagliptin došlo k mírnému, ale statisticky významnému poklesu základních parametrů metabolické kompenzace diabetu, především lačné glykemie, ale i hladiny glykovaného hemoglobinu. V kontrolní skupině, léčené dosavadní léčbou bez přidání sitagliptinu, jsme nenalezli ani významný pokles glykemie nalačno, ani pokles hladiny glykovaného hemoglobinu. Nebyl pozorován pokles cholesterolemie, ani triacylglycerolemie. U 1/3 pacientů léčených sitagliptinem se zřetelně snížil stupeň jaterní steatózy při sonografickém hodnocení. Tento nález nebyl pozorován v kontrolní skupině. Na rozdíl od kontrolní skupiny došlo k mírnému vzestupu hladin amyláz v intervenované skupině, přičemž u naprosté většiny pacientů zůstala sérová amyláza v hranicích normy. U 2 nemocných jsme nalezli po roce sledování vzestup sérové amylázy nad hranici normy. Přestože výsledky hladin amyláz u všech ostatních nemocných zůstaly v hranicích normy, mezi počátkem sledování a koncem sledování jsme v sitagliptinové skupině nalezli statisticky významný vzestup. Tento nález nebyl ve skupině kontrolní. Nezávažné infekce dýchacích a močových cest se vyskytly podobně často jak v sitagliptinové, tak v kontrolní skupině.
Klíčová slova:
diabetes mellitus 2. typu – sitagliptin – vedlejší účinkyÚvod
Pro snížení rizika mikrovaskulárních komplikací onemocnění diabetes mellitus 2. typu (DM2T) je zásadní podmínkou dobrá kontrola glykemie [2,16].
Historicky se první pokusy ovlivnit DM2T extrakty z gastrointestinálního traktu datují do počátku 20. století. V roce 1906 byla publikována práce popisující snahu léčit diabetes extrakty z duodenální sliznice [47]. O 20 let později provedl La Barre s kolegy experimenty, během kterých podávali intravenózně sekretin psům. Při tom došlo k hypoglykemii. Autoři došli k závěru, že sekretin má 2 aktivní principy: inkretin, ovlivňující vnitřní sekreci pankreatu, a exkretin, ovlivňující zevní sekreci [20,46].
Z hlediska sekrece inzulinu se po dalších 50 letech ukázalo překvapivé zjištění, že vzestup plazmatické hladiny inzulinu je vyšší po perorálním než po intravenózním podání glukózy. Schopnost vyplavit inzulin více po perorálním potravovém podnětu než po podnětu intravenózním je právě přičítána gastrointestinálním hormonům, v současnosti především tzv. inkretinům. Právě stimulace sekrece inzulinu cestou inkretinů, především pak glukagonu podobným peptidem 1 (glucagon-like peptide 1, GLP1), je zodpovědná za první fázi stimulované postprandiální sekrece inzulinu. Dochází k ní podstatně dříve, než k ostrůvkům mohou dospět vstřebané živiny, dle současných poznatků odpovědné za druhou fázi stimulované inzulinové sekrece [24].
Teprve pochopení přesných mechanizmů sekrece, kinetiky a účinku GLP1 včetně znalosti jeho odbourávání vedly k experimentálnímu a posléze klinickému užití inkretinové terapie [24,27]. Tento princip, vypracovaný v 80. letech minulého století, zkoušený v letech 90., se stal na počátku 21. století jednou z nejvýznamnějších inovací v léčbě diabetu.
Potenciální schopnost využití inkretinového principu v diabetologii je teoreticky popisována již déle než 20 let [13], základní experimentální a klinicko-fyziologické pilíře této terapie byly rozpracovány zejména skupinami okolo Holsta [13,18], Naucka [24,25,27] a Ahrena [1]. Historicky dochází i s ohledem na inkretinový princip k renesanci poznatků o glukagonu, hormonu objeveném již na počátku 20. let minulého století [19]. Ostatně GLP1 a glukagon jsou produkty jednoho a téhož genu [3].
Dipeptidylpeptidáza 4 (DPP4) je serinová exopeptidáza přítomná v plazmatické membráně mnoha buněčných typů. Je také ve své rozpustné formě přítomna v krevní plazmě a tělesných tekutinách [5]. Vysoce specificky štěpí proteiny obsahující na druhé pozici prolin nebo alanin. Má však také další biologické funkce spojené s neproteolytickým účinkem. Typicky snižuje biologickou aktivitu řady humorálních mediátorů včetně inkretinů (GLP1, GIP), chemokinů a neuropeptidů, a tak ovlivňuje biologické procesy v celém organizmu [33].
Inhibitory dipeptidylpeptidázy 4 (iDPP4) prolongují účinek inkretinových hormonů, konkrétně GLP1 a glukóza-dependentního inzulinotropického polypeptidu (GIP) inhibicí jejich odbourávání. To vede ke zlepšení glykemického profilu nemocných s DM2T především díky zvýšení endogenní sekrece inzulinu z β-buněk a potlačením sekrece glukagonu z α-buněk [9].
Bezpečnost jednotlivých antidiabetik včetně iDPP4 je, stejně jako u všech ostatních léků, základní podmínkou jejich širokého podávání. První články o bezpečnosti iDPP4 jsou již téměř 10 let staré. Sitagliptin, první z řady iDPP4, byl již tehdy shledán jako dobře tolerovaný lék, ve srovnání s glipizidem s nízkým rizikem hypoglykemie a s poklesem hmotnosti oproti pacientům léčeným glipizidem [26]. Základní vedlejší účinky iDPP4 jsou známy a jsou uváděny v jejich SPC. V českém SPC nalézáme upozornění na častější výskyt infekcí horních dýchacích cest během 24týdenního sledování pacientů léčených sitagliptinem, tento údaj však již není v některých zahraničních SPC.
Před 5 roky publikovaná kalifornská studie poukazovala na častější případy mírné nazofaryngitidy i močových infekcí [22]. Recentně publikované analýzy řady randomizovaných studií nenalezly častější výskyt infekcí u pacientů užívajících gliptiny ve srovnání pacienty léčenými jinými antidiabetiky [33,44,45].
Vážnější komplikací mohou být iritace pankreatu až akutní pankreatitis. V roce 2009 FDA publikovala informaci pro zdravotnické profesionály o možném riziku vzniku akutní pankreatitidy v souvislosti s užíváním sitagliptinu.
Zda jsou tyto případy spojené jednoznačně s terapií iDPP4 a jak odfiltrovat riziko pankreatitidy, které je u diabetiků zvýšené, se pochopitelně často diskutuje. Definitivní závěry nejsou k dispozici, přesto a proto je třeba tyto případy sledovat, evidovat a vyhodnocovat [10]. Rozvoj karcinomu pankreatu, před kterým v roce 2010 dramaticky varoval Buttler et al [6,7], nebyl FDA potvrzen. V poměrně rozsáhlé studii provedené na skupině 18 179 pacientů v USA byl u pacientů léčených iDPP4 výskyt karcinomu pankreatu nižší než u nemocných léčených deriváty sulfonylurey a srovnatelný se skupinou pacientů léčených thiazolidindiony [11]. Na sklonku roku 2015 a v lednu roku 2016 se ovšem objevila další 2 sdělení, která asociaci sitagliptinu s rizikem karcinomu pankreatu nacházejí [23,42]. V experimentálních pracích je v souvislosti s inhibicí DPP4 popisován vyšší výskyt medulárního karcinomu štítné žlázy u hlodavců po stimulaci receptorů GLP1. Tento tumor nebyl ani po více než desetiletém užívání iDPP4 v klinické praxi popsán [42]. V experimentu byla popsána taktéž artritida, resp. polyartropatie po systémové inhibici DPP4 [30]. V současné době FDA dokumentuje při užívání různých preparátů inhibitorů DPP4 asi 30 případů těžkých bolestí kloubů, z nichž 10 vyžadovalo hospitalizaci. S ohledem na délku zkušenosti s podáváním sitagliptinu je nejvíc případů bolestí kloubů právě po tomto preparátu. S ohledem na množství nemocných, kteří iDPP4 užívají, jsou tato čísla velmi malá.
Tak jako u ostatních antidiabetik, bezpečnost iDPP4 je sledována i z hlediska kardiovaskulárních rizik. V poslední době bylo prokázáno, že podávání sitagliptinu nevede ke zvýšení rizika velkých kardiovaskulárních příhod, ke zvýšení častosti hospitalizace pro srdeční selhání ani k dalším vedlejším kardiovaskulárním účinkům [12].
Vzhledem k existenci výše uvedených literárních zpráv o možných vedlejších účincích iDPP4 jsme se rozhodli studovat vliv inhibice DPP4 na vybrané imunoregulační parametry se vztahem k DPP4. V rámci této studie jsme po dobu 52 týdnů sledovali u naší experimentální kohorty i řadu dalších klinických a laboratorních parametrů, které prezentujeme v tomto sdělení.
Pacienti a metody
Studie byla schválena Etickou komisí FN Královské Vinohrady i Etickou komisí 3. LF UK v Praze. Do studie bylo zařazeno 30 mužů a 24 žen, u nichž byl dříve diagnostikován DM2T a byli léčeni metforminem, případně kombinací metforminu a derivátu sulfonylurey nebo glinidu. Věk nemocných byl limitován 75 lety. Exkluzními kritérii byla akutní dekompenzace DM, HbA1c > 75 mmol/mol, již probíhající léčba GLP1 agonistou, DPP4 inhibitorem, SGLT2 inhibitorem nebo inzulinem, chronické zánětlivé onemocnění, nádorové onemocnění, závažná porucha funkce jater a ledvin (kreatinin > 110 μmol/l) a akutní kardiální stavy. V případě akutního zánětlivého onemocnění byl pacient pozván na kontrolu s odstupem po vyléčení (maximálně však 5–6 týdnů po zahájení léčby sitagliptinem).
Sitagliptin (Januvia®) v dávce 100 mg 1krát denně byl přidán k dosavadní medikaci u 38 pacientů s DM2T zavzatých do studie. Menší kontrolní skupina (n = 16) pacientů s DM2T byla sledována ve stejných časových intervalech k posouzení dynamiky sledovaných parametrů při absenci podávání sitagliptinu. Základní charakteristiky obou sledovaných skupin jsou uvedeny v tab. 1.
Tab. 1. Klinická charakteristika pacientů zahrnutých do studie 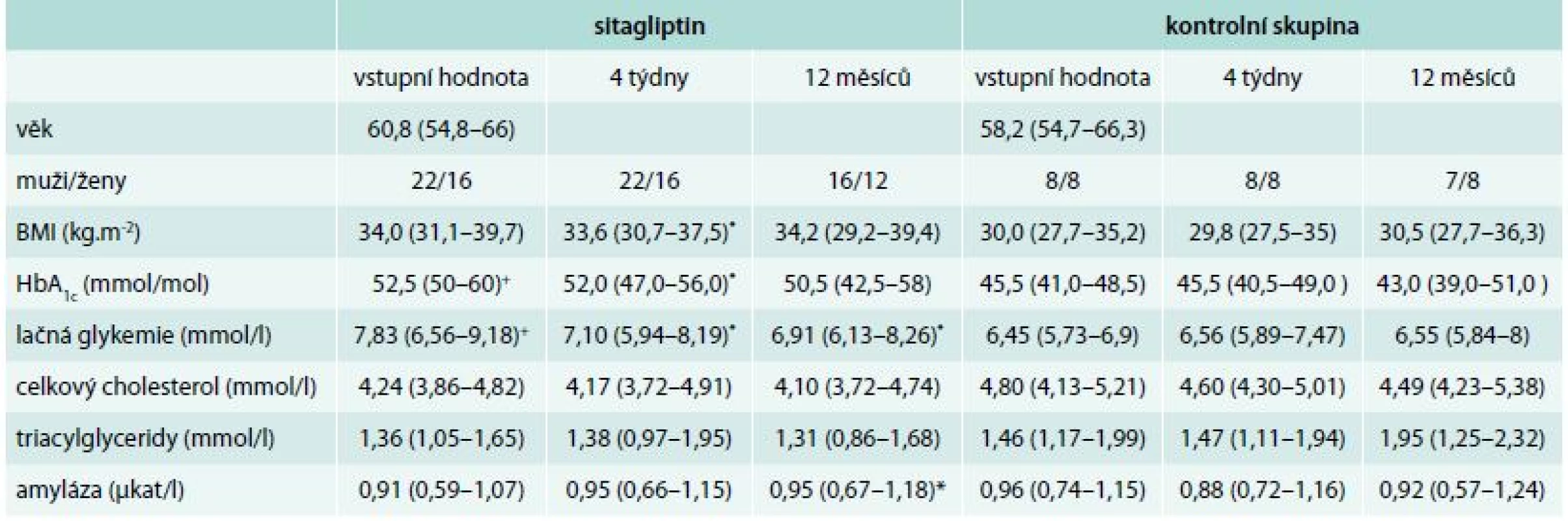
Data jsou vyjádřena jako medián a interkvartilové rozmezí. BMI – body mass index HbA1c – glykovaný hemoglobin * p < 0,05 Wilcoxonův párový test (porovnání s individuální vstupní hodnotou) + p < 0,05 Mannův-Whittneyův test (porovnání s vstupní hodnotou kontrolní skupiny) 43 pacientů bylo sledováno po dobu 1 roku (28 sitaglipitin/15 kontrolní skupina), 11 pacientů pouze po dobu 1 měsíce (10 sitagliptin/1 kontrolní skupina). Během vstupní návštěvy byl pacient obeznámen s průběhem a cílem studie, v případě léčby sitagliptinem pak s možnými nežádoucími účinky nové terapie. Pacienti vstupovali do studie dobrovolně, svou účast potvrdili podepsáním informovaného souhlasu. Následně byla s pacienty sepsána anamnéza s doplněním podrobného dotazníku o proběhlých zánětech v posledním měsíci včetně jejich způsobu ošetření, provedeno základní fyzikální, antropometrické vyšetření a ranní krevní odběry z v. cubitalis minimálně po 10hodinovém lačnění (standardní biochemické vyšetření a krevní obraz), orální glukózový toleranční test (OGTT) a ultrasonografické (USG) vyšetření břicha. USG-vyšetření bylo prováděno jedním sonografistou s 15letou praxí, funkční a školící licencí, na USG-přístroji Philips HD 11 XE s užitím konvexní sondy s dynamickým rozsahem 2–5 MHz. Kromě celkového vyšetření břicha byla ultrasonograficky hodnocena jaterní steatóza ve 2 stupních: jako mírná a jako těžká steatóza ve shodě s metodickým postupem popsaným Sanyalem. Mírná steatóza byla diagnostikována podle následujících kritérií: mírné difuzní zvýšení echogenity jaterního parenchymu ve srovnání s renálním parenchymem při zachování dobré či jen mírně zhoršené vizualizace bránice a okrajů portálních a jaterních žil. Těžká jaterní steatóza byla diagnostikována při splnění následujících kritérií: výrazné difuzní zvýšení echogenity jaterního parenchymu ve srovnání s renálním parenchymem, zvýšená echogenita při mělké hloubce zobrazení společně s atenuací při hlubokém zobrazení, výrazně zhoršená vizualizace bránice a značně neostré zobrazení okrajů portálních a jaterních žil [32]. Ačkoliv zlatým standardem pro diagnostiku jaterní steatózy, a zejména pro posouzení přítomnosti steatofibrózy, je jaterní biopsie, řada studií a metaanalýz ukázala, že zobrazovací metodiky (CT, MRI a abdominální sonografie) jsou vhodnou modalitou pro posouzení přítomnosti tuku v játrech. Zejména abdominální USG je pro svou dostupnost a nenákladnost metodou první volby, je schopna detekovat jaterní steatózu již v případech, v nichž obsah tuku v hepatocytu přesáhne 10 %, zejména pak při hodnotách tuku v hepatocytu > 20–30 % je její senzitivita 84,8 % a specificita 93,9 % [15]. Výhodou je, že na rozdíl od fibroelastografického hodnocení není sonografický obraz ovlivněn obezitou a výsledky nekolísají v závislosti na příjmu potravy [28].
Rutinní laboratorní analýzy a klinická vyšetření byly prováděny na pracovištích FN Královské Vinohrady. Sledovány byly zejména glykemie, HbA1c, cholesterolemie, triacylglycerolemie, hladina sérové amylázy a C-reaktivního proteinu (tab. 1).
Po měsíci byli pacienti pozváni ke kontrole, která probíhala podobně (s výjimkou OGTT) jako vstupní vyšetření. Pacienti s ročním sledováním byli měsíčně kontaktováni s žádostí o vyplnění dotazníku o proběhlých zánětech a infekcích a způsobu jejich ošetření. Výstupní kontrola s krevním odběrem a ultrasonografickým vyšetřením břicha pak proběhla po roce od vstupní kontroly. Během roku byli pacienti sledováni svými ambulantními diabetology.
Výsledky
U pacientů užívajících sitagliptin došlo k mírnému, ale statisticky významnému poklesu základních parametrů metabolické kompenzace diabetu, především lačné glykemie, ale i hladiny glykovaného hemoglobinu (tab. 1). V kontrolní skupině léčené dosavadní léčbou bez přidání sitagliptinu jsme nenalezli ani významný pokles glykemie nalačno, ani pokles hladiny glykovaného hemoglobinu. Nebyl pozorován pokles cholesterolemie ani triacylglycerolemie.
Na rozdíl od kontrolní skupiny jsme při intraindividuálním sledování změn aktivity amyláz v periferní krvi (S-AMS) pacientů léčených sitagliptinem nalezli mírný, ovšem statisticky významný vzestup tohoto parametru po roce léčby. S výjimkou 2 pacientů se však hladiny S-AMS po celou dobu studie pohybovaly v rámci laboratorní normy (tab. 1).
Jaterní steatóza výrazně ustoupila u 33 % nemocných, kteří dostávali sitagliptin, zatímco její stupeň se nezměnil u nikoho z kontrolních pacientů (tab. 2). V jednom případě pacientky léčené sitagliptinem byl pozorován raritní ložiskový způsob mizení steatózy.
Tab. 2. Výskyt jaterní steatózy u pacientů léčených sitaglitpinem a pacientů zařazených do kontrolní skupiny v průběhu ročního sledování 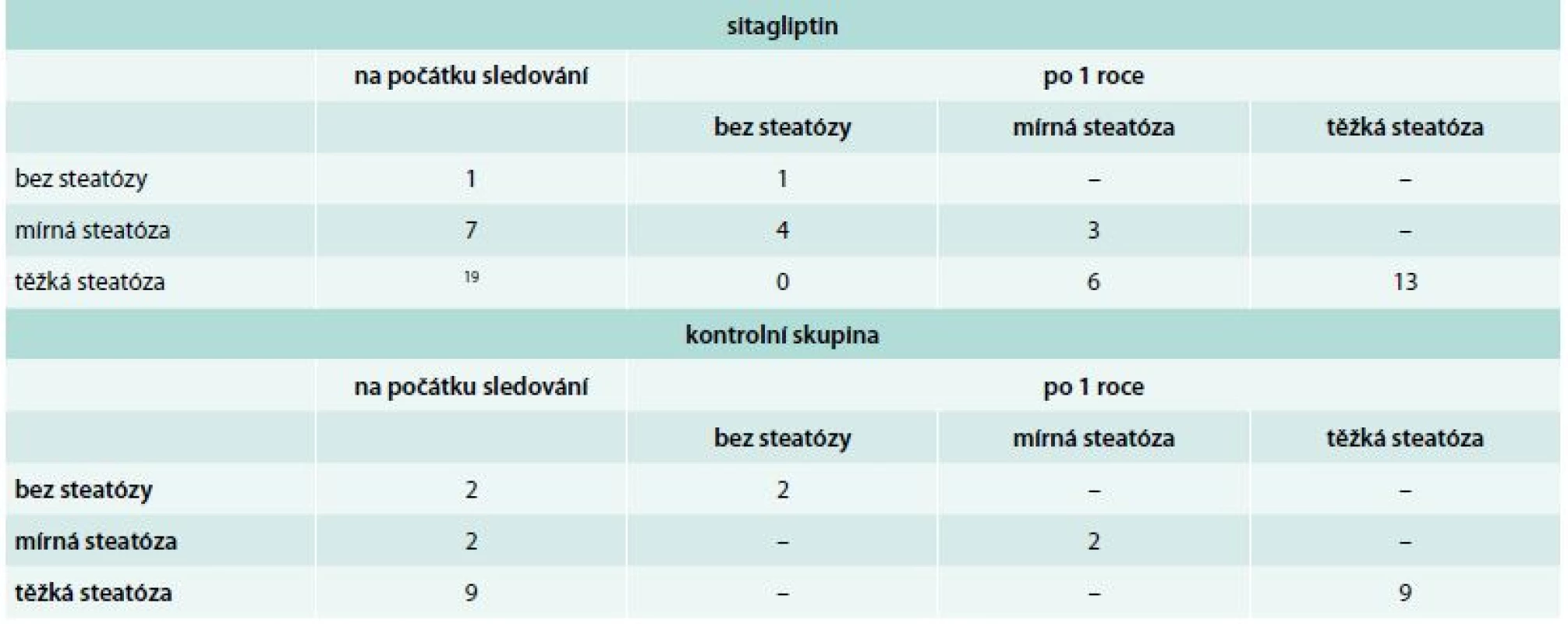
ve skupině nemocných léčených sitagliptinem: zlepšení steatózy: 10/27 v kontrolní skupině: zlepšení steatózy: 0/13 U jedné, na počátku studie 50leté nemocné, během léčby docházelo ve čtvrtletních intervalech spíše k mírnému zhoršování kompenzace a k výraznému zvýšení hladin hemoglobinu a hematokritu. Hematologické vyšetření však neprokázalo žádnou patologii. Jak kompenzace diabetu, tak krevní obraz se zlepšily po převedení pacientky na terapii kombinací metforminu a sulfonylurey. Podobný nález jsme nenalezli u žádného z dalších nemocných, kterým byl podáván sitagliptin, ani u nemocných z kontrolní skupiny.
Při monitoraci výskytu infekčních či zánětlivých onemocnění jsme v průběhu roční studie nenalezli rozdíl mezi kontrolní skupinou a skupinou léčenou sitagliptinem (data neuvedena).
Diskuse
Předkládaný článek popisuje naši zkušenost se zcela nezávislým, firemně nepodporovaným, ročním sledováním skupiny nemocných léčených iDPP4 sitagliptinem. Ve firemně podporovaných a firmami organizovaných studiích je obvykle počet intervenovaných pacientů vyšší, doba sledování však nebývá delší. Například Nauck et al [26] sledovali skupinu 1 172 nemocných rozdělenou na 2 poloviny, z nichž jedna užívala 100 mg sitagliptinu denně po dobu 52 týdnů. Dále např. Raz et al [29] sledovali skupinu 190 nemocných po dobu 30 týdnů, Williams-Herman et al [43] s afiliací farmaceutického průmyslu pak měli v 54týdenním sledování ve velké multinacionální studii 1 091 účastníků.
Sitagliptin, první z iDPP4, je na trhu po schválení FDA od podzimu roku 2006. Proto jsme také zvolili tento preparát jako modelový pro sledování vedlejších účinků gliptinů v naší studii. Naši studii, kterou jsme připravovali od roku 2010, provázelo několik nepříznivých momentů. Prvním byl fakt, že se postupně uvolnila politika pojišťoven vůči nasazování inhibitoru DPP4 sitagliptinu, druhým pak i situace, že se na trhu objevila celá řada dalších substancí stejné skupiny. Počet nemocných, kteří by doposud nebyli léčeni iDPP4 a kteří by současně vyhovovali inkluzním a exkluzním kritériím naší studie, se tedy výrazně zmenšil.
Mírný, ale statisticky významný pokles lačné glykemie a hladiny glykovaného hemoglobinu byl očekávatelným výsledkem léčby iDPP4. Pozorovaná malá absolutní změna parametrů kompenzace diabetu nás vede k předpokladu, že pozorované změny jednotlivých parametrů lze patrně interpretovat jako přímý důsledek podávání sitagliptinu, a nikoli jako efekt poklesu glykemie.
V současné době je k dispozici řada sdělení, která prokazují vliv podávání sitagliptinu na řadu základních funkcí, z poslední doby např. studie, které neprokázaly zhoršení kardiovaskulárního rizika, ani rizika kardiovaskulárních příhod či srdečního selhání po sitagliptinu [12,45]. Podrobně bylo o recentních výsledcích kardiovaskulární bezpečnosti u sitagliptinu, saxagliptinu a alogliptinu referováno i v české literatuře [39]. Ani žádný z našich nemocných neměl během sledování kardiovaskulární příhodu.
Literárních pramenů týkajících se výskytu infekcí u pacientů užívajících iDPP4 překvapivě není mnoho [22,33,45]. Při naší měsíčně prováděné monitoraci výskytu infekčních či zánětlivých onemocnění jsme v průběhu roční studie nalezli jen nevýznamné množství lehčích infekcí horních cest dýchacích a cest močových a nebyl pozorován rozdíl mezi kontrolní skupinou a skupinou léčenou sitagliptinem.
Lando et al [8] ve své studii pozorovali zvýšení hladin amylázy při různých typech inkretinové terapie až ve 30 %. Během ročního sledování jsme u skupiny léčené sitagliptinem zaznamenali významný vzestup aktivity S-AMS většinou nepřevyšující referenční rozmezí. U 2 nemocných došlo k nárůstu hodnot amyláz nad horní hranici normy na hodnoty S-AMS 2,25, resp. 2,51 μkat/l, při normě laboratoře ve FN Královské Vinohrady do 1,67 μkat/l. Pacienti byli bez jakýchkoliv subjektivních příznaků. Protože sledování probíhalo v době, ve které ještě nebyly jasněji definovány vztahy k tomuto jevu, vysadili jsme sitagliptin a doporučili pacienty převést na původní léčbu. Sonografické vyšetření neprokázalo u těchto nemocných žádné změny pankreatu. V literatuře nenajdeme jasné doporučení, jaký by měl být postup u nemocných se vzestupem sérové amylázy pozorované při léčbě sitagliptinem. Problematika postižení pankreatu zánětlivým či nádorovým onemocněním při terapii inhibitory DPP4 zůstává ve středu zájmu. Celostátní dánská studie neprokázala vztah mezi terapií založenou na účinku inkretinů ani inhibitorů DPP4 a rizikem akutní pankreatitidy [41]. K podobným výsledkům dospěli Tella a Rendell [40], kteří analyzovali data z článků, které nalezli v Public Medline. Přes určitou nejistotu uzavírají, že velké randomizované studie neprokázaly zvýšené riziko karcinomu nebo pankreatitidy spojené s léčbou inhibitory DPP4. Oproti tomu studie publikované v elektronické podobě na konci roku 2015 a v tištěné podobě letos asociaci sitagliptinu s rizikem karcinomu konstatují [23,42]. Úvodník publikovaný v prestižním časopise Diabetes Care loni na podzim nekonstatuje větší riziko pankreatické patologie při inkretinové léčbě, považuje však toto stanovisko za zatím ještě nedefinitivní a vyzývá k podrobnému šetření v této oblasti [10]. Podobně jako autoři článku v Diabetes Care se domníváme, že je namístě značná obezřetnost do chvíle, než bude věc definitivně vyřešena. Vše je komplikováno též skutečností, že samotný diabetes představuje riziko vzniku karcinomu pankreatu.
Ústup jaterní steatózy po inhibitorech DPP4 je dobře známý a díky tomu se začíná uvažovat o použití iDPP4 i u jaterní steatózy nediabetologické etiologie. U našich nemocných jsme významnou redukci steatózy nalezli u třetiny nemocných, kteří dostávali sitagliptin, ale u nikoho z kontrolní skupiny. Mechanizmus vedoucí k ústupu jaterní steatózy je často diskutován. Zatímco někteří autoři nenalézají receptor pro GLP1 na povrchu hepatocytů, dalšími byl nalezen a je uváděn do souvislosti s aktivací jaterní oxidace lipidů a obnovením alterované jaterní signalizace indukované vysokotukovou dietou [37]. Exendin, agonista GLP1 receptorů, vedl ke zlepšení steatohepatitidy díky zvýšení exprese Sirt 1 u vysokotukovou dietou indukované experimentální obezity u myši [21]. GLP1 redukuje také jaterní lipogenezi, a to cestou aktivace cAMP-aktivované proteinové kinázy [4]. Přehled vztahů mezi inkretinovou terapií a metabolickým syndromem podal Svačina [36].
V průběhu 52týdenní studie jsme neprokázali na námi sledovaných parametrech závažnější vedlejší účinky. U 2 pacientů byl nalezen vzestup sérové amylázy nad fyziologickou normu, k statisticky významnému vzestupu amylázy v intraindividuálním porovnání v mezích fyziologické normy došlo ovšem v celé skupině probandů. Drobné infekce dýchacích a močových cest se u pacientů užívajících sitagliptin vyskytly stejně často jako u pacientů z kontrolní skupiny.
Práce vznikla díky podpoře grantu IGA MZ ČR 12407–4/2011. Autoři děkují za technickou spolupráci paní Dianě Mžykové.
prof. MUDr. Michal Anděl, CSc.
michal.andel@lf3.cuni.cz
II. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
www.fnkv.cz
Doručeno do redakce 7. 2. 2016
Přijato po recenzi 29. 5. 2016
Zdroje
1. Ahrén B. Glucagon-like peptide-1 (GLP-1): a gut hormone of potential interest in the treatment of diabetes. Review. Βioassays 1998; 20(8): 642–651.
2. American Diabetes Association. Standards of medical care in diabetes-2015. Diabetes Care 2015; 38(Suppl 1): S1-S93.
3. Anděl M, Klimeš I. Glukagon: fyziologie, patofyziologie a klinika. Avicenum: Praha: 1986.
4. Ben-Shlomo S, Zvibel I, Shnell M et al. Glucagon-like peptide-1 reduces hepatic lipogenesis via activation of AMP-activated protein kinase. J Hepatol 2011; 54(6): 1214–1223.
5. Busek P, Stremenová J, Krepela E et al. Modulation of substance P signaling by dipeptidyl peptidase-IV enzymatic activity in human glioma cell lines. Physiol Res 2008; 57(3): 443–449.
6. Buttler PC, Dry S, Elashoff RR. GLP-1 based therapy for diabetes: what you do not know can hurt you. Diabetes Care 2010; 33(2): 453–455.
7. Buttler PC, Matveyenko AV, Dry S et al. Glucagon-like peptide 1 therapy and exocrine pancreas: innocent bystander or friendly fire. Diabetologia 2010; 53(1): 1–6.
8. Lando H, Alattar M, Dua A. Elevated Amylase and Lipase Levels in Patients Using Glucagonlike Peptide-1 Receptor Agonists or Dipeptidyl-Peptidase-4 Inhibitors in the Outpatient Setting. Endocr Pract 2012; 18(4): 472–477.
9. Drucker DJ. The role of gut hormones in glucose homeostasis. J Clin Invest 2007; 117(1): 24–32.
10. Gale EA. Smoke or fire? Acute pancreatitis and the liraglutide trials. Diabetes Care 2015; 38(6): 948–950.
11. Gokhale M, Buse JB, Gray CL et al. Dipeptidyl-peptidase-4 inhibitors and pancreatic cancer: a cohort study. Diabetes Obes Metab 2014; 16(12): 1247–1256.
12. Green JB, Bethel MA, Armstrong PW et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. New Engl J Med 2015; 373(3):232–242. Erratum in Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. [N Engl J Med. 2015].
13. Gutniak M, Orskov C, Holst JJ et al. Antidiabetogenic effect of glucagon-like peptide-1 (7–36)amide in normal subjects and patients with diabetes mellitus. N Engl J Med 1992; 326(20): 1316–1322.
14. Gupta NA, Mells J, Dunham RM et al. Glucagon-like peptide - 1 receptor is present on humanhepatocytes and has a direct role in decreasing hepatic steatosis in vitro by modulating elements of the insulin signaling pathway. Hepatology 2010; 51(5): 1584–1592.
15. Hernaez R, Lazo M, Bonekamp S et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta-analysis. Hepatology 2011; 54(3): 1082–1090.
16. Holman RR, Paul SK, Bethel MA et al. 10 Year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
17. Holst JJ. The physiology of glucagon-like peptide 1. Physiol Rev 2007; 87(4): 1409–1439.
18. Holst JJ. Pharmacology of GLP-1 based therapies. Brit J Diab Vasc Dis 2008; 8(2 Suppl): S10-S18.
19. Kimbal CP, Murlin JR. Aqueous extracts of pancreas. III. Some precipitation reactions of insulin. J Biol Chem 1923; 58(1): 337–346.
20. La Barre J, Stil EU. Studies on physiology of secretin III. Further studies on the effects of secretin on blood sugar. Am J Physiol 1930; 91 : 649–653.
21. Lee J, Hong SW, Chae SW et al. Exendin-4 improves steatohepatitis by increasing Sirt1 expression in high-fat diet-induced obese C57BL/6J mice. PLoS One 2012; 7(2): e31394. Dostupné z DOI: http://dx.doi.org/10.1371/journal.pone.0031394.
22. Mikhail N. Safety of dipeptidyl peptidase 4 inhibitors for treatment of type 2 diabetes. Curr Drug Saf 2011; 6(5): 304–309.
23. Nagel AK, Ahmed-Sarwar N, Werner PM et al. Dipeptidyl Peptidase-4 Inhibitor-Associated Pancreatic Carcinoma: A Review of the FAERS Database. Ann Pharmacother 2016; 50(1): 27–31.
24. Nauck MA, Niederreichholz U, Ettler R et al. Glucagon-like peptide-1 inhibition of gastric emptying outweights its insulinotropic effects in healthy humans. Am J Physiol 1997; 273(5 Pt 1): E981-E988.
25. Nauck MA, Weber I, Bach I et al. Normalization of fasting glycaemia by intravenous GLP-1 ([7–36 amide] or [7–37]) in type 2 diabetic patients. Diabet Med 1998; 15(11): 937–945.
26. Nauck MA, Meininger G, Sheng D et al. Sitagliptin Study 024 Group: Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controled on metformin alone: a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9(2): 194–205.
27. Nauck M. The modulating effects of GLP-1 in type 2 diabetes. Br J Diabetes Vasc Dis 2008; 8(Suppl 2): S1-S2 .
28. Piscaglia F, Salvatore V, Mulazzani L et al. Ultrasound Shear Wave Elastography for Liver Disease. A Critical Appraisal of the Many Actors on the Stage. Ultraschall Med 2016; 37(1): 1–5.
29. Raz I, Chen Y, Wu M et al. Efficacy and safety of sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes. Curr Med Res Opin 2008; 24(2): 537–550.
30. Saito T, Ohnuma K, Suzuki H et al. Polyarthropathy in type 2 diabetes patients treated with DPP4 inhibitors. Diabetes Res Clin Pract 2013; 102(1): e8-e12. Dostupné z DOI: http://dx.doi.org/10.1016/j.diabres.2013.07.010.
31. Samson SL, Bajaj M. Potential of incretin-based therapies for non-alcoholic fatty liver disease. J Diabetes Complications 2013; 27(4): 401–406.
32. Sanyal AJ. [American Gastroenterological Association]. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology 2002; 123(5): 1705–1725.
33. Scheen AJ. Safety of dipeptidyl peptidase-4 inhibitors for treating type 2 diabetes. Expert Opin Drug Saf 2015; 14(4): 505–524.
34. Sromova L, Busek P, Mareckova H et al. The effect of dipeptidyl peptidase-IV inhibition on the immune functions in patients with type 2 diabetes. FEBS J 2014; 281(Suppl 1): 281.
35. Stulc T, Sedo A. Inhibition of multifunctional dipeptidyl peptidase-IV: is there a risk of oncological and immunological adverse effects? Diabetes Res Clin Pract 2010; 88(2): 125–131.
36. Svačina Š. Inkretinová léčba a metabolický syndrom. Vnitř Lék 2011; 57(4): 417–421.
37. Svegliati-Baroni G, Saccomanno S, Rychlicki C et al. Glucagon-like peptide - 1 receptor activation stimulates hepatic lipid oxidation and restores hepatic signalling alteration induced by a high-fat diet in nonalcoholic steatohepatitis. Liver Int 2011; 31(9): 1285–1297.
38. Škrha P, Anděl M, Šedo A. DPP-4 inhibitory a autoimunita. DMEV 2014; 17(2): 61–64.
39. Špinar J, Špinarová L, Vítovec J. Studie TECOS, EXAMINE a SAVOR: Čím se liší a co přinášejí? Vnitř Lék 2015; 61(11): 976–983.
40. Tella SH, Rendell MS. DPP-4 inhibitors: focus on safety. Expert Opin Drug Saf 2015; 14(1): 127–140.
41. Thomsen RW, Pedersen L, Møller N et al. Incretin-based therapy and risk of acute pancreatitis: a nationwide population-based case-control study. Diabetes Care 2015; 38(6): 1089–1098.
42. Tseng CH. Sitagliptin and pancreatic cancer risk in patients with type 2 diabetes. Eur J Clin Invest 2016; 46(1): 70–79.
43. Williams-Herman D, Johnson J, Teng R et al. Efficacy and safety of initial combination therapy with sitagliptin and metformin in patients with type 2 diabetes: a 54-week study. Curr Med Res Opin 2009; 25(3): 569–583.
44. Yang TY, Liaw YP, Huang JY et al. Association of Sitagliptin with cardiovascular outcome in diabetic patients: a nationwide cohort study. Acta Diabetol 2016; 53(3): 461–468.
45. Yang W, Cai X, Han X et al. DPP-4 inhibitors and risk of infections: a meta-analysis of randomized controlled trials. Diabetes Metab Res Rev 2016; 32(4): 391–404.
46. Zunz E, La Barre J. Contributions à l´étude des variations physiologiques de la secretion interne du pancreas: relations entre les secretions externe et interne du pancreas. Arch Int Physiol Biochim 1929; 31 : 20–24.
47. Moore B, Edie ES, Abram JH. On the treatment of Diabetus mellitus by acid extract of Duodenal Mucous Membrane. Biochem J 1906; 1(1): 28–38.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorialČlánek Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péčeČlánek Kardiomyopatie v MR obrazeČlánek Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetem 2. typu – editorial
- Kardiomyopatie v MR obraze – editorial
- Neinfekční a nenádorové lymfadenopatie – editorial
- Perkutánní endoskopická gastrostomie: analýza praxe v endoskopickém centru terciární lékařské péče
- Diabetic Kidney Disease 3rd stage – laboratory markers of mineral bone disorder
- Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem
- Roční sledování vedlejších účinků podávání sitagliptinu u pacientů s diabetes mellitus 2. typu
- Akútne príčiny náhlych úmrtí u pacientov so závažnou hypoglykémiou
- Kardiomyopatie v MR obraze
- Studie HOPE-3: statiny snižují kardiovaskulární příhody u pacientů s intermediárním rizikem ICHS
- mikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
-
Odešel prof. MUDr. Bořivoj Semrád, CSc.
*7. 11. 1938 †19. 6. 2016 -
Bolest v diabetologické ambulanci
Zpráva z IX. mezioborového setkání diabetologických týmů, tentokrát s algeziology, psychiatry, psychology a psychoterapeuty - Symposium of the International Atherosclerosis Society – Anitschkow Days
- Debora Karetová, Jan Bultas. Farmakoterapie tromboembolických stavů
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Sinusová histiocytóza s masivní lymfadenopatií: FDG-PET/CT dokumentovaná parciální remise po léčbě 2-chlorodeoxyadenozinem
- Neinfekční a nenádorové lymfadenopatie – editorial
- Aplikační technika inzulinu u dospělých pacientů s diabetem
- Kardiomyopatie v MR obraze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



