-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba diabetu u pacientů s onemocněním jater a ledvin
The treatment of diabetes in patients with liver and renal impairment
Diabetes mellitus is a progressive disease that may eventually lead to the development of chronic complications. In patients with type 2 diabetes, a simultaneous occurrence of liver or renal impairment is quite frequent. The presence of these diseases significantly increases the risk of hypoglycemia and in case of the renal impairment also the cardiovascular risk. At the same time, the options of antidiabetic treatment are markedly limited in particular in patients with more advanced impairment owing to the fact that numerous antidiabetic drugs are either metabolized or excreted by the liver or the kidney. In this paper, we focus on the treatment of diabetes in patients with renal or liver impairment including limitations of particular drugs and drug classes. We also briefly summarize the risks associated with renal or liver impairment with respect to antidiabetic treatment.
Key words:
diabetes mellitus – hypoglycemia – liver impairment – renal impairment
Autoři: Martin Haluzík
Působiště autorů: III. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2015; 61(4): 304-311
Kategorie: Přehledné referáty
Souhrn
Diabetes mellitus je progresivní onemocnění, které často vede ke vzniku chronických komplikací. U pacientů s diabetem 2. typu se mnohdy setkáváme se souběžným výskytem jaterní či renální insuficience. Přítomnost těchto onemocnění zvyšuje riziko hypoglykemie a v případě renální insuficience i kardiovaskulární riziko. Zároveň jsou však zejména u pacientů s pokročilým postižením výrazně omezeny možnosti jejich antidiabetické léčby s ohledem na fakt, že řada léčiv je v játrech nebo ledvinách metabolizována, případně těmito orgány vylučována. V tomto článku se zaměřujeme na léčbu diabetu u pacientů s renální nebo jaterní insuficiencí včetně konkrétních omezení jednotlivých léků a lékových skupin. Stručně také shrnujeme rizika, která jsou s přítomností renální a jaterní insuficience v souvislosti s léčbou diabetu spojena.
Klíčová slova:
diabetes mellitus – hypoglykemie – jaterní insuficience – renální insuficienceÚvod
Diabetes mellitus (DM) je onemocnění s progresivním průběhem, které může zejména při dlouhodobě neuspokojivé kompenzaci vést ke vzniku chronických komplikací [1]. Na vzniku dlouhodobých komplikací se podílejí i další přidružená onemocnění – arteriální hypertenze, obezita, dyslipidemie – označovaná společně jako metabolický syndrom či syndrom inzulinové rezistence [2]. Mikrovaskulární komplikace zahrnují diabetickou neuropatii, diabetickou retinopatii a diabetickou nefropatii nazývanou u diabetiků 2. typu nově též diabetické onemocnění ledvin [3–5]. Makrovaskulární komplikace se projevují jako 2–3násobně zvýšené riziko kardiovaskulárních příhod zejména infarktu myokardu, mozkové mrtvice a ischemické choroby dolních končetin [6,7]. Jak makrovaskulární, tak mikrovaskulární komplikace mají zásadní dopad na životní prognózu i kvalitu života pacientů s diabetem [8]. Zároveň však přítomnost komplikujících onemocnění často značně omezuje možnosti výběru farmakoterapie u těchto pacientů [9–12]. Řada pacientů s jaterní a renální insuficiencí je navíc často nesprávně léčena léky, které jsou při jejich stupni jaterní či renální insuficience již kontraindikovány [13]. Tento fakt je dán jednak nedostatečným sledováním renální a jaterní funkce, jednak mnohdy i nedostatečnou informovaností lékařů o omezeních některých léků.
V tomto článku se věnujeme specifikům léčby diabetu u pacientů s renální insuficiencí a jaterní insuficiencí. Přítomnost obou těchto onemocnění může zvyšovat riziko hypoglykemie a také nežádoucích účinků antidiabetik, z nichž mnohá jsou v játrech či ledvinách metabolizována, případně těmito orgány vylučována [14]. Renální insuficience navíc výrazně zvyšuje riziko kardiovaskulární morbidity a mortality [15].
Léčba diabetu u pacientů s onemocněním jater
Játra jsou jednak hlavním orgánem metabolizace většiny léků, jednak centrálním orgánem glukózového metabolizmu. Výrazné snížení jaterní funkce může vést k poklesu jaterní glukoneogeneze a zvýšení rizika hypoglykemie. V praxi nejběžnější jaterní onemocnění (steatóza) vede naopak ke zvýšení jaterní inzulinové rezistence [16]. Obecně platí, že mírné změny jaterní funkce (elevace jaterních enzymů na méně než 2,5–3násobek normy) obvykle nepředstavují z hlediska omezení antidiabetik významnější problém. U těžších forem jaterní insuficience je naopak většina antidiabetik kontraindikována. Omezení léčby u pacientů s jaterní insuficiencí jsou přehledně uvedena v tab. 1 a podrobněji se jim věnujeme níže.
Tab. 1. Počty pacientů v jednotlivých větvích dle nasazené léčby 
*platí pro Glucobay Možnosti použití jednotlivých antidiabetik u pacientů s onemocněním jater
Metformin není v organizmu metabolizován a je vylučován v nezměněné formě močí [17,18]. Je kontraindikován při jaterní nedostatečnosti, akutní otravě alkoholem a alkoholizmu. Důvodem těchto omezení je zvýšení rizika laktátové acidózy při snížení schopnosti jater laktát utilizovat. U pacientů s jaterní insuficiencí by tedy metformin neměl být podáván. U pacientů s prostou jaterní steatózou a mírnou elevací jaterních testů může naopak podávání metforminu tento stav zlepšovat a není důvod se jej obávat. Občasná mírná konzumace alkoholu nepředstavuje dle našich zkušeností při léčbě metforminem problém, nicméně v SPC je uveden úplný zákaz konzumace alkoholu.
Všechny dostupné deriváty sulfonylurey (glimepirid, glipizid, gliquidon, gliklazid, glibenklamid) i zástupce glinidů repaglinid se metabolizují v játrech, přičemž gliquidon a glibenklamid mají účinný metabolit [19]. S výjimkou gluquidonu a repaglinidu, jejichž exkrece probíhá převážně žlučí, se ostatní deriváty sulfonylurey vylučují hlavně močí. Všechny deriváty sulfonylurey (s výjimkou glipizidu, u nějž není tato kontraindikace v SPC uvedena) i repaglinid jsou podle SPC kontraindikovány u závažné jaterní nedostatečnosti. U gliquidinu a repaglinididu není podle SPC doporučeno podávat při jakémkoliv stupni jaterní insuficience. Obecně platí, že pokud je jaterní funkce výrazněji omezena a hrozí zvýšené nebezpečí hypoglykemií, měli bychom se derivátům sulfonylurey buď úplně vyhnout nebo je podávat pouze v nízkých dávkách a pacienta pečlivě edukovat stran možného výskytu hypoglykemie.
Akarbóza působí především lokálně a pouze méně než 1 % podané dávky se dostává do systémové cirkulace. Podle SPC není třeba upravovat dávkování u pacientů s preexistující sníženou funkcí jater a těžší poruchy funkce jater nejsou v kontraindikacích uvedeny. Z praktického hlediska budou hlavním omezením léčby akarbózou často se vyskytující gastrointestinální nežádoucí účinky.
Pioglitazon je metabolizován v játrech a vylučován z 55 % močí a ze 45 % stolicí. Podle SPC je pioglitazon kontraindikován u pacientů s poruchou funkce jater. Konkrétně je doporučována kontrola jaterních testů před zahájením léčby, přičemž léčbu pioglitazonem není možno zahájit u pacientů se zvýšenou hladinou jaterních transamináz (ALT > 2,5násobek horní hranice normy) nebo s jinými příznaky onemocnění jater. Po zahájení léčby pioglitazonem je doporučena kontrola hladiny jaterních enzymů v pravidelných intervalech dle posouzení klinického stavu. Dojde-li během léčby ke zvýšení hodnot ALT na 3násobek horní hranice, je třeba jaterní testy co nejdříve zopakovat a v případě potvrzení pak léčbu přerušit. Doporučení ke zvýšené opatrnosti stran poškození jater vycházejí u tohoto preparátu primárně z faktu, že první používaný tiazolidindion – troglitazon byl stažen z trhu pro hepatotoxicitu. Pioglitazon má naopak z některých studií doklady o zlepšení jaterních testů i o pozitivních efektech na jaterní steatózu a steatohepatitidu a případy selhání jater nebyly při jeho podávání (na rozdíl od troglitazonu) popsány [20]. Pozitivní vliv pioglitazonu na jaterní steatózu a elevaci jaterních testů však zatím nevedl k úpravě SPC.
Možnosti použití inhibitorů DPP4 u pacientů s onemocněním jater se u jednotlivých preparátů liší, obecně je ale jejich výhodou proti derivátům sulfonylurey fakt, že nezvyšují riziko hypoglykemie [21]. Sitagliptin je z větší části vylučován v nezměněné podobě močí. U pacientů s mírnou až středně těžkou poruchou funkce jater není nutno dávku nijak upravovat. Podávání sitagliptinu pacientům s těžkou poruchou funkce jater nebylo hodnoceno, a není proto doporučováno [22]. Vildagliptin je metabolizován převážně v ledvinách a z 85 % vylučován močí [22]. Vildagliptin nesmí být podáván pacientům se zhoršenou funkcí jater, včetně pacientů, kteří mají zvýšené hodnoty alaninaminotransferázy (ALT) nebo aspartátaminotransferázy (AST) > 3krát nad horní hranicí normálu před zahájením léčby. Před nasazením vildagliptinu je doporučena kontrola jaterních testů a během 1. roku jejich monitorace v 3měsíčních intervalech a poté pravidelně s menší frekvencí. U pacientů se zvýšením aminotransferáz během léčby na více než 3násobek normy případně s příznaky poškození jater by měl být vildagliptin vysazen a léčba již nesmí být znovu zahájena ani po normalizaci jaterních testů. Uvedená opatření jsou dána historickým faktem, že při podávání vildagliptinu v dávce 100 mg 1krát denně byly popsány ojedinělé případy elevace jaterních testů [23]. Při podávání v dávce 50 mg 2krát nebo 1krát denně (tak, jak je standardní v klinické praxi) nebyl zvýšený výskyt elevace jaterních testů popsán. Uvedená omezení však zatím v SPC přetrvávají. Saxagliptin je metabolizován v játrech prostřednictvím cytochromu P450 3A4/5 a vylučován převážně močí [24]. U pacientů s mírným nebo středně závažným poškozením jater není nutná úprava dávky. Saxagliptin by měl být užíván s opatrností u pacientů se středně závažným poškozením jater a jeho užití se nedoporučuje u pacientů se závažným poškozením jater. Linagliptin je minimálně metabolizován a vylučován v nezměněné podobě převážně stolicí [25]. Podle SPC studie farmakokinetiky linagliptinu naznačují, že není nutná úprava dávky u pacientů s poruchou funkce jater, ale klinické zkušenosti u takových pacientů chybí. U linagliptinu lze tedy předpokládat možnost jeho podávání i u pacientů s těžkým poškozením jater. V případě alogliptinu není u pacientů s lehkou až středně těžkou poruchou funkce jater potřeba žádná úprava dávky. U pacientů s těžkou poruchou funkce jater nebyly účinky alogliptinu studovány a jeho použití u takových pacientů proto není doporučeno.
Rovněž možnosti použití GLP1 agonistů u onemocnění jater jsou u jednotlivých preparátů poněkud odlišné. Exenatid i lixisenatid jsou eliminovány převážně glomerulární filtrací s následnou proteolytickou degradací [26]. U pacientů s jaterní nedostatečností nebyly prováděny žádné farmakokinetické studie, nicméně se neočekává, že by jaterní dysfunkce ovlivňovala jejich koncentrace v krvi. U pacientů s jaterní nedostatečností není dle SPC zapotřebí úprava dávkování těchto dvou léků. Liraglutid je metabolizován podobným způsobem jako velké bílkoviny, aniž by byl zjištěn určitý orgán jako hlavní cesta eliminace. Zkušenosti s léčbou pacientů ve všech stadiích poškození jater jsou v současnosti velmi omezené na to, aby u pacientů s lehkým, středním nebo závažným poškozením jater mohlo být použití doporučeno [27].
Glifloziny mohou být vzhledem k mechanizmu působení i faktu, že nevyvolávají hypoglykemii, potenciálně zajímavou léčebnou možností u pacientů s onemocněním jater [28]. Dapagliflozin, empagliflozin i kanagliflozin jsou metabolizovány glukuronidací v ledvinách a játrech. U pacientů s mírným nebo středně závažným poškozením funkce jater není při léčbě glifloziny nutné upravovat dávku. U pacientů se závažným poškozením jater nemá být vzhledem k nedostatku zkušeností podáván kanagliflozin ani empagliflozin. Dapagliflozin je možné podat v zahajovací dávce 5 mg a při dobré toleranci ev. zvýšit na plnou dávku 10 mg.
Léčbu inzulinem je možné použít u pacientů s jakýmkoliv stupněm jaterního selhání. Neexistují žádná specifická doporučení stran úpravy dávkování, inzulinového režimu či rozdílného působení různých typů inzulinů. V SPC inzulinu je uváděno, že u pacientů se závažným jaterním poškozením mohou být nároky na potřebu inzulinu sníženy poklesem kapacity pro glukoneogenezi i poklesem metabolizace inzulinu. Vzhledem ke zvýšenému riziku hypoglykemie platí u pacientů s těžším poškozením jater ještě více než u diabetiků bez komplikací nutnost použití co nejjednoduššího režimu s co nejmenším rizikem hypoglykemií a velmi obezřetného zvyšování dávek.
Léčba diabetu u pacientů s onemocněním jater: jak postupovat prakticky
Přesná doporučení pro léčbu diabetiků s jaterní insuficiencí nejsou k dispozici. Problematické může mnohdy být i určení, o jaký stupeň jaterní nedostatečnosti se u pacienta jedná.
Zásadně musíme odlišit jaterní nedostatečnost s prokazatelným zhoršením jaterní funkce v důsledku jaterního onemocnění (zde platí výše uvedené kontraindikace dle SPC) od mírné elevace jaterních testů v důsledku prosté jaterní steatózy (obvykle uváděná horní hranice je do 2,5–3násobku normy), která nás naopak v antidiabetické léčbě prakticky neomezuje.
Pokud přípravky rozdělíme podle v SPC uváděných kontraindikací a omezení (tab. 1), získáme skupinu přípravků, které jsou kontraindikovány nebo nedoporučeny ve všech stadiích jaterní insuficience (metformin, repaglinid, pioglitazon, liraglutid, vildagliptin), přípravky, které lze podávat ve všech stadiích jaterní insuficience (linagliptin, exenatid, lixisenatid, akarbóza, inzulin, dapagliflozin) a přípravky zbývající, které je možné používat s různými omezeními jen při lehčím případně středním stupni jaterní insuficience. U novějších přípravků mohou být současná omezení dána primárně nedostatkem zkušeností u pacientů se zhoršenou funkcí jater a není vyloučeno, že v budoucnu může být v některých případech použití u těchto pacientů povoleno.
U pacientů s těžkým stupněm jaterní insuficience tedy můžeme z perorálních antidiabetik použít linagliptin bez nutnosti redukce dávky či dapagliflozin v poloviční počáteční dávce (5 mg). Využít můžeme i lixisenatid či exenatid a pochopitelně také inzulin.
Léčba diabetu u pacientů s chronickým onemocněním ledvin
U diabetiků s chronickým onemocněním ledvin je významně zvýšeno riziko hypoglykemie a kardiovaskulárních komplikací ve srovnání s nemocnými s diabetem bez této komplikace [29]. Ledviny jsou důležitým glukoneogenetickým orgánem a s poklesem jejich funkce se snižuje i schopnost glukoneogeneze [30]. Tato porucha pak spolu s častějším výskytem diabetické neuropatie podmiňuje podstatně vyšší výskyt hypoglykemií, které mohou být často asymptomatické. U nemocných s pokročilými stadii renálního postižení se pak k faktorům podmiňujícím častější výskyt hypoglykemií přidává i větší variabilita v příjmu potravy (nechutenství při retenci katabolitů) a v případě léčby očišťovacími metodami i kolísání inzulinové senzitivity a clearance inzulinu. Omezení léčby u pacientů s renální insuficiencí jsou přehledně uvedena v tab. 2 a podrobněji se jim věnujeme níže.
Tab. 2. Omezení léčby u pacientů s renální insuficiencí. Zpracováno v souladu s SPC jednotlivých přípravků. 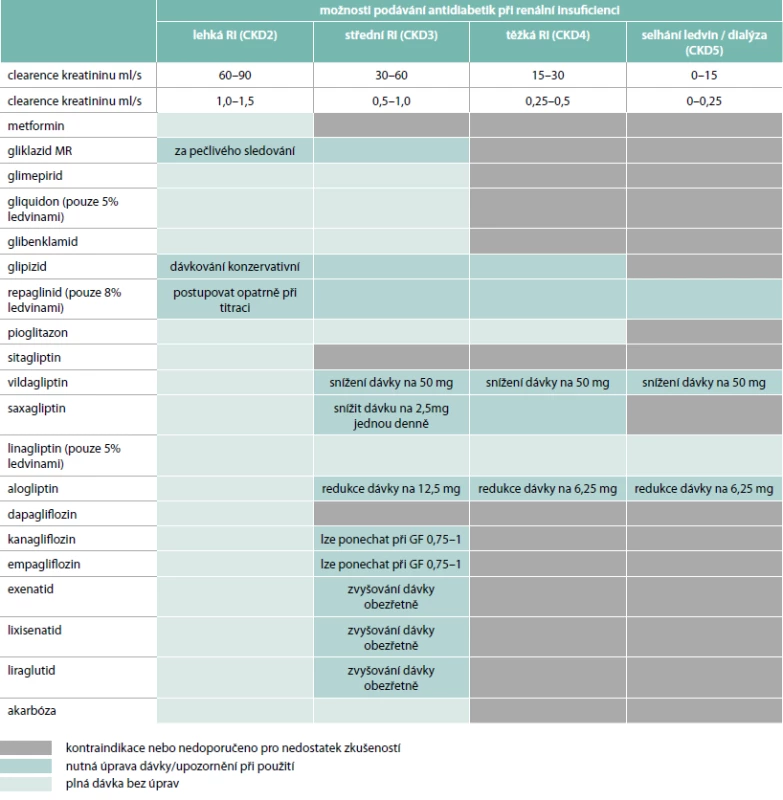
Metformin je základním lékem diabetu 2. typu (DM2T), těžší stupně renální insuficience jsou však kontraindikací jeho podání z důvodu zvýšení rizika laktátové acidózy [31]. Metformin není v organizmu metabolizován a je vylučován v nezměněné formě močí. Při poškozené funkci ledvin tak může docházet ke kumulaci metforminu v organizmu. Metformin je dle SPC kontraindikován při renálním selhání nebo renální dysfunkci (glomerulární filtrace – GF < 1,0 ml/s), dále u akutních onemocnění s rizikem poruchy renálních funkcí, jako je dehydratace, těžká infekce, šok, intravenózní podání jodových kontrastních látek. Standardy České diabetologické společnosti uvádějí, že metformin je kontraindikován při těžké renální insuficienci (GF < 0,5 ml/s). Při GF 0,5–1,0 ml/s léčbu metforminem nově nezahajujeme, u již léčených nemocných snížíme dávku metforminu na polovinu (některá mezinárodní doporučení uvádějí při této renální funkci dávku maximálně 1 000 mg/denně). Při GF > 1,0 ml/s podáváme metformin bez omezení dávky. Podmínkou je kontrola kreatininu v séru a renálních funkcí – minimálně 1krát za rok u osob s normální GF a 4krát za rok u osob poruchou renálních funkcí.
Deriváty sulfonylurey jsou u pacientů zejména s těžšími stadii renální insuficience nevýhodné vzhledem ke zvýšenému riziku hypoglykemie [32]. Podle SPC nicméně můžeme prakticky všechny (glibenklamid, glipizid, gliklazid i glimepirid) podávat pacientům s lehkou až středně těžkou renální insuficiencí (eGRF 0,5–1,0 ml/s). Gliklazid v redukované dávce i pacientům s GF < 0,5 ml/s. Ve většině recentních pramenů jsou jako nejvýhodnější deriváty uváděny glipizid a gliklazid, které prakticky nejsou eliminovány ledvinami, a renální insuficience by tedy přinejmenším jejich vylučování a metabolizaci neměla ovlivňovat. Vyšší riziko hypoglykemie nicméně i při jejich použití přetrvává.
Vzhledem k dobré dostupnosti řady léků s nižším rizikem hypoglykemie by však zejména starší deriváty sulfonylurey s delším poločasem (glibenklamid, glipizid) a vyšším rizikem hypoglykemie u pacientů s renální insuficiencí neměly být pokud možno používány vůbec. Tradičně byl u pacientů s renální insuficiencí používán také gliquidon, který je z hlediska metabolizace rovněž minimálně ovlivněn stupněm renální insuficience. Jedná se však o poněkud méně účinný derivát sulfonylurey s krátkým poločasem, který je nutné používat několikrát denně, což je z pohledu pacienta i lékaře méně výhodné.
Z glinidů je u pacientů s renální insuficiencí použitelný repaglinid, který je téměř úplně metabolizován v játrech, a jeho metabolity jsou vylučovány převážně žlučí. Podobně jako gliquidon je nutné jej podávat 3krát denně a i v případě tohoto preparátu je nevýhodné zvýšení rizika hypoglykemie. Léčbu proto začínáme nízkou dávkou a dlouhodobě zásadně nepřekračujeme střední dávky.
Jak bylo popsáno výše, akarbóza účinkuje lokálně ve střevě a její biologická dostupnost je pouze 1–2 %. Studie nicméně prokázaly, že u pacientů s těžkým renálním postižením jsou sérové koncentrace akarbózy přibližně 5–6krát vyšší než u nemocných s normální renální funkcí. Podle SPC je akarbóza kontraindikována u pacientů s těžšími poruchami funkce ledvin (GF < 0,4 ml/s) a ani u pacientů s lehčími stupni renální insuficience nejsou s podáváním akarbózy větší zkušenosti. Její častější nežádoucí gastrointestinální účinky však budou u těchto pacientů značně omezující.
Pioglitazon může být podle SPC u pacientů se všemi stadii onemocnění ledvin s výjimkou hemodialyzovaných (GF > 0,07 ml/s) podáván bez úpravy dávky. O použití pioglitazonu u dialyzovaných pacientů nejsou žádné údaje, proto se pioglitazon nesmí u těchto pacientů používat. Z praktického hlediska bude použití pioglitazonu u pacientů s těžšími stadii renální insuficience omezeno jeho možnými nežádoucími účinky – retencí tekutin, anémií a snížením kostní denzity. Je třeba striktně vyloučit přítomnost srdečního selhání, které je kontraindikací léčby pioglitazonem [33].
DPP4 inhibitory jsou zajímavou léčebnou možností u pacientů s renální insuficiencí s ohledem na minimální výskyt nežádoucích účinků včetně hypoglykemie a celkově velmi dobrou snášenlivost [34]. V případě sitagliptinu není u pacientů s mírnou poruchou funkce ledvin (GF ≥ 0,8 ml/s) dávku nutno upravovat [24]. U pacientů se středně těžkou poruchou funkce ledvin (GF ≥ 0,5 až < 0,8 ml/s) je dávka sitagliptinu 50 mg jednou denně, zatímco u pacientů s těžkou poruchou funkce ledvin (GF < 0,5 ml/s) nebo s terminálním onemocněním ledvin (ESRD) vyžadujícím hemodialýzu nebo peritoneální dialýzu, je dávka sitagliptinu 25 mg jednou denně. Při léčbě vildagliptinem není u pacientů s mírnou poruchou funkce ledvin (GF ≥ 0,8 ml/s) nutná úprava dávky [24]. U pacientů se středně těžkou nebo těžkou poruchou funkce ledvin nebo u pacientů v konečném stadiu onemocnění ledvin (ESRD) je doporučená dávka vildagliptinu 50 mg 1krát denně. Saxagliptin je možné bez omezení podávat u pacientů s lehkou renální insuficiencí [24]. U pacientů se středně závažným až závažným poškozením ledvin se doporučuje snížit běžnou dávku saxagliptinu z 5 mg na 2,5 mg. U pacientů se závažným poškozením ledvin se doporučuje opatrnost při podávání saxagliptinu a saxagliptin se nedoporučuje podávat pacientům s terminálním poškozením funkce ledvin (ESRD) vyžadujícím hemodialýzu. Dávku linagliptinu není nutné u pacientů s renální insuficiencí upravovat [35]. Alogliptin je možné bez omezení podávat u pacientů s lehkou poruchou funkce ledvin (GF > 0,8 ml/s). U pacientů se středně těžkou poruchou funkce ledvin (GF ≥ 0,5 až ≤ 0,8 ml/s) se dávka snižuje na 12,5 mg jednou denně a u pacientů s těžkou poruchou funkce ledvin (GF < 0,5 ml/s) nebo terminálním renálním selháním vyžadujícím dialýzu na 6,25 mg denně.
Užití GLP1 agonistů může být u pacientů s renální insuficiencí výhodné s ohledem na jejich bezpečnost stran hypoglykemie [36]. Omezením jsou naopak jejich častější nežádoucí gastrointestinální účinky a snížení hmotnosti, které je v pokročilejších stadiích renální insuficience nevýhodné. Exenatid, lixisenatid i liraglutid je možné bez redukce dávky podávat pacientům s lehkou renální insuficiencí (GF 0,8–1,3 ml/s), u středně těžké renální insuficience (GF 0,5–0,8 ml/s) by dle SPC zvyšování dávky GLP1 agonistů mělo probíhat obezřetně. Podávání exenatidu, lixisenatidu i liraglutidu u pacientů v konečném stadiu renálního selhávání nebo se závažnou renální nedostatečností (GF < 0,5 ml/s) není doporučeno. Podrobnější informace o použití GLP1 agonistů u pacientů s renální insuficiencí jsou uvedeny v článku MUDr. Adamíkové v tomto čísle časopisu Vnitřní lékařství.
Antidiabetická účinnost gliflozinů je závislá na renální funkci. Proto není jejich podávání doporučeno u pacientů s pokročilejšími stadii renální insuficience. U pacientů s GF < 1,0 ml/s by žádný z gliflozinů neměl být nově nasazován [37]. V případě již zavedené léčby kanagliflozinem či empagliflozinem může být léčba ponechána při GF v rozmezí 0,75–1 ml/s při pravidelných kontrolách renální funkce. Dapagliflozin by dle SPC měl být při poklesu GF < 1,0 ml/s vysazen.
Léčba inzulinem je u pacientů s onemocněním ledvin často nezbytná. Je však nutné postupovat velmi obezřetně vzhledem k vyššímu riziku hypoglykemie a také změnám v metabolizaci exogenně podávaného inzulinu [38]. Při exogenní aplikaci inzulinu je 70 % z něj metabolizováno v ledvinách a pouze asi 30 % v játrech, zatímco v případě endogenně produkovaného inzulinu je tomu naopak. V pokročilých stadiích renální insuficience dochází také k významné poruše degradace inzulinu [39]. Tyto změny se podstatněji projeví až při poklesu glomerulání filtrace na hodnoty 0,25–0,3 ml/s. V této fázi se snižuje nejen clearance inzulinu v ledvinách, ale klesá také jeho metabolizace v játrech, což je vysvětlováno negativním působením uremických toxinů na játra. Rovněž inzulinová senzitivita a celková potřeba inzulinu může u pacientů s renální insuficiencí výrazně kolísat. Studie ukazují, že potřeba inzulinu může u pacientů s postupným poklesem glomerulární filtrace z 1,3 ml/s na 0,2 ml/s klesnout o 40–50 %.
Specifická doporučení k úpravě dávek inzulinu u pacientů s renální insuficiencí jsou dosti obecná a k dispozici jejich není mnoho. Podle doporučení Američan College of Physicians by dávky inzulinu měly být u pacientů s glomerulární filtrací 0,8–0,2 ml/s sníženy o 25 % a u pacientů s glomerulární filtrací < 0,2 ml/s pak o 50 %. Uvedené úpravy jsou pochopitelně pouze orientační a v praxi postupujeme vždy podle výsledků selfmonitoringu a snažíme se kromě dosažení co nejlepší kompenzace také co nejvíce omezit výskyt hypoglykemií. Velmi významnou otázkou, na kterou známe dosud pouze částečnou odpověď, je, jak těsná by měla být kompenzace u pacientů s různým stupněm renálního postižení. Z obecného hlediska máme dostatek důkazů, že těsná kontrola glykemie je nejlepší prevencí vzniku diabetické nefropatie i její progrese. Velké epidemiologické analýzy u pacientů s diabetickou nefropatií a s glomerulární filtrací < 1 ml/s ukazují, že mortalita se zvyšuje jak u pacientů s příliš nízkým, tak i příliš vysokým glykovaným hemoglobinem, přičemž jako optimální rozmezí se jeví glykovaný hemoglobin v rozmezí 50–65 mmol/l. Výpovědní hodnota glykovaného hemoglobinu navíc může být u pacientů s renální insuficiencí vzhledem ke změnám přežívání erytrocytů a častějšímu výskytu anémie dosti sporná.
Ze srovnávacích studií inzulinových analog a humánních inzulinů, které máme k dispozici, vyplývá, že u populace diabetiků s normální či jen lehce sníženou renální funkcí (těžší renální insuficience je obvykle vylučovacím kritériem zařazení do těchto studií) lze pomocí inzulinových analog dosáhnout srovnatelné nebo mírně lepší kompenzace při nižším výskytu hypoglykemií [40]. Tyto údaje naznačují, že podobné výsledky můžeme pravděpodobně očekávat i u pacientů s těžšími stupni renální insuficience. Studie, které by tento předpoklad potvrzovaly, však zatím nejsou k dispozici. Farmakokinetické studie naznačují, že přítomnost chronické renální insuficience farmakokinetiku ani farmakokinetiku inzulinových analog významněji neovlivňuje.
Praktické aspekty léčby diabetu u pacientů s onemocněním ledvin
U pacientů s lehčím stupněm renální insuficience jsou léčebné možnosti široké a omezení minimální. Pouze v případě metforminu bychom léčbu neměli zahajovat při GF < 1 ml/s a u derivátů sulfonylurey, glinidů a inzulinu bychom měli být v dávkování velmi obezřetní vzhledem k riziku hypoglykemie. Složitější je situace u středně těžké renální insuficience. Rozumnou alternativou je léčba linagliptinem bez nutnosti úpravy dávky případně vildagliptinem v dávce 50 mg 1krát denně. Ostatní gliptiny nejsou v tabletách s nižší dávkou k dispozici. Při GF v rozmezí 0,75–1 ml/s je možné ponechat léčbu kanagliflozinem nebo empagliflozinem a metforminem v dávce redukované na polovinu (doporučení ČDS), zatímco dapagliflozin by měl být vysazen již při poklesu GF < 60 ml/min. U středně těžké renální insuficience připadá v úvahu také léčba lixisenatidem nebo exenatidem, zatímco podávání liraglutidu není doporučeno. U těžkého stupně renální insuficience zůstává možnost podávání linagliptinu v plné či vildagliptinu v poloviční dávce a ve všech stadiích je pochopitelně možné využít inzulinové terapie se zohledněním výše uvedených rizik.
Závěr
Léčba diabetu u pacientů s renální a jaterní insuficiencí je komplikovaná vzhledem vyššímu riziku hypoglykemie a faktu, že řada antidiabetik včetně inzulinu je v játrech a ledvinách metabolizována. Možnosti léčby značně rozšířila dostupnost novějších léků, zejména DPP4 inhibitorů, z nichž linagliptin je možné bez omezení dávky podávat ve všech stadiích renální a jaterní insuficience. Obecně platí, že perorální antidiabetika zvyšující riziko hypoglykemie – deriváty sulfonylurey a glinidy – bychom měli indikovat velmi obezřetně a přísně respektovat jejich kontraindikace a případnou redukci dávek. V případě nutnosti inzulinové terapie jsou preferovány jednodušší režimy s nižším rizikem hypoglykemie. Preferována by měla být spíše inzulinová analoga s ohledem na předpokládaný nižší výskyt hypoglykemií. Vhodné je zvážit možnost kombinace dlouhodobě působícího inzulinu s perorálními antidiabetiky nezvyšujícími riziko hypoglykemie – DPP4 inhibitory či glifloziny ev. injekční dvojkombinaci inzulinu s GLP1 agonisty.
Některé novější léky, především DPP4 inhibitory a částečně také GLP1 agonisté mohou mít potenciální nefroprotektivní účinky [41,42]. V případě GLP1 agonistů byl opakovaně popsán pozitivní vliv na zlepšení jaterní steatózy [43]. Není tedy vyloučeno, že v budoucnu budeme některá nová antidiabetika indikovat nejen s ohledem na jejich bezpečnost, ale i možné pozitivní účinky na onemocnění jater a ledvin.
Podporováno RVO-VFN64165 a projektem OPPK CZ.2.16/3.1.00/24012.
prof. MUDr. Martin Haluzík, DrSc.
mhalu@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 16. 2. 2015
Přijato po recenzi 13. 3. 2015
Zdroje
1. Tamayo T, Rosenbauer J, Wild SH et al. Diabetes in Europe: An update for 2013 for the IDF Diabetes Atlas. Diabetes research and clinical practice 2013; 103(2): 206–217.
2. Svačina S, Owen K. Syndrom inzulínové rezistence. Triton: Praha 2003. ISBN 80–7254–353–9.
3. Gimeno-Orna JA, Castro-Alonso FJ, Boned-Juliani B et al. Fasting plasma glucose variability as a risk factor of retinopathy in Type 2 diabetic patients. J Diabetes Complications 2003; 17(2): 78–81.
4. Pappachan JM, Sebastian J, Bino BC et al. Cardiac autonomic neuropathy in diabetes mellitus: prevalence, risk factors and utility of corrected QT interval in the ECG for its diagnosis. Postgrad Med J 2008; 84(990): 205–210.
5. Feest TG, Dunn EJ, Burton CJ. Can intensive treatment alter the progress of established diabetic nephropathy to end-stage renal failure? QJM 1999; 92(5): 275–282.
6. Haffner SM. Pre-diabetes, insulin resistance, inflammation and CVD risk. Diabetes Res Clin Pract 2003; 61(Suppl 1): S9-S18.
7. Haffner SM, Lehto S, Ronnemaa T et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339(4): 229–234.
8. Haffner SM. Insulin resistance, inflammation, and the prediabetic state. Am J Cardiol 2003; 92(4A): 18J-26J.
9. Haluzik M, Rychlík I et al. Léčba diabetu u pacientů s onemocněním ledvin a jater. Mladá fronta: Praha 2012. ISBN 978–80–204–2671–0.
10. Škrha J (ed). Diabetologie. Galén: Praha 2009. ISBN 978–80–7262–607–6.
11. Haluzík M (ed). Praktická léčba diabetu. Mladá fronta: Praha 2009. ISBN 978–80–204–2071–8.
12. Pelikánová T, Bartoš V (eds). Praktická diabetologie. 5th ed. Maxdorf: Praha 2011. ISBN 978–80–7345–244–5.
13. Koro CE, Lee BH, Bowlin SJ. Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States. Clin Ther 2009; 31(11): 2608–2617.
14. Meyer C, Dostou JM, Welle SL et al. Role of human liver, kidney, and skeletal muscle in postprandial glucose homeostasis. Am J Physiol Endocrinol Metab 2002; 282(2): E419-E427.
15. Meyer C, Dostou JM, Gerich JE. Role of the human kidney in glucose counterregulation. Diabetes 1999; 48(5): 943–948.
16. Sakurai M, Takamura T, Ota T et al. Liver steatosis, but not fibrosis, is associated with insulin resistance in nonalcoholic fatty liver disease. J Gastroenterol 2007; 42(4): 312–317.
17. Ali S. Fonseca V. Overview of metformin: special focus on metformin extended release. Expert Opin Pharmacother 2012; 13(12): 1797–1805.
18. Anděl M, Škrha P, Trnka J. Metformin: na pomezí diabetologie a onkologie. Diabetologie, metabolizmus, endokrinologie, výživa 2013; 16(4): 212–217.
19. Rosenstock J, Marx N, Kahn SE et al. Cardiovascular outcome trials in type 2 diabetes and the sulphonylurea controversy: rationale for the active-comparator CAROLINA trial. Diab Vasc Dis Res 2013; 10(4): 289–301.
20. Promrat K, Lutchman G, Uwaifo GI et al. A pilot study of pioglitazone treatment for nonalcoholic steatohepatitis. Hepatology 2004; 39(1): 188–196.
21. Ahren B, Schweizer A, Dejager S et al. Mechanisms of action of the dipeptidyl peptidase-4 inhibitor vildagliptin in humans. Diabetes Obes Metab 2011; 13(9): 775–783.
22. Baetta R, Corsini A. Pharmacology of dipeptidyl peptidase-4 inhibitors: similarities and differences. Drugs 2011; 71(11): 1441–1467.
23. Cai L, Cai Y, Lu ZJ et al. The efficacy and safety of vildagliptin in patients with type 2 diabetes: a meta-analysis of randomized clinical trials. J Clin Pharm Ther 2012; 37(4): 386–398.
24. Scheen AJ. Pharmacokinetics of dipeptidylpeptidase-4 inhibitors. Diabetes Obes Metab 2010; 12(8): 648–658.
25. Neumiller JJ. Pharmacology, efficacy, and safety of linagliptin for the treatment of type 2 diabetes mellitus. Ann Pharmacother 2012; 46(3): 358–367.
26. Madsbad S. Exenatide and liraglutide: different approaches to develop GLP-1 receptor agonists (incretin mimetics) – preclinical and clinical results. Best Pract Res Clin Endocrinol Metab 2009; 23(4): 463–477.
27. Davies MJ, Kela R, Khunti K. Liraglutide – overview of the preclinical and clinical data and its role in the treatment of type 2 diabetes. Diabetes Obes Metab 2011; 13(3): 207–220.
28. Abdul-Ghani MA, DeFronzo RA. Inhibition of renal glucose reabsorption: a novel strategy for achieving glucose control in type 2 diabetes mellitus. Endocr Pract 2008; 14(6): 782–790.
29. Detournay B, Simon D, Guillausseau PJ et al. Chronic kidney disease in type 2 diabetes patients in France: prevalence, influence of glycaemic control and implications for the pharmacological management of diabetes. Diabetes Metab 2012; 38(2): 102–112.
30. Gerich JE. Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: therapeutic implications. Diabet Med 2010; 27(2): 136–142.
31. Viollet B, Guigas B, Sanz Garcia N et al. Cellular and molecular mechanisms of metformin: an overview. Clin Sci (Lond) 2012; 122(6): 253–270.
32. Owens DR, Swallow R, Dugi KA et al. Efficacy and safety of linagliptin in persons with type 2 diabetes inadequately controlled by a combination of metformin and sulphonylurea: a 24-week randomized study. Diabet Med 2011; 28(11): 1352–1361.
33. Lincoff AM, Wolski K, Nicholls SJ et al. Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials. JAMA 2007; 298(10): 1180–1188.
34. Deacon CF. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes: a comparative review. Diabetes Obes Metab 2011; 13(1): 7–18.
35. Aletti R, Cheng-Lai A. Linagliptin: the newest dipeptidyl peptidase-4 inhibitor for type 2 diabetes mellitus. Cardiol Rev 2012; 20(1): 45–51.
36. Aaboe K, Krarup T, Madsbad S et al. GLP-1: physiological effects and potential therapeutic applications. Diabetes Obes Metab 2008; 10(11): 994–1003.
37. Bakris GL, Fonseca VA, Sharma K et al. Renal sodium-glucose transport: role in diabetes mellitus and potential clinical implications. Kidney Int 2009; 75(12): 1272–1277.
38. Iglesias P, Diez JJ. Insulin therapy in renal disease. Diabetes Obes Metab 2008; 10(10): 811–823.
39. Papa G, Baratta R, Cali V et al. Factors that influence basal insulin requirement in type 2 diabetes. Acta Diabetol 2012; 49(5): 387–393.
40. Dunn CJ, Plosker GL, Keating GM et al. Insulin glargine: an updated review of its use in the management of diabetes mellitus. Drugs 2003; 63(16): 1743–1778.
41. Thomas MC. Renal effects of dapagliflozin in patients with type 2 diabetes. Ther Adv Endocrinol Metab 2014; 5(3): 53–61.
42. Haluzik M, Frolik J, Rychlik I. Renal Effects of DPP-4 Inhibitors: A Focus on Microalbuminuria. Int J Endocrinol 2013; 2013 : 895102. Dostupné z DOI: <http://doi: 10.1155/2013/895102>.
43. Cuthbertson DJ, Irwin A, Gardner CJ et al. Improved glycaemia correlates with liver fat reduction in obese, type 2 diabetes, patients given glucagon-like peptide-1 (GLP-1) receptor agonists. PloS one 2012; 7(12): e50117. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0050117>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Úvodní slovo prof. MUDr. Štěpána Svačiny, CSc., MBA,
editora tohoto vydání časopisu Vnitřní lékařství - Postavení nových antidiabetik v klinické praxi: SGLT2 vs DPP4 inhibitory
- Sdělení redakce časopisu
-
Volí diabetologové terapii racionálně?
Základní výsledky projektu PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu) - Biosimilární inzuliny – nové možnosti v léčbě diabetu
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Možnosti terapie agonisty receptoru pro GLP1 u diabetiků s nefropatií
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba diabetu u osob vyššího věku
- Problematika infekce při syndromu diabetické nohy
- Léčba hypertenze u diabetes mellitus
- Pohybová aktivita u pacientů s mikrovaskulárními komplikacemi diabetu
- Glykace proteinů oční čočky u diabetiků a její neinvazivní měření – první zkušenosti v České republice
- miRNA-192, miRNA-21 a miRNA-200: nové markery karcinomu pankreatu u diabetiků?
- Pokroky ve vývoji inzulinových pump a jejich pokročilých automatických funkcí
- Mikrobiální flóra trávicího traktu a diabetes
- Myokiny – hormony svalové tkáně
-
Úvodní slovo prof. MUDr. Štěpána Svačiny, CSc., MBA,
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Myokiny – hormony svalové tkáně
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba hypertenze u diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



