-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Glykace proteinů oční čočky u diabetiků a její neinvazivní měření – první zkušenosti v České republice
Glycation of lens proteins in diabetes and its non-invasive assessment – first experience in the Czech Republic
Advanced glycation end-products (AGEs) play a crucial role in the pathogenesis of diabetes and its complications. Their accumulation in the lens reflects total glycation rate in the human body. Recently, a new confocal biomicroscope ClearPath DS-120 quickly measuring lens autofluorescence (LAF) has been developed. Our pilot study included 69 patients with diabetes and 49 healthy controls, in all subject LAF was measured and compared with skin autofluorescence (SAF) assessed by AGE-Reader. Both LAF (T1DM: 0,27 ± 0,09; T2DM: 0,22 ± 0,06; controls: 0,17 ± 0,04 AU; p < 0,0001) and SAF (T1DM: 2,0 ± 0,4; T2DM: 2,3 ± 0,6; controls: 1,8 ± 0,3 AU; p < 0,0001) was significantly higher in patients with diabetes. In all groups significant relationship between LAF and SAF was observed (T1DM: r = 0,53, p < 0,005, T2DM: r = 0,37, p < 0.05; controls: r = 0,30, p < 0,05). On the contrary, LAF and SAF relationship with glycated hemoglobin (HbA1c) was rather poor, since HbA1c cannot wholly reflect long-term glycation process. Lens autofluorescence could be a robust marker of long-term diabetes control predicting future complication risks. However, confirmation of such hypothesis will need other and long-term clinical studies.
Key words:
advanced glycation end-products – diabetes mellitus – glycation – hyperglycemia – lens autofluorescence – skin autofluorescence
Autoři: Jan Škrha Jr; Jan Šoupal; Martin Prázný; Jan Škrha
Působiště autorů: III. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2015; 61(4): 346-350
Kategorie: Původní práce
Souhrn
Konečné produkty pokročilé glykace (AGEs) hrají významnou roli v patogenezi diabetu i diabetických komplikací. Jejich hromadění v oční čočce odráží celkový stav glykace v organizmu. Nedávno byl na trh uveden nový konfokální biomikroskop ClearPath DS-120, který umožňuje rychlé a neinvazivní stanovení AGEs v oční čočce na základě autofluorescence (LAF) některých AGEs. V naší pilotní studii jsme vyšetřili LAF u 69 diabetiků a 49 zdravých kontrol a srovnali se současně měřenou kožní autofluorescencí (SAF) na předloktí pomocí AGE-Readeru. Bylo pozorováno významné zvýšení LAF (DM1T: 0,27 ± 0,09; DM2T: 0,22 ± 0,06; kontroly: 0,17 ± 0,04 AU; p < 0,0001) i SAF (DM1T: 2,0 ± 0,4; DM2T: 2,3 ± 0,6; kontroly: 1,8 ± 0,3 AU; p < 0,0001) u pacientů s diabetem oproti zdravým kontrolám. Ve všech skupinách byl popsán významný vztah mezi LAF a SAF (DM1T: r = 0,53; p < 0,005; DM2T: r = 0,37; p < 0,05; kontroly: r = 0,30; p < 0,05). Naopak závislost LAF ani SAF na HbA1c nebyla přesvědčivá, což asi souvisí s tím, že hodnota glykovaného hemoglobinu dostatečně neodráží mnohaletý stav glykace v organizmu. Stanovení oční autofluorescence možná přináší robustní marker dlouhodobé kompenzace diabetu predikující riziko budoucích komplikací, avšak definitivní potvrzení takové hypotézy si vyžádá četnější a delší klinické studie.
Klíčová slova:
autofluorescence oční čočky – diabetes mellitus – glykace – hyperglykemie – konečné produkty pokročilé glykace – kožní autofluorescenceÚvod
Již více než 100 let známe spontánní neenzymatický děj mezi redukujícími sacharidy a proteiny nazývaný glykace. Tato reakce byla poprvé popsána Louis Camillem Maillardem, a nese tak dodnes jeho jméno [1]. Jedná se o reakci relativně pomalou, která však u všech živých organizmů dříve či později vede ke vzniku značně heterogenních molekul označovaných jako konečné produkty pokročilé glykace (advanced glycation endproducts – AGEs). Tuto reakci urychlují vyšší koncentrace glukózy či dalších sacharidů, dikarbonyly (metylglyoxal či glyoxal), ale v některých tkáních i vyšší koncentrace kyseliny askorbové [2].
AGEs vznikají a negativně se uplatňují během fyziologického stárnutí, Alzheimerově chorobě, erektilní dysfunkci, ateroskleróze, při zánětlivých onemocněních či renální dysfunkci [3]. Nejvíce se však se zvýšenou akumulací AGEs setkáváme u diabetu, u nějž jsou považovány za jeden z hlavních faktorů rozvoje cévních změn, a to jak změn mikroangiopatických, tak makroangiopatických. Uplatňují se zde 3 základní patofyziologické mechanizmy vlivu AGEs:
- akumulace AGEs v extracelulární matrix vedoucí k „zesíťování“ proteinů a snížené cévní elasticitě
- glykace intracelulárních proteinů měnící jejich funkci, a v neposlední řadě
- vazba AGEs na membránové receptory aktivující intracelulární kaskády modulující mj. genovou expresi [3].
Neméně významná je účast AGEs v samotné patogenezi diabetu. V posledních letech přibývá důkazů o tom, že konečné produkty glykace se podstatnou měrou podílejí na rozvoji inzulinové rezistence. Bylo popsáno několik mechanizmů a o celé řadě dalších se spekuluje. Glykace inzulinu kupříkladu vede k jeho nižší účinnosti v cílových tkáních [4]. Rovněž bylo prokázáno, že vyšší koncentrace metylglyoxalu (prekurzoru AGEs) modifikují AMP kinázu, a tím zvyšují inzulinovou rezistenci v játrech [5].
Je tedy pochopitelné, že vliv AGEs v rozvoji diabetu i diabetických komplikací je komplexní a zasahuje více či méně všechny orgánové soustavy a nevyhýbá se ani oční čočce.
Glykace a autofluorescence oční čočky
Oční čočka je orgán zajišťující lom světelných paprsků na sítnici. K úplné funkci musí být čočka elastická a plně transparentní, což zajišťují komplikovaně organizované proteiny. Největší část proteinů čočky tvoří krystaliny, které jsou pomalu syntetizovány na periferii čočky a se stárnutím se přesouvají do jejího centra, v němž tvoří jádro. Tam se také vyskytují pravděpodobně nejdéle „žijící“ proteiny lidského těla. Na rozdíl od okolních struktur obsahuje čočka mladého jedince nižší koncentraci kyslíku i glukózy [6,7]. V průběhu let však podléhá změnám, při kterých dochází ke kolorizaci a hromadění AGEs. První popsanou molekulou ze skupiny AGEs byl v roce 1986 karboxymetyllysin [8], postupně následovaly fluorescenční pentosidin či pyrralin [9]. Do dnešního dne je známo více než 15 různých molekul AGEs, z nichž většina se vyskytuje právě v oční čočce. Zatímco některé AGEs mají spíše souvislost s rozvojem stařecké katarakty, jiné AGEs se výrazně uplatňují v rozvoji diabetických změn [10]. Do druhé skupiny patří i v posledních letech hojně studovaný glukosepan, významný marker diabetické mikroangiopatie [11].
Již bylo uváděno, mnohé AGEs mají fluorescenční vlastnosti, jež lze využít k jejich neinvazivnímu stanovování. Samotná autofluorescence čočky byla známa již v 1. polovině minulého století [12,13], ale až koncem 20. století bylo doloženo, že autofluorescence čočky (LAF) stoupá s věkem a je výrazně vyšší u diabetiků [14]. Zároveň autofluorescence úzce koreluje s celkovým množstvím všech stanovovaných AGEs v čočce [15]. Na našem pracovišti jsme v minulých letech vyšetřili u mnoha diabetiků 1. i 2. typu kožní autofluorescenci (SAF) [16], ale jednoduché měření autofluorescence oční čočky bylo dlouho nedostupné. Teprve nedávno byl vyvinut přístroj neinvazivně stanovující LAF.
Cílem této pilotní studie bylo porovnat oční a kožní autofluorescenci u diabetiků 1. a 2. typu a výsledky srovnat se zdravými kontrolami.
Soubor vyšetřených a metody
Měření autofluorescence oční čočky (LAF) a kůže (SAF) u diabetiků i zdravých kontrol probíhalo na III. interní klinice 1. LF UK a VFN Praha na podzim roku 2014. Celkem bylo vyšetřeno 69 diabetiků (32 s diabetem 1. typu – DM1T, 37 s diabetem 2. typu – DM2T; průměrný věk 53 ± 12 let) a 49 zdravých kontrol (průměrný věk 43 ± 12 let). Podrobnější charakteristiku souboru uvádí tab. Studie byla v souladu s Helsinskou deklarací a byla schválena Etickou komisí Všeobecné fakultní nemocnice Praha.
Tab. 1. Charakteristika souboru a základní výsledky 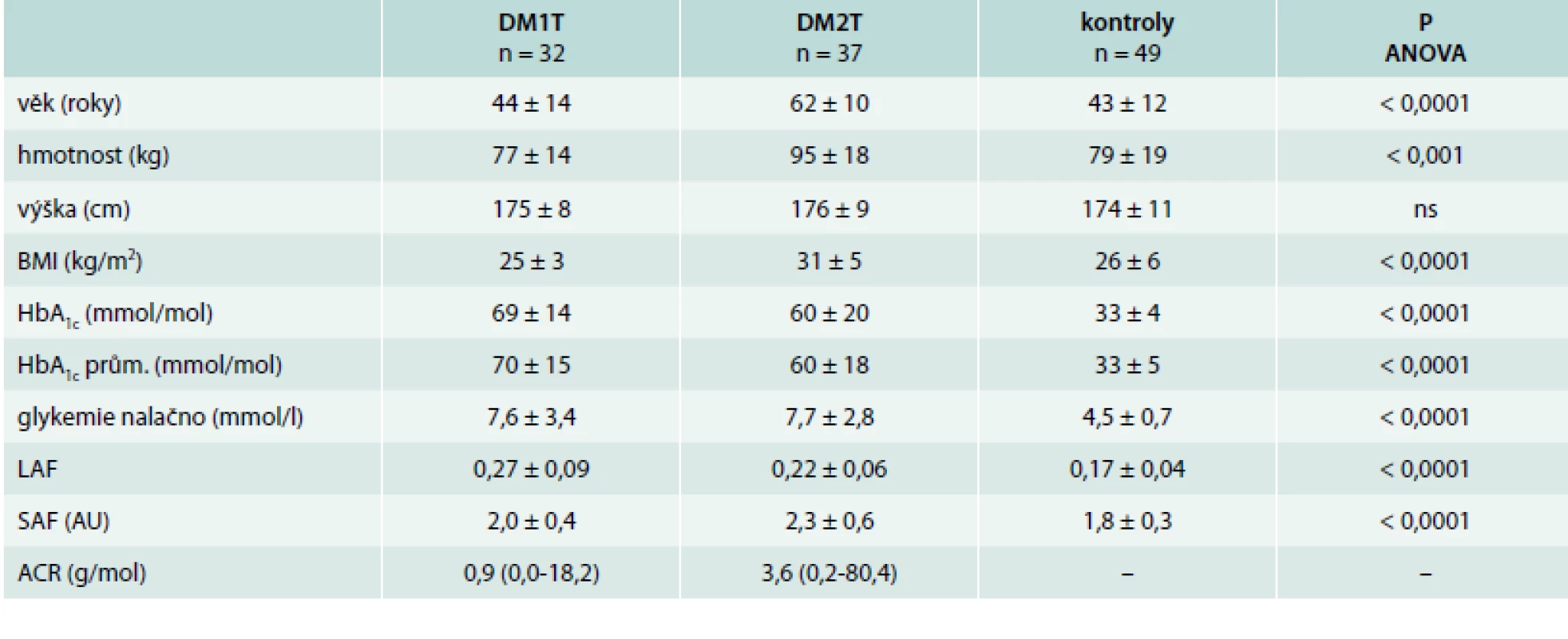
K měření LAF byl poprvé v České republice využit biomikroskop ClearPath DS-120 (Freedom Meditech, San Diego, US), který neinvazivně stanovuje autofluorescenci levé oční čočky. Během několika vteřin přístroj osvítí čočku modrým světlem a měří fluorescenční zelené světlo a zároveň rozptýlené modré světlo. Softwarově je pak vypočten poměr autofluorescence čočky k rozptýlenému světlu v centrální části oční čočky, který nás informuje o množství akumulovaných konečných produktů glykace AGEs. Čím vyšší tento poměr je, tím je obsah AGEs v čočce vyšší [17]. Přináší tak novou informaci o dlouhodobé glykační zátěži konkrétního jedince. Kožní autofluorescence (SAF) byla měřena na předloktí pomocí AGE-Readeru (DiagnOptics BV, Groningen, Nizozemí) dle originálních doporučení [18] a je uváděna v arbitrárních jednotkách (AU).
Výsledky LAF a SAF vyšetřených osob byly srovnány s jejich věkem, antropometrickými údaji, glykovaným hemoglobinem (HbA1c) a albuminurií, vyjádřenou pomocí poměru močového albuminu/kreatininu (ACR). Za pozitivní mikroalbuminurii byl považován ACR > 3 g/mol. Vzhledem k logaritmickému rozložení ACR byla data logaritmována. Stav kompenzace diabetu byl vyjádřen jednak glykovaným hemoglobinem v době měření (HbA1c), a dále průměrnou hodnotou glykovaného hemoglobinu v posledním roce (HbA1c prům).
Výsledky biochemických parametrů jsou vyjádřeny jako průměr a směrodatná odchylka (SD), popř. průměr a rozpětí u logaritmických dat. Rozdíly mezi skupinami byly vyhodnoceny jednocestnou variační analýzou (ANOVA) s post hoc testy. Korelace byly stanoveny pomocí Pearsonova koeficientu. Statistická analýza byla provedena v programu Statistica 12 (StatSoft).
Výsledky
Autofluorescence oční čočky (LAF) byla významně vyšší u pacientů s diabetem 1. i 2. typu oproti kontrolám (0,27 ± 0,09; 0,22 ± 0,06; 0,17 ± 0,04; p < 0,0001). Analogické výsledky byly pozorovány u SAF (2,0 ± 0,4; 2,3 ± 0,6; 1,8 ± 0,3 AU; p < 0,0001). V jednotlivých případech jsme identifikovali několik osob bez diabetu se zvýšenou autofluorescencí čočky. Naproti tomu se vyskytlo několik případů recentně zachycených diabetiků 1. typu, u kterých byla autofluorescence nízká. Glykovaný hemoglobin v době měření byl vyšší u DM1T oproti DM2T a kontrolám (69 ± 14; 60 ± 20; 33 ± 3 mmol/mol; p < 0,0001) a velice srovnatelné výsledky byly i u průměrného HbA1c v posledním roce.
Ve všech skupinách byla pozorována závislost autofluorescence na věku (LAF: r = 0,31, p < 0,001; SAF: r = 0,61, p < 0,0001). Naopak souvislost s HbA1c se projevila jen u DM2T jak v případě LAF (DM1T: r = 0,10, ns; DM2T: r = 0,46, p < 0,01; kontroly: r = 0,28, ns, obr. 1, tak v případě SAF (DM1T: r = 0,32, ns; DM2T: r = 0,62, p < 0,0001; kontroly: r = 0,22, ns). Podobné byly závislosti i s průměrným HbA1c v posledním roce. Ve všech skupinách byl pozorován významný vztah mezi LAF a SAF (DM1T: r = 0,53, p < 0,005, DM2T: r = 0,37, p < 0,05; kontroly: r = 0,30, p < 0,05) (obr. 2). LAF se významně nelišila u pacientů bez či s pozitivní (mikro)albuminurií.
Obr. 1. Závislost autofluorescence oční čočky (LAF) na HbA<sub>1c</sub> 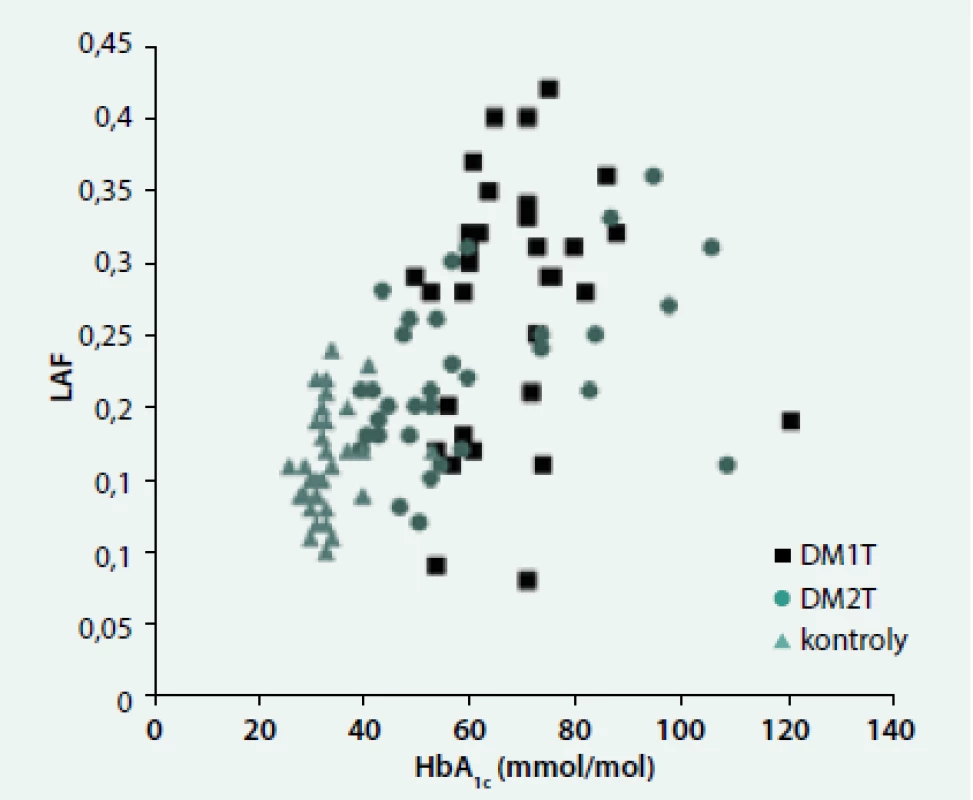
Obr. 2. Závislost autofluorescence oční čočky (LAF) na kožní autofluorescenci (SAF) 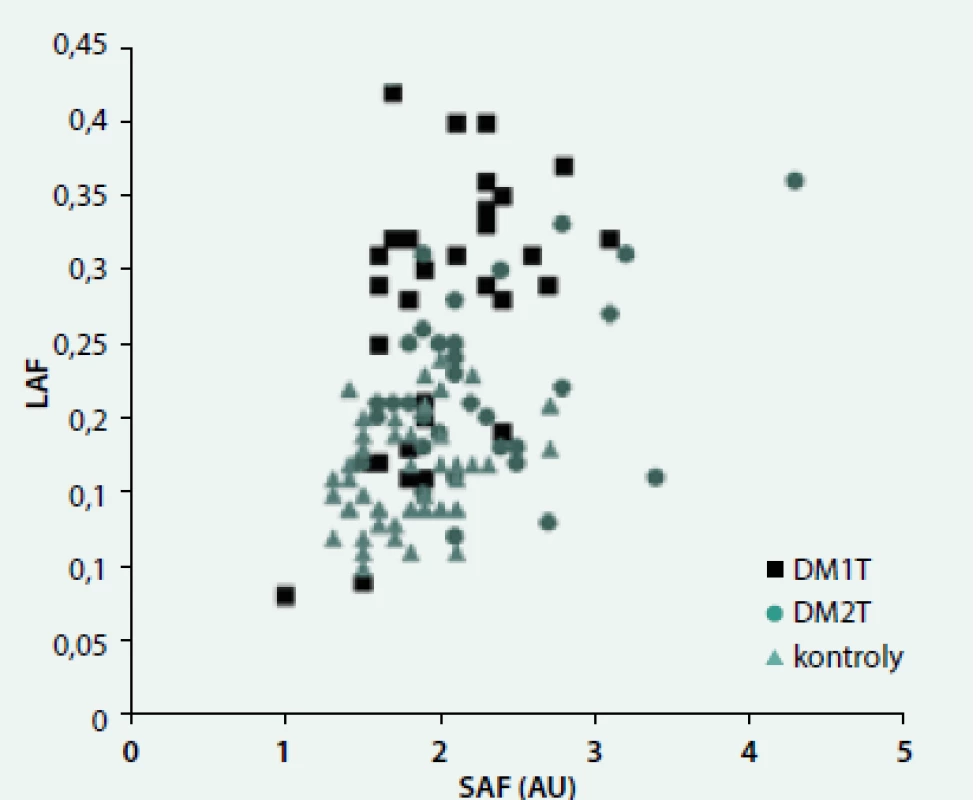
Diskuse
Autofluorescence oční čočky stanovená biomikroskopem ClearPath DS-120 přináší snadno dostupný parametr reflektující dlouhodobou zátěž organizmu glykačními mechanizmy. Tím hlavním faktorem zvyšujícím LAF je nepochybně chronická porucha glukózového metabolizmu s opakovanou hyperglykemií. Lze tedy předpokládat, že se takové déletrvající latentní onemocnění odrazí v celkové LAF a upozorní na možné riziko diabetu dříve, než dojde ke klinickým projevům hyperglykemie. Na druhou stranu je ale nutné zdůraznit, že rychle rozvinutý diabetes v mladším věku se nemusí vyšší LAF ještě projevit. Definitivní diagnóza diabetu je tak stále založena pouze na laboratorně stanovené hyperglykemii nalačno, během orálního glukózového tolerančního testu či náhodné hyperglykemii s klinickými příznaky.
V naší pilotní studii byla závislost LAF na aktuální hladině HbA1c i průměrném HbA1c v posledním roce jen částečná. Je pravděpodobné, že aktuální i průměrný glykovaný hemoglobin v posledním roce dostatečně neodrážejí mnohaletý stav glykace v organizmu, a tudíž s autofluorescencí čočky souvisí jen parciálně. Navíc naměřená LAF podává informaci o množství fluorescenčních molekul, zatímco některé AGEs fluorescenční vlastnosti nemají, a tudíž o jejich hromadění přesnou představu nemáme. V minulosti však bylo prokázáno, že mezi fluorescenčními a nefluorescenčními molekulami je silná pozitivní závislost [19]. V naší relativně malé studii jsme nepozorovali významnější rozdíly v LAF u pacientů bez či s pozitivní albuminurií. Je však možné, že v patogenezi diabetické nefropatie se uplatňují i nefluorescenční AGEs či další mechanizmy.
Námi prezentovaná významná závislost mezi autofluorescencí čočky a kůže u pacientů s diabetem 2. typu doposud nebyla publikována, zatímco u pacientů s diabetem 1. typu již byl podobný vztah doložen [20]. Obě práce dokládají, že glykační proces srovnatelně postihuje různé tkáně organizmu.
Je jistě lákavá představa, že se oční autofluorescence stane robustním ukazatelem dlouhodobé kompenzace diabetu predikujícím riziko dalších komplikací, avšak na definitivní potvrzení takové hypotézy si budeme muset ještě počkat.
MUDr. Jan Škrha jr
jan.skrha@seznam.cz
III. interní klinika 1. LF UK a VFN, Praha
www.int3.lf1.cuni.cz
Doručeno do redakce 15. 2. 2015
Přijato po recenzi 13. 3. 2015
Zdroje
1. Maillard LC. The action of amino acids on sugar; the formation of melanoidin by a methodic route. Cr Hebd Acad Sci 1912; 154 : 66–68.
2. Ortwerth BJ, Chemoganskiy V, Mossine VV et al. The effect of UVA light on the anaerobic oxidation of ascorbic acid and the glycation of lens proteins. Invest Ophthalmol Vis Sci 2003; 44(7): 3094–3102.
3. Schalkwijk CG, Miyata T. Early - and advanced non-enzymatic glycation in diabetic vascular complications: the search for therapeutics. Amino acids 2012; 42(4): 1193–1204.
4. Boyd AC, Abdel-Wahab YHA, McKillop AM et al. Impaired ability of glycated insulin to regulate plasma glucose and stimulate glucose transport and metabolism in mouse abdominal muscle. Biochim Biophys Acta 2000; 1523(1): 128–134.
5. Gugliucci A. “Blinding” of AMP-dependent kinase by methylglyoxal: A mechanism that allows perpetuation of hepatic insulin resistance? Medical Hypotheses 2009; 73(6): 921–924.
6. Shui YB, Beebe DC. Age-dependent control of lens growth by hypoxia. Invest Ophthalmol Vis Sci 2008; 49(3): 1023–1029.
7. Tomana M, Prchal JT, Garner LC et al. Gas-chromatographic analysis of lens monosaccharides. J Lab Clin Med 1984; 103(1): 137–142.
8. Ahmed MU, Thorpe SR, Baynes JW. Identification of N-epsilon-carboxymethyllysine as a degradation product of fructoselysine in glycated protein. J Biol Chem 1986; 261(11): 4889–4894.
9. Sell DR, Monnier VM. Structure elucidation of a senescence cross-link from human extracellular-matrix – implication of pentoses in the aging process. J Biol Chem 1989; 264(36): 21597–21602.
10. Nagaraj RH, Linetsky M, Stitt AW. The pathogenic role of Maillard reaction in the aging eye. Amino acids 2012; 42(4): 1205–1220.
11. Monnier VM, Sun WJ, Sell DR et al. Glucosepane: a poorly understood advanced glycation end product of growing importance for diabetes and its complications. Clin Chem Lab Med 2014; 52(1): 21–32.
12. Vannas MWA. Eine Methode zur Meesung der Fluorenzenz (lor lehnden menschlichen Augenlinse und eine Untersuchung über ihre Abhängigkeit). Alter Klin Monatabl Augenh 1938; 95 : 53–64.
13. Klang G. Measurements and studies of the fluorescence of the human lens in vivo. Acta ophthalmologica 1948; 31 : 1–152.
14. Bleeker JC, Vanbest JA, Vrij L et al. Autofluorescence of the lens in diabetic and healthy-subjects by fluorophotometry. Invest Ophthalmol Vis Sci 1986; 27(5): 791–794.
15. Abiko T, Abiko A, Ishiko S et al. Relationship between autofluorescence and advanced glycation end products in diabetic lenses. Exp Eye Res 1999; 68(3): 361–366.
16. Skrha J, Soupal J, Ekali GL et al. Skin Autofluorescence Relates to Soluble Receptor for Advanced Glycation End-Products and Albuminuria in Diabetes Mellitus. J Diab Res 2013, 2013 : 650694. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/650694>.
17. Burd J, Lum S, Cahn F et al. Simultaneous noninvasive clinical measurement of lens autofluorescence and rayleigh scattering using a fluorescence biomicroscope. J Diabetes Sci Technol 2012; 6(6): 1251–1259.
18. Mulder DJ, Water TV, Lutgers HL et al. Skin autofluorescence, a novel marker for glycemic and oxidative stress-derived advanced glycation endproducts: an overview of current clinical studies, evidence, and limitations. Diabetes Technol Ther 2006; 8(5): 523–535.
19. Meerwaldt R, Graaff R, Oomen PHN et al. Simple non-invasive assessment of advanced glycation endproduct accumulation. Diabetologia 2004; 47(7): 1324–1330.
20. Januszewski AS, Sachithanandan N, Karschimkus C et al. Non-invasive measures of tissue autofluorescence are increased in Type 1 diabetes complications and correlate with a non-invasive measure of vascular dysfunction. Diabet Med 2012; 29(6): 726–733.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Úvodní slovo prof. MUDr. Štěpána Svačiny, CSc., MBA,
editora tohoto vydání časopisu Vnitřní lékařství - Postavení nových antidiabetik v klinické praxi: SGLT2 vs DPP4 inhibitory
- Sdělení redakce časopisu
-
Volí diabetologové terapii racionálně?
Základní výsledky projektu PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu) - Biosimilární inzuliny – nové možnosti v léčbě diabetu
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Možnosti terapie agonisty receptoru pro GLP1 u diabetiků s nefropatií
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba diabetu u osob vyššího věku
- Problematika infekce při syndromu diabetické nohy
- Léčba hypertenze u diabetes mellitus
- Pohybová aktivita u pacientů s mikrovaskulárními komplikacemi diabetu
- Glykace proteinů oční čočky u diabetiků a její neinvazivní měření – první zkušenosti v České republice
- miRNA-192, miRNA-21 a miRNA-200: nové markery karcinomu pankreatu u diabetiků?
- Pokroky ve vývoji inzulinových pump a jejich pokročilých automatických funkcí
- Mikrobiální flóra trávicího traktu a diabetes
- Myokiny – hormony svalové tkáně
-
Úvodní slovo prof. MUDr. Štěpána Svačiny, CSc., MBA,
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Myokiny – hormony svalové tkáně
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba hypertenze u diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



