-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Systémová léčba glukokortikoidy: praktický pohled
Systemic glucocorticoids treatment: practical view
Glucocorticoids are derivatives of natural human glucocorticoid cortisol. There are used for treatment of a number of diseases and disorders for more than 65 years mainly because of their immunosuppressive properties. However, their use is accompanied by various side effects that have to be considered when treating patients. The article summarizes biological effects of glucocorticoids, main indications for their use, their side effects and precautions necessary to bear in mind during treatment.
Key words:
glucocorticoids – side effects – treatment
Autoři: Michal Kršek
Působiště autorů: III. interní klinika – klinika endokrinologie a metabolizmu 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2015; 61(10): 905-913
Kategorie: Přehledné referáty
Souhrn
Glukokortikoidy jsou deriváty přirozeného lidského glukokortikoidu kortizolu. Jsou po více než 65 let používány v léčbě řady nemocí a poruch, především pro své imunosupresivní vlastnosti. Jejich použití je však provázeno radou vedlejších účinků, které musíme při léčbě pacientů vzít do úvahy. Článek shrnuje biologické účinky glukokortikoidů, hlavní indikace pro jejich použití, jejich vedlejší účinky a preventivní opatření, která musíme mít na mysli v průběhu léčby.
Klíčová slova:
glukokortikoidy – léčba – vedlejší účinkyÚvod
V roce 1949 Hench et al popsali výrazné zlepšení stavu pacientů s revmatoidní artritidou po podání kortizonu [1]. Poté nastal rychlý rozvoj glukokortikoidů a jejich použití v medicíně. Léky s obsahem glukokortikoidů jsou dnes používány prakticky ve všech oborech medicíny. I přes to, že v řadě indikací jsou dnes systémově podávané glukokortikoidy vytlačovány topickými steroidy či jinými léky (imunosupresivy, biologickou léčbou apod), v řadě indikací zůstávají léky první volby, či dokonce léky zachraňujícími život. V tomto článku jsou shrnuty základní poznatky o glukokortikoidech s důrazem na jejich systémové podávání a na praktické aspekty této léčby.
Kortizol a jeho biologické účinky
Struktura a působení kortizolu
Kortizol je hlavním glukokortikoidem produkovaným kůrou nadledviny u člověka. Biochemická struktura kortizolu je uvedena na obr. 1. Kortizol vykonává většinu svých účinků prostřednictvím glukokortikoidního receptoru a částečně i mineralokortikoidního receptoru. Jedná se o intracelulární receptory regulující transkripci jednotlivých genů. Glukokortikoidní intracelulární receptor má velikost 90 kDa. Mechanizmus přenosu signálu je schematicky znázorněn na obr. 2.
Obr. 1. Strukturní vzorec kortizolu 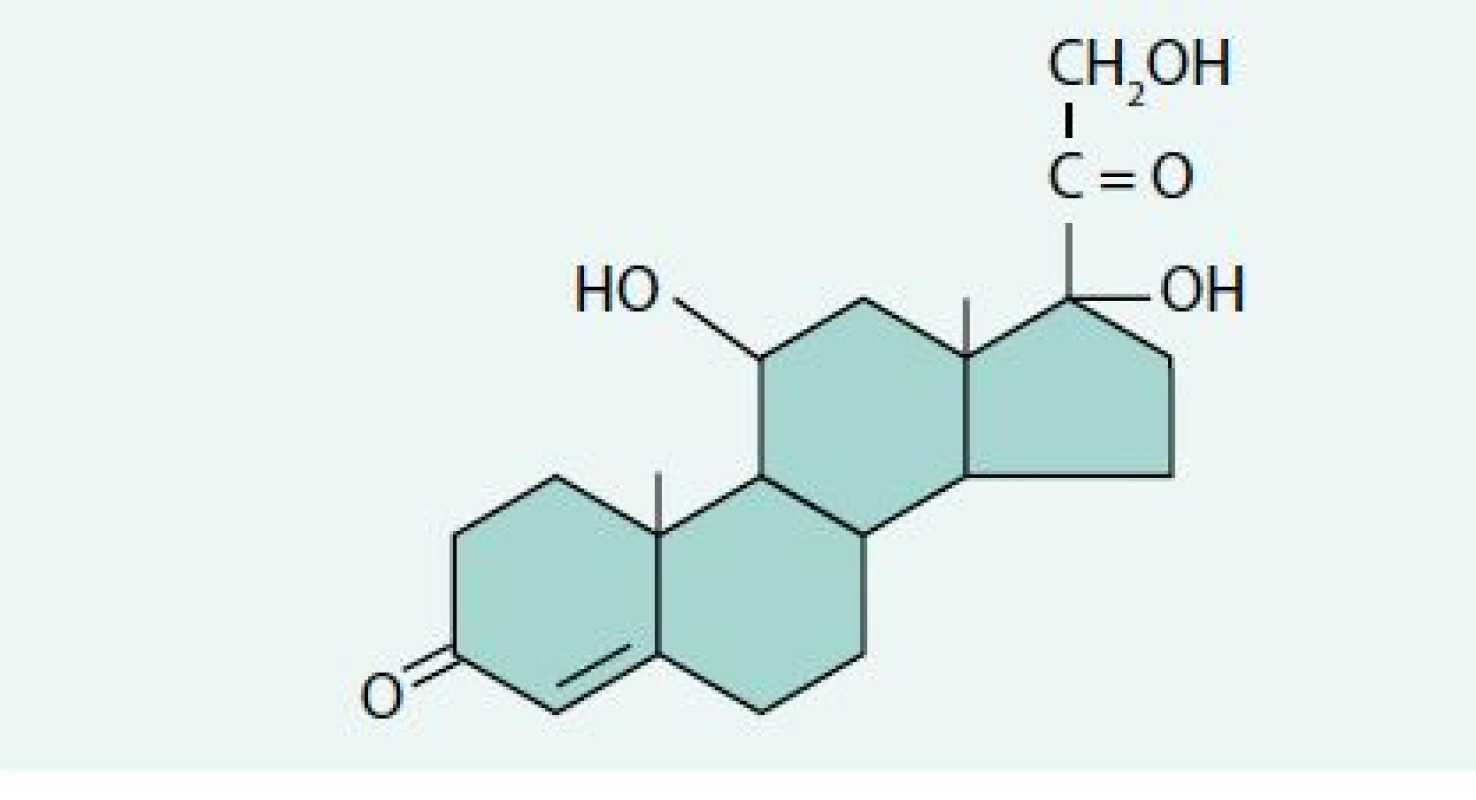
Obr. 2. Působení kortizolu a glukokortikoidů (GK) 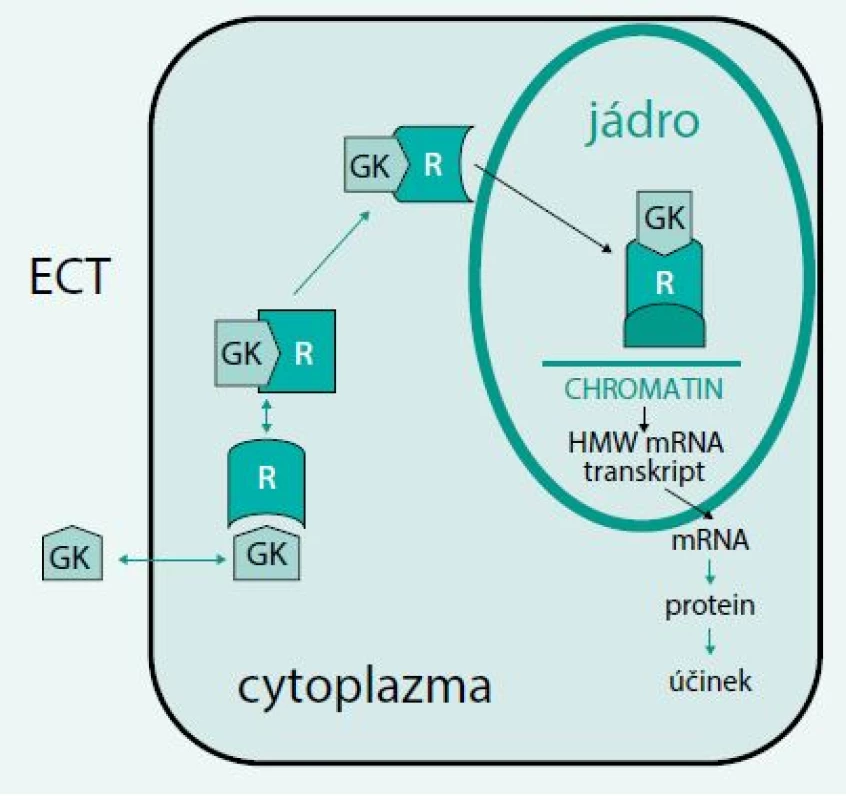
ECT – extracelulární tekutina GK – glukokortikoidy HMW – vysoká molekulární hmotnost (high molecular weight) mRNA – mesengerová ribonukleová kyselina R – receptor Biologické účinky kortizolu
Účinky na metabolizmus sacharidů
Kortizol patří mezi kontraregulační hormony, stimuluje glukoneogenezi, syntézu glykogenu a jeho ukládání v játrech, snižuje utilizaci glukózy v periferních tkáních, a vede tak ke zvýšení glykemie. Kortizol dále působí permisivně na účinky glukagonu a adrenalinu na glukoneogenezi a syntézu glykogenu [2–4].
Účinky na metabolizmus proteinů
Kortizol má na metabolizmus proteinů výrazný katabolický účinek. Vede k mobilizaci aminokyselin z tkání, zejména z kosterního svalstva, a k negativní dusíkové bilanci organizmu.
Účinky na metabolizmus tuků
Kortizol inhibuje transport glukózy v adipocytech a inhibuje v nich lipolýzu a uvolňování volných mastných kyselin. Společně s inzulinem vede při dostatečném příjmu potravy k podpoře lipogeneze a ukládání tuku [3].
Účinky na vodní a elektrolytový metabolizmus
Kortizol vede k retenci Na+ iontů a k exkreci K+ iontů. Protrahovaná expozice vysokým koncentracím kortizolu vede k závažné hypokalemii a hypokalemické alkalóze. Tento účinek je zprostředkován jak stimulací glukokortikoidních, tak stimulací mineralokortikoidních receptorů. Kortizol dále vede ke stimulaci výměny Na+ za K+ v proximálním tubulu, a tím ke zvýšené tubulární exkreci látek kyselé povahy. Kortizol dále inhibuje Na+ dependentní uptake fosfátů a tím vede ke zvýšení jejich exkrece (fosfaturie). Kromě těchto přímých účinků má kortizol na vodní a elektrolytový metabolizmus i účinky nepřímé. K nim patří především zvyšování glomerulární filtrace a snižování syntézy antidiuretického hormonu [5,6].
Účinky na kostní tkáň
Protrahované zvýšení koncentrací kortizolu vede k rozvoji osteopenie a osteoporózy. Kortizol vede k inhibici osteoblastické aktivity a stimuluje osteoklastickou aktivitu a osteoresorpci. Kromě přímých účinků na kostní tkáň ovlivňuje kortizol i fosfokalciový metabolizmus, vede k negativní kalciové bilanci (snižuje resorpci Ca2+ iontů ve střevě i jejich zpětnou resorpci v ledvinách a zvyšuje tak jejich exkreci). Negativní bilance Ca2+ pak vede k aktivaci sekrece parathormonu, který přispívá k dalšímu úbytku kostního minerálu.
Účinky na imunitní systém
Účinky kortizolu na imunitní systém mají velmi komplexní povahu a zahrnují účinky na leukocyty, lymfocyty a celou řadu cytokinů. Výsledným efektem je především imunosupresivní a protizánětlivý účinek. Kortizol vede ke zvýšení počtu cirkulujících leukocytů, především mechanizmem snížení migrace polymorfonukleárů z intravaskulárního kompartmentu do tkání, prodlužováním jejich poločasu v cirkulaci a zvýšením jejich uvolňování z marginálního poolu do cirkulace. Kortizol indukuje apoptózu lymfocytů, což se může podílet na jeho imunosupresivních vlastnostech. Kortizol dále vede k supresi exprese a produkce následujících cytokinů: interleukinů IL1, IL2, IL3, IL4, IL5, IL10, IL12, interferonu γ, TNF (tumor necrosis factor) α, GM-CSF (granulocyte-macrophage-colony stimulating factor). Kromě toho kortizol suprimuje expresi a produkci řady mediátorů zánětlivé odpovědi: prostaglandinů, leukotrienů, bradykininu, serotoninu, histaminu, kolagenázy, elastázy, inhibitoru aktivátoru plazminogenu (PAI-1). Na ovlivnění imunitních reakcí se podílí i vliv na krevní elementy. Ovlivňuje pohyb a transport leukocytů (inhibice migrace do zánětlivého ložiska, snížená adherence leukocytů k endotelu, inhibice chemotaxe) i jejich funkce (suprese reakce pozdní hypersenzitivity, suprese baktericidní aktivity monocytů, suprese funkce neutrofilů i monocytů, porucha fagocytózy neutrofilů i monocytů). Dále kortizol způsobuje inhibici clearance a degradaci senzitizovaných erytrocytů a trombocytů [7].
Účinky na kardiovaskulární systém
Účinky kortizolu na kardiovaskulární systém jsou komplexní. Kortizol má permisivní účinek na působení vazopresorických látek, zejména noradrenalinu a angiotenzinu II a zvyšuje expresi α1B - a β2-receptorů a indukuje na voltáži závislé kalciové kanály v buňkách hladkého svalstva včetně svalstva cévní stěny. Kromě účinků na cévy vykazuje kortizol přímé účinky na srdce, zvyšuje syntézu adrenalinu v srdci, stimuluje Na, K-ATPázu v kardiomyocytech [8].
Účinky na centrální nervový systém
Nadbytek kortizolu vede k poruchám chování a spánku a možnost indukce afektivních poruch, především depresivní poruchy.
Základní fyziologické účinky kortizolu jsou shrnuty v tab. 1.
Tab. 1. Přehled základních biologických účinků glukokortikoidů 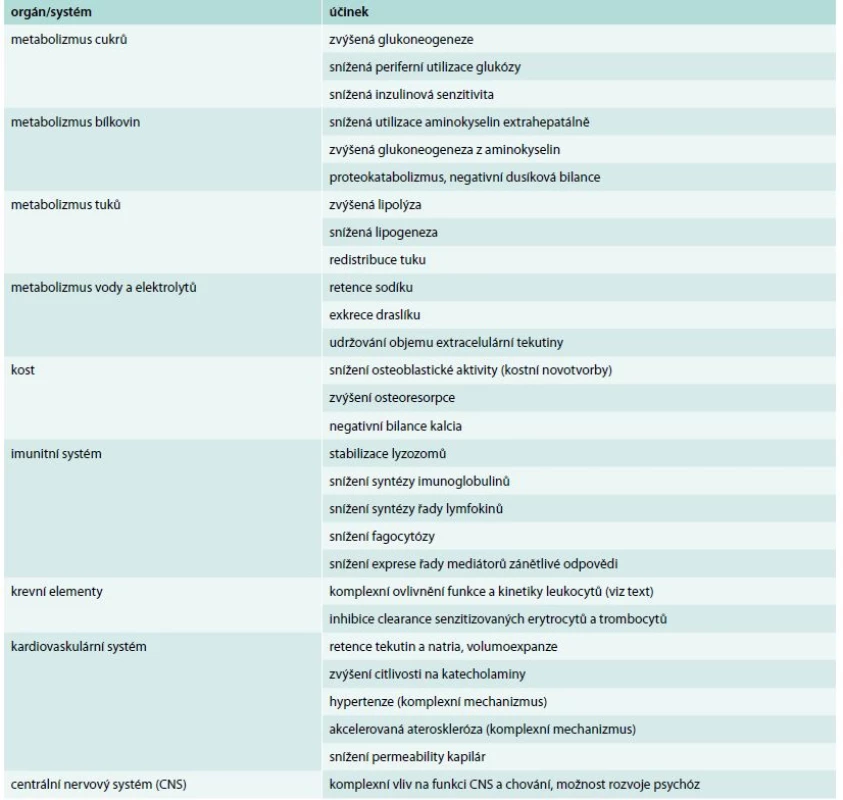
Syntetické glukokortikoidy
S rozšiřujícím se zaváděním glukokortikoidů do praxe, především v indikacích imunosupresivních a protizánětlivých léků, se objevila potřeba vývoje selektivnějších preparátů s akcentovanou glukokortikoidní aktivitou a redukovanou mineralokortikoidní aktivitou. Kromě glukokortikoidní selektivity se tyto preparáty liší i svým biologickým poločasem. Z praktického hlediska je důležité, že glukokortikoidní selektivita je funkcí dávky a že čím vyšší dávky selektivních glukokortikoidů používáme, tím je vyšší riziko nežádoucích účinků vyplývajících z aktivace mineralokortikoidního receptoru [9–12]. Strukturu základních syntetických glukokortikoidů uvádí obr. 3 a jejich rozdělení podle doby účinku a glukokortikoidní resp. mineralokortikoidní potence tab. 2.
Tab. 2. Rozdělení glukokortikoidů podle délky působení a podle glukokortikoidní a mineralokortikoidní účinnosti. Upraveno podle [10–13] ![Rozdělení glukokortikoidů podle délky působení a podle glukokortikoidní a mineralokortikoidní účinnosti. Upraveno podle [10–13]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e3b7e2a4a8bf4891a7a6f9e69100b982.jpg)
Obr. 3. Strukturní vzorce základních syntetických glukokortikoidů používaných k systémové kortikoterapii 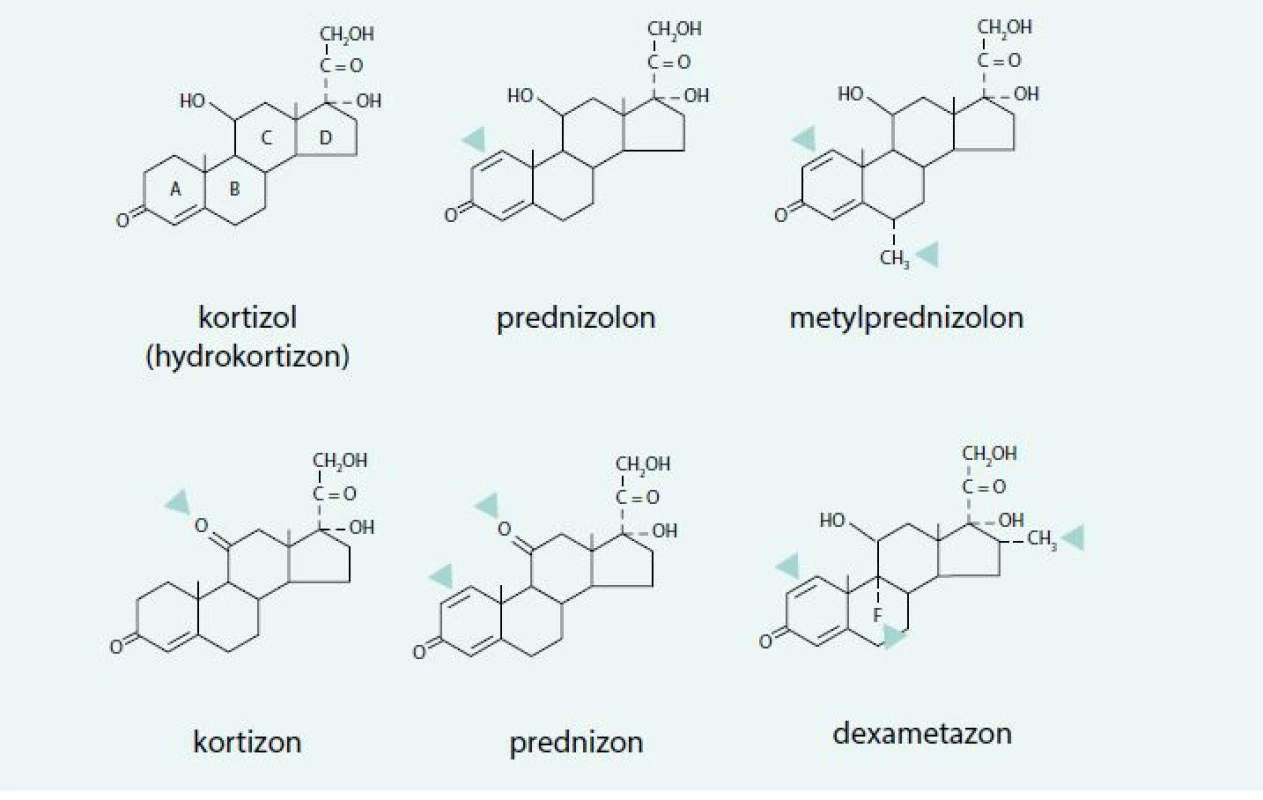
Indikace systémového podání glukokortikoidů
Indikace systémového podávání glukokortikoidů můžeme rozdělit do 4 základních skupin:
- vlastní léčebné indikace
- hormonální substituční léčba hypokortikalizmu
- hormonální supresní léčba kongenitální adrenální hyperplazie
- dynamické testy v endokrinologii
Další oddíly se budou týkat pouze léčebného podávání systémových glukokortikoidů. V tomto článku není možné rozebrat ani podchytit jednotlivé léčebné indikace podání glukokortikoidů, které jsou velmi četné a indikace a zásady jejich podávání jsou předmětem jednotlivých lékařských oborů. Základní indikace jsou proto uvedeny pouze formou tab. 3. Přehled systémových glukokortikoidů registrovaných v ČR uvádí tab. 4.
Tab. 3. Stručný přehled základních indikací systémového podání glukokortikoidů 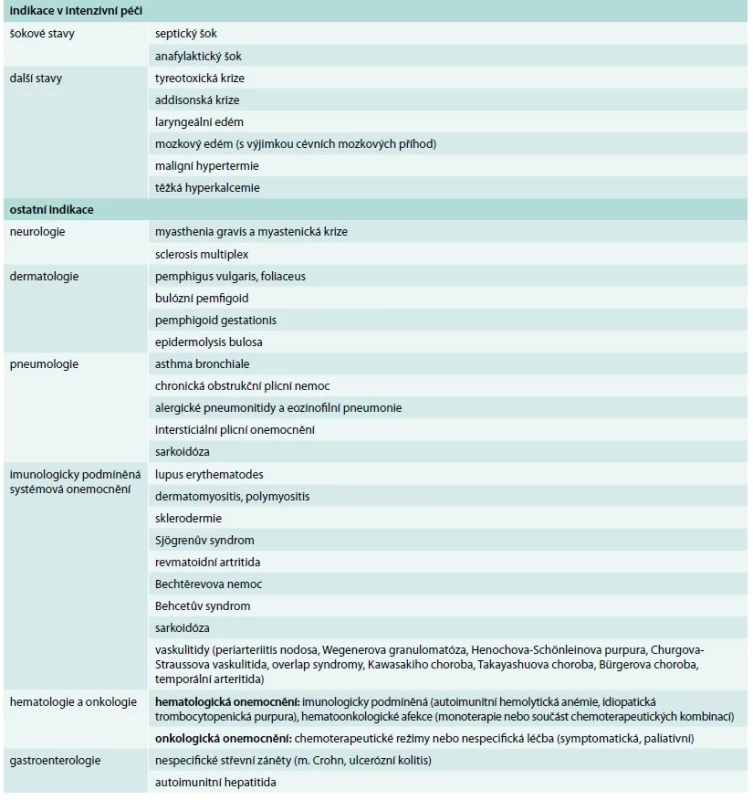
Tab. 4. Přehled systémových glukokortikoidů registrovaných v ČR. Upraveno podle [19] ![Přehled systémových glukokortikoidů registrovaných v ČR. Upraveno podle [19]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/571fbfe2711aff7ae40ab15c18340766.jpg)
Nežádoucí účinky
Systémová léčba glukokortikoidy může být provázena řadou nežádoucích účinků. Obecně lze říci, že při léčebném použití glukokortikoidů, obvykle z důvodu jejich protizánětlivého a imunosupresivního účinku, mohou být jejich všechny další účinky nežádoucí. Neexistuje pravidlo, podle kterého by bylo možné určit, kdy a zda se daný nežádoucí účinek rozvine. Obecně lze říci, že čím vyšší dávky glukokortikoidů používáme a čím delší dobu je používáme, tím je riziko jejich nežádoucích účinků vyšší. Přehled základních nežádoucích účinků léčby glukokortikoidy je uvedený v tab. 5.
Tab. 5. Přehled nežádoucích účinků glukokortikoidů 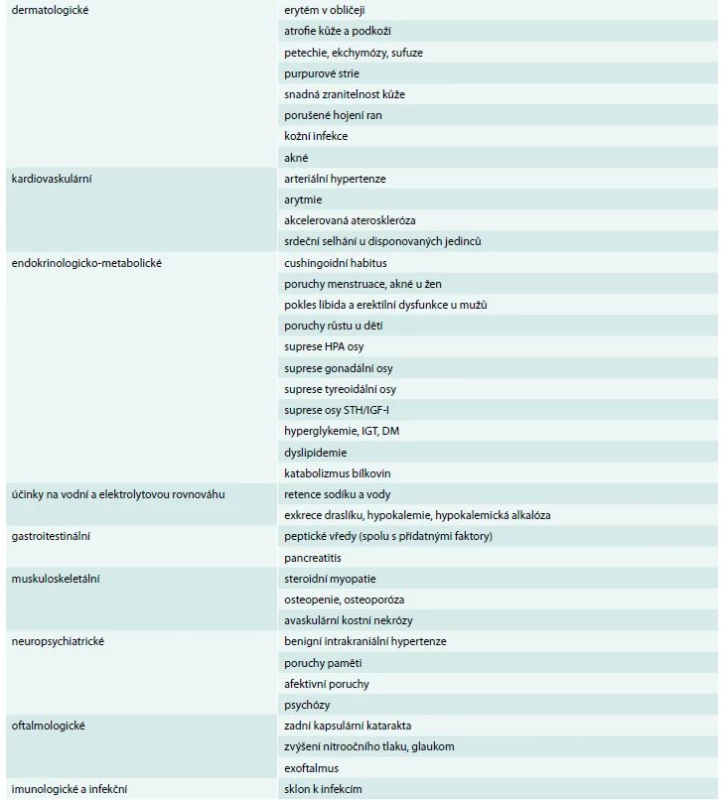
DM – diabetes mellitus GH – growth hormone/růstový hormon HPA – hypothalamic pituitary adrenal/osa hypotalamus-hypofýza-nadledviny IGF-I – insulin-like growth factor-I/inzulinu podobný růstový faktor-I IGT – impaired fasting glucose/porucha glukózové tolerance STH – somatotropní hormon (růstový) Porucha glukózové tolerance a vznik diabetes mellitus jsou častými nežádoucími účinky systémového podávání glukokortikoidů. Při léčbě bychom proto měli pravidelně monitorovat glykemii a při diagnóze poruchy glukózové tolerance či diabetes mellitus zahájit příslušnou léčbu (dietní, režimovou a medikamentózní), která je v zásadě podobná léčbě diabetes mellitus 2. typu. U pacientů, kteří již mají diabetes mellitus před zahájením léčby, je nutno počítat s jeho zhoršenou kompenzací a nutností úpravy léčby [13–15]. Vzestup tělesné hmotnosti a vznik centrální obezity je dalším možným nežádoucím účinkem, který je nutné sledovat a časně intervenovat. Při léčbě vysokými dávkami glukokortikoidů bychom se však měli vyvarovat přísných redukčních režimů, které by mohly vést ke zhoršení již přítomného katabolizmu bílkovin. Kardiovaskulární nežádoucí účinky jsou časté a potenciálně nebezpečné. Riziko poruch srdečního rytmu je přítomno především při podávání vysokých dávek (megadávek) glukokortikoidů, přibližně nad 500 mg metylprednisolonu nebo ekvipotentních dávkách jiného glukokortikoidu a vyšších, zejména při jejich parenterálním podání. Uvedené dávky je proto doporučeno podávat za hospitalizace nebo alespoň za observace v ambulanci při a alespoň 2 hodiny po jejich podání. Chronická terapie glukokortikoidy vede často k rozvoji arteriální hypertenze a retenci tekutin a u disponovaných jedinců může vést k srdečnímu selhání. Obecně lze říci, že chronická terapie glukokortikoidy zvyšuje kardiovaskulární riziko, dochází při ní k arteriální hypertenzi, retenci tekutin, vzestupu hmotnosti, poruše glukózové tolerance, dyslipidemii a k hyperkoagulačnímu stavu. Tyto faktory vedou ke zvýšené morbiditě a mortalitě. Všechny dílčí rizikové faktory je proto nutné během léčby glukokortikoidy pečlivě monitorovat a časně intervenovat [16]. Úbytek kostní hmoty a vznik osteopenie a osteoporózy jsou běžnými průvodními jevy chronické kortikoterapie. Kostní denzitu bychom měli v průběhu terapie monitorovat a při dlouhodobém používání vysokých dávek glukokortikoidů bychom měli současně preventivně podávat preparáty kalcia a vitaminu D [17]. Vzhledem k možnosti vzniku depresivní poruchy je nutné sledovat i změny psychiky a včas její poruchy intervenovat ve spolupráci s psychiatrem. Při podávání vysokých dávek glukokortikoidů byla popsána i suicidia.
Funkční hypokortikalizmus
Funkční hypokortikalizmus je specifickým nežádoucím účinkem dlouhodobé terapie glukokortikoidy, při které dochází mechanizmem zpětné vazby k útlumu tvorby CRH v hypotalamických neuronech, ACTH v kortikotrofních buňkách hypofýzy a následně kortizolu v zona fasciculata a zona reticularis kůry nadledvin. Čím delší dobu léčíme a čím vyšší dávku glukokortikoidu podáváme, tím s větší pravděpodobností nastane útlum. Doba podávání a dávka, které útlum vyvolají, jsou velmi individuální a nelze spolehlivě predikovat, kdy se útlum u jakého pacienta objeví, jak bude výrazný a dokonce ani to, jak dlouho bude docházet k zotavení (probuzení) funkce osy hypotalamus-hypofýza-nadledviny (HPA).
Na útlum HPA osy je nutno pomýšlet v době, kdy se snažíme dávky glukokortikoidů snižovat a posléze je vysadit. V případě útlumu osy a nepodání substituční dávky glukokortikoidů bychom pak před sebou měli hypokortikálního pacienta se všemi důsledky pro jeho zdravotní stav včetně rizika hypokortikální (addisonské) krize s rizikem úmrtí.
Při dlouhodobé terapii glukokortikoidy nemůžeme útlumu HPA osy nikdy zcela zabránit. Měli bychom ale dodržovat opatření vedoucí ke zmenšení rizika útlumu:
- v případech, v nichž je to možné, nepodávat glukokortikoidy celkově (systémově), ale lokálně
- pokud musíme podávat glukokortikoidy celkově, pak se snažit o podávání co nejnižších účinných dávek po co nejkratší dobu
- při volbě preparátu podávat pokud možno glukokortikoidy s kratším biologickým poločasem (čím „dlouhodobější“ glukokortikoid podáváme, tím je riziko a stupeň útlumu vyšší)
- v případě nutnosti podávat vysoké dávky se snažit podávat je v kombinaci s jinými imunosupresivně působícími léky, tak abychom mohli snížit dávku glukokortikoidu
- maximum denní dávky, pokud možno dávka celá, by měla být podána ráno
- pokud je to možné, doporučuje se alternativní podávání (podávání ob den) nebo intermitentní podávání (několik dnů léčby následovaných několika dny přestávky)
Snižování dávky a následné vysazování terapie glukokortikoidy má některá úskalí.
Detrakční syndrom je označení pro stav, který se může vyvinout na základě příliš rychlého snížení dávky glukokortikoidů. Organizmus pacienta je adaptován na vysoké koncentrace glukokortikoidů a při výrazném snížení dávky dochází k relativnímu nepoměru mezi dávkou a potřebou glukokortikoidů. Detrakční syndrom se projevuje zvýšenou únavností, slabostí, artralgiemi, myalgiemi, nechutenstvím, nauzeou, případně zvracením, může být přítomna i hypotenze a tachykardie, zvýšená tělesná teplota, někdy se vyskytuje deskvamace kůže. Pokud se objeví příznaky detrakčního syndromu, měli bychom dávku glukokortikoidů zvýšit na nejbližší vyšší tolerovanou dávku.
Kromě detrakčního syndromu se může u pacientů vyvinout v průběhu dlouhodobé léčby psychická závislost na podávání kortikosteroidů a pacienti pak mohou vyžadovat opětovné zvýšení dávky. V praxi se však špatně odlišuje, zdali má pacient mírné příznaky detrakčního syndromu nebo syndrom psychické závislosti na glukokortikoidech.
Hypokortikalismus je problémem, kterému je potřeba se při vysazování vyhnout, aby nedošlo k ohrožení pacienta. Při vysazování bychom měli dodržovat následující pravidla:
- dávku snižovat postupně dle individuální tolerance pacienta a dle klinického obrazu základního onemocnění
- při vysazování je vhodné v případě léčby „dlouhodobými“ glukokortikoidy přejít na ranní eventuálně i alternativní podávání střednědobých glukokortikoidů nebo cirkadiánní podávání krátkodobých glukokortikoidů
- pokud se při snižování dostaneme na dávky „přibližně substituční“, tj. asi 30 mg hydrokortizonu nebo 7,5 mg prednizonu, a klinický stav pacienta to umožňuje, můžeme se pokusit o vysazení léčby
- před vysazením se ale musíme přesvědčit, že je přítomna dostatečná aktivita HPA osy respektive endogenní sekrece kortizolu. Nejlépe to lze vyšetřit tak, že pacient je léčen krátkodobým glukokortikoidem (hydrokortizonem), který na minimálně 24 hod před odběrem vysadíme, laboratorní vyšetření pak provádíme ráno na lačno takto:
- vyšetříme ranní sérovou nebo plazmatickou koncentraci kortizolu
- výsledky interpretujeme následujícím způsobem:
- pokud je koncentrace kortizolu < 150 nmol/l, pacient je hypokortikální a je nutno mu dále podávat substituční dávku glukokortikoidu za příslušných zásad zvyšování dávky v zátěžových situacích
- pokud je koncentrace kortizolu > 450 nmol/l, je endogenní sekrece kortizolu dostatečná a glukokortikoidy je možno vysadit
- pokud je koncentrace kortizolu v „normálním rozmezí“ 150–450 nmol/l, může být endogenní sekrece kortizolu dostatečná za bazálních podmínek, ale nemáme jistotu, zdali je systém schopen jí zvýšit za zátěžových situací; v tomto případě provádíme některý z dynamických testů funkce HPA osy, test s inzulinem indukovanou hypoglykemií (inzulinový toleranční test) nebo kortrosynový (synacthenový) test s aplikací tetrakosaktidu
V procesu snižování dávek či vysazování glukokortikoidů nebo u pacientů dlouhodobě na nízkých dávkách glukokortikoidů musíme s pacientem v případě zátěžových situací vždy zacházet jako s pacientem hypokortikálním bez ohledu na aktuálně podávanou dávku glukokortikoidů a tuto musíme v takových situacích vždy adekvátně zvýšit. Pokud bychom tak neučinili, je pacient vážným způsobem ohrožen stavem vyplývajícím z nepoměru mezi potřebou a dávkou glukokortikoidů. Takový pacient by měl být vybaven průkazkou hypokortikálního pacienta.
Závěr
Glukokortikoidy jsou léky používanými více než 65 let a stále se bez nich při léčbě řady onemocnění neobejdeme. I když je systémová léčba glukokortikoidy provázena řadou nežádoucích účinků, tak lze říci, že za dodržení určitých pravidel jde o léčbu bezpečnou. Závěrem lze konstatovat, že glukokortikoidy:
- kauzálně neléčí žádné onemocnění (s výjimkou substituční léčby hypokortikalizmu); působí především symptomaticky, protizánětlivě
- léčba glukokortikoidy je zejména užitečná u stavů dočasných a epizodických
- je snaha léčit dlouhodobě jinými léky, aby se zamezilo prolongovanému použití glukokortikoidů
- i přes řadu nevýhod jsou glukokortikoidy u řady stavů velmi účinné, zlepšující stav nemocných i životní prognózu; vždy je nutno vážit poměr risk : benefit
Doručeno do redakce 16. 8. 2015
Přijato po recenzi 25. 9. 2015
prof. MUDr. Michal Kršek, CSc.
michal.krsek@lf1.cuni.cz
III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN, Praha
www.vfn.cz
Zdroje
1. Hench PS, Kendall EC et al. The effect of a hormone of the adrenal cortex (17-hydroxy-11-dehydrocorticosterone; compound E) and of pituitary adrenocorticotropic hormone on rheumatoid arthritis. Proc Staff Meet Mayo Clin 1949; 24(8): 181–197.
2. Exton JH. Mechanisms of hormonal regulation of hepatic glucose metabolism. Diabetes Metab Rev 1987; 3(1): 163–183.
3. Fain JN. Inhibition of glucose transport in fat cells and activation of lipolysis by glucocorticoids. In: Baxter JD, Rousseau GG (eds). Glucocorticoid Hormone Action. Springer: Berlin 1979 : 547–560. ISBN 978–3540089735.
4. Carter-Su C, Okamoto K. Effect of glucocorticoids on hexose transport in rat adipocytes: Evidence for decreased transporters in the plasma membrane. J Biol Chem 1985; 260(20): 11091–11098.
5. Clore JN, Estep H, Ross-Clunis H et al. Adrenocorticotropin and cortisol-induced changes in urinary sodium and potassium excretion in man: Effects of spironolactone and RU 486. J Clin Endocrinol Metab 1988; 67(4): 824–831.
6. Freiberg JM, Kinsella J, Sacktor B. Glucocorticoids increase the Na+-H+ exchange and decrease the Na+ gradient-dependent phosphate-uptake systems in renal brush border membrane vesicles. Proc Natl Acad Sci USA 1982; 79(16): 4932–4936.
7. Cronstein BN, Kimmel SC, Levin RJ et al. A mechanism for the antiinflammatory effect of corticosteroids: The glucocorticoid receptor regulates leukocyte adhesion to endothelial cells and expression of endothelial-leukocyte adhesion molecule 1 and intracellular adhesion molecule 1. Proc Natl Acad Sci USA 1992; 89(21): 9991–9995.
8. Collins S, Caron MG, Lefkowitz RJ. Beta-adrenergic receptors in hamster smooth muscle cells are transcriptionally regulated by glucocorticoids. J Biol Chem 1988; 263(19): 9067–9070.
9. Meikle AW, Tyler FH. Potency and duration of action of glucocorticoids. Effects of hydrocortisone, prednisone and dexamethasone on human pituitary-adrenal function. Am J Med 1977; 63(2): 200–207.
10. Harter JG. Corticosteroids: their physiologic use in allergic disease. NY State J Med 1966; 66 : 827–840.
11. Axelrod L. Glucocorticoid therapy. Medicine (Baltimore) 1976; 55(1): 39–65.
12. Axelrod L. Adrenal corticosteroids. In: Miler RR, Greenblatt DJ (eds). Handbook of drug Therapy. Elsevier North-Holland: New York: 1979.
13. Axelrod L. Glucocorticoids. In: Kelley WN, Harris ED jr, Ruddy S (eds). Textbook of Rheumatology. 4th ed. WB Saunders: Philadelphia 1993. ISBN 9780721631561.
14. van Raalte DH, Ouwens DM, Diamant M. Novel insights into glucocorticoid-mediated diabetogenic effects: towards expansion of therapeutic options? Eur J Clin Invest 2009; 39(2): 81–93.
15. Mazziotti G, Gazzaruso C, Giustina A. Diabetes in Cushing syndrome: basic and clinical aspects. Trends Endocrinol Metab 2011; 22(12): 499–506.
16. Munir A, Newell-Price J. Management of diabetes mellitus in Cushing’s syndrome. Neuroendocrinology 2010; 92(Suppl 1): S82-S85.
17. Mancini T, Kola B, Mantero F et al. High cardiovascular risk in patients with Cushing’s syndrome according to 1999 WHO/ISH guidelines. Clin Endocrinol 2004; 61(6): 768–777.
18. Albaum JM, Youn S, Levesque LE et al. Osteoporosis management among chronic glucocorticoid users: a systematic review. J Popul Ther Clin Pharmacol 2014; 21(3): e486-e504. Dostupné z WWW: <http://www.jptcp.com/pubmed.php?articleId=488>.
19. Marek J. Terapie kortikoidy. In: Marek J (ed) et al. Farmakoterapie vnitřních nemocí. Praha: Grada 2005 : 405–412. ISBN 80–247–0839–6.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Významné životní jubileum prof. MUDr. Josefa Marka, DrSc.
- Náš pan profesor Marek
-
Úvodní slovo prof. MUDr. Michala Krška, CSc.,
editora tohoto vydání časopisu Vnitřní lékařství - Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



