-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Glykemická variabilita a kontinuální monitorace glykemie
Glycemic variability and continuous monitoring of glycemia
Blood glucose levels are not constant in ther human body even in physiological status. It fluctuates depending on food intake, exercise, psychological and other factors. Normally it fluctuates between 3.9 to 7.5 mmol/l and in fasting in the standard conditions it does not exceed even more narrow range 3.9 to 5.5 mmol/l. Fluctuations are more pronounced in patient with diabetes. Hyperglycemia is a common and basic pathology in diabetes, however, antidiabetic drug often cause hypoglycemia, both increasing the range for glucose fluctuations. The level of glucose fluctuation is called glycemic variability (GV). Glycemic variability is now a favorite target of scientific research in diabetology. Increased glycemic variability is associated with hypoglycemia, possibly may contribute to chronic diabetes complications and negatively influences quality of life of diabetic patients. Last but not least, thanks to the new technology of continuous glucose monitoring, we can better describe and measure it. Finally, glycemic variability emerges as a potentially important therapeutical target.
Key words:
continuous glucose monitoring – glycemic variability – insulin pump – sensor augmented pump
Autoři: Martin Prázný; Jan Šoupal
Působiště autorů: III. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2014; 60(9): 757-763
Kategorie: 60. narozeniny prof. MUDr. Jana Škrhy, DrSc., MBA
Souhrn
Koncentrace glukózy v krvi není konstantní ani za fyziologického stavu, ale pohybuje se v závislosti na příjmu potravy, fyzické aktivitě, psychických a dalších faktorech v poměrně úzkém rozmezí přibližně mezi 3,9 a 7,5 mmol/l a nalačno za standardních podmínek v ještě užším intervalu 3,9–5,5 mmol/l. U diabetiků se kolísání hodnot glykemie zvyšuje, protože – jak vyplývá z definice diabetu – na jedné straně dochází k hyperglykemii, ale na druhé straně se díky nepřiměřenému účinku antidiabetické léčby objevují i hypoglykemie. Míra kolísání glykemie se nazývá glykemická variabilita (GV). Glykemická variabilita se dostává do centra pozornosti hned pro několik skutečností: zvýšená glykemická variabilita je spojena se zvýšeným výskytem hypoglykemií, možná se podílí na rozvoji pozdních komplikací diabetu, negativně ovlivňuje psychickou pohodu pacienta a konečně díky příchodu nové technologie – kontinuální monitorace glykemie – ji nyní dokážeme lépe popsat, změřit, zkoumat, ale i ovlivnit.
Klíčová slova:
glykemická variabilita – kontinuální monitorace glykemie – inzulinová pumpa – senzorGlykemická variabilita a její místo v hodnocení kompenzace diabetu
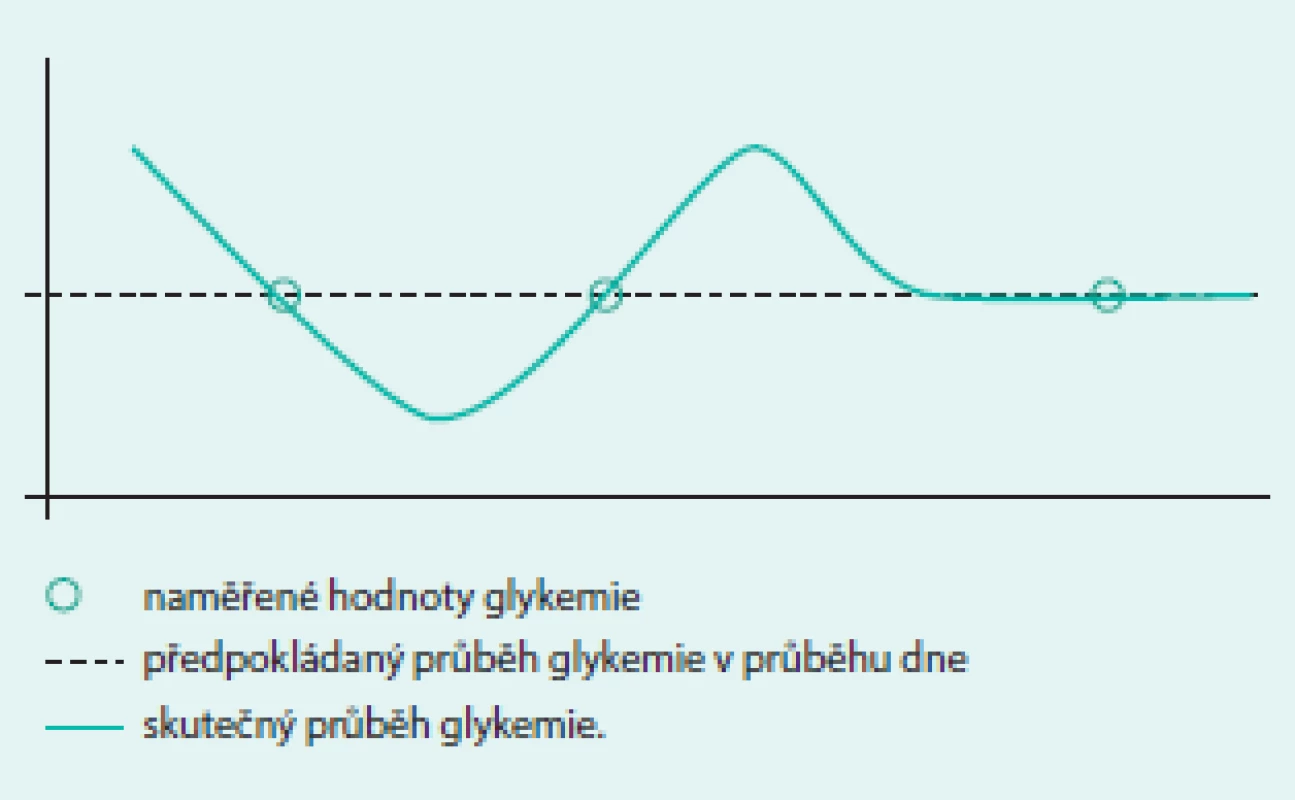
Kompenzaci diabetu můžeme hodnotit různými způsoby. Nejjednodušeji ji lze popsat dvěma parametry: hodnotou glykemie a glykovaného hemoglobinu HbA1c. Zatímco první parametr je průřezová hodnota popisující současný stav, která nevypovídá téměř nic o minulém ani budoucím průběhu glykemie, druhý parametr podává souhrnnou informaci o míře hyperglykemie, které byl organizmus exponován v průběhu posledních 6–8 týdnů. Nelze z něho však zjistit, zda byla hyperglykemie setrvalá s mírným kolísáním, nebo zda se vyskytovaly střídavě hypoglykemie a hyperglykemie a jaká byla jejich četnost. Ani jedna samostatně naměřená hodnota tedy nepřináší informaci o kolísání glykemie. Pokud je však k dispozici více po sobě jdoucích hodnot, lze různými způsoby vypočítat i míru jejich variability. Více informací o glykemii získávají pacienti např. při pravidelném samostatném měření glykemie (selfmonitoringu) pomocí osobního glukometru (self-monitoring of blood glucose – SMBG). Diabetici 2. typu si, pokud nejsou léčeni inzulinem, zpravidla měří glykemii maximálně několikrát za týden, naopak diabetici 1. typu by měli provádět selfmonitoring nejméně 3–4krát denně a ti nejmotivovanější provádějí za den až kolem 10 měření. Přestože je taková frekvence měření většinou zcela dostačující pro správné vedení léčby, ani v tomto případě nelze zachytit veškeré poklesy a vzestupy glykemie, ke kterým v průběhu dne dojde (obr. 1).
Kvalitativně zcela nové informace o kompenzaci diabetu přináší kontinuální monitorace glykemie (continuous glucose monitoring – CGM), při které je koncentrace glukózy sledována pomocí malého senzoru zavedeného do podkožní tkáně. K senzoru je připojen vysílač, který přenáší data ze senzoru do přijímače. Tam jsou data uložena, na jejich podkladě může být přímo zobrazen průběh glykemie a jsou spouštěny varovné signály při vybočení z cílového pásma glykemie. Zařízení může sloužit i jako pouhý záznamník dat, která pacient nevidí, a tudíž je nemůže ovlivňovat – v tomto případě metoda slouží (např. podobně jako 24hodinové monitorování krevního tlaku) k hodnocení úspěšnosti léčby, jako podklad pro její úpravu a také pro výzkumné účely. Glykemie je měřena vždy po 5 min, a pokud vše funguje správně, systém poskytuje celkem 288 hodnot glykemie za den. K dosažení potřebné přesnosti je nutno jej nejméně 2krát denně kalibrovat pomocí osobního glukometru. Kontinuální monitorace glukózy je v poslední době jednou z nejdiskutovanějších technologických novinek v diabetologii. Zavedení kontinuální monitorace glykemie do běžné klinické praxe lze přirovnat k počátku éry osobních glukometrů v 80. letech minulého století – s tím rozdílem, že CGM poskytuje informace o glykemii na kvalitativně mnohem vyšší úrovni. Díky širší dostupnosti této technologie se uvažuje o tom, zda v současné době postačuje k hodnocení kompenzace diabetu pouze glykemie a glykovaný hemoglobin a zda by nebylo vhodné jako další metodu, která přispívá k popisu kompenzace diabetu, používat i glykemickou variabilitu.
Hodnocení glykemické variability
K hodnocení glykemické variability (GV) je možno použít různé metody a vzorce, žádná z nich však není v současné době akceptována jako zlatý standard [1]. Přestože lze GV vypočítat i z dat získaných klasickým selfmonitoringem glykemií pomocí glukometru, v současné době je jednoznačně preferován výpočet glykemické variability z dat získaných při kontinuální monitoraci glykemie. Přehled některých způsobů stanovení GV je uveden v tab.
Tab. Schematické rozdělení příčin inzulinové rezistence (IR) 
Standardní odchylka (SD) a variační koeficient (CV)
SD a CV představují nejjednodušší a nejpoužívanější metody výpočtu GV. Oba parametry je možné vypočítat i z běžného glykemického profilu, což usnadňuje jejich použití v praxi. Přesnější výsledek poskytuje kalkulace GV ze záznamu CGM. SD a CV může jednoduše vypočítat běžný software používaný ke zpracování dat stažených z glukometrů a kontinuálních senzorů.
Mean amplitude of glycemic excursions (MAGE)
MAGE je často používaná metoda, pomocí které lze vypočítat průměrnou velikost kolísání glykemie mezi sousedními vzestupy a poklesy během dne. Jako referenční hodnota slouží střední hodnota glykemie, výkyvy glykemie menší než 1 SD jsou ignorovány. Může se tak stát, že nemusejí být zaznamenány menší, ale přesto potenciálně důležité výkyvy glykemie. MAGE je v současné době využíván především ke stanovení GV z CGMS.
Continuous overlapping net glycemic action (CONGA-n)
CONGA-n je parametr variability sloužící k hodnocení intradenní GV ze záznamu CGM. Je spočítán jako SD rozdílu mezi současnou hodnotou glykemie a glykemií, která předcházela o n hodin. Parametr CONGA je považován za objektivnější než MAGE, protože nevyžaduje uměle určenou hodnotu glykemie, na které se výpočet zakládá.
Určité omezení validity parametrů glykemické variability vyplývá i ze způsobu jejich výpočtu. Výpočet je prováděn pomocí software, který nejprve zpracuje data získaná z CGM, vyřadí nebo nahradí data ztracená při výpadcích daných nepřesností technologie nebo chybou pacienta a provede výpočet. Způsob, kterým jsou data zpočátku zpracována a upravena, ovlivňuje i výslednou hodnotu vypočítaného parametru. Ukazuje se, že i stejné parametry vypočítané ze stejných dat, ale pomocí různých programů, se od sebe mohou velmi lišit, což omezuje srovnatelnost výsledků studií publikovaných různými výzkumnými skupinami používajícími odlišné softwarové nástroje [2] (obr. 2).
Obr. 2. Senzor systému Dexcom G4 s vysílačem a přijímačem. 
Glykemická variabilita a její souvislost s chronickými komplikacemi diabetu
Za jeden z hlavních mechanizmů vzniku specifických komplikací diabetes mellitus (DM) je považován oxidační stres. Setrvalá hyperglykemie aktivuje oxidační stres zvýšením produkce reaktivních forem kyslíku v mitochondriích a endoplazmatickém retikulu, což spouští kaskádu dějů vedoucích ke vzniku chronických komplikací diabetu [3]. Podle některých studií je oxidační stres aktivován nejen při setrvalé hyperglykemii, ale navíc také díky zvýšené glykemické variabilitě [4–6]. Bez ohledu na patofyziologické mechanizmy je pro klinickou praxi nejdůležitější otázka, zda GV ovlivňuje morbiditu a mortalitu pacientů s DM a zda přispívá k rozvoji pozdních komplikací diabetu nad rámec prosté expozice hyperglykemii.
Souvislost GV s pozdními komplikacemi diabetu se začala zvažovat po publikaci výsledků studie DCCT (Diabetes Control and Complications Trial), do které bylo zahrnuto 1 441 pacientů s diabetes mellitus 1. typu (DM1T). Zdrojem dat pro výpočet GV byl 7bodový profil SMBG stanovený 1krát za každé 3 měsíce. První analýzy ukázaly rozdílný výskyt mikrovaskulárních komplikací u pacientů s podobnou hodnotou HbA1c léčených konvenčním nebo intenzifikovaným inzulinovým režimem [7], a tento rozdíl byl přičítán odlišné GV v obou skupinách. O 10 let později však byla data z této studie přehodnocena a původně publikovaný vztah vyšší glykemické variability a retinopatie byl označen jako nevýznamný. Další subanalýza studie DCCT však ukázala, že je to možná spíše dlouhodobá GV vyjádřená variabilitou HbA1c, která pravděpodobně souvisí s rizikem rozvoje diabetické retinopatie a nefropatie, a že každé 1 % (10 mmol/mol) směrodatné odchylky HbA1c zvyšuje riziko diabetické nefropatie o 80 % a retinopatie dokonce o více než 100 % [8]. Přesto nebyla hypotéza o možné souvislosti krátkodobé glykemické variability s aktivací oxidačního stresu a chronickými komplikacemi DM opuštěna [6,9]. Zajímavou prospektivní studii na relativně malé kohortě 100 pacientů s DM1T publikoval Bragd et al [10]. GV zde byla také vypočítána ze SMBG a výskyt mikrovaskulárních komplikací včetně periferní neuropatie byl hodnocen po dobu 11 let. Studie prokázala pozitivní korelaci mezi výskytem periferní neuropatie a GV, což naznačuje, že periferní nervový systém by mohl být vůči GV citlivější. Tyto závěry však další retrospektivní analýzou dat studie DCCT nebyly potvrzeny [11].
V roce 2011 byla publikována studie, ve které se hodnotila souvislost GV s přítomností a závažností ischemických změn koronárních tepen u pacientů s DM2T a suspektní ICHS [12]. Do studie bylo zařazeno 344 pacientů s DM2T a bolestí na hrudi, pro kterou byla indikována selektivní koronarografie. Před koronarografií byla pacientům provedena kontinuální monitorace glykemie a z výsledků pak vypočítána GV. Pacienti s ICHS měli signifikantně vyšší GV a také závažnost postižení koronárního řečiště narůstala s mírou GV. Důležité je, že mezi oběma skupinami nebyly pozorovány žádné signifikantní rozdíly v hodnotě HbA1c a hodnotou glykemie nalačno – obě klasické metody tedy obě skupiny na rozdíl od GV nedokázaly rozlišit. Výsledky této studie tedy ukazují navíc na možnou souvislost GV s přítomností a mírou aterosklerotických, tedy makrovaskulárních změn. Glykemická variabilita je nadto i nezávislým prediktorem mortality u kriticky nemocných pacientů, a to i u pacientů netrpících diabetem [13,14].
Limitace při hodnocení glykemické variability
Diabetici 1. typu mívají zpravidla vyšší glykemickou variabilitu a méně komorbidit než diabetici 2. typu, a proto je nejspíš výhodnější pokusit se objevit souvislost mezi glykemickou variabilitou a komplikacemi právě u DM1T. Určitou souvislost jsme např. nalezli i ve studii provedené na našem pracovišti u pacientů s DM1T, kteří byli přibližně stejně staří, měli srovnatelnou dobu trvání diabetu i kompenzaci diabetu, ale lišili se glykemickou variabilitou. Pacienti s mikrovaskulárními komplikacemi měli významně vyšší GV (měřenou z 12–14 dnů kontinuální monitorace glykemie) než pacienti bez komplikací. V celém souboru pacientů jsme nalezli korelaci mezi hodnotou GV a prahem vibračního čití (použitého k hodnocení diabetické neuropatie), což opět poukazuje na možnou vyšší citlivost nervového systému ke GV [15]. Na druhou stranu je nutné si uvědomit, že validně prokázat příčinnou souvislost mezi GV a komplikacemi lze pouze v prospektivní studii zahájené nejlépe u recentně diagnostikovaných pacientů, u nichž je ovšem riziko rozvoje komplikací malé, a tudíž doba, po kterou by museli být sledováni, by naopak musela být dlouhá, nejspíše více než 10–15 let. Studie by také musela být provedena na velkém souboru pacientů. Problémem by pak jistě bylo i stanovení vhodné frekvence a délky CGM, ze které by se GV vypočítávala, a kompliance pacientů. Senzory by totiž musely být používány v zaslepeném módu, aby na naměřené hodnoty nemohli pacienti okamžitě reagovat a ovlivňovat tak vstupní data – ukazuje se totiž, že používání CGM v klinické praxi vede relativně rychle k poklesu glykemické variability [16].
Glykemická variabilita a hypoglykemie
Glykemická variabilita má i bezprostřední dopad na běžný život pacientů a akutní komplikace léčby diabetu, je totiž nezávislým prediktorem hypoglykemií u diabetiků 1. typu a souvisí i s výskytem hypoglykemií u diabetiků 2. typu. Kilpatrick publikoval další data ze studie DCCT, na nichž ukázal, že HbA1c, průměrná glykemie a glykemická variabilita mají nezávislou úlohu při určení individuálního rizika hypoglykemie [17]. Dokonce i výskyt závažných hypoglykemií u pacientů s DM1T by bylo do určité míry možné predikovat podle GV, protože ta bývá v období 2 dnů předcházejících závažné hypoglykemii zvýšená [18]. U diabetiků 2. typu souvisela variabilita glykemie nalačno s rizikem nočních hypoglykemií např. ve studii PREDICTIVE [19].
Hypoglykemie je v současné době hlavní překážkou při dosažení optimální kompenzace diabetu, a nadto jsou hypoglykemie také významnou přímou příčinou úmrtí pacientů diabetiků. Někteří autoři odhadují, že asi 6–10 % všech úmrtí může být ve vztahu k hypoglykemii u pacientů s DM1T [20] a hypoglykemie jsou patrně primární příčinou úmrtí i u pacientů s DM2T, i když zde přesné údaje zatím chybí. Vysoké riziko úmrtí při hypoglykemii je alarmující, protože hypoglykemie je prakticky vždy iatrogenní komplikací. U některých pacientů se mohou rozvinout obavy z hypoglykemie jako významný psychologický fenomén vedoucí k závažné a dlouhodobé dekompenzací diabetu. Tento jev se často vyskytuje u pacientů s opakovanými závažnými hypoglykemiemi s poruchou vědomí. U těchto pacientů jak hypoglykemie, tak i strach z nich negativně ovlivňují kvalitu jejich života.
Prostředky k ovlivnění glykemické variability
U diabetiků 2. typu má nejvyšší vliv na glykemickou variabilitu postprandiální období. Proto příliš nepřekvapí, že glykemickou variabilitu snižují léky založené na inkretinovém principu (inhibitory dipeptidylpeptidázy 4 a agonisté receptoru pro GLP1) [21]. Jejich terapeutický efekt (stimulace sekrece inzulinu a inhibice sekrece glukagonu) je závislý na hyperglykemii a při normoglykemii se snižuje, proto mají také velmi nízké riziko hypoglykemie. U pacientů s DM2T léčených inzulinem a všech pacientů s DM1T je jednoznačným prostředkem ke snížení glykemické variability přesné dávkování inzulinu a dodržování režimových opatření. Kromě toho mohou tito pacienti profitovat i z inzulinových analog, u nichž je nižší riziko hypoglykemií [22,23].
Zejména u diabetiků 1. typu je přesnost dávkování inzulinu kritickým prvkem kompenzace diabetu. Rozhodnutí o množství inzulinu a času jeho aplikace, ať už je inzulin podáván pomocí injekčních stříkaček, inzulinových per nebo inzulinových pump, spočívá v běžném životě dodnes na pacientech, významně je zatěžuje a ovlivňuje kvalitu jejich života. Použití CGM u pacientů s DM1T zlepšuje kompenzaci diabetu [24]. Pokud pacienti souběžně používají inzulinovou pumpu, je účinnost této kombinace přímo závislá na čase, po který je napojen kontinuální senzor. Inzulinová pumpa umožňuje přesné vyladění inzulinové terapie zejména u pacientů s dobrou citlivostí a s potřebou malých dávek inzulinu. Kontinuální monitorace glykemie pak ukazuje pacientům nejen jejich aktuální glykemii, ale včas také varuje, když se dostanou na hranici zvýšené nebo snížené glykemie – CGM neustále počítá rychlost změny koncentrace glukózy a ukazuje trvale trendové šipky (pokles, vzestup, případně rychlý pokles nebo rychlý vzestup). Spojení obou technologií (SAP – Sensor Augmented Pump, případně senzor a pumpa) propojuje jejich hlavní výhody. V současné době jsou v ČR dostupné dva systémy SAP – Minimed Paradigm Veo (Medtronic) a Animas Vibe (Johnson&Johnson), obr. 3 a 4.
Obr. 3. Kombinace inzulínové pumpy a CGM – Minimed Paradigm Veo (Medtronic, USA). 
Obr. 4. Kombinace inzulínové pumpy a CGM – Animas Vibe (Johnson & Johnson, USA). 
Díky SAP mají pacienti neustálý přehled o aktuální glykemii, prediktivní alarmy jsou spouštěny v předstihu, aby pacienti měli dostatek času na reakci – úpravu dávky inzulinu, sacharidů nebo i fyzické aktivity. Pacienti tedy musí neustále věnovat pozornost hodnotě glykemie a reagovat na varování, upravovat dávky inzulinu a přesně plánovat své budoucí činnosti. Kombinace kontinuálního senzoru a inzulinové pumpy výrazně snižuje obavy pacientů z hypoglykemie, zkracuje čas strávený v hypoglykemii, snižuje glykemickou variabilitu a současně příznivě ovlivňuje kompenzaci diabetu [25,26]. S využitím nových technologií mohou pacienti dosáhnout lepší kompenzace, ovšem zároveň tráví svou léčbou více času – při rutinním používání přibližně o 1 hod za týden více než pacienti léčení inzulinovými pery [27]. Přestože obecně udávají pacienti s léčbou pomocí SAP spokojenost, velká část z nich postupně vykazuje příznaky vyhoření a přestávají senzor používat. Účinnost technologií jako CGM nebo SAP je zcela jasně dána časem, po který pacienti používají senzor [24], proto je ztráta adherence pacientů ke kontinuální monitoraci glykemie alarmující, i když z psychologického hlediska pochopitelná. Praktické použití SAP je ukázáno na obr. 5 a 6.
Obr. 5. Záznam CGM u 62leté pacientky s DM1T v trvání po dobu 28 let, léčené kombinací senzoru a pumpy. Průměrná hodnota glykemie ze senzoru je 6,6 ± 2,1 mmol/l, celková průměrná dávka inzulinu 25 j/den, 63 % aplikováno ve formě bolusů (celkem v průměru 9 bolusů denně), glykovaný hemoglobin 49 mmol/mol. Pacientka používá k jídlu integrovaný kalkulátor bolusů. Klinicky nevýznamné hypoglykemie se vyskytují obvykle 2krát v týdnu a jsou pacientkou dobře rozpoznávány, žádné závažné hypoglykemie se neobjevují. Software Carelink Pro (Medtronic). 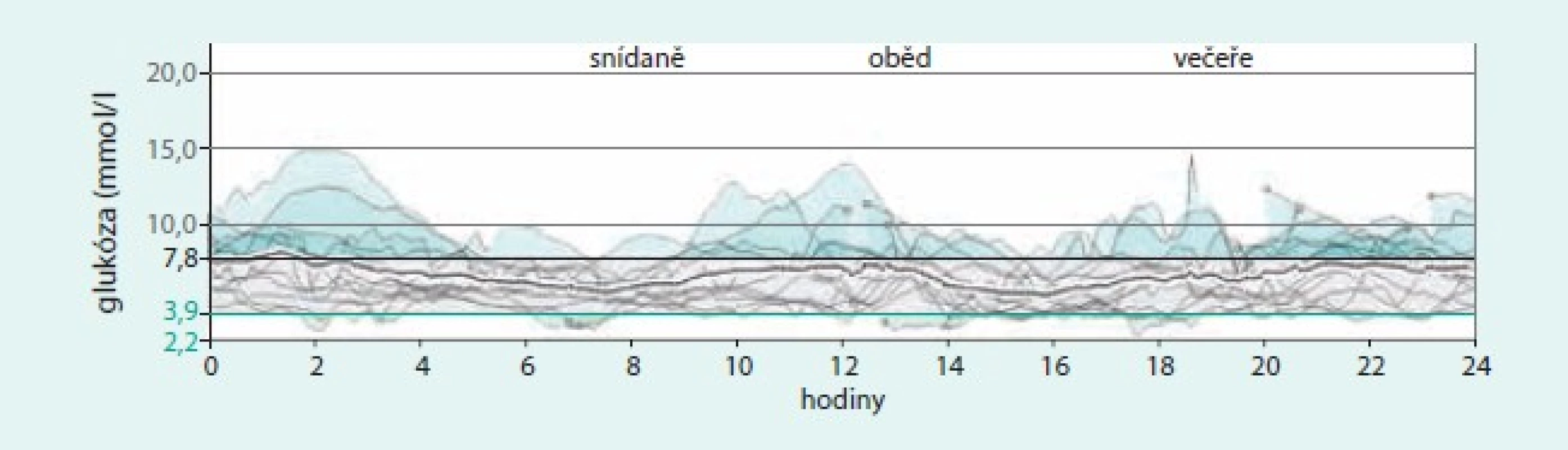
Obr. 6. Postprandiální glykemie po večeři u téže pacientky – CGM záznam použití bolusového kalkulátoru. Vodorovná osa ukazuje čas v hodinách, svislá glykemii v mmol/l. Svislá čára v bodě 0 je softwarově synchronizovaný čas aplikace bolusu, který tak udává přibližný začátek jídla. Průměrná dávka inzulinu před večeří je 3,4 j, glykemie před večeří je 6,3 mmol/l a po večeři 7,2 mmol/l – postprandiální vzestup glykemie je méně než 1 mmol/l. Software Carelink Pro (Medtronic). 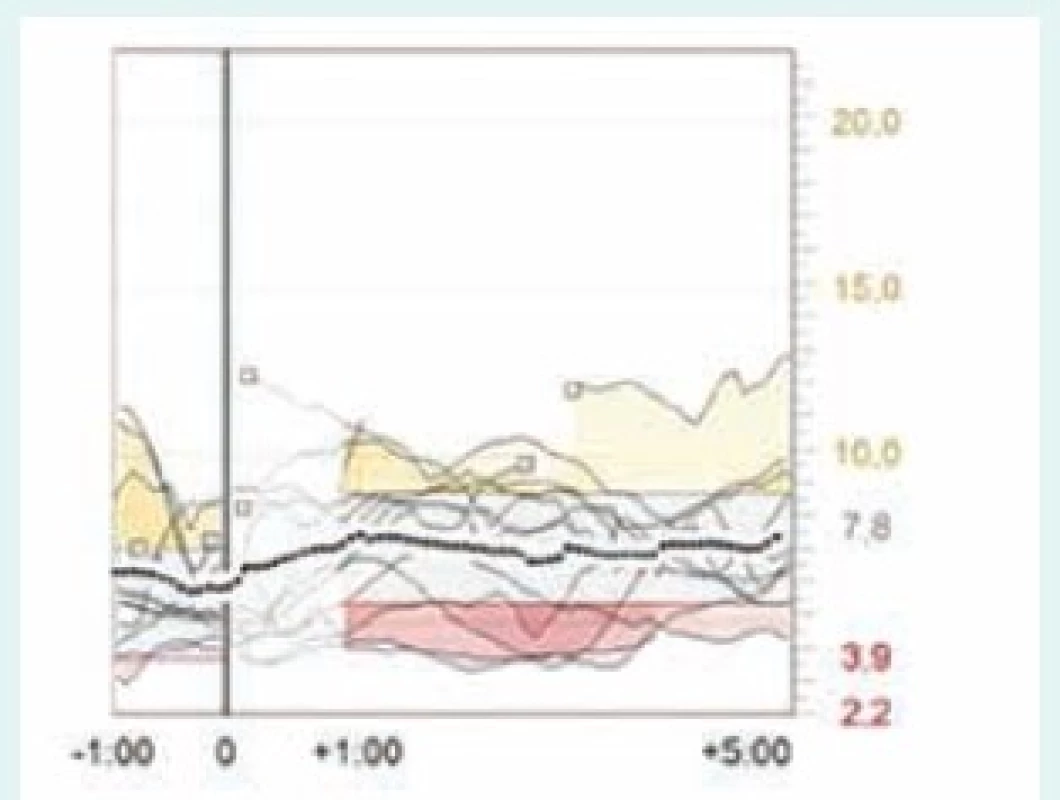
Současné pokroky ve vývoji uzavřených (closed-loop) systémů pro dávkování inzulinu
Uzavřený okruh dávkování inzulinu představuje poslední krok v technologii náhrady inzulinové sekrece elektromechanickým zařízením. Předchozí studie ukázaly, že koncept uzavřeného dávkovacího okruhu je možný a zejména díky dostatečné kvalitě senzorů pro kontinuální monitoraci glykemie i funkční, zejména v relativně klidném období noci [28,29]. Největší výzvou pro automatické systémy dávkování inzulinu je provoz nezávislý na pacientově příjmu potravy a fyzické aktivitě. S úspěchem byl uzavřený okruh testován po dobu 36 hod u 12 adolescentů – pacienti si aplikovali bolusy inzulinu manuálně před každým hlavním jídlem, ale svačiny byly pokryty automatickým systémem, 2krát denně byli zatíženi mírnou fyzickou aktivitou, která nebyla řídící jednotce oznámena. Procento času stráveného v cílovém rozmezí bylo při použití uzavřeného okruhu 84 %, zatímco v kontrolní skupině léčené klasicky pouze 49 %, a v 17 z celkem 24 nocí strávených na systému uzavřeného okruhu bylo dosaženo 100 % času stráveného v cílovém rozmezí glykemie [30]! Také z dalších studií vyplývá, že systémy založené na uzavřeném okruhu dávkování inzulinu jsou v tuto chvíli nejen funkční, ale vykazují i vynikající účinnost. V současné době je nutné hlavně důkladně otestovat jejich bezpečnost.
V současné době existuje pouze jediný typ inzulinové pumpy, který implementuje automatickou reakci na zjištěnou glykemii v klinické praxi v běžně komerčně dostupném zařízení. Low Glucose Suspend (LGS) je volitelná funkce inzulinové pumpy Minimed Paradigm Veo. Pumpa dočasně přeruší dávkování inzulinu v případě, že senzor hlásí hypoglykemii a pacient na toto upozornění nereaguje. Dávkování inzulinu je po 2 hod opět spuštěno. Použití funkce LGS bylo spojeno se snížením výskytu nočních hypoglykemií u dětí a dospívajících. Také snižuje výskyt noční hypoglykemie u vysoce rizikových dospělých diabetiků 1. typu [31,32]. V nejbližší době se očekává vylepšení funkce LGS tak, že bude prediktivní – přívod inzulinu bude zastaven ještě předtím, než nastane hypoglykemie, a dávkování bude opět spuštěno v momentu, kdy bude na základě aktuálního trendu hodnot CGM jasné, že hypoglykemie končí.
Závěr
Dostupné důkazy z dosud publikovaných studií naznačují možné spojení mezi zvýšenou glykemickou variabilitou (krátkodobou i dlouhodobou) a cévními komplikacemi u pacientů s diabetem. Přestože je příčinná souvislost zatím nejasná, je jednou z možných spojnic mezi glykemickou variabilitou a komplikacemi oxidační stres. Z tohoto důvodu je ve vztahu ke zvýšené glykemické variabilitě na místě určitá předběžná opatrnost. I kdyby však vyšší glykemická variabilita s pozdními komplikacemi přímo nesouvisela, je spojená se zvýšeným rizikem hypoglykemií u obou typů diabetu a zabraňuje trvalému dosažení cílových hodnot glykemie. Glykemická variabilita by proto mohla být považována nejen za další prostředek popisující kompenzaci a kvalitu léčby, ale také za jeden z terapeutických cílů při léčbě diabetu. Technologickou možností, jak ovlivnit glykemickou variabilitu u inzulinem léčených pacientů, je aplikace systému inzulinové pumpy a kontinuálního senzoru glykemie, v ideálním případě propojené automatickou řídící jednotkou. Plně automatické propojení obou systémů povede k vytvoření uzavřeného okruhu dávkování inzulinu, který nebude vyžadovat zásah pacienta. První systémy, které používají částečné automatické propojení senzoru a pumpy, jsou již v klinické praxi používány ve formě funkce automatického zastavení dávkování inzulinu – Low Glucose Suspend v inzulinové pumpě Minimed Paradigm Veo. Tato funkce je pacienty dobře přijímána, což může naznačovat, jak budou plně funkční uzavřené obvody přijímány i dalšími pacienty a jak jim mohou při snižování zátěže vyplývající z léčby diabetu pomáhat. Uvedení plně automatických systémů pro dávkování inzulinu do klinické praxe se očekává již v nedaleké budoucnosti a bude patrně pro pacienty s diabetem nejvýznamnějším technologickým přínosem od dob prvního klinického využití inzulinu v roce 1922.
Věnování
Věnováno prof. MUDr. Janu Škrhovi, DrSc., mému váženému učiteli, u příležitosti jeho významného životního jubilea s díky za odborné i lidské vedení spletitým bludištěm diabetologie.
doc. MUDr. Martin Prázný, CSc., Ph.D.
mpra@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN, Praha
int3.lf1.cuni.cz
Doručeno do redakce 6. 7. 2014
Přijato po recenzi 17. 7. 2014
Zdroje
1. Siegelaar SE et al. Glucose variability; does it matter? Endocr Rev 2010; 31(2): 171–182.
2. Sechterberger MK, Luijf YM, Devries JH. Poor agreement of computerized calculators for mean amplitude of glycemic excursions. Diabetes Technol Ther 2014; 16(2): 72–75.
3. Brownlee M. The pathobiology of diabetic complications: A unifying mechanism. Diabetes 2005; 54(6): 1615–1625.
4. Brownlee M, Hirsch IB. Glycemic variability: A hemoglobin A1c-independent risk factor for diabetic complications. JAMA 2006; 295(14):1707–1708.
5. Monnier L, Mas E, Ginet C et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. J JAMA. 2006; 295(14): 1681–1687.
6. Ceriello A, Esposito K, Piconi L et al. Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients. Diabetes 2008; 57(5): 1349–1354.
7. DCCT study group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993; 329(14): 977–986.
8. Kilpatrick ES, Rigby AS, Atkin SL. A1C variability and the risk of microvascular complications in type 1 diabetes: data from the Diabetes Control and Complications Trial. Diabetes Care 2008; 31(11): 2198–2202.
9. Lachin JM1, Genuth S, Nathan DM et al. Effect of glycemic exposure on the risk of microvascular complications in the diabetes control and complications trial – revisited. Diabetes 2008; 57(4): 995–1001.
10. Bragd J, Adamson U, Bäcklund LBet al. Can glycaemic variability, as calculated from blood glucose self-monitoring, predict the development of complications in type 1 diabetes over a decade Diabetes Metab 2008; 34(6 Pt 1): 612–616.
11. Siegelaar SE, Kilpatrick ES, Rigby AS et al. Glucose variability does not contribute to the development of peripheral and autonomic neuropathy in type 1 diabetes: Data from the DCCT. Diabetologia 2009; 52(10): 2229–2232.
12. Su G, Mi S, Tao H et al. Association of glycemic variability and the presence and severity of coronary artery disease in patients with type 2 diabetes. Cardiovasc Diabetol 2011; 10 : 19. Dostupné z DOI: <http://doi: 10.1186/1475–2840–10–19>.
13. van den Berghe G, Wouters P, Weekers Fet al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345(19): 1359–1367.
14. Lanspa MJ, Dickerson J, Morris AH et al. Coefficient of glucose variation is independently associated with mortality in critically ill patients receiving intravenous insulin. Crit Care 2014; 18(2): R86.
15. Šoupal J1, Škrha J Jr, Fajmon M et al. Glycemic variability is higher in type 1 diabetes patients with microvascular complications irrespective of glycemic control. Diabetes Technol Ther 2014; 16(4): 198–203.
16. Garg SK, Schwartz S, Edelman SV. Improved glucose excursions using an implantable real-time continuous glucose sensor in adults with type 1 diabetes. Diabetes Care 2004; 27(3): 734–738.
17. Kilpatrick ES, Rigby AS, Goode K et al. Relating mean blood glucose and glucose variability to the risk of multiple episodes of hypoglycaemia in type 1 diabetes. Diabetologia 2007; 50(12): 2553–2561.
18. Kovatchev BP, Cox DJ, Farhy LS et al. Episodes of severe hypoglycemia in type 1 diabetes are preceded and followed within 48 hours by measurable disturbances in blood glucose. J Clin Endocrinol Metab 2000; 85(11): 4287–4292.
19. Niskanen L, Virkamäki A, Hansen JB et al. Fasting plasma glucose variability as a marker of nocturnal hypoglycemia in diabetes: evidence from the PREDICTIVE study. Diabetes Res Clin Pract 2009; 86(2): e15-e18.
20. Cryer PE. Hypoglycemia in type 1 diabetes mellitus. Endocrinol Metab Clin North Am 2010; 39(3): 641–654.
21. Irace C, Fiorentino R, Carallo C et al. Exenatide improves glycemic variability assessed by continuous glucose monitoring in subjects with type 2 diabetes. Diabetes Technol Ther 2011; 13(12): 1261–1263.
22. Yki-Järvinen H, Dressler A, Ziemen Met al. Less nocturnal hypoglycemia and better post-dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin during insulin combination therapy in type 2 diabetes. HOE 901/3002 Study Group. Diabetes Care 2000; 23(8): 1130–1136.
23. Evans M, Schumm-Draeger PM, Vora J et al. A review of modern insulin analogue pharmacokinetic and pharmacodynamic profiles in type 2 diabetes: improvements and limitations. Diabetes Obes Metab 2011; 13(8): 677–684.
24. Pickup JC, Freeman SC, Sutton AJ. Glycaemic control in type 1 diabetes during real time continuous glucose monitoring compared with self monitoring of blood glucose: meta-analysis of randomised controlled trials using individual patient data. BMJ 2011; 343: d3805. Dostupné z DOI: <http://doi: 10.1136/bmj.d3805>.
25. Buse JB, Kudva YC, Battelino T et al. Effects of sensor-augmented pump therapy on glycemic variability in well-controlled type 1 diabetes in the STAR 3 study. Diabetes Technol Ther 2012; 14(7): 644–647.
26. Battelino T1, Phillip M, Bratina N et al. Effect of continuous glucose monitoring on hypoglycemia in type 1 diabetes. Diabetes Care 2011; 34(4): 795–800.
27. Kamble S, Weinfurt KP, Schulman KA et al. Patient time costs associated with sensor-augmented insulin pump therapy for type 1 diabetes: results from the STAR 3 randomized trial. Med Decis Making 2013; 33(2): 215–224.
28. Elleri D1, Allen JM, Biagioni M et al. Evaluation of a portable ambulatory prototype for automated overnight closed-loop insulin delivery in young people with type 1 diabetes. Pediatr Diabetes 2012; 13(6): 449–453.
29. Kumareswaran K, Elleri D, Allen JM, et al. Meta-analysis of overnight closed-loop randomized studies in children and adults with type 1 diabetes: the Cambridge cohort. J Diabetes Sci Technol 2011; 5(6): 1352–1362.
30. Elleri D, Allen JM, Kumareswaran K et al. Closed-loop basal insulin delivery over 36 hours in adolescents with type 1 diabetes: randomized clinical trial. Diabetes Care 2013; 36(4): 838–844.
31. Danne T, Kordonouri O, Holder M et al. Prevention of hypoglycemia by using low glucose suspend function in sensor-augmented pump therapy. Diabetes Technol Ther 2011; 13(11): 1129–1134.
32. Choudhary P, Shin J, Wang Y et al. Insulin pump therapy with automated insulin suspension in response to hypoglycemia: reduction in nocturnal hypoglycemia in those at greatest risk. Diabetes Care 2011; 34(9): 2023–2025.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Kalcium, vitamin D a zdraví
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Profesor Jan Škrha šedesátiletý
- Gratulace prof. MUDr. Richarda Češky, CSc., FACP, FEFIM, předsedy České internistické společnosti ČLS JEP
- Dlouhodobě působící inzulinová analoga a riziko hypoglykemických příhod
- Faktory vedoucí k poškození a destrukci B-buněk Langerhansových ostrůvků pankreatu
- Kalcium, vitamin D a zdraví
- Studie SOLOSTAR prokázala vysoký stupeň spokojenosti pacientů s používáním inzulinového pera SoloStar® v České republice
- Novinky a perspektivy v léčbě inzulinem
- Terapie inzulinem glargin v režimu bazál/bolus v klinické praxi: observační neintervenční multicentrický projekt LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
- Játra, ledviny a diabetes: tři tváře deficitu genu HNF1B
- Problematika diferenciálnej diagnostiky paraneoplastickej hypoglykémie
- Hypoglykemie jako limitace léčby diabetes mellitus
- Změny kostního metabolizmu u diabetiků
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- Glykemická variabilita a kontinuální monitorace glykemie
- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Jak dnes indikujeme perorální antidiabetika (od metforminu ke gliptinům a gliflozinům)
- Receptor pro konečné produkty pokročilé glykace (RAGE) – klíčový hráč diabetické angiopatie?
- Diabetes mellitus a karcinom pankreatu – příčina nebo následek?
- Inkretinová mimetika v léčbě diabetu 2. typu
- Retrospektívy a perspektívy personalizovanej liečby cukrovky
- První fixní trojkombinace perindopril arginin-indapamid-amlodipin: nový přístup v kombinační léčbě hypertenze
- Tisíce nalietaných hodín okolo celého sveta nemusia byť len vizitkou biznismena, ale aj úspešného lekára, výskumníka, pedagóga, manažéra a vysokého univerzitného hodnostára v jednej osobe
- Jindřiška Perušičová. Perorální léčba diabetu 2013.
- Jan Chlumský. Plicní funkce pro klinickou praxi.
- Jiří Knor, Jiří Málek. Farmakoterapie urgentních stavů.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání