-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
Acute pancreatitis – Validation of Revised Atlanta Classification on 159 patients and prognostic factors
Introduction:
In the last few years the Atlanta classification of acute pancreatitis (AP) have been revised. However prognostic markers of AP are still being searched for. The aim of this study is to validate the 3 severity cathegories proposed by the revised Atlanta classification. We also tried to reevaluate the association between two laboratory markers (leucocyte count and RDW – red cell distribution width) on admission and prognosis of the patients with AP.Methods:
159 patients were included into the study. The patients were classified according to revised Atlanta criteria and the subgroups evaluated according to mortality, lenght of hospital stay and need for interventions. Leucocyte count and RDW on admission was evaluated in the patients.Results:
All the subgroups of patients were associated with significantly relevant differences in mortality, lenght of hospital stay and need for operations on pancreas. Leucocyte count and RDW were identified as significant predictors for severe AP and RDW was also identified as significant predictor for mortality in patients with AP.Conclusion:
New categories of severity as defined by Revised Atlanta classification are describing well the mortality, lenght of hospital stay and need for interventions in the patients with AP. Leucocyte count and RDW on admission are needed to be confirmed as potential prognostic markers of severity and mortality in AP.Key words:
acute pancreatitis – Atlanta classification – leucocyte count – mild form – moderately form – prognostic factors – RDW – severe form
Autoři: Katarína Floreánová 1; Petr Dítě 2; Bohuslav Kianička 3; Lenka Dovrtělová 4; Marie Přecechtělová 1
Působiště autorů: Interní gastroeneterologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc. 1; Akademické centrum gastroenterologie Interní kliniky LF OU a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 2; Gastroenterologické oddělení II. interní kliniky LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc. 3; Katedra podpory zdraví Fakulty sportovních studií MU Brno, vedoucí katedry Mgr. Lenka Dovrtělová, Ph. D. 4
Vyšlo v časopise: Vnitř Lék 2014; 60(7-8): 567-574
Kategorie: Původní práce
Souhrn
Úvod:
V posledních letech prošla více než 20 let sloužící Atlantská klasifikace akutní pankreatitidy (AP) revizí. Přesto se prognostické ukazatele AP neustále hledají. Naše studie se pokouší zhodnotit odůvodnění 3 nově zavedených stupňů tíže revidované klasifikace akutní pankreatitidy a přínos 2 jednoduchých krevních laboratorních testů jako markerů rizika úmrtí a těžkého průběhu AP.Metody:
Do studie bylo zahrnuto a sledováno celkem 159 pacientů s AP. Pacienti byli rozděleni do skupin podle Revidované Atlantské klasifikace a jednotlivé skupiny byly hodnoceny podle počtu úmrtí, délky hospitalizace a počtu stavem vyžadovaných intervencí včetně operací pankreatu. Počet leukocytů a distribuční šíře červených krvinek (RDW – red blood cell distribution width) v první den hospitalizace byly hodnoceny z hlediska prognózy AP.Výsledky:
Podíl úmrtí, délka hospitalizace a počty operací pankreatu se statisticky významně lišily mezi všemi jednotlivými skupinami tíže podle Revidované Atlantské klasifikace. Počty bílých krvinek a RDW v 1. den hospitalizace byly identifikovány jako významné prediktory těžké AP a RDW také jako významný prediktor úmrtí.Souhrn:
Nově zavedené kategorie lehké, středně těžké a těžké AP podle pravidel Revidované Atlantské klasifikace dobře vystihují prognózu, délku hospitalizace a riziko intervencí u nemocných. Počet bílých krvinek a RDW v první den hospitalizace se jeví jako možný adept mezi ukazatele k predikci úmrtí a rozvoje těžké formy AP.Klíčová slova:
akutní pankreatitida – Atlantská klasifikace – lehká forma – počet leukocytů – prognostické faktory – RDW – středně těžká forma – těžká formaÚvod
Klasifikace akutní pankreatitidy (AP) je důležitá jak pro klinickou praxi, tak pro účely úspěšného klinického výzkumu, vedoucího k pokroku v diagnostice a také terapii tohoto onemocnění. Ideální klasifikaci by mělo být možné aplikovat na všechny pacienty, měla by reflektovat případné změny v průběhu onemocnění a správně předpovídat prognózu u jednotlivých pacientů [1]. Tak, jak se vyvíjely diagnostické a zejména zobrazovací a endoskopické metody, postupně byly navrhovány klasifikace, které by zohledňovaly také nálezy těchto metod.
Pozorování akutní pankreatitidy spojené s „těžkým“ průběhem při hemoragiích pankreatu a nekróze tukové tkáně popsal jako jeden z prvních Woolsey již v roce 1903 [2]. První dělení akutní pankreatitidy podle závažnosti se ale objevilo teprve v klasifikaci z Cambridge (1983) [3,4]. Těžká AP je zde definována zejména přítomností multiorgánového selhání, zatímco pozdější revize dělení ze sympozií v Marseille a Římě se více zaměřují na lokální komplikace AP [5,6]. Znovu zavedení klinických kritérii do klasifikace tíže akutní pankreatitidy dochází na mezinárodním sympoziu v Atlantě (1992), kde se sešlo 40 odborníků ze spektra 6 lékařských oborů z 15 zemí světa [7]. Těžká akutní pankreatitida byla definována jako přítomnost orgánového selhání nebo přítomnost lokálních komplikací (nekróza, absces, pseudocysta). Lehká AP pak byla definována jako nepřítomnost orgánového selhání a lokálních komplikací.
Původní Atlantská klasifikace sloužila odborníkům v oblasti výzkumu i lékařům 20 let. V posledních letech se ale více začaly projevovat její limity a současně ozývat hlasy k její revizi [8–11]. V první řadě tato klasifikace neposkytovala dostatečně přesný popis patomorfologických nálezů tak, jak je lze popsat na zobrazovacích metodách. Jedna studie hodnotila shodu v popisu morfologických nálezů u AP mezi radiology jako velmi nízkou a následně se rozvinula diskuse o možnostech změny pravidel k popisu lokálních komplikací AP [12,13]. Dále byla publikována studie, která odlišila skupinu pacientů se zvýšenou frekvencí komplikací AP a navazující prodlouženou hospitalizací, avšak s výrazně nižší mortalitou oproti pacientům s těžkou AP, tak jak je popisuje Atlantská klasifikace [9]. Diskuse ohledně možnosti zavedení více kategorii tíže AP tak byla otevřena [11].
Revize Atlantské klasifikace vznikla po několika kolech korekcí iniciálního konceptu na základě připomínek ze strany 11 mezinárodních pankreatologických společností [14]. Šlo o postupnou revizi původního návrhu a postupné budování konsenzu online mezi předními světovými experty v oblasti pankreatologie. Definitivní verze byla publikována v roce 2012.
V oblasti tíže onemocnění Revidovaná Atlantská klasifikace zavádí 3 kategorie:
- lehká akutní pankreatitida je definována absencí orgánového selhání a absencí jakýchkoliv lokálních či systémových komplikací
- středně těžká akutní pankreatitida je podmíněna přítomností tranzientního orgánového selhání (trvajícího méně než 48 hod) nebo lokálními či systémovými komplikacemi
- těžká akutní pankreatitida je charakterizována přítomností perzistujícího orgánového selhání (> 48 hod)
Orgánové selhání je definováno využitím modifikovaného Marshalova skórovacího systému [15], který posuzuje kardiovaskulární systém, respirační systém a ledvinné funkce. Nově jsou vymezeny pojmy lokálních komplikací a tyto jsou popsány podle kritérii vycházejících z popisu kontrastního CT. Mezi lokální komplikace s pouze tekutinovým obsahem patří akutní peripankreatická tekutinová kolekce (APFC – acute pancreatic fluid collection) a pseudocysta. Obě se vyskytují v terénu intersticiální edematózní pankreatitidy, ale zatímco AFPC se vyskytuje v prvních 4 týdnech po začátku AP, pseudocysta je vzácnější oválný útvar s průkaznou stěnou a vyvíjí se teprve po 4 týdnech trvání onemocnění. Tyto je dále potřeba odlišit od kolekcí s různým podílem solidního obsahu: akutní nekrotickou kolekcí a walled-off nekrózou. Akutní nekrotická kolekce obsahuje nekrotický materiál a nemá jasně ohraničující stěnu, walled-off nekróza se vyvíjí obvykle teprve po 4 týdnech trvání onemocnění a má jasně definovanou stěnu z reaktivní tkáně. Kolekce se solidním obsahem je někdy ne zcela snadné odlišit od kolekcí s čistě tekutinovým obsahem, proto je k definitivnímu odlišení doporučeno provést vyšetření pomocí dalších zobrazovacích metod (MRI, USG, endosonografické vyšetření) [14]. Průběh akutní pankreatitidy je rozdělen na časnou a pozdní fázi, čímž se snaží reflektovat dvouvrcholovou křivku úmrtnosti na AP [4]. Jednotlivé kategorie závažnosti podle definic původní Atlantské (1992) a Revidované Atlantské (2012) klasifikace porovnává tab. 1.
Tab. 1. Klasifikace tíže akutní pankreatitidy podle původní a Revidované Atlantské klasifikace 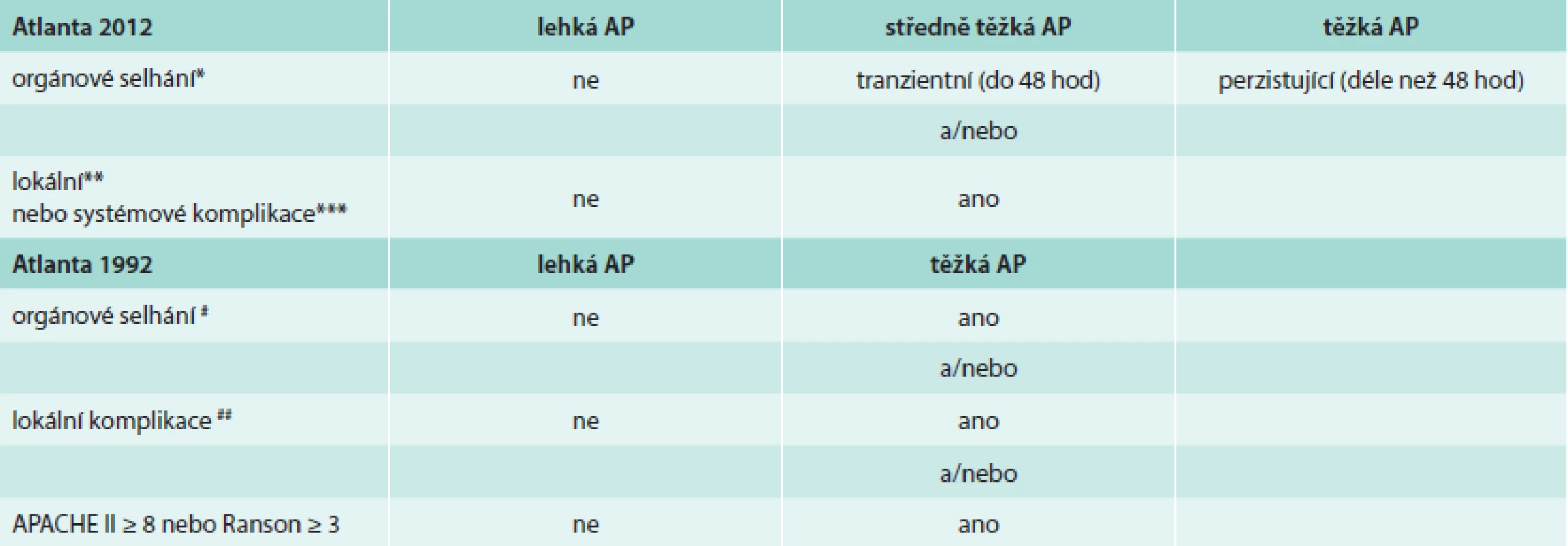
* dosažení alespoň skóre 2 u jakéhokoliv ze 3 systémů (kardiovaskulární, respirační, renální) podle modifikovaného Marshalova skóre [15] ** akutní peripankreatická tekutinové kolekce, akutní pankreatické nekrózy, pseudocysty, walled-off pankreatické nekrózy *** exacerbace preexistujícího onemocnění # šok (systolický TK < 90 mm Hg), plicní nedostatečnost (PaO2 ≤ 60 mm Hg), renální selhání (kreatinin > 177 μmol/l po rehydrataci), GIT krvácení > 500 ml/24 hod ## nekróza, absces, pseudocysta Současně s revizí Atlantské klasifikace se objevila i jiná konkurující klasifikace akutní pankreatitidy, tzv. Klasifikace založená na determinantech [16]. Tato klasifikace považuje za 2 zásadní „determinanty“ tíže AP jednak orgánové selhání a potom infekci pankreatických nekróz. Vzájemnou kombinací těchto determinant (orgánové selhání – tranzientní/perzistující a nekrózy pankreatu – sterilní/infikované) pak vymezuje 4 kategorie závažnosti akutní pankreatitidy (lehká, středně těžká, těžká, kritická).
Validitu obou navržených systémů je nyní nutno ověřit v prospektivních studiích, které již začaly probíhat a výsledky některých z nich již byly publikovány [17–21]. Validitu jednotlivých kategorii Revidované Atlantské klasifikace se snaží posoudit také naše studie. Pokud je nám známo, jde zatím o první studii tohoto typu v České republice.
Přes veškeré pokroky v diagnostice a léčbě AP stále kolem 10–25 % případů probíhá závažným způsobem s orgánovým selháním a často s fatálním průběhem [22]. Časné odlišení případů s tímto průběhem oproti lehké AP je vitální pro rychlé započetí léčby na jednotce intenzivní péče, protože jakékoliv zpoždění má za vinu nárůst úmrtnosti [23,24]. Veliké úsilí bylo v minulých desetiletích věnováno nalezení prognostických nástrojů sloužících právě k časné identifikaci případů s rozvíjejícím se těžkým průběhem akutní pankreatitidy. Jde o širokou varietu nástrojů od jednoduchých klinických ukazatelů (věk, pohlaví, body mass index – BMI) a běžných či méně používaných laboratorních testů (urea, CRP, krevní obraz, glukóza, prokalcitonin, sérový amyloid A, interleukiny atd), přes komplexní skórovaní systémy (Ransonova kritéria, Glasgowské skóre, APACHE II, BISAP atd), často nově navržené [25,26], až po vysoce propracované nástroje biostatistického hodnocení výsledků včetně umělých neuronových sítí [27]. Ideální ukazatel tíže AP by měl být směrodatný v co nejkratší době po objevení se prvních příznaků, dostatečně přesný v odhadu závažnosti a nejlépe univerzálně a snadno dostupný a levný. Přes obrovské úsilí věnované jeho nalezení, ukazatel s právě těmito vlastnostmi se stále hledá.
Metody
V období 1. 1. 2009 až 31. 12. 2010 bylo v FN Bohunice postupně hospitalizováno 159 pacientů s diagnózou akutní pankreatitidy. Diagnóza AP byla stanovena na základě podmínek stanovených Revidovanou Atlantskou klasifikací. U všech pacientů jsme v průběhu hospitalizace zaznamenali do protokolu dostupné informace o průběhu onemocnění, včetně výsledků laboratorních a zobrazovacích vyšetření, počet, typ a výsledek případných intervencí a osud pacienta. Informace o menší části pacientů hospitalizovaných ve FN Brno Bohunice byly vyhledány dodatečně pomocí nemocničního počítačového systému. U zemřelých byla stanovena nejpravděpodobnější příčina úmrtí pomocí pitevního protokolu. Byla zaznamenána délka první hospitalizace a po 36 měsíců od začátku první hospitalizace byli pacienti sledováni a zaznamenán průběh včetně řešení případných komplikací sledované ataky AP. Posléze byli pacienti ohodnoceni co se týče tíže onemocnění, byli zařazeni do jedné z kategorií jak původní Atlantské, tak také Revidované Atlantské klasifikace. Jednotlivé skupiny pacientů byly následně porovnány z hlediska podílu úmrtí, celkové délky hospitalizace u pacientů, u kterých nedošlo k úmrtí, a počtu provedených intervencí (včetně operačních zákroků a endoskopických popř. transkutánních drenáží vyžadovaných stavem pacienta). Pod pojmem operace, či operační terapie se zde uvádí operace pankreatu s laváží a drenáží. Výsledky u jednotlivých podskupin pacientů podle obou klasifikací byly podrobeny statistickému zpracování. K porovnání výsledků a výpočtu statistické významnosti byl použit χ2 test dobré shody.
Z možných prognostických ukazatelů bylo vybráno BMI a dva jednoduché laboratorní parametry krevního obrazu zaznamenané v 1. den hospitalizace (počet bílých krvinek a distribuční šířka červených krvinek). ROC analýza byla použita k ověření jejich významu ve stanovení prognózy pacienta. Hodnota p < 0,05 byla považována za statisticky významnou. Statistické analýzy byly provedeny pomocí softwaru IBM SPSS Statistics 22.
Výsledky
Ze zařazených 159 pacientů bylo 91 mužů a 68 žen. Základní charakteristiky souboru uvádí tab. 2. Průměrný věk pacientů byl 56 let. Střední délka doby od počátků potíží k hospitalizaci v FN Brno Bohunice byl 1 den. V souboru bylo 35,8 % pacientů s biliární AP a 25,4 % s alkoholickou etiologií AP, jiná etiologie byla určena u 11,7 % a příčina nebyla identifikována u celkem 17 %. Ultrasonografické vyšetření břicha ukázalo viditelné změny pankreatu v prvních dnech hospitalizace pouze u 23 % pacientů. Celkem bylo v souboru 19 úmrtí, to činilo celkovou úmrtnost v souboru 11,95 %. V souboru byl nalezen trend zvyšující se úmrtnosti s věkem.
Tab. 2. Základní charakteristika souboru 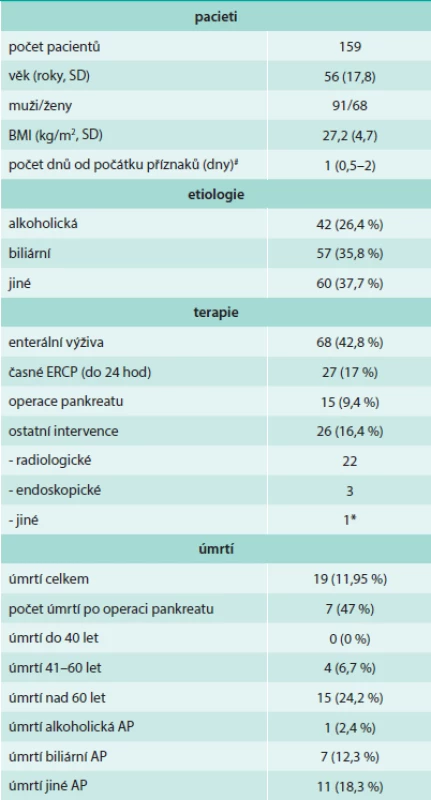
# hodnoty uvedeny jako medián (interkvartily) * Juraszova operace (pseudocysto-gastro-anastomóza) Příčiny úmrtí
Tab. 3 uvádí stručný přehled příčin úmrtí u pacientů včetně jejich zařazení podle Revidované Atlantské klasifikace. Největší podíl na úmrtích měl rozvoj sepse (celkem 12 úmrtí) ať už z důvodu septických lokálních komplikací AP anebo rozvoje brochopneumonie či sepse nedefinovaného původu.
Tab. 3. Příčiny úmrtí u pacientů s AP 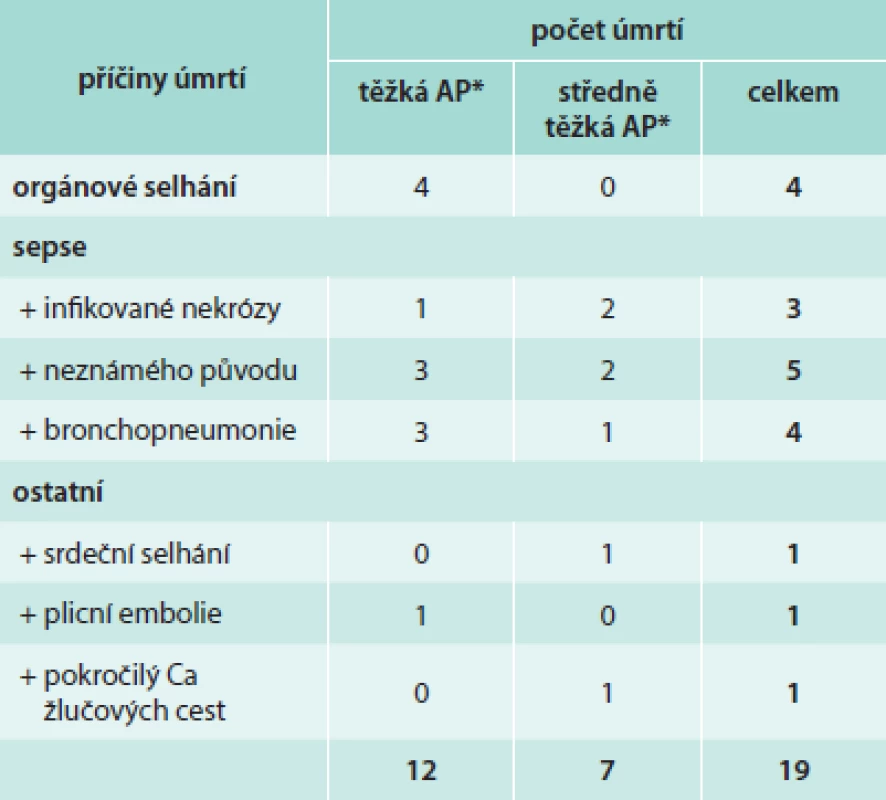
* dle Revidované Atlantské klasifikace (2012) Tab. 4 porovnává stručně prognózu u pacientů s operací pankreatu, drenáží a laváží a u pacientů léčených konzervativně a také střední načasování operací. Dva z operovaných pacientů se středně těžkou AP zemřeli, oba do 2 dní po operačním zákroku v důsledku sepse. Z jednotlivých skupin v tab. 4 se vyjímá vysokou úmrtností skupina konzervativně řešených pacientů s těžkou AP. Po bližším prošetření těchto pacientů ale zjistíme, že 4 zemřelí byli původně přijati v těžkém stavu a léčeni pro multiorgánové selhání, popř. ještě další závažná onemocnění, nicméně diagnóza AP u nich byla stanovena teprve z pitevního nálezu. U dalších 2 těchto pacientů se rozvinul perakutní průběh onemocnění a zemřeli do 2 dnů od prvních příznaků.
Tab. 4. Terapie chirurgická vs konzervativní u středně těžké a těžké akutní pankreatitidy dle Revidované Atlantské klasifikace 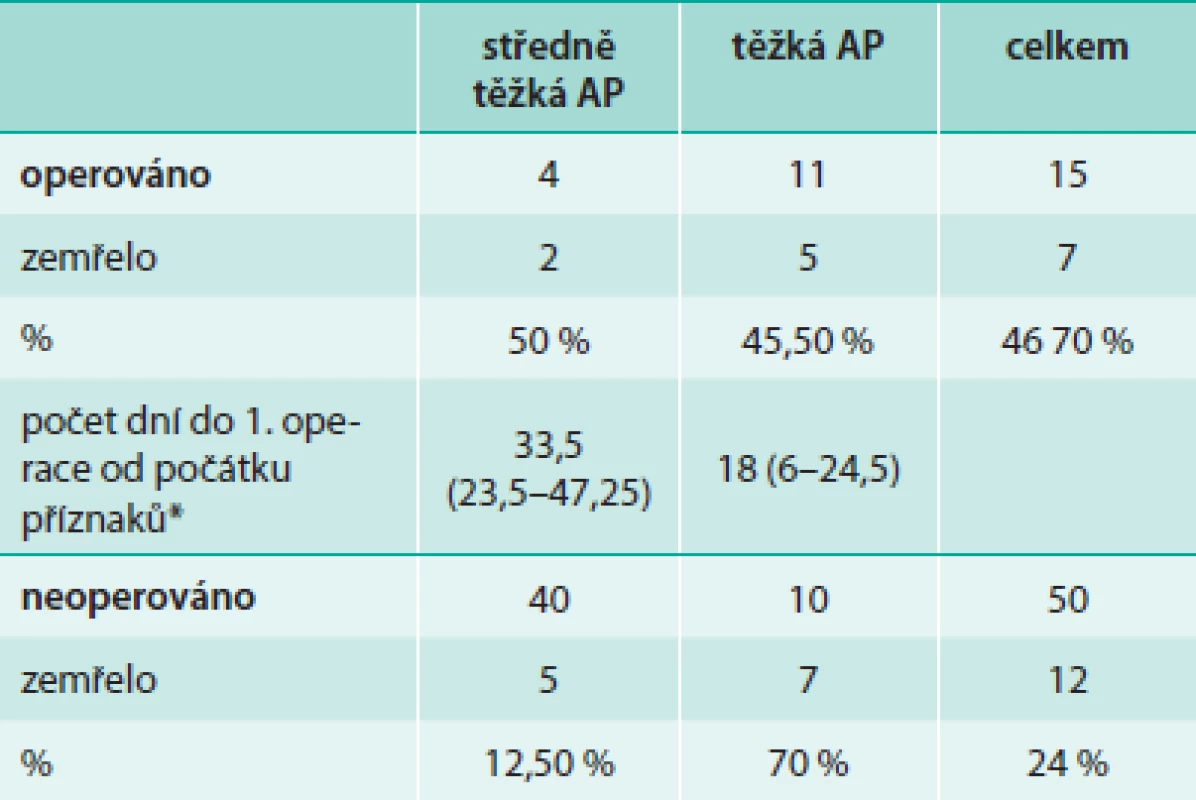
* hodnoty uvedeny jako medián (interkvartily) Atlantská klasifikace 1992
Těžká AP byla identifikována u 57 pacientů a lehká AP byla u 102 pacientů. Mezi oběma skupinami pacientů byly nalezeny statisticky významné rozdíly ve všech 3 výstupových parametrech (úmrtnost, délka hospitalizace přeživších pacientů, počet intervencí).
Revidovaná Atlantská klasifikace 2012
Do kategorie lehké AP bylo zařazeno celkem 94 pacientů, ve středně těžké kategorii bylo 44 pacientů a v kategorii těžké AP 21 pacientů. V podílu úmrtí byl nalezen statisticky významný rozdíl mezi všemi kategoriemi závažnosti celkově i mezi těžkou a středně těžkou AP (p < 0,001). Délka 1. hospitalizace (u přeživších pacientů) a počet provedených operací pankreatu se rovněž statisticky významně lišily mezi všemi jednotlivými skupinami dle Revidované Atlantské klasifikace. Když jsme porovnali skupiny z hlediska počtu všech provedených intervencí vyžadovaných stavem (zahrnující jak operace pankreatu, tak drenáže pod CT-kontrolou či endoskopické drenáže kolekcí), statisticky významný rozdíl (p < 0,001) byl nalezen pouze mezi lehkou a středně těžkou AP. Základní charakteristiky pacientů, které by mohly ovlivnit výslednou prognózu (např. věk, pohlaví, či BMI v jednotlivých skupinách) se mezi jednotlivými skupinami závažnosti významně nelišily. Souhrn výsledků v jednotlivých kategoriích Atlantské i Revidované Atlantské klasifikace uvádí tab. 5.
Tab. 5. Porovnání výsledků souboru pacientů dle původní i Revidované Atlantské klasifikace 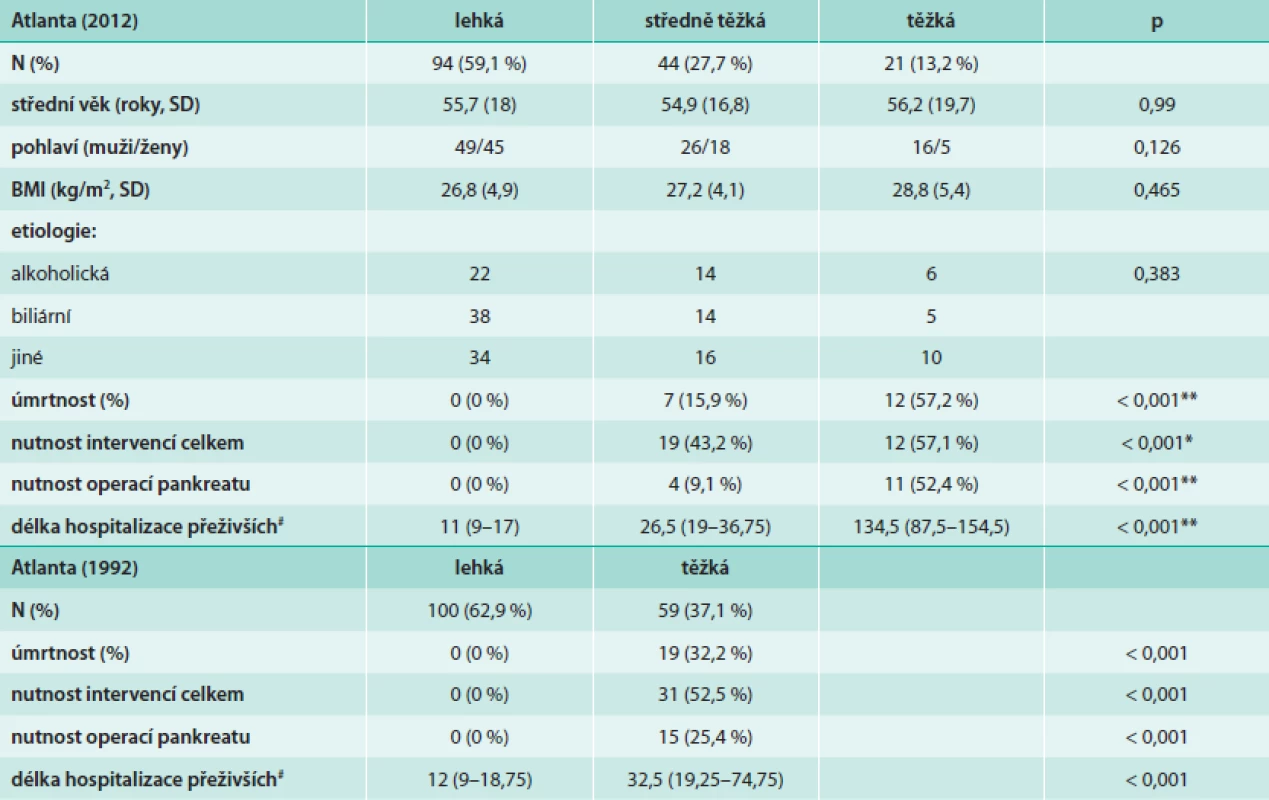
** statisticky významné rozdíly byly nalezeny mezi všemi kategoriemi závažnosti * statisticky významný rozdíl byl nalezen mezi lehkou a středně těžkou kategorií závažnosti # hodnoty uvedeny jako medián (interkvartily) Prognostické faktory krevního obrazu v první den hospitalizace
Pomocí ROC analýzy byly jako významné prediktory pro těžkou AP (dle Atlanta 2012) identifikovány počty bílých krvinek (AUC = 0,734; 95% interval spolehlivosti IS 0,585–0,883; p = 0,001) a RDW (AUC = 0,707; 95% IS 0,600–0,814; p = 0,002), graf. Pro cut off hodnotu počtu bílých krvinek 16,25 × 109 byla těžká AP (dle Atlanta 2012) předpověděna s 76,2% senzitivitou a 76,1% specificitou.
Graf 1. ROC křivka RDW pro predikci úmrtí 
RDW bylo pomocí ROC analýzy identifikováno také jako významný prediktor úmrtí (AUC = 0,716, 95% IS 0,594–0,837; p = 0,002). Při cut off hodnotě RDW 13,25 % bylo úmrtí předpověděno s 68,4% senzitivitou a 67,9% specificitou.
BMI se v našem souboru neprojevilo jako významný prediktor úmrtí či těžké AP.
Souhrn výsledků ROC analýzy ukazatelů krevního oběhu ukazuje tab. 6. ROC křivku RDW pro predikci úmrtí znázorňuje graf.
Tab. 6. ROC analýza pro WBC a RDW při hodnocení těžké AP (Atlanta 1992, Atlanta 2012) a úmrtnosti 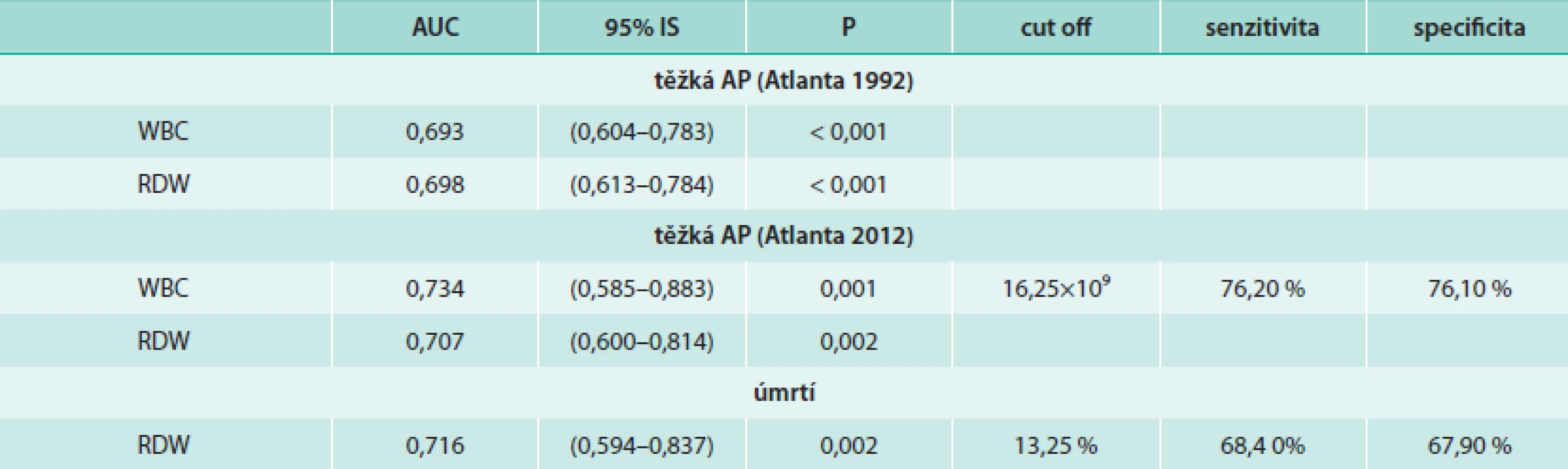
Diskuse
Již několik let před vznikem Revidované Atlantské klasifikace AP se diskutovalo o možném větším množství podskupin tíže u onemocnění akutní pankreatitidou [8,9]. Několik studii potvrzovalo teorii, že přítomnost či nepřítomnost orgánového selhání hraje zásadní roli v úmrtnosti u AP [8–10]. Revidovaná Atlantská klasifikace reflektující nové poznatky o patogenezi a přirozeném průběhu AP a založená na dosaženém konsenzu mezi experty vyžaduje nyní ověření a validaci v pokud možno prospektivních klinických studiích [28].
Naše studie ukázala signifikantní rozdíly v průběhu a výsledcích u jednotlivých kategorií Revidované Atlantské klasifikace, a to ve všech 3 výstupních parametrech (podíl úmrtí, potřeba intervencí, délka hospitalizace). Rozřazení pacientů mezi jednotlivé kategorie Revidované Atlantské klasifikace v naší studii nečinilo výraznější obtíže, což reflektuje poměrně jasné a jednoduché definování pojmů v nově navržené klasifikaci. Podstatná část pacientů se středně těžkou AP podle revidované klasifikace se rekrutovala z těžké AP dle původní Atlantské klasifikace. Pouze několik těchto pacientů bylo zařazeno pod lehkou AP dle původní Atlantské klasifikace. To ukazuje na skutečnost, že do Revidované Atlanty jsou nově zařazeni také pacienti s pouhou exacerbací chronického onemocnění vyvolanou AP [14]. Někdy je namítáno, že středně těžká AP dle Revidované Atlantské klasifikace je vlastně směsicí více kategorií, které mohou mít také různou prognózu [29]. Nicméně naše práce stejně jako již několik dalších podporuje odůvodnění této středně těžké kategorie AP, jenž se ve výsledcích dostatečně liší od dalších kategorií této klasifikace [17,18,20,21].
O validaci nové klasifikace a také ve stejné době vzniklé klasifikace založené na determinantech se pokusilo nezávisle na sobě několik prospektivních i retrospektivních studií [17–21] s vesměs velmi příznivým výsledkem vzhledem k oběma klasifikacím. V dřívějších studiích [8,9] bylo zdůrazňováno, že pankreatitida bez rozvoje orgánového selhání s pouze lokálními komplikacemi se liší od lehké AP zejména potřebou delší hospitalizace a vyšší morbiditou, zatímco mortalita zůstává stejně nízká jako u lehké formy AP. V naší studii jsme naopak zaznamenali plynule se zvyšující podíl úmrtí se signifikantními rozdíly v úmrtnosti mezi všemi 3 kategoriemi tíže. Již v kategorii středně těžké AP, při níž se na základě definice nerozvíjí perzistentní orgánové selhání, jsme zaznamenali nezanedbatelných 7 úmrtí, ne všechna úmrtí ovšem souvisela přímo s komplikacemi AP, ale často navazovala na prolongovanou hospitalizaci a pravděpodobně celkové oslabení organizmu po prodělané AP. Na místě je proto domněnka, že i AP bez časného rozvoje perzistentního orgánového selhání může nést jisté riziko úmrtí. Několik z nedávno publikovaných studií rovněž popisuje vyšší než nulovou mortalitu u kategorie středně těžké AP [19–21]. Podstatná část úmrtí u nás souvisela se sepsí a infekcemi, ty jsou u akutní pankreatitidy závažnou komplikací ovlivňující prognózu [4,30].
Infikovaná nekróza je jedním z 2 determinant tíže AP podle Klasifikace založené na determinantech [15]. Tato 4kategoriální klasifikace tak dává naroveň pankreatitidu s perzistentním orgánovým selháním a AP i zcela bez orgánového selhání, ale s prokázanou infikovanou nekrózou. Zavedení orgánového selhání a infikované nekrózy jako 2 hlavních determinant pro posuzování tíže vychází z výsledků studií, ve kterých se infikovaná nekróza potvrdila jako faktor zvyšující mortalitu AP a dalších, které potvrzují výrazně vyšší mortalitu u pacientů s přítomností orgánového selhání a infikovanou nekrózou současně [31,32]. Je ovšem možné, že tyto nabízené determinanty tíže jsou také pouze výrazem probíhajícího zánětu pankreatu, anebo že se na prognóze pacienta s AP uplatňují současně více než jenom 2 hlavní determinanty a není jednoduché zhodnotit, jakou měrou se na tíži který z nich kauzálně podílí [33]. Otázkou zatím zůstává, zda si obě nově navržené klasifikace budou konkurovat, anebo je bude možno používat doplňujícím způsobem. Ve studii Nawaze et al se klasifikace založená na determinantech ukázala lepší v predikci počtu vyžadovaných zákroků, zatímco Revidovaná Atlantská klasifikace lépe předpovídala délku hospitalizace [17]. Vzhledem k tomu, že 4kategoriální klasifikace je závislá na stanovení přítomnosti nekróz a jejich infekce, zatímco Revidovanou Atlantskou klasifikaci lze používat dynamicky již od stanovení diagnózy s postupnou reevaluací, domníváme se, že Atlantská klasifikace najde snáze své uplatnění v klinické praxi, zatímco 4kategoriální klasifikace by mohla lépe posloužit k řazení a referování pacientů v rámci klinického výzkumu.
Prognostické ukazatele hodnocené naší studii (BMI, leukocyty v 1. den hospitalizace a distribuční šíře červených krvinek v 1. den hospitalizace) jsme vybrali pro jejich jednoduchost, univerzálně běžnou dostupnost a okamžité použití.
Hladina bílých krvinek jako ukazatel tíže AP ať již samostatně či jako součást mnoha skórovacích systémů byla v minulosti použita již několikrát v různých studiích s různými výsledky [34–37]. Leukocyty byly často hodnoceny také zejména jako ukazatelé zvýšené pravděpodobnosti pankreatické/peripankreatické infekce [37,38]. Hladina leukocytů je součástí definice systémové – zánětlivé reakce organizmu (SIRS – systemic inflammatory response syndrome), jehož prodloužené trvání podporuje vznik orgánového selhání, a tak její souvislost s horším průběhem AP není překvapující.
Distribuční šíře erytrocytů (RDW – red cell distribution width) reprezentuje variabilitu objemu erytrocytů a jeho referenční meze se pohybují mezi 11 a 14 %. Vyšší hodnoty ukazují na vyšší variabilitu v objemu červených krvinek, jsou ukazatelem míry anizocytózy. RDW je jednoduchý parametr běžně referovaný jako součást rutinního vyšetření krevního obrazu a jeho dosavadní diagnostické využití se vztahovalo téměř výhradně k identifikaci několika typů anémii. V posledních letech se ale stále častěji ve studiích potvrzuje i jako významný nezávislý ukazatel úmrtnosti pacientů se srdečním selháním [39–41], dále jako nespecifický prediktor špatné prognózy u pacientů v intenzivní a poresuscitační péči [42] a také u mnoha dalších onemocnění včetně spojitosti s vyšším rizikem cévní mozkové příhody [43]. Studie Cavusoglu et al ukázala u RDW jeho silnou a na anémii nezávislou předpovědní schopnost zvýšeného rizika úmrtí do 24 měsíců u širokého spektra pacientů, včetně asymptomatických [44]. Patofyziologické mechanizmy objasňující tyto souvislosti nejsou zatím z větší části známy. Spekuluje se o účasti zánětu a prozánětlivých interleukinech snižujících odpověď buněk na erytropoetin a o celkových zánětlivých reakcích organizmu podílejících se různými způsoby na supresi erytropoézy celkově, umožňujících tak vyplavení méně zralých a větších retikulocytů do krevního oběhu [41,44,45]. První studie poukazující na propojení hladiny RDW při příjmu s vyšší mortalitou u AP byla publikována Senolem et al v roce 2013 [45], naše výsledky tyto závěry potvrzují. Potencionální možnost využití hladiny RDW k predikci průběhu u pacientů s AP by bylo potřeba ověřit na větších multicentrických prospektivních studiích.
Naše studie zaznamenala několik omezení, která se projevila v metodologii a také výsledcích. Protože se jednalo o sběr dat z jedné nemocnice, která navíc plní funkci terciárního centra, kumulovaly se u nás těžší případy AP a část pacientů byla přeložena k péči z jiných oblastí. K překladu do terciárního centra jsou často vybíráni starší a složitější pacienti. To se projevilo vysokým poměrem těžších forem AP a také vyšším poměrem úmrtí. Menší část pacientů zejména s lehkou AP nepodstoupila vyšetření kontrastního CT břicha, které bylo na uvážení ošetřujícího lékaře a nebylo nutnou součástí diagnózy, proto mohly některé lokální komplikace bez klinických projevů uniknout pozornosti a mohlo tak dojít k chybnému zařazení pacienta do kategorie tíže. Jak bylo poznamenáno výše, data malé části pacientů z oddělení byla posbírána dodatečně retrospektivně a mohlo přitom dojít k úniku některých dat, např. přesné doby trvání orgánového selhání.
Závěr
Jasně zakotvená klasifikace akutní pankreatitidy je důležitým předpokladem pokroku klinického výzkumu v této oblasti a nástrojem pro přesně dané definování stavu a komplikací pacienta při jeho předávání. Nově Revidovaná Atlantská klasifikace akutní pankreatitidy nabízí významné zpřesnění definic a dobře charakterizuje jednotlivé kategorie tíže akutní pankreatitidy. Infekce a septické stavy jsou významnou bezprostřední příčinou úmrtí na akutní pankreatitidu. Další klinické studie jsou vyžadovány k potvrzení významu distribuční šíře červených krvinek a hladiny bílých krvinek, jako možných nástrojů k predikci tíže a úmrtnosti na akutní pankreatitidu.
MUDr. Katarína Floreánová
floreanova@mail.muni.cz
Interní gastroeneterologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 15. 4. 2014
Přijato po recenzi 28. 5. 2014
Zdroje
1. Frey CF. Classification of pancreatitis: State-of-the-art, 1986. Pancreas 1986; 1(1): 62–68.
2. Woolsey G. VIII. the diagnosis and treatment of acute pancreatitis. Ann Surg 1903; 38(5): 726–735.
3. Sarner M, Cotton PB. Classification of pancreatitis. Gut 1984; 25(7): 756–759.
4. Dítě P, Novotný I, Jelíšková M et al. Klasifikace akutní pankreatitidy. Gastroenterológia pre prax 2012; 11(2): 82 -84.
5. Singer MV, Gyr K, Sarles H. Revised classification of pancreatitis. Report of the Second International Symposium on the Classification of Pancreatitis in Marseille, France, March 28–30, 1984. Gastroenterology 1985; 89(3): 683–685.
6. Sarles H. Classification and definition of pancreatitis. Marseilles-Rome 1988. Gastroenterol Clin Biol 1989; 13(11): 857–859.
7. Bradley EL. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992. Arch Surg 1993; 128(5): 586–590.
8. Talukdar R, Clemens M, Vege SS. Moderately severe acute pancreatitis: Prospective validation of this new subgroup of acute pancreatitis. Pancreas 2012; 41(2): 306–309.
9. Vege SS, Gardner TB, Chari ST et al. Low mortality and high morbidity in severe acute pancreatitis without organ failure: A case for revising the Atlanta classification to include “moderately severe acute pancreatitis”. Am J Gastroenterol 2009; 104(3): 710–715.
10. de-Madaria E, Soler-sala G, Lopez-font I et al. Update of the Atlanta classification of severity of acute pancreatitis: Should a moderate category be included? Pancreatology 2010; 10(5): 613–619.
11. Petrov MS, Windsor JA. Classification of the severity of acute pancreatitis: How many categories make sense? Am J Gastroenterol 2010; 105(1): 74–76.
12. Besselink MGH, van Santvoort HC, Bollen TL et al. Describing computed tomography findings in acute necrotizing pancreatitis with the Atlanta classification: An interobserver agreement study. Pancreas 2006; 33(4): 331–335.
13. van Santvoort HC, Bollen TL, Besselink MG et al. Describing peripancreatic collections in severe acute pancreatitis using morphologic terms: An international interobserver agreement study. Pancreatology 2008; 8(6): 593–599.
14. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis – 2012: Revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62(1): 102–111.
15. Marshall JC, Cook DJ, Christou NV et al. Multiple organ dysfunction score: A reliable descriptor of a complex clinical outcome. Crit Care Med 1995; 23(10): 1638–1652.
16. Dellinger EP, Forsmark CE, Layer P et al. Determinant-based classification of acute pancreatitis severity: An international multidisciplinary consultation. Ann Surg 2012; 256(6): 875–880.
17. Nawaz H, Mounzer R, Yadav D et al. Revised Atlanta and determinant-based classification: Application in a prospective cohort of acute pancreatitis patients. Am J Gastroenterol 2013; 108(12): 1911–1917.
18. Acevedo-Piedra NG, Moya-Hoyo N, Rey-Riveiro M et al. New classifications of severity of acute pancreatitis: Validation of determinant-based and revision of the Atlanta classification. Pancreatology 2013; 13(4): e2.
19. Thandassery RB, Yadav TD, Dutta U et al. Prospective validation of 4-category classification of acute pancreatitis severity. Pancreas 2013; 42(3): 392–396.
20. Talukdar R, Bhattacharyya A, Rao B, et al. Validation of the revised Atlanta definitions of severity of acute pancreatitis: Have all loose ends being tied? Pancreatology 2013; 13(4): S6–S7.
21. He WH, Lu NH, Chen YX et al. Analysis of the severity of 932 patients with acute pancreatitis accordance with the revised Atlanta classification. J Gastroenterol Hepatol 2013; 28(4): 679–680.
22. Schütte K, Malfertheiner P. Markers for predicting severity and progression of acute pancreatitis. Best Pract Res Clin Gastroenterol 2008; 22(1): 75–90.
23. Wu BU. Prognosis in acute pancreatitis. CMAJ 2011; 183(6): 673–677.
24. Al Mofleh IA. Severe acute pancreatitis: pathogenetic aspects and prognostic factors. World J Gastroenterol 2008; 14(5): 675–684.
25. Bota S, Sporea I, Sirli R et al. Predictive factors for severe evolution in acute pancreatitis and a new score for predicting a severe outcome. Ann Gastroenterol 2013; 26(2): 156–162.
26. Oskarsson V, Mehrabi M, Orsini N et al. Validation of the harmless acute pancreatitis score in predicting nonsevere course of acute pancreatitis. Pancreatology 2011; 11(5): 464–468.
27. Bartosch-Härlid A, Andersson B, Aho U et al. Artificial neural networks in pancreatic disease. Br J Surg. 2008; 95(7): 817–826.
28. Gress TM, El-Omar E. Revision of the Atlanta classification of acute pancreatitis: The editorial perspective. Gut 2013; 62(1): 1.
29. Lerch MM. Classifying an unpredictable disease: The revised Atlanta classification of acute pancreatitis. Gut 2013; 62(1): 2–3.
30. Lata J, Juránková J, Stibůrek O et al. Probiotika u akutní pankreatitidy – randomizovaná, placebem kontrolovaná, dvojitě slepá studie. Vnitř Lék 2010; 56(2): 111–114.
31. Besselink MG, van Santvoort HC, Boermeester MA et al. Timing and impact of infections in acute pancreatitis. Br J Surg 2009; 96(3): 267–273.
32. Lytras D, Manes K, Triantopoulou C et al. Persistent early organ failure: Defining the high-risk group of patients with severe acute pancreatitis? Pancreas 2008; 36(3): 249–254.
33. Bradley EL. Atlanta redux: Revisiting the severity stratification system for acute pancreatitis. Ann Surg 2012; 256(6): 881–882.
34. Blum T, Maisonneuve P, Lowenfels AB et al. Fatal outcome in acute pancreatitis: Its occurrence and early prediction. Pancreatology 2001; 1(3): 237–241.
35. Brisinda G, Maria G, Ferrante A et al. Evaluation of prognostic factors in patients with acute pancreatitis. Hepatogastroenterology 1999; 46(27): 1990–1997.
36. Azab B, Chainani V, Shah N et al. Neutrophil-lymphocyte ratio as a predictor of major adverse cardiac events among diabetic population: A 4-year follow-up study. Angiology 2013; 64(6): 456–465.
37. Armengol-Carrasco M, Oller B, Escudero LE et al. Specific prognostic factors for secondary pancreatic infection in severe acute pancreatitis. Dig Surg 1999; 16(2): 125–129.
38. Dambrauskas Z, Gulbinas A, Pundzius J et al. Value of routine clinical tests in predicting the development of infected pancreatic necrosis in severe acute pancreatitis. Scand J Gastroenterol 2007; 42(10): 1256–1264.
39. Means TR. Free and Easy? Red Cell Distribution Width (RDW) and Prognosis in Cardiac Disease. J Card Fail 2011; 17(4): 299–300.
40. Allen LA, Felker GM, Mehra MR et al. Validation and potential mechanisms of red cell distribution width as a prognostic marker in heart failure. J Card Fail 2010; 16(3): 230–238.
41. Förhécz Z, Gombos T, Borgulya G et al. Red cell distribution width in heart failure: Prediction of clinical events and relationship with markers of ineffective erythropoiesis, inflammation, renal function, and nutritional state. Am Heart J 2009; 158(4): 659–666.
42. Kim J, Kim K, Lee JH et al. Red blood cell distribution width as an independent predictor of all-cause mortality in out of hospital cardiac arrest. Resuscitation 2012; 83(10): 1248–1252.
43. Ani C, Ovbiagele B. Elevated red blood cell distribution width predicts mortality in persons with known stroke. J Neurol Sci 2009; 277(1–2): 103–108.
44. Cavusoglu E, Chopra V, Gupta A et al. Relation between red blood cell distribution width (RDW) and all-cause mortality at two years in an unselected population referred for coronary angiography. Int J Cardiol 2010; 141(2): 141–146.
45. Senol K, Saylam B, Kocaay F et al. Red cell distribution width as a predictor of mortality in acute pancreatitis. Am J Emerg Med 2013; 31(4): 687–689.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 7-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Jakou roli představuje péče o výživu ve smyslu malnutrice ve stáří? – editorial
- Celiakie u pacientů s diabetes mellitus 1. typu – editorial
- Diagnóza psaná klínovým písmem – editorial
- Diabetes mellitus u žen – editorial
- Vliv podávání tekutého mléčného nutričního doplňku se zvýšeným obsahem syrovátkových bílkovin na nutriční stav seniorů
- Celiakie u pacientů s diabetes mellitus 1. typu
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Genetika a farmakogenetika osteoporózy
- Význam lymfangiogenézy a ultraštruktúry lymfatických kapilár pri metastázovaní malígneho melanómu
- Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let?
- Specifika diabetes mellitus u žen
- Osteoporóza a metabolické kostní změny u celiakie v dospělosti
- Model vzdělávání sekundáře na Interní klinice FN Motol Praha Naše naše zkušenosti s lokálním projektem vzdělávání mladých lékařů v rámci jejich povinné postgraduální výuky
-
Zdeněk Mařatka a jeho podíl na založení České gastroenterologické společnosti a jejího časopisu.
Gastroenterologická společnost v Čechách a na Slovensku - Chirurgická léčba Crohnovy choroby
- Pokroky v diagnostice a léčbě nespecifických střevních zánětů
- Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
- Crohnova nemoc – genetické faktory z pohledu etiopatogeneze
- Etiologie a patogeneze idiopatických střevních zánětů
- Historie chirurgické léčby nespecifických zánětů střevních
- Epidemiologie dyspepsie
- Manažment pacientov s horným typom dyspepsie
- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Správa z XXXIII. dní mladých internistov
- Dostál P a kol. Základy umělé plicní ventilace.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Chirurgická léčba Crohnovy choroby
- Manažment pacientov s horným typom dyspepsie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



