-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endoskopická klasifikace neoplazií tlustého střeva a konečníku
Endoscopic classification of colon and rectal neoplasias
Along with the dynamic evolution of the new field of digestive endoscopy, the need of unified and unambiguous terms for endoscopic findings arose in the second half of the 20th century. In collaboration with the OMED members, professor Zdeněk Mařatka drew up the first internationally acknowledged terminology for digestive endoscopy which was used in the full range for a period of almost 20 years. The technical progress later brought with it endoscopes which made it possible to view flat lesions, frequently overlooked until then. The classification of the surface lesions was further specified by the Paris Classification which drew from the experience of Japanese endoscopists. Thanks to the new endoscopic methods of imaging mucosa in vivo and the pit-pattern and vascular-pattern classification, we can currently estimate the biological nature of lesion with great accuracy and therefore choose the best therapeutic procedure.
Key words:
adenoma – colonoscopy – colorectal carcinoma – Mařatka classification – Paris classification – pit-pattern – vascular-pattern
Autoři: Miroslav Zavoral; Gabriela Vojtěchová; Štěpán Suchánek
Působiště autorů: Interní klinika 1. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha, přednosta prof. MUDr. Miroslav Zavoral, Ph. D.
Vyšlo v časopise: Vnitř Lék 2014; 60(7-8): 664-668
Kategorie: 100. výročí narození profesora Z. Mařatky
Souhrn
Společně s dynamickým rozvojem nového oboru digestivní endoskopie vznikla ve 2. polovině 20. století nutnost jednotného a jednoznačného názvosloví endoskopických nálezů. Profesor Zdeněk Mařatka ve spolupráci se členy OMED vypracoval první mezinárodně uznávanou terminologii pro digestivní endoskopii, která byla v plné šíři užívána bezmála 20 let. Technický pokrok následně přinesl endoskopy, umožňující zobrazit i do té doby často přehlížené ploché léze. Zpřesnění klasifikace povrchových lézí přinesla Pařížská klasifikace, vycházející ze zkušenosti japonských endoskopistů. Díky novým endoskopickým metodám zobrazení sliznice in vivo a klasifikaci pit-pattern a vascular-pattern můžeme v současné době s velkou přesností odhadnout biologickou povahu léze a zvolit tak optimální terapeutický postup.
Klíčová slova:
adenom – klasifikace Mařatkova – klasifikace Pařížská – kolonoskopie – kolorektální karcinom – pit-pattern – vascular-patternÚvod
Digestivní endoskopie je poměrně mladý medicínský obor. S pokrokem technických možností se zdokonaluje nejen schopnost detekce, ale i diagnostiky a terapie patologických lézí. Cesta k dnešním endoskopům byla zdlouhavá. První optický přístroj pro zobrazení vnitřních dutin, endoskop, sestavil v roce 1806 německý lékař Philipp Bozzini [1]. Šedesát let poté provedl Adolph Kussmaul ezofagoskopii rigidním endoskopem. Není divu, že jeho prvním pacientem byl polykač mečů. Snahy o zobrazení kolon limitovaly technické možnosti. V 50. letech minulého století zavedli chirurgové Deddish a Fairweather kolonoskopii z kolotomie. Techniku trakční kolonoskopie po transintestinální intubaci vodičem s navázaným závažím popsal v roce 1955 Blankenhorn et al [2]. Až do roku 1957 si pacienti museli počkat na první plně flexibilní endoskop (gastroskop) konstruovaný Basilem Hirschowitzem. Pomocí rigidního zavaděče se zahnutým koncem, kterým bylo možno prostrčit bioptickou sondu či fibroskop, bylo možno vyšetřit colon descendens a zřídka, v 10 % případů, i colon transversum [3]. V roce 1964 Hirohumi Niwa společně s Olympus Optical Corp vytvořil první kolonoskop, se kterým dosáhl levého, a v 8 % případů dokonce i pravého kolon [4]. Tehdy již bylo možné odebírat histologické vzorky pod optickou kontrolou, pořizovat fotodokumentaci a od roku 1983 i videozáznam.
Mařatkova klasifikace
S dynamickým rozvojem endoskopie vzešla potřeba jednotné mezinárodní klasifikace endoskopických nálezů. V roce 1976 byl Evropskou společností pro gastrointestinální endoskopii (European Society of Gastrointestinal Endoscopy – ESGE) založen Výbor pro terminologii v digestivní endoskopii, který se o dva roky později přejmenoval na Výbor světové společnosti pro digestivní endoskopii (Committee of the World Society of Digestive Endoscopy – OMED). První standardizovanou terminologii vypracoval ve spolupráci s členy OMED prof. Zdeněk Mařatka. Anglická verze „Terminology, definitions and diagnostic criteria in digestive endoscopy“ [5], publikovaná v roce 1984, byla během čtyř let přeložena do pěti světových jazyků.
Prof. Mařatka byl přesvědčen, že jen dobře popsané a zařazené endoskopické nálezy mohou být správně interpretovány a vést k diagnóze. Jeho terminologie je seznamem explicitně definovaných termínů. Endoskopická zpráva by měla, dle Mařatky, obsahovat podrobný popis zobrazených částí GIT (lumen, obsah, stěna, peristaltika, sliznice, ev. krvácení, abnormální otvory, ploché, prominující a vkleslé léze) a jejich interpretaci shrnutou v závěru. Finální diagnózu je možné určit až po obdržení výsledku histologického či cytologického vyšetření. V tab. 1 uvádíme Mařatkovu klasifikaci kolorektálních neoplazií. V roce 1992 byla publikována ilustrovaná verze terminologie.
Tab. 1. Mařatkova klasifikace kolorektálních neoplazií [5] ![Mařatkova klasifikace kolorektálních neoplazií [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c0d40fc2c1e1e7a20b0036a81d7e4946.png)
Minimální standardní terminologie (minimal standard terminology – MST) vznikla z nutnosti zjednodušení klasifikace OMED pro elektronický zápis endoskopické zprávy. MST obsahuje 95 % nejčastějších pojmů z původní terminologie.
Japonská klasifikace
V 2. polovině 20. století se východní, resp. japonská endoskopická škola začala významně odlišovat od té západní. Příčinou byla vysoká zátěž japonské populace karcinomem žaludku a související nutnost detekce a klasifikace karcinomu žaludku v časném stadiu [6]. Japonci ve snaze najít ploché léze používali častěji chromoendoskopii a zvětšovací endoskopy. Zkušenosti z endoskopie horní části trávicího traktu aplikovali i na kolon. Japonskou endoskopickou klasifikaci kolorektálního karcinomu přináší tab. 2 [7].
Tab. 2. Japonská endoskopická klasifikace KRK [7] ![Japonská endoskopická klasifikace KRK [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/50890792284ae5e6c5f5b3ed306ce596.png)
Pařížská klasifikace
Na přelomu listopadu a prosince roku 2002 se v Paříži setkal mezinárodní multidisciplinární team a vytvořil tzv. Pařížskou klasifikaci povrchových lézí. Pojem povrchová léze zahrnuje v této klasifikaci neoplastické léze, u kterých z jejich endoskopického vzhledu usuzujeme, že nepřesahující muscularis mucosae nebo neinvadují hlouběji než do submukózy.
Rozlišujeme polypoidní 0-I léze, které dále dělíme na 0-Ip a 0-Is (stopkaté a přisedlé). Široce přisedlý či polostopkatý typ 0-Isp není nutné rozlišovat, neboť jeho management je shodný s 0-Is.
Nepolypoidní typ 0-II značí lézi nižší než 2,5 mm (nepřesahuje výši branží zavřených bioptických kleští), která může být povrchová vyvýšená (0-IIa), plochá (0-IIb) a povrchová vkleslá (0-IIc).
Dalším typem léze je léze vkleslá 0-III.
Nejčastějšími smíšenými lézemi jsou povrchová vkleslá léze s vyvýšenými okraji (typ 0-IIc + 0-IIa) a povrchová vyvýšená léze s centrální vkleslinou (0-IIa + 0-IIc), tab. 3 a obr. 1–5 [8].
Tab. 3. Pařížská klasifikace povrchových lézí [8] ![Pařížská klasifikace povrchových lézí [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1519158a9fe93a095f8a36f034e49425.png)
Obr. 1. Přisedlý polyp kolon transverzum, 0–Is. Bílé světlo. 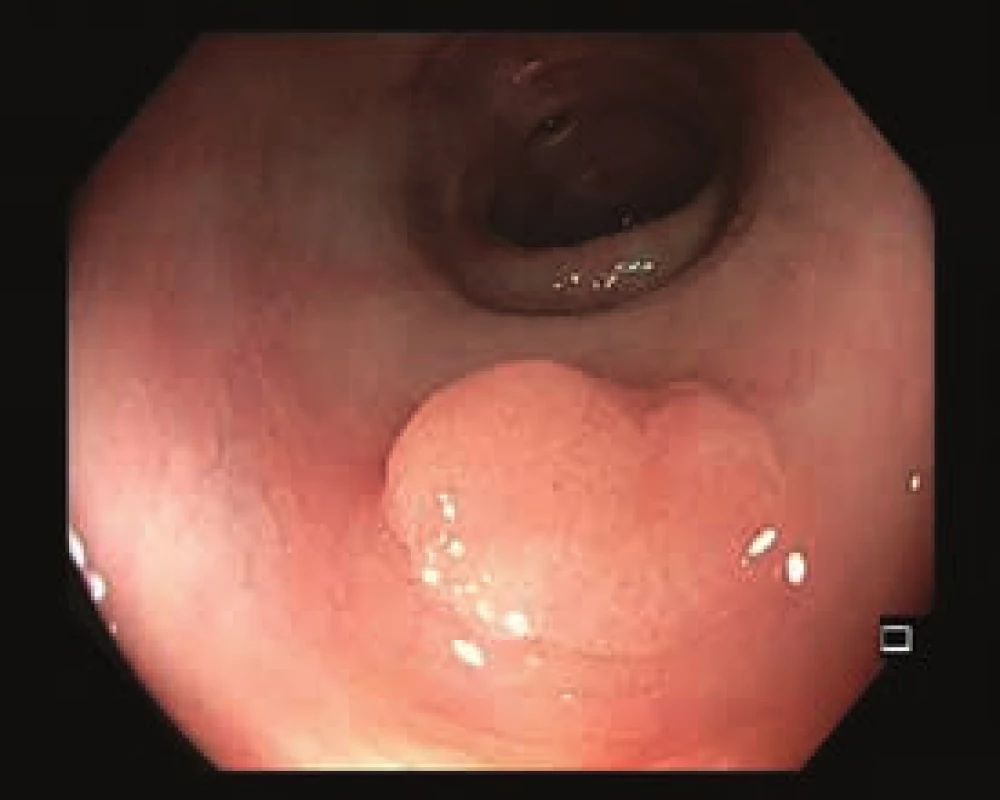
Obr. 2. Nepolypoidní léze na dně céka, 0–IIa. Zobrazení v NBI. 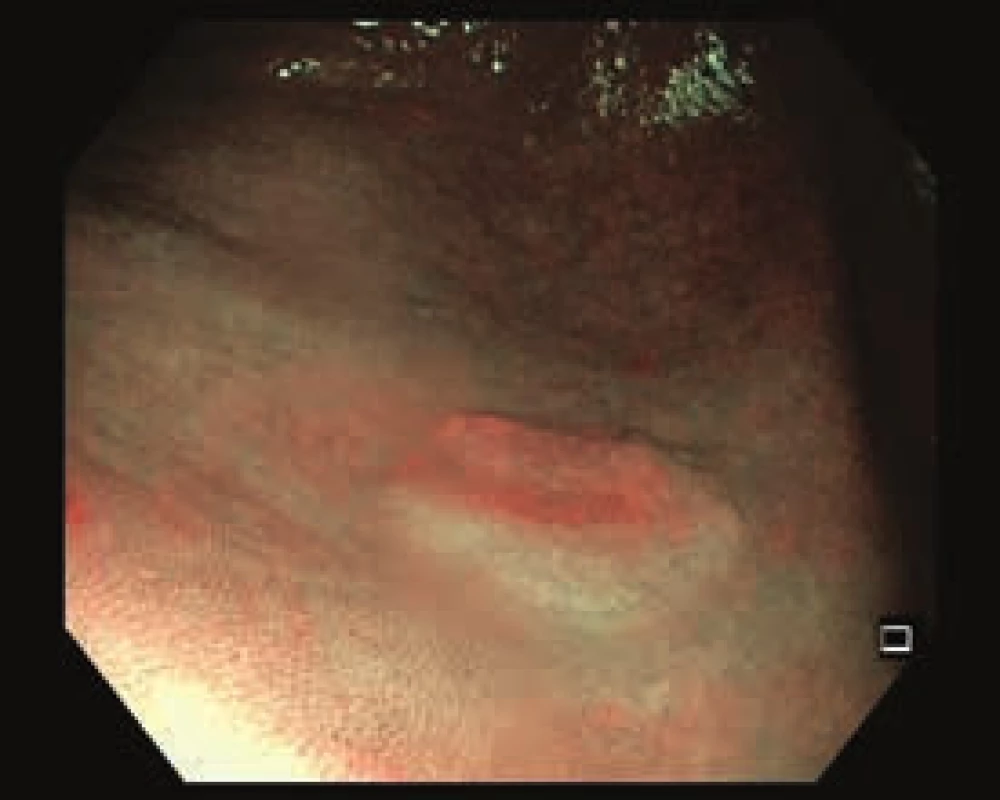
Obr. 3. Smíšená léze v orálním ascendens, 0–Is + IIc. Po submukózní injekci patrný pouze parciální lifting sign v centrální části léze. Bílé světlo. 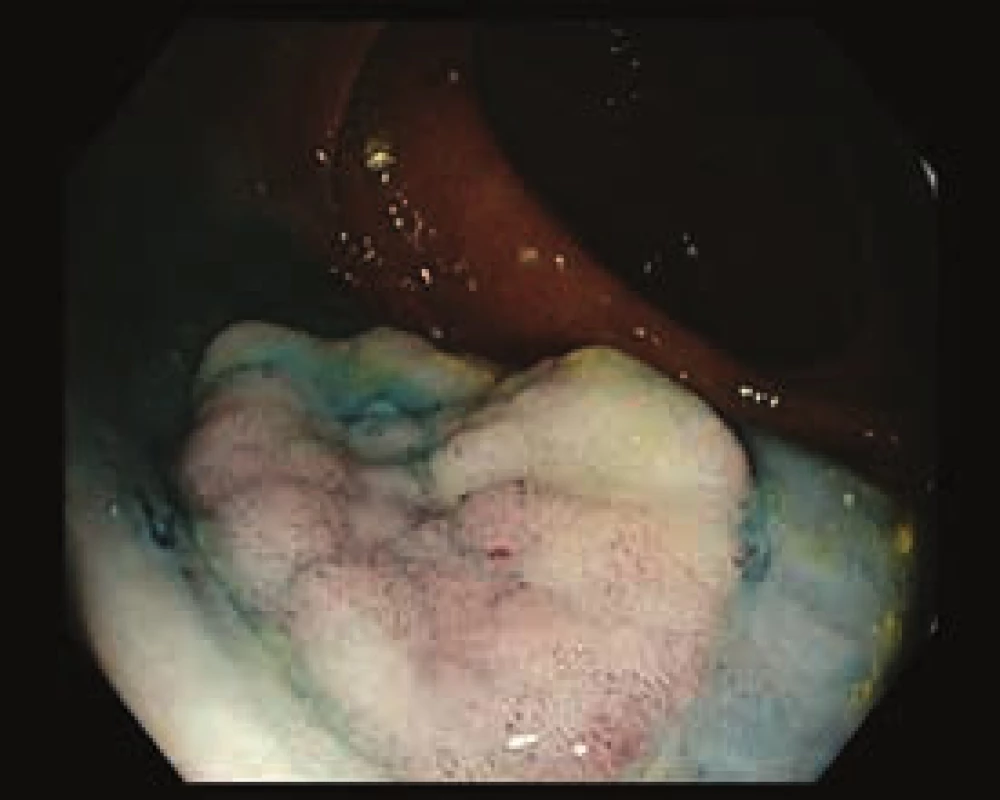
Obr. 4. Smíšená léze v orálním ascendens, 0–Is + IIc. Zobrazení v NBI. 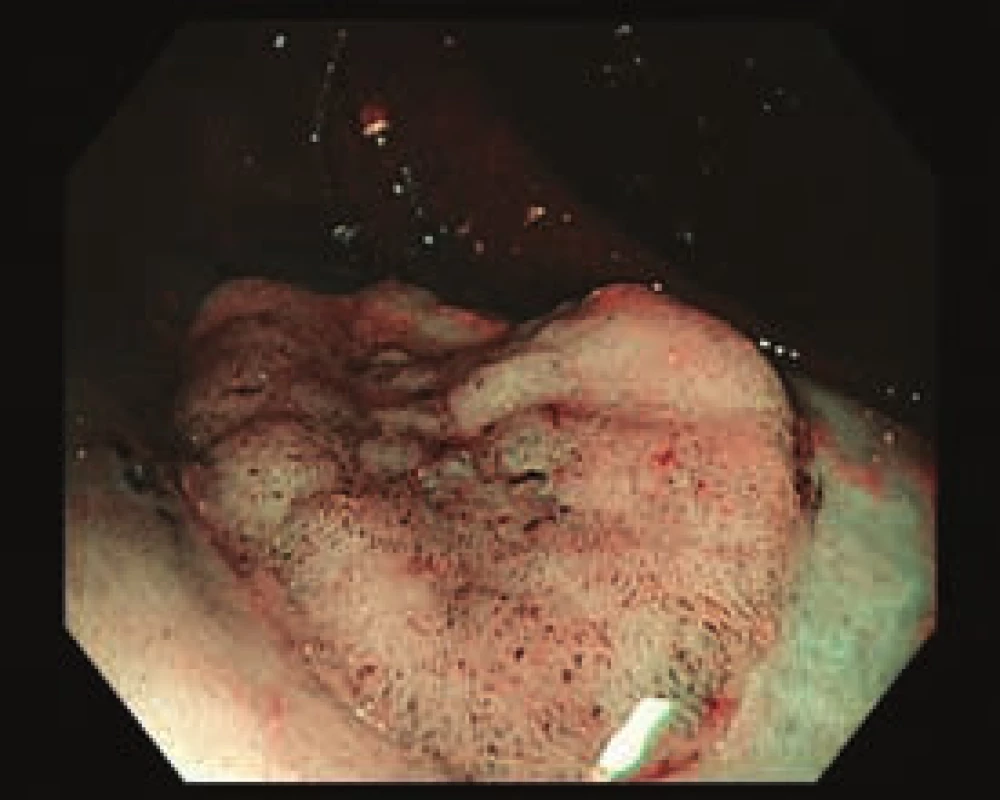
Obr. 5. Smíšená léze v transverzu, 0–Is + IIb. Zobrazení v NBI. 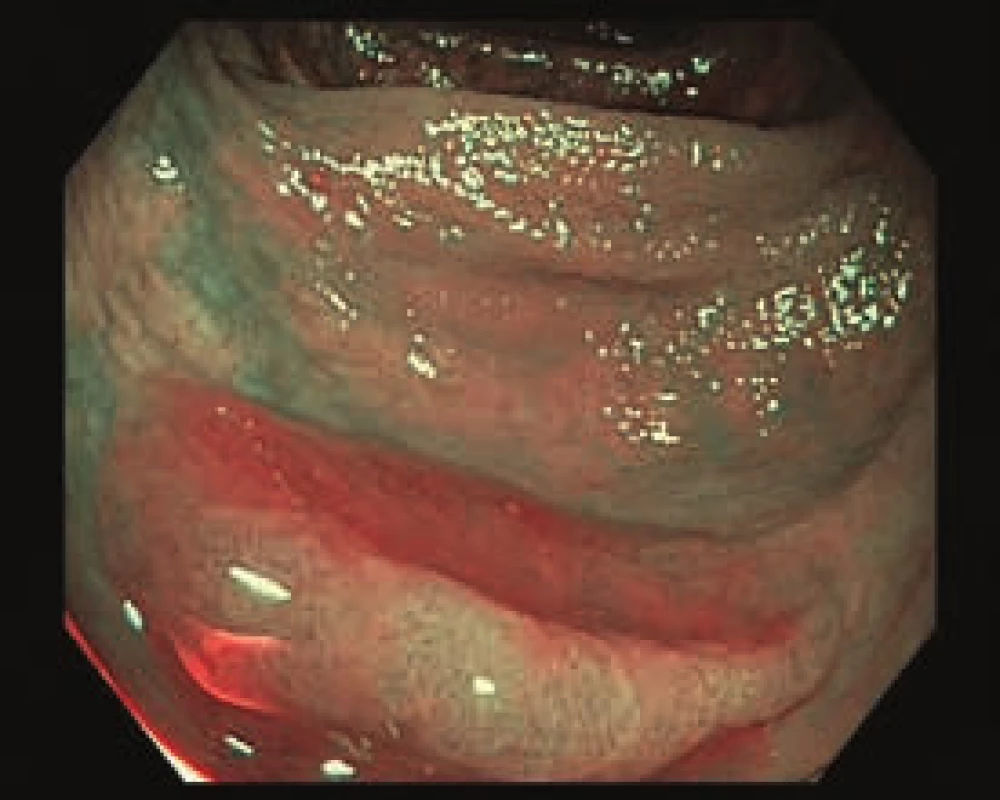
Hlavním smyslem endoskopické klasifikace povrchových lézí je predikce rizika submukózní invaze a postižení lymfatických uzlin. U typu 0-I výše rizika koreluje s velikostí polypu. U typů 0-IIc je invaze do submukózy relativně častá. Obecně je velikost léze důležitým znakem, dle kterého lze usuzovat na riziko maligního zvratu. Hranice mezi malým a velkým adenomem byla stanovena na 10 mm. Za tzv. pokročilý adenom, tedy adenom s vyšším maligním potenciálem, označujeme lézi velikosti 10 mm a více, s vilózní komponentou či high grade kolorektální neoplazií.
Klasifikace LST lézí
Pojem horizontálně se šířící nádor (laterally spreading type – LST lesion), který poprvé zavedl prof. Kudo, označuje povrchové vyvýšené léze > 10 mm [9]. S ohledem na jejich povrchovou strukturu rozlišujeme 2 základní typy LST lézí: granulární a negranulární typ. Srovnání klasifikace LST lézí a Pařížské klasifikace přináší tab. 4.
Tab. 4. Morfologická klasifikace LST lézí a korelace s Pařížskou klasifikací [9] ![Morfologická klasifikace LST lézí a korelace s Pařížskou klasifikací [9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/240b42514eb1b6d55e1706102817241e.png)
Kudova pit-pattern klasifikace
Dalším výrazným mezníkem ve vývoji endoskopických metod bylo zavedení zvětšovacích a high-resolution endoskopů, které v kombinaci s chromoendoskopií výrazně přispěly k lepší lokalizaci, charakteristice a diagnostice kolorektálních lézí. Při klasické chromodiagnostice jsou barviva (metylenová modř, krystal violeť, indigo karmín) přímo aplikována na střevní sliznici. Virtuální chromoendoskopie, jako např. narrow band imaging (NBI) využívá světelných filtrů, zatím co u I-scan a Fujinon intelligent color enhancement (FICE) je výsledný obraz získán na základě počítačového zpracování.
Japonský gastroenterolog Kudo prohlížel léze zvětšovacím endoskopem po aplikaci barviv a jako první poukázal na rozdíl v uspořádání ústí krypt v závislosti na jejich biologické povaze. Následně vypracoval 5stupňovou pit-pattern klasifikaci (tab. 5). Neneoplastické léze (I a II) mají pravidelné pit-patterns a představují normální sliznici či hyperplastický polyp. Neoplastické léze (III-V) se vyznačují stoupající mírou slizničních nepravidelností [10]. Podmínkou pro využití pit-pattern klasifikace pro určení optimálního terapeutického postupu je provádění zvětšovací kolonoskopie a chromodiagnostiky či NBI. Japonští autoři udávají shodu s histologickým vyšetřením v 90–95 % [11]. Významným faktorem, který ovlivňuje použitelnost této klasifikace v praxi, je zkušenost endoskopisty.
Tab. 5. Kategorie „pit-pattern“ sliznice tlustého střeva: zvětšovací kolonoskopie s chromodiagnostikou/NBI 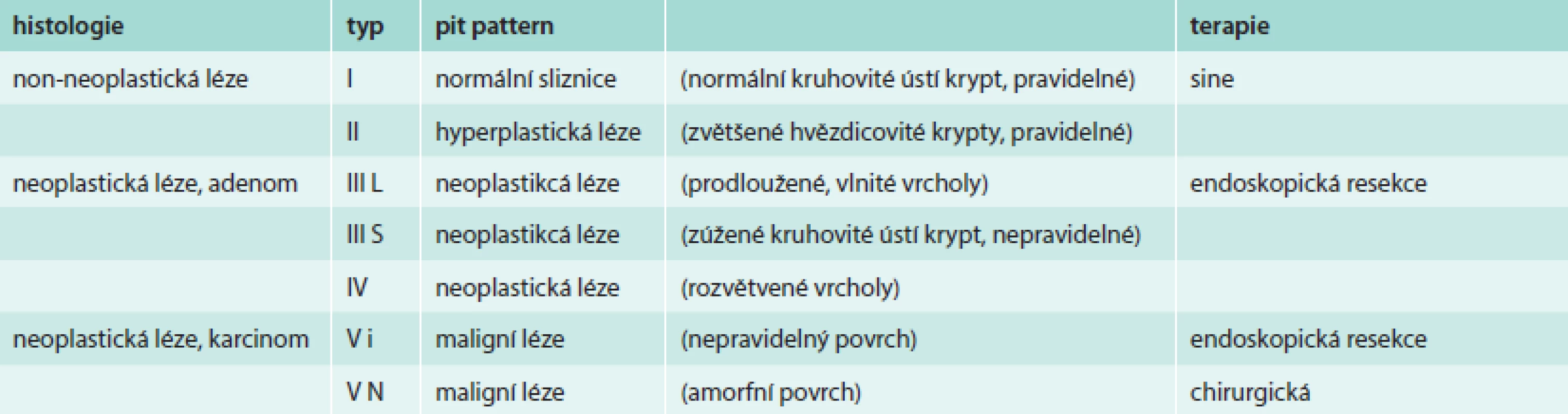
Vascular pattern klasifikace
Další v Japonsku standardně používanou pomůckou v rozlišení mezi non-neoplastickou, neoplastickou lézí a karcinomem je klasifikace „vascular pattern“. Na základě uspořádání cév při ústí krypt, pozorovaných zvětšovacím endoskopem s NBI, můžeme zvolit optimální terapeutický postup (tab. 6) [12].
Tab. 6. Kategorie „vascular pattern“ na povrchu sliznice tlustého střeva: zvětšovací kolonoskopie s NBI 
Terapie časné kolorektální neoplazie
Dle velikosti a charakteru léze (viz výše uvedené klasifikace) lze k endoskopické léčbě užít polypektomii (EPE) endoskopickou kličkou, endoskopickou mukozální resekci (EMR) po „podpichu“ fyziologickým roztokem, eventuálně s adrenalinem nebo barvou pro lepší orientaci, nebo endoskopickou submukózní disekci (ESD). Při ESD se pomocí speciálních endoskopických akcesorií (nože ESD) odstraňuje polyp en block i se submukózou. Pokud je však karcinom málo diferencovaný, vzdálenost maligních buněk od okraje resekátu je ≤ 1 mm, či v histologickém preparátu detekujeme známky invaze do lymfatických cév, nelze endoskopický výkon považovat za suficientní a chirurgická resekce je pak nezbytná [13]. U vysoce suspektních lézí (typ IIc či III dle Pařížské klasifikace, pit-pattern VN nebo nečetné vascular-pattern) přistupujeme rovnou k chirurgickému řešení, neboť endoskopický výkon by pro pacienta představoval zbytečnou zátěž, riziko komplikací a oddálení kurativní léčby.
Závěr
Výše uvedené endoskopické klasifikace kolorektálních neoplazií pomáhají endoskopistům určit optimální terapeutický postup a zlepšit tak prognózu i kvalitu života jejich pacientů.
prof. MUDr. Miroslav Zavoral, Ph.D.
miroslav.zavoral@uvn.cz
Interní klinika 1. LF UK a ÚVN, Praha
www.uvn.cz
Doručeno do redakce 2. 6. 2014
Zdroje
1. Bozzini P. Der Lichtleiter Oder Die Beschreibung Einer Einfachen Vorrichtung Und Ihrer Anwendung Zur Erleuchtung Innerer Hohlen Und Zwischenraume des Lebenden Animalischen Korpers. Verlag Des Landes Industrie Compoir: Weimar (Germany) 1807.
2. Blankenhorn DH, Hirsch J, Ahrens EH jr. Transintestinal intubation: technic for measurement of gut length and physiologic sampling at known loci. Proc Soc Exp Biol 1955; 88(3): 356.
3. Fox JA, Kreel L. Technique of retrograde colonic intubation and its initial application to high colonic biopsy. Gut 1967; 8(1): 77–80.
4. Niwa H, Fujino M, Yoshitoshi Y. Colonic fiberscopy for routine practice. IInd World Congress of Gastrointinal Endoscopy. Rome and Copenhagen 1970. Piccin Medical Books: Padova 1972.
5. Mařatka Z. Terminology, definitions and diagnostic criteria in digestive endoscopy. Scand J Gastroenterol 1984; 19(Suppl 103): 1–74.
6. Aiko T, Sasako M. The new Japanese classification of gastric carcinomas: points to be revised. Gastric Cancer 1998; 1(1): 25–30.
7. Kato H, Sakamoto T, Otsuka H et al. Endoscopic diagnosis and treatment for colorectal cancer. In: Ettarh R (ed). Colorectal cancer – from prevention to patient care. InTech 2012 : 327–348. ISBN 978–953–51–0028–7.
8. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. Gastrointestinal Endoscopy 2003; 58(Suppl): 1–21.
9. Kudo S. Early colorectal cancer. Tokyo: Igaku-shoin 1996. ISBN 13 : 9780896403307. ISBN 10 : 896403300.
10. Kudo S, Tamura S, Nakajima T et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc 1996; 44(1): 8–14.
11. Kogure E, Kudo S, Tamegai Y et al. Is it possible to predict histopathological findings by magnifying colonoscopic „pit pattern diagnosis“? Gut 2003; 52(Suppl 6): A9.
12. Kudo S, Lambert R, Allen JI et al. Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointestinal Endoscopy 2008; 68(1): 11–12.
13. Quirke P, Risio M, Lambert R Quality assurance in pathology in colorectal cancer screening and diagnosis. In: Segnan N, Patnick J, von Karsa L. European guidelines for quality assurance in colorectal cancer screening and diagnosis. European Union 2010 : 206–232. ISBN 978–92–79–16435–4 (Printed version).
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktoryČlánek Význam lymfangiogenézy a ultraštruktúry lymfatických kapilár pri metastázovaní malígneho melanómuČlánek Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let?Článek Epidemiologie dyspepsie
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 7-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Jakou roli představuje péče o výživu ve smyslu malnutrice ve stáří? – editorial
- Celiakie u pacientů s diabetes mellitus 1. typu – editorial
- Diagnóza psaná klínovým písmem – editorial
- Diabetes mellitus u žen – editorial
- Vliv podávání tekutého mléčného nutričního doplňku se zvýšeným obsahem syrovátkových bílkovin na nutriční stav seniorů
- Celiakie u pacientů s diabetes mellitus 1. typu
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Genetika a farmakogenetika osteoporózy
- Význam lymfangiogenézy a ultraštruktúry lymfatických kapilár pri metastázovaní malígneho melanómu
- Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let?
- Specifika diabetes mellitus u žen
- Osteoporóza a metabolické kostní změny u celiakie v dospělosti
- Model vzdělávání sekundáře na Interní klinice FN Motol Praha Naše naše zkušenosti s lokálním projektem vzdělávání mladých lékařů v rámci jejich povinné postgraduální výuky
-
Zdeněk Mařatka a jeho podíl na založení České gastroenterologické společnosti a jejího časopisu.
Gastroenterologická společnost v Čechách a na Slovensku - Chirurgická léčba Crohnovy choroby
- Pokroky v diagnostice a léčbě nespecifických střevních zánětů
- Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
- Crohnova nemoc – genetické faktory z pohledu etiopatogeneze
- Etiologie a patogeneze idiopatických střevních zánětů
- Historie chirurgické léčby nespecifických zánětů střevních
- Epidemiologie dyspepsie
- Manažment pacientov s horným typom dyspepsie
- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Správa z XXXIII. dní mladých internistov
- Dostál P a kol. Základy umělé plicní ventilace.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Chirurgická léčba Crohnovy choroby
- Manažment pacientov s horným typom dyspepsie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



