-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
Extended options of anticoagulant treatment in thromboembolism
Thromboembolic disease (TD) is a relatively common disease with acute risk of death and potential long-term consequences in term of postthrombotic syndrome or chronic pulmonary hypertension. Anticoagulant therapy is the basic therapeutic procedure; thrombolytic therapy and the introduction cava filter are appropriately indicated for individual cases. In past few years, new direct oral anticoagulant drugs (NOAC) have occurred – Xa factor or thrombin inhibitors which have demonstrated the same efficacy and even higher safety in comparison to conventional treatment. In mid 2014, 3 drugs of this group are registered in Czech Republic – rivaroxaban (Xarelto®), dabigatran (Pradaxa®) and apixaban (Eliquis®). These drugs have comparable efficacy and safety but they differ in schedule of dose administration. Rivaroxaban and apixaban can be administered immediately after diagnosis of venous thrombosis or hemodynamically stable pulmonary embolism. LMWH application has to precede few days the administration of dabigatran. Limitation of new drugs is their price. Unavailability of antidotes is temporary because current researches continue to find one for dabigatran and another for both of xabans. Duration of anticoagulant treatment after acute phase depends on the presence of thrombosis risk factors and the individual bleeding risk. Minimal duration of anticoagulant therapy is 3 months, commonly 6–12 months and in high risk patients it is “long term” treatment. Good results of new anticoagulant drugs in trials in term of thromboembolism recurrence prevention may change established habits in TD patients with long term treatment.
Keywords:
anticoagulant therapy – apixaban – dabigatran – deep vein thrombosis – new direct oral anticoagulants – rivaroxaban
Autoři: Debora Karetová 1; Jan Bultas 2
Působiště autorů: II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha, přednosta prof. MUDr. Aleš Linhart, DrSc., FESC, FCMA 1; Farmakologický ústav 3. LF UK, Praha, přednosta prof. MUDr. Jan Bultas, CSc. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(11): 977-984
Kategorie: Přehledné referáty
Souhrn
Tromboembolická nemoc (TEN) je relativně častým onemocněním s akutním rizikem úmrtí a potenciálními dlouhodobými následky v podobě posttrombotického syndromu nebo chronické plicní hypertenze. Základním léčebným postupem zůstává antikoagulační léčba; trombolytická léčba a zavedení kaválního filtru jsou určeny pro vhodně indikované individuální stavy. V posledních letech se v léčbě TEN objevila nová přímá perorální antikoagulancia (NOAC) – inhibitory faktoru Xa nebo trombinu, která prokázala stejnou účinnost a lepší bezpečnost léčby ve srovnání s konvenčním postupem. V polovině roku 2014 jsou registrovány v České republice 3 z těchto léků – rivaroxaban (Xarelto®), dabigatran (Pradaxa®) a apixaban (Eliquis®). Mají srovnatelnou účinnost a bezpečnost, rozdílná jsou však schémata podávání. Rivaroxabanem a apixabanem lze léčit perorálně ihned od stanovení diagnózy žilní trombózy nebo hemodynamicky stabilní plicní embolie, dabigatranem po úvodní několikadenní aplikaci LMWH. Omezením nových léků je ekonomická náročnost léčby. Nedostupnost antidota je dočasná, vyvíjejí se jak pro dabigatran, tak pro oba xabany. Délka antikoagulační medikace po akutní fázi se odvíjí od přítomnosti řady faktorů vzniku trombózy, v kontextu individuálního rizika krvácení. Minimální délka antikoagulační léčby je 3 měsíce, častěji však léčíme 6–12 měsíců, u nejrizikovějších nemocných tzv. dlouhodobě. Dobré výsledky extenze antikoagulační medikace na zábranu rekurence TEN ve studiích s novými antikoagulancii mohou změnit zavedené zvyklosti dlouhodobé medikace nemocných s TEN.
Klíčová slova:
antikoagulační léčba – apixaban – dabigatran – hluboká žilní trombóza – nová přímá perorální antikoagulancia – rivaroxabanÚvod
Tromboembolická nemoc (TEN), do které řadíme hlubokou žilní trombózu (HŽT) a plicní embolii (PE), je 3. nejběžnějším kardiovaskulárním onemocněním. Nově do této skupiny onemocnění zařazujeme i některé formy povrchových tromboflebitid neboli trombóz povrchových žil, pokud mají vysoké riziko přechodu do hlubokého systému a postihují dlouhý úsek žíly.
Cílem léčby HŽT je zabránění progrese vzniklé trombózy, dislokace trombu (prevence úmrtí v souvislosti s plicní embolizací a prevence následků v podobě chronické tromboembolické plicní hypertense – CTEPH), dosažení maximální rekanalizace postižené žíly (prevence vzniku posttrombotického syndromu – PTS) a následně zábrana recidivy trombózy.
Sama plicní embolie je dosud potenciálně smrtelným onemocněním, až 15 % nemocných umírá v 1. měsíci. Chronická tromboembolická plicní hypertenze bývá invalidizujícím stavem, který se po plicní embolii vyvine u 0,1–4 % nemocných. Posttrombotický syndrom vzniká při nekompletní rekanalizaci obturovaných žil nebo vlivem destrukce jejich chlopní až u 50 % nemocných, přičemž u 5–10 % jde o formy vážné, hrozící vznikem bércového vředu.
Klíčovou léčebnou strategií TEN v akutní fázi je antitrombotická léčba (antikoagulační, vzácněji trombolytická); při její kontraindikaci přichází v úvahu léčba endovaskulární nebo chirurgická, případně je k zábraně vzniku plicní embolie volena implantace kaválního filtru.
Přehled léčebných možností hluboké žilní trombózy a stabilní plicní embolie
Intervence u akutní proximální žilní trombózy
V akutní i následné fázi léčíme naprostou většinu nemocných s TEN antikoagulancii, která jsou schopna účinně bránit růstu trombu a umožňují, aby endogenní aktivátor tkáňového plazminogenu trombus rozpustil. Následně pak antikoagulancia brání recidivám, které se objevují nejčastější v prvých měsících po akutní příhodě, a jejich riziko v čase klesá.
Intervenční metody léčby se opírají zejména o endovaskulární postupy, při nichž je katétrem zavedeným do popliteální žíly podávána trombolýza (lokální), případně je tento postup kombinován s metodami farmakomechanické disoluce trombu (např. jeho mechanickým rozrušením a následnou aspirací, obvykle po několikahodinové aplikaci trombolytika). Tato katétrem aplikovaná lokální trombolýza (CDT – Catheter Directed Thrombolysis) je určena pro nemocné splňující následující podmínky: jde o ilikofemorální lokalizaci trombózy u mladších pacientů, se symptomy choroby netrvajícími déle než 14 dnů, při nízkém riziku krvácení a dobrém celkovém stavu pacienta (bez chorob limitujících přežití a zejména bez přítomnosti kontraindikací podání trombolýzy). U nemocných, u nichž po reperfuzi dojde k odhalení stenózy ilické žíly (např. u May-Thurnerova syndromu, tedy v místě překřížení v. iliaca communis s pravou společnou ilickou tepnou), je prováděna balonková venoplastika, obvykle s implantací stentu [1]. Po úspěšné endovaskulární léčbě u ilikofemorálních trombóz je následně nižší frekvence výskytu posttrombotického syndromu oproti konzervativní léčbě. Chirurgická trombektomie je s rozvojem endovaskulárních metod používána vzácně. Stejně sporadicky, jako k chirurgické trombektomii, se sahá v léčbě TEN k implantaci kaválních filtrů. Zavedení dočasných, ev. permanentních filtrů je jednoznačně indikováno při kontraindikaci antikoagulační léčby u proximální trombózy. Další indikací může být recidiva tromboembolických příhod při lege artis vedené antikoagulační medikaci. Spornější je zavedení filtru u nestabilní plicní embolii (PE), zejména při snížené kardiopulmonální rezervě, nebo v přítomnosti masivní trombózy s přesahem do dolní duté žíly (vlající trombus). Optimální je odstranění filtru po ukončení antikoagulační dlouhodobé léčby, což však z řady důvodů nebývá vždy možné a filtry jsou pak naopak potenciálním zdrojem trombózy dolní duté žíly, zejména při nedostatečně účinné antikoagulační medikaci. Ta z tohoto důvodu má být zachována; případně pokud nemožnost její aplikace byla důvodem zavedení filtru, má k ní být přistoupeno následně, pomine-li kontraindikace [2]. Všechny intervenční metody léčby TEN jsou z výše uvedených důvodů stále vyhrazeny pro jednotlivé dobře indikované nemocné.
Konzervativní léčba akutní žilní trombózy (a stabilní plicní embolie) se zaměřením na nová perorální antikoagulancia
Většina nemocných s TEN je léčena antikoagulancii. Ve všech fázích léčby, zejména však v její extenzi, je nutno opakovaně vyhodnocovat přínos antikoagulační léčby a její potenciální riziko ve smyslu navození nejvážnější komplikace – krvácení. Platí, že naprostá většina nemocných z antikoagulační medikace po celou dobu léčby profituje. Navíc s novými léčebnými režimy se riziko krvácení významně snižuje, stejně tak je nižší rekurence příhod proti datům z dřívějška.
Léčba akutní fáze TEN
Léčba akutní fáze se v klasickém režimu opírá o heparin a jeho deriváty. Aplikace LMWH (low-molecular-weight heparin/nízkomolekulární heparin) je dosud nejběžnějším postupem. Pentasacharid fondaparinux není v ČR užíván (není dostupná terapeutická dávka přípravku Arixtra 7,5 mg) a jeho užití je rezervováno pro případy heparinem indukované trombocytopenie, u nichž musíme aplikovat 3 subkutánní injekce v síle 2,5 mg denně. Od roku 2012 je reálnou a již zavedenou možností léčby rivaroxaban; v polovině roku 2014 byl pro danou indikaci registrován i apixaban. Po iniciaci léčby LMWH můžeme také nově přejít na dabigatran.
„Klasická antikoagulační léčba heparinem“
Zatímco mezinárodní doporučení pro léčbu TEN, např. 9. vydání tzv. ACCP Guidelines [3], stále hovoří o intravenózní léčbě heparinem nebo dokonce o jeho subkutánním podávání, v České republice je již více než 10 let základní normou léčby v akutní fázi TEN aplikace některého z nízkomolekulárních heparinů (LMWH). Tato strategie je účinnější – doložen je jak pokles mortality o čtvrtinu, tak bezpečnější – pozorován je i téměř o polovinu menší výskyt krvácení. V této indikaci lze užít enoxaparin (Clexane), nadroparin (Fraxiparin), bemiparin (Zibor) a ev. dalteparin (Fragmin). Nefrakcionovaný heparin je rezervován pro nemocné s plicní embolií, u nichž nelze vyloučit nutnost eskalace léčby ve smyslu podání celkové trombolýzy. Nízkomolekulární hepariny jsou podávány pro vyšší komfort nemocných spíše 1krát denně (forte přípravky), byť existují práce, které říkají, že v léčbě je dávkování 2krát denně mírně bezpečnější a je méně časných rekurencí příhod [4]. Pro ověření účinnosti léčby LMWH existuje možnost monitorace antikoagulační aktivity stanovením aktivity antiXa. Toto vyšetření volíme ke stanovení optimální léčebné dávky při nedostatečné terapeutické odezvy, v léčbě těhotných nebo u nemocných v renální insuficienci, případně při hmotnosti pod 50 kg nebo nad 100 kg. Terapeutická hladina antiXa při léčbě TEN se pohybuje mezi 0,6 až 1,2 IU/ml antiXa (v prevenci 0,2–0,4 IU/ml antiXa). Důležité je přitom časování náběru, a sice odebrání krve 3–4 hod po aplikaci LMWH. Při poklesu clearence kreatininu pod 30 ml/min je nutno dávku LMWH redukovat na polovinu nebo prodloužit dávkovací interval na dvojnásobek.
Perorální antikoagulační léčba
V akutní fázi, tj. po iniciaci parenterální aplikace některého z heparinů, bylo standardním přístupem současné podávání warfarinu a vysazení heparinu teprve po vzestupu INR na terapeutickou hodnotu. Vzhledem k problémům s léčbou warfarinem je vítána možnost jiné perorální léčby. Dostupná je léčba přímými inhibitory faktoru Xa – rivaroxabanem či apixabanem, a také trombinovým inhibitorem dabigatranem po iniciaci léčby pomocí LMWH. Oba tyto léky řadíme mezi tzv. přímá perorální antikoagulancia, označovaná nejčastěji jako NOAC (New Oral AntiCoagulants, případně pro zachování zkratky i v době, kdy již nebude platit označení „nová“ s vysvětlením jako Non-vitamin K Oral AntiCoagulants). Lze se setkat i s případnější zkratkou – DOAC (Direct Oral AntiCoagulants).
Fáze dlouhodobé antikoagulační medikace a její případná extenze
Jako základní nutná doba léčby po akutní fázi jsou 3 měsíce. Délka antikoagulační léčby je dána poměrem benefitu dlouhodobé antikoagulační terapie (snížení recidivy TEN) a riziky této medikace. Při zvažování délky medikace má rozhodující význam – vedle faktorů vzniku a rozsahu tromboembolie – celkový stav nemocného. Ten je daný zejména množstvím komorbidit, které zásadně určují rizika léčby. Jistý vliv na rozhodování o délce léčby má i postoj nemocného k problému.
V současnosti – po splnění úvodní fáze 5–10denní léčby LMWH – léčíme dlouhodobě buď warfarinem, nebo od poloviny roku 2014 máme novou možnost – přechod na dabigatran, který má rovněž schváleno užití v léčbě TEN. U onkologických nemocných je po akutní fázi příhody ve většině případů výhodnější pokračovat v léčbě LMWH. Nemocné léčené od počátku rivaroxabanem či apixabanem léčíme samozřejmě již zavedenou léčbou takto i dlouhodobě.
Důležitá je délka antikoagulační léčby: základní délku, tedy 3 měsíce po akutní příhodě, volíme u nemocných s trombózou žíly nevelkého kalibru (např. lokalizovanou v oblasti bérce), případně u těch, u nichž k sekundární trombóze (neboli „provokované“) došlo vlivem situace, která již pominula, a jiný rizikový stav (trombofilní terén) není přítomen. Jde např. o stavy trombózy po operacích u jinak zdravých jedinců. U tranzitorně působících rizikových faktorů vzniku trombózy obecně podáváme antikoagulační medikaci kratší dobu než u forem idiopatických („neprovokovaných“), u nichž není zřejmá vyvolávající příčina vzniku trombózy. Délku antikoagulační léčby u těchto idiopatických forem prodlužujeme na 6–12 měsíců při proximální lokalizaci trombózy, stejně tak déle léčíme u větších plicních embolií, u recidiv příhod, při přítomnosti méně významných hereditárních trombofilií a zejména při jejich kombinacích (heterozygoti mutace koagulačního faktoru V nebo faktoru II, elevace faktoru VIII). Delší dobu antikoagulace volíme samozřejmě také u všech trombóz, u nichž spouštěcí faktor („trigger“) nadále přetrvává. K dlouhodobé (> 12 měsíců trvající léčbě) jsou dedikováni nemocní s vážnými trombofilními stavy, např. deficiencí antitrombinu, proteinu C a S, homozygoti leidenské mutace faktoru V nebo protrombinu, při pozitivitě antifosfolipidových protilátek, v přítomnosti opakovaných recidiv TEN nebo u případů s vážnými následky po proběhlé žilní tromboembolii, tedy u chronické tromboembolické plicní hypertenzi nebo těžších forem posttrombotického syndromu [5]. I při důvodné prolongaci antikoagulační léčby je však minimálně jednou ročně nutné vyhodnotit rizika krvácení a kvalitu života nemocného léčeného antikoagulancii.
Rizikové faktory rekurence žilního tromboembolizmu:
- idiopatický vznik (příčina vzniku tromboembolické příhody nezjištěna)
- trombofilní stav – hereditární nebo získaný
- rozsah původní žilní trombózy – proximální formy
- vyšší věk
- mužské pohlaví
- onkologické onemocnění v aktivní fázi
- reziduální trombotické masy po léčbě (dle duplexní ultrasonografie)
- přetrvávající elevace D-dimerů stanovených 1 měsíc po ukončení antikoagulační léčby
Nová přímá perorální antikoagulancia v léčbě TEN
Je zřejmé, že nová perorální antikoagulancia byla registrována s cílem nahradit účinný, ale z pohledu problematických farmakokinetických i farmakodynamických vlastností nevýhodný warfarin. Jeho hlavní nevýhodou je zejména variabilní léčebná odezva jak mezi jedinci, tak v průběhu léčby u daného nemocného. Při ovlivnění tak významného reparačního pochodu, kterým je hemokoagulace, a v kontextu úzkého terapeutického okna, je nestandardní chování warfarinu velkým handicapem. Kolísání účinku warfarinu je způsobeno jednak interindividuální variabilitou efektu na podkladě genetické výbavy (ovlivňující rozdílnou citlivost cílového enzymu – vitamin K reduktázy – k inhibici warfarinem a variabilní aktivitou izoenzymu CYP2C9, který warfarin degraduje). Nevýhodná je také intraindividuální variabilita efektu na podkladě řady lékových a potravinových interakcí. Klinický význam má též skutečnost, že v prvých dnech léčby je paradoxně navozen prokoagulační efekt: hladina antikoagulačních proteinů C a S totiž klesá rychleji než hladina faktorů prokoagulačních. Z variabilní antikoagulační aktivity při léčbě warfarinem, při níž relativně často přestřelujeme nad terapeutické okno, vyplývá vysoké riziko krvácení, větší než riziko při stabilnější hladině při podávání NOAC.
Výhodou nových léků je přímá (bez nutnosti spolupůsobení antitrombinu) a víceméně selektivní inhibice daného koagulačního faktoru (faktoru Xa u xabanů a faktoru IIa u gatranů), perorální forma aplikace, menší variabilita účinku umožňující u rozhodující většiny populace podávání bez nutnosti monitorace krevními testy. Účinnost a bezpečnost NOAC v léčbě žilní trombózy (a stabilní plicní embolie) byla prokázána v rozsáhlých studiích 3. fáze klinického hodnocení na tisícových souborech. Způsob dávkování jednotlivých nových léků a léčebné schéma se řídí tím, jak byly užity v těchto mezinárodních studiích léčby HŽT a PE – zda šlo o zahájení léčby přímo novým antikoagulanciem (v případě rivaroxabanu či apixabanu), nebo zda iniciálně byla vložena fáze podání enoxaparinu, po níž se teprve přecházelo na testovaný lék (dabigatran či edoxaban).
Všechny studie prokázaly non-inferioritu proti standardní medikaci (enoxaparin + warfarin), při velmi dobrém – superiorním – bezpečnostním profilu.
Studie s novými perorálními antikoagulancii – nepřímá srovnání
V akutní léčbě žilního tromboembolizmu byla hodnocena 4 nová antikoagulancia (kromě výše uvedených ještě edoxaban), přičemž byla porovnávána se standardní medikací enoxaparin/warfarin (u rivaroxabanu či apixabanu) nebo po ukončení fáze podání LMWH s warfarinem (dabigatran a edoxaban). Všechny tyto léky, kromě edoxabanu, byly v rámci prodloužení následné léčby testovány i proti placebu. Léčba byla tedy prolongována na období, v němž základní lege artis fáze antikoagulační medikace mohla být ukončena. Vedle placeba byl dabigatran porovnáván v rámci „extenze“ i s warfarinem.
V léčbě TEN tedy stojíme nově před otázkou, kterého pacienta léčit warfarinem a kterému podat rivaroxaban, apixaban nebo dabigatran. Užití edoxabanu není ještě schváleno. Jde o otázku složitou, na kterou nemáme, a pravděpodobně ani v budoucnosti nedostaneme odpověď přímým porovnáním těchto léků. Proto musíme vyjít z porovnání farmakologických vlastností jednotlivých molekul, výsledků studií s nimi a na základě těchto hledisek hledat optimální přípravek pro daného jedince (tab. 1).
Tab. 1. Porovnání farmakologických vlastností warfarinu a jednotlivých NOAC 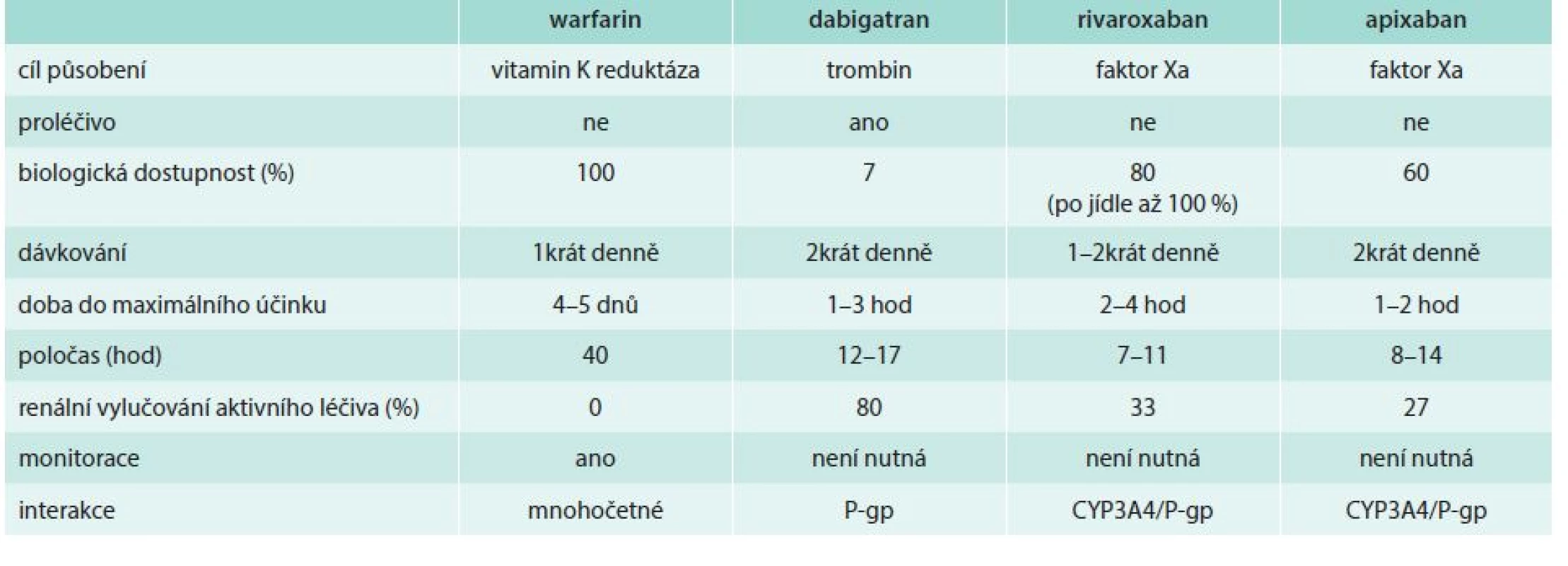
Srovnání farmakologických vlastností perorálních antikoagulancií
Zatímco warfarin inhibuje řadu koagulačních faktorů (II, VII, IX a X) i antikoagulačních faktorů (proteinu C a S), jejichž funkce je závislá na aktivní formě vitaminu K, nová antikoagulancia inhibují vždy jediný koagulační faktor. Na rozdíl od warfarinu nastupuje efekt za 30–60 min a maximální koncentrace dosahují 1–3 hod po požití a jejich poločas se pohybuje kolem 6–14 hod. Zatímco warfarin je eliminován především extrarenálně, NOAC jsou vylučovány v různé míře též ledvinami, pouze u dabigatranu je renální eliminace rozhodující. Biologická dostupnost všech nových přímých antikoagulancií je ovlivněna na úrovni enterocytu eliminační pumpou – glykoproteinem P (P-gp) a u rivaroxabanu a apixabanu též oxidázou CYP3A4. Induktory a inhibitory těchto metabolických a transportních systémů proto ovlivňují dostupnost těchto molekul. Lékové interakce tedy existují, ale jsou proti warfarinu nečetné a méně významné. Zásadní rozdíly v riziku interakcí mezi jednotlivými NOAC nejsou. Dieta nemá vliv na biologickou dostupnost, pouze u rivaroxabanu se doporučuje užívání s jídlem k maximalizaci vstřebání léku.
Přímá antikoagulancia jako skupina mají výhodu mnohem lépe předpověditelného účinku v porovnání s warfarinem, proto jsou podávána ve fixních dávkách bez nutnosti monitorace. Antidotem působení warfarinu je vitamin K, nicméně jeho efekt nastupuje pozvolna a následná normalizace testu INR není okamžitá a trvá až 24 hod. Specifická antidota pro NOAC nejsou zatím dostupná, ale pro xabany je v poslední fázi hodnocení analog faktoru Xa – andexanet α – a u dabigatranu antidotum na bázi protilátky – idarucizumab. K reverzi jejich účinku je nyní v urgentních stavech možno použít koncentráty koagulačních faktorů (Prothromplex, Beriplex, Feiba aj), kromě ostatních zavedených technik stavění krvácení.
Shrneme-li vlastnosti všech antikoagulancií, pak rozhodující je rozdíl v rychlosti nástupu účinku – rychlý a srovnatelný u NOAC, délka účinku – výrazně delší u warfarinu, srovnatelná u NOAC, variabilita efektu – výrazně větší u warfarinu, srovnatelná u NOAC, renální eliminace – vysoká a rozhodující u dabigatranu, nízká u rivaroxabanu, apixabanu a edoxabanu a zanedbatelná u warfarinu. Farmakogenetická výbava výrazně ovlivňuje expozici warfarinu, málo u NOAC. Lékové interakce se tak zásadně uplatní v případě warfarinu, u xabanů a gatranů – díky zpravidla duální inhibici či aktivaci (na úrovni CYP3A4 a P-gp) – má význam pouze interakce se silnými a částečně i se středními induktory a inhibitory obou systémů, zásadní rozdíly uvnitř této skupiny nejsou.
Porovnání designu jednotlivých studií s NOAC v základních studiích léčby akutní TEN
Všechny 4 nové molekuly byly testovány obdobně, tedy proti standardní léčbě kombinací enoxaparinu s warfarinem. Šlo o studie RE-COVER I a II (dabigatran), EINSTEIN-DVT a PE (rivaroxaban), AMPLIFY (apixaban) a Hokusai-VTE (edoxaban) [6–12].
Kromě studií Einstein, v níž po randomizaci byli nemocní vedeni v otevřené léčbě, byly ostatní studie dvojitě zaslepeny. Měly shodné primární cíle účinku – snížení rekurence trombotických a tromboembolických příhod, stejně tak cíle zjišťující bezpečnost, které se opíraly o vyhodnocení počtu a typu krvácení v jednotlivých větvích.
Dávkovací schémata v akutní léčbě TEN u rivaroxabanu a apixabanu (vyšší dávka zpočátku a následný sestup na běžnou – „chronickou dávku“) se opírala o data ze studií 2. fáze. U dabigatranu a edoxabanu byly dávkovací režimy převzaty ze studií 2. fáze u fibrilace síní, a proto v léčbě žilní TEN byla akutní fáze řešena podáním LMWH.
Lišila se i doba „povinné“ antikoagulační léčby v jednotlivých studiích: ve studiích RE-COVER a AMPLIFY byla fixována na 6 měsíců, na rozdíl od flexibilní možnosti léčby (po 3, 6 nebo 12 měsíců) ve studiích EINSTEIN a Hokusai-VTE. Studie s edoxabanem jako jediná, bez ohledu na dobu léčby, posléze všechny nemocné analyzovala po 12 měsících od akutní příhody.
Aby bylo možno říci, zda je léčba účinná i pro nemocné s plicní embolií (se současnou trombózou končetiny nebo i bez jejího průkazu), byla ve studiích RE-COVER, AMPLIFY a Hokusai-DVT povinnost zařazení alespoň 30 % nemocných s PE. Na rozdíl od tohoto modelu byl rivaroxaban u nemocných s PE testován ve zvláštní studii. Do studií pochopitelně nebyli zařazeni nemocní s hemodynamicky instabilní PE, kteří mohli být kandidáty trombolytické léčby. Určitou nevýhodou byla malá prevalence nemocných s pokročilou renální nedostatečností nebo nad 75 let věku (tab. 2).
Tab. 2. Porovnání uspořádání jednotlivých studií léčby akutní TEN s novými antikoagulancii a základní charakteristiky nemocných 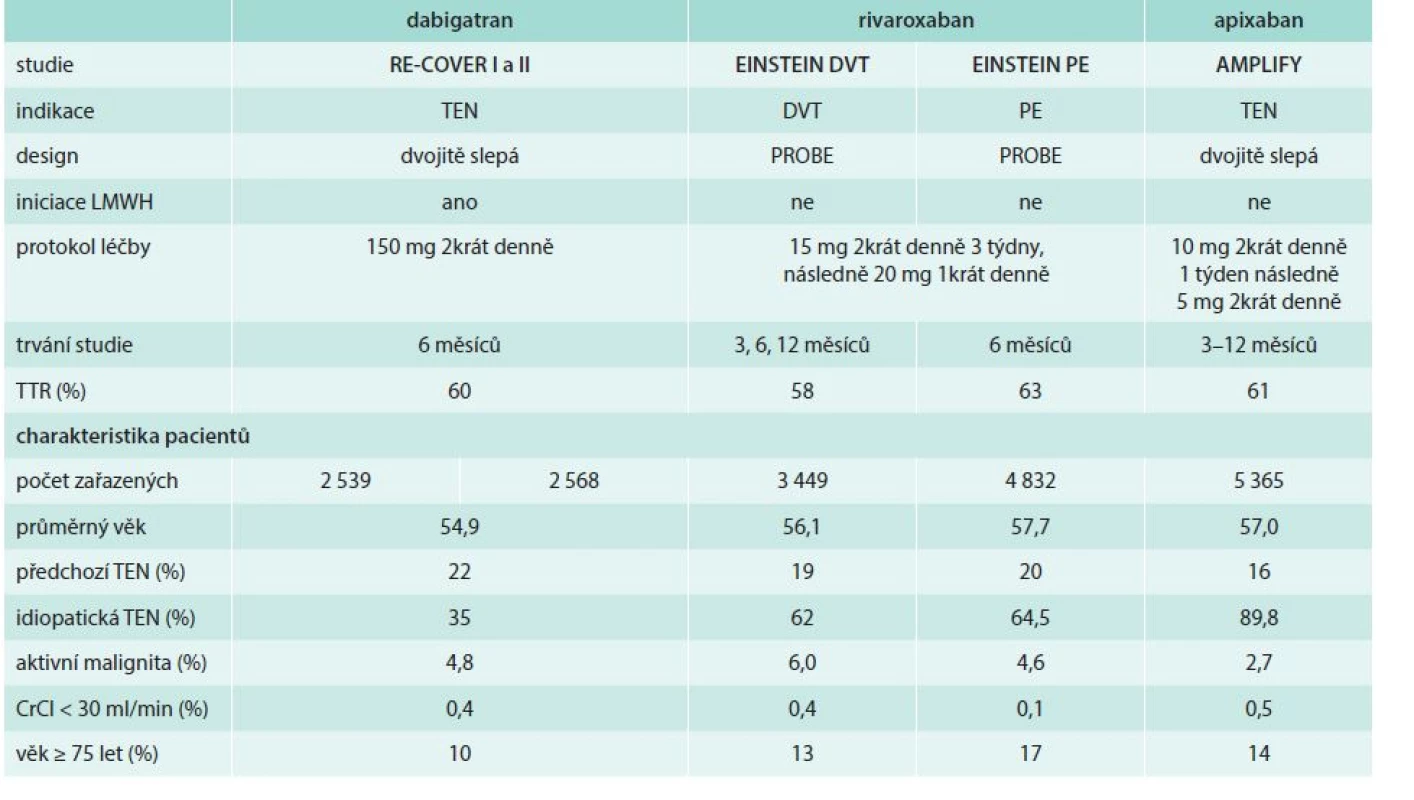
TEN – tromboembolická nemoc DVT – hluboká žilní trombóza PE – plicní embolie PROBE – prospektivní, randomizovaná, otevřená studie, se zaslepeným vyhodnocením cílových ukazatelů (endpointů) TTR – time in target range/procento stanovení INR v cílovém rozmezí 2–3 Porovnání designu jednotlivých studií s NOAC v extenzi léčby
Rivaroxaban, apixaban a dabigatran byly ve studiích EINSTEIN-Extension, AMPLIFY-Extension a RE-SONATE ve dvojitě slepém uspořádání porovnány s placebem. V dabigatranové studii RE-SONATE trvala léčba 6–18 měsíců, zatímco na rivaroxabanu a apixabanu dobu kratší (6–12 měsíců). Rivaroxaban a dabigatran byly podávány v jedné dávce (20 mg denně resp. 150 mg 2krát denně); apixaban měl možnost dávkování buď 5 mg 2krát denně nebo 2,5 mg 2krát denně. Statistická konfigurace byla směřována k průkazu superiority aktivní léčby a hlavním sledovaným ukazatelem byla rekurence TEN. Jediný dabigatran byl v léčebné extenzi (studie RE-MEDY) navíc porovnán s warfarinem. Doba léčby byla 3–12 měsíců (tab. 3) [13–15].
Tab. 3. Porovnání uspořádání jednotlivých studií extenze antikoagulační léčby TEN s novými antikoagulancii, hlavní výsledky (snížení rekurence) 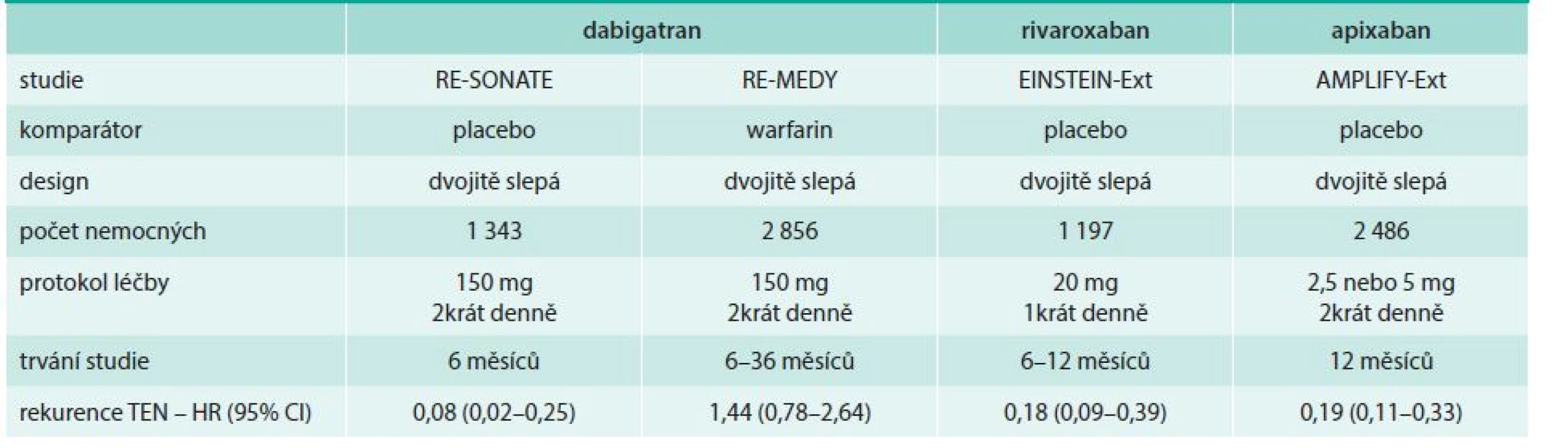
HR – hazzard ratio/poměr rizik CI – konfidenční interval Porovnání výsledků jednotlivých studií s NOAC
Ve všech studiích s NOAC v akutní a subakutní fázi TEN byla prokázána noninferiorita účinnosti proti konvenční léčbě. Současně prakticky u všech molekul byla prokázána vyšší bezpečnost ve smyslu snížení rizika velkých krvácení nebo součtu velkých nebo klinicky významných krvácení.
Kromě redukce rizika vzniku krvácení je u skupiny všech nových antikoagulancií nepochybný větší komfort léčby, ať již v omezení aplikace parenterální léčby LMWH na počátku léčby (u rivaroxabanu a apixabanu), nebo jednoduchého dávkování po iniciální léčbě LMWH (u dabigatranu a edoxabanu). Ve všech případech byla eliminována nutnost docházení na krevní testy.
Jediná studie s edoxabanem se věnovala vyhodnocení rozsahu resp. dopadu PE na funkci pravé komory. Ve větvi s prokázanou dilatací pravé komory pomocí CT nebo její dysfunkcí určenou na základě zvýšení BNP (brain natriuretic peptide) byl edoxaban lepší než warfarin, přičemž mortalita v obou větvích (s normální funkcí nebo dysfunkcí PK) se nelišila.
Ve studiích prolongované léčby (extenze) dabigatran, rivaroxaban i apixaban významně bránily rekurenci TEN proti placebu a současně tato léčba měla nízké procento velkých krvácení. Dabigatran byl v porovnání s warfarinem v extenzi medikace noninferiorní.
Jako limitaci všech studií lze shodně uvést, že nebylo zařazeno dostatek mladších a naopak starých nemocných, průměrný věk se ve studiích pohyboval mezi 54 a 58 roky. Ve všech studiích také pouze malé procento (< 10 %) zařazených reprezentovalo nemocné s renální dysfunkcí (tab. 4) [16].
Tab. 4. Ukazatele účinnosti a bezpečnosti jednotlivých NOAC v indikaci léčby TEN/redukce rizika RR (95% CI) 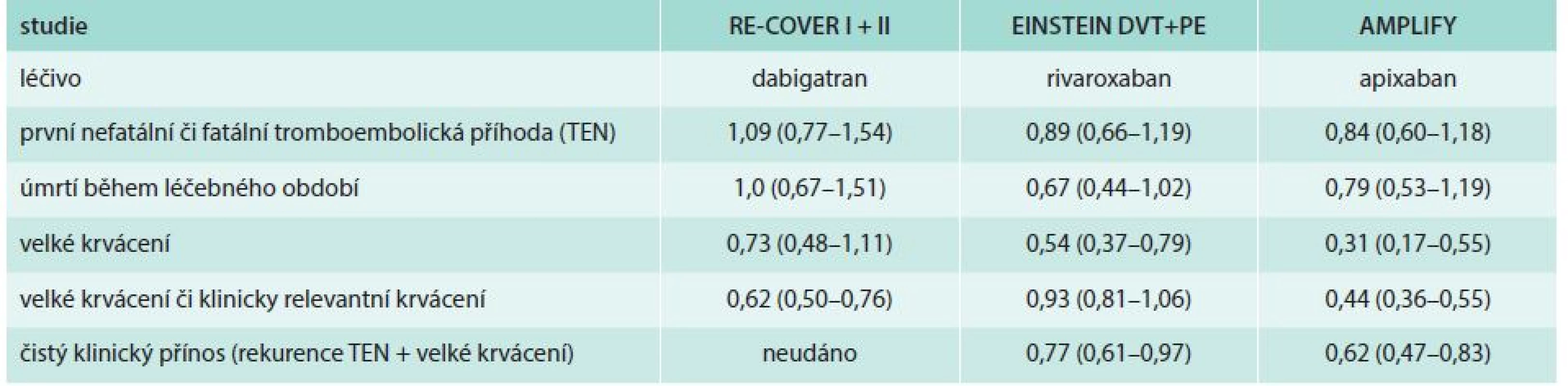
Kterému nemocnému s žilním tromboembolizmem podat které antikoagulans?
Tuto úvahu lze zahájit eliminací těch nemocných, kteří k léčbě novými perorálními antikoagulancii vhodní nejsou. Jde zejména o nemocné s masivními trombózami a rozsáhlými, oběhově deteriorujícími plicními emboliemi, kteří vyžadují trombolytickou léčbu. Ani bezprostřední navázání léčby NOAC po podané trombolýze není prověřeným postupem, tyto nemocné nelze k léčbě novými antikoagulancii indikovat. Stejně tak vyloučíme nemocné, u nichž je zásadně vyšší riziko krvácení v době akutního stavu (např. trombózy po operacích, porodech apod). Stále platí, že tyto nemocné lze bezpečněji léčit nitrožilně podaným nefrakcionovaným heparinem, jehož výhodou je možnost rychlé reverze případného krvácení protaminem. Další skupinou, která není pro léčbu NOAC vhodná, jsou nemocní s pokročilou renální nebo hepatální insuficiencí. Rivaroxaban a apixaban jsou kontraindikovány u nemocných s clearance kreatininu < 15 ml/min, velká opatrnost a redukce dávky je na místě při ClCr < 30 ml/min. Dabigatran je kontraindikován již při poklesu ClCr < 30 ml/min. Léčba NOAC u nemocných s nádory je sice možná, ale zkušenosti s ní jsou omezené. Ve studiích s NOAC bylo zařazeno vždy pouze malé procento onkologických nemocných. Předchozí data u nemocných s aktivními nádory svědčí pro výhodnější léčbu LMWH jak v akutní fázi, tak v následných měsících. Stejně tak u nemocných, u nichž je pochybnost o dostatečné komplianci s antikoagulační léčbou, je otázkou, zda předepsat dražší NOAC, aniž jsme schopni užívání kontrolovat. Nová antikoagulancia nebyla podávána těhotným, kojícím ani dětem. Nemáme dostatečný průkaz účinku NOAC u těžkých hereditárních trombofilií, jakými je např. antifosfolipidový syndrom nebo deficience antikoagulačně působících proteinů.
Pokud tedy není pacient ve výše uvedených kategoriích, máme několik možností jak postupovat. Lékaři, kteří jsou do jisté míry konzervativní a léty prověřené podávání nízkomolekulárního heparinu v akutní fázi preferují, nemusejí své zvyklosti měnit a pouze po 5–10denní úvodní parenterální aplikaci některého z LMWH pokračují podáváním dabigatranu v dávkách 2krát 150 mg nebo 2krát 110 mg (dle rizika krvácení a funkčního stavu ledvin, dle věku). Tento postup je možný jak v začátku za hospitalizace a po propuštění, nebo trvale ambulantně. Jinou možností je cesta podávání jediného perorálního léku – rivaroxabanu či apixabanu – ihned po stanovení diagnózy TEN. I u nemocných léčených některým z nových antikoagulancií je nutné kontrolovat odezvu na léčbu a důkladně vysvětlit rizika s danou diagnózou a léčbou spojená. Pacient by se totiž do jisté míry mohl mylně domnívat, že choroba není významná, je-li léčena ambulantně a pouze perorálními léky. Musíme dbát i na dodržení vyššího dávkování v začátku léčby, u rivaroxabanu je předepsáno na 3 týdny, u apixabanu je nutná vyšší dávka v prvém týdnu. Xabany obecně jsou dobrou volbou pro starší nemocné, u nichž je často přítomno omezení funkce ledvin, a docházení ke kontrolám INR je obtížné.
I léčba NOAC může být spojena se vznikem krvácení, i když v menší míře než při léčbě warfarinem. Na to musí být nemocný upozorněn, aby věděl v případě epistaxe, hematurie nebo krvácení z gastrointestinálního traktu jak si počínat. Gastrointestinální krvácení u všech NOAC, kromě apixabanu, převyšovalo překvapivě krvácení po warfarinu, zpětně vyhodnoceno šlo většinou o projev nádorové infiltrace ve sliznici. Celkem vzato, jde vlastně o do jisté míry pozitivní jev umožňující včasnější odhalení nádoru. Lékař musí při medikaci NOAC evidovat i léčbu několika málo léky, které mohou měnit jejich účinné hladiny, jako jsou induktory či inhibitory oxidázy CYP3A4 či transportéru P-gp.
Podávání antikoagulancia s myšlenkou prevence recidivy déle, než jsme dosud byli navyklí při užití warfarinu, je nutno vždy individuálně posoudit. Zvažujeme riziko recidivy i krvácení jedince. Tato otázka bude aktuálnější v budoucnosti, až bude léčba ekonomicky méně náročná. Výsledky extenze léčby s NOAC v porovnání s placebem daly nepochybně vynikající výsledky ve snížení rizika recidivy TEN, které jsou rozhodně významnější proti snížení rizika recidivy ve studiích s acetylsalicylovou kyselinou [17]. Obdobný parametr, tedy snížení rizika recidivy po ukončení zvyklé doby antikoagulační léčby, řešila studie SURVET se sulodexidem, jejíž výsledky ale nebyly ještě publikovány.
Pokud bychom měli zmínit také nevýhody nových perorálních antikoagulancií, pak je to v současnosti nedostupnost antidota (ale krátký poločas dává možnost rychlejšího odeznění efektu proti warfarinu), riziko většího dopadu na účinnost léčby při vynechání dávky a nemožnost jednoduchého ověření kompliance s léčbou (v akutní fázi stonání lze předpokládat dobrou disciplínu užívání u většiny nemocných, problém může nastat v následné fázi). Zásadní nevýhodou je samozřejmě i významně vyšší cena přípravků ve srovnání s warfarinem.
Lze říci, které antikoagulansje výhodnější, pro kterého pacienta v léčbě žilní trombózy? Jistě ne absolutně. Vodítkem může být rozsah trombózy nebo plicní embolie, tedy situace, v níž lékař současně spoléhá na své zkušenosti s iniciálním podáním nízkomolekulárního heparinu a na nové antikoagulans přejde po této fázi, nebo naopak se neobává minout fázi heparinizace a jde pohodlnější cestou perorální léčby od začátku, což podporuje možnost ambulantní léčby [18].
Závěr
Možnosti konzervativní léčby hluboké žilní trombózy (a stabilní plicní embolie) se v posledních 2 letech rozšířily a na základě výsledků klinických studií jsou registrovány nové léky pro tuto indikaci. Zejména užití tzv. nových přímých perorálních antikoagulancií se v praxi rozšiřuje. Zatím je možno konstatovat, že nejsou ve srovnání se zavedenou konvenční léčbou, spočívající v překryvném režimu podávání nízkomolekulárního heparinu a warfarinu, určitě horší ve smyslu recidivy příhod, přičemž jejich bezpečnostní profil je lepší. Zatím u těchto přípravků nemáme dostatek dat v léčbě onkologických nemocných, stejně tak u těžce obézních, velmi starých nemocných, nebo při pokročilé renální nedostatečnosti, protože těchto nemocných bylo do studií s NOAC zařazeno relativně málo. Neznáme zatím také vliv této nové léčby na míru rekanalizace žilního systému.
Léčba novými přímými antikoagulancii se však jistě bude rozšiřovat. Někteří lékaři budou preferovat monoterapii jedním přípravkem, výhodnou zejména u ambulantních nemocných, jiní budou, zejména u těžších nemocných vyžadujících hospitalizaci, preferovat iniciální aplikaci heparinu s následným přechodem na nový přípravek (tab. 5).
Tab. 5. Režim léčby a dávkování všech nových perorálních antikoagulancií v indikaci léčby žilní trombózy (a plicní embolie), v ČR schválen v roce 2014 rivaroxaban, dabigatran a apixaban 
Podpořeno Prvouk-P35/LF1/5.
doc. MUDr. Debora Karetová, CSc.
dkare@lf1.cuni.cz
II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 30. 9. 2014
Přijato po recenzi 14. 10. 2014
Zdroje
1. Fahrni J, Engelberger P, Kucher N et al. Catheter-based treatment of ilio-femoral deep vein thrombosis – an update on current evidence. Vasa 2013; 42(3): 161–167.
2. Čížek V, Kučera D, Válka M. Kavální filtry. Postgraduální medicína 2010; 12(1): 83–89.
3. Kearon C et al. Antithrombotic Therapy for VTE Disease: Antithrombotic Therapy and Prevention of Thrombosis. 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST 2012; 141(2 Suppl): e419S-e494S.
4. Van Dongen CJ, MacGillavry MR, Prins MH. Once vs twice daily LMWH for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev 2005; (3): CD003074.
5. Goldhaber SZ, Piazza G. Optimal duration of anticoagulation after venous thromboembolism. Circulation 2011; 123(6): 664–667.
6. Schulman S, Kakkar AK, Goldhaber SZ et al. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. Circulation 2014; 129(7): 764–772.
7. Schulman S, Kearon C, Kakkar AK et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009; 361(24): 2342–2352.
8. Bauersachs R, Berkowitz SD, Brenner B et al. EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med. 2010; 363(26): 2499–2510.
9. Büller HR, Prins MH, Lensin AW et al. EINSTEIN-PE Investigators. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012; 366(14):1287–1297.
10. Prins MH, Lensing AW, Bauersachs R et al. EINSTEIN Investigators. Oral rivaroxaban versus standard therapy for the treatment of symptomatic venous thromboembolism: a pooled analysis of the EINSTEIN-DVT and PE randomized studies. Thromb J 2013; 11(1): 21. Dostupné z DOI: <http://doi: 10.1186/1477–9560–11–21>.
11. Agnelli G, Buller HR, Cohen A et al. AMPLIFY Investigators. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med 2013; 369(9): 799–808.
12. Hokusai-VTE Investigators. Büller HR, Décousus H, Grosso MA et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013; 369(15): 1406–1415.
13. Schulman S, Kearon C, Kakkar AK et al. RE-MEDY Trial Investigators. RE-SONATE Trial Investigators. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med. 2013; 368(8): 709–718.
14. Schulman S. RE-MEDY; RE-SONATE Trial Investigators. Extended anticoagulation in venous thromboembolism. N Engl J Med. 2013; 368(24): 2329. Dostupné z DOI: <http://doi: 10.1056/NEJMc1304815>.
15. Agnelli G, Buller HR, Cohen A et al. AMPLIFY-EXT Investigators. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013; 368(8): 699–708.
16. Fox BD, Kahn SR, Langleben D et al. Efficacy and safety of novel oral anticoagulants for treatment of acute venous thromboembolism: direct and adjusted indirect meta-analysis of randomised controlled trials. BMJ 2012; 345: e7498. Dostupné z DOI: <http://doi: 10.1136/bmj.e7498>.
17. Becattini C, Agnelli G, Schenone A et al. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012; 366(21): 19591967.
18. Nicolaides A, Fareed J, Kakkar AJ et al.: Prevention and treatment of venous thromboembolism: international consensus statement (guidelines according to scientific evidence). Clin Appl Thromb Hemost 2013; 19(2): 116–118.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Účinnost a bezpečnost inzulinu lispro u obézních pacientů s diabetes mellitus 2. typu: retrospektivní metaanalýza sedmi randomizovaných kontrolovaných studií
- Pražské evropské dny interní medicíny 2014
-
Vrbíková J, Fanta M, Koryntová D. Syndrom polycystických ovarií.
Průvodce ošetřujícího lékaře. - Za profesorem Zdeňkem Plachetou
-
Úvodní slovo předsedy České internistické společnosti J. E. Purkyně profesora MUDr. Richarda Češky, CSc., FACP, FEFIM
Interna a ateroskleróza: Více rozdílů nebo pojítek? -
K preventivní medicíně musí lékař dozrát
Rozhovor s prof. MUDr. Hanou Rosolovou, DrSc. - Empagliflozin: další z tichých revolucionářů – editorial
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Prevence kardiovaskulárních onemocnění v běžné klinické praxi: lze dosáhnout zlepšení?
- Markery reziduálního kardiovaskulárního rizika
- Nové pohledy na hormonální substituční terapii
- Novinky v oblasti hypolipidemické léčby
- Nefarmakologická léčba – výsledky z Poděbrad
-
Familiární hypercholesterolemie včera a dnes.
Vlastní zkušenosti a nálezy u našeho souboru nemocných s familiární hypercholesterolemií - LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
- Co mají společného žilní a tepenná onemocnění?
- Kardiovaskulární rizikový profil u 40letých mužů a 50letých žen v České republice: výsledky průřezové studie
-
Adherence pacientů s diabetem 2. typu k aplikaci inzulinových analog: vynechávání, časový posun a snižování dávek
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) v České republice
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nové pohledy na hormonální substituční terapii
- LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



