-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Účinky GLP-1 (glucagon‑like peptide 1) na játra
Effects of GLP-1 (glucagon‑like peptide ‑ 1) on liver
Effects of glucagon‑like peptide 1 (GLP‑1) on liver cells are very intensively studied. In the metabolism of saccharides GLP‑1 stimulates synthesis of glycogen and reduces glucose production – thus acting like insulin. In the lipid metabolism it enhances fatty acid oxidation and lipid transport from hepatocytes while reducing de novo lipogenesis – effects more similar to glucagon action. Some studies suggest beneficial effects of GLP‑1 on oxidative stress, endoplasmic reticulum stress, production of inflammatory mediators and dysfunction of biliary secretion. Current results suggest that drugs affecting incretin system could be used in the treatment of certain liver diseases (e.g. NAFLD and NASH) in the future. In the following article we mention the known effects of GLP ‑ 1 on liver functions and liver metabolism and we point out its possible future therapeutic use in the treatment of liver diseases.
Key words:
glucagon‑like peptide 1 – incretins – liver – non‑alcoholic fatty liver disease – fatty liver – metabolism of saccharides – metabolism of lipids
Autoři: J. Fontana 1; Z. Červinková 2; M. Anděl 1
Působiště autorů: Centrum pro výzkum diabetu, metabolizmu a výživy 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, vedoucí centra prof. MU Dr. Michal Anděl, CSc. 1; Ústav fyziologie Lékařské fakulty UK v Hradci Králové, přednostka prof. MU Dr. Zuzana Červinková, CSc. 2
Vyšlo v časopise: Vnitř Lék 2013; 59(7): 551-558
Kategorie: 80. narozeniny prof. MUDr. Marie Brodanové, DrSc.
Souhrn
Problematika vztahu glucagon‑like peptide 1 (GLP‑1) k jaterním buňkám je velmi intenzivně studována. V rámci metabolizmu sacharidů stimuluje GLP‑1 tvorbu glykogenu a snižuje novotvorbu glukózy – působí tedy podobně jako inzulin. V oblasti metabolizmu lipidů se popisuje posílení oxidace mastných kyselin a odsunu lipidů z hepatocytů při souběžném snížení de novo lipogeneze – účinky více připomínající vliv glukagonu. Některé práce naznačují příznivý vliv GLP‑1 na oxidační stres, stres endoplazmatického retikula, produkci zánětlivých mediátorů či na dysfunkci biliární sekrece. Dosavadní výsledky napovídají, že léčiva ovlivňující inkretinový systém by v budoucnu mohla být využita v léčbě některých jaterních onemocnění, jako jsou např. NAFLD či NASH. V následujícím přehledu zmíníme dosud známé účinky GLP‑1 na jaterní funkce a jaterní metabolizmus a poukážeme na jeho možné budoucí terapeutické využití při léčbě jaterních onemocnění.
Klíčová slova:
glucagon‑like peptide 1 – inkretiny – játra – non‑alcoholic fatty liver disease – jaterní steatóza – metabolizmus sacharidů – metabolizmus lipidůÚvod
Původní představa z konce 19. století o tom, že pankreatická sekrece je regulována jen nervově, byla zásadně změněna Baylissem a Starlingem již v roce 1902. Ti zjistili, že podání kyselého roztoku do gastrointestinálního traktu stimuluje pankreatickou sekreci i při přerušení inervace žaludku a střeva. Starling v roce 1905 zavedl pojem hormon a nejprve ho použil pro sekretin [1]. Poměrně brzy poté, v roce 1906, již byly podávány střevní extrakty mladým diabetikům s cílem ovlivnit jejich chorobu. V roce 1889 totiž Minkovski a Mehring vyvolali diabetes u psa po pankreatektomii. Od té doby bylo jasné, že diabetes se slinivkou souvisí.
La Barré [2] pojmenoval jako inkretin zatím nepřesně definovaný hormon, který vedl k hypoglykemii a který byl extrahovaný ze sliznice tenkého střeva. Již La Barré se domníval, že by tento hormon mohl představovat prostředek pro léčbu diabetu. Počátkem 40. let minulého století však byla Loewem existence inkretinů zpochybněna a další výzkum byl prováděn až po 30 letech. V roce 1970 byl Brownem izolován GIP (původně gastrický inhibiční polypeptid, přejmenovaný později na glukóza dependentní inzulinotropní peptid) [3]. Bell et al [4,5] klonovali proglukagonový gen a posléze nalezli sekvenci lidského proglukagonu. Sekvence GLP‑1 (7 - 36) má schopnost být rapidním sekretagogem inzulinu. Má však poločas v plazmě jen 1 – 2 min, protože je inaktivována pomocí dipeptidylpeptidázy ‑ 4 (DPP4) na neaktivní GLP‑1 (9 - 36).
V roce 1964 popsali nezávisle McIntyre et al [6] a Elrick et al [7] překvapivý nález vyššího vzestupu plazmatické hladiny inzulinu po perorálním než po intravenózním podání glukózy. Tento rozdíl byl nazván inkretinovým účinkem [8]. Tentýž jev podrobněji kvantifikoval Nauck z Creutzfeldovy skupiny [9]. Rok poté Kreymann et al [10] popsali, že glucagon‑like peptide 1 (GLP‑1) je lidským inkretinem. Snížená odpověď GLP‑1 na perorální glukózový podnět u diabetiků 2. typu byla publikována současně [11]. Konečně v roce 1998 byla stejnými autory popsána normalizace glykemie u diabetiků 2. typu po podání GLP‑1 [12].
Právě stimulace sekrece inzulinu cestou inkretinů, především pak GLP‑1, je zodpovědná za I. fázi stimulované postprandiální sekrece inzulinu. Dochází k ní podstatně dříve, než se k ostrůvkům mohou dostat vstřebané živiny, dle současných poznatků zodpovědné za II. fázi stimulované inzulinové sekrece. Účinek inkretinů trvá patrně tak dlouho, jak dlouho je střevo exponováno vstřebaným živinám, tedy zhruba 2 – 3 hod. Inkretinový účinek má tak zásadní roli v inzulinové odpovědi na alimentární podnět. Ačkoliv je tento poznatek známý téměř čtvrt století, teprve před 10 lety se dostal k praktickému užití jednak v terapii, jednak při konceptuálním uvažování o patogenezi diabetu 2. typu.
Produkty proglukagonového genu
Základní genový produkt společný glukagonu, GLP‑1, GLP‑2 a dalším proteinům exprimovaným v α buňkách Langerhansových ostrůvků, střevu či mozku, je proglukagon. Jeho enzymatickým štěpením prohormonální konvertázou vznikají výše uvedené produkty. GLP‑1, tedy glucagon‑like peptide 1 má více než 50% shodu v aminokyselinové sekvenci s glukagonem.
Vlastní GLP‑1 je ve střevě produkován v L buňkách. Ty jsou lokalizovány od duodena až po kolon, maximum jejich gastrointestinální distribuce je však v terminálním ileu a orálních částech tlustého střeva.
V krevním oběhu cirkuluje GLP‑1 ve 2 zkrácených biologicky účinných formách. Většinově, z 80 %, se jedná o tzv. 7 – 36 amidovaný produkt, zhruba 20 % tvoří 7 – 37 glycinový produkt. Již tyto formy GLP‑1 jsou tvořeny v L buňkách střeva štěpením proglukagonu prohormonální konvertázou 1/ 3.
Kinetika GLP‑1
Hladiny GLP‑1 nalačno se u zdravých zpravidla pohybují v rozmezí mezi 5 a 10 pmol/ l, postprandiálně pak stoupají na zhruba 3násobek těchto hodnot [13]. Zdá se, že sekrece GLP‑1 je však mnohem vyšší, větší část je již metabolizována ve střevní mikrocirkulaci. Plazmatický poločas GLP‑1 je kratičký – zpravidla se udává 1 – 2 min [14]. K jeho degradaci dochází štěpením dipeptidylpeptidázou ‑ 4 (DPP4) na fragment GLP‑1 (9-36), který již není inzulinovým sekretagogem. Kromě štěpení GLP‑1 pomocí DPP4 jsou popisovány i další, zřejmě méně významné cesty jeho degradace, jako např. štěpení neutrální endopeptidázou (NEP) 24.11. Terminální procesování GLP‑1 a následné vyloučení pak probíhá v ledvinách.
Terapeutické využití účinků inkretinů
S ohledem na zvýšení sekrece inzulinu byl GLP‑1 či jeho analoga zvažován jako možný terapeutický prostředek při léčbě diabetu 2. typu. S ozřejmením vztahu mezi degradací GLP‑1 pomocí DPP4 se objevila sílící snaha vyvinout inhibitor DPP4 s cílem udržet hladinu GLP‑1 co nejdéle co nejvyšší [15]. Terapeutický potenciál jak analog GLP‑1, tak inhibitorů DPP4 se ukázal jako reálný a obě skupiny léků jsou v současné době již řadu let zavedenou součástí léčby diabetu. Na trhu se objevují jak nová analoga GLP‑1, tak zejména další inhibitory DPP4.
Potravní stimulace sekrece GLP‑1
Potravní stimulace zvyšuje plazmatické hladiny GLP‑1 bifazicky: k I. fázi vzestupu dochází za 5 – 15 min po požití potravy, II. fáze má vrchol za 30 – 60 min po jídle [13]. Mezi živiny, nejvíce potencující sekreci GLP‑1, patří sacharidy. Méně již podporují sekreci základní složky rostlinných a živočišných tuků. Bylo prokázáno, že oleje s monoenovými mastnými kyselinami zvyšují sérové hladiny GLP‑1 více než saturované mastné kyseliny či triacylglyceroly [16,17]. Jinými slovy olivový olej zvyšuje hladiny GLP‑1 více než máslo. V experimentu na izolovaných buňkách u myších enterokrinních buněčných linií STV ‑ 1 bylo zjištěno, že žlučové kyseliny zvyšují sekreci GLP‑1 cestou receptoru TGR ‑ 5, spojeného s G ‑ proteinem [18].
Protein je obvykle ze základních složek stravy považován za nejméně účinný v stimulaci sekrece inkretinů. Při studiu glykemického a inzulinemického indexu bylo u mléka a některých mléčných výrobků zjištěno, že dochází k neproporčně vyššímu vzestupu inzulinemie, než by odpovídalo obsahu sacharidů [19]. Zejména výrobky obsahující syrovátku vedou k většímu vzestupu inzulinu, než by odpovídalo jejich obsahu sacharidů. Při podrobnější analýze vlivu mléčných výrobků obsahujících syrovátku na sekreci inzulinu bylo zjištěno, že právě obsah syrovátky je faktorem, který zvyšuje sekreci inzulinu, jak cestou zvýšené sekrece GLP‑1, tak cestou přímé stimulace větvenými aminokyselinami – leucinem, izoleucinem a valinem [20 – 22]. I u nemocných diabetem 2. typu stimulovalo přidání syrovátkových proteinů k sacharidům inzulinovou sekreci a vedlo ke snížení postprandiální glykemie [23]. Při tom bylo prokázáno, že právě syrovátkové proteiny mají ze všech testovaných proteinů nejvyšší obsah větvených aminokyselin, které jsou již od konce 60. let minulého století známy jako velmi potentní sekreatagoga inzulinu [20]. Vysoký obsah větvených aminokyselin je tedy s největší pravděpodobností faktorem, který vede k vzestupu hladiny inzulinu po perorálním přívodu syrovátky [21]. Odtud také vyplývá její obliba jako přirozeného proteinového anabolika využívaného při stimulaci růstu svalové hmoty.
Vztah GLP‑1 k játrům
Problematika vztahu GLP‑1 k játrům je velmi intenzivně studována. Dosavadní výsledky napovídají, že léčiva ovlivňující inkretinový systém by v budoucnu mohla být využita v léčbě některých jaterních onemocnění. V následujícím přehledu zmíníme dosud známé účinky GLP‑1 na jaterní funkce a jaterní metabolizmus a poukážeme na jeho možné budoucí terapeutické využití při léčbě jaterních onemocnění.
Nepřímé účinky GLP‑1 na jaterní metabolizmus
GLP‑1 ovlivňuje jaterní metabolizmus přímými i nepřímými mechanizmy. Mezi nejvýznamnější nepřímé mechanizmy, kterými GLP‑1 ovlivňuje jaterní buňky, patří:
- ovlivnění sekrece inzulinu a glukagonu z Langerhansových ostrůvků pankreatu,
- ovlivnění autonomního nervového systému,
- zpomalení motility GIT,
- ovlivnění chuti k jídlu.
Účinky inzulinu a glukagonu na metabolizmus sacharidů, lipidů a proteinů v jaterní buňce jsou velmi dobře známy. Proto jen odkazujeme na tab. 3, která srovnává účinky GLP‑1, inzulinu a glukagonu na jaterní metabolizmus. Je pochopitelné, že zpomalení motility žaludku a celého gastrointestinálního traktu spolu se snížením chuti k jídlu snižuje dostupnost energetických substrátů pro hepatocyty a následně jistě snižuje i syntézu jaterního glykogenu a TAG. Protože jsou tyto poznatky dobře známé a byly mnohokrát popsány v mezinárodním i českém písemnictví, budeme se v textu detailněji věnovat jen ovlivnění autonomního nervového systému účinkem GLP‑1 a vyplývajícím důsledkům pro jaterní buňky.
Mechanizmy působení GLP‑1 na játra (GLP‑1 receptor a játra, ovlivnění nervové signalizace, druhý GLP‑1 receptor, alternativní vstup peptidu do buňky)
Otázka, jak GLP‑1 zprostředkovává své účinky na jaterní buňky, není dosud zcela definitivně zodpovězena. Publikované práce totiž mnohdy přinášejí zcela protichůdné výsledky. V této části se pokusíme shrnout dosavadní poznatky a teorie o tom, jaký receptor využívá GLP‑1 na hepatocytech, a zda nevyužívá i jiné mechanizmy pro zprostředkování svých účinků na jaterní buňky.
Pankreatický typ GLP‑1 receptoru (GLP‑1R) je receptor spřažený s G ‑ proteinem (GPCR), patřící do sekretinové receptorové rodiny [24]. Poprvé byl objeven před více než 2 desetiletími na buněčné linii RIN1046 - 38 odvozené od inzulinomu [25,26]. Od té doby byla jeho přítomnost identifikována na buňkách mnoha tkání lidského těla (např. Langerhansovy ostrůvky pankreatu, CNS, kardiovaskulární systém, plíce, ledviny, trávicí systém, aferentní vagová zakončení) i na buňkách některých lidských nádorů [13,24,27]. Po vazbě GLP‑1 na tento receptor dochází skrze Gs ‑ protein ke zvýšení aktivity adenylátcyklázy, která katalyzuje intracelulární tvorbu cAMP [25,28 – 30].
Otázkou však nadále zůstává, zda GLP‑1 zprostředkovává své účinky na jaterní buňky právě skrze tento typ receptoru. Detekce exprese pankreatického typu GLP‑1R v játrech totiž není v dosud publikovaných pracích konzistentní [31,32]. Jejich přehled zachycují tab. 1 a 2, převzaty z [32].
Tab. 1. Výsledky podporující jaterní expresi a aktivitu GLP-1 receptoru pankreatického typu [32]. ![Výsledky podporující jaterní expresi a aktivitu GLP-1 receptoru pankreatického typu [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/aac956056dbd451c3c2334d2470d0885.png)
Tab. 2. Výsledky nepodporující jaterní expresi a aktivitu GLP-1 receptoru pankreatického typu [32]. ![Výsledky nepodporující jaterní expresi a aktivitu GLP-1 receptoru pankreatického typu [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7d60a42698f86924ade6fe4a43d56f93.png)
Z přehledu je patrné, že dosud nejsou dostupné jednoznačně přesvědčivé důkazy, které by prokazovaly nebo naopak vylučovaly jaterní expresi pankreatického typu GLP‑1R. Je pravda, že recentnější práce jsou v detekci GLP‑1R sice úspěšnější, ale některé z nich ho detekovaly pouze v buněčných liniích, které mohou mít odlišnou expresi od normálních hepatocytů [32]. Naši rozpolcenost dobře dokumentuje práce od Aviv et al [36]. Autoři v ní popisují 1 – 5 min po přidání exenatidu (analog GLP‑1) aktivaci tvorby cAMP a zvýšenou fosforylaci CREB, PKB, PKCζ a ERK1/ 2. Expresi GLP‑1R se jim ale současně popsat nepodařilo [36].
Právě tyto nejednoznačné nálezy vedly některé výzkumné skupiny k postulaci odlišných hypotéz působení GLP‑1 na jaterní buňky.
Jednou z hypotéz je, že GLP‑1 by mohl ovlivňovat jaterní buňky nepřímo skrze své působení na nervovou signalizaci. V tomto modelu by se GLP‑1 vázal na své receptory na aferentních vagových vláknech (uložených ve střevní stěně a v hepatoportální oblasti) [49,50], signál by byl veden do nucleus tractus solitarius, následovala by buď přímá (na úrovni mozkového kmene), či nepřímá (skrze přepojení v hypothalamu) aktivace eferentních vagových vláken, která by zprostředkovala tento nepřímý účinek GLP‑1 na jaterní buňky [13,50 – 56]. Popsaný model podporuje fakt, že vagová aktivace inhibuje jaterní produkci glukózy, což je i jeden z typicky popisovaných účinků GLP‑1 na jaterní metabolizmus [52,57] (blíže k účinku GLP‑1 na metabolizmus sacharidů v následující části). Do tohoto modelu dobře zapadá i nález velmi vysoké degradace GLP‑1 (7 - 36) akcí DPP4 ihned po jeho sekreci z L buněk, tedy ještě ve střevní stěně – předtím, než se GLP‑1 dostane do krevních kapilár [51,58]. Bylo zjištěno, že většina GLP‑1 uchovávaného v granulích L buněk je ve formě GLP‑1 (7 - 36), tedy v účinné formě [51]. Jeho bezprostřední degradace ve střevní stěně dosahuje velmi vysokých hodnot. Přibližně 75 % GLP‑1, které opouští střevo, je již přeměněno na štěpné produkty [51,58]. V játrech následně probíhá další degradace snižující aktivitu zbylého GLP‑1 (7 - 36) zhruba o polovinu [59], a tak pouze 10 – 15 % L buňkami sekretovaného GLP‑1 (7 - 36) se objevuje v systémové cirkulaci v aktivní formě [53]. Tento fakt také ukazuje na složitost interpretace hladin GLP‑1 získaných ze systémové krve.
Výsledky z in vitro studií (uvedené dále v textu), ve kterých je pochopitelně vyloučen jakýkoliv vliv nervové signalizace, nicméně naznačují přímý účinek GLP‑1 na jaterní buňky. Tyto nálezy ale nevylučují i fungování výše popsaného mechanizmu. V in vitro podmínkách se totiž používají suprafyziologické – nanomolární koncentrace GLP‑1, které jsou fyziologicky v lidském těle nedosažitelné, neboť hladina GLP‑1 v krvi jen zřídka překročí hodnotu 50 pmol/ l [13,60]. Popsaný mechanizmus tedy může být (i přes in vitro nálezy) významný pro působení GLP‑1 v lidském těle za fyziologických podmínek. Léčba založená na ovlivnění inkretinového systému (GLP‑1 analoga, která jsou rezistentní k degradaci DDP4, či inhibitory DPP4), která vychýlí fyziologické poměry, může ale i přesto vést k přímému účinku na jaterní buňky.
Dalším uvažovaným mechanizmem působení GLP‑1 na hepatocyty je možnost jeho účinku pomocí jiného receptoru, než je pankreatický typ GLP‑1R. Nejspíše by se také jednalo o GPCR. Spekuluje se např. o receptoru pro glukagon, či o jiném receptoru patřícím do sekretinové receptorové rodiny.
Také se uvažuje o možnosti, že na hepatocyty účinkují štěpy GLP‑1 vzniklé jeho „degradací“ [31,61]. Produkty proteolýzy GLP‑1 (7 - 36) vzniklé účinkem DPP4 a NEP 24.11, GLP‑1 (9 - 36) a GLP‑1 (28 - 36), totiž v několika pracích prokazovaly účinky na jaterní buňky, ačkoliv samy mají jen velmi nízkou afinitu ke GLP‑1R [62 – 64]. Dle této hypotézy by byly GLP‑1 (9 - 36) či GLP‑1 (28 - 36) přeneseny přes cytoplazmatickou membránu do nitra hepatocytu, kde by v případě GLP‑1 (9 - 36) následovalo jeho selektivní štěpení pomocí endopeptidáz (např. NEP 24.11). Vzniklé kratší peptidy – nonapeptid GLP‑1 (28 - 36) a pentapeptid GLP‑1 (32 - 36) – by byly přeneseny do matrix mitochondrie, kde by mohly ovlivňovat mitochondriální metabolizmus [31,64]. Podle tohoto modelu by měl GLP‑1 2 rozdílné role v metabolizmu. Jednak by jako GLP‑1 (7 - 36) přímo skrze GLP‑1R, např. stimuloval pankreatickou sekreci inzulinu, a jednak by jeho štěpné produkty modulovaly látkovou přeměnu v periferních tkáních [31,61]. Kromě vlivu na jaterní buňky byly popsány i účinky štěpných produktů GLP‑1 na srdce [65 – 67] a na krevní cévy [67,68].
Vliv GLP‑1 na jaterní metabolizmus sacharidů
Valverde et al [43] publikovali několik studií o vlivu GLP‑1 na jaterní metabolizmus sacharidů. GLP‑1 v nich zvyšoval aktivitu glykogensyntázy A, snižoval aktivitu glykogenfosforylázy A a podporoval zabudování značené glukózy do glykogenu v izolovaných potkaních hepatocytech. Tyto účinky GLP‑1 byly koncentračně závislé a zvyšovaly se s rostoucí koncentrací glukózy. Analog GLP‑1 exenatid prokazoval podobné účinky a antagonista GLP‑1R exendin (9 - 39) naopak tyto účinky blokoval [43,69,70]. Egan et al [71] popsali zvýšení odsunu glukózy u obézních dobrovolníků během infuze GLP‑1, přičemž tento výsledek nebyl vyvolán zvýšenou endogenní sekrecí inzulinu. Podobné výsledky publikovali i Dardevet et al [72], kteří popsali na inzulinu nezávislé zvýšení jaterního odsunu glukózy a jaterní syntézy glykogenu během infuze GLP‑1 (7 - 36) u psů, přičemž neprokázali ovlivnění nejaterního odsunu glukózy.
Další práce prokazují snížení jaterní produkce glukózy po podání štěpných produktů GLP‑1 – GLP‑1 (9 - 36) a GLP‑1 (28 - 36). Např. Elahi et al [61] popsali, že podání infuze GLP‑1 (9 - 36) vede u obézních inzulin‑rezistentních osob v postabsorpční fázi až k 50% snížení jaterní produkce glukózy, přičemž toto významné snížení nebylo způsobeno změnami hladin inzulinu a glukagonu v plazmě. U štíhlých inzulin‑senzitivních osob nebyl účinek GLP‑1 (9 - 36) tak výrazný [61]. Podobné výsledky byly zopakovány i v podmínkách in vitro [48,64]. Tomas et al [48] prokázali 30% snížení produkce glukózy v izolovaných myších hepatocytech při jejich kultivaci s GLP‑1 (9 - 36). Snížení bylo srovnatelné se snížením produkce glukózy hepatocyty navozeným účinkem inzulinu. Přidání antagonisty GLP‑1R [exendin (9 - 39)] do média nevedlo k oslabení účinku GLP‑1 (9 - 36), což naznačuje, že GLP‑1 (9 - 36) působí nezávisle na GLP‑1R. Exendin (9 - 39) dokonce paradoxně vedl k mírnému prohloubení suprese produkce glukózy [48]. Výsledky byly podepřeny nálezem snížení exprese enzymů klíčových pro jaterní glukoneogenezi – fosfoenolpyruvátkarboxykinázy a glukóza ‑ 6-fosfatázy při kultivaci hepatocytů s GLP‑1 (9 - 36). V další práci ze stejné laboratoře popsali Tomas et al [64] podobnou supresi produkce glukózy, zvýšení hladiny ATP a potlačení oxidačního stresu a tvorby ROS u izolovaných myších hepatocytů působením GLP‑1 (28 - 36). Mezi další studie prokazující účinek štěpných produktů GLP‑1 na sacharidový metabolizmus patří např. práce od Deacon et al [73], kteří popsali zvýšený odsun glukózy u prasat během infuze GLP‑1 (9 – 36) či práce od Meier et al [74], kteří prokázali mírný efekt GLP‑1 (9 - 36) na postprandiální glykemii u zdravých inzulin‑senzitivních dobrovolníků. Naopak práce od Vahl et al [75] neprokázala žádný vliv GLP‑1 (9 - 36) na parametry glukózové tolerance.
Inkretinové účinky na jaterní metabolizmus sacharidů jsou již rutinně v praxi využívány při terapii diabetu 2. typu léky ovlivňujícími inkretinový mechanizmus. Snížení jaterní produkce glukózy se významně podílí na jejich účinku na jaterní sacharidový metabolizmus u diabetiků 2. typu. Řada prací však naznačuje, že budoucnost by mohla patřit i kratším biologickým štěpům původního GLP‑1. O potenciálním využití v praxi se již spekuluje [64].
Vliv GLP‑1 na jaterní metabolizmus lipidů
Účinky GLP‑1, jeho analog a inhibitorů DPP4 na jaterní metabolizmus lipidů jsou v současné době velmi intenzivně studovány a dosavadní poznatky byly v nedávné době shrnuty 2 přehledovými články od Samson et al a Lee et al [32,76]. Následující text vychází z těchto článků.
Gupta et al a Lee et al [37,40] popsali, že analog GLP‑1 exenatid snižuje intracelulární akumulaci lipidů v buněčných linií Huh7 a HepG2 kultivovaných s mastnými kyselinami. Podávání analog GLP‑1 {exenatid, liraglutid, AC3174 [Leu(14)] exendin‑4} bylo v několika zvířecích modelech obezity (leptin decientní ob/ ob myši, db/ db myši deficientní na leptinový receptor, myši na vysokotukové dietě či myši na ALIOS dietě („American Lifestyle ‑ Induced Obesity Syndrome“) spojeno s poklesem obsahu jaterních triacylglycerolů a s redukcí stupně jaterní steatózy [35,77 – 80]. Podobně příznivé účinky (pokles jaterních a sérových triacylglycerolů, snížení histologického stupně jaterní steatózy, úprava dysfunkce biliární sekrece) byly zjištěny i ve zvířecích modelech s deficiencí DPP4 či při podávání inhibitoru DPP4 [39,81,82].
Současně jsou popisovány významné účinky GLP‑1, jeho analog či inhibice DPP4 na expresi genů v hepatocytech. Většina prací prokazuje posílení oxidace mastných kyselin při souběžném snížení de novo lipogeneze [35,39,40,77,81]. Pro to svědčí zvýšení jaterní exprese klíčových faktorů oxidace mastných kyselin – PPARα (peroxisome proliferator activated receptor) a karnitinacyltransferázy Ia pokles exprese klíčových faktorů de novo syntézy mastných kyselin: syntázy mastných kyselin (FAS), stearoyl ‑ CoA desaturázy I (SCD1) a SREBP ‑ 1c (sterol regulatory element‑binding protein‑1c) [35,39,40,77,81]. Existují ale i práce popisující v některých směrech opačný vliv GLP‑1 na genovou expresi, kdy u DPP4 deficientních potkanů došlo po 2měsíční vysokotukové dietě naopak ke zvýšení exprese FAS, SCD1 a SREBP ‑ 1c [82]. Z dalších výsledků týkajících se ovlivnění genové exprese bylo popsáno zvýšení exprese proteinů zodpovědných za vstup mastných kyselin do hepatocytů – FABP (fatty acid binding protein), za peroxizomální β ‑ oxidaci – acyl ‑ CoA oxidázy II a za odsun lipidů z hepatocytů (sekreci VLDL) – MTTP (microsomal triglyceride transfer protein) a ApoB [83].
Shrnutí těchto výsledků dovoluje konstatovat, že GLP‑1 zvyšuje schopnost jaterních buněk vypořádat se s nadbytkem mastných kyselin, s čímž souvisí i zvýšený odsun jaterních triacylglycerolů.
U lidí zatím bohužel nebyly v této oblasti publikovány dostatečně přesvědčivé výsledky. Některé práce nicméně naznačují podobně pozitivní efekt inkretinové terapie na jaterní metabolizmus lipidů [84 – 92].
Porovnání účinku GLP‑1 (a jeho štěpných produktů), glukagonu a inzulinu na jaterní metabolizmus sacharidů a lipidů je uvedeno v tab. 3.
Tab. 3. Porovnání účinku GLP-1 (a jeho štěpných produktů), glukagonu a inzulinu na jaterní metabolizmus sacharidů a lipidů. 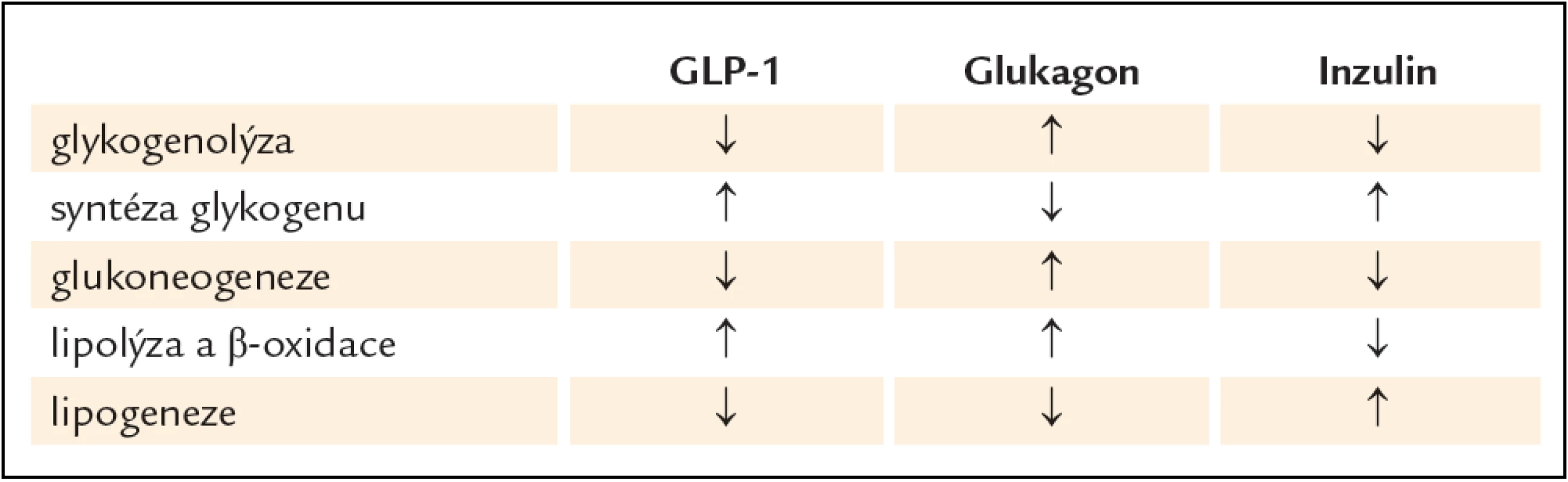
Vliv GLP‑1 na jaterní metabolizmus proteinů a aminokyselin
Zatímco o přímém vlivu GLP‑1 na jaterní metabolizmus sacharidů a lipidů je dostupných mnoho publikací, nepodařilo se nám nalézt významné publikace na téma vlivu GLP‑1 na jaterní metabolizmus proteinů či aminokyselin.
Vliv GLP‑1 na metabolizmus žlučových kyselin
V práci od Ben ‑ Shlomo et al [82] nedošlo u DPP4 deficientních potkanů na vysokotukové dietě k rozvoji dysfunkce biliární sekrece, kterou vysokotuková dieta navozuje [93]. Autoři popsali snížené hladiny žlučových kyselin ve v. cava inferior, pokles produkce žlučových kyselin podmíněný sníženou expresí CYP7A1, rate limiting enzymu přeměny cholesterolu na žlučové kyseliny, a zvýšenou expresi transportérů žlučových kyselin – ABCB11 a ABCC3 [82].
Vliv GLP‑1 na stres endoplazmatického retikula v hepatocytech, oxidační stres a na hladinu zánětlivých mediátorů
Sharma et al [79] sledovali účinek exenatidu na primární lidské hepatocyty kultivované s mastnými kyselinami. Působení exenatidu u nich vedlo k aktivaci autofagie (proces chránící hepatocyty před náloží mastných kyselin), ke snížení obsahu lipidů, markerů stresu ER a hladiny aktivované kaspázy 3, což zlepšovalo přežití buněk [79]. Další práce popisují snížení produkce zánětlivých mediátorů (např. TNF α) a markerů oxidačního stresu působením GLP‑1 [35,39,64].
Tyto výsledky by mohly naznačovat potenciální příznivý efekt GLP‑1 na jaterní onemocnění, na jejichž patogenezi se podílí složka oxidačního stresu a stresu ER.
Vztah GLP‑1 a NAFLD
Nadměrná akumulace tuků v játrech je označována jako jaterní steatóza (fatty liver disease). Non ‑ alcoholic fatty liver disease (NAFLD) je jedním z nejčastějších jaterních onemocnění západní polokoule postihující mezi 20 a 30 % dospělé populace [94]. Přibližně u 10 – 25 % pacientů může NAFLD progredovat do non‑alcoholic steatohepatitis (NASH) a 10 – 15 % osob s NASH může vyvinout hepatocelulární karcinom [95,96]. Kromě toho je NAFLD velmi úzce spojen s metabolickým syndromem, diabetem 2. typu a kardiovaskulární morbiditou a mortalitou. Z důvodu této velké závažnosti se hledá specifická léčba NAFLD.
Z nálezů uvedených výše vyplývá, že na inkretinech založená terapie by mohla pozitivně ovlivnit některé patologické procesy provázející NAFLD a NASH, a to nejen u obézních diabetiků, u nichž byly tyto účinky již v několika pracích popsány [84 – 92], ale přinejmenším i u některých pacientů s NAFLD či NASH bez přítomnosti diabetu. Tyto úvahy ale zatím nepřešly do běžné klinické praxe. Předpokládáme však důkladné zkoumání v této oblasti.
Závěr
Rozsáhlé poznatky o působení GLP‑1 na metabolizmus i řadu dalších funkcí jaterní buňky ukazují v oblasti metabolizmu sacharidů jeho aktivitu podobnou inzulinu, v oblasti metabolizmu lipidů jeho aktivitu podobnou glukagonu. Z hlediska patologicky orientovaného pohledu se tyto účinky jeví jako příznivé. Mnohotvárnost a vícerozměrnost působení hormonů, živin a metabolitů na jaterní buňky tak dostává i další dimenzi, která je v posledních 25 letech velmi intenzivně studována. Dalšími podněty ke studiu je masivní zavedení léků ovlivňujících inkretinový systém do léčby diabetu. Z hlediska jaterního postižení má tato terapie jak své přínosy, tak i svá rizika. Touto problematikou se v předkládaném článku nezabýváme a odkazujeme na specializovanou literaturu [97].
Článek byl sepsán v rámci práce podpořené grantem GAUK 1488213.
Spoluautoři článku jsou zavázáni paní profesorce Marii Brodanové a tímto článkem jí nejen blahopřejí, ale snaží se i poděkovat. Michal Anděl byl aspirantem jejího manžela Vladimíra Brodana a s Marií Brodanovou spolupracoval před 38 roky na tématu glukagon a metabolizmus aminokyselin u nemocných s jaterní cirhózou. Marie Brodanová byla oponentkou kandidátské dizertační práce Zuzany Červinkové. Vážíme si ji pro její kolegialitu, vztah ke klinické medicíně, k nemocným, k její důslednosti a přesnosti, někdy až pedantskému přístupu k vlastním publikacím. Věříme, že na našem článku příliš chyb nenajde.
MU Dr. Josef Fontana
www.lf3.cuni.cz/
e‑mail: josef.fontana@lf3.cuni.cz
Doručeno do redakce: 9. 6. 2013
Zdroje
1. Hugo J, Vokurka M. Velký lékařský slovník. Praha: Maxdorf 2009.
2. La Barre J. Sur les possibilite’s d’un traitement du diabe’te par l’incre’tine. Bull Acad R Med Belg 1932; 12 : 620 – 634.
3. Brown JC, Mutt V, Pederson RA. Further purification of a polypeptide demonstrating enterogastrone activity. J Physiol 1970; 209 : 57 – 64.
4. Bell GI, Santerre RF, Mullenbach GT. Hamster preproglucagon contains the sequence of glucagon and two related peptides. Nature 1983; 302 : 716 – 718.
5. Bell GI, Sanchez ‑ Pescador R, Laybourn PJ et al. Exon duplication and divergence in the human preproglucagon gene. Nature 1983; 304 : 368 – 371.
6. McIntyre N, Holdsworth CD, Turner DS. New interpretation of oral glucose tolerance. Lancet 1964; 2 : 20 – 21.
7. Elrick H, Stimmler L, Hlad CJ Jr et al. Plasma insulin responses to oral and intravenous glucose administration. J Clin Endocrinol Metab 1964; 24 : 1076 – 1082.
8. Creutzfeldt W. The [pre‑] history of the incretin concept. Regul Pept 2005; 128 : 87 – 91.
9. Nauck MA, Homberger E, Siegel EG et al. Incretin effects of increasing glucose loads in man calculated from venous insulin and C ‑ peptide responses. J Clin Endocrinol Metab 1986; 63 : 492 – 498.
10. Kreymann B, Williams G, Ghatei MA et al. Glucagon‑like peptide ‑ 1 7 – 36: a physiological incretin in man. Lancet 1987; 2 : 1300 – 1304.
11. Nauck M, Stöckmann F, Ebert R et al. Reduced incretin effect in type 2 (non‑insulin‑dependent) diabetes. Diabetologia 1986; 29 : 46 – 52.
12. Nauck MA, Weber I, Bach I et al. Normalization of fasting glycaemia by intravenous GLP‑1 ([7 – 36 amide] or [7 – 37]) in type 2 diabetic patients. Diabet Med 1998; 15 : 937 – 945.
13. Holst JJ. The physiology of glucagon‑like peptide 1. Physiol Rev 2007; 87 : 1409 – 1439.
14. Vilsbøll T, Agersø H, Krarup T et al. Similar elimination rates of glucagon‑like peptide ‑ 1 in obese type 2 diabetic patients and healthy subjects. J. Clin Endocrinol Metab 2003; 88 : 220 – 224.
15. Ahrén B. Glucagon‑like peptide ‑ 1 (GLP‑1): a gut hormone of potential interest in the treatment of diabetes. Bioessays 1998; 20 : 642 – 651.
16. Thomsen C, Rasmussen O, Lousen T et al. Differential effects of saturated and monounsaturated fatty acids on postprandial lipemia and incretin responses in healthy subjects. Am J Clin Nutr 1999; 69 : 1135 – 1143.
17. Beysen C, Karpe F, Fielding BA et al. Interaction between specific fatty acids, GLP‑1 and insulin secretion in humans. Diabetologia 2002; 45 : 1533 – 1541.
18. Katsuma S, Hirasawa A, Tsujimoto G. Bile acids promote glucagon‑like peptide ‑ 1 secretion through TGR5 in a murine enteroendocrine cell line STC ‑ 1. Biochem Biophys Res Commun 2005; 329 : 386 – 390.
19. Östman EM, Liljeberg Elmståhl HG, Björck IM.Inconsistency between glycemic and insulinemic responses to regular and fermented milk products. Am J Clin Nutr 2001; 74 : 96 – 100.
20. Fajans SS, Floyd JC Jr, Knopf RF et al. Effect of amino acids and proteins on insulin secretion in man. Recent Prog Horm Res 1967; 23 : 617 – 662.
21. van Loon LJ, Kruijshoop M, Verhagen H et al.Ingestion of protein hydrolysate and amino acid ‑ carbohydrate mixtures increases postexercise plasma insulin responses in men. J Nutr 2000; 130 : 2508 – 2513.
22. Nilsson M, Stenberg M, Frid AH et al. Glycemia and insulinemia in healthy subjects after lactose‑equivalent meals of milk and other food proteins: the role of plasma amino acids and incretins. Am J Clin Nutr 2004; 80 : 1246 – 1253.
23. Frid AH, Nilsson M, Holst JJ et al. Effect of whey on blood glucose and insulin responses to composite breakfast and lunch meals in type 2 diabetic subjects. Am J Clin Nutr 2005; 82 : 69 – 75.
24. Mayo KE, Miller LJ, Bataille D et al. International Union of Pharmacology. XXXV. The glucagon receptor family. Pharmacol Rev 2003; 55 : 167 – 194.
25. Drucker DJ, Philippe J, Mojsov S et al. Glucagon‑like peptide I stimulates insulin gene expression and increases cyclic AMP levels in a rat islet cell line. Proc Natl Acad Sci USA 1987; 84 : 3434 – 3438.
26. Göke R, Conlon JM. Receptors for glucagon‑like peptide ‑ 1(7 - 36)amide on rat insulinoma ‑ derived cells. J Endocrinol 1988; 116 : 357 – 362.
27. Körner M, Stöckli M, Waser B et al. GLP‑1 receptor expression in human tumors and human normal tissues: potential for in vivo targeting. J Nucl Med 2007; 48 : 736 – 743.
28. Thorens B. Expression cloning of the pancreatic beta cell receptor for the gluco ‑ incretin hormone glucagon‑like peptide 1. Proc Natl Acad Sci USA 1992; 89 : 8641 – 8645.
29. Thorens B, Porret A, Bühler L et al. Cloning and functional expression of the human islet GLP‑1 receptor. Demonstration that exendin‑4 is an agonist and exendin‑(9-39) an antagonist of the receptor. Diabetes 1993; 42 : 1678 – 1682.
30. Moens K, Heimberg H, Flamez D et al. Expression and functional activity of glucagon, glucagon‑like peptide I, and glucose‑dependent insulinotropic peptide receptors in rat pancreatic islet cells. Diabetes 1996; 45 : 257 – 261.
31. Tomas E, Habener JF. Insulin‑like actions of glucagon‑like peptide ‑ 1: a dual receptor hypothesis. Trends Endocrinol Metab 2010; 21 : 59 – 67.
32. Samson SL, Bajaj M. Potential of incretin‑based therapies for non‑alcoholic fatty liver disease. J Diabetes Complications 2013. In press.
33. Campos RV, Lee YC, Drucker DJ. Divergent tissue ‑ specific and developmental expression of receptors for glucagon and glucagon‑like peptide ‑ 1 in the mouse. Endocrinology 1994; 134 : 2156 – 2164.
34. Egan JM, Montrose‑Rafizadeh C, Wang Y et al. Glucagon‑like peptide ‑ 1(7 - 36)amide (GLP‑1) enhances insulin‑stimulated glucose metabolism in 3T3-L1 adipocytes: one of several potential extrapancreatic sites of GLP‑1 action. Endocrinology 1994; 135 : 2070 – 2075.
35. Ding X, Saxena NK, Lin S et al. Exendin‑4, a glucagon‑like protein‑1 (GLP‑1) receptor agonist, reverses hepatic steatosis in ob/ ob mice. Hepatology 2006; 43 : 173 – 181.
36. Aviv V, Meivar ‑ Levy I, Rachmut IH et al. Exendin‑4 promotes liver cell proliferation and enhances the PDX ‑ 1‑induced liver to pancreas transdifferentiation process. J Biol Chem 2009; 284 : 33509 – 33520.
37. Gupta NA, Mells J, Dunham RM et al. Glucagon‑like peptide ‑ 1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosis in vitro by modulating elements of the insulin signaling pathway. Hepatology 2010; 51 : 1584 – 1592.
38. Svegliati ‑ Baroni G, Saccomanno S, Rychlicki C et al. Glucagon‑like peptide ‑ 1 receptor activation stimulates hepatic lipid oxidation and restores hepatic signalling alteration induced by a high‑fat diet in nonalcoholic steatohepatitis. Liver Int 2011; 31 : 1285 – 1297.
39. Ben ‑ Shlomo S, Zvibel I, Shnell M et al. Glucagon‑like peptide ‑ 1 reduces hepatic lipogenesis via activation of AMP‑activated protein kinase. J Hepatol 2011; 54 : 1214 – 1223.
40. Lee J, Hong SW, Chae SW et al. Exendin‑4 improves steatohepatitis by increasing Sirt1 expression in high‑fat diet‑induced obese C57BL/ 6J mice. PLoS One 2012; 7: e31394.
41. Ghiglione M, Blazquez E, Uttenthal LO et al. Glucagon‑like peptide ‑ 1 does not have a role in hepatic carbohydrate metabolism. Diabetologia 1985; 28 : 920 – 921.
42. Blackmore PF, Mojsov S, Exton JH et al. Absence of insulinotropic glucagon‑like peptide ‑ I(7 – 37) receptors on isolated rat liver hepatocytes. FEBS Lett 1991; 283 : 7 – 10.
43. Valverde I, Morales M, Clemente F et al. Glucagon‑like peptide 1: a potent glycogenic hormone. FEBS Lett 1994; 349 : 313 – 316.
44. Wei Y, Mojsov S. Tissue ‑ specic expression of the human receptor for glucagon‑like peptide ‑ I: brain, heart and pancreatic forms have the same deduced amino ‑ acid ‑ sequences. FEBS Lett 1995; 358 : 219 – 224.
45. Bullock BP, Heller RS, Habener JF. Tissue distribution of messenger ribonucleic acid encoding the rat glucagon‑like peptide ‑ 1 receptor. Endocrinology 1996; 137 : 2968 – 2978.
46. Dunphy JL, Taylor RG, Fuller PJ. Tissue distribution of rat glucagon receptor and GLP‑1 receptor gene expression. Mol Cell Endocrinol 1998; 141 : 179 – 186.
47. Flock G, Baggio LL, Longuet C et al. Incretin receptors for glucagon‑like peptide 1 and glucose‑dependent insulinotropic polypeptide are essential for the sustained metabolic actions of vildagliptin in mice. Diabetes 2007; 56 : 3006 – 3013.
48. Tomas E, Stanojevic V, Habener JF. GLP‑1(9 – 36)amide metabolite suppression of glucose production in isolated mouse hepatocytes. Horm Metab Res 2010; 42 : 657 – 662.
49. Nakagawa A, Satake H, Nakabayashi H et al.Receptor gene expression of glucagon‑like peptide ‑ 1, but not glucose‑dependent insulinotropic polypeptide, in rat nodose ganglion cells. Auton Neurosci 2004; 110 : 36 – 43.
50. Vahl TP, Tauchi M, Durler TS et al. Glucagon‑like peptide ‑ 1 (GLP‑1) receptors expressed on nerve terminals in the portal vein mediate the effects of endogenous GLP‑1 on glucose tolerance in rats. Endocrinology 2007; 148 : 4965 – 4973.
51. Hansen L, Deacon CF, Orskov C et al. Glucagon‑like peptide ‑ 1 – (7 – 36)amide is transformed to glucagon‑like peptide ‑ 1 – (9 – 36)amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine. Endocrinology 1999; 140 : 5356 – 5363.
52. D‘Alessio D, Vahl T, Prigeon R. Effects of glucagon‑like peptide 1 on the hepatic glucose metabolism. Horm Metab Res 2004; 36 : 837 – 841.
53. Holst JJ, Deacon CF. Glucagon‑like peptide ‑ 1 mediates the therapeutic actions of DPP ‑ IV inhibitors. Diabetologia 2005; 48 : 612 – 615.
54. Hayes MR, De Jonghe BC, Kanoski SE. Role of the glucagon‑like ‑ peptide ‑ 1 receptor in the control of energy balance. Physiol Behav 2010; 100 : 503 – 510.
55. Hayes MR, Kanoski SE, De Jonghe BC et al.The common hepatic branch of the vagus is not required to mediate the glycemic and food intake suppressive effects of glucagon‑like ‑ peptide ‑ 1. Am J Physiol Regul Integr Comp Physiol 2011; 301: R1479 – R1485.
56. Hayes MR. Neuronal and intracellular signaling pathways mediating GLP‑1 energy balance and glycemic effects. Physiol Behav 2012; 106 : 413 – 416.
57. Boyle PJ, Liggett SB, Shah SD et al. Direct muscarinic cholinergic inhibition of hepatic glucose production in humans. J Clin Invest 1988; 82 : 445 – 449.
58. Hansen L, Hartmann B, Bisgaard T et al. Somatostatin restrains the secretion of glucagon‑like peptide ‑ 1 and 2 from isolated perfused porcine ileum. Am J Physiol Endocrinol Metab 2000; 278: E1010 – E1018.
59. Deacon CF, Pridal L, Klarskov L et al. Glucagon‑like peptide 1 undergoes differential tissue ‑ specific metabolism in the anesthetized pig. Am J Physiol 1996; 271: E458 – E464.
60. Orskov C, Wettergren A, Holst JJ. Secretion of the incretin hormones glucagon‑like peptide ‑ 1 and gastric inhibitory polypeptide correlates with insulin secretion in normal man throughout the day. Scand J Gastroenterol 1996; 31 : 665 – 670.
61. Elahi D, Egan JM, Shannon RP et al. Glucagon‑like peptide ‑ 1(9 – 36)amide, cleavage product of glucagon‑like peptide ‑ 1(7 – 36)amide, is a glucoregulatory peptide. Obesity (Silver Spring) 2008; 16 : 1501 – 1509.
62. Tomas E, Wood JA, Stanojevic V et al. Glucagon‑like peptide ‑ 1(9 – 36)amide metabolite inhibits weight gain and attenuates diabetes and hepatic steatosis in diet‑induced obese mice. Diabetes Obes Metab 2011; 13 : 26 – 33.
63. Tomas E, Wood JA, Stanojevic V et al. GLP‑1 - derived nonapeptide GLP‑1(28 – 36)amide inhibits weight gain and attenuates diabetes and hepatic steatosis in diet‑induced obese mice. Regul Pept 2011; 169 : 43 – 48.
64. Tomas E, Stanojevic V, Habener JF. GLP‑1 – derived nonapeptide GLP‑1(28 – 36)amide targets to mitochondria and suppresses glucose production and oxidative stress in isolated mouse hepatocytes. Regul Pept 2011; 167 : 177 – 184.
65. Nikolaidis LA, Elahi D, Shen YT et al. Active metabolite of GLP‑1 mediates myocardial glucose uptake and improves left ventricular performance in conscious dogs with dilated cardiomyopathy. Am J Physiol Heart Circ Physiol 2005; 289: H2401 – H2408.
66. Sonne DP, Engstrøm T, Treiman M. Protective effects of GLP‑1 analogues exendin‑4 and GLP‑1(9 – 36)amide against ischemia ‑ reperfusion injury in rat heart. Regul Pept 2008; 146 : 243 – 249.
67. Ban K, Noyan ‑ Ashraf MH, Hoefer J et al. Cardioprotective and vasodilatory actions of glucagon‑like peptide 1 receptor are mediated through both glucagon‑like peptide 1 receptor ‑ dependent and - independent pathways. Circulation 2008; 117 : 2340 – 2350.
68. Green BD, Hand KV, Dougan JE et al. GLP‑1 and related peptides cause concentration ‑ dependent relaxation of rat aorta through a pathway involving KATP and cAMP. Arch Biochem Biophys 2008; 478 : 136 – 142.
69. Alcántara AI, Morales M, Delgado E et al. Exendin‑4 agonist and exendin(9 – 39)amide antagonist of the GLP‑1(7 – 36)amide effects in liver and muscle. Arch Biochem Biophys 1997; 341 : 1 – 7.
70. López ‑ Delgado MI, Morales M, Villanueva ‑ Peñacarrillo ML et al. Effects of glucagon‑like peptide 1 on the kinetics of glycogen synthase a in hepatocytes from normal and diabetic rats. Endocrinology 1998; 139 : 2811 – 2817.
71. Egan JM, Meneilly GS, Habener JF et al. Glucagon‑like peptide ‑ 1 augments insulin‑mediated glucose uptake in the obese state. J Clin Endocrinol Metab 2002; 87 : 3768 – 3773.
72. Dardevet D, Moore MC, Neal D et al. Insulin‑independent effects of GLP‑1 on canine liver glucose metabolism: duration of infusion and involvement of hepatoportal region. Am J Physiol Endocrinol Metab 2004; 287: E75 – E81.
73. Deacon CF, Plamboeck A, Møller S et al. GLP‑1(9 – 36)amide reduces blood glucose in anesthetized pigs by a mechanism that does not involve insulin secretion. Am J Physiol Endocrinol Metab 2002; 282: E873 – E879.
74. Meier JJ, Gethmann A, Nauck MA et al.The glucagon‑like peptide ‑ 1 metabolite GLP‑1(9 – 36)amide reduces postprandial glycemia independently of gastric emptying and insulin secretion in humans. Am J Physiol Endocrinol Metab 2006; 290: E1118 – E1123.
75. Vahl TP, Paty BW, Fuller BD et al. Effects of GLP‑1 - (7 – 36)NH2, GLP‑1 – (7 – 37), and GLP‑1 - (9 – 36)NH2 on intravenous glucose tolerance and glucose‑induced insulin secretion in healthy humans. J Clin Endocrinol Metab 2003; 88 : 1772 – 1779.
76. Lee J, Hong SW, Rhee EJ et al. GLP‑1 Receptor Agonist and Non ‑ Alcoholic Fatty Liver Disease. Diabetes Metab J 2012; 36 : 262 – 267.
77. Samson SL, Gonzalez EV, Yechoor V et al. Gene therapy for diabetes: metabolic effects of helper ‑ dependent adenoviral exendin 4 expression in a diet‑induced obesity mouse model. Mol Ther 2008; 16 : 1805 – 1812.
78. Samson SL, Sathyanarayana P, Jogi M et al. Exenatide decreases hepatic broblast growth factor 21 resistance in non‑alcoholic fatty liver disease in a mouse model of obesity and in a randomised controlled trial. Diabetologia 2011; 54 : 3093 – 3100.
79. Sharma S, Mells JE, Fu PP et al. GLP‑1 analogs reduce hepatocyte steatosis and improve survival by enhancing the unfolded protein response and promoting macroautophagy. PLoS One 2011; 6: e25269.
80. Trevaskis JL, Griffin PS, Wittmer C et al. Glucagon‑like peptide ‑ 1 receptor agonism improves metabolic, biochemical, and histopathological indices of nonalcoholic steatohepatitis in mice. Am J Physiol Gastrointest Liver Physiol 2012; 302: G762 – G772.
81. Shirakawa J, Fujii H, Ohnuma K et al. Diet‑induced adipose tissue inammation and liver steatosis are prevented by DPP ‑ 4 inhibition in diabetic mice. Diabetes 2011; 60 : 1246 – 1257.
82. Ben ‑ Shlomo S, Zvibel I, Rabinowich L et al. Dipeptidyl peptidase 4 – deficient rats have improved bile secretory function in high fat diet‑induced steatosis. Dig Dis Sci 2013; 58 : 172 – 178.
83. Mells JE, Fu PP, Sharma S et al. Glp ‑ 1 analog, liraglutide, ameliorates hepatic steatosis and cardiac hypertrophy in C57BL/ 6J mice fed a Western diet. Am J Physiol Gastrointest Liver Physiol 2012; 302: G225 – G235.
84. Tushuizen ME, Bunck MC, Pouwels PJ et al.Incretin mimetics as a novel therapeutic option for hepatic steatosis. Liver Int 2006; 26 : 1015 – 1017.
85. Klonoff DC, Buse JB, Nielsen LL et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years. Curr Med Res Opin 2008; 24 : 275 – 286.
86. D’Amico E. Efficacy of liraglutide in a patient with type 2 diabetes and cryptogenic cirrhosis. Acta Biomed 2011; 82 : 160 – 161.
87. Sathyanarayana P, Jogi M, Muthupillai R et al. Effects of combined exenatide and pioglitazone therapy on hepatic fat content in type 2 diabetes. Obesity 2011; 19 : 2310 – 2315.
88. Vilsbøll T, Christensen M, Junker AE et al. Effects of glucagon‑like peptide ‑ 1 receptor agonists on weight loss: systematic review and meta‑analyses of randomised controlled trials. BMJ 2012; 344: d7771.
89. Ohki T, Isogawa A, Iwamoto M et al. The effectiveness of liraglutide in nonalcoholic fatty liver disease patients with type 2 diabetes mellitus compared to sitagliptin and pioglitazone. Scientific World Journal 2012; 2012 : 496453.
90. Cuthbertson DJ, Irwin A, Gardner CJ et al. Improved glycaemia correlates with liver fat reduction in obese, type 2 diabetes, patients given glucagon‑like peptide ‑ 1 (GLP‑1) receptor agonists. PLoS One 2012; 7: e50117.
91. Kenny PR, Brady DE, Torres DM et al. Exenatide in the treatment of diabetic patients with non‑alcoholic steatohepatitis: a case series. Am J Gastroenterol 2010; 105 : 2707 – 2709.
92. Buse JB, Klonoff DC, Nielsen LL et al. Metabolic effects of two years of exenatide treatment on diabetes, obesity, and hepatic biomarkers in patients with type 2 diabetes: an interim analysis of data from the open ‑ label, uncontrolled extension of three double‑blind, placebo ‑ controlled trials. Clin Ther 2007; 29 : 139 – 153.
93. Pizarro M, Balasubramaniyan N, Solís N et al.Bile secretory function in the obese Zucker rat: evidence of cholestasis and altered canalicular transport function. Gut 2004; 53 : 1837 – 1843.
94. Ruhl CE, Everhart JE. Epidemiology of nonalcoholic fatty liver. Clin Liver Dis 2004; 8 : 501 – 519.
95. Kim CH, Younossi ZM. Nonalcoholic fatty liver disease: a manifestation of the metabolic syndrome. Cleve Clin J Med 2008; 75 : 721 – 728.
96. Vanni E, Bugianesi E, Kotronen A et al. From the metabolic syndrome to NAFLD or vice versa? Dig Liver Dis 2010; 42 : 320 – 330.
97. Haluzik M, Rychlik I et al. Léčba diabetu u pacientů s onemocněním ledvin a jater. Praha: Mladá Fronta 2012.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Onemocnění jater u diabetikůČlánek Polypózy trávicího traktuČlánek Wilsonova chorobaČlánek Mnohočetný myelomČlánek Flavonoidy vážně i nevážně
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- K významnému životnímu jubileu prof. MUDr. Marie Brodanové, DrSc.,
- K životnímu jubileu prof. MU Dr. Marie Brodanové, DrSc.
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Pokroky v onkohematologii v 21. století
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Rifaximin v léčbě chronické divertikulózy
- Flavonoidy vážně i nevážně
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



