-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní pankreatitida – novinky v léčbě
Acute pancreatitis – new developments in treatment
Acute pancreatitis continues to be a potentially very severe disease. According to new classification schemes, a severe pancreatitis (up to 20%) is conditioned by structural changes and organ failures. The first critical moment concerns a fast development of pancreatic necrosis, followed by delayed infection. The most common complications of pancreatitis include infections, bleeding, compartment syndrome and decompensation of comorbidities. At the early stage the most important measure concerns the active expansion of blood volume and treatment of organ dysfunction. General antibiotic prophylaxis has been rejected; it is indicated only if there are signs of persistent circular failure and inflammatory response syndrome. The choice of antibiotic regimens usually includes Ciprofloxacin plus Metronidazole, Imipenem and Propene, administered for at least 10 to 14 days. After that the prophylaxis should be assessed and it may be continued under a changed regimen. The lab tests as well as imaging methods are continuously monitored and the administration of antibiotics is adequately adjusted. If infection is demonstrated antibiotics are indicated based on standard microbiological parameters and clinical relationships. Any surgical intervention (nephrectomy) is delayed as long as possible. Indication would concern impaired condition despite intensive care, e.g. newly developed sepsis, pains, food intake inability or other complications, such as bleeding. Recently the open surgical nephrectomy is confronted with derivations of infected necrosis via mini‑invasive procedures, such as transcutaneous drainage, laparoscopic video ‑ assisted nephrectomy or endoscopic transgastric nephrectomy. The methods may be combined. Mortality and morbidity of mini‑invasive procedures are comparably significantly lower.
Key words:
acute pancreatitis – acute pancreatitis treatment – infections – antibiotic prophylaxis – interventions in acute pancreatitis
Autoři: J. Špičák
Působiště autorů: Klinika hepatogastroenterologie IKEM Praha, přednosta prof. MU Dr. Julius Špičák, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(7): 597-605
Kategorie: 80. narozeniny prof. MUDr. Marie Brodanové, DrSc.
Souhrn
Akutní pankreatitida zůstává potenciálně velmi závažným onemocněním. Těžká pankreatitida (do 20 %) je podle nových klasifikačních schémat podmíněna strukturálními změnami a orgánovým selháním. Prvním kritickým momentem je rychlý vznik pankreatické nekrózy, druhým její obvykle opožděná infekce. Pankreatitida se dále může komplikovat nejčastěji jinými infekčními komplikacemi, krvácením, kompartment syndromem a dekompenzací komorbidit. V časné fázi je nejdůležitějším opatřením aktivní expanze krevního volumu a léčba orgánové dysfunkce. Paušální antibiotická profylaxe byla odmítnuta a je indikována pouze u známek přetrvávajícího oběhového selhávání a syndromu zánětlivé odpovědi. Variantami antibiotických režimů jsou obvykle ciprofloxacin s metronidazolem, imipenem a meropenem podávané nejméně 10 – 14 dnů. Poté je třeba profylaxi vyhodnotit a případně v ní i pokračovat změněným režimem. Průběžně se vyhodnocují jak výsledky odběrů, tak zobrazovacích metod a podávání antibiotik se adekvátně upravuje. V případě průkazu infekce se nasazují antibiotika podle obvyklých mikrobiologických parametrů a klinických souvislostí. Případný operační zákrok (nekrektomie) se maximálně oddaluje. Indikací je zhoršení přes intenzivní péči, např. nově vzniklá sepse, bolesti, neschopnost přijímat potravu či komplikace, jako např. krvácení. V poslední době se proti otevřené chirurgické nekrektomii prosazují derivace infikované nekrózy miniinvazivními postupy, jako jsou transkutánní drenáž, laparoskopická videoasistovaná nekrektomie a endoskopická transgastrická nekrektomie. Metody lze kombinovat. Mortalita i morbidita miniinvazivních přístupů je ve srovnání významně nižší.
Klíčová slova:
akutní pankreatitida – léčba akutní pankreatitidy – infekční komplikace – antibiotická profylaxe – intervence u akutní pankreatitidyÚvod
Akutní pankreatitida je akutní zánětlivé onemocnění primárně postihující pankreas a následně orgány dalších systémů. Typicky vzniká bezprostředně po vyvolávající příčině a její průběh je variabilní, nicméně s tendencí ke kompletní reparaci. Vztah k chronické pankreatitidě je stále předmětem dohadů. Jisté je, že akutní abúzus alkoholu pankreatitidy nevyvolává. Při chronickém alkoholizmu epizoda pankreatitidy obvykle nenásleduje ebrietu, ale vykazuje všechny rysy akutního onemocnění. Z tohoto pohledu jsou nejčastější příčinou akutní pankreatitidy cholelitiáza a alkoholizmus. Další určené příčiny (do 20 % onemocnění) zahrnují některé léky, endoskopickou retrográdní cholangiopankreatografii, hypertriglyceridemii, závažné operace a u přibližně 10 % zůstává etiologie neznámá.
Incidence pankreatitidy souvisí s alkoholizmem, výskytem cholelitiázy a zdokonalováním diagnostiky. Zdá se, že se zvyšuje a v jednotlivých studiích se pohybuje mezi 4 a 45 na 100 000 obyvatel za rok.
Klinický průběh
Průběh akutní pankreatitidy je z pohledu předchorobí a prvních symptomů v podstatě nepředvídatelný. U přibližně 80 % je průběh lehký a nemoc spontánně regreduje během několika dnů. U asi 20 % nemocných se rozvine těžká akutní pankreatitida se stále vysokou mortalitou blížící se v jednotlivých studiích až 40 %. Organickým substrátem těžké pankreatitidy je pankreatická nekróza, která může postihovat i okolní struktury. Je plně rozvinuta do několika dnů od počátku onemocnění. Její vznik doprovází počáteční těžký klinický stav, jehož patofyziologickým podkladem je prozánětlivá imunní reakce (systemic inflammatory response syndrome – SIRS). Může jej doprovázet selhání 1 nebo více orgánů, která se jen vzácně vyskytují u akutní ne ‑ nekrotické pankreatitidy. Mortalita nemocných s orgánovým selháním se pohybuje kolem 40 %. Ještě horší prognózu mají nemocní s perzistujícím a multiorgánovým selháním. Druhou událostí zásadně ovlivňující průběh akutní pankreatitidy je infekce. V průběhu těžkého onemocnění může dojít k běžné infekci postihující jiné orgány, jako je bronchopneumonie nebo uroinfekce. Nejčastěji komplikují počátek onemocnění. Se zpožděním nejčastěji 2 – 4 týdnů může dojít k infekci pankreatické nekrózy. Dochází k ní procesem zvaným bakteriální translokace bakteriemi střevního lumen. Ta je do určité míry fyziologická a patologického rozměru nabývá při těžkých stavech, jako jsou vedle pankreatitidy např. polytraumata a popáleniny. U pankreatitidy bakterie kolonizují locus rezistentiae minoris, což je zde nekrotický pankreas. Na vzniku infekčních komplikací se jistě podílí snížená imunita, což ovšem nevysvětluje interval mezi nejčastějším výskytem mimo ‑ pankreatických infekcí a infikovanou nekrózou pankreatu. Klinicky se infikovaná nekróza projevuje recidivou sepse a perzistencí či znovuobjevením orgánového selhání [1].
Diagnostika a prognostika
Pro diagnózu akutní pankreatitidy je klíčová epigastrická bolest a nejméně 3násobné zvýšení amylázy nebo lipázy. Pankreatitida ovšem může být i bezbolestná a elevace enzymů může během několika dnů ustoupit, takže na možnost pankreatitidy je především nutné pomyslet. Pro diagnózu nekrotizující pankreatitidy je určující zobrazení nekrózy kontrastní počítačovou tomografií. Je vhodné ji provádět až od 5. dne, protože dříve se nekróza nemusí znázornit. Nekrózu, případně kolekce tekutiny je v jednotlivých případech možné sledovat CT, magnetickou rezonancí i ultrasonografií. Univerzální návod nelze podat, magnetická rezonance vyžaduje spolupráci, naopak není zatížena zářením a nejlépe posoudí strukturu tekutinových ložisek. Při zjevně nekomplikovaném průběhu není CT ani magnetickou rezonanci nutné indikovat.
Je patrná až umanutá snaha o klasifikaci pankreatitidy. Předem je třeba si ujasnit, k čemu ji vlastně potřebujeme. Vytváří jednak komunikační schéma, za druhé by měla poskytovat návod pro rozhodování.
Ransonovo skóre bylo opisováno z publikace na publikaci, aniž by se v Čechách kdo namáhal alespoň standardizovat historické jednotky jednotlivých parametrů. Obsahuje 11 kritérií a klinickému průběhu odpovídá ve svých hraničních polohách. Podobně je koncipováno glasgowské skóre. Některá recentní skóre jsou jednodušší. Bedside Index for Severity of Acute Pancreatitis (BISAP) obsahuje 5 proměnných: N urey, stav vědomí, SIRS, věk a pleurální efuze. Skóre 3, 4 a 5 odpovídá mortalita 5,3 %, 12,2 % a 22,5 %. Dalším jednoduchým skóre je Harmless Acute Pancreatitis Score (HAPS). Zvažují se 3 parametry, které je možné určit hned po přijetí: peritoneální dráždění, hematokrit a kreatinin [2].
Tzv. APACHE skóre bylo vyvinuto za účelem hodnocení a monitorování kriticky nemocných. Verze z roku 1985, tzv. APACHE II, zahrnuje preexistující vitální faktory a kritéria, která se snadno hodnotí a lze je libovolně opakovat (teplota, tlak, dech, pulz, stav vědomí, krevní plyny, elektrolyty, hematokrit, leukocyty, kreatinin). Dobře slouží původnímu účelu monitorace závažného stavu, pokud jde o rozhodování o další léčbě (intervence), zvažuje se v kontextu dalších okolností.
Atlantský konsenzus byl výsledkem jednání předních pankreatologů z různých oborů v Atlantě na počátku 90. let minulého století. Těžkou pankreatitidu podmiňuje přítomností závažných systémových nebo lokálních komplikací, jako oběhové, renální a respirační selhání, závažné změny koagulace, hypokalcemie a krvácení do GIT. Lokální komplikace zahrnují nekrózu, absces a pseudocystu. Námitky směřují zejména proti velmi různé váze jednotlivých kritérií.
Významným přínosem ve smyslu posouzení strukturálních změn je CT, nekrózu však spolehlivě určí až po 4. dnu od počátku onemocnění.
Post‑atlantská klasifikační skóre zvažují v různých kombinacích strukturální změny na zobrazovacích vyšetřeních nebo infekci a orgánové selhání. Průběh klasifikují do 3 či 4 kategorií: lehká, středně těžká, těžká případně kritická pankreatitida. Nezdá se, že by kterékoliv z uvedených schémat dosáhlo podobně univerzálního přijetí jako např. Child ‑ Pughova klasifikace u jaterní dysfunkce a jejich vztah k rozhodování o dalším postupu je třeba následně rozvést: v I. fázi je třeba rozlišit lehkou pankreatitidu s pravděpodobným nekomplikovaným průběhem. Taková vyžaduje pouze běžnou bilanční léčbu vycházející z obvyklých laboratorních parametrů a symptomů a může být hospitalizována na jakékoliv metabolické jednotce. Naopak těžká pankreatitida s protrahovaným orgánovým selháním vyžaduje hospitalizaci ve specializovaném centru, kde jsou k dispozici veškeré diagnostické, terapeutické eliminační a invazivní metody včetně specializované chirurgie. Z tohoto pohledu je ve smyslu určení tíže pankreatitidy důležitější specificita než senzitivita. Spíše než klasifikační skóre je důležité pro klíčové kroky v terapeutických postupech, kterými jsou nasazení antibiotik a intervence, posuzování jednotlivých parametrů [3,4].
Nejasnost v posuzování tíže pankreatitidy vyplývá z problematické definice. Lehká pankreatitida je ta, jejíž symptomy rychle vymizí, neohrožuje komplikacemi a nevyžaduje intervenci. Posuzování těchto parametrů je ovšem možné až retrospektivně, takže tíži v průběhu je třeba posuzovat podle zástupných kritérií.
Léčba
V důsledku akutní pankreatitidy se uvolňují cytokiny a další prozánětlivé mediátory, což vede k vazodilataci, zvýšené permeabilitě kapilár, snížení intravaskulárního objemu a z toho vyplývající hypoperfuzi a hypoxii důležitých orgánů. Recentní studie prokázaly zásadní význam udržení perfuze cévního řečiště střeva a pankreatu v prevenci orgánové ischemie, reperfuzního poškození, bakteriální translokace a usídlení bakterií v nekrotickém pankreatu. Nezbytným léčebným opatřením již v prvních 24 hod je agresivní tekutinová resuscitace, jejíž průběh zrcadlí hemokoncentrace. Tato bilanční léčba musí být průběžně monitorována. Vysoká spotřeba tekutiny během prvních 24 hod je rizikovým faktorem orgánového selhání. Dvě retrospektivní studie prokázaly účinnost agresivního podávání tekutin. Podání 1/ 3 během prvních 24 hod z celkového objemu podaného během 72 hod znamenalo snížení SIRS, orgánového selhání, kratší hospitalizaci a nížší mortalitu. Doporučuje se 250 – 300 ml/ hod nebo tolik, aby diuréza byla více než 0,5 ml/ kg/ hod, následující 1 000 – 2 000 ml bolus. Zvláštní pozornost zasluhují nemocní s dalšími rizikovými faktory, jako jsou polymorbidita, obezita a vyšší věk. Dvě studie naopak zjistily, že agresivní resuscitace krystaloidy může být škodlivá, avšak většina odborníků soudí, že příčinou jsou metodické problémy definice pulmonálních komplikací a kritéria žádoucí hemodiluce. První byla retrospektivní analýzou 99 nemocných a ukázala, že ve skupině s přísunem více než 4 l během prvních 24 hod hospitalizace byl vyšší výskyt respiračních komplikací a větší potřeba pobytu na jednotce intenzivní péče. Respirační komplikace však nebyly systematicky definovány, i když nemocní s edémem plic byli vyloučeni. Další randomizovaná studie pocházející z Číny zjistila, že rychlá oběhová resuscitace byla spojena s vyšším výskytem sepse a mortality. Nicméně proti názoru většiny odborníků agresivní podávání krystaloidů přesáhlo 72 hod a maximum bylo aplikováno během druhých 24 hod. Jako kritérium sloužilo udržení hodnoty hematokritu pod 35 %, zatímco se soudí, že vhodnějšími parametry jsou výdej moči, tlak, pulz, normalizace centrálního žilního tlaku a mírný pokles hematokritu [5,6]. Složení krystaloidů zkoumaly 2 studie, z nichž 1 neshledává rozdíly, zatímco další doporučuje Ringerův laktát [7,8].
Infekční komplikace a antibiotická profylaxe
Vzhledem k významnému podílu infekčních komplikací na morbiditě a mortalitě je její prevence a léčba významným zvažovaným opatřením.
Různými aspekty antibiotické léčby se zabývá mnoho studií. Od 40. let 20. století byly publikovány studie o celkem 32 antibiotikách a zkoumala se zejména farmakokinetika. Zjišťoval se průnik antibiotik do pankreatu na zvířecích modelech i u člověka ve vzorcích pankreatické tkáně a v pankreatickém sekretu získaném u člověka odběry při ERCP či ze sekretu píštělí.
Za mezník se považuje práce Büchlera et al, kteří zkoumali koncentraci jednotlivých antibiotik v pankreatickém resekátu ve srovnání s koncentrací v séru. Za nejúčinnější byly shledány ofloxacin, ciprofloxacin a imipenem [9].
V prvních klinických kontrolovaných studiích se podával ampicilin bez průkazu snížení letality v léčených skupinách. Tyto výsledky vedly k odmítnutí paušální antibiotické profylaxe, jejímž jediným důsledkem byla selekce rezistentních kmenů. Pozdější námitky se týkaly metodiky studií, které zahrnovaly všechny nemocné s akutní pankreatitidou bez ohledu na její tíži. Dnes víme, že u takto koncipovaných studií není možné stanovit relevantní cíle, studie a výsledky jsou nutně nehodnotitelné [10].
Jsou známy výsledky 14 kontrolovaných studií u těžké pankreatitidy, z nichž 6 prokázalo úspěšnost antibiotické profylaxe a ostatní nikoliv. Dvě z těchto studií byly dvouslepé a účinnost profylaxe nepotvrdily. Nejčastěji podávanými antibiotiky byly ciprofloxacin, metronidazol, imipenem a meropenem a doba trvání léčby byla 2 týdny [11 – 24].
Sami jsme v prospektivní kontrolované studii podávali u těžké pankreatitidy ciprofloxacin s metronidazolem a dále meropenem. Celkem jsme zařadili 104 nemocné a přínos antibiotické profylaxe jsme neprokázali v žádném parametru [25].
Výsledky studií postupně hodnotilo několik metaanalýz, jejich závěry se vyvíjely v souvislosti se zařazováním nových metodicky kvalitnějších studií. Golubova metanalýza (1998) zpracovala dosud publikované studie bez redukce na prokázanou pankreatickou nekrózu a prokázala statisticky významnou redukci mortality (5,3 % vs 18,2 %, OR 0,25) s přispěním Sainiovy studie. Další metanalýza byla publikována o rok později, Cochrane metaanalýza v roce 2006. Všechny se shodly na doporučení antibiotické profylaxe u těžké pankreatitidy [26 – 28].
Mazaki et al výsledky našeho multicentrického snažení a antibiotickou profylaxi odmítli [29]. Cochrane metaanalýza z roku 2010 zpracovala výsledky studií Dellingera, Rokkeho, Isenmanna, Nordbacka, Pederzoliho, Schwarze a Sainia, přestože poslední 2 jmenovaní jsou metodicky diskutabilní. Ve všech parametrech: mortalita, infikovaná pankreatická, peripankreatická a nepankretická nekróza a nutnost chirurgické léčby, prokázala pouze pozitivní trend, který nedosáhl statistické významnosti. Při analýze podskupin beta‑laktamová antibiotika vs chinolony a metronidazol byly lepší výsledky dosaženy u první z nich, ale ani zde rozdíl nedosáhl statistického významu. Přes varovné výsledky jiných studií mykotické superinfekce nebyly významným problémem [30].
Následovala metaanalýza Wittau et al, zahrnující 14 studií a celkem 841 nemocných. Profylaktické podání antibiotik neprokázalo pozitivní vliv na žádný sledovaný parametr: mortalita (RR 0,74), incidence infikované pankreatické nekrózy (RR 0,78), incidence non‑pankreatické infekce (RR 0,70) a chirurgické intervence (RR 0,93) [31].
Poslední nám známá metanalýza Yao et al zahrnula 9 studií a 564 nemocných. Prokázala významnou redukci vzniku infikované nekrózy (p = 0,04), nikoliv však mortality (p = 0,1) a potřeby chirurgické intervence (p = 0,17) [32].
Aktivní antibiotickou profylaxi relativizují údaje o kandidové sepsi s velmi špatnou prognózou. V 6 studiích se vyskytla fungální infekce u 12 – 41 % nemocných s mortalitou 54 – 84 %, která byla ve 3 studiích statisticky významně vyšší než u bakteriální infekce samotné [33]. Názory na případnou profylaxi mykotické superinfekce profylaxí triazolovými deriváty (fluconazol) se různí. Ve studii He et al se snížil podíl mykotické superinfekce z 30 % na 16 %, ale ani on ani další neprokázali vliv na mortalitu [34,35]. Podobně jako u bakteriální infekce hrozí u antimykotické profylaxe selekce rezistentních kmenů.
Přibližně do poloviny minulé dekády byl obecně přijímán názor, že infikovanou nekrotizující pankreatitidu nelze zvládnout bez nekrektomie a v případě jejího průkazu byla operace absolutní indikací. Průlomem byla práce Rünziho et al, která prokázala, že při dlouhodobé antibiotické léčbě není operace nezbytně nutná. Z 28 nemocných bylo operováno pouze 12 v průměru 36 dnů od přijetí (mortalita 12 %) [36]. V poslední dekádě je též trendem oddalování načasování operace a uplatňují se miniinvazivní přístupy. V důsledku změny strategie léčby se také relativizuje význam mikrobiologického vyšetření punktátu pankreatu. Jsou pracoviště, která tuto metodu stále používají poměrně často, jiná ji odmítají a o případné intervenci se rozhodují podle klinického stavu a nepřímých ukazatelů infekce [37].
V posledních letech se atraktivní léčebnou alternativou antibiotik stala probiotika, případně pre ‑ a synbiotika. Probiotika mají hypoteticky napravovat střevní dysmikrobii. Zejména preklinické studie prokázaly, že probiotika inhibují proliferaci patogenních bakteriálních kmenů, zpevňují intestinální bariéru, a tím snižují translokaci a modulují imunitu, čímž snižují riziko infekce. Prebiotika ovlivňují nutrici, mikrobiom a působení probiotik. Přínos byl zaznamenán u dráždivého tračníku, cestovatelského průjmu, ale i u nespecifických střevních zánětů. U akutní pankreatitidy bylo publikováno na 48 studií všeho druhu, 7 klinických s náročnější metodologií. Slibná holandská studie s 296 probandy musela být přerušena pro vysokou mortalitu v aktivní skupině v důsledku střevní nekrózy. Střevní mikrobiom a jeho ovlivnění je univerzální téma, věčnou otázkou je také relevance jednotlivých parametrů a souvislostí [38].
Recentně byla publikována metaanalýza studií s podáváním pro‑, pre‑, a synbiotik. Konstatovala heterogenní soubor a neprokázala vliv na žádný obvyklý relevantní parametr významu infekčních komplikací [39].
Intervence u akutní pankreatitidy
Patogeneze těžké nekrotizující pankreatitidy zahrnuje jako 1 z kritických momentů infekci pankreatické nekrózy. Obecně platí, že úspěšná léčba bakteriální infekce orgánových nekróz je podmíněna derivací infekce drenáží, případně odstraněním nekrotické tkáně. V pankreatologii byl tento přístup na přelomu 80. a 90. let minulého století přesně formulován několika významnými osobnostmi, jejichž příjmení shodou okolností začíná na B:Braedly, Beger a Büchler (viz výše i dále). Po infekci pankreatické nekrózy se aktivně pátralo. V případě podezření na infekci se prováděla biopsie tenkou jehlou na mikrobiologické vyšetření a v případě pozitivity se automaticky operovalo. Platný operační postup spočíval v tupém odstranění nekrotických tkání v několika modifikacích. Konzervativní postup se považoval za rouhačství, které si dovolili jako první porušit Rünzi et al [36]. Vysoká mortalita u časných operací a úspěchy konzervativní antibiotické léčby vedly ke změně konceptu. Biopsie pankreatu se aktivně neindikuje a klíčovou roli v indikaci případné invaze hraje klinika a výsledky zobrazovacích metod. V případě sepse a podezření na infikovanou nekrózu se protahuje antibiotická léčba s oddálením pankreatické intervence optimálně po 3. týdnu od počátku onemocnění, kdy výkon usnadňuje a riziko komplikací snižuje demarkace nekrotické tkáně. Dalšími indikacemi k operaci třeba i bez průkazu infekce jsou komplikace např. krvácení a tzv. kompartment syndrom s intraabdominální hypertenzí.
Standardní chirurgická léčba
Chirurgická léčba v pečlivě indikovaných případech zůstává standardem. Nekrektomie se provádí v několika variantách. Při uzavřené nekrektomii s drenáží se po vybavení nekróz z dalších incizí zavádí 2 – 12 drénů. Vedle facilitace drenáže je jejich zamýšleným účinkem komprese. U otevřené nekrektomie s otevřenou kompresí není incize uzavřena. Při nekrektomii s forsírovanou laváží se zavádí z obou stran břicha 2 a více drénů a provádí se laváž až 10 – 30 l během několika dnů. Drény se vyjímají za 2 – 3 týdny. Opakovaná nekrektomie znamená, že se vyjmutí nekrotického obsahu provádí na etapy při neuzavřené incizi. Jednoznačný důvod k preferenci jedné metody chybí, protože srovnávací studie ze zjevných důvodů neexistují. Nejčastějšími komplikacemi jsou vedle krvácení a sekundární infekce pankreatické píštěle a kýly v jizvě. U otevřené a opakované nekrektomie je menší riziko pooperační sepse. Na druhé straně po opakovaných laparotomiích je větší počet komplikací, jako fistul, krvácení, hernií a poruch evakuace žaludku v přímé souvislosti s počtem re‑laparotomií. Srovnání jednotlivých studií jednoznačně ukazuje, že oddálení načasování operace je provázeno lepší prognózou. Podle retrospektivní unicentrické studie Besselinka et albyla mortalita u operovaných do 2 týdnů 75 %, operovaných v intervalu 2 – 4 týdnů 45 % a s delším odstupem 8 % [40]. Nejednotnost přístupu, která se zrcadlí zejména v načasování operace a poměru pankreatické infekce, ukazuje tab. 1 [41 – 58]. Je také patrné, že u řady byť specializovaných pracovišť není operace u akutní pankreatitidy běžným zákrokem. Velmi poučná je rozsáhlá retrospektivní, avšak výborně designovaná studie z Rostocku. V letech 2000–2003 autoři aktivně pátrali po pankreatické infekci. U 20 nemocných s pozitivní FNA (skupina 1) byla provedena operace, u 12 do 3 týdnů. Mortalita byla 45 %. V dalších letech po změně přednosty přešli na zdrženlivý přístup: ani v případě sepse se bakteriologické vyšetření pankreatického punktátu neprovádělo a chirurgická léčba byla indikována jen u komplikací. Operaci se vyhnulo 14 z 24 nemocných a mortalita byla 8,3 % (skupina 2, tab. 2) [59].
Tab. 1. Různé techniky chirurgické léčby se liší načasováním, poměru pankreatické infekce i výsledky. 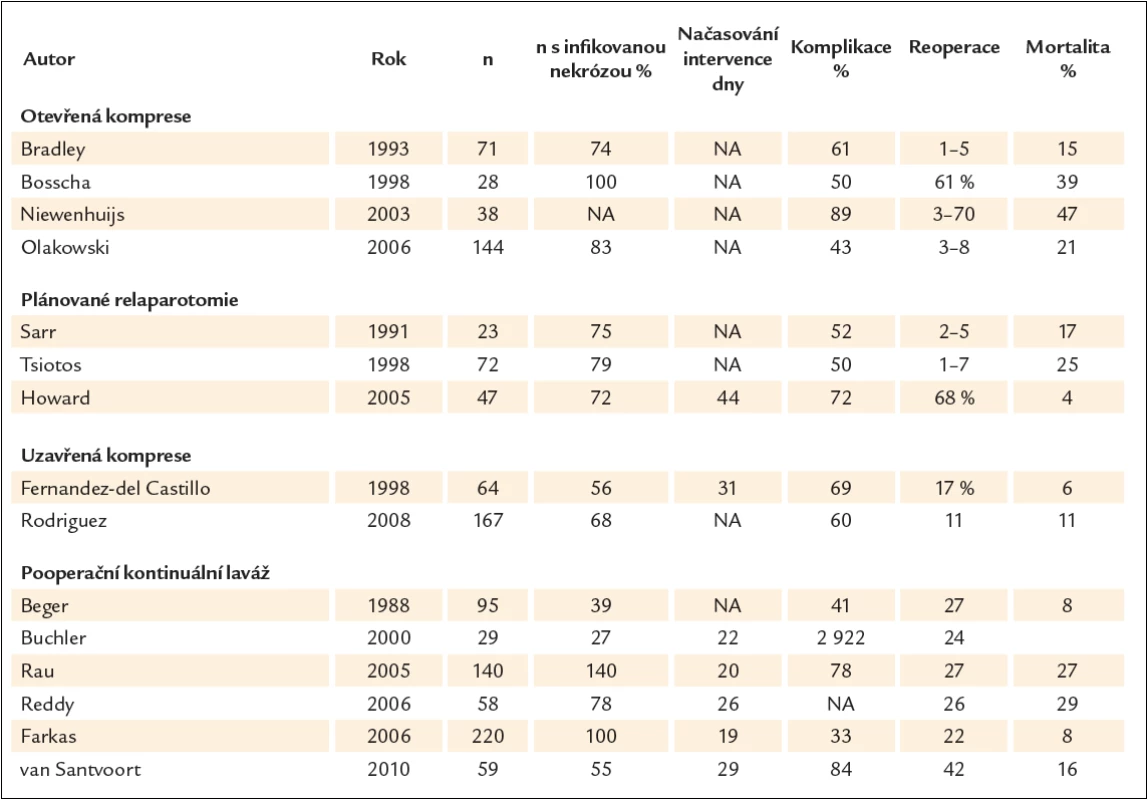
Tab. 2. Srovnání výsledků chirurgické léčby ve 2 obdobích. V prvním se v případě zjištění pankreatické infekce automaticky operovalo, ve druhém se operovalo jen při vzniku komplikací. 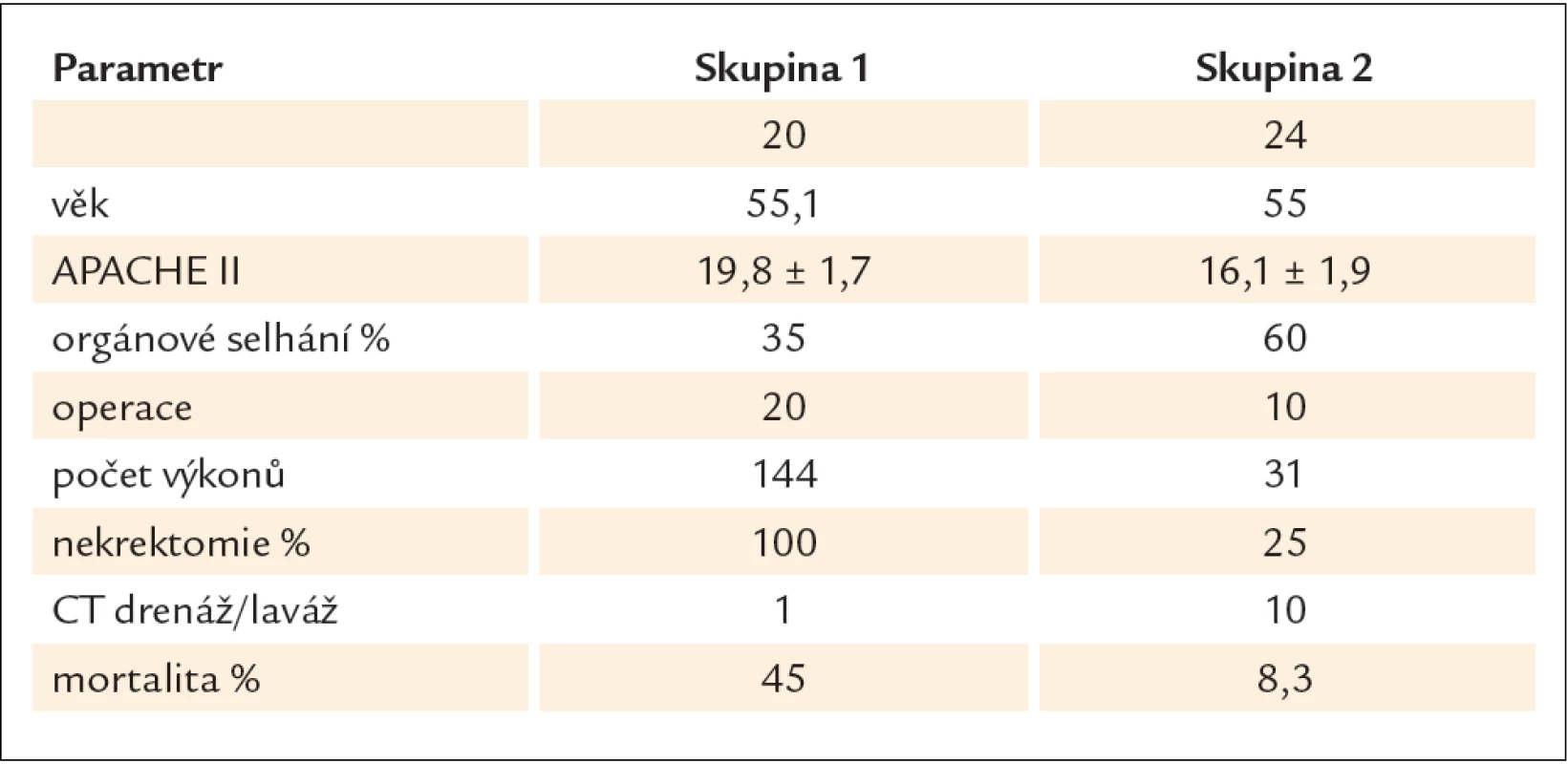
Minimálně invazivní nekrektomie
Předpokládanou výhodou je menší zátěž pro pacienta a snížené riziko lokálních komplikací. Strategie je stejná jako při otevřené nekrektomii: drenáž, laváž, případně odstranění nekróz. Přístup je možný z retroperitonea, transperitoneální přes ligamentum gastrocolicum a transluminální laparoskopicky či endoskopicky přes stěnu žaludku a hlediska zvoleného instrumentu pod kontrolou počítačové tomografie, endoskopický a laparoskopický. Miniinvazivní výkony nelze provádět v případě urgentní potřeby a jejich součástí není cholecystektomie. Radiologická drenáž se dosahuje z transperitoneáloního, retroperitoneálního a transmurálního přístupu, kterému se většina odborníků snaží vyhnout [60 – 66]. Drény mají mnohočetné otvory usnadňující vymývání zkolikvovaného obsahu. Preferují se drény o síle 20 – 30 F. Denně se monitoruje odpad a v pravidelných intervalech se provádí jejich laváž. Denně se hodnotí účinnost drenáže a ta se adekvátně upravuje zaváděním paralelních drénů či jejich výměnou. Při endoskopickém transgastrickém přístupu se nekróza lokalizuje pomocí endoskopické ultrasonografie. Incize stěny žaludku se dilatuje balónkem a zajišťuje vícečetnými stenty. Po dilataci se endoskopem vizualizuje nekrotická dutina a odstraňují nekrotické hmoty košíčkem a síťkou. Výkony jsou zdlouhavé a běžnou komplikací je krvácení. Mezi jednotlivými etapami se kavita lavážuje. Přístup usnadňuje aproximující široký metalický stent, který otvor dokonale zajistí a obě lumen přiblíží a stabilizuje [67 – 74]. Laparoskopická nekrektomie z předního přístupu se vede retrogastrickým, retrokolickým a transmezokolickým přístupem [75,76]. Retroperitoneální debridement pod kontrolou videa (video‑assisted retroperitoneal debridement – VARD) se provádí z přístupu dorzo ‑ laterálního. Drén se nejdříve zavádí pod kontrolou počítačovou tomografií. Incize se provádí subkostálně a dilatuje digitálně. Pod laparoskopickou kontrolou se nekrotická tkáň odstraňuje grasperem. Zavádějí se i drény z paralelních incizí. Rizikem je vedle krvácení kolonická interpozice (tab. 3) [77 – 81].
Tab. 3. Miniinvazivní léčba u akutní nekrotizující pankreatitidy. 
Jednotlivé intervenční metody nejsou identické po stránce technické ani taktické. Miniinvazivní operace nelze provádět při urgentních komplikacích a nelze je doplnit o současnou cholecystektomii. Miniinvazivní výkony se optimálně provádějí u kolikvovaných a ohraničených nekróz (walled ‑ of pancreatic necrosis). Samotná transabdominální drenáž pod radiologickou (CT) kontrolou neumožňuje odstranění pevných nekróz. Metody lze kombinovat. Při tzv. step ‑ up approach se přibližně 12. den provádí transabdominální drenáž s laváží a s odstupem navazuje miniinvazivní nekrektomie, v případě dalšího zhoršení nekrektomie otevřená. Výkony lze kombinovat i v opačném pořadí. V současné době se problematice systematicky věnuje několik pracovišť (bohužel nikoliv u nás) a probíhá několik srovnávacích studií. Mininvazivní metody dnes činí až vysoce přes 50 % všech intervencí a jejich výsledky naznačují zlepšenou prognózu. Podle recentní holandské studie step ‑ up approach vedl ve srovnání se zevní drenáží k redukci součtu komplikací z 69 % na 40 %, snížení dlouhodobých komplikací, jako diabetu a kýly v jizvě, jakož i redukci nákladů o 12 % [82]. Další opět holandská studie srovnávala miniinvazivní a otevřenou nekrosektomii. V součtu klinických cílových parametrů byl rozdíl 20 % vs 80 % (p = 0,03), ve vzniku nového orgánového selhání 0 % vs 50 % (p = 0,03) a v komplikacích pankreatických fistul 10 % vs 70 % (p = 0,02) [83]. Potenciál miniinvazivních metod a vhodný algoritmus ilustruje multicentrická americko‑kanadská studie. Po zjištění infikované kolikvované pankreatické nekrózy se zaváděla drenáž pod CT kontrolou. Při redukci kolekce tekutiny o 75 % a více (9 nemocných) to byla intervence konečná. Z ostatních 31 nemocných se u 6 prováděla otevřená nekrektomie. U 25 se prováděla miniinvazivní retroperitoneální nekrektomie po 30 dnech a z nich u 6 se přecházelo na nekrektomii otevřenou. U většiny nemocných (81 %) postačila 1 revize, mortalita byla 2,5 %, krvácení vzniklo u 7,5 % a fistula u 17,5 % [84].
Závěr
Úspěšnou léčbu podmiňuje komplexní diagnostika a klasifikace. V časné fázi je nejdůležitějším opatřením aktivní expanze krevního volumu a léčba orgánové dysfunkce. Infekce je v této fázi obvykle mimopankreatická. V další fázi je kritickým momentem průběhu infekce pankreatické nekrózy. Panuje shoda, že antibiotická profylaxe není v žádném případě indikována u lehké pankreatitidy. U těžké pankreatitidy je antibiotická profylaxe předmětem individuální volby. Doporučuje se u známek přetrvávajícího oběhového selhávání a syndromu zánětlivé odpovědi. Do přelomu milénia přetrvávala hypotéza, že infekci pankreatické nekrózy lze řešit jedině neprodleným chirurgickým zákrokem. Jednotlivé studie byly zatíženy vysokou mortalitou. V dalších letech převládl koncept zdůrazňující komplexní konzervativní léčbu včetně aktivního podávání krystaloidů a antibiotik. Operace, která se maximálně oddaluje, je nutná u méně než 50 % nemocných. Z intervencí se stále více uplatňují miniinvazivní přístupy.
prof. MU Dr. Julius Špičák, CSc.
www.ikem.cz
e‑mail: julius.spicak@ikem.cz
Doručeno do redakce: 2. 5. 2013
Zdroje
1. Besselink MG, van Santvoort HC, Boermeester MA et al. Timing and impact of infections in acute pancreatitis. Br J Surg 2009; 96 : 267 – 273.
2. Bradley EL 3rd. A clinically based classification for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta GA, September 11 – 13, 1992. Arch Surg 1993; 128 : 586 – 590.
3. Zaheer A, Singh VK, Qureshi RO et al. The revised Atlanta classification for acute pancreatitis: updates in imaging terminology and guidelines. Abdom Imaging 2013; 38 : 125 – 136.
4. Špičák J. Akutní pankreatitida. Praha: Grada 2005.
5. Eckerwall G, Olin H, Andersson B et al. Fluid resuscitation and nutritional support during severe acute pancreatitis in the past: what have we learned and how can we do better? Clin Nutr 2006; 25 : 497 – 504.
6. Mao EQ, Fei J, Peng YB et al. Rapid hemodilution is associated with increased sepsis and mortality among patients with severe acute pancreatitis. Chin Med J 2010; 123 : 1639 – 1644.
7. Haydock MD, Mittal A, Wilms HR et al. Fluid therapy in acute pancreatitis: anybody’s guess. Ann Surg 2013; 257 : 182 – 188.
8. Fisher JM, Gardner TR. The “golden hours” of management in acute pancreatitis. Am J Gastroenterol 2012; 107 : 1146 – 1150.
9. Büchler MW, Malfertheiner P, Friess H et al. Human pancreatic tissue concentration of bactericidal antibiotics. Gastroenterology 1992; 103 : 1902 – 1908.
10. Finch WT, Sawyers JL, Schenker SA. A prospective study to determine the efficacy of antibiotics in acute pancreatitis. Ann Surg 1976; 183 : 667 – 672.
11. Pederzoli P, Bassi C, Vesentini S et al. A randomized multicenter clinical trial of antibiotic prophylaxis of septic complications in acute necrotizing pancreatitis with imipenem. Surg Gynecol Obstet 1993; 176 : 480 – 483.
12. Delcensiere R, Yzet T, Ducroix JP. Prophylactic antibiotics in treatment of severe acute alcoholic pancreatitis. Pancreas 1996; 13 : 198 – 201.
13. Sainio A, Kemppainen E, Puolakkainen Pet al. Early antibiotic treatment in acute necrotising pancreatitis. Lancet 1995; 346 : 663 – 667.
14. Schwarz M, Isenmann R, Mayer H et al. Antibiotic use in necrotizing pancreatitis. Results of a controlled study. Dtsch Med Wochenschr 1997; 122 : 356 – 361.
15. Luiten EJ, Hop WC, Lange JF et al. A controlled clinical trial of selective decontamination for the treatment of severe acute pancreatitis. Ann Surg 1995; 222 : 57 – 65.
16. Takeda K, Matsumo S, Sunamura M et al. Continuous regional arterial infusion of protease inhibitor and antibiotics in acute necrotizing pancreatitis. Am J Surg 1996; 171 : 394 – 398.
17. Mai G, Gloor B, Uhl W et al. Routine antibiotic prophylaxis in necrotizing pancreatitis increased gram ‑ positive infectious. Digestion 1999; 60 : 360 – 389.
18. Bassi C, Falconi M, Talamini G et al. Controlled trial of pefloxacin versus imipenem in severe acute pancreatitis. Gastroenterology 1998; 115 : 1513 – 1517.
19. Manes G, Uomo I, Menchise A et al. Timing of antibiotic prophylaxis in acute pancreatitis: a controlled randomized study with meropenem. Am J Gastroenterol 2006; 101 : 1348 – 1353.
20. Isenmann R, Rünzi M, Kron M et al. Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo ‑ controlled, double‑blind trial. Gastroenterology 2004; 126 : 997 – 1004.
21. Dellinger EP, Tellado JM, Soto NE et al. Early antibiotic treatment in severe acute necrotizing pancreatitis: a randomized, double‑blind, placebo ‑ controlled study. Ann Surg 2007; 245 : 674 – 683.
22. Røkke O, Harbitz TB, Liljedal J et al. Early treatment of severe pancreatitis with imipenem: a prospective randomized clinical trial. Scand JGastroenterol 2007; 42 : 771 – 776.
23. Xue P, Deng LH, Zhang ZD et al. Effect of antibiotic prophylaxis on acute necrotizing pancreatitis: results of a randomized controlled trial. J Gastroenterol Hepatol 2009; 24 : 736 – 742.
24. García‑Barrasa A, Borobia FG, Pallares R et al. A double‑blind, placebo ‑ controlled trial of ciprofloxacin prophylaxis in patients with acute necrotizing pancreatitis. J Gastrointest Surg 2009; 13 : 768 – 774.
25. Spicak J, Hubaczova M, Antos F et al. Antibiotic prophylaxis of infectious complications in severe acute pancreatitis: Preliminary results of controlled study. Digestion 2000; 61: A287.
26. Golub R, Siddiqi F, Pohl D. Role of antibiotics in acute pancreatitis: a meta‑analysis. J Gastrointest Surg 1998; 2 : 496 – 503.
27. Sharma VK, Howden CW. Prophylactic antibiotic administration reduces sepsis and mortality in acute necrotizing pancreatitis: a meta‑analysis. Pancreas 2001; 22 : 28 – 31.
28. Villatoro E, Bassi C, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev 2006; 4: CD002941.
29. Mazaki T, Ishii Y, Takayama T. Meta‑analysis of prophylactic antibiotic use in acute necrotizing pancreatitis. Br J Surg 2006; 93 : 674 – 684.
30. Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev 2010; 5: CD002941.
31. Wittau M, Mayer B, Scheele J et al. Systematic review and meta‑analysis of antibiotic prophylaxis in severe acute pancreatitis. Scand JGastroenterol 2011; 46 : 261 – 270.
32. Yao L, Huang X, Li Y et al. Prophylactic antibiotics reduce pancreatic necrosis in acute necrotizing pancreatitis: a meta‑analysis of randomized trials. Dig Surg 2010; 27 : 442 – 449.
33. Gloor B, Müller CA, Worni M et al. Pancreatic infection in severe pancreatitis: the role of fungus and multiresistant organisms. Arch Surg 2001; 136 : 592 – 596.
34. He YM, Lv XS, Ai ZL et al. Prevention and therapy of fungal infection in severe acute pancreatitis: a prospective clinical study. World J Gastroenterol 2003; 9 : 2619 – 2621.
35. Eggimann P, Jamdar C, Siriwardena AK. Pro/ con debate: antifugal prophylaxis is important to prevent fungal infection in patients with acute necrotizing pancreatitis receiving broad ‑ spectrum antibiotics. Crit Care 2006; 10 : 229 – 231.
36. Runzi M, Niebel W, Goebell H et al. Severe acute pancreatitis: nonsurgical treatment of infected necroses. Pancreas 2005; 30 : 195 – 199.
37. van Brunschot S, Bakker OJ, Besselink MG et al. Treatment of acute pancreatitis. Clin Gastroenterol Hepatol 2012; 10 : 520 – 524.
38. Besselink MG, van Santvoort HC, Buskens Eet al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised double‑blind, placebo ‑ controlled trial. Lancet 2008; 371 : 651 – 659.
39. Zhang MM, Cheng JQ, Lu YR et al. Use of pre‑, pro‑, a synbiotics in patients with acute pancreatitis: a meta‑analysis. World J Gastroenterol 2010; 16 : 3970 – 3978.
40. Besselink MG, de Bruijn MG, Rutten JP et al. Surgical intervention in patients with necrotizing pancreatitis. Br J Surg 2006; 93 : 593 – 539.
41. Bradley EI 3rd. A fifteen year experience with open drainage for infected pancreatic necrosis. Surg Gynecol Obstet 1993; 177 : 215 – 222.
42. Bosscha K, Hulstaert PF, Hennipman A et al.Fulminant acute pancreatitis and infected necrosis: results of open management of the abdomen and planned reoperations. J Am Coll Surg 1998; 187 : 255 – 262.
43. Nieuwenhuijs VB, Besselink MG, van Minnen LP et al. Surgical management of acute necrotizing pancreatitis: a 13‑years experience and a systematic review. Scand J Gastroenterol 2003; 239 : 111 – 116.
44. Olakowski M, Dranka ‑ Bojarowska D, Szlachta ‑ Swiatkowska E et al. Management of necrotizing pancreatitis: flexible approach depending on intra ‑ operative assessment of necrosis. Acta Chir Belg 2006; 106 : 172 – 176.
45. Sarr MG, Nagorney DM, Mucha P Jr et al. Acute necrotizing pancreatitis: management by planned, staged pancreatic necrosectomy/ debridement and delayed primary wound closure over drains. Br J Surg 1991; 78 : 576 – 581.
46. Tsiotos GG, Luque ‑ de ‑ León E, Sarr MG. Long‑term outcome of necrotizing pancreatitis treated by necrosectomy. Br J Surg 1998; 85 : 1650 – 1653.
47. Howard TJ, Patel JB, Zyromski N et al. Declining morbidity and mortality rates in the surgical management of pancreatic necrosis. J Gastrointest Surg 2077; 11 : 43 – 49.
48. Fernandez ‑ del Castillo C, Rattner DW, Makary MA et al. Debridement and closed packing for the treatment of necrotizing pancreatitis. Ann Surg 1998; 228 : 676 – 684.
49. Rodriguez JR, Razo AO, Targarona J et al. Debridement and closing packing for sterile or infected necrotizing pancreatitis: insights into indications and outcomes in 167 patients. Ann Surg 2008; 247 : 294 – 299.
50. Beger HG, Büchler M, Bittner R et al. Necrosectomy and postoperative local lavage in patients with necrotizing pancreatitis: results of a prospective clinical trial. World J Surg 1988; 12 : 255 – 262.
51. Büchler MW, Gloor B, Müller CA et al. Acute necrotizing pancreatitis: treatment strategy according to status of the infection. Ann Surg 2000; 232 : 619 – 626.
52. Rau B, Bothe A, Beger HG. Surgical treatment of necrotizing pancreatitis by necrosectomy and closed lavage: changing patient characteristics and outcome in a 19‑year, single‑center series. Surgery 2005; 138 : 28 – 39.
53. Reddy M, Jindal R, Gupta R et al. Outcome after pancreatic necrosectomy: trends over 12 years at an Indian centre. ANZ J Surg 2006; 76 : 704 – 709.
54. Farkas G, Marton J, Mandi Y et al. Surgical management and complex treatment of infected pancreatic necrosis: 18‑year experience at a single center. J Gastroenterol Surg 2006; 10 : 278 – 285.
55. van Santvoort HC, Besselink MG, Bakker OJet al. A step ‑ up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010; 362 : 1491 – 1502.
56. Büchler MW, Gloor B, Müller CA et al. Acute necrotizing pancreatitis: treatment strategy according to the status of infection. Ann Surg 2000; 232 : 619 – 626.
57. Rau B, Bothe A, Beger HG et al. Surgical treatment of necrotizing pancreatitis by necrosectomy and closed lavage: changing patient characteristic and outcome in 19‑year, single center series. Surgery 2005; 138 : 28 – 39.
58. Howard TJ, Patel JB, Zyromski N et al. Declining morbidity and mortality rates in the surgical management of pancreatic necrosis. J Gastrointest Surg 2007; 11 : 43 – 49.
59. Alsfasser G, Schwandner F, Pertschy A et al.Treatment of necrotizing pancreatitis: redefining the role of surgery. World J Surg 2012; 36 : 1142 – 1147.
60. Freeny PC, Hauptmann F, Althaus SJ et al. Percutaneous CT ‑ guided catheter drainage of infected acute necrotizing pancreatitis: techniques and results. AJR Am J Roedntgenol 1998; 170 : 969 – 975.
61. van Santwoort HC, Besselink MG, Bakker OJet al. A step ‑ up approach or open necrosectomy for necrotiozing pancreatitis. N Engl J Med 2010; 362 : 1491 – 1502.
62. Mortelé KJ, Girshman J, Szejnfeld D et al. CT ‑ guided percutaneous catheter drainage of acute necrotizing pancreatitis: clinical experience and observations in patients with sterile and infected necrosis. AJR Am J Roentgenol 2009; 192 : 110 – 116.
63. Bruennler T, Langgartner J, Lang S et al. Outcome of patients with acute, necrotizing pancreatitis requiring drainage ‑ does drainage size matter? World J Gastroenterol 2008; 14 : 725 – 730.
64. Lee JK, Kwak KK, Park JK et al. The efficacy of nonsurgical treatment of infected pancreatic necrosis. Pancreas 2007; 34 : 399 – 404.
65. Baril NB, Ralls PW, Wren SM et al. Does an infected peripancreatic fluid collection or abscess mandate operation? Ann Surg 2000; 231 : 361 – 367.
66. Gambiez LP, Denimal FA, Porte HL et al. Retroperitoneal approach and endoscopic management of peripancreatic necrosis collections. Arch Surg 1998; 133 : 66 – 72.
67. Seifert H, Biermer M, Schmitt W et al. Transluminal endoscopic necrosectomy after acute pancreatitis: a multicentre study with long‑term follow‑up (the GEPARD study). Gut 2009; 58 : 1260 – 1266.
68. Coelho D, Ardengh JC, Eulálio JM et al. Management of infected and sterile pancreatic necrosis by programmed endoscopic necrosectomy. Dig Dis 2008; 26 : 364 – 369.
69. Escourrou J, Shehab H, Buscail L et al. Peroral transgastric/ transduodenal necrosectomy: access in the treatment of infected pancreatic necrosis. Ann Surg 2008; 248 : 1074 – 1080.
70. Lopes CV, Pesenti C, Bories E et al. Endoscopic ‑ ultrasound ‑ guided endoscopic transmural drainage of pancreatic pseudocysts and abscesses. Scand J Gastroenterol 2007; 42 : 524 – 529.
71. Voermans RP, Veldkamp MC, Rauws EA et al. Endoscopic transmural debridement of symptomatic organized pancreatic necrosis (with videos). Gastrointest Endosc 2007; 66 : 909 – 916.
72. Papachristou GI, Takahashi N, Chahal P et al. Peroral endoscopic drainage/ debridement of walled‑off pancreatic necrosis. Ann Surg 2007; 245 : 943 – 951.
73. Hookey LC, Debroux S, Delhaye M et al. Endoscopic drainage of pancreatic ‑ fluid collection in 116 patients: a comparison of etiologies, drainage techniques, and outcomes. Gastrointest Endosc 2006; 63 : 635 – 643.
74. Baron TH, Harewood GC, Morgan DE et al. Outcome differences after endoscopic drainage of pancreatic necrosis, acute pancreatic pseudocysts, and chronic pancreatic pseudocysts. Gastrointest Endosc 2002; 56 : 7 – 17.
75. Parekh D. Laparoscopic ‑ assisted pancreatic necrosectomy: a new surgical option for treatment of severe necrotizing pancreatitis. Arch Surg 2006; 141 : 895 – 902.
76. Zhu JF, Fan XH, Zhang XH. Laparoscopic treatment of severe acute pancreatitis. Surg Endosc 2001; 15 : 146 – 148.
77. Raraty MG, Halloran CM, Dodd S et al. Minimal access retroperitoneal pancreatic necrosectomy: improvement in morbidity and mortality with a less invasive approach. Ann Surg 2010; 251 : 787 – 793.
78. Chang YC, Tsai HM, Lin XZ et al. No debridement is necessary for symptomatic or infected acute necrotizing pancreatitis: delayed, mini‑retroperitoneal drainage for acute necrotizing pancreatitis without debridement and irrigation. Dig Dis Sci 2006; 51 : 1388 – 1395.
79. Castellanos G, Piñero A, Serrano A et al. Translumbar retroperitoneal endoscopy: an alternative in the follow‑up and management of drained infected pancreatic necrosis. Arch Surg 2005; 140 : 952 – 955.
80. Carter CR, McKay CJ, Imrie CW. Percutaneous necrosectomy and sinus tract endoscopy in the management of infected pancreatic necrosis: an initial experience. Ann Surg 2000; 232 : 175 – 180.
81. Seifert H, Biermer M, Schmitt W et al. Transluminal endoscopic necrosectomy after acute pancreatitis: a multicenter study with long‑term follow‑up (the GEPARD Study). Gut 2009; 58 : 1260 – 1266.
82. van Santwoort HC, Besselink MG, Bakker OJet al. A step ‑ up approach or open necrosectomy for necrotiozing pancreatitis. N Engl J Med 2010; 362 : 1491 – 1502.
83. Bakker OJ, van Santvoort HC, van Brunschot Set al. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA 2012; 307 : 1053 – 1061.
84. Horvath K, Freeny P, Escallon J et al. Safety and efficacy of video ‑ assisted retroperitoneal debridement for infected pancreatic collections: a multicenter, prospective single‑arm phase 2 study. Arch Surg 2010 : 145 : 817 – 825.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Onemocnění jater u diabetikůČlánek Polypózy trávicího traktuČlánek Wilsonova chorobaČlánek Mnohočetný myelomČlánek Flavonoidy vážně i nevážně
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- K významnému životnímu jubileu prof. MUDr. Marie Brodanové, DrSc.,
- K životnímu jubileu prof. MU Dr. Marie Brodanové, DrSc.
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Pokroky v onkohematologii v 21. století
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Rifaximin v léčbě chronické divertikulózy
- Flavonoidy vážně i nevážně
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



