-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
Practice guideline and trends for immunosuppressive treatment of glomerulonephritides according to KDIGO (Clinical Practice Guideline for Glomerulonephritis)
We summarize recommendations for glomerulonephritis treatment, established by internationally recognized experts in the field and sponsored by KDIGO (Kidney Disease Improving Global Outcomes). Up till now, the KDIGO review has been the most prestigious analysis of therapeutic trials on immunosuppressive treatment of glomerulonephritides. The 167 recommendations addresses the following forms of glomerulopathies: steroid-sensitive nephrotic syndrome and steroid resistant nephrotic syndrome in children; minimal change disease and idiopathic focal segmental glomerulosclerosis in children and adults; idiopathic membranous nephropathy; idiopathic membranoproliferative glomerulonephritis; glomerulonephritis associated with infection; immunoglobulin A nephropathy and Henoch-Schönlein purpura nephritis; lupus nephritis; pauci-immune focal and segmental necrotizing glomerulonephritis; and anti--glomerular basement membrane antibody glomerulonephritis. We focuse our attention on progress in this topic in the last decade.
Key words:
glomerulonephritis – treatment – immunosuppression
Autoři: Ľ. Podracká 1; K. Matoušovic 2
Působiště autorů: I. klinika detí a dorastu Lékárskej fakulty UPJŠ a DFN Košice, Slovenská republika, prednostka prof. MUDr. Ľudmila Podracká, CSc. 1; Interní klinika 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 2
Vyšlo v časopise: Vnitř Lék 2013; 59(2): 113-118
Kategorie: Přehledný referát
Motto: Je doba svítání v mnoha otázkách aetiologie a pathogenesy nefritid – a tím i doba důležitého vyjasňování v indikacích therapeutických. (prof. Pelnář, Nemoc Brightova, Spolek lékařů českých, 1932)
Souhrn
Shrnujeme závěry doporučení pro léčbu glomerulonefritidy, která byla vytvořena předními světovými odborníky na poli glomerulonefritidy pod záštitou KDIGO (Kidney Disease Improving Global Outcomes). Je to dosud nejvýznamnější rozbor publikovaných léčebných studií na téma imunosuprese u glomerulonefritid. V rozboru KDIGO je předloženo celkem 167 postupů u následujících forem glomerulopatií: nefrotický syndrom dětí reagující na steroidy; nefrotický syndrom dětí na steroidy rezistentní; nefrotický syndrom s minimálními změnami u dospělých; idiopatická fokálně-segmentární glomeruloskleróza u dospělých; idiopatická membranózní glomerulonefritida; idiopatická membranózně proliferativní glomerulonefritida; glomerulonefritida se vztahem k infekci; IgA nefropatie; nefritida při Henochově-Schönleinově purpuře; lupusová nefritida; fokální a segmentární nekrotizující glomerulonefritida („pauci immune“) a glomerulonefritida s protilátkami proti bazální membráně glomerulů. V práci upozorňujeme na trendy ve vývoji názorů na tuto problematiku v posledním desetiletí.
Klíčová slova:
glomerulonefritis – léčba – imunosupreseÚvod
V roce 2012 byl v časopisu Kidney International v rámci iniciativy Kidney Disease Improving Global Outcomes (KDIGO, která je pod patronací National Kidney Foundation), publikován podrobný rozbor terapeutických studií o imunosupresi u glomerulonefritidy a vytvořen soubor 167 doporučených postupů pro léčbu glomerulonefritid. Byl nazván Clinical Practice Guideline for Glomerulonephritis a vytvořili jej přední světoví odborníci na tomto poli. Ve svých závěrech respektovali výhradně studie s vysokou výpovědní hodnotou podle zásad medicíny založené na důkazech. Navzdory tomu přiznávají, že řada závěrů není jednoznačně prokázána a síla důkazu není často přesvědčující. Přesto je toto sdělení zatím nejlepším rozborem dosud známých skutečností a nepochybně dobrým vodítkem pro širokou nefrologickou praxi. Předností analýzy je také to, že nevěnuje pozornost málo přesvědčivým léčebným přístupům, jejichž závěry potvrdí nebo vyvrátí až budoucnost.
Nefrotický syndrom u dětí reagující na kortikosteroidy
Pod touto entitou je zahrnut především tzv. nefrotický syndrom s minimálními změnami (NSMZ), ale podobně se může chovat i jiná morfologická léze vyvolávající nefrotický syndrom, především fokálně segmentární glomeruloskleróza (u dospělých se v doporučených postupech hovoří jen o NSMZ). Již před několika desetiletími byly publikovány dobře provedené randomizované studie u dětí [1,2], jejichž závěry jsou s malými změnami dosud platné a vychází z nich i doporučení KDIGO. Jedna ze změn se týká dávkování prednisonu (dávkování prednisonu a prednisolonu je stejné). Místo dříve doporučované dávky 60 mg/m2/24 hod, maximálně však 80 mg/24 hod, je dnes doporučováno nepodávat více než 60 mg/24 hod po 4–6 týdnů. Alternativně lze vycházet z tělesné hmotnosti a doporučuje se dávka 2 mg/kg/24 hod, také do 60 mg/24 hod. Po dalších 2–5 měsíců se pokračuje v dávce 40 mg/m2 nebo 1,5 mg/kg (nejvýše 40 mg/24 hod) obden. Nově se tedy doporučuje pozvolnější pokles dávkování a minimální doba podávání je nyní 12 týdnů, dříve to bylo 8 týdnů [3].
Relaps se léčí stejně jako první ataka. Remise je definována jako 3 dny bez proteinurie a v podávání prednisonu se pokračuje v obdenním dávkování alespoň měsíc, při častých relapsech alespoň 3 měsíce.
Opatrnější je nyní přístup k aplikaci alkylačních cytostatik (cyklofosfamid 2 mg/kg/24 hod) nebo chlorambucil (0,1–0,2 mg/kg/24 hod, maximální kumulativní dávka 11,2 mg/kg) u často relabujícího nebo kortikodependentního NSMZ. Doporučuje se podávat je také 8–12 týdnů, ale teprve poté, co byla remise navozena kortikoidy. Podle dřívějších návodů se léčba alkylačními cytostatiky zahajovala rovnou, bez úvodní léčby prednisonem [3]. Aplikace alkylačních látek se u dětí nemá opakovat.
V léčebném arzenálu pro NSMZ v rámci kortikoidy šetřících režimů zůstává nadále jako alternativa levamizol a cyklosporin (4–5 mg/kg/24 hod) [4], nově takrolimus (0,1 mg/kg/24 hod), event. mykofenolát mofetilu (počáteční dávka 1 200 mg/m2/24 hod), vše je však vzhledem k častým relapsům doporučeno podávat alespoň 12 měsíců.
Zcela nové je doporučení použít anti-CD20 (rituximab) při častých relapsech, ale jen tehdy, jestliže NSMZ relabuje navzdory jiné léčbě.
Není-li odezva po 8 týdnech podávání prednisonu, jde o tzv. NSMZ na kortikoidy rezistentní. V tomto případě se doporučuje podat inhibitory kalcineurinu alespoň po 6 měsíců, event. spolu s nízkou dávkou prednisonu.
S vysokou spolehlivostí je dokumentována jen léčba první ataky NSMZ a nutnost dlouhodobého podávání po dosažení remise, většina ostatních tvrzení je doložena méně přesvědčivě.
NSMZ u dospělých
Doporučená strategie léčby je stejná jako u dětí s dávkou prednisonu 1 mg/kg/24 hod (maximálně však až 80 mg/24 hod) nebo 2 mg/kg obden (120 mg/24 hod), alespoň 4, ne však více než 16 týdnů a po dosažení remise se má dávka snižovat pomalu (zejména u relapsu) po dobu až 6 měsíců. Při častých relapsech nebo při kortikodependenci je doporučen cyklofosfamid (2–2,5 mg/kg/24 hod) po 8 týdnů, případně kalcineurinové inhibitory dlouhodobě (1–2 roky). Při intoleranci výše uvedených léků je možno zkusit mykofenolát mofetilu (500–1 000 mg 2krát denně). Doporučení u dospělých jsou ve všech aspektech podepřena méně přesvědčivými studiemi, než je tomu u dětí, a stále platí, že remise nastupuje pomaleji a počet relapsů je nižší [3]. K poklesu a vymizení proteinurie dochází obvykle rychle, částečná remise je netypická a budí podezření na jinou lézi. Důležité je upozornění na vhodnost upřesnění diagnózy biopsií při kortikorezistenci. Může jít o fokálně segmentární glomerulosklerózu. Podle některých autorů je vymizení proteinurie po prednisonu spolehlivějším ukazatelem prognózy u NSMZ a FSG než vlastní morfologická podstata léze [5].
Fokálně segmentární glomerukloskleróza (FSG) dospělých
Znalosti o léčbě tohoto onemocnění zásadně nepokročily. Především je nutno vyloučit sekundární (adaptivní) formu FSG, která nemá imunologický původ a sklerotizace glomerulů je zde následkem přetížení reziduálních nefronů při intraglomerulární hypertenzi a hyperfiltraci a u níž se reakce na imunosupresi nepředpokládá. Základním lékem u pacientů s nefrotickým syndromem zůstává prednison 1 mg//kg/24 hod (nejvýše 80 mg/24 hod) v jedné denní dávce nebo 2 mg/kg obden (nejvýše 120 mg) nejméně po 4, ale nejdéle po 16 týdnů s pomalým snižováním po dosažení remise po dalších 6 měsíců. Kalcineurinové inhibitory zůstávají stejně jako dříve [6] lékem druhé volby při nevhodnosti prednisonu. Relaps se léčí stejně jako relaps NSMZ dospělých. U FSG resistentní na steroidy je doporučeno zkusit cyklosporin alespoň po 4–6 měsíců a při dosažení remise (i částečné) podávat další rok a potom pomalu snižovat. Další možností je kombinovat mykofenolát mofetilu s vysokými dávkami dexametazonu. Lze shrnout, že doklady pro účinnou léčbu FSG jsou mnohem méně přesvědčivé než u NSMZ, stejně jako tomu bylo na přelomu tisíciletí [6].
Idiopatická membranózní glomerulonefritis
Prvním úkolem je, zejména u starších dospělých, vyloučit sekundární původ a vzhledem k častému spontánnímu vyhojení se zahájením imunosupresivní léčby nespěchat (úplná nebo částečná remise se vyskytla u téměř 2/3 případů za 4 roky) [7]. V žádném případě bychom ale neměli oddálit zahájení léčby u pacientů s klesající funkcí nebo tam, kde lze soudit na nepříznivý vývoj. Stejně jako bylo doporučováno dříve [8], je na místě léčit jen pacienty s nefrotickým syndromem a stoupajícím sérovým kreatininem (o 30 % v průběhu 6–12 měsíců pozorování), ale nižším než 300 µmol/l. Většinou jsou lékem první volby inhibitory ACE (sartany) podávané 1/2 roku. Klasickým schématem po těchto 6 měsících jsou alternativní měsíční cykly steroidů a alkylačních látek (raději cyklofosfamid než dříve doporučovaný chlorambucil) [8], zahájené třídenní infuzí 1 g metylprednisolonu a následované p.o. dávkou prednisonu 0,5 mg/kg/24 hod v 1., 3. a 5. měsíci léčby. Ve 2., 4. a 6. měsíci se podávají alkylační látky. Toto schéma (s chlorambucilem) bylo navrženo v Itálii již v roce 1980 [9] a opakovaně publikováno. Alternativou je šestiměsíční podávání alkylačních látek (je ovšem spojeno s vyšším rizikem nežádoucích účinků). Další možností je cyklosporin nebo takrolimus, a to po 6 měsíců k průkazu účinnosti léčby, a event. pokračování v podávání po dalších 12 měsíců v dávce redukované na polovinu. Při relapsu je doporučeno stejné schéma, při němž se při první atace dostavila remise. Pro děti je doporučen stejný postup jako u dospělých. Při riziku trombózy možno zavést antikoagulaci warfarinem.
Idiopatická membranózně proliferativní glomerulonefritida
Doklady o správném postupu jsou velmi chudé [10]. Se značnou dávkou nejistoty je za přítomnosti nefrotického syndromu a klesající funkci ledvin doporučeno podávání cyklofosfamidu či mykofenolátu mofetilu p.o. spolu s denní nebo obdenní dávkou prednisonu po dobu 6 měsíců. V 90. letech minulého století bylo u dospělých s touto formou a při nefrotickém syndromu a snížené funkcí ledvin doporučeno zkusit acetylsalicylovou kyselinu (325 mg/24 hod) a/nebo dipyridamol (75–100 mg/24 hod), což bylo opuštěno [10].
Glomerulonefritida vyvolaná infekcí
Základním lékem u této formy s pozitivitou HCV je pegylovaný interferon, a to v případě uspokojivé funkce ledvin v kombinaci s ribavirinem, při snížené funkci jako monoterapie. Jsou-li přítomny kryoglobuliny spolu s agresivním onemocněním, potom plazmaferéza, metylprednisolon, cyklofosfamid či anti-CD20. Při glomerulonefritidě a HBV infekci se postupuje stejně jako u nemocných bez glomerulonefritidy (α interferon).
IgA nefropatie
Na přelomu tisíciletí ještě neexistovaly přesvědčivé doklady o užitečnosti inhibitorů ACE či sartanů u této choroby [11] a tyto léky byly zmiňovány především v souvislostech antihypertenzní léčby [12]. Nově se doporučují s jistotou při proteinurii vyšší než 1 g/24 hod a velmi pravděpodobně již i u pacienta s proteinurií vyšší než 0,5 g/24 hod. Jejich dávku je třeba zvyšovat tak dlouho, dokud proteinurie neklesne pod 1 g/24 hod. Zatímco dříve se za indikaci k zahájení léčby prednisonem považovala poměrně vysoká proteinurie (3 g/24 hod) [11], dnes mají být podávány již při proteinurii nízké (nad 1 g/24 hod) po dobu 6 měsíců. Příznivý účinek kombinace prednisonu s cytostatiky (cyklofosfamid, azatioprin) nebyl nikdy přesvědčivě doložen, a proto není (s výjimkou IgA nefropatie probíhající pod obrazem rychle progredující glomerulonefritidy) doporučována ani nyní. Rovněž efekt mykofenolátu mofetilu zatím nebyl prokázán. Dříve ani nyní není jasně prokázán účinek antiagregancií, a proto se ani v rozboru KDIGO nedoporučují. Zatímco dříve bylo doporučováno provedení tonzilektomie při recidivujících tonzilitidách [11], podle posledního rozboru není tonzilektomie u IgA nefropatie indikována z jiné než otorinolaryngologické indikace. Dříve i nyní byly a jsou rozpaky nad použitím rybího oleje. Zřejmě v důsledku důrazu na studii provedenou v Mayo Clinic [13] je podle KDIGO doporučeno jeho použití u pacientů s proteinurií nad 1 g/24 hod, u nichž nebyla výše proteinurie ovlivněna inhibitory ACE či sartany. V praxi je ovšem tento postup realizovatelný jen obtížně vzhledem k finančním nárokům při nutnosti vysoké dávky (12–24 g/24 hod). Probíhá-li IgA nefropatie pod obrazem rychle progredující glomerulonefritidy, je indikována kombinace steroidů s cyklofosfamidem. Hlavním trendem v léčbě IgA nefropatie je tedy důraz na podávání inhibitorů ACE (sartanů) téměř u každého pacienta s proteinurií a důraz na léčbu prednisonem již při poměrně nízké proteinurii.
Henochova-Schönleinova purpura
U dětí s nízkou proteinurií (0,5–1 g//24 hod/1,73 m2) jsou na místě jen inhibitory ACE (sartany). Při proteinurii vyšší a při uspokojivé glomerulární filtraci (více než 50 ml/min), která nereagovala na inhibitory ACE, je na místě půlroční podávání kortikoidů (stejně jako u IgA nefropatie). Podávání kortikoidů jako prevence vzniku nefritidy není u Henochovy-Schönleinovy purpury doporučeno. Léčba u dospělých je stejná jako u dětí.
Glomerulonefritida při SLE
Strategie léčby je, stejně jako dříve, diktována bioptickým nálezem a výší proteinurie. Základním lékem zůstávají kortikoidy buď samotné, nebo kalcineurinové inhibitory (u mezangiálně proliferativní léze – třída II s proteinurií vyšší než 3 g/24 hod) nebo v kombinaci s cyklofosfamidem či mykofenolátem mofetilu (fokální či difuzní lupoidní nefritida – třída III a IV). Po zklidnění aktivity je na místě udržovací léčba azatioprinem či mykofenolátem mofetilu s nízkou dávkou kortikosteroidů po dobu 1 roku. Značná nejistota v návrhu léčby je cítit u membranózní lupoidní nefritidy (třída V), kde je možno kromě antihypertenziv a antiproteinurických léčiv podat kortikosteroidy plus další imunosupresiva (cyklofosfamid, kalcineurinové inhibitory, mykofenolát mofetilu či azatioprin). Bez ohledu na stupeň poškození ledvin mají pacienti užívat hydroxychlorochin (až 6,5 mg/kg/1,73 m2) a při průkazu antifosfolipidových protilátek antikoagulancia. Při rezistenci na běžnou léčbu lze uvážit anti-CD20, i.v. imunoglobuliny či kalcineurinové inhibitory
Fokálně-segmentární nekrotizující glomerulonefritis („pauci immune“)
Základem léčby je jednoznačně cyklofosfamid s kortikoidy, anti-CD20 s kortikoidy možno zkusit u mírnějších lézí. Plazmaferéza zde má místo v případě rychlé progrese a u plicního krvácení. Udržovací léčba azatioprinem nebo mykofenolátem mofetilu, případně metotrexátem má trvat 18 měsíců po zklidnění nemoci. U rezistentního onemocnění lze zkusit anti-CD20, plazmaferézu či i.v. imunoglobuliny. Dlouhodobá léčba trimetoprim-sulfametoxazolem je stále doporučována za přítomnosti respirační infekce. Relaps se léčí stejně jako první ataka. Pokud je onemocnění v klinické remisi, není třeba odkládat transplantaci z důvodu perzistence ANCA protilátek. Léčba je tedy obdobná jako na přelomu tisíciletí [14], tehdy ještě ovšem nebyla dostupná protilátka anti-CD20.
Anti-GBM glomerulonefritida
Léčba se v posledních desetiletích nemění [14], tedy sestává z trojkombinace cyklofosfamid, kortikoidy a plazmaferéza. Udržovací léčba se nedoporučuje. Není doporučeno léčit pacienty, u nichž je extrakapilární proliferace přítomna ve 100 % glomerulů, a v případě závislosti na dialýze. Podle našeho názoru by bylo lépe formulovat konzervativní přístup k léčbě na podkladě morfologické ireverzibility léze, podle našich zkušeností dané zejména stupněm tubulointersticiální regrese.
Diskuze
Předložený rozbor vychází z metodologie označované GRADE (Grading of Recommendation, Assessment, Development and Evaluation), která umožňuje přiřadit každému doporučení jednak sílu (přesvědčivost) důkazů (A – vysoký, high; B – střední, moderate; C – nízký, low; D – pochybný, very low), jednak sílu (přesvědčivost) doporučení (1 – přesvědčivé, strong, 2 – diskutabilní, weak or discretionary). Je samozřejmé, že je vztah mezi těmito dvěma aspekty, ale pro sílu doporučení byly kromě kvality důkazů vzaty v úvahu ještě další aspekty (např. cena). Věrohodnost doporučení je potom vyjádřena od 1A po 2D. Na podkladě tohoto třídění jsou doporučení prezentována jako vhodná pod pojmem:
a) doporučujeme (we recommend) a
b) lze uvážit (we suggest).Některá obecná tvrzení nejsou takto zařazena (not graded). Tab. 1 shrnuje četnost jednotlivých kategorií. Je z ní mimo jiné patrné, že z celkového počtu 167 léčebných návodů jsou spolehlivostí 1A doložena pouze 4 následující tvrzení: cyklofosfamid a kortikosteroidy jsou léky první volby při fokálně-segmentární nekrotizující glomerulonefritidě („pauci imunne“); nepoužívat etanercept jako pomocnou léčbu u téže formy; cyklofosfamid, mykofenolát mofetilu, inhibitory ACE a sartany se nepodávají těhotným se SLE a kortikoidy jsou součástí iniciální léčby lupusové nefritidy typu III. Je tedy zřejmé, že navzdory velkému úsilí badatelů a mnoha publikovaným léčebným studiím není většina doporučovaných léčebných postupů podložena zcela přesvědčivými prameny.
Tab. 1. Absolutní a procentuální zastoupení síly důkazů (A až D) a síly jednotlivých doporučení (hladina 1 a 2). Každé doporučení je klasifikováno ve stupnici 1A až 2D. Některá obecná doporučení nebyla zařazena. 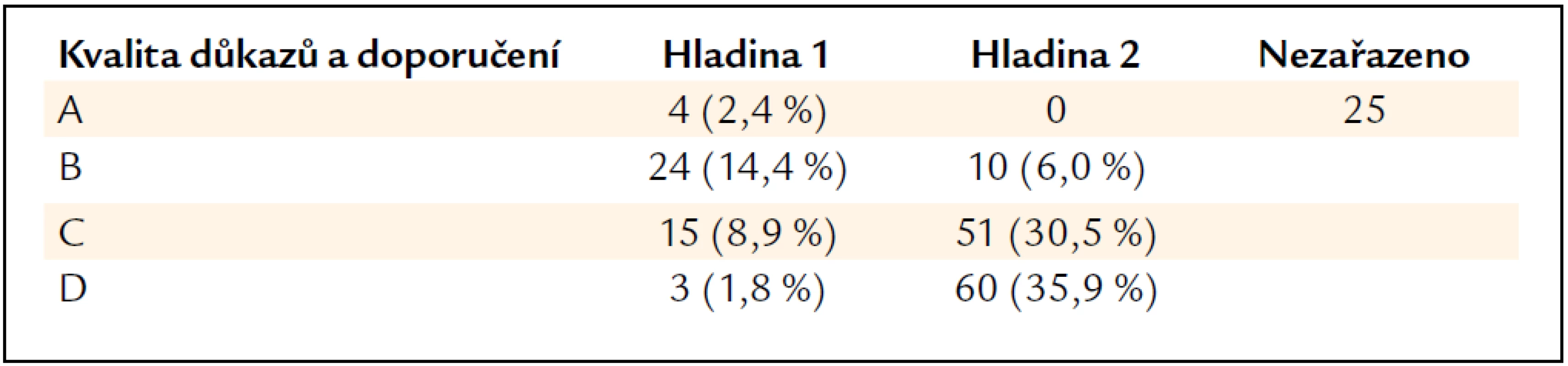
Nejistota závěrů má různé důvody. Tím hlavním je ale nedostatek dostatečně početných a epidemiologicky dokonalých studií a také rozdílné výsledky zdánlivě identických léčebných studií, provedených věhlasnými vědeckými institucemi a z epidemiologického hlediska bez zjevné chyby, ale se zcela odlišnými výsledky, jako např. efekt prednisonu ve stejném dávkování po stejnou dobu u membranózní glomerulonefritidy [15,16]. A takových situací je mnoho. Řada studií uvádí jako léčebný úspěch částečnou (partial) remisi, která není jednotným pojmem. Většinou se týká výše proteinurie a jejího poklesu v poměru ke vstupní hodnotě a tento poměr je stanoven úsudkem či odhadem. Je otázkou, zda např. pokles proteinurie na polovinu vstupní hodnoty lze považovat za zklidnění glomerulopatie. Klinická zkušenost napovídá, že teprve pokles proteinurie pod 1 g/24 hod a lépe pod 0,5 g/24 hod je spojen se zpomalením progrese glomerulopatie. Za skutečný úspěch léčby lze však považovat úplné vymizení proteinurie pod hranici mikroalbuminurie. Sami se domníváme, že pokud mikroalbuminurie přetrvává, je na místě pokračovat v podávání inhibitorů ACE/sartanů. Přítomnost mikroalbuminurie signalizuje určitou poruchu ledvin, buď jako projev původního onemocnění, nebo jako důsledek přetížení reziduálních nefronů, a jejich ochrana je tedy vhodná. Podobné nejasnosti se týkají sérového kreatininu (zdvojnásobení či vzestup o různé procento při jeho odlišné vstupní hodnotě) a jeho clearance.
Doporučené postupy, které s vysokou pravděpodobností platí, jsou vlastně známy již dlouho u glomerulopatií s vyhraněným klinickým a morfologickým obrazem. Sem lze zařadit nefrotický syndrom s minimálními změnami [1–3,4,17–21] a rychle progredující glomerulonefritidu (především typ způsobený protilátkami proti bazální membráně glomerulárních kapilár – anti-GBM). Zde je efekt imunosuprese, případně doplněné plazmaferézou, spolehlivý. Velmi pravděpodobné je ovlivnění imunokomplexové glomerulonefritidy při SLE imunosupresí. V tomto případě jde o ukládání imunitních komplexů do různých struktur glomerulu, agresivita procesu však značně kolísá a tím i výzva k intenzitě imunosuprese. Málo agresivní lupoidní membranózní nefropatie u značné části pacientů na imunosupresi nereaguje, zatímco imunokomplexová rychle progredující lupoidní nefritida se zklidní téměř vždy. Ještě větší rozpaky panují nad užitím imunosuprese u primární membranózní glomerulonefritidy, kde již po desetiletí převládá názor, že se má, z důvodu poměrně časté spontánní remise [7], se zahájením imunosuprese několik měsíců vyčkat, pokud ovšem již od samého začátku neklesá funkce ledvin. Tento přístup je však z oblasti dohadů a není podpořen přesvědčivými doklady. Neúčinnost samotných kortikoidů je nepochybná, vliv alkykačních cytostatik je sporný [22,23]. Kauzální léčba IgA nefropatie není dosud známa, přestože podstata tvorby nefropatogenních imunitních komplexů se zdá být objasněna [24]. Autoprotilátky jsou namířeny proti aberantním cukerným řetězcům imunoglobulinu A1. Doklady o příznivém působení glukokortikosteroidů na základní patogenetický proces přesvědčivé nejsou [25] a také nad použitím rybího oleje [13] trvají rozpaky [26].
Léčebné postupy uvedené v doporučených postupech KDIGO jsou založeny pouze na morfologii glomerulů a neberou a pro nedostatek dokladů ani nemohou brát zřetel na přidružené změny parenchymu ledviny, zejména na stupeň tubulární atrofie, intersticiální sklerózy a arteriosklerózy a arteriolosklerózy, přestože prognóza glomerulopatií je těmito změnami silně ovlivněna. Je dlouho známo, že stupeň tubulointersticiální regrese je spolehlivým ekvivalentem glomerulární filtrace a jejího dalšího vývoje [27,28]. V rozboru se v řadě situací jen konstatuje, že při podstatně snížené glomerulární filtraci se již imunosuprese nedoporučuje. Hranicí je obvykle clearance kreatininu 0,5 ml/s.
V posledních 15 letech byla objevena nová imunosupresiva, prvotně obvykle zkoušená v transplantační medicíně a později s různými výsledky aplikovaná v konvenční nefrologii, podle rozboru KDIGO však zásadní změnu v léčebných postupech na poli glomerulonefritidy nepřinesla. Téměř vždy je jejich aplikace doporučena až v druhé linii, poté, co „klasická“ imunosuprese zůstala bez efektu. Z nich se jako nejperspektivnější jeví oba inhibitory kalcineurinu [29], zda je v konvenční nefrologii účinnější cyklosporin či takrolimus, se zatím neví. Mykofenolát mofetilu je obvykle doporučován jako alternativa k azatioprinu v dlouhodobé zajišťovací léčbě např. u glomerulonefritidy při SLE nebo u fokálně segmentární nekrotizující glomerulonefritidy („pauci immune“).
K aplikaci tzv. biologické léčby je rozbor KDIGO dosti rezervovaný, přestože lze soudit, že budoucnost může v tomto ohledu přinést pozitivní výsledky [30].
I tato významná publikace potvrzuje známou skutečnost, že léky první volby či téměř konstantní součástí iniciální léčby u glomerupatií jsou inhibitory ACE/sartany, schopné snížit krevní tlak, proteinurii i glomerulární hypertenzi a zpomalit postup těchto závažných chorob [31].
Léčebná doporučení KDIGO nesporně představují fundované shrnutí známých skutečností a nepochybně se stanou pomocníkem a vodítkem k volbě léčebné strategie glomerulonefritid v nefrologické praxi. Měly by být součástí knihovny všech lékařů, kteří s těmito nemocemi přicházejí do styku. Je však známou klinickou zkušeností, že doporučovaný léčebný postup, byť přesně definovaný, je třeba u konkrétního pacienta individualizovat. Jednak proto, že většina bioptických nálezů není „čistou“ jednotkou výslovně zapadající do klasifikačního systému glomerulopatií, jednak proto, že reakce na podanou léčbu individuálně kolísá. Proto je dané schéma beze zbytku dodrženo jen zřídka. To konečně zdůrazňují i autoři této publikace tvrzením, že ani tento mimořádně pečlivě zpracovaný rozbor nemůže nahradit to, co nazýváme „selským rozumem“ (Nothing stated in this guideline replaces physician´s assessment in this regard).
Práce byla podpořena granty IGA NT 11081, VZ MSM 0021620819 a VEGA 1/0715/11.
prof. MUDr. Ľudmila Podracká, CSc.
www.lf.upjs.sk
e-mail: podracka12@yahoo.com
Doručeno do redakce: 11. 12. 2012
Přijato po recenzi: 22. 1. 2013
Zdroje
1. Nephrotic syndrome in children: a randomized trial comparing two prednisone regimens in steroid-responsive patients who relapse early. Report of the international study of kidney disease in children. J Pediatr 1979; 95 : 239–243.
2. Cyclophosphamide treatment of steroid dependent nephrotic syndrome: comparison of eight week with 12 week course. Report of Arbeitsgemeinschaft für Pädiatrische Nephrologie. Arch Dis Child 1987; 62 : 1102–1106.
3. Bargman JM. Management of minimal lesion glomerulonephritis: Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S3–S16.
4. Podracká L, Böör A, Šasinka M. Cyclosporin A versus cyklofosfamid v liečbě nefrotického syndromu detí. Čas Lék Česk 2008; 147 : 38–43.
5. Dzúrik R, Šašinka M, Mydlík M et al. Nefrológia. Bratislava: Herba 2004.
6. Burgess E. Management of focal segmental glomerulosclerosis. Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S26–S32.
7. Schieppati A, Mosconi L, Perna A et al. Prognosis of untreated patients with idiopathic membranous nephropathy. N Engl J Med 1993; 329 : 85–89.
8. Muirhead N. Management of idiopathic membranous nephropathy. Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S47–S55.
9. Imbasciati E, Cagnoli L, Case N et al. Controlled study of treatment of steroids and chlorambucil, in alternate months, for membranous nephropathy and focal glomerulosclerosis. Preliminary evaluation of the results. Minerva Nefrol 1980; 27 : 571–575.
10. Levin A. Management of membranoproliferative glomerulonephritis. Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S41–S46.
11. Nolin L, Courteau M. Management of IgA nephropathy. Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S56–S62.
12. Bedogna V, Valvo E, Casagrande P et al. Effects of ACE inhibition in normotensive patients with chronic glomerular disease and normal renal function. Kidney Int 1990; 38 : 101–107.
13. Donadio jr. JV, Grande JP, Bergstralh EJ et al. The long-term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Mayo Nephrology Collaborative Group. J Am Soc Nephrol 1999; 10 : 1772–1777.
14. Jindal KK. Management of idiopathic crescentic and diffuse proliferative glomerulonephritis. Evidence-based recommendations. Kidney Int 1999; 55: (Suppl. 70): S33–S40.
15. Coggins CH. Is membranous nephropathy treatable? Am J Nephrol 1981; 1 : 219–221.
16. Cameron JS, Healy MJ, Adu D. The Medical Research Council trial of short-term high-dose alternate day prednisolone in idiopathic membranous nephropathy with nephrotic syndrome in adults. The MRC Glomerulonephritis Working Party. Q J Med 1990; 74 : 133–156.
17. Bagga A, Sharma A, Srivastava RN. Levamisole therapy in corticosteroid-dependent nephrotic syndrome. Pediatr Nephrol 1997; 11 : 415–417.
18. Hodson EM, Willis NS, Craig JC. Interventions for idiopathic steroid-resistant nephrotic syndrome in children. Cochrane Database Syst Rev 2010; 11: CD003594.
19. Kurman MR. Recent clinical trials with levamisole. Ann N Y Acad Sci 1993, 685 : 269–277.
20. Niaudet P, Drachman R, Gagnadoux MF et al. Treatment of idiopathic nephrotic syndrome with levamisole. Acta Paediatr Scand 1984; 73 : 637–641.
21. Glassock RJ. Therapy of idiopathic nephrotic syndrome in adults. A conservative or aggressive therapeutic approach? Am J Nephrol 1993; 13 : 422–428.
22. Schieppati A, Perna A, Zamora J et al. Immunosuppressive treatment for idiopathic membranous nephropathy in adults with nephrotic syndrome. Cochrane Database Syst Rev 2004; 4: CD004293.
23. Janeček M, Říhová Z, Tesař V et al. Naše zkušenosti s léčbou membranózní nefropatie cyklosporinem. Vnitř Lék 2005; 51 : 504–509.
24. Mestecky J, Raska M, Julian BA et al. IgA Nephropathy: Molecular Mechanisms of the Disease. Annu Rev Pathol. 2012, Oct 18. [Epub ahead of print].
25. Hogg RJ, Lee J, Nardelli N et al. Southwest Pediatric Nephrology Study Group. Clinical trial to evaluate omega-3 fatty acids and alternate day prednisone in patients with IgA nephropathy: report from the Southwest Pediatric Nephrology Study Group. Clin J Am Soc Nephrol 2006; 1 : 467–474.
26. Dillon JJ. Fish oil therapy for IgA nephropathy: efficacy and interstudy variability. J Am Soc Nephrol 2001; 12 : 846–847.
27. Bohle A, Kressel G, Müller CA et al. The pathogenesis of chronic renal failure. Pathol Res Pract 1989; 185 : 421–440.
28. Matoušovic K, Rossmann P. Primary glomerulonephritis. Morphological and clinical aspects of diagnosis and prognosis. Praha: Academia 1994.
29. Patel P, Pal S, Ashley C et al. Combination therapy with sirolimus (rapamycin) and tacrolimus (FK-506) in treatment of refractory minimal change nephropathy, a clinical case report. Nephrol Dial Transplant 2005; 20 : 985–987.
30. Pescovitz MD, Book BK, Sidner RA. Resolution of recurrent focal segmental glomerulosclerosis proteinuria after rituximab treatment. N Engl J Med 2006; 354 : 1961–1963.
31. Praga M, Hernández E, Montoyo C et al. Long-term beneficial effects of angiotensin-converting enzyme inhibition in patients with nephrotic proteinuria. Am J Kidney Dis 1992; 20 : 240–248.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2011
- Ischemická choroba dolních končetin a recidivující ileofemorální flebotrombóza u 24letého muže s antifosfolipidovým syndromem
- Synkopa ako prvý a jediný príznak myxómu ľavej predsiene
- Transplantace srdce a následná léčba AL-amyloidózy
- Role přímého inhibitoru trombinu mezi novými perorálními antikoagulancii
- Aortální regurgitace – editorial
- Současné trendy v léčbě a následné dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu – editorial
- Představuje KDIGO Clinical practice Guideline for Glomerulonephritis přelom pro diagnostiku a léčbu glomerulonefritid? – editorial
- Srdeční myxomy – editorial
- Měnící se přístup k léčbě AL-amyloidózy – editorial
- Aortální regurgitace
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Aortální regurgitace
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Transplantace srdce a následná léčba AL-amyloidózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



