-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
Inflammatory response and C ‑ reactive protein value in patient with acute coronary syndrome
Inflammation plays an important role in the pathophysiology of acute coronary syndrome as well as in the process of atherosclerosis in general. At the moment of myocardial ischaemia, local and systemic inflammatory reaction is amplified; in ischaemic myocardium there is increased expression of proinflammatory cytokines, particularly interleukin-6, which mediates C ‑ reactive protein (CRP) production by hepatocytes. CRP activates the complement cascade and thereby contributes to the lysis and removal of damaged cardiomyocytes. Whereas in a healthy population CRP levels range from 1.2 to 2.0 mg / l, in patients with ACS the levels of CRP significantly increase with the peak of 2nd to 4th day from the onset of myocardial infarction. Peak CRP levels ranged from 20 to 250 mg / l in patients with STEMI treated conservatively, the median of peak of CRP levels was 79 mg/ l in patients with anterior wall STEMI treated with primary PCI. There is a recommendation of CRP evaluation within the early risk stratification of patients with ACS according to the current ESC guidelines. In patients with NSTEMI, CRP levels > 10 mg/ l are associated with increased long‑term mortality. In patients with STEMI treated with primary PCI, CRP levels > 79 mg/ l could predict negative left ventricle remodelation. The predictive value of GRACE risk score was improved using CRP, levels > 22 mg/ l predicted worse prognosis in patients with either STEMI or NSTEMI treated invasively. However, if also cardiac troponin and natriuretic peptides in addition to GRACE risk score were used, CRP levels were useless in further risk stratification improvement. In clinical practice, in terms of coinciding infection, problems with CRP levels interpretetation can occur as well. Several patients either in cardiogenic shock or after cardiopulmonary resuscitation have signs of systemic inflammatory response, and sometimes it is very difficult to decide whether there is a necessity to iniciate the antibiotic therapy because of infectious cause. In patients after cardiopulmonary resuscitation, CRP levels > 180 mg/ l indicate highly probable infection, but with the poor sensitivity. For patients in cardiogenic shock, procalcitonin appears to be more useful for the detection of infection; in this group of patients, procalcitonin levels > 2 ng/ ml are common, and levels > 10 ng/ ml indicate infection undoubtedly.
Key words:
C ‑ reactive protein – myocardial infarction – prognosis – infectious complications
Autoři: L. Kubková 1,2; J. Špinar 1,2; M. Pávková Goldbergová 3; Jiří Jarkovský 4
; J. Pařenica 1,2
Působiště autorů: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jindřich Špinar, CSc., FESC 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny Brno, ředitel MUDr. Goraz Stokin 2; Ústav patologické fyziologie LF MU Brno, přednostka prof. MU Dr. Anna Vašků, CSc. 3; Institut biostatistiky a analýz LF MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 4
Vyšlo v časopise: Vnitř Lék 2013; 59(11): 981-988
Kategorie: Přehledný referát
Souhrn
V průběhu akutního koronárního syndromu (AKS) dochází k rozvoji zánětlivé reakce. Zánět hraje významnou roli v patofyziologii aterosklerózy a při vzniku nestabilního aterosklerotického plátu. Po ischemickém inzultu myokardu dochází k zesílení lokální i celkové zánětlivé reakce, v ischemickém myokardu je zvýšená exprese prozánětlivých cytokinů, především interleukinu-6, který stimulací hepatocytů vede ke zvýšené produkci C ‑ reaktivního proteinu (CRP). CRP aktivuje klasickou cestou komplement a podílí se na lýze a odstranění poškozených kardiomyocytů. Zatímco ve zdravé populaci se hladina CRP pohybuje od 1,2 do 2,0 mg/ l, u pacientů s AKS hodnoty CRP výrazně narůstají s maximem hodnot 2. – 4. den od vzniku infarktu myokardu. Maximální hodnoty u pacientů se STEMI léčených konzervativně se pohybovaly v rozmezí 20 – 250 mg/ l, u pacientů se STEMI přední stěny léčených primární PCI byl dokumentován medián vrcholové hodnoty CRP 79 mg/ l. Podle doporučených postupů ESC je hodnocení CRP vhodné k časné rizikové stratifikaci pacientů s AKS. U pacientů s NSTEMI jsou vstupní hodnoty CRP > 10 mg/ l spojeny s vyšší dlouhodobou mortalitou. U pacientů se STEMI léčenými primární PCI maximální hodnota CRP > 79 mg/ l předpovídala negativní remodelaci levé komory. Ve smíšené kohortě pacientů se STEMI/ NSTEMI léčenými převážně intervenčně vstupní hodnoty CRP > 22 mg/ l zvyšovaly prediktivní hodnotu GRACE risk skóre. Pokud však byla k predikci prognózy využita kromě GRACE skóre i hodnota troponinu a natriuretických peptidů, nepřinášela hodnota CRP informaci navíc. V klinické praxi může být interpretace hladin CRP u pacientů s AKS problematická z hlediska možné koincidující infekce. Řada pacientů v kardiogenním šoku nebo po kardiopulmonální resuscitaci (KPR) má známky systémové zánětlivé reakce a někdy je velmi obtížné rozhodnout, zda se jedná o infekci s nutností zahájení antibiotické terapie. Ve skupině pacientů po KPR představuje hodnota CRP > 180 mg/ l velmi pravděpodobnou infekci, ale tato hodnota má malou senzitivitu k detekci infekce. U pacientů v kardiogenním šoku je k detekci infektu přínosnější prokalcitonin než CRP, přičemž běžné jsou hodnoty prokalcitoninu > 2 ng/ ml a hodnoty > 10 ng/ ml svědčí pro jednoznačnou infekci.
Klíčová slova:
C ‑ reaktivní protein – infarkt myokardu – prognóza – infekční komplikaceÚvod
Akutní koronární syndrom (AKS) je v současné době i přes moderní diagnostické a terapeutické postupy stále příčinou relativně vysoké morbidity a mortality. Podle českého registru akutních koronárních syndromů CZECH [1] představuje roční incidence AKS 3 248 pacientů na 1 000 000 obyvatel a celková hospitalizační mortalita pacientů přijatých pro AKS je 5,1 %. Podle typu koronárního syndromu dosahuje hospitalizační mortalita 0,9 % u pacientů s nestabilní anginou pectoris, 4,4 % u pacientů s non‑Q infarktem myokardu a až 10,0 % u pacientů s Q ‑ infarktem myokardu. Zatímco u pacientů s nekomplikovaným průběhem STEMI, léčených primární PCI a bez srdečního selhání, je prognóza excelentní s hospitalizační mortalitou 0,2 %, s tíží srdečního selhání mortalita výrazně stoupá. Při mírném srdečním selhání (Killip II) představuje 3,2 %, při plicním edému 14,3 % a u pacientů v kardiogenním šoku až 64 % [2].
K rizikové stratifikaci pacientů s AKS byly vytvořeny klinické skórovací systémy, např. TIMI risk skóre nebo GRACE risk skóre. K dalšímu upřesnění rizika jsou využívány biochemické markery (biomarkery), v časné fázi AKS je to především troponin, natriuretické peptidy a C ‑ reaktivní protein [3,4]. U vysoce rizikových pacientů je pak indikován časný invazivní přístup s intenzivní léčbou všech komplikací.
Akutní infarkt myokardu je komplexní syndrom, jehož nejčastější příčinou je ruptura aterosklerotického plátu koronární tepny. Vysoce protromboticky působícímu jádru aterosklerotického plátu jsou tak vystaveny cirkulující krevní destičky a koagulační proteiny, které se podílejí na tvorbě intrakoronárního trombu. Ruptuře předchází destabilizace aterosklerotického plátu, která je považována za částečně zánětlivý proces. Proto již v počáteční fázi AKS mohou být ve srovnání s pacienty se stabilní formou aterosklerózy zvýšené hladiny zánětlivých parametrů, ke kterým patří C ‑ reaktivní protein (CRP), sérový amyloid A, myeloperoxidáza, interleukin‑6 (IL‑6) a další. K dalšímu rozvoji zánětlivé reakce pak dochází v průběhu akutního infarktu myokardu. Jak demonstrovala studie Shock trial, která hodnotila terapii u pacientů s akutním infarktem myokardu komplikovaným kardiogenním šokem [5], asi u 20 % těchto pacientů se rozvinula klinicky závažná zánětlivá reakce s febriliemi a leukocytózou, která budila podezření na sepsi. K rozvoji této těžké zánětlivé reakce došlo 4. den u pacientů s pozitivními hemokulturami a už 2. den u pacientů bez následně prokázaného infektu. Pacienti, u kterých došlo k rozvoji této těžké aseptické zánětlivé reakce, byli mladší a častěji podstoupili operační revaskularizaci CABG [6]. Tyto výsledky podporují teorii, že v některých případech může k rozvoji kardiogenního šoku přispět těžká zánětlivá reakce na podkladě ischemického inzultu, která vede ke snížení periferní vaskulární rezistence a podílí se tak na vzniku závažné hypotenze [7]. Z klinické praxe je známo, že u části pacientů s AKS dochází k různému vzestupu zánětlivých markerů, leukocytóze či febriliím, aniž by pacienti měli zjevné známky infekce. V případech, kdy je pacient po resuscitaci a/ nebo na invazivní umělé plicní ventilaci, je v počáteční fázi velmi obtížné rozhodnout, zda se jedná o aseptickou zánětlivou reakci či o infekci, která vyžaduje antibiotickou léčbu.
Cílem této práce je popsat na základě publikovaných klinických studií rozvoj zánětlivé reakce u pacientů s AKS, zhodnotit význam C ‑ reaktivního proteinu ve stanovování jejich prognózy a pokusit se na základě dosavadních prací zhodnotit, zda nám mohou běžně používané biomarkery zánětu pomoci v diagnostice infekčních komplikací u pacientů se SIRS (systemic inflammatory response syndrome) v rámci AKS.
Patofyziologie rozvoje zánětlivé reakce u AKS
V rozvoji a progresi AKS hrají zánětlivé mechanizmy klíčovou roli. Vztahují se k rozvíjející se ateroskleróze, kdy je celý proces iniciován aktivací, dysfunkcí a strukturálními změnami endotelu, které vedou k subendoteliální retenci lipidových komponent z plazmy. Lipidy jsou modifikovány kyslíkovými radikály a jinými enzymy, např. myeloperoxidázou (MPO) a lipoxygenázou, což iniciuje zánětlivý proces. Aktivovaný endotel secernuje chemokiny (např. CCL2/ MCP ‑ 1) a exprimuje adhezivní molekuly (např. E ‑ selectin a VCAM‑1), které umožňují adhezi leukocytů, monocytů a aktivaci destiček. Aktivované destičky secernují další chemokiny (např. CCL5 a CXCL4) a dále zvyšují infiltraci tkáně zánětlivými buňkami. Monocyty, T‑lymfocyty a dendritické buňky (DC) jsou prvními zánětlivými buňkami, které aterosklerotická léze obsahuje. V intimě monocyty diferencují v makrofágy, které fagocytují modifikované lipidy. Monocyty se mohou diferencovat i v DC. Makrofágy i T‑lymfocyty produkují řadu aterogenních mediátorů včetně cytokinů a chemokinů. DC jsou za fyziologických okolností v arteriích přítomny, v procesu aterosklerózy jsou ale aktivně diferencovány. Aterogenní mediátory včetně zánětlivé reakce přispívají k nestabilitě a ruptuře aterosklerotického plátu [8] a mají vliv na hemostázu [9]. Po ischemickém inzultu myokardu dochází k zesílení lokální i celkové zánětlivé reakce, kdy byla dokumentována zvýšená genová exprese pro‑zánětlivých cytokinů v infarktovém ložisku [10]. Zejména se jedná o expresi interleukinu-6 (IL‑6), který má výrazný podíl na stimulaci produkce CRP a ostatních proteinů akutní fáze. Rovněž zvýšená aktivita sympatiku stimuluje imunitní reakci prostřednictvím zvýšených hladin IL‑6 u akutního infarktu myokardu [11].
K posouzení zánětlivé reakce u AKS lze z periferní krve stanovit celkový počet leukocytů, jejich podtypů a stupeň jejich aktivace, hladinu CRP, prokalcitoninu, sérového amyloidu SAA, hladinu fibrinogenu, cytokinů, jako jsou interleukiny IL‑1, IL‑6 a TNFα, hladinu adhezivních molekul, jako jsou sVCAM‑1, sICAM‑1, hladinu povrchových leukocytárních antigenů, jako je sCD40L, hladinu myeloperoxidázy (MPO), matrix ‑ metaloproteináz (MMPs), fosfolipázy Lp ‑ PLA2, plazmatického proteinu PAPP ‑ A a v neposlední řadě i hladinu neopterinu, jak je popisováno v některých dostupných pracích [12].
C ‑ reaktivní protein a jeho biologická role
CRP je protein akutní fáze, který patří do pentraxinové rodiny plazmatických proteinů. Nativní CRP sestává z 5 identických podjednotek o 206 aminokyselinách, které spolu tvoří symetrickou pentamerickou molekulu. CRP je z větší části tvořen hepatocyty. Byla však detekována tvorba CRP i v aterosklerotickém plátu cévní stěny, zejména makrofágy a buňkami hladké svaloviny plátu, spolu s proteiny komplementu [13]. To podporuje koncept endogenní aktivace komplementu v aterosklerotické lézi prostřednictvím CRP. Produkce CRP je řízena cirkulujícími zánětlivými cytokiny, zejména IL‑6 a TNFα. Tyto působky mohou mít původ v různých systémových zdrojích včetně tukové tkáně, a dále v buňkách aterosklerotických lézí a cévní stěny obecně. Hladina CRP stoupá za 6 hod a dosahuje vrcholu za 48 hod po akutním podnětu. Plazmatický poločas CRP je 18 – 20 hod [14]. Přes původní domněnku, že CRP je pouhým ukazatelem vaskulárního zánětu, bylo prokázáno, že hraje aktivní roli v procesu aterogeneze. CRP stimuluje monocyty k uvolňování pro‑zánětlivých cytokinů, jako je IL‑1b, IL‑6 a TNFα, indukuje tvorbu monocytárního chemotaktického proteinu (MCP ‑ 1) a expresi intracelulárních adhezivních molekul (ICAM‑1) a adhezivních molekul cévní stěny (VCAM‑1) endotelovými buňkami [15 – 17]. Tím aktivuje buňky cévní stěny, stimuluje adhezi cirkulujících buněk k endotelu a ovlivňuje funkci koagulačních faktorů [13]. CRP prostřednictvím vazby na FcgRII receptor buněk dále stimuluje fagocytózu a podílí se na tvorbě pěnových buněk opsonizací LDL částic [18]. CRP aktivuje klasickou cestou komplement a tím se podílí na lýze a odstraňování poškozených myokardiálních buněk. U zemřelých pacientů po infarktu myokardu byla zjištěna v infarktové oblasti depozita CRP společně s depozity komplementu C3 a C4 [19]. Možnou aktivní rolí CRP cestou aktivace komplementu při infarktovém poškození myokardu se zabývali i Griseli et al [20]. Po aplikaci humánního CRP u králičího modelu infarktu myokardu došlo ke zvětšení infarktového ložiska o 40 % právě komplementem zprostředkovanou zánětlivou reakcí. Jiná experimentální práce na transgenních myších, které produkovaly humánní CRP, demonstrovala remodelaci a zhoršení funkce levé komory ve srovnání s kontrolami. Na této negativní reakci ve skupině myší s expresí humánního CRP se podílela zvýšená apoptóza a infiltrace makrofágy v hraniční zóně infarktového ložiska, zvýšená exprese chemotaktických molekul MCP ‑ 1 a zvýšená aktivita matrix ‑ metaloproteináz (MMP ‑ 9), které vedly k destrukci extracelulární matrix a následnému zhoršenému hojení jizvy [21].
Dalším mechanizmem, který se může podílet na negativním vlivu CRP u pacientů s AKS, je nadprodukce oxidu dusnatého (NO). Při inkubaci CRP s kardiomyocyty došlo ke zvýšení produkce inducibilní NO ‑ syntázy [22]. Zatímco fyziologické hladiny NO působí kardioprotektivně, vysoké koncentrace NO mají negativně inotropní a cytotoxický efekt na kardiomyocyty a podílejí se na vazodilataci, která může vést k rozvoji kardiogenního šoku [7].
Graf 1. Srovnání časových křivek C‑ reaktivního proteinu ve skupině pacientů s akutním infarktem myokardu s elevacemi ST bez selhání, ve skupině pacientů s akutním infarktem myokardu komplikovaným kardiogenním šokem a ve skupině pacientů se septickým šokem (původní data autorů). 
Diagnostický a prognostický význam CRP u AKS
Fyziologická hladina CRP je ve „zdravé“ populaci velmi nízká. Ve studii MONICA se průměrné hodnoty CRP ve skupinách s narůstajícím věkem pohybovaly od 1,2 do 2 mg/ l [23], ve skupině stabilních pacientů po infarktu myokardu léčených statiny byl medián CRP 1,5 – 2,1 mg/ l [24]. U pacientů s akutním infarktem myokardu dochází k rozvoji zánětlivé reakce za 4 – 8 hod od vzniku AKS infiltrací infarktového ložiska neutrofily. Hodnota CRP narůstá a vrcholí přibližně za 50 hod, tj. 2. – 4. den od vzniku infarktu [25] a k normálním hodnotám se vrací v nekomplikovaných případech po 7 dnech [26]. V dobách, kdy byli pacienti s akutním infarktem myokardu s elevacemi ST (STEMI) léčeni konzervativně, se pohybovaly vrcholové hodnoty CRP v rozmezí 20 – 250 mg/ l. U pacientů s akutním STEMI léčených trombolýzou, u kterých nedošlo k úspěšné reperfuzi, byly hodnoty CRP srovnatelné s hodnotami CRP u pacientů léčených konzervativně, zatímco úspěšná trombolýza vedla k výraznému snížení hodnoty CRP na asi 20 % oproti hodnotám u pacientů léčených konzervativně. Je zajímavé, že zatímco u konzervativně léčených pacientů a/ nebo u pacientů neúspěšně trombolyzovaných byla vysoká korelace mezi hodnotou CRP a velikostí infarktu (r = 0,6; p < 0,01), u pacientů po úspěšné trombolýze byly hodnoty CRP výrazně nižší, než by odpovídalo rozsahu infarktu hodnoceného plochou pod časovou křivkou CK ‑ MB. Rozsah infarktu vysvětloval variaci CRP u pacientů bez zprůchodněné infarktové tepny v 35 %, u pacientů se zprůchodněnou tepnou to bylo pouze 9 % [27].
Rozložení peakových hodnot CRP hodnocených 3. den hospitalizace v neselektované skupině pacientů s AKS (STEMI/ NSTEMI/ NAP) dokumentuje graf 2.
Graf 2. Rozdělení maximálních hodnot C-reaktivního proteinu v konsekutivní skupině 2 092 pacientů hospitalizovaných na Interní kardiologické klinice FN Brno pro akutní koronární syndrom (původní data autorů). 
U revaskularizovaných pacientů může suboptimální reperfuze myokardu na podkladě mikrovaskulární obstrukce vést k nedostatečné oxygenaci kardiomyocytů, stejně jako k akumulaci CRP a složek komplementu v infarktovém ložisku, s následným komplexním reperfuzním poškozením kardiomyocytů [28]. Prokázala to velmi pečlivě provedená studie u pacientů se STEMI léčených primární PCI (jednalo se o homogenní soubor pacientů s 1. infarktem, postižením 1 tepny a uzávěrem infarktové tepny před PCI), u kterých byla mikrovaskulární obstrukce hodnocena pomocí magnetické rezonance (MRI). Celkem 34 % pacientů mělo známky mikrovaskulární obstrukce přetrvávající i po jednom týdnu, což bylo provázeno 2násobnou hodnotu CRP ve srovnání s pacienty bez MRI známek mikrovaskulární obstrukce po jednom týdnu od PCI [29].
V práci Takahashi et al z roku 2003 byl ve skupině pacientů se STEMI přední stěny léčených primární PCI medián vrcholové hodnoty CRP 79 mg/ l (s rozmezím 16 – 270 mg/ l), maxima dosahovaly hodnoty 2. – 4. den. Hodnoty CRP korelovaly s hodnotami IL‑6, ale vrcholová hodnota CRP nekorelovala s kumulativní ani vrcholovou hodnotou CK ‑ MB. Tím bylo potvrzeno, že u revaskularizovaných pacientů s akutním infarktem myokardu není zánětlivá reakce těsně úměrná rozsahu ischemického postižení. Zároveň bylo prokázáno, že hodnota CRP, ale nikoli hodnota CK, korelovala s remodelací levé komory, hodnocené magnetickou rezonancí po 6 měsících [30]. Další práce, která u pacientů s prvním STEMI léčených primární PCI prokázala korelaci hodnot CRP s hodnotami IL‑6 (před PCI, 2. den i za týden po IM), zároveň demonstrovala korelaci CRP s hodnotou solubilního terminálního konce komplementu C5b ‑ 9. I tato práce prokázala, že hodnoty CRP stanovené 2 dny po PCI korelovaly s remodelací levé komory [31]. Podobně v práci japonských autorů, kteří ve skupině 139 pacientů s 1. infarktem přední stěny léčených primární PCI hodnotili rozvoj remodelace levé komory, se ukázala vrcholová hodnota CRP jako nezávislý prediktor remodelace levé komory a peak CRP (25 ± 45 mg/ l) koreloval s objemy levé komory. Při terapii ACE‑inhibitory a beta‑blokátory byly vrcholové hodnoty CRP nižší [32]. Velmi vysoké vrcholové hodnoty CRP > 200 mg/ l byly u pacientů s Q infarktem nezávislým prediktorem ruptury volné stěny levé komory, rozvoje aneuryzmatu a jednoroční mortality [33].
Prognostický význam CRP u pacientů s AKS hodnotila celá řada prací, výběr nejvýznamnějších recentních studií je uveden v tab. 1. Je nutné poznamenat, že většina prací hodnotila CRP v době přijetí a nikoli vrcholové hodnoty CRP. Podle analýzy Scirica et al, provedené u 3 225 pacientů s AKS, byl zjištěn jasný prognostický význam hladiny CRP pro predikci krátkodobé a dlouhodobé mortality a srdečního selhání, pokud bylo stanovení CRP provedeno do 48 hod od vzniku bolestí. Ve skupině pacientů s CRP stanoveným po 48 hod od vzniku bolestí nebyla zjištěna žádná prognostická závislost [34].
Tab. 1. Přehled vybraných publikací, které hodnotily krátkodobý a dlouhodobý prognostický význam CRP u pacientů s NSTEMI a STEMI. Ve všech studiích byl proveden odběr CRP při přijetí. 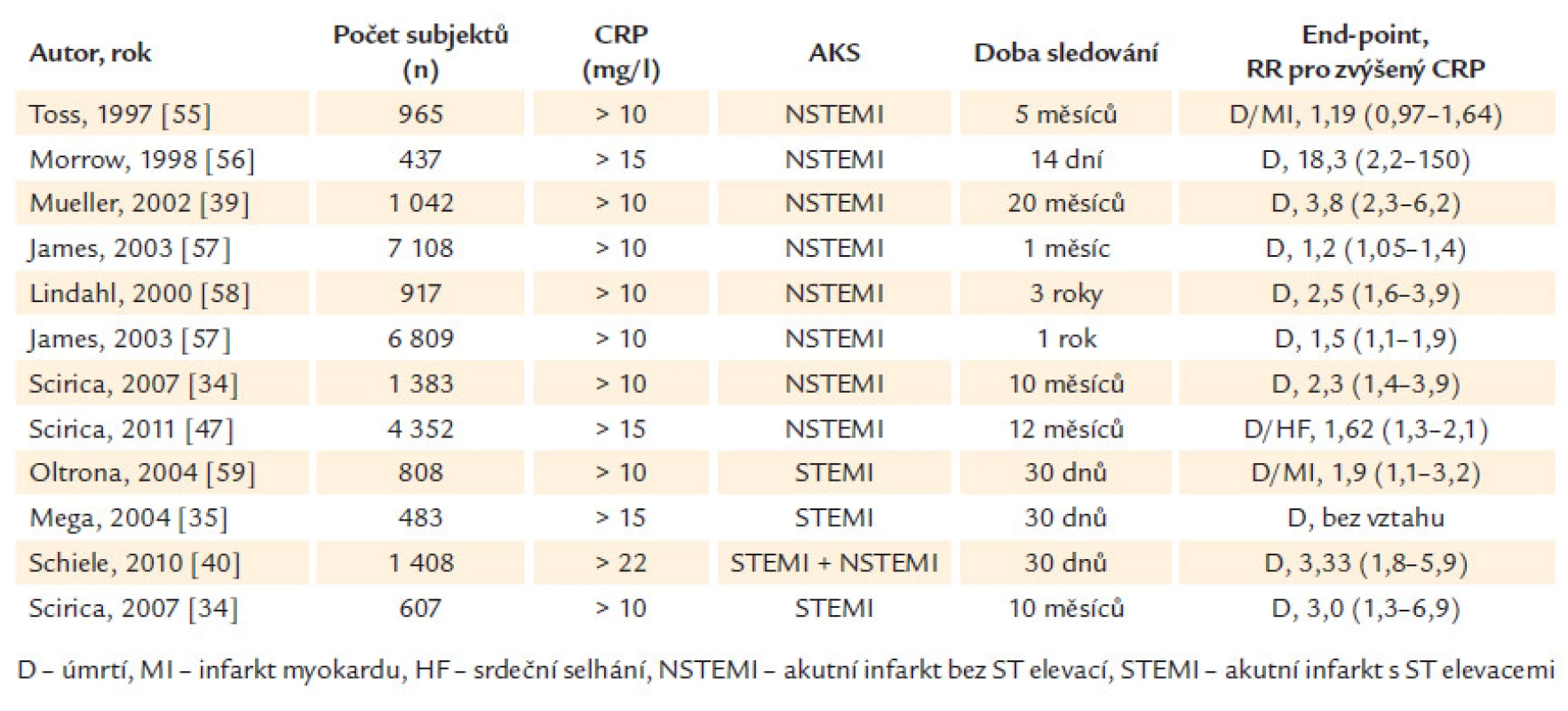
Vstupní hodnoty CRP u pacientů s AKS mohou až 10násobně převyšovat hodnoty CRP u pacientů se známým stabilním onemocněním koronárních tepen nebo u pacientů bez známé ischemické choroby srdeční. Vstupní hodnoty CRP jsou výrazně vyšší u pacientů se STEMI (medián 17,8 mg/ l) ve srovnání s pacienty s NSTEMI (10,6 mg/ l) a nestabilní anginou pectoris (5,8 mg/ l) [34].
Zatímco prognostický význam CRP byl opakovaně prokázán ve studiích u pacientů s NSTEMI, některé studie u pacientů se STEMI jednoznačný prognostický význam CRP neprokázaly [35] (tab. 1). Příkladem je prospektivní multicentrická studie RISCA. Ta hodnotila CRP při přijetí, při propuštění a s odstupem 1 měsíce. Ve skupině pacientů s kombinovaným end‑pointem do 1 roku ve srovnání se skupinou pacientů bez end‑pointu byly sice hodnoty CRP při přijetí významně vyšší [19,5 ± 44,2 vs 13,6 ± 26,1 mg/ l, OR (95% CI) 1,2 (1,1 – 1,4)], hraničně zvýšené po 1 měsíci (5,5 vs 4,9 mg/ l) a srovnatelné při propuštění. Po adjustaci na klinické prognostické parametry (věk, diabetes mellitus, srdeční selhání, glykemie a deprese ST na vstupním EKG) však žádná z hodnot CRP nepřinesla další prognostický význam [36].
Recentní analýzy významu CRP u pacientů s AKS léčených převážně intervenčně
Intervenční léčebný přístup významně zlepšil prognózu pacientů s AKS [37,38]. Prognostický význam CRP v rizikové stratifikaci demonstrovali Mueller et al na souboru 1 042 konsekutivních pacientů s NSTEMI léčených časně invazivním způsobem. CRP byl hodnocen při přijetí a všichni pacienti podstoupili časnou koronarografii se strategií revaskularizace do 24 hod od přijetí. Ve skupině pacientů s CRP < 10 mg/ l byla zjištěna nižší hospitalizační mortalita ve srovnání s pacienty s CRP > 10 mg/ l (1,0 % vs 3,7 %). Je zajímavé, že i v této kohortě pacientů léčených intervenčním přístupem bylo při dlouhodobém sledování přežívání i po 4 letech výrazně lepší ve skupině pacientů s nižší hodnotou CRP (92 % pro CRP < 3 mg/ l a 88 % pro CRP 3 – 10 mg/ l) ve srovnání se skupinou pacientů se vstupní hodnotou CRP > 10 mg/ l (78 %) [39].
Další hodnotnou práci publikovali Schiele et al v roce 2010, kteří v rámci rizikové stratifikace pacientů s AKS hodnotili aditivní přínos CRP k rizikovému skórovacímu systému GRACE. Tento model vychází z věku, tepové frekvence, systolického krevního tlaku, hodnoty kreatininu, známek srdečního selhání, ST denivelací na EKG, oběhové zástavy před přijetím a pozitivity kardiospecifických markerů. Byla vyhodnocena 30denní mortalita celkem u 1 501 pacientů se STEMI/ NSTEMI/ NAP. Hodnocení CRP proběhlo při přijetí s výsledným mediánem CRP 6,4 mg/ l. Čtvrtina pacientů s nejvyšší hodnotou CRP > 22 mg/ l (medián CRP v této skupině byl 66 mg/ l) měla významně vyšší mortalitu ve srovnání s ostatními pacienty s nižším CRP (17,7 vs 4,9 %, p < 0,001). Podle multivariantního modelu byla zvýšená hodnota CRP významným nezávislým prediktorem 30denní mortality [OR (95% CI) 3,3 (1,8 – 5,9)]. Mezi hodnotou GRACE skóre a hladinou CRP byla pouze slabá korelace a variabilita CRP byla vysvětlitelná hodnotou GRACE skóre pouze z 5 %. Hodnota CRP > 22 mg/ l významně zlepšovala předpovědní hodnotu mortality GRACE skóre a model s použitím CRP navíc k parametrům GRACE skóre adekvátně reklasifikoval 12 % pacientů [40].
Cut‑off hodnoty CRP
Pro stanovení cut‑off hodnoty je velmi důležitý časový údaj od vzniku infarktu myokardu k hodnocení (odběru) CRP. Změny hodnot CRP ve skupině pacientů s nekomplikovaným STEMI a ve skupině pacientů s kardiogenním šokem po akutním infarktu myokardu ve srovnání se skupinou pacientů v septickém šoku dokumentuje obr. 1. Ve skupině pacientů se STEMI léčenými konzervativně nebo trombolýzou se hodnoty CRP nad 180 – 250 mg/ l ukázaly jako nezávislý prediktor dlouhodobé prognózy [33,41,42], pokud se jednalo o vrcholovou hodnotu CRP stanovenou 2. – 4. den od vzniku infarktu. Ve skupině pacientů se STEMI léčenými primární PCI byla pro remodelaci levé komory cut‑off hodnota peaku CRP 79 mg/ l [30].
Většina recentních prací využívá k rizikové stratifikaci pacientů s AKS vstupní hodnoty CRP a jako cut‑off uvádí nejčastěji hodnotu 3, 10 nebo 15 mg/ l pro pacienty s NSTEMI a hodnoty CRP > 10 mg/ l pro pacienty se STEMI. Odpovídá to předpokladu výraznější zánětlivé reakce v souvislosti s rozsahem ischemie a nekrózy u pacientů se STEMI [34]. U pacientů se STEMI i NSTEMI se hodnota CRP 22 mg/ l jevila jako vhodná cut‑off hodnota, která zvyšovala prediktivní sílu klinického rizikového skórovacího systému GRACE [40]. Jedna menší studie u pacientů s NSTEMI prokázala, že zvýšená hodnota CRP > 8,7 mg/ l při propuštění je nezávislým prediktorem recidivy infarktu myokardu [43]. Stanovení hodnoty hs ‑ CRP u stabilních pacientů po více než 1 měsíci od infarktu myokardu přináší rovněž informaci navíc, hodnota hs ‑ CRP > 2 mg/ l zvyšovala riziko kardiovaskulárních příhod (2,8 vs 3,9 příhod/ 100 osob/ rok, p = 0,008) bez ohledu na hladinu LDL‑cholesterolu [44]. Podle doporučení Evropské kardiologické společnosti je u pacientů s NSTEMI cut‑off hodnota CRP 10 mg/ l ke stratifikaci pacientů s vyšším rizikem mortality v průběhu následujících 6 měsíců až 4 let [3].
End‑pointy klinických prací spojené se zvýšenou hodnotou CRP
Provedené studie prokázaly prognostický význam CRP u pacientů s AKS především v souvislosti s krátkodobou a dlouhodobou kardiovaskulární a celkovou mortalitou, s rozvojem srdečního selhání a s remodelací levé komory. Některé práce prokázaly rovněž vztah CRP k reinfarktu a nebo k ruptuře levé komory.
Multimarkerová strategie
Celá řada prací využívá k hodnocení prognózy pacientů s AKS více biomarkerů s cílem zjistit, který z nich přináší nejvíce informací a jak se vzájemně nezávisle doplňují.
Rozsah myokardiální nekrózy je hodnocen troponiny, hemodynamický stres natriuretickými peptidy BNP (B‑type natriuretic peptide) a NT ‑ proBNP (amino terminal pro‑B‑type natriuretic peptide), zánětlivá reakce nejčastěji CRP, myeloperoxidázou (MPO) nebo interleukinem 6 (IL‑6), poškození ledvin cystatinem C nebo NGAL ‑ em (neutrophil gelatinase associated lipocalin) [45], poškození extracelulární matrix metaloproteinázami (MMP ‑ 2a MMP ‑ 9) a jejich inhibitory (TIMP ‑ 1), dále jsou hodnoceny markery endotelové aktivace (např. sICAM‑1, endoglin) a markery oxidačního stresu (např. malondialdehyd nebo 8 - hydroxy ‑ deoxyguanosin).
V analýze 917 pacientů s NSTEMI, kteří byli sledováni průměrně po dobu 37 měsíců, byla hodnocena hladina fibrinogenu, CRP a troponinu T a podle multivariantní analýzy byly zvýšené hodnoty troponinu T [> 0,6 µg/ l; HR 10,8 (2,6 – 44,6)] i CRP [> 10 mg/ l; HR 2,3 (1,3 – 4,0)] nezávislými prediktory dlouhodobé mortality z kardiovaskulárních příčin [46]. Multimarkerový přístup využili rovněž autoři recentní rozsáhlé studie Merlin‑TIMI 36 u souboru 4 352 pacientů s NSTEMI publikované v roce 2011. Hodnotili vstupní hodnoty biomarkerů (troponin I, NT ‑ proBNP, hs ‑ CRP a MPO) s jejich předdefinovanými cut ‑ pointy. Průměrná doba sledování byla 1 rok a sledovanými end‑pointy byla kardiovaskulární mortalita, recidiva infarktu myokardu a hospitalizace pro srdeční selhání. Všechny 4 hodnocené biomarkery se po adjustaci na kreatininovou clearance a klinické parametry TIMI risk skóre (věk > 65 let, známá ateroskleróza koronárních tepen se stenózou > 50 %, užití ASA v posledních 7 dnech, opakovaná ataka bolestí v posledních 24 hod, ST deprese na EKG ≥ 0,5 mm, přítomnost více než 3 rizikových faktorů pro aterosklerózu) ukázaly jako samostatné nezávislé prediktory kombinovaného kardiovaskulárního end‑pointu [HRadj 2,71 (p < 0,001) pro troponin I ≥≥ 0,03 ng/ ml; HRadj 3,01 (p < 0,001) pro NT ‑ proBNP ≥ 400 pg/ ml; HRadj 1,45 (p = 0,02) pro hs ‑ CRP ≥ 15 mg/ l; HRadj 1,49 (p = 0,006) pro myeloperoxidázu ≥ 670 pmol/ l]. Pokud však byly hodnoceny všechny 4 biomarkery společně, nezávislými prediktory kardiovaskulární mortality byly pouze troponin I a NT ‑ proBNP. Po adjustaci na všechny parametry TIMI risk skóre (včetně pozitivity troponinu) zvyšoval prediktivní hodnotu TIMI risk skóre pouze NT ‑ proBNP, nikoliv však už myeloperoxidáza či CRP [47]. Podle výsledků této i dalších prací [48] se zdá, že pro rizikovou stratifikaci pacientů s NSTEMI přináší CRP méně informací navíc ke klinickému modelu (jako je např. TIMI risk skóre) než srdeční troponiny nebo natriuretické peptidy.
Infekční komplikace u pacientů hospitalizovaných pro akutní koronární syndrom
CRP je biomarker, který je v klinické praxi běžně užíván k diagnostice zánětu a infekce především. Žádná z výše uvedených prací neřešila možnou otázku podílu infekčních komplikací na zvýšených hodnotách CRP u pacientů hospitalizovaných pro AKS a přínos CRP k diagnostice infekce u těchto pacientů. Nepodařilo se nám najít data, která by hodnotila výskyt infekčních komplikací u konsekutivních pacientů hospitalizovaných pro AKS. Výskyt nozokomiálních infekcí na jednotkách intenzivní péče obecně je přibližně 20 %, průměrná roční incidence je 8 % pro infekce dýchacích cest, 7,9 % pro infekce spojené s žilním katétrem, 7,6 % pro močové infekce a 3,3 % pro sepse. Mortalita pacientů s nozokomiální infekcí je výrazně vyšší ve srovnání s pacienty bez infekce (33,2 % vs 20,0 %, p < 0,001) [49]. Infekcí jsou ohroženi především pacienti se srdečním selháním nebo po kardiopulmonální resuscitaci, kteří jsou na invazivní umělé plicní ventilaci [50]. Mortalita v důsledku samotné pneumonie spojené s umělou plicní ventilací představuje 10 % (95% CI 3 – 17 %) [51]. Ukázalo se, že ani nadměrné nebo preventivní podávání antibiotik u rizikových pacientů není výhodné a komplikace spojené s užíváním antibiotik jsou popisovány u 5 – 25 % pacientů léčených na jednotkách intenzivní péče. Nejčastější komplikací je klostridiová infekce (Clostridium difficile), která se klinicky manifestuje jako průjem (60 %), méně často jako kolitida, zvracení, renální selhání, toxické megakolon, střevní perforace nebo septický šok s relativně vysokou mortalitou [52]. Proto je nutná optimalizace diagnostiky a léčby možné rozvíjející se infekce i u pacientů hospitalizovaných pro AKS.
Ve skupině pacientů po oběhové zástavě léčených kardiopulmonální resuscitací a následně hypotermií byla respirační infekce mikrobiologicky prokázána u 54 % pacientů, peak CRP byl 3. – 4. den (196 mg/ l, 95% CI 138 – 235 mg/ l), vyšší hodnoty měli pacienti s prokázanou infekcí, přičemž cut‑off hodnota 180 mg/ l měla sice 86% specificitu pro průkaz infekce, ale nízkou senzitivitu. Nebyl rozdíl v počtu leukocytů ve skupině s/ bez infekce. Prokalcitonin, jehož hodnota byla stanovována denně a peak 0,85 ng/ ml (0,56 – 4,22 ng/ml) byl 1. den bez ohledu na přítomnost infekce, se neukázal být přínosný k diagnostice infektu v kterémkoliv čase [53]. Ve skupině pacientů s kardiogenním šokem po akutním infarktu myokardu měla 1/ 4 pacientů hodnoty CRP nad 100 mg/ l a prokalcitoninu nad 2 ng/ml, přičemž hodnota prokalcitoninu nad 2 ng/ml neznamenala jasnou sepsi. Jako cut‑off hodnota prokalcitoninu pro vysoce pravděpodobnou sepsi u pacientů v kardiogenním šoku se v porovnání s pacienty v septickém šoku jevila hodnota 10 ng/ml, podle ROC analýzy bylo přínosnější stanovení prokalcitoninu než CRP [54].
Závěr
V průběhu AKS dochází k rozvoji systémové zánětlivé reakce, již vstupní hodnoty CRP jsou ve srovnání se stabilními pacienty zvýšeny. Maxima dosahuje CRP 2. – 4. den, obecně jsou hodnoty CRP vyšší u pacientů se STEMI v porovnání s NSTEMI a NAP. Ke krátkodobé i dlouhodobé rizikové stratifikaci pacientů se častěji užívají vstupní hodnoty CRP, dle doporučení ESC představuje hodnota > 10 mg/ l prediktor horší dlouhodobé prognózy. V neselektované skupině pacientů se STEMI/ NSTEMI léčených časně intervenčně vstupní hodnoty CRP > 22 mg/ l významně zvyšují předpovědní hodnotu GRACE skóre. Vrcholová hodnota CRP > 79 mg/ l u pacientů se STEMI léčených primární PCI předpovídá rozvoj negativní remodelace levé komory. Neexistují spolehlivá data, která by hodnotila vztah infekčních komplikací a CRP u pacientů hospitalizovaných pro AKS. Ve skupině pacientů po KPR hodnota CRP > 180 mg/ l naznačuje pravděpodobnou infekci. U pacientů v kardiogenním šoku je k detekci infektu přínosnější prokalcitonin než CRP, přičemž běžné jsou hodnoty prokalcitoninu > 2 ng/ ml a hodnoty > 10 ng/ ml svědčí pro jednoznačnou infekci.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 65269705 (FN Brno) a projektem European Regional Development Fund – Projekt Fakultní nemocnice u sv. Anny v Brně a ICRC (No. CZ.1.05/ 1.1.00/ 02.0123).
MU Dr. Mgr. Jiří Pařenica, Ph.D.
www.fnbrno.cz
e‑mail: jiri.parenica@atlas.cz
Doručeno do redakce: 4. 4. 2013
Přijato po recenzi: 26. 6. 2013
Zdroje
1. Widimsky P, Zelizko M, Jansky P et al. The incidence, treatment strategies and outcomes of acute coronary syndromes in the “reperfusion network” of different hospital types in the Czech Republic: results of the Czech evaluation of acute coronary syndromes in hospitalized patients (CZECH) registry. Int J Cardiol 2007; 119 : 212 – 219.
2. Pařenica J, Kala P, Jarkovský J et al. Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí. Vnitř Lék 2011; 57 : 43 – 51.
3. Hamm CW, Bassand JP, Agewall S et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST‑segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST‑segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 2999 – 3054.
4. Morrow DA, Cannon CP, Jesse RL et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Circulation 2007; 115: e356 – e375.
5. Hochman JS, Sleeper LA, Webb JG et al. Early revascularization and long‑term survival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006; 295 : 2511 – 2515.
6. Kohsaka S, Menon V, Lowe AM et al. Systemic inflammatory response syndrome after acute myocardial infarction complicated by cardiogenic shock. Arch Intern Med 2005; 165 : 1643 – 1650.
7. Reynolds HR, Hochman JS. Cardiogenic Shock: current concepts and improving outcomes. Circulation 2008; 117 : 686 – 697.
8. Ross R. Atherosclerosis – an inflammatory disease. N Engl J Med 1999; 340 : 115 – 126.
9. Wennberg P, Wensley F, Di Angelantonio E et al. Haemostatic and inflammatory markers are independently associated with myocardial infarction in men and women. Thromb Res 2012; 129 : 68 – 73.
10. Ono K, Matsumori A, Shioi T et al. Cytokine gene expression after myocardial infarction in rat hearts: possible implication in left ventricular remodeling. Circulation 1998; 98 : 149 – 156.
11. Bürger A, Benicke M, Deten A et al. Catecholamines stimulate interleukin‑6 synthesis in rat cardiac fibroblasts. Am J Physiol Heart Circ Physiol 2001; 281: H14 – H21.
12. Kaski JC, Avanzas P, Arroyo ‑ Espliguero R. Neopterin – a forgotten biomarker. J Am Coll Cardiol 2003; 42 : 1142 – 1143.
13. Fay WP. Linking inflammation and thrombosis: Role of C ‑ reactive protein. World J Cardiol 2010; 2 : 365 – 369.
14. Ridker PM. Clinical application of C ‑ reactive protein for cardiovascular disease detection and prevention. Circulation 2003; 107 : 363 – 369.
15. Blake GJ, Ridker PM. Novel clinical markers of vascular wall inflammation. Circ Res 2001; 89 : 763 – 771.
16. Blake GJ, Ridker PM. Inflammatory bio ‑ markers and cardiovascular risk prediction. J Intern Med 2002; 252 : 283 – 294.
17. Blake GJ, Ridker PM. C ‑ reactive protein and other inflammatory risk markers in acute coronary syndromes. J Am Coll Cardiol 2003; 41 (Suppl 4): S37 – S42.
18. Bharadwaj D, Stein MP, Volzer M et al. The major receptor for C ‑ reactive protein on leukocytes is Fcgamma receptor II. J Exp Med 1999; 190 : 585 – 590.
19. Lagrand WK, Niessen HW, Wolbink GJ et al. C ‑ reactive protein colocalizes with complement in human hearts during acute myocardial infarction. Circulation 1997; 95 : 97 – 103.
20. Griselli M, Herbert J, Hutchinson WL et al.C ‑ reactive protein and complement are important mediators of tissue damage in acute myocardial infarction. J Exp Med 1999; 190 : 1733 – 1740.
21. Takahashi T, Anzai T, Kaneko H et al. Increased C ‑ reactive protein expression exacerbates left ventricular dysfunction and remodeling after myocardial infarction. Am J Physiol Heart Circ Physiol 2010; 299: H1795 – H1804.
22. Ikeda U, Maeda Y, Yamamoto K et al. C ‑ Reactive protein augments inducible nitric oxide synthase expression in cytokine ‑ stimulated cardiac myocytes. Cardiovasc Res 2002; 56 : 86 – 92.
23. Koenig W, Sund M, Fröhlich M et al. C ‑ reactive protein, a sensitive marker of inflammation, predicts future risk of coronary heart disease in initially healthy middle ‑ aged men: results from the MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 to 1992. Circulation 1999; 99 : 237 – 242.
24. Ridker PM, Cannon CP, Morrow D et al. C ‑ reactive protein levels and outcomes after statin therapy. N Engl J Med 2005; 352 : 20 – 28.
25. Pietilä K, Harmoinen A, Pöyhönen L et al. Intravenous streptokinase treatment and serum C ‑ reactive protein in patients with acute myocardial infarction. Brit Heart J 1987; 58 : 225 – 229.
26. De Beer FC, Hind CR, Fox KM et al. Measurement of serum C ‑ reactive protein concentration in myocardial ischaemia and infarction. Br Heart J 1982; 47 : 239 – 243.
27. Pietilä K, Harmoinen A, Hermens W et al. Serum C ‑ reactive protein and infarct size in myocardial infarct patients with a closed versus an open infarct‑related coronary artery after thrombolytic therapy. Eur Heart J 1993; 14 : 915 – 919.
28. Beranek JT. C ‑ reactive protein and complement in myocardial infarction and postinfarction heart failure. Eur Heart J 1997; 18 : 1834 – 1836.
29. Ørn S, Manhenke C, Ueland T et al. C ‑ reactive protein, infarct size, microvascular obstruction, and left ‑ ventricular remodelling following acute myocardial infarction. Eur Heart J 2009; 30 : 1180 – 1186.
30. Takahashi T, Anzai T, Yoshikawa T et al. Serum C ‑ reactive protein elevation in left ventricular remodeling after acute myocardial infarction – role of neurohormones and cytokines. Int J Cardiol 2003; 88 : 257 – 265.
31. Mather AN, Fairbairn TA, Artis NJ et al. Relationship of cardiac biomarkers and reversible and irreversible myocardial injury following acute myocardial infarction as determined by cardiovascular magnetic resonance. Int J Cardiol 2013; 20 : 458 – 464.
32. Uehara K, Nomura M, Ozaki Y et al. High‑sensitivity C ‑ reactive protein and left ventricular remodeling in patients with acute myocardial infarction. Heart Vessels 2003; 18 : 67 – 74.
33. Anzai T, Yoshikawa T, Shiraki H et al. C ‑ reactive protein as a predictor of infarct expansion and cardiac rupture after a first Q ‑ wave acute myocardial infarction. Circulation 1997; 96 : 778 – 784.
34. Scirica BM, Morrow DA, Cannon CP et al. Clinical application of C ‑ reactive protein across the spectrum of acute coronary syndromes. Clin Chem 2007; 53 : 1800 – 1807.
35. Mega JL, Morrow DA, de Lemos JA et al. B‑type natriuretic peptide at presentation and prognosis in patients with ST‑segment elevation myocardial infarction: an ENTIRE ‑ TIMI ‑ 23 substudy. J Am Coll Cardiol 2004; 44 : 335 – 339.
36. Bogaty P, Boyer L, Simard S et al. Clinical utility of C ‑ reactive protein measured at admission, hospital discharge, and 1 month later to predict outcome in patients with acute coronary disease: The RISCA (recurrence and inflammation in the acute coronary syndromes) study. J Am Coll Cardiol 2008; 51 : 2339 – 2346.
37. Kala P, Miklik R. Pharmaco ‑ mechanic Antithrombotic Strategies to Reperfusion of the Infarct ‑ Related Artery in Patients with ST‑Elevation Acute Myocardial Infarctions. J Cardiovasc Transl Res 2013; 6 : 378 – 387.
38. Kala P, Kanovsky J, Rokyta R et al. Age‑related treatment strategy and long‑term outcome in acute myocardial infarction patients in the PCI era. BMC Cardiovasc Disord 2012; 12 : 31.
39. Mueller C, Buettner HJ, Hodgson JM et al. Inflammation and long‑term mortality after non‑ST elevation acute coronary syndrome treated with a very early invasive strategy in 1,042 consecutive patients. Circulation 2002; 105 : 1412 – 1415.
40. Schiele F, Meneveau N, Seronde MF et al. C ‑ reactive protein improves risk prediction in patients with acute coronary syndromes. Eur Heart J 2010; 31 : 290 – 297.
41. Pietilä KO, Harmoinen AP, Jokiniitty J et al. Serum C ‑ reactive protein concentration in acute myocardial infarction and its relationship to mortality during 24 months of follow‑up in patients under thrombolytic treatment. Eur Heart J 1996; 17 : 1345 – 1349.
42. Tommasi S, Carluccio E, Bentivoglio M et al. C ‑ reactive protein as a marker for cardiac ischemic events in the year after a first, uncomplicated myocardial infarction. Am J Cardiol 1999; 83 : 1595 – 1599.
43. Biasucci LM, Liuzzo G, Grillo RL et al. Elevated levels of C ‑ reactive protein at discharge in patients with unstable angina predict recurrent instability. Circulation 1999; 99 : 855 – 860.
44. Ridker PM, Cannon CP, Morrow D et al. C ‑ reactive protein levels and outcomes after statin therapy. N Engl J Med 2005; 352 : 20 – 28.
45. Helánová K, Pařenica J, Dlouhý V et al. The importance of NGAL and cystatin C biomarkers in cardiovascular diseases. Vnitř Lék 2012; 58 : 286 – 290.
46. Lindahl B, Toss H, Siegbahn A et al. Markers of myocardial damage and inflammation in relation to long‑term mortality in unstable coronary artery disease. N Engl J Med 2000; 343 : 1139 – 1147.
47. Scirica BM, Sabatine MS, Jarolim P et al. Assessment of multiple cardiac biomarkers in non‑ST‑segment elevation acute coronary syndromes: observations from the MERLIN ‑ TIMI 36 trial. Eur Heart J 2011; 32 : 697 – 705.
48. Apple FS, Pearce LA, Chung A et al. Multiple biomarker use for detection of adverse events in patients presenting with symptoms suggestive of acute coronary syndrome. Clin Chem 2007; 53 : 874 – 881.
49. Januel JM, Harbarth S, Allard R et al. Estimating attributable mortality due to nosocomial infections acquired in intensive care units. Infect Control Hosp Epidemiol 2010; 31 : 388 – 394.
50. Sykora R. Infectious complications in patients after cardiac arrest undergoing therapeutic hypothermia. Vnitř Lék 2011; 57 : 491 – 495.
51. Melsen WG, Rovers MM, Koeman M et al. Estimating the attributable mortality of ventilator‑associated pneumonia from randomized prevention studies. Crit Care Med 2011; 39 : 2736 – 2742.
52. Bergogne ‑ Bérézin E. Treatment and prevention of antibiotic associated diarrhea. Int J Antimicrob Agents 2000; 16 : 521 – 526.
53. Schuetz P, Affolter B, Hunziker S et al. Serum procalcitonin, C ‑ reactive protein and white blood cell levels following hypothermia after cardiac arrest: a retrospective cohort study. Eur J Clin Invest 2010; 40 : 376 – 381.
54. Geppert A, Steiner A, Delle ‑ Karth G et al. Usefulness of procalcitonin for diagnosing complicating sepsis in patients with cardiogenic shock. Intensive Care Med 2003; 29 : 1384 – 1389.
55. Toss H, Lindahl B, Siegbahn A et al. Prognostic influence of increased fibrinogen and C ‑ reactive protein levels in unstable coronary artery disease. Circulation 1997; 96 : 4204 – 4210.
56. Morrow DA, Rifai N, Antman EM et al. C ‑ reactive protein is a potent predictor of mortality independently of and in combination with troponin T in acute coronary syndromes: a TIMI 11A substudy. J Am Coll Cardiol 1998; 31 : 1460 – 1465.
57. James SK, Armstrong P, Barnathan E et al. Troponin and C ‑ reactive protein have different relations to subsequent mortality and myocardial infarction after acute coronary syndrome: A GUSTO ‑ IV substudy. J Am Coll Cardiol 2003; 41 : 916 – 924.
58. Lindahl B, Toss H, Siegbahn A et al. Markers of myocardial damage and inflammation in relation to long‑term mortality in unstable coronary artery disease. N Engl J Med 2000; 343 : 1139 – 1147.
59. Oltrona L, Ottani F, Galvani M. Clinical significance of a single measurement of troponin‑I and C ‑ reactive protein at admission in 1,773 consecutive patients with acute coronary syndromes. Am Heart J 2004; 148 : 405 – 415.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- SAVOR-TIMI 53 – Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Atypická fraktura metatarzální kosti u pacienta s mnohočetným myelomem, který byl dlouhodobě léčen bisfosfonáty
- Úloha biomarkerů v časné diagnostice kardiotoxicity onkologické léčby – editorial
- Kardiální biomarkery – editorial
- Prevalencia diabetickej retinopatie, distálnej symetrickej diabetickej polyneuropatie a screening glomerulárnej filtrácie v čase diagnózy diabetes mellitus 2. typu – kohortná štúdia
- Léčba těžké sepse na pracovištích intenzivní péče v České republice – pilotní výsledky projektu EPOSS
- Nový krevní test biomarkeru SEPT9 a screening kolorektálního karcinomu
- Možnosti genetickej diagnostiky nádorových a zápalových ochorení čriev na Slovensku
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Tyreostatická liečba a jej nežiadúce účinky
- Úloha kardiálnych biomarkerov v monitorovaní kardiotoxicity po transplantácii kmeňových krvotvorných buniek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Tyreostatická liečba a jej nežiadúce účinky
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



