Léčba těžké sepse na pracovištích intenzivní péče v České republice – pilotní výsledky projektu EPOSS
Serious sepsis treatment in intensive care departments in the Czech Republic – EPOSS Project pilot results
Introduction:
Severe sepsis is still associated with significant morbidity and mortality, which is however different, as well as its management, depending on the region. What is the situation in the Czech Republic and what is the character of patients with severe sepsis is currently not known. The aim of the project is to describe the processes of care, outcome and characteristics of patients with severe sepsis admitted to the intensive care department of the Czech Republic.
Methods:
This is a multicentre and observational project with retrospective enrollment of patients who meet the criteria for severe sepsis before or within 24 hours after admission to selected intensive care units (ICU‑ EPOSS).
Results:
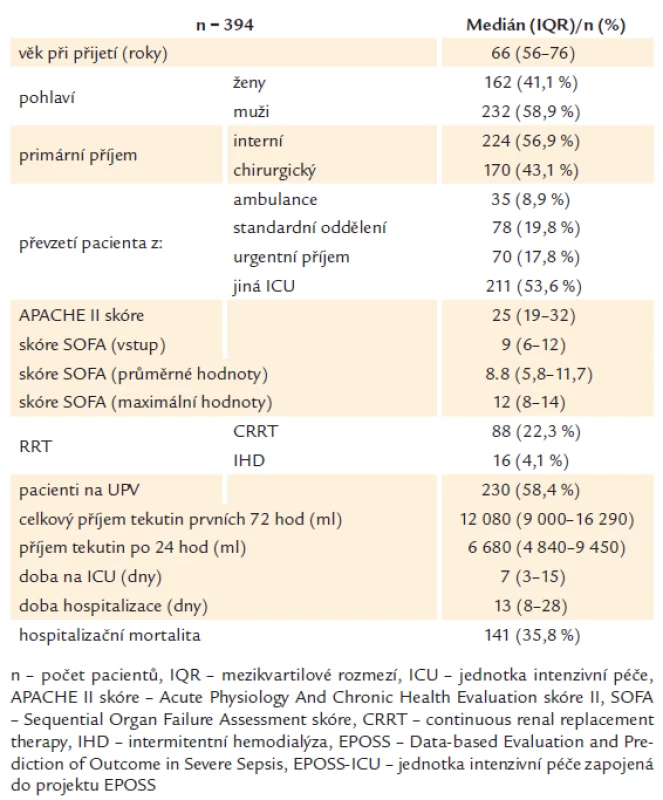
394 patients were analyzed. Median age at admission was 66 (56– 76) years, males predominated (58.9%) and the median APACHE II score on admission was 25 (19– 32). Patients were predominantly medical (56.9%) and most were secondary admitted from other ICU (53.6%). Meeting the criteria of severe sepsis was most frequently within the period (± 4 hours) of admission the EPOSS‑ ICU (77.6%). Median total fluid intake during the first 24 hours was 6,680 (4,840– 9,450) ml. Most patients required mechanical ventilation (58.4%). Compliance with the resuscitation bundle of severe sepsis in our group was very good and was associated with lower mortality of patients. Most frequently, the EPOSS‑ ICU length of stay (LOS) was 7 (3– 15) days and median hospital LOS was 13 (8– 28) days. Hospital mortality in our cohort was 35.8%.
Conclusion:
Introducing the project, which in its first stage obtained valuable and internationally comparable data about patients with severe sepsis admitted to the involved ICU in the Czech Republic.
Key words:
severe sepsis – intensive care – treatment – process of care – outcome
Autoři:
J. Maláska 1; M. Slezák 1; D. Schwarz 17; J. Jarkovský 17
; M. Adamus 2; K. Cvachovec 3; V. Černý 4; P. Dostál 4; M. Fořtová 5; E. Havel 6; I. Herold 7; E. Kasal 8; R. Kula 9; J. Maňák 10; M. Matějovič 11; D. Nalos 12; R. Pařízková 4; A. Šobáňová 13; V. Šrámek 14; J. Tichý 9; R. Turek 15; I. Zýková 16; L. Dušek 17; P. Ševčík 9; Za Projekt Eposs:; V. Agalarev 1; P. Bakalík 1; V. Belanová 13; J. Cerman 6; L. Číž 13; L. Dadák 14; J. Duba 1; J. Fortunato 10; T. Gabrhelík 2; R. Gál 1; R. Hůlek 17; O. Hrdý 1; M. Huchý 8; I. Chytra 8; D. Klimeš 17; J. Klučka 1; M. Kratochvíl 1; L. Kosková 1; J. Máca 9; O. Mašlík 15; M. Matysová 9; P. Minarčíková 1; J. Molnárová 15; H. Ondrášková 1; M. Pelichovská 3; J. Polák 4; R. Schwarz 9; J. Stašek 1; E. Straževská 1; H. Suchomelová 1; P. Suk 1; P. Štourač 1; J. Tichý 9; M. Wolfová 15; R. Uvízl 2; H. Zapletalová 13; J. Zatloukal 9; I. Zimová 1
Působiště autorů:
Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Roman Gál, Ph. D.
1; Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty UP a FN Olomouc, přednosta doc. MU Dr. Milan Adamus, Ph. D.
2; Klinika anesteziologie, resuscitace a intenzivní péče 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MU Dr. Karel Cvachovec, CSc., MBA
3; Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Vladimír Černý, Ph. D., FCCM
4; Anesteziologicko‑resuscitační oddělení Pardubické krajské nemocnice, a. s., Pardubice, přednostka prim. MU Dr. Magdalena Fořtová
5; Chirurgická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Alexander Ferko, CSc.
6; Anesteziologicko‑resuscitační oddělení Oblastní nemocnice Mladá Boleslav, a. s., Mladá Boleslav, přednosta prim. MU Dr. Ivan Herold, CSc.
7; Anesteziologicko‑resuscitační klinika Lékařské fakulty UK a FN Plzeň, přednosta doc. MU Dr. Eduard Kasal, CSc.
8; Anesteziologicko‑resuscitační klinika Lékařské fakulty OU a FN Ostrava, přednosta prof. MU Dr. Pavel Ševčík, CSc.
9; Klinika gerontologická a metabolická Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Luboš Sobotka, CSc.
10; I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Martin Matějovič, Ph. D.
11; Oddělení intenzivní medicíny Masarykovy nemocnice Ústí nad Labem, o. z., přednosta prim. MU Dr. Daniel Nalos
12; Oddělení intenzivní péče operačních oborů Krajské nemocnice T. Bati, a. s., Zlín, přednostka prim. MU Dr. Anna Šobáňová
13; Anesteziologicko‑resuscitační klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MU Dr. Vladimír Šrámek, Ph. D.
14; Anesteziologicko‑resuscitační oddělení Krajské nemocnice T. Bati, a. s., Zlín, přednosta prim. MU Dr. Radovan Turek
15; Anesteziologicko‑resuscitační oddělení Krajské nemocnice Liberec a. s., přednosta prim. MU Dr. Dušan Morman
16; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D.
17
Vyšlo v časopise:
Vnitř Lék 2013; 59(11): 962-970
Kategorie:
Původní práce
Souhrn
Úvod:
Těžká sepse je stále spojena s významnou morbiditou a mortalitou, která se nicméně liší, stejně jako její management, v závislosti na regionu. Jaká je situace v ČR a jaký mají charakter pacienti s těžkou sepsí v současné době, není známo. Cílem projektu je popsat procesy péče, výsledek léčby a charakteristiku pacientů s těžkou sepsí přijímaných na pracoviště intenzivní péče v ČR.
Metodika:
Jedná se o multicentrický a observační projekt s retrospektivním zařazováním pacientů, kteří splní kritéria těžké sepse před nebo do 24 hod od přijetí na vybrané jednotky intenzivní péče (EPOSS‑ ICU).
Výsledky:
Analyzováno bylo 394 pacientů. Medián věku při přijetí byl 66 (56– 76) let, převažovali muži (58,9 %) a medián APACHE II skóre při příjmu byl 25 (19– 32). Příjímaní pacienti byli převážně interního charakteru (56,9 %) a nejvíce příjmů bylo sekundárních z jiných ICU (53,6 %). Splnění kritérií těžké sepse bylo nejčastěji v období (± 4 hod) od příjmu na EPOSS‑ ICU (77,6 %). Medián celkového příjmu tekutin během prvních 24 hod byl 6 680 (4 840– 9 450) ml. Většina nemocných vyžadovala umělou plicní ventilaci (58,4 %). Splnění tzv. resuscitačních balíčků pro těžkou sepsi bylo v našem souboru velmi dobré a bylo spojeno s nižší mortalitou pacientů. Nejčastěji byla délka pobytu na EPOSS‑ ICU 7 (3– 15) dnů a medián celkové doby hospitalizace v nemocnici byl 13 (8– 28) dnů. Celková nemocniční mortalita souboru byla 35,8 %.
Závěr:
Představujeme projekt, který ve své první fázi získal cenná a mezinárodně srovnatelná data o pacientech s těžkou sepsí přijímaných na zapojená pracoviště intenzivní péče v ČR.
Klíčová slova:
těžká sepse – intenzivní péče – léčba – procesy péče – výsledek léčby
Úvod
Sepse je stále závažným medicínským problémem. V Evropě se dle studie SOAP (Sepsis Occurrence in Acutely Ill Patients) sepse vyskytne u asi 35 % pacientů v průběhu jejich pobytu na jednotce intenzivní péče (intensive care unit – ICU) [1]. I přes určité pokroky v terapii se mortalita pacientů s těžkou sepsí pohybuje mezi 20– 70 % v závislosti na věku pacienta, přidružených onemocněních a počtu selhávajících orgánů [2,3]. Ve Spojených státech amerických je odhadována roční incidence asi 751 000 pacientů s těžkou sepsí (tj. sepse spojená s orgánovou dysfunkcí) s průměrnými náklady na jednoho pacienta asi 22 000 USD (asi 440 000 Kč) [2,4].
Motivací ke vzniku tzv. Surviving Sepsis Campaign (SSC, 2002), která je iniciativou několika profesních organizací, byla snaha o zlepšení péče o pacienty se sepsí a snížení jejich mortality. Jedním ze zásadních výstupů byla tvorba doporučení pro léčbu těžké sepse, jehož poslední verze byla publikována v roce 2008 [5]. Součástí doporučení jsou i tzv. Severe sepsis bundles – Balíčky pro léčbu těžké sepse. Jsou rozděleny podle časové naléhavosti: první, resuscitační balíček (Sepsis Resuscitation Bundle) je určen pro prvních 6 hod a druhý, udržovací balíček (Sepsis Management Bundle) se týká prvních 24 hod od stanovení diagnózy těžké sepse. Tyto balíčky zahrnují diagnostické a terapeutické kroky, které dle EBM (evidence‑based medicine, medicína založená na důkazech) ovlivňují prognózu pacientů. Jsou k dispozici výsledky několika studií, u kterých bylo cílem posouzení vlivu respektování doporučovaných balíčků pro léčbu těžké sepse na časnou morbiditu a mortalitu těchto pacientů – rozsáhlá analýza a přehled viz Barochia et al [6]. I když některé pracovaly s velkými populacemi pacientů a ukázaly zlepšení mortality pacientů s těžkou sepsí [6,7], mohou být zatíženy metodologickými nedostatky (např. vytvořením kontrolní skupiny), a tak přinášet rozporuplné výsledky [8]. Implementace zmiňovaných balíčků pro léčbu těžké sepse do denní klinické praxe je náročná [7,9]. Za účelem zlepšení managementu a zvýšení povědomí o sepsi vznikla řada národních aktivit, které vyprodukovaly cenná data (Finsepsis, German Sepsis Society) [10,11]. V České a Slovenské republice již řadu let pracuje Česko‑ slovenské fórum pro sepsi (založeno v lednu roku 2003). Ze Slovenské republiky jsou také k dispozici některá epidemiologická data [12]. V ČR však data o pacientech s těžkou sepsí přijímaných na intenzivní péči chybějí, jsou k dispozici např. jen údaje o incidenci infekční endokarditidy [13].
Projekt EPOSS (Data‑based Evaluation and Prediction of Outcome in Severe Sepsis) má za cíl zjištění základních charakteristik těchto pacientů, popis procesů v jejich managementu a získání dat o výsledku léčby na vybraných ICU v ČR. Tato práce představuje pilotní data tohoto projektu.
Metodika
Projekt je retrospektivní, observační a byl schválen multicentrickou etickou komisí Fakultní nemocnice Brno. Od pacientů nebyl vyžadován písemný informovaný souhlas.
Pilotní projekt byl prováděn od ledna roku 2011 do května roku 2012 na celkem 16 pracovištích intenzivní péče v ČR (EPOSS‑ ICU, seznam viz Appendix). Nábor participujících center byl prováděn oznámeními na národních kongresech, oslovením členů České společnosti intenzivní medicíny (ČSIM) České lékařské společnosti J. E. Purkyně a České společnosti anesteziologie, resuscitace a intenzivní medicíny (ČSARIM) České lékařské společnosti J. E. Purkyně v bulletinech a přímým oslovením vedoucích pracovišť pomocí e‑mailů. Centra byla opakovaně vyzvána k účasti na projektu, který je součástí aktivity Czech Clinical Trial Network a pracuje s podporou odborných společností ČSARIM a ČSIM.
Do registru byla zpětně ze zdravotnické dokumentace nemocného anonymně zadávána vybraná data všech konsekutivních pacientů, kteří před přijetím nebo maximálně v prvních 24 hod na EPOSS‑ ICU splnili kritéria těžké sepse. Data byla zadávána lékaři participujících center prostřednictvím strukturovaných formulářů (elektronický CRF – Case Report Form) do výzkumné databáze s webovým uživatelským rozhraním (http:/ / eposs.registry.cz). Před zahájením projektu a pravidelně v jeho průběhu byla pořádána setkání řešitelů za účelem objasnění sporných bodů při zadávání dat do registru. Pravidelně byla zadávajícím centrům posílána měsíční hlášení s počtem zařazených pacientů, registr měl i trvale otevřenou linku uživatelské podpory s možností kontaktovat koordinátora projektu.
Databáze byla vytvořena a provozována Institutem biostatistiky a analýz LF a PřF Masarykovy univerzity Brno (IBA MU) za podpory výzkumného grantu firmy AstraZeneca. IBA MU ani sponzor neměly možnost zasahovat do zadávání dat. Participující centra jsou vlastníky svých dat a jejich představitelé tvoří odbornou radu projektu.
Demografická, klinická a terapeutická data byla zadávána od času T0 po dobu prvních 7 dní (D1– D7). Čas T0 byl definován jako čas faktického splnění kritérií pro těžkou sepsi. Acute Physiology And Chronic Health Evaluation II skóre (APACHE II) [14] bylo počítáno při příjmu, stejně jako Sequential Organ Failure Assessment skóre (SOFA) [15], které bylo počítáno také dále D2– D7. Při příjmu byly zaznamenávány pohlaví, hmotnost, výška a věk pacienta. V čase T0, T3, T6 byly zaznamenávány hodnoty a dosažení jednotlivých komponent iniciálního balíčku pro léčbu těžké sepse (viz Appendix) [5]. Z dalších terapeutických intervencí bylo v D2– D7 zaznamenáváno použití a konkrétní typ renální eliminační techniky (renal replacement therapy – RRT): tj. kontinuální renální eliminační technika (continuous renal replacement therapy – CRRT) a intermitentní hemodialýza (IHD). Dále v D2– D7 celkový příjem tekutin a nutnost umělé plicní ventilace (UPV).
Centra s nekompletními údaji byla opakovaně vyzvána k doplnění chybějících údajů. Při exportu dat k analýze jsme považovali chybějící data za nedostupná a pacienti, u kterých nebyly k dispozici tzv. povinné položky (viz Appendix), byli bráni jako nevalidní a nebyli zařazeni do další analýzy. Nakonec bylo zaznamenáno propuštění z EPOSS‑ ICU, z nemocnice a event. úmrtí pacienta (na EPOSS‑ ICU nebo v nemocnici). V databázi je také rozlišováno, jestli byl pacient do centra referován z domu, jiné nemocnice nebo zařízení dlouhodobé péče. Dále odkud byl pacient na EPOSS‑ ICU přijat, zda z ambulance, standardního oddělení, urgentního příjmu nebo jiné ICU.
Těžká sepse byla definována jako sepse s přítomností minimálně jedné orgánové dysfunkce vzdálené od místa infekce [16]. Infekce byla definována jako přítomnost patogenního organizmu v původně sterilním prostředí a/ nebo klinicky suspektní infekce s nutností podání antibiotik [17]. Za „chirurgické“ byli považováni pacienti, kteří prodělali chirurgický výkon do 4 týdnů před přijetím na EPOSS‑ ICU. „Traumatologický“ byl označen příjem pacienta na EPOSS‑ ICU přímo spojený s traumatem nebo jako komplikace prodělaného traumatu do 30 dnů před tímto příjmem. Ostatní příjmy na EPOSS‑ ICU byly považovány za interní.
Statistická analýza
Pro popis dat bylo použito standardní popisné analýzy, absolutní a relativní četnosti kategorií pro kategoriální data a medián doplněný interkvartilovým rozpětím (interquartile range – IQR) pro data spojitá. Statistická významnost rozdílů mezi skupinami pacientů v kategoriálních parametrech byla hodnocena pomocí χ2 testu maximální věrohodnosti.
Výsledky
Během období pilotní fáze bylo do projektu zařazeno celkem 470 pacientů. Z EPOSS‑ ICU, které jsou součástí fakultních nemocnic, bylo zařazeno 415 (88,2 %) pacientů. U 57 záznamů nebyly k dispozici všechny povinné údaje a ze sledování bylo rovněž vyřazeno 19 pacientů, u kterých byla splněna kritéria těžké sepse až po 24 hod pobytu na EPOSS‑ ICU (obr. 1). Celkem tak bylo finálně analyzováno 394 záznamů pacientů.
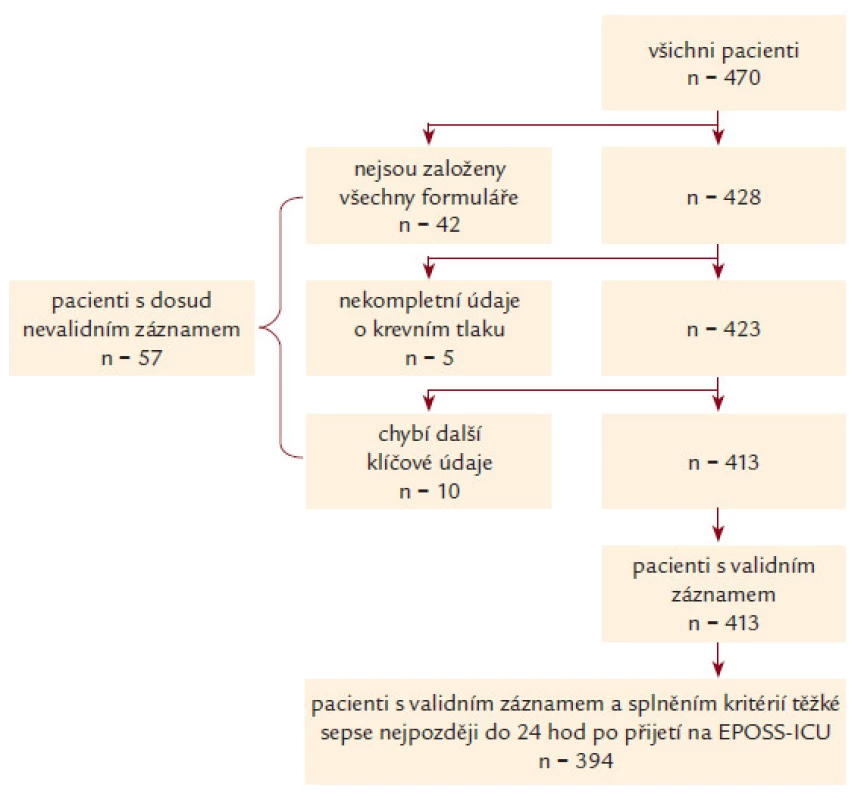
Charakteristika pacientů
Základní demografická data pacientů s těžkou sepsí přijímaných na EPOSS‑ ICU shrnuje tab. 1. V souboru převažovali muži (58,9 %) nad ženami (41,1 %) a medián věku při přijetí byl 66 (56– 76) let. Tíže onemocnění při příjmu na EPOSS‑ ICU byla stanovena na základě APACHE II skóre, medián 25 (19– 32), a stupeň orgánové dysfunkce při příjmu dle vstupního SOFA skóre, medián 9 (6– 12). Medián maximálního SOFA skóre, reflektující stupeň orgánové dysfunkce v průběhu hospitalizace na EPOSS‑ ICU, byl 12 (8– 14) a medián průměrného SOFA skóre byl 8,8 (5,8– 11,7). Příjímaní pacienti byli převážně interního charakteru (56,9 %) a nejvíce příjmů bylo sekundárních z jiných ICU (53,6 %).
Většina nemocných splnila kritéria těžké sepse v časové blízkosti jejich příjmu na EPOSS‑ ICU, tj. krátce (1– 4 hod) před přijetím (28,9 %) a krátce (1– 4 hod) po přijetí (10,4 %) na EPOSS‑ ICU nebo v době přijetí (38,3 %) (obr. 2a). Celkově před přijetím na EPOSS‑ ICU splnilo kritéria těžké sepse celkem 169 pacientů (42,9 %). Tito pacienti (tj. byli již přijímáni s diagnózou těžké sepse) byli nejčastěji přijímáni z jiné ICU (60,9 %), poté ze stan-dardního oddělení (19,5 %), urgentního příjmu (12,4 %) a ambulance (7,1 %, typ nespecifikován) (obr. 2b).


Léčba těžké sepse
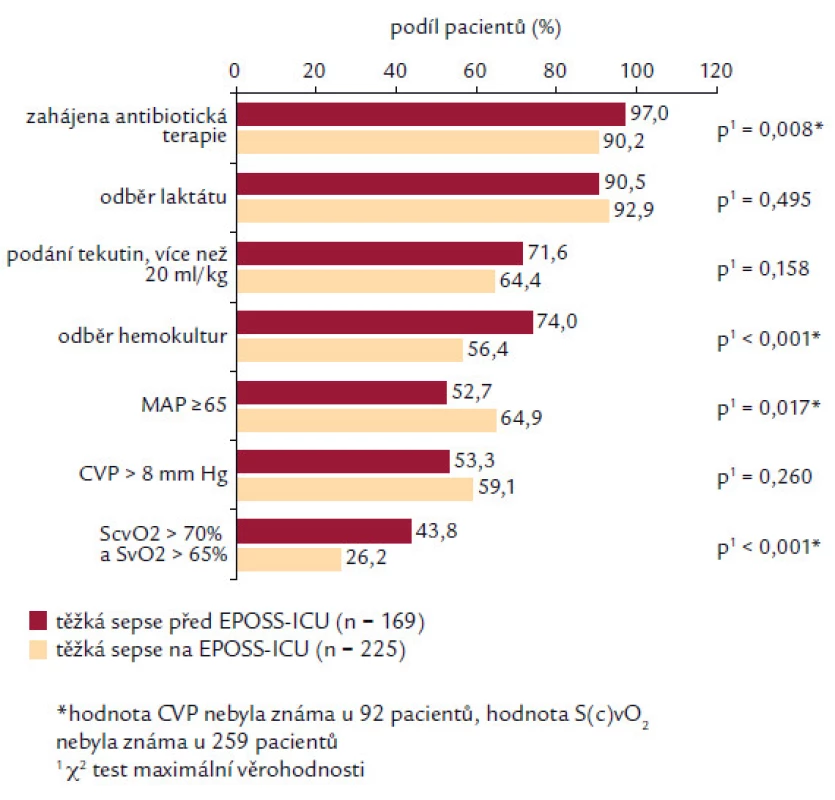
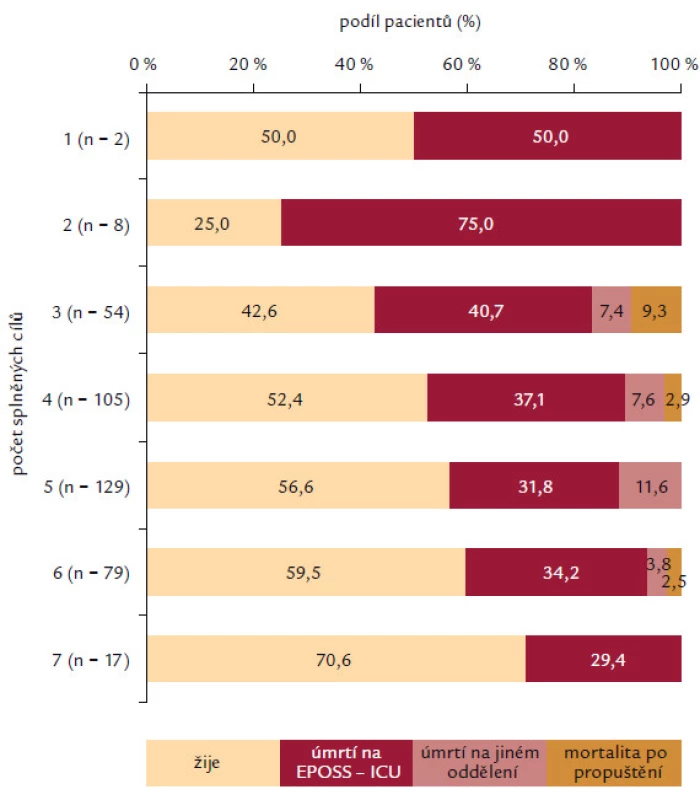
Analyzovány byly 2 skupiny pacientů dle času splnění diagnostických kritérií před nebo až po přijetí na EPOSS‑ ICU. Pokud pacienti splnili kritéria těžké sepse ještě před přijetím na EPOSS‑ ICU, měli častěji nasazené antibiotikum (97,0 % vs90,2 %; p = 0,008), častěji měli odběrhemokultur (74,0 % vs 56,4 %; p < 0,001) a měli větší procento dosažení ScvO2 (saturace centrální venózní krve) > 70 % nebo SvO2 (saturace smíšené venózní krve) > 65 % (43,8 % vs 26,2 %; p < 0,001). Naopak tato skupina pacientů dosahovala v menším procentu MAP > 65 mm Hg (52,7 % vs 65,9 %; p = 0,017). V četnosti podání více než 20 ml/ kg tekutin (71,6 % vs 64,4 %; p = 0,158) a dosažení CVP > 8 mm Hg (59,1 % vs 53,3 %; p = 0,260) a četnosti odběru laktátu (p = 0,495) nebyl zaznamenán signifikantní rozdíl (obr. 3). Při interpretaci je nutné brát na zřetel fakt, že většina pacientů byla na EPOSS‑ ICU překládána z jiného pracoviště intenzivní péče (53,6 %). Analýza asociace splnění jednotlivých cílů v resuscitačním balíčku s mortalitou pacientů v našem souboru je prezentována v obr. 4. Je sledovatelná závislost stoupajícího počtu pacientů, kteří přežili ataku těžké sepse, a splnění počtu položek (od 25,0 % přeživších pacientů při splnění 2 položek až k 70,6 % v případě splnění kompletního balíčku). Nejčastěji bylo u pacientů splněno 5 položek balíčku (32,7 %) a kompletní balíček byl splněn pouze u 17 pacientů (4,3 %).
Medián celkového příjmu tekutin bě-hem prvních 24 hod byl 6 680 (4 840 až 9 450) ml a během prvních 72 hod 12 080 (9 000– 16 290) ml. Během pobytu na EPOSS‑ ICU většina nemocných vyžadovala umělou plicní ventilaci (58,4 %) a podíl pacientů, napojených na některou z forem renálních eliminačních technik, byl 26,4 % (CRRT – 22,3 %, IHD – 4,1 %).
Výsledek léčby pacientů
Nejčastěji byla délka pobytu na EPOSS‑ ICU 7 (3– 15) dnů a medián celkové doby hospitalizace v nemocnici byl 13 (8– 28) dnů. Celková nemocniční mortalita souboru byla 35,8 %.
Diskuze
Charakter a tíže nemocných s těžkou sepsí, která vede k hospitalizaci na ICU zapojených do projektu, jsou podobné jako ve státech s rozvinutým zdravotnictvím. Kritéria těžké sepse jsou nejčastěji splňovány v době kolem příjmu na intenzivní péči. Pacienti jsou nejvíce přijímáni z oborových jednotek intenzivní péče. Adherence k doporučení pro léčbu a výsledek léčby těchto pacientů je srovnatelný s celosvětovou literaturou.
Věkové složení našeho souboru, tj. medián 66 (IQR 56– 76) let, je obdobné jako v epidemiologické observační studii SOAP (Sepsis Occurrence in Acutely Ill Patients), kde medián věku pacientů byl 65 (IQR 51– 74) let [1] a o něco vyšší než v mezinárodní prevalenční studii EPIC II (The Extended Prevalence of Infection in Intensive Care study), kde byl věkový průměr 60,9 (interval spolehlivosti (CI) 60,5– 61,3) let [18]. Je nutné dodat, že první z uváděných studií byla prováděna pouze v Evropě, naopak studie druhá byla mezinárodní včetně kontinentů, jako je Jižní Amerika a Afrika. Na druhé straně rozložení pohlaví při srovnání s výše uvedenými projekty je v našem souboru podobné – náš soubor má zastoupení mužů 58,9 %, studie SOAP 63,0 % a studie EPIC II také 63,0 %.
Závažnost onemocnění dle vstupního APACHE II skóre byla v našem souboru 25 (19– 32) bodů. Srovnání s velkými epidemiologickými studiemi je v tomto případě obtížné, jelikož většinou používají jiný skórovací systém k zhodnocení vstupní tíže onemocnění (např. SAPS II – Simplified Acute Physiology Score). Je však srovnatelné s velkými randomizovanými intervenčními studiemi léčby těžké sepse (studie PROWESS, průměrné APACHE II skóre pro studovanou skupinu 24,6 ± 7,6 (průměr ± směrodatná odchylka (SD)) a pro placebo skupinu bylo 25,0 ± 7,8 (průměr ± SD) [19]. Stupeň orgánové dysfunkce při přijetí na EPOSS‑ ICU (SOFA skóre 9 (6– 12)) bylo vyšší než v již zmiňované studii SOAP (6,5 ± 4,0) [1] a EPIC II (7,2 (7,1– 7,3)). Výše uvedené údaje dokumentují fakt, že naši pacienti s těžkou sepsí byli přijímáni ve velice závažném stavu. V SOFA a EPIC II navíc kritéria těžké sepse nesplnili všichni zařazení pacienti (např. jen 79 % pacientů ve studii SOAP).
Splnění kritérií pro těžkou sepsi bylo nejčastěji situováno do období kolem příjmu na EPOSS‑ ICU (± 4 hod) a nejčastěji byli přijímáni z oborových ICU. Vzhledem k tomu, že jsme nezaznamenávali čas žádosti o příjem a skutečný čas příjmu na EPOSS‑ ICU, tak nemůžeme doložit daty, nicméně se domníváme, že příjem a management těchto nemocných mohl probíhat již za supervize personálu EPOSS‑ ICU. Tomu by odpovídala i skutečnost, že v naší analýze nebyly v léčbě před a po přijetí na EPOSS‑ ICU velké rozdíly. Nebylo ale analyzováno, jak se lišil management léčby dle jednotlivých typů referujícího pracoviště.
V recentní analýze velké databáze pacientů s těžkou sepsí [20] byl analyzován rozdíl v organizaci příjmu na ICU, kdy v USA byla většina (65,1 %) pacientů přijímána z urgentního příjmu oproti Evropě, kdy byla většina (51,5 %) přijímána ze standardních oddělení. Pokud je pacient navíc přijímán cestou standardního oddělení, představuje to dle literatury rizikový faktor pro mortalitu [7]. Organizace příjmu pacienta s těžkou sepsí je v naší zemi, dle předkládaných dat, odlišná, kdy pacienti ze standardních oddělení mají v logistice příjmu často vložený pobyt na oborové ICU.
V souboru převažovali pacienti interního charakteru (56,9 %), což je souladu s daty, které k nám přicházejí z jiných zemí. V již několikrát zmiňované studii SOAP bylo zastoupení pacientů, kteří měli sepsi, téměř identické (57,0 %) jako v našem souboru. Navíc právě nechirurgičtí pacienti měli nejvyšší mortalitu a povaha příjmu byla nezávislý rizikový faktor mortality [1].
V našem souboru bylo v prvních 24 hod podáno nejčastěji 6 680 ml tekutin a během prvních 72 hod nejčastěji 12 080 ml. Nabízí se srovnání se studií Riverse et al., kde průměrný celkový příjem tekutin v prvních 72 hod byl 13 443 ± 6 390 (± SD) ml [21]. Porovnání s retrospektivní analýzou použití tekutin ze studie VASST (The Vasopressin in Septic Shock Trial), kde celkové množství podaných tekutin bylo 6 300 ± 3 500 (± SD) ml, nicméně v období prvních 12 hod, je komplikovanější [22]. Ve zmiňované práci totiž není konkrétně specifikován přesný příjem tekutin za prvních 24 hod. V nedávno publikované, rozsáhlé a randomizované studii CHEST (The Crystalloid versus Hydroxyethyl Starch Trial) porovnávající tekutinovou terapii 0,9% fyziologickým roztokem (FR) oproti 6% hydroxyetylškrobu (HES) u obecné skupiny pacientů na ICU, byl příjem tekutin za prvních 24 hod 2 000 ml u skupiny s HES a 2 600 ml u skupiny s 0,9% FR (podrobnější data u podskupiny pacientů se sepsí zatím nebyla publikována) [23].
Použití umělé plicní ventilace v našem souboru (58,4 %) v porovnání se soubory pacientů s těžkou sepsí z Evropy (68,1 %) a USA (41,4 %) je srovnatelné a logicky je spíše blíže evropské praxi. Renální eliminační techniky byly použity v našem souboru u asi 1/ 4 pacientů (26,4 %) s predominancí kontinuálních metod. Je to o něco více, než udávají studie SOAP (20 %) [1] a EPIC II(13 %) [18].
Srovnání terapie na základě dosažení cílů a splnění intervencí mezi naším souborem a mezi studiemi sledujícími vliv implementace balíčků pro léčbu těžké sepse na kvalitu a výsledek léčby pacientů je obtížnější. Na rozdíl od těchto aktivit, v našem projektu, mapujícím reálnou situaci rutinní praxe managementu pacientů s těžkou sepsí, nebyl zaváděn léčebný protokol. Proto nelze v naší databázi rozlišit, zda je faktické dosažení cíle, který je určen v resuscitačním balíčku, podepřeno konkrétní doporučovanou terapeutickou intervencí.
Nicméně při srovnání s analýzou 384 pacientů [24] je splňování cílů iniciálního balíčku v našem souboru frekventnější, kromě dosažení všech 7 intervencí, kde bylo v našem souboru jen u 4,3 % pacientů oproti 11,2 % ve skupině španělských autorů. V analýze souboru pacientů zařazené do SSC iniciativy bylo dosažení všech cílů vyšší jak v evropských zemích (18,4 %), tak v USA (21,6 %) [20].
V našem souboru je zřejmá souvislost mezi stoupajícím počtem dosahovaných cílů a splněných intervencí resuscitačního balíčku na jedné straně a zvyšujícím se počtem pacientů, kteří přežijí ataku těžké sepse, na straně druhé. V našem souboru bylo nejčastěji splněno 4 nebo 5 parametrů septického balíčku (celkem 59,4 % nemocných). K nejčastěji splněným doporučením patřilo zahájení ATB léčby, odběr laktátu, podání iniciálního bolusu tekutin a odběr hemokultur.
Délka pobytu na EPOSS‑ ICU 7 (3– 15) dní a celková doba hospitalizace 13 (8– 28) dní se nelišila od studie SOAP 6,9 (3,1– 15,0) a 17,8 (8,0– 38,2) dní. Hospitalizační mortalita pacientů zařazených do projektu EPOSS byla 35,8 % (141/ 394 pacientů) a je srovnatelná s evropskými údaji – např. 28denní mortalita ve studii 6S [25] byla 37,0 %. Ve španělské studii s implementací protokolu septických balíčků měla intervenovaná skupina mortalitu srovnatelnou – 37,5 % [24]. SSC iniciativa začínala s nemocniční mortalitou ve sledovaných centrech 37,0 %, která se snížila během periody 2 let na 30,8 % [7]. Podobný projekt v SR, kterým se částečně inspiroval i projekt náš, uvádí nemocniční mortalitu nemocných s těžkou sepsí 51,2 % [12]. Projektu se účastnila pouze vybraná pracoviště a vzorek není zřejmě zcela reprezentativní. Z celkového počtu 84 slovenských ICU se ho účastnilo pouze 12 (tj. 14,3 %). V ČR byla v minulosti provedena pouze jednodenní studie se zjištěním prevalence sepse, která byla 34,2 %, a těžké sepse 16,8 % na zapojených ICU [26].
Jsme si vědomi toho, že projekt má svá omezení. Data v projektu byla pořizována retrospektivně. Tento druh studií se však dnes počtem mezinárodních projektů vyrovná studiím prospektivním nebo randomizovaným. Rozvoj klinických registrů a od nich odvozených sledování (health care research) zasahuje všechny oblasti medicíny a je základem nových metodických postupů hodnocení zdravotnických technologií (Health Technology Assessment). Reprezentativní databáze projektu EPOSS splňuje všechna kritéria kladená na tento typ hodnocení léčebné péče. Vzhledem k tomu, že do projektu jsou s výjimkou jedné zapojeny všechny fakultní nemocnice v ČR a většina krajských nemocnic, lze data považovat za reprezentativní v těchto velkých institucích. Přesto vnitřní organizace nemocnic může být odlišná (např. ne všichni nemocní s těžkou sepsí jsou překládáni na EPOSS‑ ICU) a do budoucna bude jistě prospěšné znalosti o struktuře a organizaci péče doplnit. Také se t.č. nemůžeme vyjádřit k tomu, jak vypadá situace v ostatních, hlavně menších zdravotnických zařízeních. EPOSS také nesledoval nemocné, u kterých vznikla těžká sepse až po delší době (> 24 hod) pobytu na EPOSS‑ ICU a ty nemocné, kteří prodělali ataku těžké sepse a nebyli přijati na EPOSS‑ ICU. Protože nebyla analyzována celková data objemu péče na EPOSS‑ ICU, nemůžeme zde porovnat prevalenci sepse na jednotlivých EPOSS‑ ICU. Tyto údaje jsou důležité pro zpětné hodnocení kvality databáze – např. dodržení konsekutivního zadávání všech nemocných s těžkou sepsí do registru u EPOSS‑ ICU (většina EPOSS‑ ICU však byla lůžková oddělení oborů anesteziologie‑ resuscitace, kde předpokládáme podobné složení nemocných). Problém interní validity dat byl řešen již od počátku projektu a byl zaveden systém validačních procedur, které do analýz nezařazují pacienty, kteří nemají splněné tzv. povinné položky (viz Apendix). Prezentovaná data jsou také v základních demografických charakteristikách srovnatelná s velkými projekty v této oblasti provedenými celosvětově [1,7,18].
Závěr
Projekt EPOSS poskytuje první relevantní informace o pacientech s těžkou sepsí přijímaných na pracoviště intenzivní medicíny v ČR. Výsledky jsou v řadě aspektů srovnatelné s údaji z vyspělých zemí. V rámci projektu EPOSS vznikla informační infrastruktura umožňující další pokračování sběru dat, hodnocení kvality a generování originálních hypotéz tohoto významného segmentu nemocniční péče.
Podporováno cíleným grantem společnosti AstraZeneca.
Projekt EPOSS probíhá pod záštitou Česko‑ Slovenského fóra pro sepsi, České společnosti intenzivní medicíny České lékařské společnosti J. E. Purkyně, České společnosti anesteziologie, resuscitace a intenzivní medicíny České lékařské společnosti J. E. Purkyně a Czech Clinical Trials Network.
Apendix
I. Seznam pracovišť zapojených do projektu:
1. FN Brno – Klinika anesteziologie, resuscitace a intenzivní medicíny, Jihlavská 20, 625 00 Brno‑Bohunice
2. FN u sv. Anny – Anesteziologicko‑resuscitační klinika, Pekařská 53, 656 91 Brno
3. FN Hradec Králové – Klinika anesteziologie, resuscitace a intenzivní medicíny, Sokolská 581, 500 05 Hradec Králové
4. FN Hradec Králové – Klinika gerontologická a metabolická, Sokolská 581, 500 05 Hradec Králové
5. Krajská nemocnice Liberec – Anesteziologicko‑resuscitační oddělení, Husova 10, 460 63 Liberec
6. Klaudiánova nemocnice Mladá Boleslav – Anesteziologicko‑resuscitační oddělení, V. Klementa 47, 293 50 Mladá Boleslav
7. FN Olomouc – Klinika anesteziologie, resuscitace a intenzivní medicíny, I. P. Pavlova 185/ 6, 779 00 Olomouc
8. FN Ostrava – Anesteziologicko‑resuscitační klinika, 17. listopadu 1790, 708 52 Ostrava‑ Poruba 708 52
9. Pardubická krajská nemocnice – Anesteziologicko‑resuscitační oddělení, Kyjevská 44, 532 03 Pardubice
10. FN Plzeň – I. interní klinika, alej Svobody 80, 304 60 Plzeň‑ Lochotín
11. FN Plzeň – Anesteziologicko‑resuscitační klinika, Dr. E. Beneše 13, 305 99 Plzeň‑ Bory
12. FN v Motole – Klinika anesteziologie a resuscitace 2. LF UK a FN v Motole, V úvalu 84, 150 06 Praha 5
13. Masarykova nemocnice Ústí nad Labem – Oddělení intenzivní medicíny, Sociální péče 3316/ 12A, 401 13 Ústí nad Labem
14. Krajská nemocnice T. Bati – Anesteziologicko‑resuscitační oddělení, Havlíčkovo nábřeží 600, 762 75 Zlín
15. Krajská nemocnice T. Bati – Oddělení intenzivní péče operačních oborů, Havlíčkovo nábřeží 600, 762 75 Zlín
II. Povinné položky
Vstupní údaje
chirurgický příjem
převzetí pacienta z
datum přijetí do nemocnice je dřívější než datum narození
výška
datum a čas přijetí pacienta na vaše pracoviště
datum přijetí do nemocnice
příchod pacienta do nemocnice (vašeho centra)
primární příjem
hmotnost
datum a čas splnění kritérií těžké sepse
Sledované parametry – T0
diastolický tlak
SOFA skóre – PaO2
SOFA skóre
SOFA skóre – sérový kreatinin
SOFA skóre – CNS: GCS
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – játra: Bilirubin
SOFA skóre – koagulace: trombocyty
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – FiO2
SOFA skóre – PaO2 (mm Hg)
laktát
střední arteriální tlak
systolický tlak
Sledované parametry – T3
diastolický tlak
systolický tlak
výdej tekutin za první 3 hod
příjem tekutin za první 3 hod
střední arteriální tlak
Sledované parametry – T6
střední arteriální tlak
laktát
příjem tekutin za prvních 6 hod
výdej tekutin za prvních 6 hod
systolický tlak
diastolický tlak
Sledované parametry – T12
laktát
výdej tekutin za prvních 12 hod
příjem tekutin za prvních 12 hod
střední arteriální tlak
diastolický tlak
systolický tlak
Sledované parametry – T24
SOFA skóre – PaO2
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – FiO2
SOFA skóre – koagulace: trombocyty
SOFA skóre – játra: Bilirubin
SOFA skóre – kardiovaskulární systém: hypotenze
střední arteriální tlak
laktát
příjem tekutin
výdej tekutin
diastolický tlak
systolický tlak
SOFA skóre
SOFA skóre – sérový kreatinin
SOFA skóre – CNS: GCS
Sledované parametry – den 3
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – PaO2
systolický tlak
diastolický tlak
bilanci tekutin uveďte od
výdej tekutin od výše uvedeného data
příjem tekutin od výše uvedeného data
laktát
střední arteriální tlak
SOFA skóre
SOFA skóre – sérový kreatinin
SOFA skóre – CNS: GCS
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – játra: Bilirubin
SOFA skóre – koagulace: trombocyty
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – FiO2
Sledované parametry – den 4
střední arteriální tlak
příjem tekutin od výše uvedeného data
výdej tekutin od výše uvedeného data
systolický tlak
diastolický tlak
bilanci tekutin uveďte od
sofa skóre
SOFA skóre – PaO2
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – FiO2
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – koagulace: trombocyty
SOFA skóre – játra: Bilirubin
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – CNS: GCS
SOFA skóre – sérový kreatinin
Sledované parametry – den 5
bilanci tekutin uveďte od
systolický tlak
výdej tekutin od výše uvedeného data
příjem tekutin od výše uvedeného data
střední arteriální tlak
SOFA skóre – PaO2
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – FiO2
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – koagulace: trombocyty
SOFA skóre – játra: Bilirubin
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – CNS: GCS
SOFA skóre – sérový kreatinin
SOFA skóre
diastolický tlak
Sledované parametry – den 6
diastolický tlak
výdej tekutin od výše uvedeného data
příjem tekutin od výše uvedeného data
střední arteriální tlak
SOFA skóre
SOFA skóre – sérový kreatinin
SOFA skóre – CNS: GCS
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – játra: Bilirubin
SOFA skóre – koagulace: trombocyty
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – FiO2
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – PaO2
bilanci tekutin uveďte od
systolický tlak
Sledované parametry – den 7
bilanci tekutin uveďte od
diastolický tlak
systolický tlak
výdej tekutin od výše uvedeného data
píjem tekutin od výše uvedeného data
střední arteriální tlak
SOFA skóre
SOFA skóre – sérový kreatinin
SOFA skóre – CNS: GCS
SOFA skóre – kardiovaskulární systém: hypotenze
SOFA skóre – játra: Bilirubin
SOFA skóre – koagulace: trombocyty
SOFA skóre – dýchání: PaO2/ FiO2
SOFA skóre – FiO2
SOFA skóre – PaO2 (mm Hg)
SOFA skóre – PaO2
Infekce/ léčba ATB
datum a čas podání první dávky ATB
preparát
způsob podání
alespoň jedna otázka ze skupiny Místo infekce – primární zdroj sepse
indikace podání
datum a čas odběru první hemokultury
odběr hemokultury
dávka za 24 hod
Průběh onemocnění a propuštění
další ataka sepse během pobytu na vašem pracovišti
pacient podepsal Informovaný souhlas
kam
propuštění z vašeho pracoviště (dd. mm. rrrr)
Další sledování
hospitalizace v období od propuštění z nemocnice
úmrtí po propuštění z nemocnice
datum kontroly
MU Dr. Jan Maláska, Ph.D.
www.fnbrno.cz
e‑mail: jmalaska@fnbrno.cz
Doručeno do redakce: 25. 1. 2013
Přijato po recenzi: 8. 7. 2013
Zdroje
1. Vincent JL, Sakr Y, Sprung CL et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006; 34: 344– 353.
2. Angus DC, Linde‑ Zwirble WT, Lidicker J et al.Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med 2001; 29: 1303– 1310.
3. Martin GS, Mannino DM, Eaton S et al. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med 2003; 348: 1546– 1554.
4. Chalupka AN, Talmor D. The Economics of Sepsis. Critical Care Clin 2012; 28: 57– 76.
5. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Intensive Care Med 2008; 34: 17– 60.
6. Barochia AV, Cui X, Vitberg D et al. Bundled care for septic shock: An analysis of clinical trials. Crit Care Med 2010; 38: 668– 678.
7. Levy M, Dellinger RP, Townsend S et al. The Surviving Sepsis Campaign: results of an international guideline‑based performance improvement program targeting severe sepsis. Intensive Care Med 2010; 36: 222– 231.
8. Suarez D, Ferrer R, Artigas A et al. Cost‑effectiveness of the Surviving Sepsis Campaign protocol for severe sepsis: a prospective nation‑ wide study in Spain. Intensive Care Med 2011; 37: 444– 452.
9. Reade MC, Huang DT, Bell D et al. Variability in management of early severe sepsis. Emerg Med J 2010; 27: 110– 115.
10. Engel C, Brunkhorst F, Bone HG et al. Epidemiology of sepsis in Germany: results from a national prospective multicenter study. Intensive Care Med 2007; 33: 606– 618.
11. Karlsson S, Varpula M, Ruokonen E et al. Incidence, treatment, and outcome of severe sepsis in ICU‑treated adults in Finland: the Finnsepsis study. Intensive Care Med 2007; 33: 435– 443.
12. Zahorec R, Firment J, Strakova J et al. Epidemiology of Severe Sepsis in Intensive Care Units in the Slovak Republic. Infection 2005; 33: 122– 128.
13. Benes J, Baloun R, Dzupová O. Endocarditis 2007: Results of a multicentric study on occurrence and characteristics of infective endokarditis. Vnitř Lék 2011; 57: 147– 154.
14. Knaus WA, Draper EA, Wagner DP et al. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13: 818– 829.
15. Vincent J, Moreno R, Takala J et al. The SOFA (Sepsis‑related Organ Failure Assessment) score to describe organ dysfunction/ failure. Intensive Care Med 1996; 22: 707– 710.
16. Levy MM, Fink MP, Marshall JC et al. 2001 SCCM/ ESICM/ ACCP/ ATS/ SIS International Sepsis Definitions Conference. Crit Care Med 2003; 31: 1250– 1256.
17. Calandra T, Cohen J. The International Sepsis Forum Consensus Conference on Definitions of Infection in the Intensive Care Unit. Crit Care Med 2005; 33: 1538– 1548.
18. Vincent JL, Rello J, Marshal J et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA 2009; 302: 2323– 2329.
19. Bernard GR, Vincent JL, Laterre PF et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001; 344: 699– 709.
20. Levy MM, Artigas A, Phillips GS et al. Outcomes of the Surviving Sepsis Campaign in intensive care units in the USA and Europe: a prospective cohort study. Lancet Infect Dis 2012; 12: 919– 924.
21. Rivers E, Nguyen B, Havstad S et al. Early goal‑ directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345: 1368– 1677.
22. Boyd JH, Forbes J, Nakada T et al. Fluid resuscitation in septic shock: A positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2001; 39: 259– 265.
23. Myburgh JA, Finfer S, Bellomo R et al. Hydroxyethyl Starch or Saline for Fluid Resuscitation in Intensive Care. N Engl J Med 2012; 367: 1901– 1911.
24. Castellanos‑ Ortega A, Suberviola B, Garcia‑ Astudillo LA et al. Impact of the Surviving Sepsis Campaign protocols on hospital length of stay and mortality in septic shock patients: results of a three‑year follow‑up quasi‑ experimental study. Crit Care Med 2010; 38: 1036– 1043.
25. Perner A, Haase N, Guttormsen AB et al. Hydroxyethyl Starch 130/ 0.42 versus Ringer‘s Acetate in Severe Sepsis. N Engl J Med 2012; 367: 124– 134.
26. Cerny V, Novak I, Sramek V. Prevalence těžké sepse v České republice – prospektivní multicentrická jednodenní studie. Anest Intenziv Med 2003; 15: 218– 222.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Vnitřní lékařství

2013 Číslo 11
- MINISERIÁL: Když ženám stoupá tlak...
- Tirzepatid – nová éra v léčbě nadváhy a obezity
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Specifika v komunikaci s pacienty s ránou – laická doporučení
Nejčtenější v tomto čísle
- Tyreostatická liečba a jej nežiadúce účinky
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
