-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tyreostatická liečba a jej nežiadúce účinky
Thyrostatic treatment and its adverse effects
Antithyroid drugs are relatively simple molecules known as thionamides, which contain a sulfhydryl group and a thiourea moiety within a heterocyclic structure. Propylthiouracil (6 - propyl ‑ 2 - sulfanylidene ‑ 1,2,3,4 - tetrahydropyrimidin‑4 - one) and methimazole (1 - metyl ‑ 2,3 - dihydro‑1H ‑ imidazole ‑ 2 - thione) are the antithyroid drugs used in the United States. Methimazole is used in most of Europe and Asia, and carbimazole – methimazole analogue, is used in the United Kingdom and parts of the former British Commonwealth. Their primary effect is to inhibit thyroid hormone synthesis by interfering with thyroid peroxidase ‑ mediated iodination of tyrosine residues in thyroglobulin and is an important step in the synthesis of thyroxine and triiodothyronine. Propylthiouracil (but not methimazole or carbimazole), can block the conversion of thyroxine to triiodothyronine within the thyroid and in peripheral tissues. Antithyroid drugs may have clinically important immunosuppressive effects. Side effects of thionamides are usually mild, serious untoward effects are observed in < 5% of cases, more frequently during the initial phases of treatment, when the drug daily dose is higher.
Key words:
antithyroid drugs – side effects
Autoři: A. Dokupilová 1; J. Payer 2
Působiště autorů: Kardiologická klinika FN Nitra, Slovenská republika, prednosta MU Dr. Pavol Poliačik, PhD. 1; V. interná klinika Lekárskej fakulty UK a UN Bratislava, Slovenská republika, prednosta prof. MU Dr. Juraj Payer, CSc. 2
Vyšlo v časopise: Vnitř Lék 2013; 59(11): 989-995
Kategorie: Přehledný referát
Souhrn
Tyreostatiká sú relatívne jednoduché molekuly známe ako tionamidy, obsahujú sulfhydrylovú skupinu a polovičný podiel thiourey v heterocyklickej štruktúre. Propylthiouracyl (6 - propyl ‑ 2 - sulfanylidén ‑ 1,2,3,4 - tetrahydropyrimidín ‑ 4 - jeden) a metimazol (1 - metyl ‑ 2,3 - dihydro‑1H ‑ imidazol ‑ 2 - thión) sú tyreostatiká, ktoré sa používajú v USA. Metimazol sa častejšie používa v Európe a Ázii a karbimazol – analóg metimazolu sa používa vo Veľkej Británii a častiach britského Commonwealthu. Primárnym účinkom je inhibícia syntézy tyreoidálnych hormónov následkom interferencie s tyreoperoxidázou, ktorá umožňuje jodidáciu tyrozínových reziduí v tyreoglobulíne a je dôležitým krokom v syntéze tyroxínu a trijódotyronínu. Propyltiouracyl (nie však metimazol a carbimazol) blokuje konverziu tyroxínu na trijódotyronín v štítnej žľaze a periférnych tkanivách. Tyreostatiká majú klinicky dôležité imunosupresívne účinky. Nežiadúce účinky tionamidov sú zvyčajne mierne, závažné neočakávané účinky sa pozorujú v menej ako 5 % prípadov, častejšie sa vyskytujú v úvodnej fáze liečby, kedy je denná dávka lieku najvyššia.
Kľúčové slová:
tyreostatiká – nežiadúce účinkyÚvod
Napriek tomu, že sa tyreostatiká používajú v liečbe hypertyreózy viac ako 60 rokov, stále pretrvávajú kontroverzie ohľadom výberu preparátu a iniciálnej dávky lieku. Vo všeobecnosti predstavujú liečbu prvej voľby pri hypertyreóze alebo ako prípravná liečba pred podaním rádiojódu alebo totálnou tyreoidektómiou. Tyreostatiká sú liekmi prvej voľby aj u tehotných a dojčiacich žien, u detí a adolescentov. Metimazol (MMI) predstavuje liek voľby v Európe a Japonsku, propylthiouracyl (PTU) je preferovaným liekom v USA. Nežiadúce účinky sú vo všeobecnosti zriedkavé. Môžu sa však vyskytnúť aj závažné život ohrozujúce účinky ako napr. agranulocytóza, závažná hepatotoxicita a vaskulitída. Závažnejšie nežiadúce účinky sa častejšie vyskytujú po PTU v porovnaní s MMI a sú závislé od celkovej dávky tyreostatika. PTU zostáva liekom voľby v liečbe hypertyreózy počas prvého trimestra gravidity pre riziko vzniku „metimazolovej embryopatie“ a ako iniciálna liečba tyreotoxickej krízy. Neliečená hypertyreóza v gravidite predstavuje riziko pre matku (riziko vzniku preeklampsie a srdcového zlyhávania) a pre plod (akcelerovaná kostná maturácia, retardácia rastu, predčasné narodenie, narodenie mŕtveho plodu, malformácie plodu). Preto je žiadúce dosiahnutie eutyreózy, hoci zaujímavým fenoménom je tendencia k spontánnej úprave stavu. Na druhej strane v postpartálnom období pozorujeme relaps hypertyreózy v 75 % prípadov. V gravidite a počas laktácie je cieľom použitie čo najnižšej účinnej dávky tyreostatika. V úvode liečby sa odporúčajú kontroly tyreoidálneho statusu raz za 6 týždňov, eutyreoidný stav sa dosiahne za približne 4 – 12 týždňov od začiatku tyreostatickej liečby. Na začiatku ochorenia realizujeme kontroly raz za 2 – 3 mesiace, po stabilizácii stavu je možné realizovať kontroly každých 4 – 6 mesiacov. Supresia TSH môže pretrvávať týždne a mesiace po dosiahnutí normálnych hladín tyreoidálnych hormónov. Odporúčaná dľžka tyreostatickej liečby je 12 – 18 mesiacov. Súčasťou liečby hypertyreózy pri Gravesovej chorobe je aj pravidelné sledovanie hladín protilátok proti TSH receptoru, pretrvávanie ich pozitivity na konci tyreostatickej liečby predstavuje riziko vzniku relapsu. V úvode hypertyreózy volíme vyššie dávky tyreostatika s ohľadom na objem štítnej žľazy a závažnosť hypertyreózy (PTU 300 – 1 000 mg/ pro die, MMI 15 – 30 mg/ pro die), po dosiahnutí eutyreózy je možné znížiť dávku tyreostatika na udržiavaciu úroveň za pravidelných kontrol klinického stavu a laboratórnych parametrov. Udržiavacia liečba u pacientov pozostáva z podávania relatívne nízkej dávky tyreostatika, u MMI je to 5 – 10 mg/ pro die, u PTU je to 100 – 200 mg/ pro die. Tento typ liečby sa označuje ako „titračná metóda“. V liečbe hypertyreózy je možné použiť aj tzv. metódu block ‑ and ‑ replace, ktorá spočíva v podávaní vysokých dávok tyreostatika v kombinácii s levotyroxínom. Jej význam spočíva v tom, že vysoká dávka tyreostatika má väčší imunosupresívny účinok a môže rýchlejšie navodiť remisiu hypertyreózy, pridanie levotyroxínu zabraňuje vzniku hypotyreózy. Nedávne publikované analýzy však nepotvrdili superioritu tejto metódy z hľadiska dosiahnutia permanentnej remisie hypertyreózy. Maximálny efekt uvedenej liečby sa prejaví po 6 mesiacoch. Relaps ochorenia sa najčastejšie vyskytuje 3 – 6 mesiacov po ukončení tyreostatickej liečby, vzniká približne u 50 – 60 % pacientov. Relaps ochorenia vyžaduje použitie definitívnej liečebnej modality (chirurgická liečba alebo rádiojód).
Antityreoidálne látky
Látky s antityreoidálnym účinkom rozdeľujeme do 4 podskupín:
- deriváty thiourey,
- jodidy,
- rádiojód,
- blokátory b receptorov.
Deriváty thiourey: najčastejšie používanými liekmi tejto skupiny sú metylthiouracyl, propylthiouracyl, thiamazol a carbimazol. V klinickej praxi prevažuje používanie predovšetkým derivátov thiourey, preto v práci prevláda charakteristika preparátov prvej skupiny, ale pre úplnosť uvádzame stručnú charakteristiku aj ostatných skupín.
1. Deriváty thiourey
Tyreostatiká majú relatívne jednoduchú molekulu známu ako thionamidy, ktoré obsahujú vo svojej molekule sulfhydrylovú skupinu a polovičný podiel predstavuje thiourea v heterocyklickej štruktúre. Propylthiouracyl (PTU) a metimazol (MMI) sú tyreostatiká, ktoré sa používajú v liečbe hypertyreózy v USA. Metimazol sa častejšie používa v Európe a Ázii a carbimazol (CBM) – analóg metimazolu – vo Veľkej Británii a krajinách britského Commonwealthu. Mechanizmus účinku lieku je v inhibícii syntézy tyreoidálnych hormónov následkom interferencie s tkanivovou peroxidázou, ktorá umožňuje jodidáciu tyrozínových zvyškov v molekule tyreoglobulínu. Toto je kľúčový krok syntézy tyroxínu a trijódotyronínu. Tieto látky nemajú vplyv na tyreoglobulín, ktorý už je vytvorený a uložený v štítnej žľaze, preto sa efekt liečby thionamidmi prejaví až o niekoľko týždňov. Okrem toho majú tyreostatiká ďalšie povšimnutiahodné účinky. PTU (nie však MMI a CBM) blokuje konverziu tyroxínu (T4) na trijódotyronín (T3) v periférnych tkanivách. Ďalšími klinicky významnými vlastnosťami sú ich imunosupresívne účinky. Z literatúry je známe, že u pacientov užívajúcich tyreostatiká dochádza k poklesu sérových koncentrácií protilátok proti TSH receptoru (TRAK) [1] a ďalších dôležitých imunologických molekúl vrátane intracelulárnej adhéznej molekuly 1 [2], interleukínu 2 (IL‑2) a receptorov pre interleukín 6 (IL‑6) [3,4]. K dispozícii máme dôkazy o tom, že tyreostatiká indukujú apoptózu intratyreoidálnych lymfocytov a znižujú expresiu molekúl HLA II. triedy [5]. Viaceré štúdie potvrdili, že pri užívaní tyreostatík sa znížil počet cirkulujúcich T supresorových buniek a stúpol počet T pomocných buniek a NK buniek (natural killer). Napriek týmto dôkazom netreba zabúdať, že akúkoľvek zmenu v imunitnom systéme pacienta treba hodnotiť v kontexte simultánnej úpravy funkcie štítnej žľazy.
Metimazol
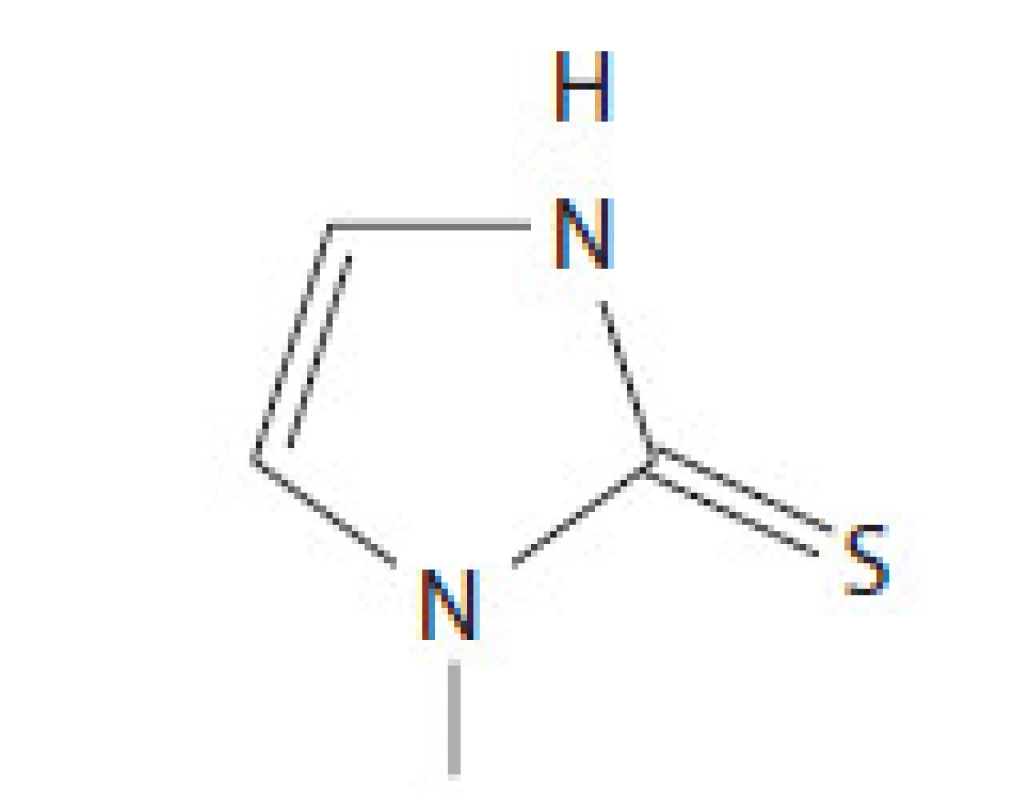
Metimazol (známy ako Tapazol, Thiamazol, ev. MMI) patrí do skupiny thionamidov. MMI inhibuje formáciu tyreoidálnych hormónov interferenciou inkorporácie jodidu do tyrozylových reziduí molekuly tyreoglobulínu. Tento krok je následkom inhibície tyreoperoxidázy, ktorá spôsobí interferenciu oxidácie jodidového iónu a jódotyrozylových zvyškov. Metimazol sa rýchlo absorbuje v gastrointestinálnom trakte, maximum sérových koncentrácií dosahuje 1 – 2 hod po užití lieku. Vďaka dlhému biologickému polčasu viac ako 24 hod je možné MMI podávať 1 – 2 - krát denne. MMI sa v sére zväčša neviaže na bielkoviny plazmy a nie je potrebná úprava dávkovania u detí, starých ľudí a pacientov s renálnym poškodením [6]. V USA je voľba tyreostatika medzi MMI a PTU otázkou preferencie lekára, avšak MMI má svoje výhody v možnosti dávkovania 1-krát denne, čo zlepšuje adherenciu pacienta k liečbe a vďaka svojej farmakokinetike dosahuje rýchlejší pokles koncentrácií tyroxínu a trijódotyronínu. Preferovaným liekom je MMI vďaka menšiemu počtu nežiadúcich účinkov. Zvyčajnou začiatočnou dávkou metimazolu je 15 – 30 mg denne. Dostupné údaje z randomizovanej klinickej štúdie udávajú, že 85 % pacientov dosiahne normálne hladiny tyroxínu a trijódotyronínu po 6 týždňoch liečby dávkou MMI 10 mg denne v porovnaní s 92 % pacientov užívajúcich 40 mg denne. Terapeutický potenciál MMI je 10 – 50 - násobne väčší ako PTU [7]. Štruktúra MMI je na obr. 1.
Propylthiouracyl
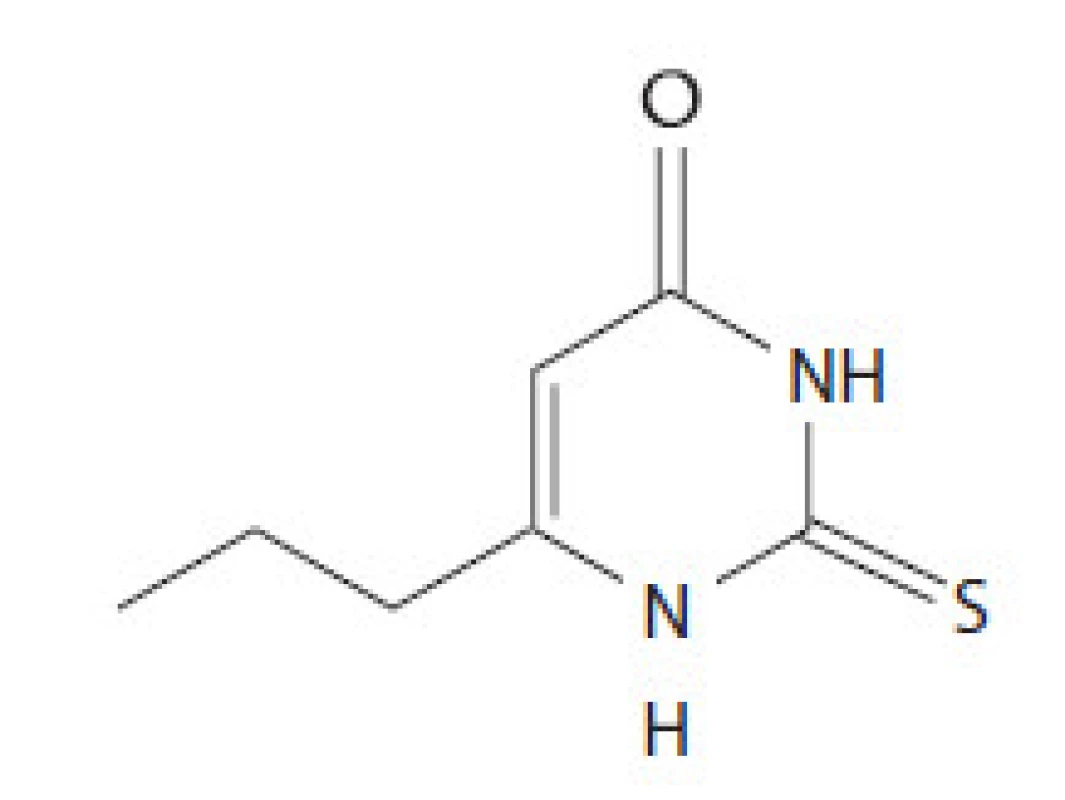
Propylthiouracil (PTU) je ďalší derivát thiouracylu, ktorý sa používa v liečbe hypertyreózy. Tretieho júna 2009 FDA vydala vyhlásenie o riziku závažného hepatálneho poškodenia vrátane hepatálneho zlyhania a smrti v súvislosti s liečbou uvedeným preparátom. Z tohto dôvodu sa neodporúča jeho použitie u tehotných žien (okrem prvého trimestra) a detí ako lieku prvej voľby. Povšimnutiahodným nežiadúcim účinkom je riziko vzniku agranulocytózy. V USA vydala FDA povolenie na jeho používanie v roku 1947. PTU inhibuje enzým tyreoperoxidázu, ktorá sa za fyziologických okolností podieľa na syntéze tyreoidálnych hormónov. Toto je jeden z kľúčových krokov vo formácii tyroxínu (T4). PTU nie je schopný inhibovať Na ‑ dependentný jodidový transportér, lokalizovaný vo folikulárnych bunkách bazolaterálnej membrány. Inhibíciu tohto kroku dokážu iba kompetitívni inhibítori ako perchlorát a thiokyanát. PTU inhibuje aktivitu enzýmu 5’ dejodázy, ktorý umožňuje konverziu T4 na aktívnu formu T3. Preparát sa podáva orálnou formou, vrcholovú koncentráciu v sére dosahuje za 1 hod a aktívne sa koncentruje v tkanive štítnej žľazy. V závislosti od variability jednotlivca je možné dosiahnuť eutyreoidný stav za 2 – 4 mesiace od zahájenia tyreostatickej liečby. Sedemdesiať percent lieku sa viaže na bielkoviny plazmy a liek prechádza placentou. Plazmatický polčas je 1 hod. Menej ako 10 % lieku sa v nezmenenej forme vylúči z tela, zostávajúca frakcia v tele podlieha hepatálnemu metabolizmu cez glukuronidáciu. Zvyčajnou začiatočnou dávku lieku je 300 – 1 000 mg PTU denne rozdelených do 3 dávok. V liečbe hypertyreózy sa využíva aj imunosupresívny efekt tyreostatík. Tyreostatiká účinne znižujú hladinu antityreoidálnych protilátok TRAK, intracelulárnych adhezívnych molekúl, solubilného IL‑2 a hladinu IL‑6, okrem toho majú aj iné in vitro imunomodulačné účinky ako napr. zníženie expresie antigénov HLA. Štruktúra PTU je na obr. 2.
Porovnanie farmakologických vlastností MMI a PTU je v tab. 1.
Tab. 1. Farmakologické charakteristiky MMI a PTU. 
2. Jodidy
Vysoké dávky jodidov majú niekoľko efektov na štítnu žľazu. Inhibujú organifikáciu a uvoľnenie hormónov štítnej žľazy, t.j. zmenšujú jej objem a vaskularizáciu. Do tejto skupiny zaraďujeme napr. Lugolov roztok, ktorý sa používal v 19. storočí v liečbe endemickej strumy a ako aditívum v liečbe tyreotoxickej krízy. Použitie jodidu je možné v prípadoch tyreotoxickej krízy v kombinácii s tyreostatikami, 10 dní pred tyreoidektómiou na zmenšenie veľkosti štítnej žľazy a zníženie jej vaskularizácie. V súčasnosti sa od tohto postupu upúšťa pre riziko závažných nežiadúcich účinkov a predstavuje minoritnú terapeutickú modalitu v liečbe hypertyreózy. Najväčší efekt sa prejaví na 10. – 14. deň kontinuálnej liečby, kedy dochádza k najvýraznejšiemu zlepšeniu symptómov vyplývajúcich z hypertyreózy. Nástup účinku je však veľmi rýchly, jodidy akútne inhibujú sekréciu tyreoidálnych hormónov do hodiny, zodpovedný mechanizmus je však neznámy. Predpokladá sa, že dochádza k inhibícii tvorby peroxidu vodíka, ktorý je v procese organifikácie jódu nezastupiteľný. Vysoké koncentrácie jodidov inhibujú uvoľnenie hormónov pravdepodobne prostredníctvom proteolýzy tyreoglobulínu. Následkom je rýchla blokáda uvoľnenia hormónov do cirkulácie a znížená syntéza tyreoidálnych hormónov vplyvom vysokého obsahu jodidu. Podanie farmakologickej dávky jodidu spôsobuje prechodnú inhibíciu organifikácie jodidu a zníženie syntézy tyreoidálnych hormónov – tento fenomén sa označuje ako Wolf ‑ Chaikoffov efekt. Pokračujúca expozícia nadmernej dávky jodidu v priebehu 2 – 4 týždňov vyvolá vplyvom „escape“ fenoménu z Wolf ‑ Chaikoffovho efektu návrat k normálnej biosyntéze tyreoidálnych hormónov.
3. Rádiojód
Rádiojód je dôležitým rádioizotopom jódu. Prvýkrát bol rádioaktívny izotop jódu použitý v diagnostike štítnej žľazy v roku 1938, ako terapeutická modalita sa používa od roku 1940. Rádiojód sa vychytáva pomocou sodíkovo ‑ jodidového symportéra cez bazálnu membránu folikulových buniek, následne rýchlo oxiduje prostredníctvom peroxidázy a viaže sa na tyrozíny na predilekčných miestach molekuly tyreoglobulínu, kde prebieha jeho organifikácia. Fyzikálny polčas rozpadu je približne 8 dní. Radiojód 131I sa po podaní absorbuje a koncentruje v tkanive štítnej žľazy. Rádioaktívne izotopy obsahujú korpuskulárnu β (99 %) a γ (1 %) zložku. Po podaní sa rádiojód inkorporuje do koloidu, β zložka sa podieľa na deštrukcii parenchymálnej zložky a γ žiarenie, ktoré prechádza tkanivami, je kvantifikovateľné externou detekciou. Zaujímavým poznatkom je, že deti liečené strednou dávkou 131I majú vyššie riziko vzniku karcinómu štítnej žľazy ako deti, ktoré dostali nepomerne vyššiu dávku. Mnohé štúdie pri použití vysokých dávok rádiojódu z indikácie tyreotoxikózy nedokázali zvýšené riziko vzniku karcinómu štítnej žľazy, avšak existuje lineárny vzťah medzi rizikom vzniku karcinómu štítnej žľazy a použitie strednej dávky rádiojódu [8]. Využitie rádiojódu je možné v liečbe multinodóznej toxickej strumy a nodóznej toxickej strumy u starých pacientov so závažnými kardiovaskulárnymi komorbiditami, u pacientov s ťažkou hypertyreózou, v liečbe diferencovaného karcinómu štítnej žľazy ako ablačná liečba po totálnej tyreoidektómii. Je preferovanou liečebnou modalitou v liečbe hypertyreózy v USA a Veľkej Británii, u profesionálnych hercov a spevákov hlavne z kozmetických dôvodov. Liečba hypertyreózy rádiojódom predstavuje efektívnu a šetrnú alternatívu operácie [9], v ambulantnom režime je aj mnohonásobne výhodnejšia z ekonomických dôvodov. Ambulantná liečba 131I nie je vhodná pre pacientov s objemom štítnej žľazy nad 40 ml [9]. Liečba rádiojódom je kontraindikovaná u tehotných a dojčiacich žien.
4. Blokátory β adrenergných receptorov
Hypertyreóza je charakteristická zvýšeným počtom β adrenergných receptorov v mnohých tkanivách. Zvýšená β adrenergná aktivita je zodpovedná za mnohé zo symptómov vrátane tachykardie, tremoru končatín, anxiety a intolerancie tepla. Preto sa beta‑blokátory používajú s cieľom ovplyvnenia týchto typických prejavov hyperkinetickej cirkulácie. V liečbe možno použiť neselektívne beta‑blokátory ako napr. propranolol, ktorý vo vysokých dávkach znižuje hladinu trijódotyronínu o viac ako 30 % inhibíciou 5 - monojóddejodázy, ktorá sa podieľa na konverzii T4 na T3. Je liekom voľby aj pri poruchách srdcového rytmu, ktoré sú vyvolané hypertyreózou, efekt sa prejaví do niekoľkých minút. Použitie beta1 - selektívnych blokátorov je vhodné u pacientov s relatívnymi kontraindikáciami použitia beta‑blokátorov, napr. atenolol je vhodný ako súčasť perioperačnej starostlivosti. Z literatúry máme k dispozícii výsledky štúdií, ktoré porovnávali účinnosť neselektívnych beta‑blokátorov s jednotlivými beta1 - selektívnymi preparátmi (atenolol, metoprolol). Výsledkom je, že nebol pozorovaný štatisticky významný rozdiel medzi uvedenými preparátmi (atenolol, metoprolol vs propranolol). Použitie beta1 – selektívnych stredne a dlho účinkujúcich preparátov je vhodnou a účinnou modalitou v liečbe hypertyreózy [10]. Beta‑blokátory sa podávajú čo najskôr pri potvrdení diagnózy hypertyreózy, pri Gravesovej chorobe je žiadúce jeho podávanie v kombinácii s thionamidmi.
V liečbe hypertyreózy je možné využiť okrem klasického postupu, v ktorom dominujú tyreostatiká a neselektívne beta‑blokátory, aj ďalšie medikamenty. S cieľom vyplaviť zo štítnej žľazy nadmerné zásoby jódu, zodpovedné za vznik hypertyreózy, možno k liečbe pridať chloristan draselný v dávke 800 – 1000 mg/ deň 2 – 6 týždňov [11]. Niektorí autori poukázali na rýchlejšie navodenie remisie tyreotoxikózy týmto spôsobom. Neodporúča sa dlhodobé podávanie uvedeného preparátu pre riziko závažných nežiadúcich účinkov, indukciu agranulocytózy, aplastickej anémie a nefrotického syndrómu. Opisuje sa aj priaznivý účinok vysokých dávok prednisonu (0,5 – 1,25 mg/ kg) [12].
Porovnanie účinnosti MMI a PTU
V súčasnosti máme limitované dáta o účinnosti uvedených preparátov v liečbe hypertyreózy vzhľadom na malý počet realizovaných klinických štúdií. V Japonsku je štandardnou úvodnou dávkou v liečbe hypertyreózy 30 mg MMI, avšak niektoré štúdie uvádzajú, že dávka 15 mg MMI je rovnako účinná. Výsledky štúdie autorov Nakamura et al sú nasledovné: MMI v dennej dávke 30 mg normalizuje T4 rýchlejšie ako PTU v dennej dávke 300 mg [13], dávka 15 mg MMI je vhodná na liečbu ľahších foriem, zatiaľ čo dávka 30 mg MMI sa odporúča na liečbu ťažších foriem. PTU sa neodporúča na iniciálne použitie, po PTU sa častejšie pozorovala mierna hepatotoxicita [13]. Glinoir et al vo svojej práci hodnotia efekt PTU. PTU neodporúčajú podávať deťom, vyhradzujú jeho použitie len pre prípady, kedy nemáme k dispozícii lepšiu alternatívu a v liečbe tyreotoxickej krízy [14]. Predstavuje preferovaný liek vo včasných fázach gravidity, v neskorších fázach odporúča prechod na MMI, kde MMI sa zdá byť logickou alternatívou. Ďalší autori Azizi et al vo svojej práci hodnotia používanie tyreostatík počas gravidity a laktácie, podľa ich záverov tyreostatiká predstavujú liek voľby počas gravidity. Manažment liečby hypertyreózy počas gravidity a laktácie vyžaduje špeciálne postupy s cieľom predísť ich nežiadúcim účinkom na matku, plod a novorodenca [15]. Chen et al vo svojej práci hodnotia vplyv tyreostatík PTU a MMI na plod (hodnotili parametre ako nízka pôrodná hmotnosť, predčasný pôrod, dieťa malé na svoj gestačný vek – small for gestational age – SGA a kongenitálne anomálie). Výsledkom ich štúdie je, že liečba PTU sa spája s vyšším rizikom vzniku SGA v porovnaní s matkami, ktoré tyreostatickú liečbu nedostali [16]. FDA nedávno vydala vyhlásenie o tom, že liečba PTU je asociovaná s vyšším rizikom klinicky závažných nežiadúcich účinkov hlavne hepatálneho poškodenia v porovnaní s MMI u dospelých aj detských pacientov [17].
Nežiadúce účinky
Nežiadúce účinky tyreostatík sú zväčša mierne a ustupujú po prerušení liečby. Závažné neočakávané nežiadúce účinky sa vyskytujú v menej ako 5 % prípadov, častejšie sa vyskytujú na začiatku liečby, keď je denná dávka najvyššia. V prípade výskytu nežiadúceho účinku po jednom tyreostatiku je možná zmena na druhé, ale riziko skríženej reaktivity je v približne 50 % prípadov [18]. Jedným z možných nežiadúcich účinkov je riziko vzniku agranulocytózy, ktorá predstavuje pokles počtu bielych krviniek na menej ako 500 mm3. Vyskytuje sa v 0,3 – 0,6 % prípadov [19]. Táto situácia vyžaduje okamžité ukončenie tyreostatickej liečby a zahájenie antibakteriálnej liečby. Na rýchlu obnovu počtu leukocytov je možné podať granulocyty colony ‑ stimulujúci faktor (G‑CSF). V jednej retrospektívnej japonskej štúdii sa agranulocytóza vyskytla v 0,81 % prípadov pacientov liečených 30 mg MMI a v 0,22 % u tých, ktorí užívali 15 mg denne. Vzhľadom k tomu, že agranulocytóza môže vzniknúť náhle a kedykoľvek v priebehu liečby, odporúča sa pravidelný monitoring počtu bielych krviniek. Pacient musí byť upovedomený o nutnosti vyhľadania lekárskej pomoci v prípade horúčky, bolestí hrdla alebo iných známkach infekcie. Symptómami agranulocytózy sú najčastejšie infekčné lézie hrdla, gastrointestinálneho traktu a kože, pocit choroby a teplota. Agranulocytóza sa najčastejšie vyskytuje počas prvých 3 mesiacov liečby, avšak riziko hepatálneho zlyhania pretrváva počas celej liečby. Častým nežiadúcim účinkom sú kožné prejavy v zmysle vzniku svrbivej vyrážky, nadmerného vypadávania vlasov a vznik kožných pigmentácií. Ďalšími nežiadúcimi účinkami sú nauzea, zvracanie, strata chuti, myalgie, artralgia, cefalea, alergické reakcie a strata vlasovej pigmentácie. FDA klasifikuje PTU ako liek triedy D v tehotenstve. Trieda D znamená riziko vzniku fetálneho poškodenia. V život ohrozujúcich situáciách benefit zo strany matky musí prevládať nad benefitom plodu. PTU je preferovaným liekom iba v 1. trimestri gravidity, kedy prebieha organogenéza a pri plánovanej gravidite. V 2. a 3. trimestri je preferovaným liekom metimazol. Pri užívaní PTU na konci gravidity v blížiacom sa termíne pôrodu môže vzniknúť ľahká hypotyreóza plodu, ktorá sa prejaví vznikom strumy u novorodenca a spôsobuje vzostup TSH plodu. PTU sa odporúča ako liek voľby počas 1. trimestra gravidity vzhľadom k tomu, že MMI je asociovaný s charakteristickými teratogénnymi vplyvmi ako napr. aplasia cutis congenita (ACC), choanálna atrézia, tracheoezofageálne fistuly a iné menej časté abnormality. ACC sa prejavuje ako chýbanie pokožky na lebke, zvyčajne rozmerov od 0,3 do 5 cm [20]. Incidencia ACC varíruje od 0,03 do 0,05 % (0,6 – 1 na 2 000 pôrodov). Uvedená vývinová anomália (lokalizovaná alebo generalizovaná) bola popísaná u pár novorodencov matiek liečených MMI počas gravidity, zatiaľ čo nemáme dáta o výskyte uvedenej anomálie po PTU. Zriedkavé prípady choanálnej atrézie a ezofageálnej atrézie boli popísané u matiek užívajúcich vysoké dávky MMI v skorých štádiách gravidity. Niekoľko prípadov situs viscerum inversus s alebo bez dextrokardie, dysgenéza obličiek bolo popísaných po PTU. Tieto dáta nemajú štatistickú významnosť vzhľadom na malý počet prípadov [21]. Cieľom liečby počas gravidity je dosiahnutie hladiny voľného tyroxínu na hornej hranici normy pre riziko vzniku hypotyreózy plodu a strumy, pretože aj ľahká hypotyreóza matky môže mať negatívne neuropsychologické dopady na plod. Použitie dávky MMI 10 mg denne sa zdá byť bezpečnou počas gravidity aj laktácie.
Nedávne pozorovania poukazujú na možnosť, hoci veľmi zriedkavú, výskytu závažnej hepatotoxicity indukovanej PTU, preto je liekom prvej voľby MMI u detí aj dospelých. V dostupnej literatúre je doteraz známych 42 prípadov hepatálneho zlyhania, 10 prípadov smrti, 5 prípadov nutnosti transplantácie pečene po PTU, z toho asi 30 % boli deti. Menej častý je výskyt hepatopatie (známky cholestázy, nekrózy) po MMI. Incidencia hepatotoxicity indukovanej PTU je 1 na 10 000 pacientov, na začiatku liečby sa môže vyskytnúť prechodný vzostup transamináz. V priebehu tyreostatickej liečby pozorujeme vzostup transamináz asi u 30 % pacientov liečených PTU. Asymptomatický vzostup transamináz býva častým laboratórnym nálezom aj u neliečených pacientov s novozistenou hypertyreózou. Hepatotoxicita indukovaná PTU môže mať široké spektrum prejavov od alergickej hepatitídy sprevádzanej vzostupom markerov hepatálneho poškodenia až po submasívnu alebo masívnu nekrózu pečene získanej z biopsie. Terapia pozostáva z okamžitého ukončenia PTU a liečby potenciálnych komplikácií hepatálneho zlyhania. Riziko hepatotoxicity indukovanej PTU pretrváva počas celej tyreostatickej liečby, najčastejšie však vzniká na začiatku liečby, kedy je dávka tyreostatika najvyššia. V súčasnosti nedokážeme identifikovať pacientov s rizikom vzniku hepatotoxicity indukovanej PTU, preto odporúčame monitorovať transaminázy počas tyreostatickej liečby. V dostupnej literatúre nachádzame aj ojedinelé prípady hepatálneho zlyhania počas gravidity. Fulminantné hepatálne zlyhanie sa počas gravidity najčastejšie vyskytuje v 3. trimestri, v jej etiológii sa uplatňujú faktory súvisiace s pôrodom a infekčné komplikácie [22,23]. V roku 2011 bola v literatúre publikovaná práca o úspešnej transplantácii pečene u pacientky s fulminantným hepatálnym zlyhaním po PTU, ktoré sa objavilo v 2. trimestri gravidity. Celkovo máme k dispozícii dáta o 12 prípadoch transplantácie pečene z indikácie fulminantného hepatálneho zlyhania realizovaným medzi 13. a 27. týždňom gravidity, s 36% pravdepodobnosťou prežitia plodu. V etiológii PTU indukovanej hepatotoxicity sa pravdepodobne uplatňujú reaktívne metabolity lieku a zvýšený oxidatívny stres sa podieľa na aktivácii zápalových a imunologických reakcií [24]. Avšak na úplné pochopenie patofyziológie sú potrebné ďalšie štúdie. PTU je preferovaným liekom u gravidných pacientiek počas 1. trimestra. V 2. a 3. trimestri je preferovaným liekom MMI.
Ďalším závažným nežiadúcim účinkom pri liečbe tyreostatikami je PTU asociovaná vaskulitída s typickým výskytom antineutrofilných cytoplazmatických protilátok (ANCA). PTU indukovaná vaskulitída má široké spektrum klinických prejavov od ľahkých foriem, ktoré sa manifestujú kožnou vyrážkou alebo artralgiou, až po závažné prejavy s postihnutím pľúc a obličiek, ktoré môžu byť život ohrozujúce, ak sú nerozpoznané a neliečené. Známky vaskulitídy zahŕňajú artritídu, výsev vaskulitídy, respiračné príznaky a vznik akútnej renálnej insuficiencie. Táto komplikácia sa zriedkavo vyskytuje počas iniciálnej liečby MMI, kedy sa používajú vyššie dávky lieku, riziko vzniku vaskulitídy sa zvyšuje dľžkou podávania u pacientov liečených PTU [25]. PTU indukovaná vaskulitída môže napadnúť aj ďalšie orgánové systémy ako muskuloskeletálny systém, respiračný trakt, gastrointestinálny trakt, krvotvorbu a nervový systém.
Prehľad nežiadúcich účinkov tyreostatickej liečby je v tab. 2.
Tab. 2. Nežiadúce účinky tyreostatickej liečby. 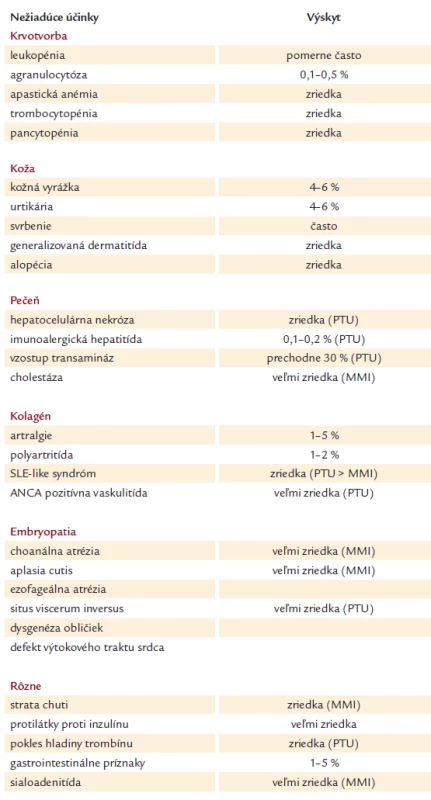
Záver
Tyreostatická liečba predstavuje veľmi efektívnu terapeutickú modalitu v liečbe hypertyreózy. Tyreostatiká sú liekom voľby v liečbe hypertyreózy u detí, gravidných, počas laktácie, používajú sa ako prípravná liečba pred podaním rádiojódu alebo pred totálnou tyreoidektómiou. Nežiadúce účinky sú zriedkavé, avšak nemožno zabúdať ani na ojedinelé, život ohrozujúce nežiadúce účinky v zmysle agranulocytózy, závažnej hepatotoxicity alebo vaskulitídy. Tieto stavy vyžadujú okamžité ukončenie tyreostatickej liečby, v niektorých prípadoch je nutné použitie kortikoidov alebo imunosupresív. Závažnosť nežiadúcich účinkov je závislá od dávky tyreostatika, častejšie sa vyskytujú po PTU. V prípade výskytu nežiadúcich účinkov po jednom tyreostatiku je možná výmena za druhé, avšak skrížená reaktivita sa vyskytuje približne v 50 %. MMI predstavuje preferovaný preparát v liečbe hypertyreózy s výnimkou 1. trimestra gravidity. Vzhľadom na riziko vzniku „metamizolovej embryopatie“ v 1. trimestri zahajujeme liečbu hypertyreózy preparátom PTU najnižšou možnou dávkou tak, aby hladina fT4 bola na hornej hranici normy, následne prechádzame na liečbu MMI. Vzhľadom na aditívny efekt PTU na periférnu konverziu T4 na T3, je PTU liekom voľby pri liečbe tyreotoxickej krízy. Použitie tyreostatík počas laktácie sa ukazuje ako bezpečné, dávka MMI 10 mg pro die neovplyvňuje negatívne funkciu štítnej žľazy novorodenca. Nevyhnutnou súčasťou manažmentu liečby hypertyreózy je sledovanie potenciálnych nežiadúcich účinkov tyreostatickej liečby.
MU Dr. Adriana Dokupilová
www.fnnitra.sk
e‑mail:dokupilovaa@hotmail.com
Doručeno do redakce: 23. 4. 2013
Přijato po recenzi: 5. 7. 2013
Zdroje
1. Laurberg P, Wallin G, Tallstedt L et al. TSH ‑ receptor autoimmunity in Graves’disease after therapy with anti‑thyroid drugs, surgery, or radioiodine: a 5‑year prospective randomized study. Eur J Endocrinol 2008; 158 : 69 – 75.
2. Sonnet E, Massart C, Gibassier J et al. Longitudinal study of soluble intercellular adhesion molecule ‑ (ICAM‑1) in sera of patients with Graves’ disease. J Endocrinol Invest 1999; 22 : 430 – 435.
3. Tsatsoulis A, Vlachoyiannopoulos PG, Dalekos GN et al. Increased serum interleukin‑1 beta during treatment of hyperthyroidism with antithyroid drugs. Eur J Clin Invest 1995; 25 : 654 – 658.
4. Salvi M, Girasole G, Pedrazzoni M et al. Increased serum concentrations of interleukin‑6 (IL‑6) and soluble IL‑6 receptor in patients with Graves’ disease. J Clin Endocrinol Metab 1996; 81 : 2976 – 2979.
5. Zantut ‑ Wittmann DE, Tambascia MA, da Silva Trevisan MA et al. Antithyroid drugs inhibit in vivo HLADR expression in thyroid follicular cells in Graves’ disease. Thyroid 2001; 11 : 575 – 580.
6. Cooper DS, Steigerwalt S, Migdal S. Pharmacology of propylthiouracil in thyrotoxicosis and chronic renal failure. Arch Intern Med 1987; 147 : 785 – 786.
7. Hegedus L. Treatment of Graves’ hyperthyroidism: evidence based and emerging modalities. Endocrinol Metab Clin North Am 2009; 38 : 355 – 371.
8. Rivkees Scott A, Sklar C, Freemark M. Clinical Review 99: The Management of Graves’ Disease in Children, with Special Emphasis on Radioiodine Treatment. J Clin Endocrinol Metab 1998; 83 : 3767 – 3776.
9. Jiskra J, Kubinyi J, Telička Z. Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta: Vnitř Lék 2012; 58 : 94 – 98.
10. Shikara MM, Polena S, Solinas A et al. Clinical Manifestations of Hyperthyroidism after Treatment with Selective b1 Adrenoceptor Blocking Agents. Proc West Pharmacol Soc 2003; 46 : 125 – 126.
11. Podoba J, Zajacová H. Amiodarón a poruchy funkcie štítnej žľazy. Cardiol 2000; 9 (Suppl 1): S20 – S24.
12. Harjai KJ, Licata AA. Effects of Amiodarone on Thyroid Function. Ann Intern Med 1997; 126 : 63 – 73.
13. Nakamura H, Noh JY, Itoh K et al. Comparison of Methimazole and Propylthiouracil in Patients with Hyperthyroidism Caused by Graves Disease J. Clin Endocrinol Metab 2007; 92 : 2157 – 2162.
14. Glinoer D, Cooper DS. The propylthiouracil dilemma. Curr Opin Endocrinol Diabetes Obes 2012; 19 : 402 – 407.
15. Azizi F, Amouzegar A. Management of hyperthyroidism during pregnancy and lactation. Eur J Endocrinol 2011; 164 : 871 – 876.
16. Chen CH, Xirasagar S, Lin CC et al. Risk of adverse perinatal outcomes with antithyroid treatment during pregnancy: A nationwide population‑based study. Int J Obst Gynaecol 2011; 118 : 1365 – 1373.
17. Karras S, Tzotzas T, Krassas GE. Toxicological considerations for antithyroid drugs in children. Expert Opin Drug Metab Toxicol 2011; 7 : 399 – 410.
18. Ahmed K, Rao S, Simha V. ANCA ‑ positive vasculitis in a patient with Graves’ disease: cross ‑ reaction between propylthiouracil and methimazole. Endocr Pract 2010; 9 : 1 – 11.
19. Bartalena L, Bogazzi F, Martino E. Adverse effects of thyroid hormone preparations and antithyroid drugs. Drug Safety 1996; 15 : 53 – 63.
20. Diav ‑ Citrin O, Ornoy A. Teratogen Update: Antithyroid Drugs – Methimazole, Carbimazole, and Propylthiouracil. Teratology 2002; 65 : 38 – 44.
21. Clementi M, Di Gianantonio E, Cassina M et al. SAFE ‑ Med Study Group. Treatment of hyperthyroidism in pregnancy and birth defects. J Clin Endocrinol Metab 2010; 95: E337 – E341.
22. Toti L, Manzia TM, Romano P et al. Successful management of a same day emergency delivery and liver transplant in a 27 weeks pregnant woman with fulminant hepatic failure. Transpl Int 2010; 23 : 114 – 115.
23. Rahman TM, Wendon J. Severe hepatic dysfunction in pregnancy. QJM 2002; 95 : 343 – 357.
24. Karras S, Memi E, Kintiraki E et al. Pathogenesis of propylthiouracil‑related hepatotoxicity in children: present concepts. J Pediatr Endocrinol Metab 2012; 25 : 623 – 630.
25. Cin MO, Gursoy A, Morris Y et al. Prevalence and clinical significance of antineutrophil cytoplasmic antibody in Graves’ patients treated with propylthiouracil. Int J Clin Pract 2009; 63 : 299 – 302.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- SAVOR-TIMI 53 – Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Atypická fraktura metatarzální kosti u pacienta s mnohočetným myelomem, který byl dlouhodobě léčen bisfosfonáty
- Úloha biomarkerů v časné diagnostice kardiotoxicity onkologické léčby – editorial
- Kardiální biomarkery – editorial
- Prevalencia diabetickej retinopatie, distálnej symetrickej diabetickej polyneuropatie a screening glomerulárnej filtrácie v čase diagnózy diabetes mellitus 2. typu – kohortná štúdia
- Léčba těžké sepse na pracovištích intenzivní péče v České republice – pilotní výsledky projektu EPOSS
- Nový krevní test biomarkeru SEPT9 a screening kolorektálního karcinomu
- Možnosti genetickej diagnostiky nádorových a zápalových ochorení čriev na Slovensku
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Tyreostatická liečba a jej nežiadúce účinky
- Úloha kardiálnych biomarkerov v monitorovaní kardiotoxicity po transplantácii kmeňových krvotvorných buniek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Tyreostatická liečba a jej nežiadúce účinky
- Zánětlivá reakce a význam C‑ reaktivního proteinu u pacientů s akutním koronárním syndromem
- Význam hodnotenia EKG v diagnostike pľúcnej embólie
- Manažment povrchovej tromboflebitídy. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání