-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
Specificities of the diagnostics and therapy of exocrine pancreatic insufficiency
Exocrine pancreatic insufficiency develops steadily; however, the initial reduction in secretion is practically not diagnosable. More advanced stages, which usually replicate morphological changes, can be determined with tests which asses the exocrine pancreatic capacity. Substantial damage of the pancreas and replacement of viable parenchyma with connective tissue is accompanied by the occurrence of steatorrhoea. This corresponds to a reduction in exocrine pancreatic secretion below 10% of physiological secretion. Exocrine pancreatic secretion tests are still not sufficiently sensitive for diagnosing early stages of pancreas defects and thus are not suitable for diagnostics. Furthermore, detecting reduced exocrine secretion does not provide any information about the aetiology of the disease, e.g. inflammation/tumor. The most precise test is a costly examination, including a stimulation of the gland with enterohormones; however, breath tests are usually recommended for the assessment of exocrine insufficiency therapy. Exocrine pancreatic insufficiency therapy consists of administering drugs containing pancreatin (amylase, lipase, and peptidase) to patients diagnosed with steatorrhoea, manifest pancreatic insufficiency. As standard, capsules containing microparticles of 1–2mm are recommended. They have a protective coating that prevents inactivation in the microparticles of the contained enzymes by gastric hydrochloric acid. The drug should be administered during each meal, i.e. several times a day. The most common mistake during pancreatic enzyme therapy is underdosage. The following rule applies to patients with digestive insufficiency: 40,000–50,000 UNT of lipase are to be administered during “main meals” and 25,000 UNT of lipase during morning or afternoon snacks. The drug should be taken during the meal; insufficient treatment and dosage are associated with insufficient digestion and absorption of a number of substances and also with pancreatic malabsorption.
Key words:
pancreatic secretion – pancreatic enzymes – pancreatin – pancreatic secretion tests
Autoři: Petr Dítě 1
; I. Novotný 2; P. Kocna 3; M. Bojková 4; T. Kupka 4; H. Nechutová 5; Bohuslav Kianička 5
Působiště autorů: Akademické centrum gastroenterologie a gastroonkologie OU Ostrava, vedoucí pracoviště prof. MUDr. Petr Dítě, DrSc. 1; Gastroenterologické oddělení Masarykova onkologického ústavu Brno, vedoucí pracoviště MUDr. Milana Šachlová, CSc. et Ph. D. 2; Ústav lékařské biochemie a laboratorní diagnostiky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA 3; Interní klinika Lékařské fakulty OU a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 4; Gastroenterologické oddělení II. interní kliniky Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc. 5
Vyšlo v časopise: Vnitř Lék 2013; 59(1): 65-70
Kategorie: Přehledný referát
Souhrn
Exokrinní pankreatická nedostatečnost se vyvíjí plynule, avšak iniciální snížení sekrece není prakticky diagnostikovatelné, pokročilejší stadia, většinou kopírující změny morfologické, lze stanovit testy, posuzujícími exokrinní pankreatickou kapacitu. Při významné devastaci pankreatu a náhradě funkčního parenchymu vazivem je přítomna steatorea a tento nález odpovídá snížení exokrinní pankreatické sekrece pod 10 % fyziologické sekrece. Testy exokrinní pankreatické sekrece nejsou stále dostatečně citlivé pro diagnostiku časných stadií postižení pankreatu, a proto se k diagnostice nehodí, navíc nález snížené exokrinní sekrece nic neříká o etiologii onemocnění, např. zánět/nádor. Nejpřesnějším testem je ekonomicky nákladný test se stimulací žlázy enterohormony, ale pro posuzování efektu terapie exokrinní nedostatečnosti jsou doporučovány testy dechové. Terapie exokrinní pankreatické nedostatečnosti spočívá v podávání léků s obsahem pankreatinu (amyláza, lipáza, peptidáza), a to nejen u osob se steatoreou anebo manifestní pankreatickou nedostatečností. Jako standard jsou doporučeny preparáty ve formě kapslí, které obsahují mikročástice 1,0–2,0 mm velké, s ochranným obalem proti inaktivaci v mikročásticích obsažených enzymů žaludeční kyselinou chlorovodíkovou. Lék má být podáván při každém jídle, tj. několikrát denně. Nejčastější chybou v léčbě pankreatickými enzymy je jejich poddávkování. Platí, že při trávicí nedostatečnosti, při tzv. hlavních jídlech, má být podáno 40 000–50 000 j lipázy, při dopoledních anebo odpoledních svačinách 25 000 j lipázy. Nejlépe je podat lék během jídla. Nedostatečná léčba a dávkování je spojena s nedostatečným trávením a vstřebáváním řady látek a s obrazem pankreatické malabsorpce.
Klíčová slova:
pankreatická sekrece – pankreatické enzymy – pankreatin – testy pankreatické sekreceÚvod
Slinivka břišní patří mezi metabolicky nejvíce aktivní orgány. Denní sekrece pankreatické šťávy činí 1000–1500 ml, pankreatický sekret obsahuje 5–10 g/l proteinů. Zatímco buňky pankreatických vývodů jsou zdrojem sekrece bikarbonátů a především karboanhydrázy II. typu, pankreatické enzymy jsou produkovány buňkami acinárními. Pankreatické enzymy jsou secernovány v tzv. proaktivní formě, označené jako zymogeny, a teprve při vstupu do duodena jsou tyto proenzymy aktivovány.
Nejvýznamnějším v této aktivační kaskádě je nepochybně trypsinogen, jehož přeměna na trypsin je spouštěcím mechanizmem aktivace všech ostatních proenzymů [1].
Enzymem, který hraje zcela zásadní roli ve štěpení tuků, je lipáza. Rozlišovány jsou 3 typy lipázy, tzv. lingvální forma, forma žaludeční a forma pankreatická. Množství produkované lingvální lipázy a především žaludeční lipázy tvoří 10–30 % celkové lipolytické aktivity [2]. Tato skutečnost vysvětluje, proč i u osob po pankreatektomii lze identifikovat tzv. reziduální absorpci tuků [3]. Zatímco úkolem lipázy je optimalizace trávení tuků, pankreatická amyláza se účastní štěpení škrobů. Ale ani zde nelze opomenout, že štěpení škrobů už začíná v dutině ústní, díky přítomnosti slinné formy amylázy. Ovšem stále platí, že nedostatečná sekrece amylázy obecně ve svých důsledcích vede pouze k lehké formě malabsorpce karbohydrátů. Podobně tomu je při nedostatečné sekreci a přítomnosti pankreatických proteáz a peptidáz v tenkém střevě.
Pankreatické enzymy, které byly vyloučeny do duodena, se odlišují významně rozdílnou stabilitou a tím i přítomností v různých částech tenkého střeva. Jejich intraluminální aktivita ve směru od duodena k ileu významně klesá díky proteolytické a především acidotické degradaci. Ze všech enzymů je stran aktivity nejvíce labilním, ale pro trávení zásadním enzymem pankreatická lipáza [4]. Aktivita lipázy progresivně klesá již v horních částech duodena, 74 % aktivity amylázy a 22 % aktivity trypsinu lze identifikovat v průběhu celého tranzitu tenkým střevem (pouze 1 % aktivity lipázy). Je tedy evidentní, že trávení a vstřebávání tuků probíhá mezi pylorem a ligemantum Treitz. Platí přitom, že přítomnost do 7,0 g tuků ve stolici je normálním (fyziologickým) nálezem [5–8].
Patofyziologické poznámky
Slinivka břišní je žlázou s velmi vysokou funkční rezervou. Proto až teprve 90% ztráta pankreatické funkční kapacity se projeví významnými klinickými projevy. Nedostatečná sekrece lipázy, amylázy a trypsinu je příčinou stavu označeného jako pankreatická malabsorpce [9,10]. Platí, že významný pokles pankreatické lipolytické aktivity nelze efektivně kompenzovat jinými fyziologickými mechanizmy. Tento stav, kdy v distální části tenkého střeva dochází ke zvýšené přítomnosti tuků i ostatních nutrientů, je příčinou porušení střevní motility, kdy je zrychleno vyprazdňování žaludku a urychlen střevní tranzit-time. Tím se uzavírá bludný kruh, kdy je porušeno trávení a vstřebávání nedostatkem pankreatických enzymů v tenkém střevě, ale navíc se zkracuje i doba, po kterou by fyziologicky trávení a vstřebávání probíhalo [11]. Výsledkem je, jak již bylo řečeno, klinický obraz malabsorpce. Pankreatická lipáza je enzymem významně acido-dependentním. Pokročilá forma chronické pankreatitidy se vyznačuje významným snížením sekrece bikarbonátů do duodena. Tím v horní části duodena klesá intraluminální pH tak, že dochází k výrazné inaktivaci lipázy, vyloučené do duodena [6]. Navíc se pokles bikarbonátové sekrece do duodena projeví poklesem postprandiální duodenální solubilizace tuků, protože v horní části duodena, díky nízkému pH, dochází k precipitaci žlučových kyselin [13].
V etiologii exokrinní pankreatické nedostatečnosti je nejčastěji zastoupena chronická pankreatitida, včetně formy hereditární a neléčené formy autoimunitní, ale exokrinní nedostatečností jsou provázeny rozsáhlejší resekční výkony na pankreatu, včetně pankreatektomie, dále tento stav bývá diagnostikován u malignit pankreatu, které destruují pankreatickou tkáň [14,15]. Postprandiální asynchronie mezi vstupem žaludečního chymu do duodena a současnou přítomností pankreatických enzymů v duodenu je jednou z dalších příčin, stejně jako resekční výkony na žaludku, syndrom krátkého střeva, Crohnova choroba nebo diabetes mellitus jsou někdy provázeny příznaky exokrinní pankreatické insuficience.
Klinická symptomatologie
Nedostatečná aktivita pankreatické lipázy se projevuje steatoreou, častá je nápadná flatulence, borborygmy nebo abdominální bolesti. Steatorea může být příčinou hubnutí. Přítomnost steatorey svědčí o snížení pankreatické funkční kapacity na 10 % normy [12]. Maldigesce při chronické pankreatitidě je spojena s nedostatečnými hladinami v tucích rozpustných vitaminů, snížením magnezemie, hladiny zinku, kalcia a kyseliny folové. Sami jsme prokázali významné snížení hladiny mědi a selenu, a to nejen u alkoholické formy chronické pankreatitidy [16]. U chronické pankreatitidy byly zjištěny nízké plazmatické hladiny řady protektivních antiaterogenních faktorů (Apo A-1 HDL, lipoprotein A), čímž lze vysvětlit opakovaně popsané změny cévní a změny kardiovaskulárního aparátu [17,18]. Častá je rovněž osteoporóza u osob s chronickou pankreatitidou [19,20].
Mezi vzácnější příčiny patří diabetes mellitus [21], stavy po náhradě kostní dřeně, traumatická postižení pankreatu a uváděna je snížená exokrinní funkce pankreatu u geriatrických pacientů [22].
Terapie
Obecně je v terapii exokrinní pankreatické nedostatečnosti třeba zajistit, aby nemocný plně abstinoval, v rámci pankreatické diety u osob se steatoreou dnes již není doporučována dieta s drastickým omezením tuků, ale zásadou je použití dostatečné dávky pankreatických enzymů ve formě kapslí. Zásadou je, aby každý pacient s exokrinní pankreatickou nedostatečností byl léčen substitucí s obsahem pankreatických enzymů, a to bez ohledu na stupeň steatorey a maldigesce [23–25]. Je třeba ovšem počítat s tím, že u části pacientů ani plná dávka pankreatické substituce neovlivní zcela přítomnost steatorey [26,27] a v takovém případě zastavení váhového poklesu, resp. zvýšení tělesné hmotnosti jsou dostatečným markerem efektivity podávané substituční léčby [28,29].
Pro léčbu preparáty s obsahem pankreatických enzymů platí následující zásady:
- Podávat dostatečnou dávku především lipázy. Dnes je jednoznačně přijato schéma, že během hlavního jídla podáváme 40 000 j lipázy, při dopolední a odpolední svačině 25 000 j. Optimální je podávat preparát s obsahem lipázy při každém jídle [30,31] (schéma 1).
- Preparáty s obsahem lipázy je třeba podat během jídla anebo těsně po skončení jídla, nikoliv před jídlem. Smyslem je zajistit synchronizaci mezi vstupem žaludečního chymu do horních partií duodena a současným uvolněním enzymů z mikročástic obsažených v kapsli, požité během anebo těsně po jídle [32,33].
- Kapsle má obsahovat pokud možno stejně velké partikule velikosti mezi 1,0–1,5 mm, jistě ne větší než 2,0 mm. Tak je zajištěna synchronizace mezi vstupem žaludečního chymu a mikročástic, uvolněnými z kapsle, do duodena současně [34–36]. I když ne všechny práce toto doporučení potvrzují, osobně se domníváme, že velikost části do 2,0 mm už vzhledem k fenoménu „žaludečního mlýnu“ má své opodstatnění.
- Jednotlivé mikročástice s obsahem enzymů musejí být pH-senzitivní s ochranou proti vlivu žaludeční kyseliny chlorovodíkové. V žaludku kyselina chlorovodíková rozpustí obal kapsle s obsahem mikročástic, mikročástice se uvolní a při pH 5,0–6,0v horní části duodena jsou z mikročástic liberalizovány jednotlivé pankreatické enzymy [37,38] (obr. 1). U osob s hyperaciditou je léčbu vhodné doplnit blokátory protonové pumpy [31,39].
- V případě, že substituční léčba není dostatečně efektivní, lze postupovat podle schématu 2.
Schéma 1. Schéma optimálního podávání preparátu s obsahem lipázy. 
Obr. 1. pH horní části zažívacího traktu (vysvětlení v textu). 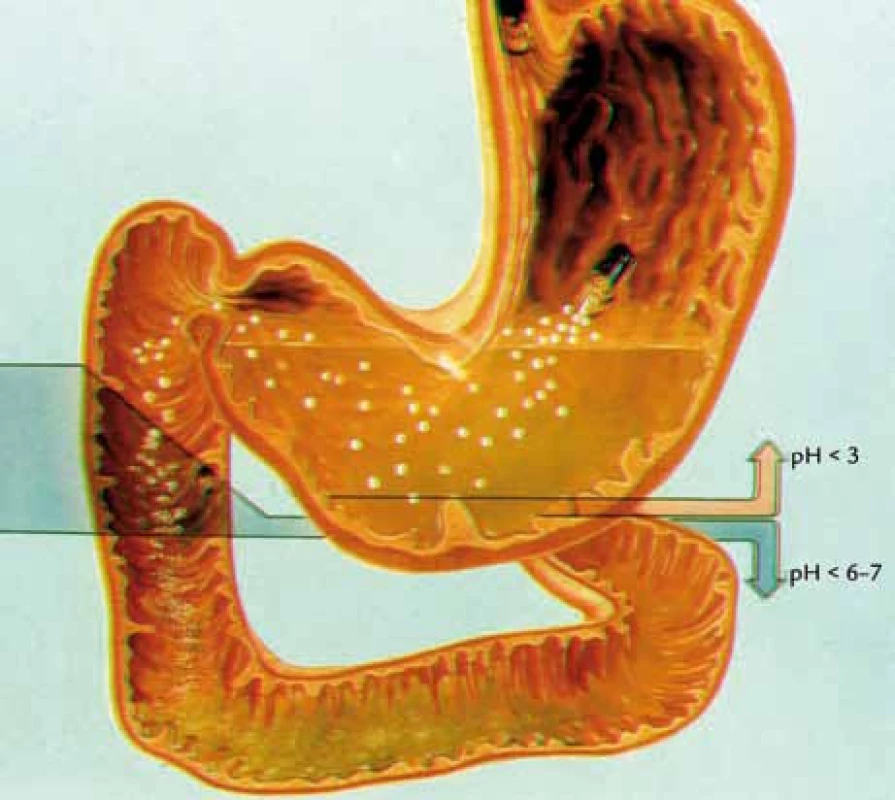
Schéma 2. Schéma terapie významné exokrinní nedostatečnosti pankreatu (potvrzena steatorea). 
Možnosti laboratorní kontroly efektivity terapie s pankreatickou substitucí
Zlatým standardem funkční diagnostiky je přes nestandardnost jeho uspořádání stále uváděn sekretin-cholecystokininový (sekretin-CCK) test, jako referenční test je v zahraničí užíváno také kvantitativní stanovení tuků v 72hodinovém sběru stolice [40]. Sekretin-CCK test poskytuje ze všech dostupných testů nejpřesnější informace o sekrečních poměrech pankreatu, především jako jediný umožňuje hodnocení sekrece bikarbonátu, který je zcela zásadním faktorem pro aktivitu pankreatických enzymů. Normální hodnoty objemu sekrece stimulované sekretinem jsou 165–536 ml/hod, koncentrace HCO3 – 9,8–39,7 mmol/hod.
Neinvazivní, nepřímé funkční testy – orální funkční testy – nevyžadují na rozdíl od sekretinového testu duodenální intubaci. Jejich podstatou je štěpení substrátu specifického pro některý z pankreatických enzymů, přičemž se odštěpený marker stanovuje v moči, séru nebo ve vydechovaném vzduchu. Součástí vyšetření je požití definovaného testačního pokrmu, který stimuluje pankreatickou a biliární sekreci, jde proto o stimulovaný – funkční test. V Evropě, nikoli však v našich zemích, jsou dosud dostupné testy s N-benzoyl-L-tyrosyl-paraaminobenzoovou kyselinou štěpenou chymotrypsinem, a stanovením kyseliny paraaminobenzoové v moči po 6 hod. Za hraniční hodnotu se považuje 30 % podaného substrátu. Je velkou zásluhou, že analogické vyšetření s N-acetyl-L-tyrosyl-paraaminobenzoovou kyselinou u nás průkopnicky zavedla již v 80. letech minulého století skupina kolem prof. Friče. Další variantou je obdobný test využívající fluoresceindilaurát – pankreolaurylový test. Nepřímým funkčním testem exokrinního pankreatu je nyní, i v České republice dostupný, dechový test se stabilním izotopem uhlíku 13C, kde substrátem je 13C-MTG (mixed triglyceride).
13C-MTG-BT test provádíme po nepřímé stimulaci pankreatu testačním pokrmem, který byl navržen tak, aby vyhovoval širokému spektru nemocných s gastroenterologickou problematikou, případnou celiakií nebo nesnášenlivostí laktázy – křehký kukuřičný chléb – bezlepkový 100 g a rostlinný tuk Rama 20 g, do kterého je přidáno 250 mg značeného triglyceridu [41]. Principem dechového testu s 13C-mixed triglyceridy je štěpení tohoto substrátu pankreatickou lipázou. 13C-MTG substrát je triglycerid s 13C-označeným octanoátem v poloze 2 a stearátem v poloze 1 a 3. Pankreatickou lipázou je triglycerid rozštěpen a 13C-octanoát je dále oxidován v játrech (β-oxidace tuků) a ve vydechovaném vzduchu je množství 13CO2 stanoveno analyzátorem dechových testů. Substrátem dechového testu pro hodnocení pankreatické funkce mohou být i další látky – např. triolein obohacený 13C, označovaný jako hiolein, 13C-cholesteryl oktanoát, existují substráty pro amylázu – škrob obohacený 13C, nebo pro aktivitu trypsinu vaječný bílek značený 13C [42–44]. Hodnocení dechových testů je založeno na měření změny poměru koncentrací 13C - a 12C-frakce oxidu uhličitého ve vydechovaném vzduchu v několika hodinových intervalech. Výsledek je vyjádřen obdobně jako u jiných nepřímých testů – kvantitativním poměrem rozštěpeného a podaného substrátu, tzv. kumulativním výdejem, většinou za 6 hod. Dechové testy lze indikovat, podobně jako dříve používané orální testy, k optimalizaci substituční enzymatické terapie. Klinický význam má proto 13C-MTG - test v diferenciální diagnostice malabsorpčního syndromu, jako funkční test exokrinní funkce pankreatu a pro dlouhodobé sledování nemocných s chronickou pankreatitidou. 13C dechové testy s mixed triglyceridy (MTG) nebo hioleinem patří mezi nepřímé funkční testy exokrinní funkce pankreatu a lze je použít k monitorování úspěšnosti pankreatické substituční léčby.
Stanovení pankreatických enzymů ve vzorku stolice je nejjednodušším testem jak pro nemocného, tak pro laboratorní stanovení, a tyto testy patří proto k nejlevnějším, základním i screeningovým testům. Nejedná se o funkční diagnostiku, test nezahrnuje žádnou stimulaci pankreatu, není porovnávána bazální hodnota nalačno, a testy nelze použít samostatně pro monitorování substituční léčby. Dříve používaný chromogenní test stanovení chymotrypsinu ve stolici může být falešně pozitivní vlivem mikrobiální flóry tlustého střeva, falešná negativita může být způsobena intraluminální degradací molekuly chymotrypsinu. V posledních letech je proto doporučováno stanovení pankreatické elastázy metodou ELISA [45], založenou na imunochemické detekci pomocí monoklonální protilátky proti lidské pankreatické elastáze. Stanovení pankreatické elastázy-1 ve stolici (FELA) je neinvazivním, jednoduchým, robustním testem, který dobře koreluje s morfologickým, statickým stavem pankreatické tkáně (histomorfologická struktura).
Optimálním řešením pro možnost laboratorní kontroly efektivity terapie s pankreatickou substitucí je proto kombinace obou u nás dostupných neinvazivních pankreatických funkčních testů – dechovým testem s 13C-mixed triglyceridy (13C-MTG) a stanovením pankreatické elastázy-1 ve stolici (FELA). Vlastní zkušenosti s použitím této kombinace testů jsme publikovali na 44. Meetingu European Pancreatic Club 2012 v Praze [46]. Laboratorně byla prokázána pankreatická exokrinní nedostatečnost 13C-MTG dechovým testem s hodnotou cPDR pod 30 % pouze u 3/56 osob, hodnota FELA pod 200 μg/g byla nalezena jen u 11 nemocných. Enzymatická substituční terapie proto pokračuje, na základě výsledků laboratorních testů, jen u 8/56, tj. 14,28 % nemocných.
Vedlejší a možné nežádoucí příznaky léčby
Vysoké dávky enzymů více než 100 000 j jednorázově mohou být provázeny pocitem na zvracení, bolestmi břicha, říháním, hypersenzitivitou. Tyto příznaky byly popsány především u dětí léčených vysokými dávkami pro diagnózu mukoviscidózy. Není jasný fenomén fibrotizující kolonopatie, zdá se, že se jedná o lokální efekt pryskyřice, která je obalem kapslí, a nikoliv o efekt vlastních enzymů [47].
Možnosti nových preparátů s obsahem lipázy
V současnosti jsou používány enzymy připravené z hovězího substrátu, a to v případech, že z jakéhokoliv důvodu nelze použít standardní preparáty, připravené z vepřového substrátu. Obecně platí, že bovinní preparáty obsahují až o 75 % méně lipázové aktivity než standardní [48].
Nadějí se zdála být příprava bakteriální lipázy, která je pH stabilní. Nevýhodou je, že neexistují bakteriální amyláza a protézy [49,50].
Jestli v budoucnu uspěje tzv. znovuobnovení vlastní lidské lipázy metodami z oblasti bioinženýrských technologií, je stále velkou futurologií, ale in vitro takové studie probíhají. Na zavedení genové terapie v této indikaci však stále čekáme [51,52].
Závěr
Exokrinní pankreatická nedostatečnost je vždy závažným stavem, který je etiologicky spojen především s chronickou pankreatitidou, pankreatickým karcinomem, stavy po resekčních výkonech na pankreatu a u osob s mukoviscidózou. Ztráta přítomnosti pankreatických enzymů v duodenu vede k nedostatečné absorpci tuků, proteinů a karbohydráz, které se projeví steatoreou, kreatoreou, břišním dyskomfortem, ztrátou tělesné hmotnosti a deficiencí řady pro organizmus základních nutrientů. Suplementační terapie léky s obsahem pankreatických enzymů má být proto zahájena ihned po průkazu exokrinní pankreatické nedostatečnosti [30]. Řada studií prokázala, že dostatečná dávka a správně zvolená galenická forma použité pankreatické suplementace zásadně pozitivně ovlivní tzv. koeficient tukové absorpce (CFA), aniž by vždy vymizela steatorea [31].
prof. MUDr. Petr Dítě, DrSc.
www.lf.osu.cz
e-mail: petr.dite@osu.cz
Doručeno do redakce: 19. 10. 2012
Přijato po recenzi: 29. 11. 2012
Zdroje
1. Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut 2005; 54: (Suppl. 6): vi1–vi28.
2. Moreau H, Sauniere JF, Gargouri Y et al. Human gastric lipase: variations induced by gastrointestinal hormones and by pathology. Scand J Gastroenterol 1988; 23 : 1044–1048.
3. Carriere F, Barrowman JA, Verger R et al. Secretion and contribution to lipolysis of gastric and pancreatic lipases during a test meal in humans. Gastroenterology 1993; 105 : 876–878.
4. Layer P, von der Ohe MR, Holst JJ et al. Altered postprandial motility in chronic pancreatitis: role of malabsorption. Gastroenterology 1997; 112 : 1624–1634.
5. Lankisch PG, Lembcke B, Wemken G et al. Functional reserve capacity of the exocrine pancreas. Digestion 1986; 35 : 175–181.
6. Layer P, Peschel S, Schlesinger T et al. Human pancreatic secretion and intestinal motility: effects of ileal nutrient perfusion. Am J Physiol 1990; 258: G196–G201.
7. Layer P, Schlesinger T, Groger G et al. Modulation of human periodic interdigestive gastrointestinal motor and pancreatic function by the ileum. Pancreas 1993; 8 : 426–432.
8. Read NW, McFarlane A, Kinsman RI et al. Effect of infusion of nutrient solutions into the ileum on gastrointestinal transit and plasma levels of neurotensin and enteroglucagon. Gastroenterology 1984; 86 : 274–280.
9. Layer P, Jansen JB, Cherian L et al. Feedback regulation of human pancreatic secretion. Effects of protease inhibition on duodenal delivery and small intestinal transit of pancratic enzymes. Gastroenterology 1990; 98 : 1311–1319.
10. Layer P, Go VL, DiMagno EP. Fate of pancreatic enzymes during small intestinal aboral transit in humans. Am J Physiol 1986; 251: G475–G480.
11. Holtmann G, Kelly DG, Sternby B et al. Survival of human pancreatic enzymes during small bowel transit: effect of nutrients, bile acids, and enzymes. Am J Physiol 1997; 273: G553–G558.
12. Whitcomb DC, Lowe ME. Human pancreatic digestive enzymes. Dig Dis Sci 2007; 52 : 1–17.
13. Zentler-Munro PL, Fitzpatrick WJ, Batten JC et al. Effect of intrajejunal acidity on aqueous phase bile acid and lipid concentrations in pancreatic steatorrhoea due to cystic fibrosis. Gut 1984; 25 : 500–507.
14. Bruno MJ. Maldigestion and exocrine pancreatic insufficiency after pancreatic resection for malignant disease: pathophysiology and treatment. Pancreatology 2001; 1: (Suppl. 1): 55–61.
15. Kalivianakis M, Minich DM, Bijleveld CM et al. Fat malabsorption in cystic fibrosis patients receiving enzyme replacement therapy is due to impaired intestinal uptake of long-chain fatty acids. Am J Clin Nutr 1999; 69 : 127–134.
16. Dítě P, Dastych M, Novotný I et al: Changes in serum levels of zinc, selenium, copper and magnesium in individuals with chronic alcoholic and chronic idiopathic pancreatitis. Progress in Medicine 2011; 26 : 181–185.
17. Montalto G, Soresi M, Carroccio A et al. Lipoproteins and chronic pancreatitis. Pancreas 1994; 9 : 137–138.
18. Gullo L, Tassoni U, Mazzoni G et al. Increased prevalence of aortic calcification in chronic pancreatitis. Am J Gastroenterol 1996; 91 : 759–761.
19. Haaber AB, Rosenfalck AM, Hansen B et al. Bone mineral metabolism, bone mineral density, and body composition in patients with chronic pancreatitis and pancreatic exocrine insufficiency. Int J Pancreatol 2000; 27 : 21–27.
20. Dujsíková H, Novotný I, Tomandl J et al. Chronická pankreatitida a skelet. Vnitř Lék 2010; 56 : 656–662.
21. Ewald N, Raspe A et al. Determinants of exocrine pancreatic function as measured by fecal elastase-1 concentration in patients with diabetes mellitus. Eur J Med Res 2009;14 : 118–122.
22. Gullo L, Simoni P. A study of pancreatic function among subjects over ninety years of age. Pancreatology 2009; 9 : 240–244.
23. Dobrilla G. Management of chronic pancreatitis. Focus on enzyme replacement therapy. Int Pancreatol 1989; 5: (Suppl.): 17–29.
24. Mundlos S, Kuhnelt P, Adler G. Monitoring enzyme replacement treatment in exocrine pancreatic insufficiency using the cholestery octanoate breath test. Gut 1990; 31 : 1324–1328.
25. Bruno MJ, Haverkort EB, Tijssen GP et al. Placebo controlled trial of enteric coated pancreatin microsphere treatment in patients with unresectable cancer of the pancreatic head region. Gut 1998; 42 : 92–96.
26. Dominguez-Munoz JE, Iglesias-Garcia J, Iglesias-Rey M et al. Effect of the administration schedule on the therapeutic efficacy of oral pancreatic enzyme supplements in patients with exocrine pancreatic insufficiency: a randomized, threeway crossover study. Aliment Pharmacol Ther 2005; 15 : 993–1000.
27. Keller J, Layer P. Pancreatic enzyme supplementation therapy. Curr Treat Options Gastroenterol 2003; 6 : 369–374.
28. Delchier JC, Vidon N, Saint-Marc Girardin MF et al. Fate of orally ingested enzymes in pancreatic insufficiency:comparison of two pancreatic enzyme preparations. Aliment Pharmacol Ther 1991; 5 : 365–378.
29. Lohr MJ, Hummel FM, Pirilis KT et al. Properties of different pancreatin preparations used in pancreatic exocrine insufficiency. Eur J Gastroenterol Hepatol 2009; 4 : 1024–1031.
30. Sikkens ECM, Cahen DL, Knipers EJ et al. Pancreatic enzyme replacement therapy in chronic pancreatitis. Best Practice Res Clin Gastroent 2010; 24 : 337–347.
31. Waljee AK, DiWagno MJ, Wu BU et al. Systematic review: pancreatic enzyme treatment of malabsorption associated with chronic pancreatitis. Aliment Pharmacol Ther 2009; 29 : 235–246.
32. Bruno MJ, Borm JJ, Hoek FJ et al. Gastric transit and pharmacodynamics of a two-millimeter enteric-coated pancreatin microsphere preparation in patients with chronic pancreatitis. Dig Dis Sci 1998; 43 : 203–213.
33. Layer P, Keller J. Lipase supplementation therapy: standards, alternatives, and perspectives. Pancreas 2003; 26 : 1–7.
34. Dominguez-Munoz JE, Birckelbach U, Glasbrenner B et al. Effect of oral pancreatic enzyme administration on digestive function in healthy subjects: comparison between two enzyme preparations. Aliment Pharmacol Ther 1997; 11 : 403–408.
35. Halm U, Loser C, Lohr M et al. A double--blind, randomized, multicentre, crossover study to prove equivalence of pancreatin minimicrospheres versus microspheres in exocrine pancreatic insufficiency. Aliment Pharmacol Ther 1999; 13 : 951–957.
36. Meyer JH, Elashoff. J Human postprandial gastric emptying of 1–3 milimeter spheres. Gastroenterology 1988; 94 : 114–119.
37. Ramo OJ, Puolakkainen PA, Seppala K et al. Self-administration of enzyme substitution in the treatment of exocrine pancreatic insufficiency. Scand J Gastroenterol 1989; 24 : 688–692.
38. Stead RJ, Skypala I, Hodson ME et al. Enteric coated microspheres of pancreatin in the treatment of cystic fibrosis: comparison with standard enteric coated preparation. Thorax 1987; 42 : 533–537.
39. Regan PT, Malagelada JR, DiMagno EP et al. Comparative effects of antacids, cimetidine and enteric coating on the therapeutic response to oral enzymes in severe pancreatic insufficiency. N Engl J Med 1977; 297 : 854–858.
40. Stevens T, Conwell DL, Whitcomb DC et al. Pancreatic exocrine function tests. In: UpToDate, Basow, DS (Ed), UpToDate, Waltham, MA, March 2012.
41. Kocna P. Dechové testy – moderní, neinvazivní diagnostika. Interní medicína 2006; 8 : 336–341.
42. Braden B. 13C breath tests for the assessment of exocrine pancreatic function. Pancreas 2010; 39 : 955–959.
43. Nakamura H, Morifuji M, Murakami Y et al. Usefulness of a 13C-labeled mixed triglyceride breath test for assessing pancreatic exocrine function after pancreatic surgery. Surgery 2009; 145 : 168–175.
44. Ishii Y, Kohno T, Ito A et al. Measurement of extra-pancreatic secretory function by 13C-dipeptide breath test. Transl Res 2007; 149 : 298–303.
45. Krechler T, Kocna P, Vaníčková Z et al. Stanovení elastázy I ve stolici – využití v diagnostice chronické pankreatitidy. Čas Lék Čes 2006; 145 : 480–483.
46. Kocna P, Kohout P Clinical, therapeutical and economical benefit of exocrine pancreatic function tests. Pancreatology 2012; 25: (Suppl.): 44.
47. Smyth RL, van Velzen D, Smyth AR et al. Strictures of ascending colon in cystic fibrosis and high-strength pancreatic enzymes. Lancet 1994; 8 : 85–86.
48. Raimondo M, DiMagno EP. Lipolytic activity of bacterial lipase survives better than that of porcine lipase in human gastric and duodenal content. Gastroenterology 1994; 107 : 231–235.
49. Suzuki A, Mizumoto A, Rerknimitr R et al. Effect of bacterial or porcine lipase with low - or high-fat diets on nutrient absorption in pancreatic-insufficient dogs. Gastroenterology 1999; 116 : 431–437.
50. Suzuki A, Mizumoto A, Sarr MG et al. Bacterial lipase and high-fat diets in canine exocrine pancreatic insufficiency: a new therapy of steatorrhea? Gastroenterology 1997; 112 : 2048–2055.
51. Kuhel DG, Zheng S, Tso P et al. Adenovirus--mediated human pancreatic lipase gene transfer to rat bile: gene therapy of fat malabsorption. Am J Physiol Gastrointest Liver Physiol 2000; 279: G1031–G1036.
52. Maeda H, Danel C, Crystal RG. Adenovirus – mediated transfer of human lipase complementary DNA to the gallbladder. Gastroenterology 1994; 106 : 1638–1644.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Liečba AL-amyloidózy v roku 2012, prínos nových liekov – editorial
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Existuje závislost mezi hladinou adipocyte fatty acid binding proteinu a kalciovým skóre u asymptomatických příbuzných pacientů s KVO?
- Léčba AL-amyloidózy v roce 2012, přínos nových léků (bortezomibu, thalidomidu a lenalidomidu). Přehled publikovaných klinických studií
- Cílená léčiva a jejich přínos pro terapii vnitřních chorob
- Léky indukovaná osteoporóza
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- AII antagonisté v léčbě hypertenze a prevenci CMP
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Léky indukovaná osteoporóza
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



