-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cílená biologická léčba solidních nádorů
Targeted biological treatment of solid tumours
Clinical use of targeted biological treatment was initiated in 1970s following a discovery of hormonal receptors and targeted clinical use of tamoxifen. Deeper understanding of molecular principles of the process of metastasizing and cell communication and signalling have contributed to the development of targeted molecular biological treatments based on direct impact on the key target structures of a tumour cell. Clinical effectiveness of targeted biological treatment has been shown in phase III clinical studies in advanced and metastasising solid tumours and importantly expanded our armamentarium of pharmacotherapeutic treatment options in breast cancer, colorectal cancer, non-small cell lung cancer, kidney cancer, hepatocellular carcinoma and gastrointestinal stromal tumour. Full implementation of targeted therapy is precluded by a lack of reliable predictors of efficacy of a number of targeted drugs. Therefore, full identification of such predictors is a subject to intensive clinical research. At present, selection of biological treatment is based on morphological, immunohistochemical and partly also molecular profile of a tumour. The future of biological treatment lies in a selection that is based on full molecular characterization of the primary tumour as well as metastasis.
Key words:
targeted biological treatment – prediction – biomarkers – treatment algorithm – individual treatment plan
Autoři: L. Petruželka 1,2
Působiště autorů: Onkologická klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Luboš Petruželka, CSc. 1; Ústav radiační onkologie 1. lékařské fakulty UK a FN Na Bulovce Praha, přednosta prof. MUDr. Luboš Petruželka, CSc. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(9): 740-744
Kategorie: 65. narozeniny MUDr. Jany Lacinové a 60. narozeniny prim. MUDr. Milana Tržila
Souhrn
Klinické využití cílené biologické léčby bylo zahájeno v 70. letech minulého století po objevu hormonálních receptorů a cíleného klinického použití tamoxifenu. Hlubší poznání molekulárních principů celého procesu metastazování, principů buněčné komunikace a přenosu signálů přispělo k rozvoji cílené molekulární biologické léčby využívající přímého zásahu klíčových terčových struktur nádorové buňky. Klinická účinnost cílené biologické léčby byla doložena v klinických studiích fáze III u pokročilých a metastazujících solidních nádorů a významně rozšířila armamentarium farmakoterapie u karcinomů prsu, karcinomů tlustého střeva a konečníku, nemalobuněčných karcinomů plic, karcinomů ledviny, hepatocelulárních karcinomů a gastrointestinálních stromálních nádorů. K plné realizaci cílené léčby stále chybí u řady tzv. cílených léků spolehlivé prediktory účinnosti, a proto je jejich plná identifikace předmětem intenzivního klinického výzkumu. V současnosti probíhá výběr biologické léčby na základě morfologického, imunohistochemického a částečně molekulárního profilu. Budoucnost biologické léčby spočívá ve výběru na základě úplné molekulární charakteristiky jak primárního nádoru, tak i z místa recidivy.
Klíčová slova:
cílená biologická léčba – predikce – biomarkery – algoritmus léčby – individuální léčebný plánÚvod
Nádorová onemocnění jsou jedním z nejběžnějších a zároveň nejzávažnějších onemocnění známých v klinické medicíně. Statistika ukazuje, že nějaká forma nádorového onemocnění postihne více než 1/3 populace a způsobí více než 20 % všech úmrtí. Ve vyspělých zemích představuje léčba nádorových chorob více než 20 % výdajů za lékařskou péči [1]. Není-li nádorové onemocnění léčeno, vede vždy k smrti. Bez ohledu na to, zda se zhoubné bujení objevuje sporadicky u jedince nebo opakovaně u mnoha členů rodiny jako dědičný znak, je genetickým onemocněním.
Hlubší poznání molekulárních principů celého procesu metastazování, principů buněčné komunikace a přenosu signálů přispělo k rozvoji cílené molekulární biologické léčby využívající přímého zásahu klíčových terčových struktur nádorové buňky na rozdíl od konvenční chemoterapie působící převážně na proliferující buňky [2]. Předpokladem pro zavedení cílené protinádorové terapie bylo podrobné zmapování celé kaskády nitrobuněčného přenosu signálu, identifikace cílových struktur a identifikace všech možností terapeutické intervence [3]. Klinické využití cílené bioregulační léčby bylo zahájeno v 70. letech minulého století po objevu hormonálních receptorů a cíleného klinického použití tamoxifenu [4]. Akceleraci preklinického výzkumu a klinické aplikace cílené onkologické léčby lze dát do časové souvislosti s přečtením lidského genomu [5]. Koncept stejné léčby pro všechny se stejnou diagnózou je postupně nahrazován konceptem personalizované medicíny. Cílem personalizovaného (individualizovaného, adresného) přístupu je individualizace léčby s respektováním jedinečných znaků nádorového onemocnění i hostitele [6]. Pro klinickou praxi to znamená vybrat správný lék ve správné dávce pro správného pacienta ve správnou dobu [7,8]. Největší překážkou úzce specifické cílené léčby je heterogenita nádorových populací v místě i v čase.
Molekulární identifikace signálních struktur jako předpoklad rozvoje cílené léčby
Onkologická léčba byla ve svých počátcích založena na empirii a postupné rozpoznávání všech procesů probíhajících na molekulární úrovni postupně umožňuje selektivní vyřazení klíčových signálních struktur. Molekulárně cílené léky narušují základní intracelulární signální dráhy, ale protinádorového účinku může být dosaženo též cílením léčiva proti strukturám nádorového stromatu [9].
Douglas Hanahan a Robert A. Weinberg definovali ve světle nových objevů základní odlišnosti v buněčné biologii charakterizující nádorový růst na molekulární úrovni, které jsou zároveň podkladem nového konceptu cíleného účinku cílených protinádorových léků [10–12]:
- nezávislost na růstových signálech → inhibitory buněčného cyklu a modulátory signální transdukce,
- nezávislost na inhibičních signálech → inhibitory buněčného cyklu a modulátory signální transdukce,
- omezení procesu apoptózy (únik proapoptotické signalizaci) → modulátory apoptózy,
- neomezený replikační potenciál → antitelomerázy a telomery ovlivňující agens,
- trvalý proces angiogeneze → antiangiogenní a antivaskulární agens,
- invazivita a metastazování → anti-invazivní agens.
Doposud rozpoznané terčové struktury cíleného molekulárního zásahu, jako jsou membránové receptorové onkoproteiny, jaderné nebo cytoplazmatické receptory, transdukční tyrozinkinázy a růstové faktory exprimované v extracelulární matrix, jsou na obr. 1.
Obr. 1. Terčové struktury biologické cílené léčby. 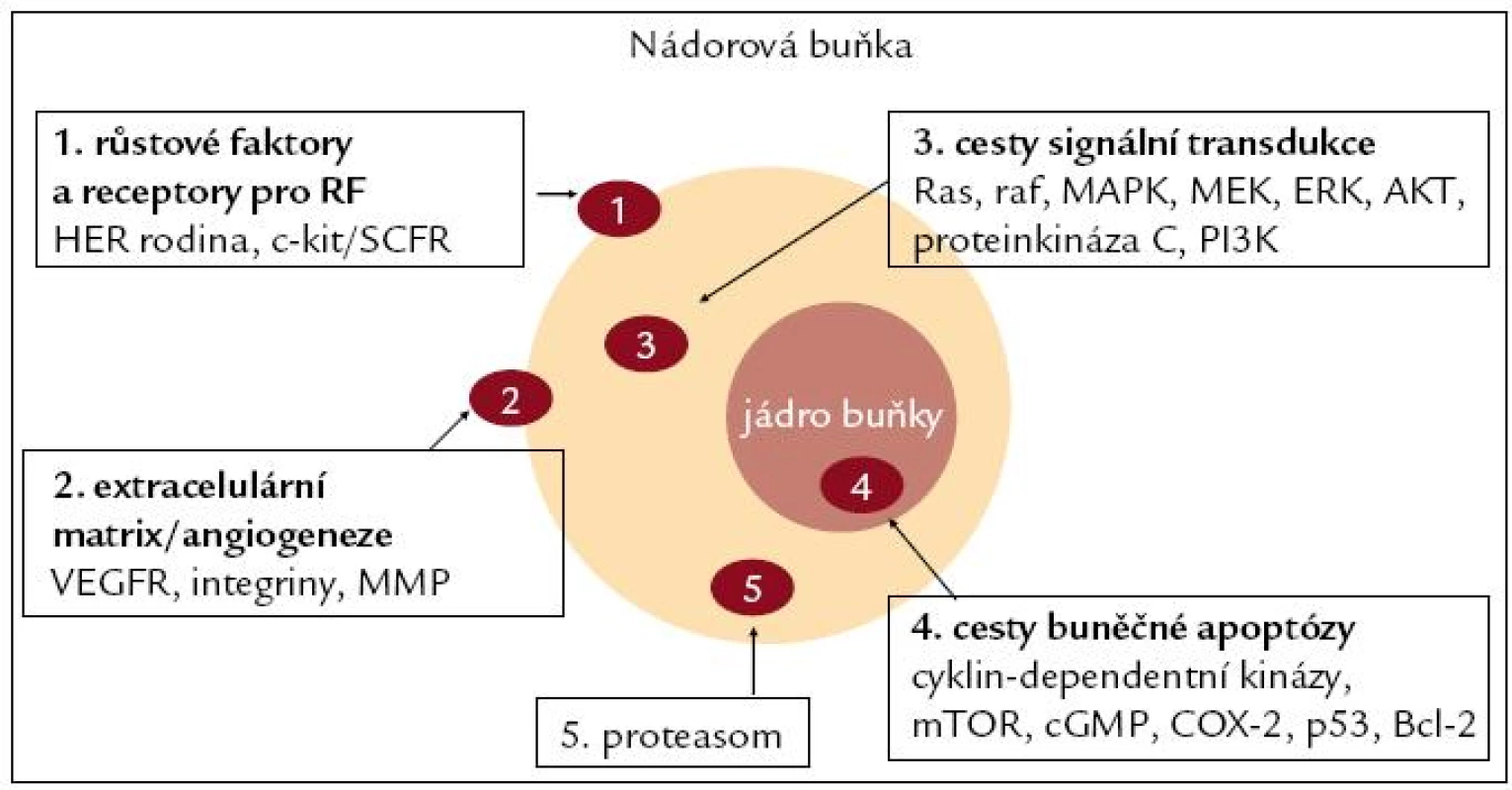
Klinická účinnost cílené biologické léčby byla doložena v klinických studiích fáze III u pokročilých a metastazujících solidních nádorů a významně rozšířila armamentarium farmakoterapie u karcinomů prsu, karcinomů tlustého střeva a konečníku, nemalobuněčných karcinomů plic, karcinomů ledviny, hepatocelulárních karcinomů a gastrointestinálních stromálních nádorů. Největší uplatnění molekulární biologické léčby bylo očekáváno v cílené eliminaci reziduálních nádorových buněk – při adjuvantním podání. Do současnosti byl prokázán přínos pouze při adjuvantní aplikaci trastuzumabu u cErbB2 dependentních časných stadií karcinomů prsu, který byl po adjuvantní hormonální terapii a adjuvantní chemoterapii dalším průlomovým mezníkem rozvoje adjuvantní léčby karcinomu prsu. U ostatních solidních nádorů kromě GIST zatím nebyl přínos přesvědčivě doložen.
Cílené podávání léčby v klinické praxi
Podání léčby nesprávně vybranému nemocnému může vést k zbytečným nežádoucím účinkům u nemocných s nízkou pravděpodobností léčebného efektu, ztrátě času pro podání správné léčby a neefektivnímu zatížení finančních zdrojů. Naopak nevyužití cílené biologické léčby ve správné indikaci snižuje léčebné vyhlídky nemocných. K plné realizaci cílené léčby stále chybí u řady tzv. cílených léků spolehlivé prediktory účinnosti, a proto je jejich plná identifikace předmětem intenzivního klinického výzkumu. V současnosti probíhá výběr biologické léčby na základě morfologického, imunohistochemického a částečně molekulárního profilu. Budoucnost biologické léčby spočívá ve výběru na základě úplné molekulární charakteristiky jak primárního nádoru, tak i z místa recidivy. V následujícím přehledu (tab. 1) jsou uvedeny základní léky užívané pro terčovou léčbu metastazujících solidních nádorů. Léky, jejichž klinická aplikace je podmíněna „povinným“ stanovením biomarkerů, jsou zatím v menšině.
Tab. 1. Základní léky užívané pro terčovou léčbu metastazujících solidních nádorů. 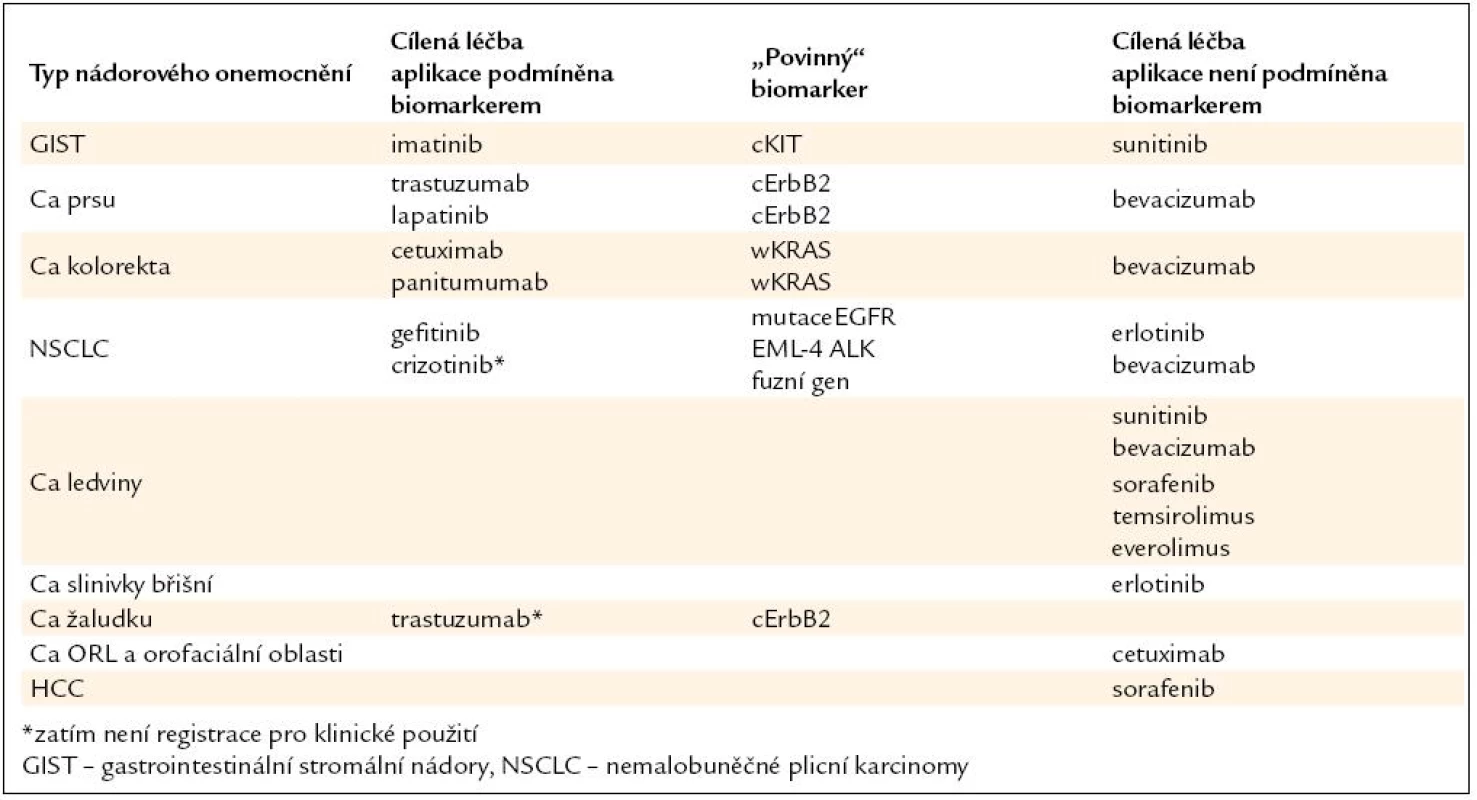
Prediktivní biomarker je v přímé spojitosti s léčebným efektem. Řada biomarkerů má jak prognostický, tak prediktivní význam. Nelze očekávat, že pro všechny cíleně působící léky se podaří identifikovat molekulární prediktory (biomarkery), a naopak pro některé léky bude v budoucnosti k dispozici více prediktorů (např. KRAS, BRAF, PIK3CA, a PTEN mutace pro antiEGFR terapii). Další možností je využití negativních biomarkerů („koho neléčit“), které předpovídají rezistenci k léčbě (př. mutace T790M pro gefitinib a erlotinib, ztráta exprese PTEN pro trastuzumab) nebo zvýšení rizika nežádoucích účinků (např. polymorfizmus UGT1A1 genu).
Z analýz klinických studií jsou známé též prediktivní klinické („nemolekulární“) biomarkery (např. hypertenze pro sunitinib a bevacizumab, hypotyreóza pro sunitinib, kožní projevy pro cetuximab, gefitinib a erlotinib). Nejlepší cestou pro výběr správné léčby bude patrně kombinace všech uvedených faktorů.
Současná éra cílené onkologické léčby byla započata podáváním tamoxifenu pouze u nemocných s laboratorně prokázanou přítomností hormonálních receptorů v nádorových buňkách. Pro klinika je nepřestavitelné zahájení hormonální léčby bez znalosti stupně exprese hormonálních receptorů. Stejně tak je nepřestavitelné zahájit léčbu trastuzumabem bez znalosti stupně exprese (amplifikace) HER-2 onkoproteinu nebo zahájit léčbu cetuximabem nebo panitimumabem bez znalosti stavu KRAS onkogenu [13,14]. Neopominutelnou součástí léčebných algoritmů jsou molekulární faktory, jak demonstrují zjednodušené algoritmy léčby metastazujících karcinomů prsu, tlustého střeva a konečníku a plic (obr. 2).
Obr. 2. Algoritmus léčby metastazujícího onemocnění. 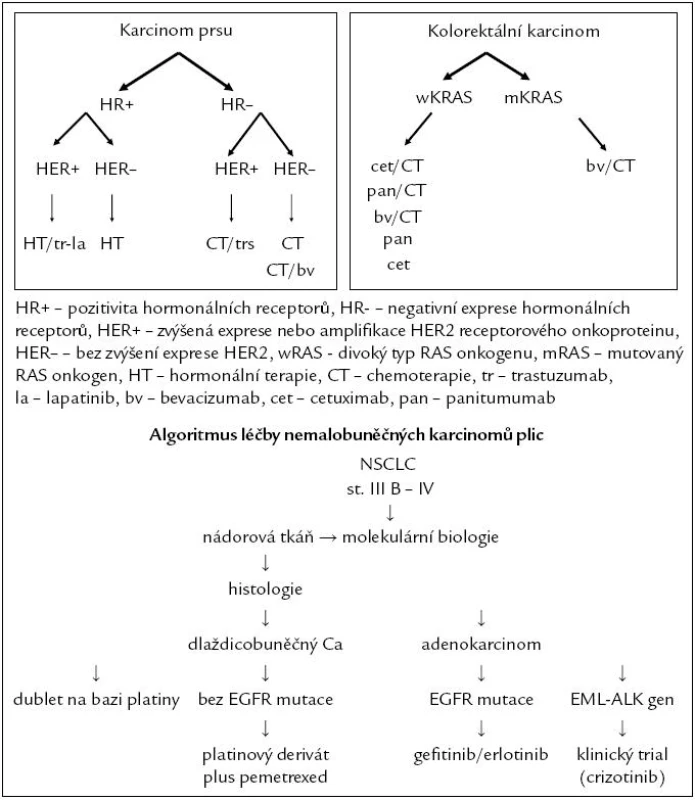
V éře personalizované medicíny je nutné přehodnotit uspořádání klinických studií s novými léky [15].
Nové klinické studie u neselektovaných nemocných by neměly být dále zahajovány. Stanovené cíle klinických studií nesmí podléhat komerčním zájmům. Jedině tak lze předejít „necílenému podávání cílené léčby“. Nový koncept uspořádání klinických studií je na obr. 3.
Obr. 3. Uspořádání klinických studií s novými léky v éře personalizované medicíny. 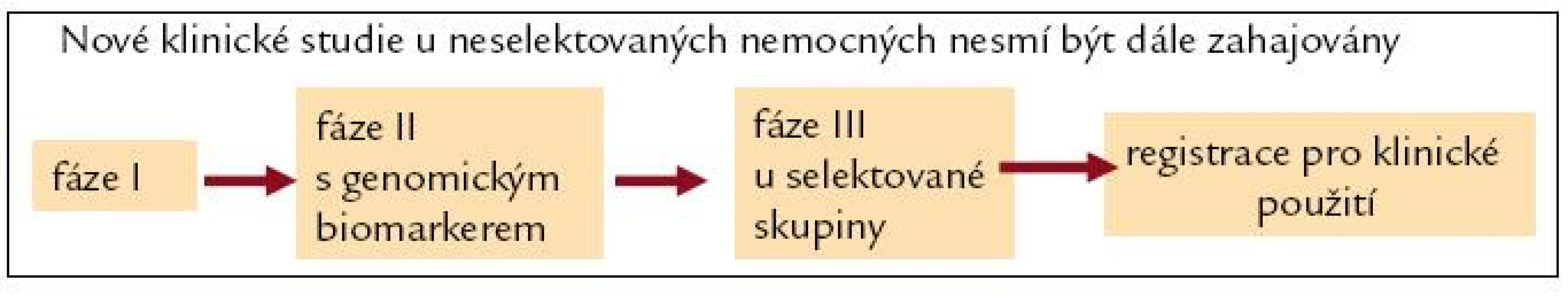
Budoucnost „cíleného“ podání cílené léčby
Tři zásadní události poslední doby dramaticky ovlivňují a v budoucnosti budou stále více ovlivňovat možnosti onkologické léčby:
- k dispozici začínají být „stovky“ nových cílených léků, které mohou přímo zasáhnout signální struktury podílející se na onkogenezi;
- molekulární identifikace rozdílů dříve morfologicky téměř identických nádorů povede k reklasifikaci nádorových onemocnění a expanzivnímu nárůstu nových klinicko-molekulárně patologických jednotek „orphan molecular disease“;
- implementace nových biotechnologií umožní významně zpřesnit předpověď rizika relapsu (prognostické faktory) časných stadií onemocnění a předpovědět účinnost vybrané léčby (prediktivní faktory) [16]. Nemocným s předurčenou rezistencí ke konveční léčbě/vysokým rizikem relapsu by měla být nabídnuta léčba novými léky v klinických studiích nového typu v komplexních výzkumných centrech [17]. Lze předpokládat, že v blízké budoucnosti budou k dispozici klinické trialy s novými léky s vysokou pravděpodobností léčebné odpovědi pro vybrané (na podkladě biomarkerů) u vymezené skupiny nemocných. Vyhodnocení výsledků za krátké časové období by mělo umožnit rychlejší zavedení nových léku do klinické praxe a zabránit často zbytečně rozsáhlýma časově zdlouhavým klinickým studiím fáze III [18].
Závěr
Podat správnou léčbu s nejvyšší účinností správnému pacientovi je cílem všech onkologů, ale ani v éře cílené molekulární léčby se výběr správných nemocných ne zcela daří. Jak nemocný hostitel, tak zhoubné nádory jsou nesmírně heterogenní. Heterogenita spočívá jak v unikátním profilu každého nádoru, tak v unikátním genovém profilu organizmu každého nemocného [19]. Individuální léčebný plán by měl spočívat v kombinaci vyhodnocení individuálního molekulárního profilu nádoru a individuálního farmakogenomického profilu každého pacienta (obr. 4).
Obr. 4. Individuální léčebný plán. 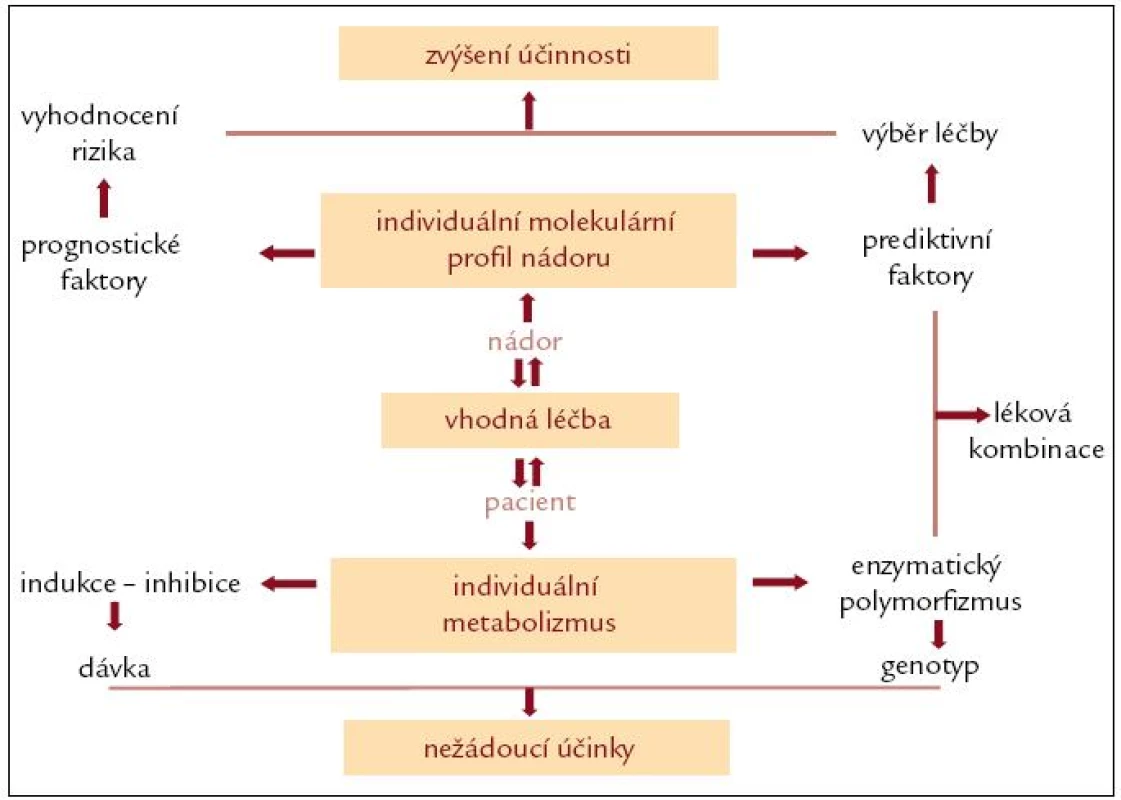
V budoucnosti nebude možné, aby byli všichni nemocní léčeni a trvale sledování v onkologických centrech disponujících zvýšeným vědecko-výzkumným a terapeutickým potenciálem. Do specializovaných center by měli být soustřeďováni nemocní, u kterých je možné dosáhnout trvalého uzdravení („cure“). Do vybraných klinických center by měla být dále soustřeďována péče o nemocné s vysokým rizikem nebo přítomností metastatické diseminace, u kterých není doposud k dispozici účinná farmakoterapie pro možnost využívání inovativních biotechnologií a participace v inovativních klinických studiích [20].
Pro okamžité zefektivnění cílené onkologické léčby je nutná:
- kultivace mezioborové spolupráce,
- zlepšení spolupráce onkologů s histopatology a molekulárními patology,
- definice nezbytných (povinných) biomarkerů před zahájením cílené bioterapie,
- sjednocení laboratorních vyšetřovacích postupů a sjednocení hodnocení výsledků,
- kontrola kvality.
Nový rozměr onkologické péče spočívá v individualizaci léčby pro každého nemocného a pro každý nádor na základě molekulární (genové) charakteristiky nádorové choroby a genové výbavy každého pacienta. Individualizovaný přístup by měl být uplatněn v každém stadiu nádorové choroby [21].
Vize onkologické léčby budoucnosti je:
- plná vyléčitelnost časných stadií onemocnění,
- léčitelnost diseminovaného onemocnění („rakovina jako chronické onemocnění“).
Budoucnost onkologické léčby je v ukončení necíleného podávání cílené léčby. Necílená snaha o akceleraci klinické aplikace nových léků bez přesné identifikace cílové struktury je slepá, finančně zablokovaná cesta. Výběr a zahájení léčby bez určení molekulárních biomarkerů nebude v budoucnosti možný. Jedině individualizace léčby může vést k redukci nákladů na léčbu. Individuální přístup přitom paradoxně posílí význam mezioborových týmů. V onkologických centrech bez dostupné adekvátně prováděné molekulární diagnostiky nebude možné rozhodovat o výběru cílené léčby.
prof. MUDr. Luboš Petruželka, CSc.
www.vfn.cz
e-mail: lubos.petruzelka@seznam.czDoručeno do redakce: 16. 5. 2011
Zdroje
1. Petruželka L. Pohled na vývoj onkologie ve 3. tisíciletí. Klin Onkol 2009; 22 : 243–244.
2. Sawyers C. Targeted cancer therapy. Nature 2004; 432 : 294–297.
3. Petruželka L, Novotný J, Závadová E. Principy molekulární bioregulační léčby. In: Cibula D, Petruželka L et al (eds). Onkogynekologie. Praha: Grada 2009.
4. Pink JJ, Jordan VC. Models of estrogen receptor regulation by estrogens and antiestrogens in breast cancer cell lines. Cancer Res 1996; 56 : 2321–2330.
5. MacConaill LE, Garraway LA. Clinical Implications of the Cancer Genome. J Clin Oncol 2010; 28 : 5219–5228.
6. Ramaswamy S, Perou CM. DNA microarrays in breast cancer: the promise of personalised medicine. Lancet 2003; 361 : 1576–1577.
7. Baselga J. Why the epidermal growth factor receptor? The rationale for cancer therapy. Oncologist 2002; 7 (Suppl 4): 2–8.
8. Stricker T, Catenacci DV, Seiwert TY. Molecular profilig of cancer – the future of personalized cancer medicine: a primer on cancer biology and tool necessary to bring molecular testing to the clinic. Semin Oncol 2011; 38 : 173–185.
9. Petruželka L. Cílená molekulární biologická léčba karcinomu prsu. Referátový výběr z onkologie 2006; 23 : 33–37.
10. Hanahan D, Weinberg RA. The Hallmarks of Cancer. Cell 2000; 100 : 57–70.
11. Hanahan D, Weinberg RA. Hallmarks of Cancer: The Next Generation. Cell 2011; 144 : 646–674.
12. Mountzios G, Soria JCH. Overview of Existing Therapies. In: Giaccone G, Soria JCH (eds). Targeted Therapies in Oncology. Informa healthcare 2007 : 1–4.
13. Petruželka L, Petruželková L. Lapatinib. Farmakoterapie 2008; 4 : 495–507.
14. Petruželka L. Cetuximab v první linii léčby kolorektálního karcinomu. Farmakoterapie 2008; 11 : 320–321.
15. Gonzalez-Angulo AM, Hennessy BT, Mills GB. Future of Personalized Medicine in Oncology: A systems Biology Approach. J Clin Oncol 2010; 28 : 2777–2783.
16. Schadt EE, Lamb J, Yang X et al. An integrative genomics approach to infer causal associations between gene expression and disease. Nat Genet 2005; 37 : 710–717.
17. Tursz T, Fabrice AF, Lazar V et al. Implications of personalized medicine – perspective from a cancer center. Nat Rev Clin Oncol 2011; 8 : 177–183.
18. Auffray C, Charron D, Hood L. Predictive, preventive, personalized and participatory medicine: back to the future. Genome Med 2010; 2 : 57–58.
19. Innocenti F, Cox NJ, Dolan ME. The use of genomic information to optimize cancer chemotherapy. Semin Oncol 2011; 38 : 186–195.
20. Mendelsohn J, Tursz T, Schilsky RL et al. Focus on personalized medicine: WIN Consortium – challenges and advances. Nat Rev Clin Oncol 2011; 8 : 133–134.
21. Petruželka L. Necílené podávání cílené biologické léčby aneb proč nemusí platit, kdo léčí více nemocných, léčí lépe. Edukační sborník XIV. dne profesora Staška 2009: Editorial.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek MUDr. Jana Lacinová – 65 letČlánek Dráždivý tračník
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- MUDr. Jana Lacinová – 65 let
- Prim. MUDr. Milanu Tržilovi k 60. narozeninám
- Česká angiologie a její proměny
- Dráždivý tračník
- Biologická léčba v dermatologii – psoriáza
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Nemoci jater v interní ambulanci
- Arytmologie dnes: rizika antiarytmické terapie v interní ambulanci
- Terapie stabilní chronické obstrukční plicní nemoci (CHOPN) a její případná kardiovaskulární rizika (základní přehled)
- Předoperační vyšetření u nemocných před nekardiálním chirurgickým výkonem
- Současný pohled na léčbu hypertenze v těhotenství
- Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky
- Cílená biologická léčba solidních nádorů
- Proteinurie v ambulantní praxi
- Význam antihypertenzní léčby u subklinického poškození mozku
- Polypragmazie a lékové interakce
- Existuje vztah mezi léčbou diabetu a vznikem nádorů?
- Kombinovaný trénink u mužů s metabolickým syndromem po akutní koronární příhodě
- Diagnostika sekundární hypertenze v ambulantní praxi
- FARIM – FARmakoterapie po Infarktu Myokardu
- Tyreopatie v ambulantní praxi
- Zemřel prof. MUDr. Vladimír Pacovský, DrSc., emeritní předseda Československé internistické společnosti
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Proteinurie v ambulantní praxi
- Prokinetika – jejich přínos v klinické praxi gastroenterologické
- Polypragmazie a lékové interakce
- Tyreopatie v ambulantní praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



