-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Adrenálne incidentalómy – je súčasný manažment racionálny?
Adrenal incidentalomas – is the present management rational?
Adrenal incidentalomas, i.e. clinically inapparent adrenal mass, are considered to be one of the most frequent tumours in human pathology. They more frequently occur in women, older age, patients with metabolic syndrome and in patients with malignant diseases. The first step in the management is exclusion of hormonal activity and differentiation of malignant and benign lesions. At present, there is no consensus with respect to differential diagnosis and treatment of adrenal incidentalomas since the development of hormonal hyperfunction and a risk of malignancy are negligible. The most frequent cause of hyperfunction is subclinical hypercortisolism, the clinical significance of which is also questionable. Recently, it has been shown that the existing recommendations lack rationality and, in addition, increase risk of falsely positive hormonal investigations. Repeated CT scans subject the patients to ionising radiation and may carry the same or even higher risk of cancer than the risk of malignant transformation of adrenal incidentaloma. This is why it is important to develop recommendations for screening and subsequent ‘follow‑up’ that will be rational, safe for the patient and reliable.
Key words:
adrenal incidentalomas – management – primary hyperaldosteronism – pheochromocytoma – subclinical hypercortisolism
Autoři: I. Lazúrová
Působiště autorů: I. interná klinika Lekárske fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ivica Lazúrová, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(9): 961-966
Kategorie: 60. narozeniny prof. MUDr. Andreje Dukáta, CSc., FESC, předsedy Slovenskej internistickej spoločnosti
Souhrn
Adrenálne incidentalómy, resp. klinicky inaparentné adrenálne masy sa považujú za jedny z najčastejších tumorov v humánnej patológii. Častejšie sa vyskytujú u žien, v staršom veku, u chorých s metabolickým syndrómom a u pacientov s malígnymi ochoreniami. Základnou úlohou pri manažmente je vylúčenie hormonálnej aktivity a odlíšenie malígnej lézie od benígnej. V súčasnosti neexistuje jednotný konsenzus v diferenciálnej diagnostike a liečbe adrenálnych incidentalómov, pretože vývoj hyperfunkcie, prípadne riziko malignity sú veľmi zriedkavé. Najčastejšou príčinou hyperfunkcie je subklinický hyperkortizolizmus, ktorého klinický význam je taktiež sporný. V poslednej dobe sa ukazuje, že doterajšie odporúčania boli málo racionálne a naviac zvyšovali riziko falošnej pozitivity hormonálnych vyšetrení. Opakované CT vyšetrenia vystavujúce pacienta ionizujúcemu žiareniu môžu mať riziko rakoviny minimálne také, resp. aj vyššie, ako je riziko malígneho zvrhnutia nadobličkového incidentalómu. Preto je dôležité vypracovať odporúčania pre skríning a následný „folow up“, ktoré budú racionálne, pre pacienta bezpečné a zároveň spoľahlivé.
Kľúčové slová:
adrenálne incidentalómy – manažment – primárny hyperaldosteronizmus – feochromocytóm – subklinický hyperkortizolizmusÚvod
Adrenálne incidentalómy alebo tzv. klinicky inaparentné adrenálne masy sa považujú dnes za jedny z najčastejších tumorov v humánnej patológii vôbec a z tohto dôvodu ich klinický manažment nadobúda rastúci význam v praxi ambulantných endokrinológov. Súčasné odporúčania týkajúce sa hormonálneho vyšetrenia a zobrazovania adrenálnych incidentalómov sú v rôznych krajinách a v rôznych centrách značne odlišné a zatiaľ nie je jednoznačný konsenzus ani v tom, ako týchto pacientov liečiť a ako dlho ich sledovať.
Výskyt incidentalómov nadobličiek stúpa z dôvodu dokonalejších zobrazovacích metód s vysokou rozlišovacou schopnosťou, ich častejšieho používania, ale aj z dôvodu starnutia populácie. Častejšie sa popisujú u osôb nad 55 rokov, u žien, u pacientov s primárnou artériovou hypertenziou, obéznych, diabetikov 2. typu a tiež u chorých s malignitami. Prevalencia v autoptických štúdiách sa pohybuje od 1,5 do 8,7% a je vyššia v tých štúdiách, ktoré sledovali výskyt všetkých nodulov o veľkosti nad 2 mm. Väčšina CT štúdií uvádza výskyt adrenálnych incidentalómov v rozpätí od 2–4% všetkých abdominálnych CT vyšetrení, v populáciách starších ako 55 rokov je ešte vyšší [1].
Podľa súčasného konsenzu adrenálny incidentalóm možno definovať ako adrenálnu masu s priemerom nad 1 cm, ktorá je detekovaná zobrazovacími metódami vykonanými z extraadrenálnej indikácie. Definícia nezahŕňa masy, ktoré sú diagnostikované u pacientov so známou súčasnou alebo minulou malignitou, pretože predstavujú zvýšené riziko adrenálnych metastáz [2].
Najčastejšie príčiny adrenálnych más
Väčšina adrenálnych incidentalómov je tvorená benígnymi léziami, ak vylúčime známe malígne ochorenie neadrenálneho charakteru. Nefunkčné (afunkčné) kortikálne adenómy predstavujú najčastejšie lézie tvoriace asi 80 % incidentalómov, zatiaľ čo hormonálne aktívne alebo malígne adrenokortikálne masy a metastázy sú menej časté. Hyperfunkčné adenómy s hypersekréciou glukokortikoidov, mineralokortikoidov, katecholamínov a androgénov sú relatívne zriedkavé, pretože vo väčšine prípadov sa uvedené hyperfunkčné syndrómy manifestujú príslušným klinickým obrazom, pričom za najčastejšiu endokrinopatiu sa považuje subklinický hyperkortizolizmus.
Z ďalších patologicko-anatomických príčin adrenálnych incidentalómov sa častejšie vyskytujú lipómy a myelolipómy, cysty, ganglioneurómy, neuroblastómy, hemangiómy, granulomatózne lézie a lymfoproliferácie. Raritne boli popísané aj iné príčiny adrenálnych más, napr. tuberkulóza, histoplazmóza a aktinomykóza. Pod pojmom pseudoadrenálne štruktúry sa rozumie CT alebo MRI obraz patologickej masy, ktorá sa lokalizuje do nadobličiek avšak perioperačne sa zistí iný pôvod masy (najčastejšie sa môže zameniť tumor obličiek, akcesórna slezina pri lokalizácii vľavo a pod.) [3].
Kortikálne adenómy sú najčastejšími adrenálnymi incidentalómami a tvoria 36–94% všetkých adrenálnych más, najčastejšie okolo 80 %. Môžu byť hyperfunkčné, t.j. produkujú hormóny – najčastejšie glukokortikoidy, menej často aldosterón a zriedkavo adrenálne androgény. Najčastejšie sú však afunkčné, nájdu sa obvykle náhodne a nemajú žiadne klinické prejavy. Sú benígne a zatiaľ nie sú dôkazy o možnom malígnom zvrhnutí adenómu. Veľkosť adenómov sa obvykle pohybuje od 1 do 9 cm, v priemere 3,3–3,5 cm.
Viacerí autori dokumentovali častejší výskyt adrenálnych adenómov (afunkčných) u pacientov s obezitou,inzulínovou rezistenciou alebo diabetom 2. typu, hypertenziou, t.j. s prejavmi metabolického syndrómu. Nie je však známe, či je príčinou metabolického syndrómu samotný adenóm, alebo či adenóm vzniká ako následok hyperinzulinémie a inzulínovej rezistencie. Podľa prvej teórie by príčinou metabolického syndrómu mohla byť subklinická alebo subtílna produkcia glukokortikoidov, o čom svedčí aj skutočnosť, že v niektorých prípadoch bolo po odstránení adenómu pozorované zlepšenie krvného tlaku, inzulínovej senzitivity ako aj ďalších kardiovaskulárnych rizikových faktorov. Druhá teória hovorí o stimulačnom vplyve inzulínu na bunky adrenokortexu. Ide o analógiu so syndrómom polycystických ovárií, kedy zvýšená hladina inzulínu v podmienkach inzulínovej rezistencie stimuluje sekréciu androgénov v stromálnych bunkách ovárií [4].
Feochromocytóm je nádor vychádzajúci z drene nadobličiek, ktorý produkuje katecholamíny a môže viesť k významnej morbidite a mortalite pacientov. Patrí medzi život najviac ohrozujúce endokrinopatie a je pomerne častou príčinou klinicky inaparentných más (1,5–23 %).
Prevalencia primárneho adrenokortikálneho karcinómu závisí od veľkosti adrenálnej masy. Pri tumoroch menších ako 4 cm je výskyt 2 %, pri tumoroch o veľkosti 4–6 cm je prevalencia 6 % a pri masách väčších ako 6 cm stúpa výskyt na 25 %. Adrenokortikálny karcinóm môže byť afunkčný alebo hyperfunkčný a môže produkovať rôzne hormóny – glukokortikoidy, estrogény, mineralokortikoidy, u detí najčastejšie androgény [5].
Myelolipóm je benígny tumor, ktorý je histologicky zložený z buniek tukového tkaniva a elementov kostnej drene. Väčšinou je zistený náhodne a neprodukuje žiadne hormóny, aj keď boli popísané prípady nadprodukcie glukokortikoidov, aldosterónu a zriedkavo aj androgénov. Na našom pracovisku sme popísali adenóm nadobličky s ložiskami myelolipómu u pacienta s primárnym hyperaldosteronizmom [6].
Adrenálne cysty sú zriedkavejšie lézie, vyskytujúce sa častejšie u žien ako u mužov v pomere obvykle 3 : 1. Patologicky možno rozdeliť cysty na endoteliálne, epiteliálne, parazitárne a posttraumatické pseudocysty. Sú obvykle benígne, niekedy sa môžu zameniť pri CT vyšetrení s cystickým adrenokortikálnym karcinómom.
Adrenálne hemorágie môžu byť bilaterálne alebo unilaterálne. Bilaterálne hemorágie sa obvykle združujú s antikoagulačnou liečbou alebo poruchou hemostázy, zriedkavejšie sa môžu vyskytnúť po chirurgickom zákroku, pri sepse alebo hypotenzii. Unilaterálne hemorágie sú obvykle následkom traumy alebo sa vyskytujú pri trombóze adrenálnej vény.
Adrenálny hemangióm je zriedkavý benígny tumor, ktorý je zložený z tesne na seba naliehajúcich cievnych kanálikov ohraničených jednou vrstvou endotelových buniek. Sú obvykle nájdené náhodne, bez hormonálnej nadprodukcie.
Ganglioneuróm je benígny tumor pozostávajúci zo Schwannových buniek a ganglionických buniek. Tieto tumory sa vyskytujú kdekoľvek pozdĺž paravertebrálnych sympatikových plexov a približne v 20–30% vychádzajú z drene nadobličiek. Raritne bola popísaná aktibomykóza [7]. Tuberkulóza, histoplazmóza a ďalšie granulomatózne ochorenia sú obvykle bilaterálne, ale sporadicky môžu byť asymetrické, a tak môžu imitovať unilaterálnu adrenálnu masu [4].
Klinický manažment pacientov s adrenálnymi incidentalómami
Pacienti, u ktorých sa zistí zobrazovacími metódami patologická adrenálna štruktúra, vyžadujú kompletné klinické, biochemické vyšetrenie a prípadnú ďalšiu špecifikáciu doplňujúcimi zobrazovacími metódami. V súčasnosti neexistuje jednoznačný konsenzus v tom, ako manažovať týchto pacientov, pretože viaceré prospektívne štúdie ukázali, že vývoj hyperfunkcie alebo riziko malignity pri adrenálnych masách sú zriedkavé (menej ako 1 % sa stáva funkčnými a menej ako 0,2 % sa stávajú malígnymi). Pritom väčšinu hyperfunkcií tvorí subklinický hyperkortizolizmus, ktorého klinický význam taktiež nie je jasný.
Prvé odporúčania pre hormonálne testovanie ako aj CT sledovanie boli odporúčania NIH z roku 2002. V roku 2009 boli publikované pre praktických endokrinológov USA ďalšie odporúčania, ktoré značne rozšírili paletu hormonálnych vyšetrení a frekvenciu sledovania CT [8]. Metaanalytická štúdia publikovaná Cawoodom et al v roku 2009 poukázala nielen na to, že vývoj hyperfunkcie a malignizácie incidentalómov je zriedkavý, ale zároveň ukázala, že odporúčané vyšetrenia dávajú množstvo falošne pozitívnych nálezov (až 50-násobne častejšie falošne pozitívne nálezy než skutočne pozitívne výsledky). Naviac dokumentovala, že priemerné odporúčanie frekvencie CT vyšetrení vystavuje pacienta expozícii 23 mSv ionizujúceho žiarenia, čo predstavuje asi 1 : 430 až 1 : 2 170 riziko vzniku rakoviny. Toto riziko je porovnateľné s rizikom vzniku adrenálnej malignity počas trojročného sledovania adrenálneho incidentalómu. V súčasnosti je nevyhnutné prehodnotiť odporúčania, ktoré by mali zohľadňovať nielen cenu vyšetrení, ale aj falošnú pozitivitu a riziko dávky žiarenia pri opakovaných CT kontrolách [2].
V rámci manažmentu adrenálnych incidentalómov musia byť zodpovedané 3 základné otázky:
- Je tumor hormonálne aktívny?
- Má charakteristiky malígnej alebo benígnej lézie?
- Je v predchorobí pacienta údaj o malígnom ochorení?
Anamnéza a fyzikálne vyšetrenie
Pacienti s adrenálnym incidentalómom majú byť vyšetrení klinicky veľmi podrobne. Medzi dôležité anamnestické príznaky hyperkortizolizmu patrí prírastok na hmotnosti alebo vznik centripetálnej obezity, hypertenzia, diabetes mellitus, virilizácia, slabosť proximálnych svalov, únava. Na rozpoznanie katecholamínovej nadprodukcie sú dôležité otázky zamerané na cefaleu, chudnutie, ataky anxiety, potenie, poruchy srdcového rytmu, palpitácie. Za účelom rozpoznania možného primárneho hyperaldosteronizmu je potrebné sa pýtať na artériovú hypertenziu, epizódy hypokaliémie, svalovú slabosť a prípadne arytmie, ktoré súvisia s hypokaliémiou.
Fyzikálne vyšetrenie zahŕňa vyšetrenie BMI, zhodnotenie typu obezity, svalstva ramenných a panvových pletencov, meranie tlaku krvi, inšpekciu kože (strie, plošné krvácania, hirzutizmus). Pri podozrení na androgénovú nadprodukciu si všímame znaky virilizácie [8].
Hormonálne vyšetrenie
Hyperkortizolizmus
Prevalencia hyperkortizolizmu v klinicky inaparentných adrenálnych masách sa uvádza od 5 do 47 % v závislosti od výsledkov rôznych štúdií s rôznymi protokolmi a tiež aj diagnostickými kritériami. Metanalytická štúdia z roku 2009 však vylúčením prác so selektovanými súbormi vypočítala reálnu prevalenciu, ktorá je asi 6,4 %.
Pretože väčšina pacientov s adrenálnymi incidentalómami nevykazuje typické prejavy Cushingovho syndrómu (CS), ale iba abnormálnu reguláciu osi hypotalamus-hypofýza-nadoblička, začal sa používať pojem subklinický hyperkortizolizmus alebo subklinická autonómna glukokortikoidná hypersekrécia (SAGH). Definuje sa ako autonómna kortizolová sekrécia u pacientov, ktorí nemajú typické klinické príznaky hyperkortizolizmu. Ide prakticky len o biochemickú abnormitu, ktorá neprechádza do klinicky manifestného hyperkortizolizmu. Iná definícia hovorí o minimálne dvoch z nasledujúcich biochemických abnormít: nedostatočný pokles nočného plazmatického kortizolu, supresia plazmatického ACTH, supresia DHEAS v plazme a/alebo vyššia hodnota voľného kortizolu v moči.
Mnohí z týchto pacientov však majú jeden alebo viac znakov metabolického syndrómu, t.j. hypertenziu, obezitu, inzulínovú rezistenciu alebo PGT/DM2, prípadne iné kardiovaskulárne rizikové faktory. Je nepravdepodobné, že by subklinický hyperkortizolizmus bol predklinickým štádiom manifestného CS, pretože prevalencia Cushingovho syndrómu spôsobeného adrenálnym adenómom je výrazne nižšia, než je prevalencia subklinického CS.
V súčasnosti nie je jednoznačný konsenzus ani v diagnostickom algoritme subklinického hyperkortizolizmu u pacientov s adrenálnymi incidentalómami.
National Institute of Health (NIH) v Bethesde odporučil ako štandardný test pre skríning subklinického Cushingovho syndrómu 1 mg dexametazónový supresívny test. Senzitivita pre 1 mg DST sa uvádza až 98,1 % a špecificita je medzi 80,5 a 98,9 %. Tieto však závisia od hranice plazmatického kortizolu, ktorú považujeme za cut-off hodnotu. Podľa NIH odporúčaní je hranica plazmatického kortizolu 138 nmol/l, pričom nižšia hodnota sa považuje za negatívny test na prítomnosť subklinického CS. Ďalší autori znižujú postupne hranicu až na 83 nmol/l, avšak tieto prísnejšie kritériá značne zvyšujú riziko falošne pozitívnych nálezov [9,10].
V nedávnej štúdii Morelli et al stanovili cut-off hodnotu kortizolu po 1 mg dexametazónu 82,8 nmol/l, ktorá spolu s elevovanými hodnotami voľného močového kortizolu a redukovanou hladinou ACTH zdá sa najlepším testom v predikcii prítomnosti chronických manifestácií subklinického kortizolového excesu. Okrem plazmatického kortizolu je možné vyšetriť aj slinný kortizol, ktorý má podobnú senzitivitu a špecificitu ako plazmatický kortizol [11]. Nie je doposiaľ stále jasný klinický význam SAGH, hlavne jeho vplyv na celkovú morbiditu a mortalitu chorých, pretože v literatúre chýbajú údaje o jeho vplyve na kardiovaskulárnu morbiditu a mortalitu.
Mineralokortikoidná nadprodukcia
Prevalencia aldosteronómu pri klinicky inaparentných adrenálnych masách sa uvádza od 1,6 do 4 %. Reálna prevalencia na základe meatanalýzy je však nižšia (0,6 %). V minulosti sa za hlavný skríningový marker považovala hladina sérového kália, avšak v posledných rokoch sa ukazuje, že prevalencia normokaliemického hyperaldosteronizmu je vyššia, než sa predpokladalo a podľa posledných údajov varíruje od 7 do 38 %. Aldosterónovo-renínový pomer (ARR) sa dnes považuje za dostatočne senzitívny a špecifický marker pre diagnózu Connovho syndrómu. Pomer vyšší ako 30 (ak je aldosterón vyjadrený v ng/dl a PRA v ng/ml/h) a vyšší ako 300 (ak je aldosterón vyjadrený v pg/ml a PRA v ng/ml/h) je vysoko suspektný z primárneho hyperaldosteronizmu. Hodnota ARR nad 50, resp. 500 už prakticky v 100%, odlíši primárny hyperaldosteronizmus od nízkorenínovej esenciálnej hypertenzie.
Feochromocytóm
Endokrinné testovanie na feochromocytóm má byť vykonané u každého pacienta s adrenálnym incidentalómom, pretože tento tumor predstavuje pomerne častú príčinu klinicky inaparentných adrenálnych más (reálna prevalencia 3,1 %). Za najcitlivejšie biochemické markery sa považujú voľné metanefríny, t.j. normetanefrín a metanefrín v plazme, pretože majú takmer 100% senzitivitu. Ostatné vyšetrenia vrátane močových katecholamínov a kyseliny vanylmandľovej sa považujú za málo citlivé a obsolentné, aj keď VMA má pomerne vysokú špecificitu. Hoci chromogranin A nie je špecifický pre feochromocytóm a býva zvýšený aj pri iných neuroendokrinných tumoroch, jeho vyšetrenie môže byť užitočné, pretože hladina dobre koreluje s veľkosťou nádorovej masy a je dobrým indikátorom recidívy po operácii [4].
Sexuálne steroidy secernujúce masy
Najčastejšie sa androgény alebo iné sexuálne steroidy produkujú v adrenokortikálnom karcinóme, avšak môžu byť tvorené aj v adenómoch, dokonca aj myelolipómoch. Väčšinou sa táto nadprodukcia prejaví klinicky, a preto sa málokedy stáva, že sa rozpozná adrenálna masa a až potom nájde nadprodukcia. Rutinné vyšetrenie testosterónu a estradiolu nie je všeobecne odporúčané, pretože adenómy zriedkavo produkujú sexuálne steroidy [4,12]. Niektorí autori odporúčajú štandardné vyšetrenie DHEAS, avšak údaje v literatúre sú kontroverzné.
Zobrazovacie metódy
Počítačová tomografia (CT)
CT vyšetrenie sa dnes považuje za najsenzitívnejšiu zobrazovaciu metódu a primárnu modalitu na zobrazenie adrenálnych más, pretože môže identifikovať obe nadobličky u 97–99 % pacientov. Adrenálne adenómy sú všeobecne malé, homogénne, dobre ohraničené lézie s jasným okrajom, okrúhle alebo oválne. Pretože obsahujú veľké množstvo intracytoplazmatického tuku, ich denzita je nízka a obvykle nepresahuje 18 HU pri nekontrastnom vyšetrení. Adrenokortikálne karcinómy sú pri CT vyšetrení obvykle väčšie, denznejšie, nepravidelné s heterogénnou štruktúrou vo vnútri tumoru v dôsledku nekróz a hemorágií. Pomerne časté sú kalcifikácie. Malé karcinómy, menšie než 6 cm, však môžu pripomínať adenóm, keďže majú viac homogénnu štruktúru. Feochromocytómy sa zobrazujú ako oválne alebo okrúhle masy s denzitou podobnou pečeni a pomerne častými nekrózami a hemorágiami v centre tumoru. Vďaka hypervaskularizácii feochromocytómy často vykazujú intenzívny enhancement (obr. 1). Diagnóza myelolipómu pozostáva z demonštrácie tuku vnútri adrenálnej masy s denzitou od –30 do –120 HU (obr. 2). Pri zobrazení cysty CT vyšetrenie dáva typický obraz s nízkou denzitou rovnajúcou sa denzite tekutiny. Akútna alebo subakútna hemorágia dáva pri CT vyšetrení typicky neenhancujúcu léziu 55–90 HU. Ganglioneurómy pri CT vyšetrení vyzerajú ako solídne masy rôznej veľkosti väčšinou až do 12 cm v priemere a môžu sa zameniť s feochromocytómom. Ostatné tumory ako neuroblastómy, granulomatózne lézie nemajú špecifický CT obraz [13,14].
Obr. 1. CT scan zobrazujúci veľký tumorózny útvar v oblasti ľavej nadobličky s nehomogénnou, prevažne vyššou denzitou a ložiskami nekrózy vnútri tumoru (histologicky feochromocytóm). 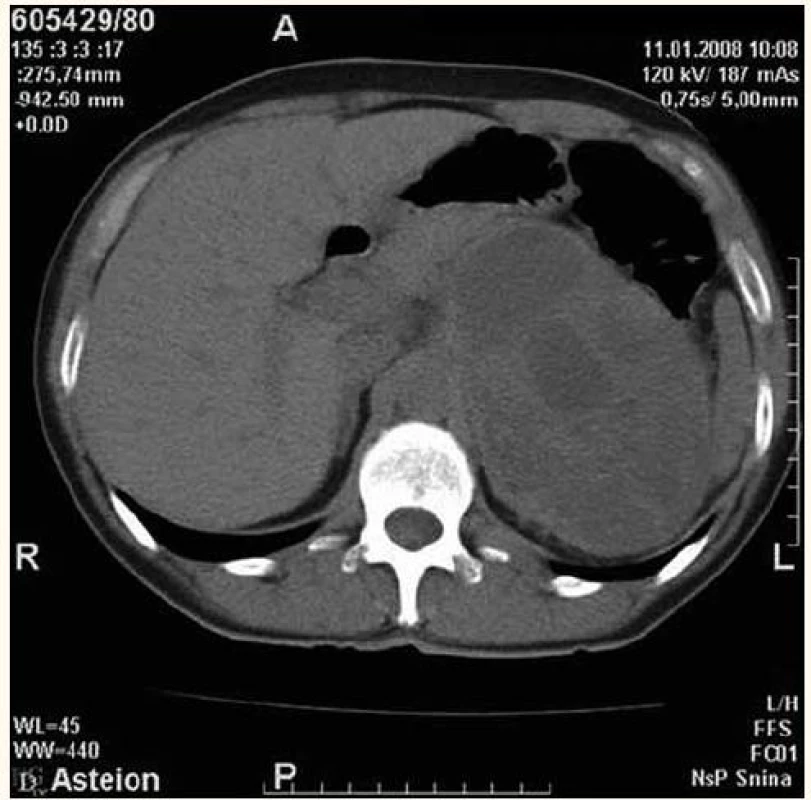
Obr. 2. CT obraz ložiskového procesu v oblasti pravej nadobličky s denzitou tukového tkaniva (histologicky myelolipóm). Vľavo normálny obraz nadobličky. 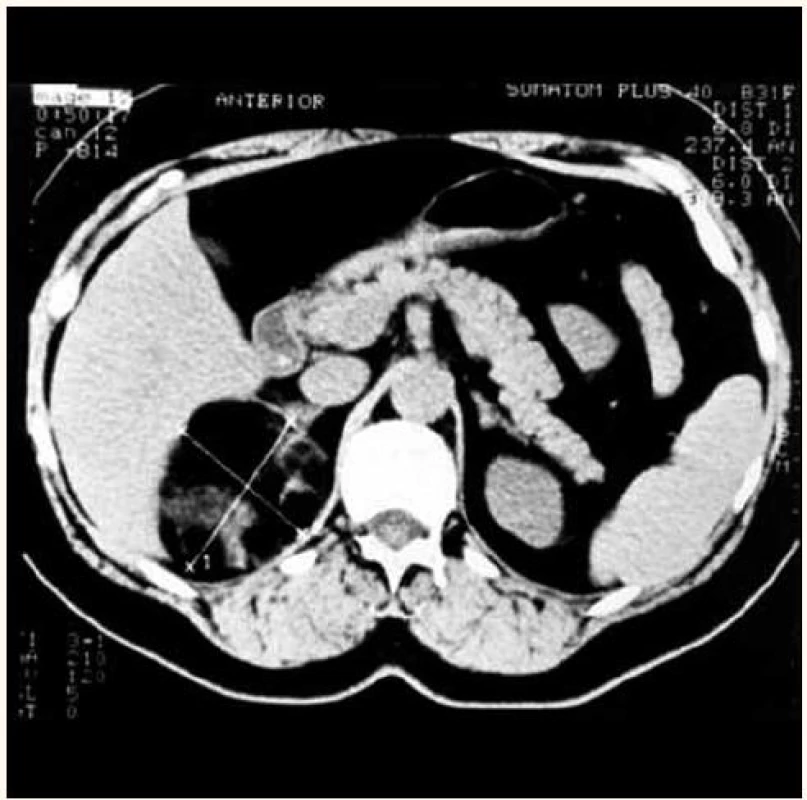
Magnetická rezonancia (MRI)
MRI má síce nižšiu senzitivitu pri zobrazení adrenálnych más ako CT, môže však lepšie charakterizovať tieto masy. Malígne lézie majú vyššiu intenzitu signálu ako benígne z dôvodu vyššieho obsahu vody, a teda dávajú jasnejší obraz pri T2 váženom zobrazení. Typický hyperintenzívny signál v T2 váženom obraze je charakteristický pre adrenokortikálny karcinóm. Feochromocytóm je všeobecne charakterizovaný nízkou intenzitou signálu v T1 váženom obraze a jasnou intenzitou v T2, čo sa označuje ako zjasnenie (brightness). Často možno vidieť centrálnu nekrózu. Tukové oblasti v myelolipómoch sú neodlíšiteľné v intenzite signálu od subkutánneho alebo retroperitoneálneho tuku. Hemangióm sa pri MRI vyšetrení zobrazí ako hypointenzívne ložisko v T1 váženom obraze s hyperintenzitou v obraze T2 [3].
Ultrasonografia
Má oveľa nižšiu senzitivitu a špecificitu ako CT a MRI, pretože dokáže identifikovať všetky adrenálne lézie s veľkosťou až nad 3 cm a iba 65% más s veľkosťou menšou ako 3 cm. Z tohto dôvodu má toto vyšetrenie iba orientačný význam pre vyhľadávanie väčších adrenálnych más, ale nie pre ich bližšiu charakteristiku.
Funkčné zobrazenie
Scintigrafia. Pre zobrazenie morfológie a funkcie kôry nadobličky sa používajú dve funkčné zobrazenia: 131I-6-β-iodomethyl-norcholesterol (NP-59) a 75Se-selenomethyl-19-norcholesterol. Zvýšené vychytávanie rádiofarmaka možno pozorovať pri adrenokortikálnom adenóme alebo nodulárnej hyperplázii. Znížené alebo chýbajúce vychytávanie môže poukazovať na karcinóm, metastázu alebo iné nefunkčné deštruktívne lézie. Pre lokalizáciu feochromocytómu alebo paragangliómu sa najčastejšie používa 123I-MIBG a 131I-MIBG, resp. 111In-octreotid.
Pozitrónová emisná tomografia (PET) a PET/CT. Väčšina malígnychtumorov má zvýšený glykolytický metabolizmus so zvýšeným vychytávaním deoxyglukózy, čo môže byť vizualizované PET použitím 18F-2-fluoro-d-deoxyglukózy (FDG). Toto zobrazenie pomáha odlíšiť benígne od malígnych lézií. Nedávno bol vyvinutý 11C-metomidát, ktorý je schopný odlíšiť lézie adrenokortikálneho pôvodu od iných lézií. PET s použitím 18F-6-fluorodopamínu sa používa predovšetkým na zobrazenie feochromocytómu [1].
Tenkoihlová aspiračná biopsia (FNA)
Transkutánna biopsia alebo aspirácia tenkou ihlou z oblasti adrenálneho ložiska sa v minulosti používala za účelom cytologického alebo histologického ozrejmenia adrenálnych lézií. Vykonáva sa obvykle pod USG alebo CT kontrolou. V súčasnosti sa používa zriedka vzhľadom k rizikám a diagnostickej výťažnosti. Môže byť však užitočná pri vyšetrení pacientov s anamnézou malígneho ochorenia a náhodným zobrazením adrenálnej masy, ktorá je podozrivá z metastatickej lézie [4].
Liečba
Základnou a jedinou kuratívnou metódou je chirurgická liečba, t.j. adrenalektómia. V súčasnosti sa vykonáva laparoskopická adrenalektómia, ktorá značne znížila riziko pooperačných komplikácií a uľahčila pooperačný priebeh. Výhodami laparoskopickej adrenalektomie sú: významná redukcia operačného času, redukcia krvných strát a skrátenie doby hospitalizácie a rekonvalescencie. Cena hospitalizácie pre transperitoneálnu laparoskopickú adrenalektómiu bola významne redukovaná (o 38 %) v porovnaní s otvorenou adrenalektómiou. Dnes je indikovaná aj pre operáciu feochromocytómov. Pre invazívne karcinómy alebo metastázy a veľmi veľké tumory zatiaľ optimálny prístup nebol stanovený. Mnohí autori ich považujú za kontraindikácie k laparoskopickej adrenalektómii, zatiaľ čo iní odporúčajú začať laparoskopicky s prípadnou konverziou. Táto oblasť je však stále predmetom diskusií a potrebné sú randomizované štúdie. Indikácie pre adrenalektómiu sú: všetky funkčné, klinicky manifestné kortikálne tumory, t.j. manifestný Cushingov syndróm, primárny aldosteronizmus, feochromocytóm a androgény secernujúci tumor.
Subklinický hyperkortizolizmus, t.j. SAGH, predstavuje stále diagnostický ako aj terapeutický problém. Oba prístupy, t.j. adrenalektómia a sledovanie (follow-up), sa dnes považujú za alternatívne liečebné postupy. Hoci niektoré štúdie ukázali signifikantné zlepšenie biochemických parametrov asociovaných s SAGH, vplyv adrenalektómie na kvalitu života, morbiditu a mortalitu zatiaľ nie je známy [4,15].
U pacientov s nefunkčnými incidentalómami sa manažment začína odlíšením benígnej od malígnej lézie, a to pomocou zobrazovacích metód. V prípade, že charakteristiky malignity pri CT alebo MRI vyšetrení chýbajú, veľkosť tumoru sa t. č. stále považuje za hlavné kritérium pre predikciu malignity, a teda aj pre terapiu. Masy menšie ako 4 cm majú minimálne riziko malignity, preto sú indikované na sledovanie. Riziko malignity pri léziách nad 6 cm je asi 25%, preto tieto masy sú všeobecne indikované na chirurgickú exstirpáciu. Pre adrenálne lézie s rozmerom 4–6 cm sa v súčasnosti akceptuje aj adrenalektómia a aj starostlivé sledovanie týchto más. V prípade, že pri CT sledovaní dochádza k progresii alebo zmenám charakteru tumoru, je indikovaná adrenalektómia.
Sledovanie (follow-up) pacientov s adrenálnymi incidentalómami
Dlhodobé štúdie u pacientov s incidentalómami ukazujú, že väčšina týchto más zostáva stabilná a nepodlieha malignizácii. Endokrinná aktivita sa môže vyvinúť asi u 20% pacientov, ale je málo pravdepodobná pri léziách pod 3 cm. Z tohto dôvodu sa odporúča sledovanie a endokrinné testovanie raz ročne počas 2–4 rokov.
Otvorenou otázkou ostáva dĺžka a intervaly CT sledovania. V tejto oblasti sú názory dosť nejednotné, pričom najintenzívnejšie sledovanie odporúčajú americké guidelines. Talianski autori odporúčajú kontrolné CT po 6 a 12 mesiacoch od prvého zobrazenia. V prípade, že tumor nerastie, nie sú t.č. dostatočné údaje, ktoré by podporovali ďalšie rádiologické sledovanie. Cawood et al uvádzajú, že riziko opakovaného ožiarenia pri CT vyšetreniach na vznik rakoviny sa vyrovná riziku malignity, ktoré predstavuje samotný adrenálny incidentalóm. Taktiež nie je zanedbateľná ani cena vyšetrení. Základné laboratórne vyšetrenie, t.j. metanefríny, PRA, aldosterón a plazmatický kortizol v dexametazónovom teste stojí približne 120 US $. Ak sa pridajú ešte ďalšie stanovenia (ACTH, močový kortizol, DHEAS, 17OHP a ďalšie), cena sa môže vyšplhať až na 200 US $. Naviac cena jedného CT s kontrastom je 500 US $, a ak sa má vykonať prvý rok CT 2krát, je to spolu 1 000 US $. NIH consensus statement z roku 2002 je z tohto hľadiska najracionálnejší a odporúča iba jedno CT vyšetrenie po 6 mesiacoch. Ďalšie odporúčania však zahŕňajú CT kontroly po 6, 12 a 24 mesiacoch, čo už predstavuje spomínané riziko radiácie [2].
Závery
Aj keď adrenálne incidentalómy sú veľmi častým nálezom pri abdominálnom CT, USG alebo MRI vyšetrení a predstavujú jedny z najčastejších tumorov v humánnej patológii, ich súčasný manažment je stále predmetom diskusií a optimálne odporúčania zohľadňujúce cenu, falošnú pozitivitu výsledkov ako aj riziko častých CT vyšetrení chýbajú. Je nevyhnutné v krátkom čase prehodnotiť doterajšie odporúčania so zohľadnením ceny, rizík a falošnej pozitivity.
prof. MU Dr. Ivica Lazúrová, CSc.
www.fnlp.sk
e-mail: ivica.lazurova@upjs.sk
Zdroje
1. Kršek M. Adrenal incidentalomas. Vnitř Lék 2007; 53 : 821 – 825.
2. Cawood TJ, Hunt PJ, O’Shea D et al. Recommended evaluation of adrenal incidentalomas is costly, has high false positive rates and confers a risk of fatal cancer that is similar to the risk of the adrenal lesion becoming malignant: time for a rethink? Eur J Endocrinol 2009; 161 : 513 – 527.
3. Gross MD, Korobkin M, Hussain HK et al. Adrenal Gland Imaging. In: De Groot L (ed). Endocrinology. Philadelphia: W.B. Saunders Comp 2006 : 126.
4. Mansmann G, Lau J, Balk E et al. The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev 2004; 25 : 309 – 340.
5. Kršek M. Adrenal carcinoma. Vnitř Lék 2009; 55 : 54 – 61.
6. Lazúrová I, Sokol L, Trejbal D et al. Aldosterone producing adenoma associated with foci of myelolipoma. Wiener Klin Wochenschr 1998; 110 : 379 – 381.
7. Lazúrová I, Závacky P, Ondic O. Adrenal actinomycosis mimicking a large tumor of the adrenal gland. J Urol 2005; 173 : 517 – 518.
8. Zeiger MA, Thompson GB, Duh QY et al. The American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons medical guidelines for the management of adrenal incidentalomas. Endocr Pract 2009; 15 (Suppl 1): 1 – 20.
9. Beuschlein F. Adrenal incidentalomas: presentation and clinical work ‑ up. Horm Res 2007; 68 (Suppl 5): 191 – 194.
10. Morelli V, Masserini B, Salcuni AS et al. Subclinical hypercortisolism: correlation between biochemical diagnostic criteria and clinical aspects. Clin Endocrinol (Oxf) 2010; 73 : 161 – 166.
11. Deutschbein T, Unger N, Hinrichs J et al: Late ‑ night and low‑dose dexamethasone ‑ suppressed cortisol in saliva and serum for the diagnosis of cortisol ‑ secreting adrenal adenomas. Eur J Endocrinol 2009; 161 : 747 – 753.
12. Wagnerová H, Lazúrová I, Habalová V et al. The prevalence of 21 - hydroxylase deficiency in adrenal incidentalomas ‑ hormonal and mutation screening. Exp Clin Endocrinol Diabetes 2008; 116 : 272 – 275.
13. Gross MD, Korobkin M, Bou Assaly W et al. Contemporary imaging of incidentally discovered adrenal mass. Nat Rev Urol 2009; 6 : 363 – 373.
14. Mitchell IC, Nwariaku FE. Adrenal masses in the cancer patient: surveillance or excision. Oncologist 2007; 12 : 168 – 174.
15. Giordano R, Marinazzo E, Berardelli R et al. Long‑term morphological, hormonal, and clinical follow‑up in a single unit on 118 patients with adrenal incidentalomas. Eur J Endocrinol 2010; 162 : 779 – 785.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Metabolický syndróm a tuhosť aorty
- Liečime správne pacientov s claudicatio intermittens?
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- XV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 25.– 28. mája 2010, Lausanne (Švajčiarsko)
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
-
Zemřel doc. MU Dr. Dušan Mrkos, CSc.,
editor emeritus časopisu Vnitřní lékařství - Profesor Jiří Ehrmann jubilantem
-
Cikánková V, Forejtová Š, Ištvánková E et al. Rehabilitace po revmatochirurgických výkonech.
Praha: Maxdorf Jessenius 2010. Počet stran 223. ISBN 978- 80-7345- 206- 3. - Prof. MU Dr. Andrej Dukát, CSc., FESC – šesťdesiatročný
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



