-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
Hormonal contraception and risk of venous thromboembolism
Oral contraceptives increase the risk of thromboembolism. Recent studies have indicated that the risk of thromboembolic disease in users of combined oral contraceptive pills varies not only with estrogen dose, but also with the type of gestagen in pills with the same estrogen dose. We describe 8 women from our intensive care unit who developed a deep venous thrombosis while on oral contraceptives. The aim of this article is also to discuss other risk factors for the potential risk of venous tromboembolism in users of combined oral contraceptive.
Key words:
oral hormonal contraception – venous thromboembolism
Autoři: O. Ludka; J. Špinar; V. Musil; Z. Pozdíšek
Působiště autorů: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC
Vyšlo v časopise: Vnitř Lék 2010; 56(5): 370-375
Kategorie: Původní práce
Souhrn
Užívání perorální hormonální antikoncepce zvyšuje riziko tromboembolizmu. Studie z posledních let poukazují na riziko žilního tromboembolizmu spojené s užíváním perorální hormonální antikoncepce, které je závislé nejen na dávce estrogenu, ale také na typu gestagenu při stejné dávce estrogenu. V článku popisujeme případy 8 žen, které byly hospitalizovány na naší jednotce intenzivní péče a které užívaly perorální hormonální antikoncepci, u nichž vznikla hluboká žilní trombóza. Cílem tohoto sdělení je poukázat i na další rizikové faktory žilního tromboembolizmu u uživatelek perorální hormonální antikoncepce.
Klíčová slova:
perorální hormonální antikoncepce – žilní tromboembolizmusÚvod
Žilní tromboembolie (hluboká žilní trombóza a/nebo plicní embolie) patří mezi kardiovaskulární onemocnění se závažnou prognózou. Neléčená akutní plicní embolie vykazuje až 30% mortalitu, zatímco rozpoznaná a léčená plicní embolie jen 8 %. Přibližně 11 % akutních plicních embolií končí náhlou smrtí. Výskyt plicních embolií v České republice není přesně znám. Roční výskyt hluboké žilní trombózy a plicní embolie činí podle směrnic Evropské kardiologické společnosti z roku 2000 0,5–1,0 na 1 000 obyvatel [1]. Podle EPI-GETBO STUDY [2] je četnost plicních embolií 60 na 100 000 a žilní trombózy 124 na 100 000 obyvatel. Pokud bychom tyto údaje extrapolovali na Českou republiku, byl by výskyt plicních embolií 6 000 a žilních trombóz 12 400 za rok. Zdrojem plicní embolie jsou u 85 % nemocných trombózy hlubokých žil dolních končetin, u dalších nemocných bývají zdrojem embolie pánevní žíly, ledvinné žíly, dolní dutá žíla, pravé srdce a jiné. Tromby nejčastěji vznikají ve svalových žilních sinech v lýtku poblíž chlopní a větvení. V průběhu přibližně týdne jich 25 % narůstá do proximálních žil a 75 % jich podléhá spontánní fibrinolýze. Až 50 % proximálních trombóz embolizuje do plic. Závažná prognóza plicní embolie již byla zmíněna výše. Predisponující faktory žilní trombózy s následnou plicní embolií zahrnují klasickou Virchowovu trias: změny koagulace, poruchy cévní stěny a zpomalení toku krve. Rizikové faktory žilní trombózy rozdělujeme na klinické a laboratorní. Klinické rizikové faktory podle British Thoracic Society dělíme na větší a menší. Větší rizikové faktory mají 5–20krát vyšší relativní riziko vzniku žilní tromboembolie, zatímco ty menší jen 2–4krát vyšší. Mezi větší rizikové faktory patří zejména pooperační stavy, traumata, imobilizace, stavy v porodnictví (pozdní těhotenství, císařský řez), šestinedělí, rozsáhlé varikózní žíly na dolních končetinách, předchozí anamnéza žilního tromboembolizmu a maligní onemocnění. Mezi menší rizikové faktory patří kardiovaskulární onemocnění (např. srdeční selhání, infarkt myokardu a další), hormonální rizikové faktory (kortikoidy, estrogeny, perorální antikoncepce a hormonální substituční léčba), CHOPN, neurologické onemocnění postihující hybnost nemocného, obezita, zánětlivé onemocnění střev, nefrotický syndrom, chronická dialýza, myeloproliferativní onemocnění, paroxyzmální noční hemoglobinurie a další. Mezi laboratorní rizikové faktory řadíme vrozené či získané trombofilní stavy (deficit antitrombinu, deficit proteinu C a S, APC rezistence – mutace faktoru V Leiden, zvýšené hodnoty inhibitoru plazminogenového aktivátoru PAI-1, antifosfolipidový syndrom a další). Takzvaná laboratorní rizika nacházíme asi u 10 % všech žilních trombóz a plicních embolií [3]. Frekvence jejich záchytu však závisí na definici vyšetřovaného souboru. Ve skupině žen užívajících kombinovanou perorální hormonální antikoncepci (COC – combined oral contraception) je vždy kolem 30–40 %.
Užívání COC patří sice mezi menší rizikové faktory žilního tromboembolizmu (VTE – venous thrombembolism) s přibližně 3krát větším relativním rizikem, ale vzhledem k počtu takto léčených žen nikoli mezi zanedbatelné faktory. V rozvinutých státech světa někdy v průběhu života užívalo až 80 % žen COC. V České republice tomu tak až do revoluce nebylo. Po uvolnění farmaceutického trhu koncem minulého století a s příchodem nových preparátů dochází postupně k nárůstu uživatelek COC na úroveň vyspělých států světa. Navíc přidáme-li k hormonální antikoncepci např. laboratorní rizikový faktor, o kterém žena nemusí vědět, jako např. heterozygotní mutaci faktoru V (Leiden), zvýší se relativní riziko až na 20násobek. Problematika VTE u uživatelek COC se tak stává stále častěji naší denní praxí a měli bychom vědět, jak riziko vzniku tromboembolizmu redukovat.
Riziko žilního tromboembolizmu u žen užívajících perorální hormonální antikoncepci
První data o hormonální antikoncepci pocházejí z roku 1957 [4]. Historie užívání hormonální antikoncepce je tedy stará přibližně půl století. První zmínky o zvýšeném riziku vzniku VTE u uživatelek perorální hormonální kontracepce se objevily již na konci 60. let minulého století [5]. Pozdější studie z 80. let poukazují na závislost rizika vzniku VTE na dávce estrogenu [6,7]. V roce 1995 poprvé poukázaly tři nezávislé epidemiologické studie na závislost rizika vzniku VTE také na typu gestagenu užitého v kombinovaných preparátech [8–10]. V těchto studiích byl potvrzen vyšší výskyt VTE u preparátů obsahujících gestageny 3. generace (desogestrel, gestoden) oproti těm, které obsahovaly gestageny 2. generace (levonorgestrel). Ve snaze přezkoumat tyto výsledky byla European Agency for Evaluation of Medicinal products (EMEA) v roce 2001 provedena metaanalýza všech epidemiologických studií s COC ve vztahu k VTE od roku 1995. Tato metaanalýza ukázala 1,5–2krát vyšší riziko VTE u pacientek užívajících preparáty s desogestrelem či gestodenem oproti těm, které užívaly preparáty s levonorgestrelem se stejnou dávkou ethinyl estradiolu (EE) [11]. Srovnání rizika vzniku VTE při užívání COC s gestageny 2. generace oproti COC s gestageny 3. generace v posledních 20 letech ukazuje tab. 1.
Tab. 1. Srovnání rizika vzniku VTE při užívání COC s gestageny 2. generace oproti COC s gestageny 3. generace. 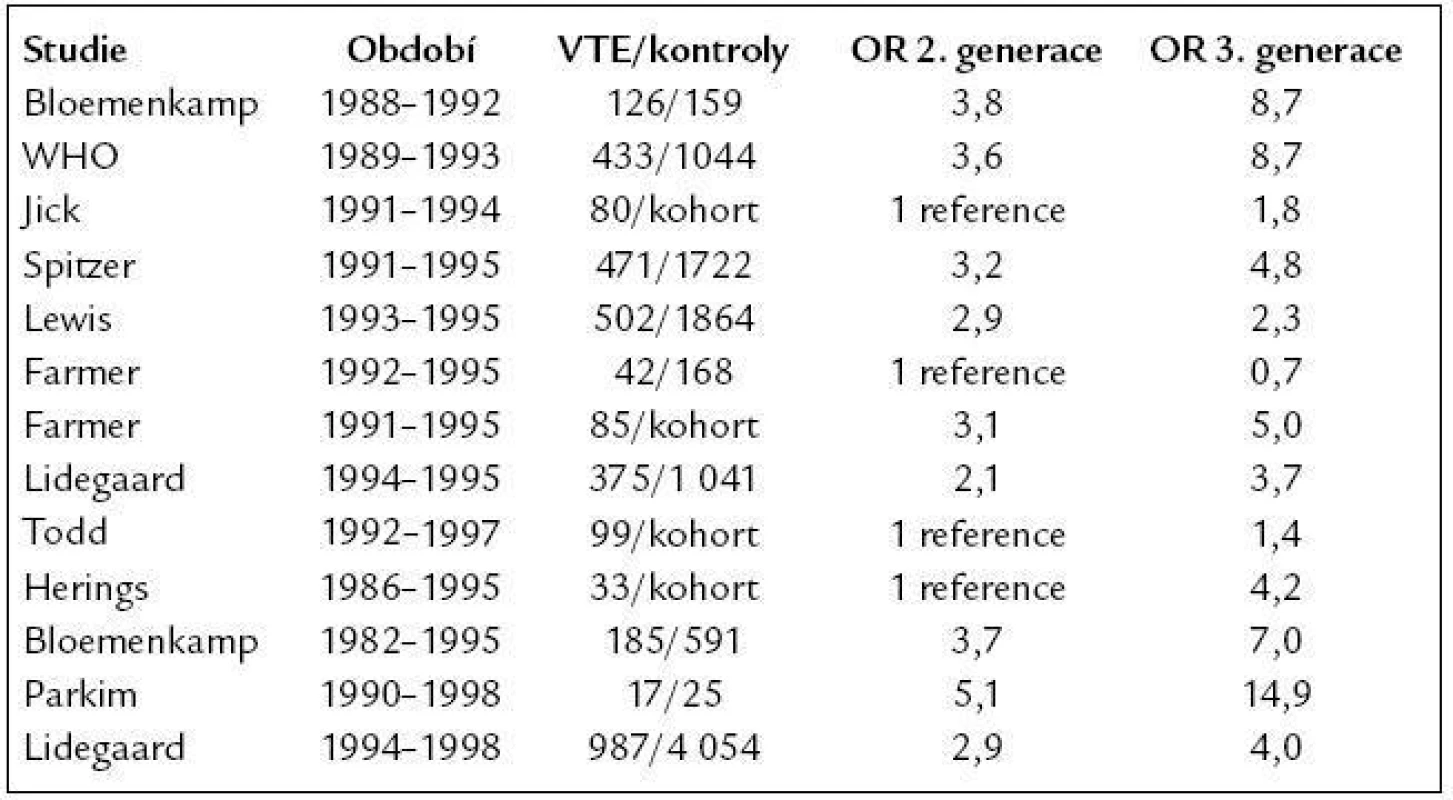
OR – odds ratio (přídatné riziko) V roce 2001 byla v Lancetu publikována další významná práce, která ukázala 4násobný nárůst rizika VTE u žen, které užívaly preparáty s cyproteron acetátem a EE, oproti těm, které užívaly preparáty s přibližně stejnou dávkou EE v kombinaci s levonorgestrelem [12]. Léčba preparáty s cyproteron acetátem je v současné době určena jen k léčbě akné a hirsutizmu současně s kontracepcí.
Nejucelenější přehled o rizicích vzniku VTE u žen, které užívají různé druhy COC, přináší studie Lidegaarda et al [13], která trvala pět let (1. 1. 1994 až 30. 12. 1998). Bylo do ní zařazeno celkem 987 žen s VTE – 309 (31 %) žen prodělalo plicní embolii a 678 (69 %) hlubokou žilní trombózu a 4 054 žen bez anamnézy VTE – kontroly. Výhodou této studie bylo, že probíhala v Dánsku, kde je veřejný zdravotní systém dostupný všem, dále zde každý obyvatel má svůj PIN (personal identification number – podoba s naším rodným číslem), což usnadňuje randomizaci pacientek. Další výhodou je elektronický systém registrace diagnóz při propuštění, do kterého jsou zařazeny všechny nemocnice v Dánsku. Neméně důležitým byl slib lékařů, že pod vlivem dřívějších studií nebudou měnit zvyky v předepisování COC. Poslední výhodou bylo to, že všichni mladí lidé s podezřením na VTE jsou v Dánsku referováni do nemocnice. Ženy byly pro potřebu statistické analýzy rozděleny do skupin podle typů užívané antikoncepce a délky užívání následovně: čtyři skupiny podle dávky estrogenů (50 μg EE, 30–40 μg EE, 20 μg EE, POP – progestin-only pills), čtyři skupiny podle trvání užívání COC (nikdy, < 1 rok, 1–5 let, > 5 let) a tři skupiny podle kombinací (1. generace – COC s 50 μg EE, 2. generace – COC s 30–40 μg EE a levonorgestrel, norgestrel nebo norgestimate – částečně metabolizován na levonorgestrel, 3. generace – COC s 20–40 μg EE a desogestrel nebo gestoden).
Tato studie ukázala, že ženy, které prodělaly VTE oproti kontrolám, častěji užívaly COC (52,5 % vs 29,8 %), naopak méně žen, které prodělaly VTE v minulosti, užívalo COC oproti kontrolám (32,6 % vs 50 %), přibližně stejné procento žen užívalo v obou skupinách cyproterone acetát (1,1 % vs 1 %). Výsledky byly dále adjustovány a korigovány na věk, rodinnou anamnézu VTE, BMI, vzdělání, kouření, diabetes mellitus, poruchy koagulace, porod v anamnéze, trvání užívání COC, typ progestinu a dávku estrogenu. Tab. 2 a 3 ukazují redukci rizika VTE po 1. roce užívání COC o 50 %, nárůst rizika VTE s dávkou estrogenu o 100 % a 33% rozdíl v riziku VTE při užívání 2. oproti 3. generaci gestagenů.
Tab. 2. Riziko vzniku VTE v závislosti na délce užívání a typu COC. 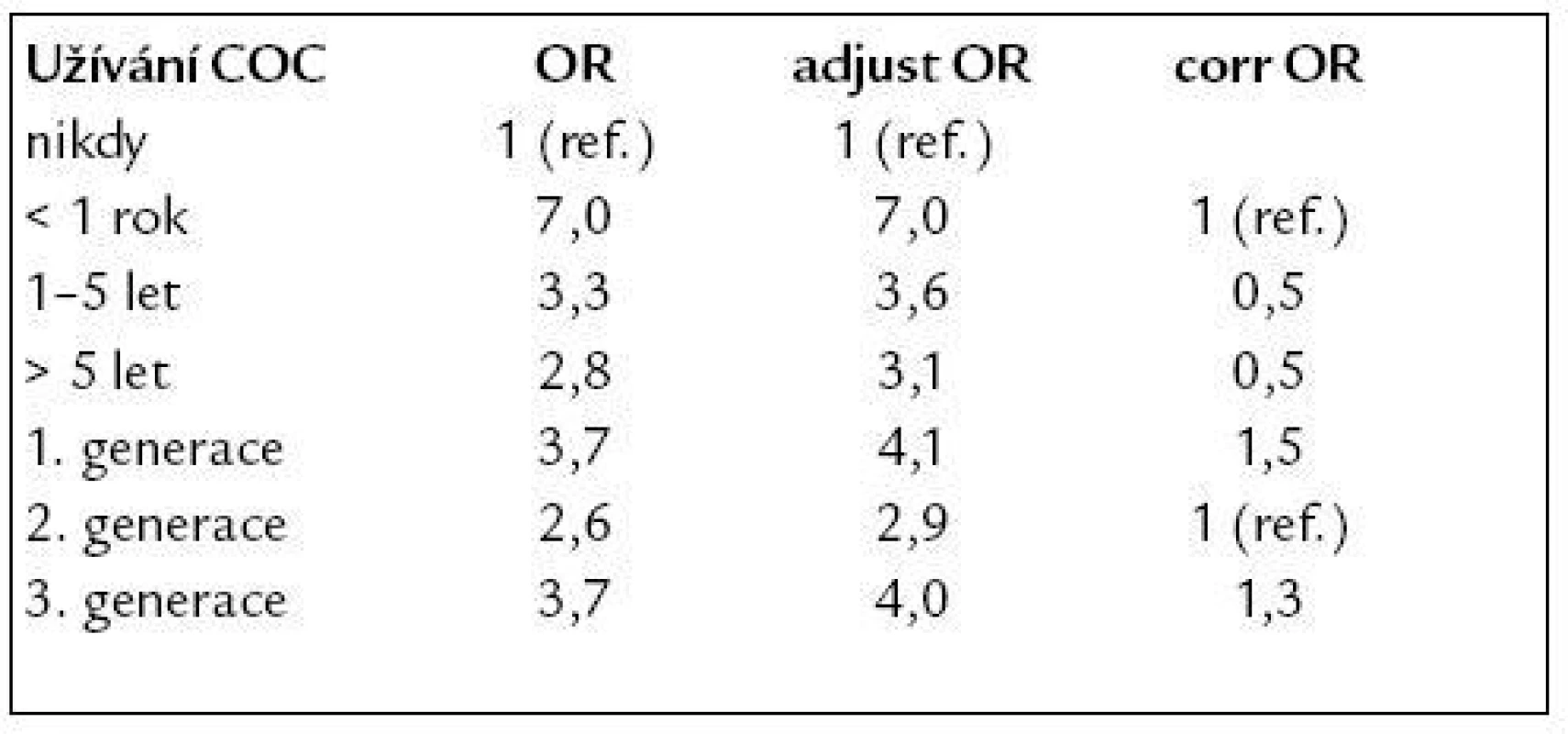
OR – odds ratio (přídatné riziko), adjust – adjustované, corr – korigované Tab. 3. Riziko vzniku VTE v závislosti na dávce EE. 
OR – odds ratio (přídatné riziko), adjust – adjustované, corr – korigované Jako významný přídatný rizikový faktor při užívání COC se ukázalo kouření více než 10 cigaret denně a body mass index nad 26, což ukazuje tab. 4.
Tab. 4. Kouření a habitus jako rizikové faktory vzniku VTE u uživatelek COC. 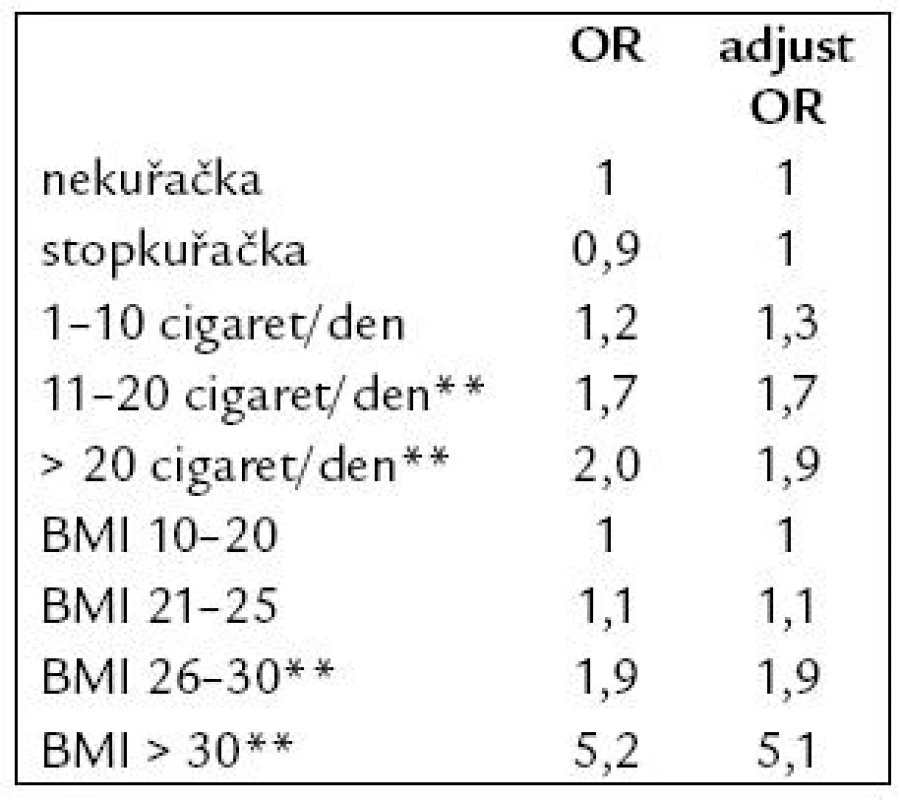
OR – odds ratio (přídatné riziko), adjust – adjustované, **p < 0,001 Mezi další přídatné rizikové faktory (tab. 5), které se uplatňují při vzniku VTE u pacientek užívajících COC, patří pozitivní rodinná anamnéza a již zmiňované trombofilní stavy, o kterých ženy většinou neví a které se někdy manifestují až po nasazení COC.
Tab. 5. Rizikové faktory VTE u uživatelek COC. 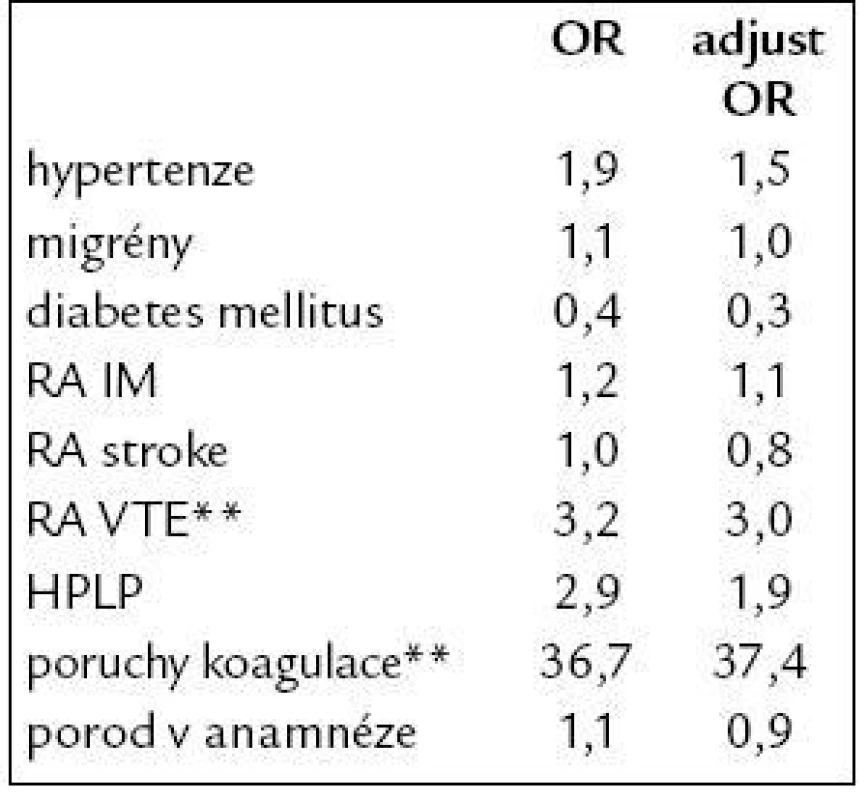
OR – odds ratio (přídatné riziko), adjust – adjustované, **p < 0,001 V září roku 2009 byla v British Medical Journal publikována další Lidegaardova práce [14] z let 1995–2005, do níž byly zařazeny ženy ve věku 15–49 let bez anamnézy kardiovaskulárního onemocnění či malignity. V průběhu sledovaného období bylo zachyceno 4 213 případů VTE. Absolutní riziko žen, které užívaly COC, bylo přibližně dvojnásobné oproti těm, které COC neužívaly. Studie taktéž potvrdila výsledky předchozího Lidegaardova průzkumu. A sice, že po 1. roce užívání COC klesá riziko vzniku VTE a že preparáty obsahující desogestrel a gestoden vykazují větší riziko vzniku VTE. WHO [8] a výše zmíněná první Lidegaardova studie [13] ale také poukazují na 40–50% snížení rizika vzniku ischemické cévní mozkové příhody u žen užívajících COC s 3. generací gestagenů oproti 2. generaci. Ženy, které měly pozitivní rodinnou anamnézu, obezitu a genetickou predispozici, trpěly častěji VTE, zatímco ženy ve věku nad 35 let s pozitivní rodinnou anamnézou ischemické cévní mozkové příhody, kouření, hypertenze a migrén měly častější výskyt ischemických cévních mozkových příhod. Incidence VTE u žen mladších 30 let užívajících COC je přibližně 10 na 100 000 za rok, zatímco incidence ischemické cévní mozkové příhody je 3 na 100 000 za rok. U žen od 31 do 44 let je to 23, resp. 15 na 100 000 za rok. Roční mortalita na VTE je v daných věkových skupinách 0,6, resp. 1,7 na milion a na ischemickou cévní mozkovou příhodu 2,2, resp. 2,3 na milion v jednotlivých věkových skupinách. VTE je tedy u mladších žen častější diagnózou než ischemická cévní mozková příhoda. Ischemické cévní mozkové příhody mají ale oproti VTE vyšší mortalitu.
Naše zkušenosti s COC u žen s hlubokou žilní trombózou – soubor nemocných
Za posledních 12 měsíců jsme na JIP Interní kardiologické kliniky FN Brno-Bohunice provedli 8krát lokální trombolýzu hluboké žilní trombózy dolních končetin u mladých žen užívajících COC.
První pacientkou byla 17letá žena normostenického habitu, nekuřačka s negativní rodinnou i osobní anamnézou VTE, která byla přijata pro levostrannou ileofemorální (IF) flebotrombózu. Nemocná užívala 7 měsíců COC (35 μg EE + cyproteron acetát), z dalších rizikových faktorů byla zjištěna heterozygotní mutace faktoru V (Leiden) a May-Turnerův syndrom (komprese v. iliaca comunis mezi a. iliaca comunis a obratlovým tělem), o kterých pacientka dosud nevěděla.
Druhou pacientkou byla 38letá žena normostenického habitu, nekuřačka, opět s negativní rodinnou i osobní anamnézou VTE, s levostrannou IF flebotrombózou, která vznikla za tři týdny po operaci herniace disku L4/L5. Pacientka po operaci časně rehabilitovala a byla po dobu jednoho týdne zajištěna profylaktickou dávkou nízkomolekulárního heparinu. Hereditární trombofilní stav u této pacientky zjištěn nebyl. Jediným dalším rizikovým faktorem bylo užívání COC (20 μg EE + gestoden), tedy preparátu s 3. generací gestagenů.
Třetí pacientkou byla dosud zdravá, 19letá nekuřačka normostenického habitu s oboustrannou IF flebotrombózou s pozitivní rodinnou anamnézou jak tromboembolické nemoci, tak ischemické cévní mozkové příhody v mladším věku, které byla před jedním a půl měsícem nasazena COC (30 μg EE + gestoden), tedy opět 3. generace gestagenů. U této mladé ženy byla navíc zjištěna heterozygotní mutace faktoru V (Leiden) a homozygotní mutace methylentetrahydrofolátreduktázy (MTHFR) s hyperhomocysteinemií při přijetí, při kontrolách již s normální hladinou homocysteinu. Pozitivita lupus antikoagulans byla u této ženy pouze jednorázová a antifosfolipidový syndrom prokázán nebyl. U pacientky byla dále zjištěna atrezie části v. cava inferior, o které dosud nevěděla.
Čtvrtou pacientkou byla 30letá žena s levostrannou IF flebotrombózou s pozitivní rodinnou anamnézou VTE v mladém věku (více příbuzných) s tři měsíce trvající terapií COC (35 μg EE + norgestimate). Žena se nikdy s ničím neléčila, nekouřila a neměla nadváhu ani obezitu. U této pacientky byl zjištěn hereditární deficit antitrombinu a homozygotní mutace faktoru V (Leiden).
Pátou pacientkou byla 17letá žena, nekuřačka, normostenického habitu s pravostrannou IF flebotrombózou s pozitivní rodinnou anamnézou VTE (matka měla po nasazení COC hlubokou flebotrombózu), pacientka užívala COC (30 μg EE + desogestrel), tedy kombinovaný preparát s gestagenem 3. generace jeden a půl měsíce. Trombofilní stavy byly došetřovány až po propuštění z naší kliniky v místě bydliště a jejich výsledek nám není dosud znám.
Šestou pacientkou byla 33letá žena s levostrannou IF flebotrombózou, u níž byla terapie COC (nezjištěný typ) jen jedním z rizikových faktorů. Nemocná byla kuřačka (až 20 cigaret denně), normostenického habitu s negativní rodinnou i osobní anamnézou VTE. U této pacientky vznikla flebotrombóza přibližně měsíc po úrazu levé dolní končetiny s frakturou lopaty kosti kyčelní a následnou imobilizací. Nemocné byla po dobu hospitalizace aplikována profylaktická dávka nízkomolekulárního heparinu. Při propuštění z nemocnice jí bylo doporučeno jen užívání 100 mg kyseliny acetylsalicylové denně jako profylaxe VTE. U této pacientky byla navíc zjištěna heterozygotní mutace faktoru V (Leiden) a již výše zmiňovaný May-Turnerův syndrom.
Sedmou pacientkou byla 30letá cizinka, nekuřačka, normostenického habitu s negativní rodinnou i osobní anamnézou s oboustrannou IF flebotrombózou, u které byla nasazena dva měsíce před vznikem této trombózy blíže neurčená COC. U této pacientky jsme navíc zjistili částečnou atrezii v. cava inferior. Trombofilní stavy nebyly po dobu pobytu v ČR došetřovány.
Nejstarší a zároveň poslední pacientkou, u které mohla léčba COC (20 μg EE + gestoden) souviset se vznikem levostranné IF flebotrombózy, byla 50letá žena, u které trombóza vznikla tři týdny po imobilizaci dolní končetiny po úrazu. Nemocná nebyla po dobu imobilizace zajištěna profylaktickou dávkou nízkomolekulárního heparinu a užívala hormonální kontracepci. Trombofilní stavy nebyly vzhledem k věku a jasné souvislosti s imobilizací dolní končetiny došetřovány. Pacientka neměla žádné další rizikové faktory VTE.
Diskuze
U 1. pacientky byla terapie COC do jednoho roku od nasazení a navíc obsahující cyproteron acetát jistě významným rizikovým kofaktorem při vzniku hluboké žilní trombózy. Pooperační období je jistě významným rizikovým faktorem vzniku VTE, je ale otázkou, zda by užití COC s 2. generací gestagenů zabránilo vzniku hluboké flebotrombózy u 2. pacientky. Jisté ale je, že riziko vzniku by při užití této kombinace bylo alespoň sníženo. Podle doporučení k předpisu kombinované hormonální antikoncepce z roku 2005 a podle doporučení WHO by měla být hormonální antikoncepce měsíc před plánovaným výkonem trvajícím více než 30 min či před operací s předpokládanou imobilizací vysazena, v případě akutní operace by měla být zajištěna profylaxe VTE po dostatečně dlouhou dobu, což u 2. pacientky splněno nebylo [15]. U 3. pacientky vyvstává otázka, proč při opakovaném rodinném výskytu tromboembolické nemoci v mladším věku byla COC nasazena bez předchozího došetření trombofilních stavů, jak je to uvedeno v doporučeních [16]. Otázka u 4. pacientky je stejná jako u předchozího případu. COC by této pacientce po odebrání řádné anamnézy a došetřením trombofilních stavů nebyla nikdy nasazena. U 5. pacientky se vyskytla čerstvě nasazená terapie COC s 3. generací gestagenu v kombinaci s pozitivní rodinnou anamnézou. Tedy opět stejná otázka, nešlo u této ženy, jejíž matka měla VTE po COC, zabránit vzniku flebotrombózy nenasazením COC, navíc preparátu obsahujícího 3. generaci gestagenu? Matka 5. pacientky měla po nasazení COC hlubokou flebotrombózu. I přes jasně pozitivní rodinnou anamnézu VTE, navíc po nasazení hormonální kontracepce, nebyly trombofilní stavy ani u matky, ani u dcery před nasazením COC (kombinovaného preparátu s gestagenem 3. generace) vyšetřeny. U této nemocné se potvrdila i největší rizikovost COC v 1. roce po nasazení. U 6. pacientky se vyskytlo mnoho rizikových faktorů pro vznik VTE (úraz s následnou imobilitou dolní končetiny, COC, kouření, heterozygotní mutace faktoru V, May-Turnerův syndrom). U této nemocné ale opět nebylo splněno doporučení vysazení hormonální kontracepce a dostatečně dlouhé profylaxe VTE pomocí nízkomolekulárního heparinu. Dle doporučení k předpisu kombinované hormonální antikoncepce z roku 2005 je hormonální antikoncepce u žen nad 35 let, které kouří více než 15 cigaret denně, kontraindikována. Pro kuřačky pod 35 let doporučení bohužel uvedeno není. Žena se však věkově blížila rizikové kategorii, a vyvstává tak otázka, zda neměla být kontracepce po dobu imobilizace alespoň přerušena. U 7. pacientky byla COC opět jen jedním z rizikových faktorů vzniku VTE. Vyskytla se zde ale jasná časová souvislost mezi nasazením hormonální kontracepce a vznikem flebotrombózy, což potvrzuje největší rizikovost vzniku VTE v 1. roce užívání hormonální kontracepce. U poslední pacientky byla jistě nejvýznamnějším rizikovým faktorem vzniku VTE imobilizace dolní končetiny bez zajištění profylaxe VTE, přesto by, podobně jako u 2. pacientky, bylo riziko vzniku VTE sníženo, pokud by nemocná užívala COC s 2. generací gestagenů. Riziko vzniku VTE by navíc mohlo být sníženo vysazením hormonální kontracepce. Anatomické abnormity, jako jsou atrezie části v. cava inferior či May-Turnerův syndrom, patří jistě mezi významné rizikové faktory, nicméně pravděpodobně předem nezjistitelné.
V našem souboru jsme uvedli jen ženy s hlubokou flebotrombózou dolních končetin, které podstoupily lokální trombolýzu. Jistě existuje ještě velká skupina žen, které jsou léčeny v sektorových nemocnicích, a dále žen s distální flebotrombózou, které jsou léčeny ambulantně. Další, jistě neméně početnou skupinou jsou mladé ženy s plicní embolií, která může souviset s užíváním COC. Nejedná se tedy jen o ojedinělé případy souvislosti VTE a užívání COC. Z našich zkušeností vyplývá, že mnoha případům VTE lze jistě do budoucna předejít. Měly bychom se častěji před nasazením COC zamýšlet nad rizikovými faktory a pečlivě zvažovat výběr preparátu. Musíme si především uvědomit, že pozitivní rodinná anamnéza VTE u blízkých příbuzných zvyšuje riziko VTE až 3krát. Klasický rizikový faktor, kterým je kouření, sice zvyšuje riziko vzniku VTE u mladých žen, mnohem více ale zvyšuje riziko vzniku ischemické cévní mozkové příhody. Na význam obezity v roli rizikového faktoru VTE již bylo poukázáno v mnoha studiích. Neměli bychom také zapomínat na možnou přítomnost trombofilních stavů či jiných anatomických abnormit. Nástrojem by měla být užší spolupráce mezi internisty, hematology a gynekology.
Závěr
Absolutní riziko VTE u mladých žen bez anamnézy předchozí tromboembolické nemoci je velmi malé, proto hormonální antikoncepce není a priori kontraindikována. V případě pozitivní osobní anamnézy VTE je hormonální antikoncepce kontraindikována. V případě pozitivní rodinné anamnézy VTE před 45. rokem věku nebo při opakovaných příhodách či VTE v neobvyklých lokalizacích je nutno indikovat vyšetření trombofilního stavu. V případě pozitivního nálezu je indikováno cílené vyšetření na stejný znak u ženy, které hodláme hormonální antikoncepci podávat. Hormonální antikoncepce je kontraindikována v případě deficitu antitrombinu, proteinu C a proteinu S, homozygotní formy mutace faktoru V (Leiden) a mutace genu kódujícího protrombin (F II20210A). V případě heterozygotní formy mutace faktoru V (Leiden) a F II20210 je nutné ženě vysvětlit míru rizika VTE při užívání hormonální antikoncepce a nechat na jejím vlastním rozhodnutí, zda hormonální antikoncepci užívat bude, či nebude. V případě, že se žena antikoncepci rozhodne užívat, je vhodné ji poučit o zajištění všech rizikových situací spojených s VTE (operace, imobilizace, přiložení sádry apod.), a to vždy pomocí nízkomolekulárního heparinu. Pokud se žilní trombóza vyskytla u rodičů v pozdějším věku, tak vyšetření trombofilního stavu indikováno není. Hormonální antikoncepce pak není u ženy kontraindikována.
Hormonální antikoncepce by měla být vysazena měsíc před plánovaným výkonem trvajícím více než 30 min či před operací s předpokládanou imobilizací, v případě akutní operace by měla být zajištěna profylaxe VTE po dostatečně dlouhou dobu pomocí miniheparinizace. Přednost v rámci rizika vzniku VTE mají preparáty COC s nízkou dávkou EE a s 2. generací gestagenů. Ženy s pozitivní rodinnou anamnézou, obezitou a genetickou predispozicí by měly na základě výsledků WHO a Lidegaardovy studie spíše užívat COC s nízkou dávkou EE a s gestageny 2. generace, zatímco ženy s pozitivní rodinnou anamnézou ischemické cévní mozkové příhody, kouření, hypertenze, migrén a věku nad 35 let by měly užívat preparáty COC s nízkou dávkou EE a s 3. generací gestagenů. Neméně důležité je poukázat na vysoké riziko VTE při užívání preparátů obsahujících cyproterone acetát.
MUDr. Ondřej Ludka, Ph.D.
www.fnbrno.cz
e mail: oludka@yahoo.com
Zdroje
1. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force on Pulmonary Embolism, European Society of Cardiology. Eur Heart J 2000; 21 : 1301–1336.
2. Noboa S, Mottier D, Oger E. EPI‑GETBO Study Group. Estimation of a potentially preventable fraction of venous thromboembolism: a community‑based prospective study. J Thromb Haemost 2006; 4 : 2720–2722.
3. Widimsky J, Maly J, Elias P et al. Doporučení diagnostiky, léčby a prevence plicní embolie, verze 2007. Cor Vasa 2008; 50 (Suppl): 1S25–1S72.
4. Rock J, Garcia CR, Pincus G. Synthetic progestins in the normal human menstrual cycle. Recent Prog Horm Res 1957; 13 : 323–339.
5. Inman WH, Vessey MP, Westerholm B et al. Thromboembolic disease and the steroidal kontent of oral contraceptives. A report to the Committee on Safety of Drugs. Br Med J 1970; 2 : 203–209.
6. Meade TW, Greenberg G, Thompson SG. Progestogens and cardiovascular actions associated with oral contraceptives and a comparison of the safety of 50 and 30 μg estrogen preparations. Br Med J 1980; 280 : 1157–1161.
7. Böttiger LE, Boman G, Eklund G et al. Oral Contraceptives and thromboembolic disease: effects of lowering oestrogen content. Lancet 1980; 1 : 1097–1101.
8. World Health Organisation Collaborative Study on cardiovascular disease and steroid hormone contraception. Effect of different progestogens in low oestrogen oral contraceptives on venous thromboembolic disease. Lancet 1995; 346 : 1582–1588.
9. Jick H, Jick SS, Gurewitch V et al. Risk of idiopathic cardiovascular death and non fatal venous thromboembolism in women using oral contraceptives with differing progestagen components. Lancet 1995; 346 : 1589–1593.
10. Spitzer WO, Lewis MA, Heinemann L et al. Third generation oral contraceptives and risk of venous thromboembolic disorders: an international case‑control study. Transnational Research Group on Oral Contraceptives and the Health of Young Women. BMJ 1996; 312 : 83–88.
11. EMEA. Committee for Proprietary Medicinal Products (CPMP) public assessment report on combined oral contraceptives and venous thromboembolism. Available from http://www.emea.EU.int/pdfs/human/reggaffair/0220101en.pdf.
12. Vasilakis‑Scaramozza C, Jick H. Risk of venous thromboembolism with cyproterone or levonorgestrel contraceptives. Lancet 2001; 358 : 1427–1429.
13. Lidegaard Ø, Edström B, Kreiner S. Oral contraceptives and venous thromboembolism: a five‑year national case‑control study. Contraception 2002; 65 : 187–196.
14. Lidegaard Ø, Løkkegaard E, Svendsen AL et al. Hormonal contraception and risk of venous thromboembolism: national follow‑up study. BMJ 2009; 339 : 557–560.
15. Čepický P, Cibula D, Dvořák K et al. Doporučení k předpisu kombinované hormonální kontracepce (CC). Aktualizace 2005. Čes Gynekol 2005; 70 : 465–468.
16. Dulíček P, Kalousek I. Hormonální antikoncepce a tromboembolická nemoc na konci tisíciletí. Plánování rodiny a reprodukční zdraví 2000; 3 : 60–63.
Štítky
Dětská gynekologie Diabetologie Endokrinologie Gynekologie a porodnictví Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Je syndrom polycystických ovarií součástí autoimunitních onemocnění? – editorial
- Problematika časné defibrilace – editorial
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
- Evaluation of cardiovascular high risk population in Specialists Ambulance: ESA
- Prevalence anémie a vliv na hospitalizační mortalitu pacientů přijatých pro akutní srdeční selhání
- Vývoj autonomních parametrů u pacientů po infarktu myokardu s ST elevacemi
- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Srdce nemocného s diabetem 1. typu
- Rozdiely medzi pohlaviami v nefarmakologickej liečbe chronického srdcového zlyhávania
- Doporučení ILCOR pro označení automatizovaných externích defibrilátorů (AED)
- Angiologické dny 2010
- Prof. MU Dr. Jiří Widimský, DrSc., FESC, FAHA, člen České lékařské akademie, se dožívá 85 let
-
Müllerová D et al. Obezita – prevence a léčba. Praha: Mladá fronta, a.s. 2009. 261 stran.
ISBN 978- 80- 204- 2146- 3. -
Cetkovský P, Kouba M et al. Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů. Praha: Triton 2009. 259 stran.
ISBN 978- 80- 7378- 343- 1. -
XXIX. dni mladých internistov Martin, Slovenská republika, 27.– 28. 5. 2010
Zborník abstraktov
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Familiární hyperkalcemie a hypofosfatemie a jejich význam v diferenciální diagnostice poruch kalcium‑ fosfátového metabolizmu
- Souborný pohled na efekt hormonu a cytokinu prolaktinu v rozvoji a patogenezi autoimunitních onemocnění
- Syndróm polycystických ovárií a autoimunitné ochorenia
- Perorální hormonální antikoncepce a riziko vzniku žilního tromboembolizmu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



