-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dysfunkce pravé komory po implantaci levostranné mechanické srdeční podpory
Right ventricular dysfunction after left ventricular assist device implantation
Objective:
The frequency of long‑term left ventricular assist device (LVAD) implantation is increasing. Acute right ventricular dysfunction or right ventricular failure after LVAD implantation has important influence on morbidity and mortality. The aim of our study was to assess the management of right ventricular dysfunction after LVAD implantation.Methods:
The study group comprised 21 patients with implanted HeartMate II® LVAD since December, 2006 to April, 2009. We evaluated in retrospective fashion baseline parameters of cardiovascular and other organ systems before LVAD implantation, applied pharmacological and mechanical support for the right ventricle, and important clinical outcomes to the end of June, 2009.Results:
LVAD was implanted in 18 men and 3 women with mean age of 48.7 ± 11.2 years. The most frequent diagnosis was dilatational cardiomyopathy (9 patients; 42.9%), and the most frequent indication for implantation was bridge-to-transplantation (19 patients; 90.4%). Pharmacological support of the right ventricle after LVAD implantation comprised dobutamine (21 patients; 100%), milrinone (21 patients; 100%), isoproterenol (1 patient; 4.8%), and levosimendan (5 patients; 23.8%). In 2 (9.5%) cases there was a need for repeated application of levosimendan during postoperative course. Inhalational nitric oxide was used in 14 (66.7%) patients. Despite extensive pharmacological support, 3 (14.3%) patients needed right ventricular assist device (RVAD) implantation. Most patients (9; 42.8%) survived to heart transplantation; in one (4.8%) case LVAD was successfuly explanted; 6 (28.6%) patients is living with LVAD; 5 (23.8%) patients died during LVAD support.Conclusion:
After LVAD implantation there is a need for aggressive pharmacological, and in some cases mechanical, support of the right ventricular function to provide adequate blood flow to LVAD in order to minimize morbidity and mortality.Key words:
mechanical circulatory support – right ventricular dysfunction – levosimendan – nitric oxide
Autoři: H. Říha 1,4; I. Netuka 2,4; T. Kotulák 1; J. Malý 2,4; M. Pinďák 1; P. Kellovský 1; F. Kopáč 1; D. Hodr 1; O. Szárszoi 2,4; J. Kettner 3; H. Al-Hiti 2; Z. Dorazilová 3; T. Marek 3; I. Skalský 2; J. Pirk 2,4
Působiště autorů: Klinika anesteziologie a resuscitace, Kardiocentrum IKEM Praha, přednosta prim. MUDr. Tomáš Kotulák 1; Klinika kardiovaskulární chirurgie, Kardiocentrum IKEM Praha, přednosta prof. MUDr. Jan Pirk, DrSc. 2; Klinika kardiologie, Kardiocentrum IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc. 3; Centrum výzkumu chorob srdce a cév IKEM Praha, vedoucí projektu prof. MUDr. Bohuslav Ošťádal, DrSc. 4
Vyšlo v časopise: Vnitř Lék 2010; 56(1): 30-36
Kategorie: Původní práce
Souhrn
Úvod:
Četnost použití dlouhodobých levostranných implantabilních mechanických srdečních podpor (LVAD) se stále zvyšuje. Akutní dysfunkce nebo selhání pravé komory po implantaci LVAD má významný vliv na morbiditu a mortalitu pacientů. Cílem práce bylo zhodnocení léčby dysfunkce pravé komory po implantaci LVAD.Metodika:
U souboru 21 pacientů s implantovaným HeartMate II® LVAD v období prosinec roku 2006 až duben roku 2009 jsme retrospektivně zhodnotili základní předoperační parametry charakterizující stav kardiovaskulárního systému a orgánové funkce před implantací LVAD, použitou farmakologickou a mechanickou podporu pravé komory po implantaci a celkové klinické výsledky k 30. červnu 2009.Výsledky:
LVAD byl implantován 18 mužům a 3 ženám s průměrným věkem 48,7 ± 11,2 let. Převažující diagnózou byla dilatační kardiomyopatie (9 pacientů; 42,9%) a indikací most k transplantaci srdce (19 případů; 90,4%). Farmakologická podpora funkce pravé komory po zavedení LVAD zahrnovala dobutamin (21 pacientů; 100%), milrinon (21 pacientů; 100%), izoprenalin (1 pacient; 4,8%) a levosimendan (5 pacientů; 23,8%). Podání levosimendanu bylo u 2 (9,5%) pacientů v pooperačním období nezbytné zopakovat. Inhalační oxid dusnatý byl aplikován 14 (66,7%) pacientům. I přes maximální farmakologickou podporu jsme museli ve 3 (14,3%) případech zavést pravostrannou mechanickou podporu (RVAD). Přemostění do transplantace srdce bylo úspěšné u 9 (42,8%) pacientů; v jednom (4,8%) případě došlo k úspěšné explantaci LVAD; 6 (28,6%) pacientů žije dosud s LVAD; 5 (23,8%) pacientů zemřelo s implantovaným LVAD.Závěr:
Po implantaci LVAD je nezbytná agresivní farmakologická a v některých případech i mechanická podpora funkce pravé komory, aby byla zajištěna adekvátní funkce LVAD, a tím minimalizována morbidita a mortalita.Klíčová slova:
mechanická srdeční podpora – dysfunkce pravé komory – levosimendan – oxid dusnatýÚvod
I přes pokrok ve farmakologické léčbě akutního i chronického srdečního selhání narůstá výrazně v posledních letech význam mechanických srdečních podpor (mechanical circulatory support – MCS) v terapii srdečního selhání [1]. MCS nalézají uplatnění v léčbě terminální fáze chronického srdečního selhání [2] – indikace bridge-to-transplantation (most k ortotopické transplantaci srdce – OTS), bridge‑to‑candidacy (most k zařazení na čekací listinu pro OTS při vysoké plicní hypertenzi) nebo permanentní léčba (destination therapy) [3]. Zároveň se MCS stále více používají v terapii akutního srdečního selhání [4] – indikace bridge‑to‑recovery (zotavení např. po rozsáhlém kardiochirurgickém výkonu, akutním infarktu myokardu nebo myokarditidě) nebo bridge‑to‑decision, kdy MCS zajistí adekvátní srdeční výdej a postupnou normalizaci orgánových funkcí, a tím čas pro další řešení vlastní příčiny akutního srdečního selhání.
V Kardiocentru Institutu klinické a experimentální medicíny (IKEM) byl zahájen systematický program používání dlouhodobých mechanických srdečních podpor v indikaci most k OTS v roce 2003 [5], a to jako první v bývalých zemích střední a východní Evropy. Zpočátku byl používán parakorporální systém Thoratec® PVAD (Thoratec® Corp., Pleasanton, CA, USA) generující pulzatilní průtok krve, a to většinou v biventrikulární konfiguraci [6]. Od roku 2006 se těžiště implantovaných dlouhodobých MCS postupně přesouvá – v souladu se světovým trendem – k implantabilním levostranným mechanickým srdečním podporám; v našem centru využíváme HeartMate II® LVAD (left ventricular assist device) [7] firmy Thoratec® Corp. (obr. 1), který generuje nepulzatilní krevní průtok a po určité době hospitalizace umožňuje propuštění pacientů z nemocniční do domácí péče a jejich další ambulantní sledování.
Obr. 1. HeartMate II<sup>®</sup> LVAD (Thoratec<sup>®</sup> Corp., Pleasanton, CA, USA; www.thoratec.com). 
Vzhledem k tomu, že se jedná o mechanickou srdeční podporu pro levou komoru, je v perioperačním období velmi důležitá funkce pravé komory. Ta je většinou postižena již základním srdečním onemocněním, následně kardiochirurgickým výkonem během implantace LVAD a po něm řadou patofyziologických změn, jako je např. vzestup žilního návratu nebo změny polohy interventrikulárního septa (IVS) [8]. V naší studii jsme se zaměřili na retrospektivní zhodnocení léčby dysfunkce pravé komory po implantaci HeartMate II® LVAD.
Materiál a metodika
Soubor nemocných
V období prosinec roku 2006 až duben roku 2009 byla v Kardiocentru IKEM implantována levostranná mechanická srdeční podpora HeartMate II® LVAD celkem 22 pacientům. Do retrospektivního zhodnocení bylo zařazeno 21 pacientů; z analýzy byla vyřazena mladá pacientka s jednokomorovou cirkulací po dříve provedeném totálním kavopulmonálním spojení, aby byla zachována homogenita souboru vzhledem k hodnocení léčby dysfunkce pravé komory. Celkové klinické výsledky byly hodnoceny do 30. června 2009.
Perioperační postup
Implantace mechanické srdeční podpory HeartMate II® proběhly na operačním sále v celkové kombinované anestezii se zajištěním dýchacích cest endotracheální rourkou. Základní hemodynamická monitorace (EKG, invazivní arteriální tlak, centrální žilní tlak – CVP) byla ve všech případech doplněna o plicnicový katétr (pulmonary artery catheter – PAC) k měření tlaků v plicnici a termodiluční stanovení srdečního výdeje a o jícnovou sondu pro echokardiografické vyšetření (TEE).
Vlastní chirurgická implantace proběhla ze sternotomického přístupu na mimotělním oběhu (MO) v normotermii a bez použití příčné aortální svorky a kardioplegické srdeční zástavy (s výjimkou několika případů, kdy bylo nutné provést v jedné době další kardiochirurgický výkon, např. na ascendentní aortě, trikuspidální nebo aortální chlopni) [9]. Vtoková kanyla byla implantována do hrotu levé komory a výtoková protéza do ascendentní aorty (obr. 2). Ve všech případech byl použit kardiochirurgický postup, kdy po 24 hod od primární implantace byla na operačním sále provedena plánovaná revize s definitivní suturou sternotomické rány. Standardní inotropní podpora pro pravou komoru během odpojování od mimotělního oběhu zahrnovala dobutamin (Dobutamin Lachema; Pliva‑Lachema, CZ) a milrinon (Corotrop; Sanofi‑Aventis, FR), event. v kombinaci s levosimendanem (Simdax; Orion Corporation, FIN); jako vazopresor první volby byl použit noradrenalin (Noradrenalin Léčiva; Zentiva, CZ), event. v kombinaci s terlipresinem (Remestyp; Ferring Léčiva, CZ) nebo vazopresinem (Vasopresin; American Regent, NY, USA). V případě přetrvávající dysfunkce pravé komory a vysokých tlaků v plicnici byl nasazen inhalační oxid dusnatý (NO). Pokud ani tato maximální farmakologická podpora nezajistila uspokojivou funkci pravé komory, byla implantována pravostranná mechanická srdeční podpora CentriMag® RVAD (Levitronix® GmbH; Curych, CH).
Obr. 2. Rentgenový snímek hrudníku pacienta s implantovaným HeartMate II<sup>®</sup> LVAD a kardiostimulátorem (archiv KC IKEM). 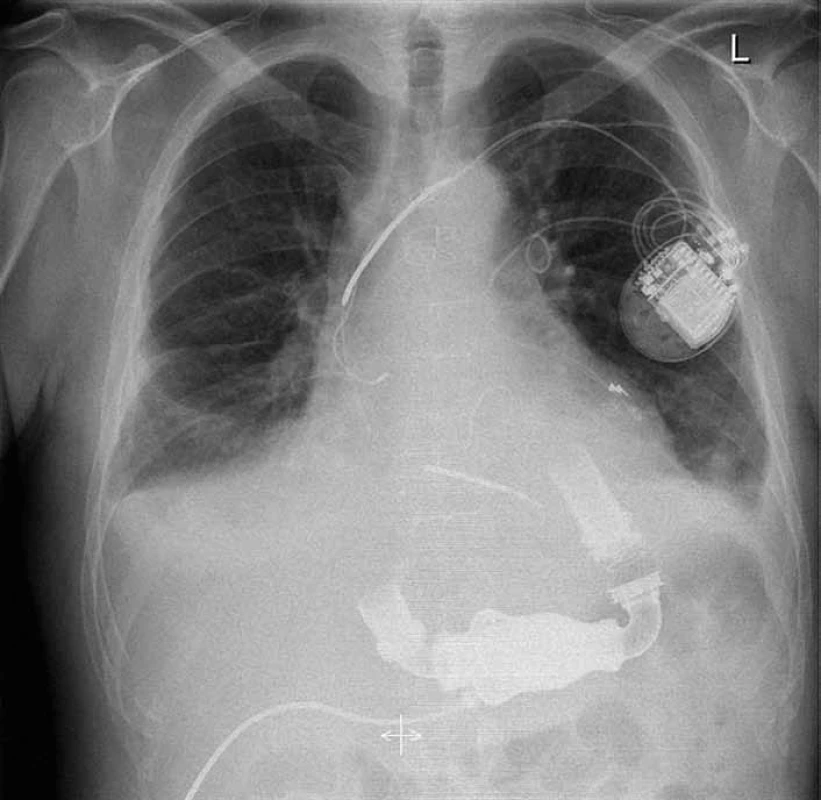
Časná pooperační intenzivní péče probíhala na resuscitačním oddělení; následně byli pacienti překládáni na kardiochirurgickou jednotku intenzivní péče. Po stabilizaci celkového stavu a po dosažení adekvátní antikoagulace (warfarinizace s cílovým INR 2,0–2,5) byli pacienti propuštěni do domácího ošetřování s pravidelnými ambulantními kontrolami.
Statistické zpracování
Údaje jsou udávány jako počet (N) s relativní četností (%), jako průměr ± SD nebo jako interval mezi minimální a maximální hodnotou. Výsledky byly hodnoceny základními metodami deskriptivní statistiky s pomocí programu Microsoft® Office Excel® 2007 SP2 (Microsoft® Corp., Redmond, WA, USA).
Výsledky
Předoperační charakteristika souboru nemocných
Základní demografické údaje pacientů jsou shrnuty v tab. 1. V souboru nemocných převažovali muži s výchozí diagnózou dilatační kardiomyopatie. V převážné většině případů byla indikace k implantaci LVAD bridge‑to‑transplantation, jednou se jednalo o indikaci bridge‑to‑candidacy (pacient s vysokou plicní hypertenzí kontraindikující zařazení na čekací listinu pro OTS) a v jednom případě o indikaci k permanentní léčbě (pacient ze zahraničí).
Nejdůležitější parametry týkající se předoperačního stavu a orgánové dysfunkce, které nepřímo ukazují na aktuální stupeň srdečního selhání, shrnuje tab. 2. Při echokardiografickém vyšetření byla systolická funkce levé komory u všech pacientů velmi výrazně snížena s hodnotami ejekční frakce (EF) okolo 20%. Systolická funkce pravé komory nebyla u většiny pacientů kvantifikována hodnotou EF, nicméně u všech pacientů byla systolická funkce hodnocena jako minimálně středně snížená. S výjimkou 2 případů byli pacienti dependentní na farmakologické podpoře oběhu, přičemž 38,1% pacientů bylo léčeno levosimendanem v posledních 5 dnech před implantací; 19% nemocných bylo dokonce v době implantace na krátkodobé levostranné mechanické srdeční podpoře (intraaortální balonková kontrapulzace nebo CentriMag® LVAD). Tři pacienti (14,3%) byli již před implantací na umělé plicní ventilaci. Většina pacientů (71,4%) vyžadovala kontinuální intravenózní aplikaci furosemidu k podpoře diurézy.
Podpora funkce pravé komory po implantaci HeartMate II® LVAD
Odpojování od MO probíhalo při umělé plicní ventilaci s inspirační frakcí kyslíku 1,0, se standardní inotropní podporou dobutaminem (5 až10 μg/kg/min) a milrinonem (nasycovací dávka 25–50 µg/kg následovaná kontinuální infuzí 0,2–0,5 µg/kg/min), s vazopresorickou podporou noradrenalinem (cílový střední arteriální tlak – MAP 70mmHg) a za kontinuální monitorace funkce pravé komory pomocí TEE a PAC (tab. 3). Za akceptovatelné hodnoty parametrů získaných pomocí PAC jsme považovali srdeční výdej > 2,5–2,8l/min/m2 (termodiluční měření) a CVP < 15mmHg; tlak v plicnici jsme porovnávali s výchozími hodnotami. Z parametrů získaných TEE byla důležitá systolická funkce pravé komory (hodnoceno orientačně bez kvantifikace EF nebo jiných numerických parametrů) a velikost pravé komory (tzn. nepřítomnost její dilatace oproti stavu před MO).
V případě, že systolická funkce pravé komory nebyla při farmakologické podpoře dobutaminem a milrinonem dostatečná, byl přidán levosimendan (nasycovací dávka 6–12 µg/kg následovaná kontinuální infuzí 0,1 µg/kg/min), což bylo nezbytné u 5 (23,8%) pacientů. U 2 z těchto pacientů bylo v prvních 5 dnech od implantace nutné zopakovat aplikaci levosimendanu na resuscitačním oddělení. U dalších 2 pacientů, kteří na operačním sále nevyžadovali podání levosimendanu, byla jeho aplikace nutná až v časném pooperačním průběhu na resuscitačním oddělení. V případě významné plicní hypertenze (standardně při vstupní plicní vaskulární rezistenci > 3 Woodovy jednotky), v případě vzestupu tlaků v plicnici oproti výchozím hodnotám a při významnějším stupni dysfunkce pravé komory bylo již na operačním sále zahájeno podávání inhalačního NO v dávce 20–40 ppm; v našem souboru to bylo u 66,7% pacientů.
U 2 (9,5%) pacientů došlo na operačním sále i přes maximální farmakologickou podporu k selhání pravé komory, které vyžadovalo zavedení krátkodobé parakorporální nepulzatilní mechanické srdeční podpory pro pravou komoru – CentriMag® RVAD (right ventricular assist device), a to kanylací do pravé síně (vtoková kanyla) a plicnice (výtoková protéza). U dalšího (4,8%) pacienta progredovala po odjezdu z operačního sálu dysfunkce pravé komory tak, že po 12 hod bylo indikováno zavedení CentriMag® RVAD. U obou pacientů se zavedenou pravostrannou MCS ihned po implantaci HeartMate II® bylo možné její úspěšné odpojení; v jednom případě po 24 hod a v druhém případě po 11 dnech. Pacient s odloženě zavedenou pravostrannou MCS zemřel během několika hodin při nezvládnutelném multiorgánovém selhání.
V dalším pooperačním průběhu na resuscitačním oddělení byla zpočátku léčba vedena podle údajů z PAC (tlaky v plicnici, centrální žilní tlak, srdeční výdej) a podle TEE vyšetření (systolická funkce pravé komory, stupeň trikuspidální regurgitace, poloha IVS, náplň levé komory). Terapeutický přístup ovlivňující hemodynamické parametry zahrnoval pomalé snižování dávky inhalačního NO a inotropik, jejichž podávání (milrinon) bylo v některých případech prolongované. U většiny pacientů byla léčba plicní hypertenze po extubaci vedena perorálně podávaným sildenafilem (Revatio; Pfizer Ltd., UK) v dávce 40mg po 8 hod, u některých pacientů v kombinaci s inhalačně podávaným iloprostem (Ventavis; Schering AG, DE) v dávce 5 µg po 3–4 hod. Echokardiografické vyšetření bylo po extubaci prováděno transtorakálně (TTE).
Celkové klinické výsledky
Klinické výsledky programu implantace dlouhodobé MCS HeartMate II® LVAD shrnuje tab. 4. Devět (42,8%) pacientů bylo úspěšně přemostěno k OTS po průměrné době mechanické podpory 173 dnů. U jednoho (4,8%) pacienta s výchozí diagnózou dekompenzovaného oboustranného srdečního selhání na podkladě těžké kombinované aortální vady s významnou dysfunkcí obou komor a trombem v hrotu levé komory, kdy s implantací HeartMate II® LVAD byla zároveň nahrazena aortální chlopeň bioprotézou a provedena plastika trikuspidální chlopně, bylo dosaženo zotavení funkce levé komory a MCS byla po 117 dnech explantována. U tohoto pacienta došlo v průběhu mechanické podpory ke změně výchozí indikace z bridge‑to‑transplantation na bridge‑to‑recovery. Pět (23,8%) pacientů zemřelo po průměrné době mechanické podpory 24 dnů; většinou pod obrazem multiorgánového selhání. Šest (28,6%) pacientů žije při průměrné době mechanické podpory 286 dnů (k 30. 6. 2009).
Diskuze
Pacienti s implantovanou dlouhodobou levostrannou MCS (LVAD) představují velkou výzvu jak pro anesteziologickou péči na operačním sále, tak pro časnou pooperační intenzivní péči, a to především z pohledu zajištění adekvátní funkce nativní pravé komory. Pravá komora má řadu anatomických a fyziologických odlišností od levé komory [10], které jsou příčinou komplikované situace při jejím selhávání [11] a mají přímý dopad na terapeutický přístup k těmto pacientům [12]. U pacientů s implantovaným LVAD je funkce levé komory nahrazena mechanickým zařízením, tzn. že při plné podpoře již není srdeční výdej levé komory závislý na funkci nativní levé komory, ale pouze na množství krve vypuzené pravou komorou. Funkce pravé komory je většinou snížena při základním srdečním onemocnění (dilatační kardiomyopatie, ischemická choroba srdeční), následně negativně ovlivněna kardiochirurgickým výkonem během implantace LVAD (použití MO, přesuny tekutin, substituce transfuzními přípravky, systémová zánětlivá odpověď) a po něm řadou dalších patofyziologických změn (viz níže). Důležitý vliv má také plicní řečiště jako hlavní determinanta afterloadu pravé komory.
Implantace LVAD vede k mnoha zásadním hemodynamickým změnám, které mají jak pozitivní, tak i negativní dopad na funkci pravé komory [13]. Důležitou roli hraje mechanická interakce mezi oběma komorami daná kontinuálním propojením svalových vláken mezi pravou a levou komorou a IVS [14]. Preload (předtížení) pravé komory se zvyšuje, protože mechanická podpora na levé straně (LVAD) zajistí přečerpání veškeré krve, která se dostane do levé komory, a tím přeneseně zvyšuje žilní návrat k pravé komoře [15]. Afterload (dotížení) pravé komory se snižuje vzhledem k minimalizaci postkapilární složky plicní hypertenze plně funkčním LVAD (v některých případech – po podání masivního množství transfuzních přípravků s následnou arteriolární vazokonstrikcí – se ovšem může zvýšit prekapilární složka plicní hypertenze). Funkce pravé komory je pozitivně ovlivněna zvýšením perfuzního tlaku po normalizaci srdečního výdeje na levé straně; negativně je ovlivněna posunem IVS doleva při objemové dekompresi (unloading) levé komory, který vede ke změně geometrie pravé komory s výslednou dilatací a poklesem systolické funkce [16,17], event. v některých případech zvětšením trikuspidální regurgitace při distrakci subvalvulárního aparátu trikuspidální chlopně.
Prvním a nejdůležitějším opatřením je prevence pravostranného selhání a tou je správná a včasná indikace pacientů k implantaci LVAD [18]. Rozhodnutí o tom, zda implantovat pouze LVAD nebo je‑li již nutná biventrikulární mechanická srdeční podpora (BiVAD), je relativně komplikované. Nejdůležitějšími kritérii jsou předoperační funkce pravé komory, stupeň prekapilární plicní hypertenze a celkový klinický stav pacienta. Implantace BiVAD je preferována u pacientů, u kterých je následkem nízkého srdečního výdeje přítomna významnější multiorgánová dysfunkce po delší dobu (v řádu dnů), kdy BiVAD zajistí adekvátní srdeční výdej bez rizika plynoucího z dysfunkce pravé komory, kterou lze v terénu déle trvajícího těžkého multiorgánového selhání očekávat. Na druhou stranu bylo opakovaně prokázáno, že opožděné zavedení RVAD po implantaci LVAD přináší výrazně horší výsledky ve smyslu vyšší mortality v porovnání s plánovaným zavedením BiVAD, je‑li toto indikováno již předoperačně [19]. Proto proběhla řada studií – typicky retrospektivně s pacienty z jednoho centra – s cílem identifikovat výchozí parametry, které by predikovaly selhání pravé komory po implantaci LVAD [20]. V publikovaných studiích bylo nalezeno více než 25 faktorů, např. nízká hodnota RVSWI (right ventricular stroke work index), předoperační umělá plicní ventilace, ženské pohlaví, zvýšená koncentrace kreatininu nebo malý tělesný povrch. V jedné z recentních studií [21] vytvořili autoři na základě retrospektivní analýzy 197 implantací LVAD rizikové skóre pro predikci pravostranného selhání, které zahrnuje 4 předoperační faktory: farmakologickou podporu vazopresorem, koncentraci bilirubinu > 34,2 µmol/l, AST > 1,3 µkat/l a kreatininu > 203,3 µmol/l (nebo přístrojová náhrada funkce ledvin). Přes výše uvedené skutečnosti je indikace k implantaci LVAD vs BiVAD na většině pracovišť (včetně našeho) dána zkušeností konkrétního centra [22] a komplexním zhodnocením stavu pacienta [18]: anamnézy (základní kardiální onemocnění, jeho délka a dosavadní průběh; přítomnost závažných komorbidit), aktuálního stavu (první vs opakovaná významná dekompenzace srdečního selhání; nutná dávka inotropik k udržení adekvátního srdečního výdeje; přítomnost mechanické podpory – většinou intraaortální balónkové kontrapulzace; stupeň orgánové dysfunkce – ledviny, játra, koagulační systém, centrální nervový systém, malnutrice) a hemodynamických parametrů (aktuální hodnoty a jejich vývoj v čase) získaných při pravostranné katetrizaci a vyšetření TEE.
Terapeutický přístup k akutní dysfunkci pravé komory po implantaci LVAD je založen na optimalizaci preloadu, afterloadu a kontraktility pravé komory za kontinuální monitorace pomocí TEE a PAC. TEE vyšetření má během implantace i časně po ní nezastupitelnou úlohu [23], a to především při hodnocení funkce pravé komory (manipulace s farmakologickou podporou), polohy IVS (příliš vysoká nastavená hodnota otáček LVAD může zpočátku vést k negativnímu posunu IVS doleva) a polohy vtokové kanyly v hrotu levé komory (ideální poloha je v ose levé komory směrem k mitrální chlopni; poloha směrem k IVS nebo laterální stěně komory může být příčinou neúplného vyprázdnění levé komory a stagnace krve s rizikem rozvoje tromboembolických komplikací). Existují různé strategie farmakologické podpory funkce pravé komory [24], nicméně společným prvkem je důraz na použití inhibitorů fosfodiesterázy III (milrinon, amrinon) a selektivní ovlivnění zvýšené plicní cévní rezistence (afterloadu pravé komory) inhalačním NO a prostacykliny [25] nebo perorálně podávaným sildenafilem. V našem souboru pacientů jsme získali velmi dobrou zkušenost s podáním levosimendanu, který může výrazným způsobem zlepšit systolickou i diastolickou funkci pravé komory a zároveň snížit tlak v plicnici [26–28].
V případě, že ani maximální farmakologická podpora nezajistí adekvátní srdeční výdej pravou komorou (a přeneseně výdej LVAD), je nezbytné neprodleně zavést pravostrannou mechanickou srdeční podporu (RVAD); opožděné zavedení RVAD, při kterém se již začíná prohlubovat multiorgánová dysfunkce z důvodu nízké systémové dodávky kyslíku při nízkém srdečním výdeji (LVAD), zhoršuje výrazně klinické výsledky [29]. V našem centru využíváme v této situaci krátkodobou parakorporální podporu CentriMag® RVAD, která je zaváděna mezi pravou síň a plicnici. Na ovládací konzoli je možné nastavením počtu otáček regulovat množství krve, které RVAD přečerpává, a tím objemovou zátěž nativní pravé komory, což využíváme při následném odpojování RVAD při postupně se zotavující funkci pravé komory.
Naše práce má některá omezení. V této studii jsme se nezaměřovali na detailní hodnocení katetrizačních a echokardiografických parametrů charakterizujících stupeň srdečního selhání, plicní hypertenzi a dysfunkci obou komor před implantací LVAD. Při hodnocení celkových klinických výsledků (např. doba mechanické podpory před OTS) jsme je nesrovnávali s výsledky v jiných zemích Evropské unie nebo Spojených státech amerických z důvodu existujících velkých rozdílů, které jsou způsobeny jinými než medicínskými vlivy (např. tím, zda jsou pacienti s mechanickou srdeční podporou vedeni na čekací listině pro OTS v urgentním nebo standardním pořadí, dále průměrnou dobou strávenou na čekací listině před OTS, kdy vliv může mít např. členství země v transplantační síti Eurotransplant [30]; počet pacientů implantovaných v indikaci permanentní léčby byl v našem souboru minimální). Vzhledem k významným rozdílům mezi jednotlivými skórovacími systémy pro predikci pravostranného selhání po implantaci LVAD [20,21] jsme neprováděli retrospektivní porovnání s hodnotami předoperačních parametrů u pacientů v našem souboru.
Závěr
Dysfunkce pravé komory zůstává očekávaným a v některých případech závažným problémem po implantaci levostranné MCS [31]. Nejdůležitějším opatřením je prevence rozvoje pravostranného selhání správnou a především včasnou indikací pacientů k implantaci LVAD; při výchozí těžké dysfunkci pravé komory s vysokou hodnotou prekapilární plicní hypertenze nebo u pacientů v těžkém stavu (trvající multiorgánové selhání) je vhodné zvážit implantaci BiVAD.
V časném období po zavedení LVAD je nezbytná inotropní podpora pravé komory; v případě významné dysfunkce pravé komory lze s výhodou aplikovat levosimendan. Dalším terapeutickým opatřením je ovlivnění zvýšené plicní cévní rezistence – ať už inhalačním NO nebo jinými farmaky.
Z našich zkušeností v souladu s publikovanými výsledky [19,29] vyplývá, že v případě těžkého selhání pravé komory nereagujícího na maximální farmakologickou léčbu je indikováno zavedení RVAD ještě na operačním sále v závěru implantace LVAD; časová prodleva do implantace RVAD s rozvojem syndromu nízkého srdečního výdeje zvyšuje mortalitu v této skupině pacientů.
Doručeno do redakce: 13. 8. 2009
Přijato po recenzi: 21. 10. 2009
MUDr. Hynek Říha, DEAA, FCCP
www.ikem.cz
e‑mail: hynek.riha@ikem.cz
Zdroje
1. Augoustides JG, Říha H. Recent progress in heart failure treatment and heart transplantation. J Cardiothorac Vasc Anesth 2009; 23 : 738–748.
2. Netuka I, Malý J, Szarszoi O. Mechanické srdeční podpory v terapii terminálního srdečního selhání. Cor Vasa 2008; 50 : 207–214.
3. Rose EA, Gelijns AC, Moskowitz AJ et al. Long‑term mechanical left ventricular assistance for end‑stage heart failure. N Engl J Med 2001; 345 : 1435–1443.
4. Březina A, Říha H, Mašín J. Současné možnosti mechanické podpory cirkulace. Anest Intenziv Med 2006; 17 : 38–44.
5. Kettner J, Netuka I, Pirk J et al. První použití mechanické srdeční podpory v České republice. Interv Akut Kardiol 2004; 3 : 86–88.
6. Kettner J, Pirk J, Netuka I et al. Použití mechanické srdeční podpory – první zkušenosti v České republice. Čas Lék Čes 2005; 144 : 38–42.
7. Struber M, Sander K, Lahpor J et al. HeartMate II left ventricular assist device; early European experience. Eur J Cardiothorac Surg 2008; 34 : 289–294.
8. Dang NC, Topkara VK, Mercando M et al. Right heart failure after left ventricular assist device implantation in patients with chronic congestive heart failure. J Heart Lung Transplant 2006; 25 : 1–6.
9. Netuka I, Malý J, Szarszoi O et al. Single‑stage extensive chronic type A dissecting aortic aneurysm repair and continuous‑flow ventricular assist device implantation. J Heart Lung Transplant 2009; 28 : 523–526.
10. Haddad F, Couture P, Tousignant C et al. The right ventricle in cardiac surgery, a perioperative perspective: I. Anatomy, physiology, and assessment. Anesth Analg 2009; 108 : 407–421.
11. Greyson CR. Pathophysiology of right ventricular failure. Crit Care Med 2008; 36: S57–S65.
12. Haddad F, Couture P, Tousignant C et al. The right ventricle in cardiac surgery, a perioperative perspective: II. Pathophysiology, clinical importance, and management. Anesth Analg 2009; 108 : 422–433.
13. Stone ME. Current status of mechanical circulatory assistance. Semin Cardiothorac Vasc Anesth 2007; 11 : 185–204.
14. Santamore WP, Gray LA Jr. Left ventricular contributions to right ventricular systolic function during LVAD support. Ann Thorac Surg 1996; 61 : 350–356.
15. Omoto T, Tanabe H, LaRia PJ et al. Right ventricular performance during left ventricular unloading conditions: the contribution of the right ventricular free wall. Thorac Cardiovasc Surg 2002; 50 : 16–20.
16. Klima UP, Lee MY, Guerrero JL et al. Determinants of maximal right ventricular function: role of septal shift. J Thorac Cardiovasc Surg 2002; 123 : 72–80.
17. Saleh S, Liakopoulos OJ, Buckberg GD. The septal motor of biventricular function. Eur J Cardiothorac Surg 2006; 29 (Suppl 1): S126–S138.
18. Aaronson KD, Patel H, Pagani FD. Patient selection for left ventricular assist device therapy. Ann Thorac Surg 2003; 75: S29–S35.
19. Fitzpatrick JR 3rd, Frederick JR, Hiesinger W et al. Early planned institution of biventricular mechanical circulatory support results in improved outcomes compared with delayed conversion of a left ventricular assist device to a biventricular assist device. J Thorac Cardiovasc Surg 2009; 137 : 971–977.
20. Ochiai Y, McCarthy PM, Smedira NG et al. Predictors of severe right ventricular failure after implantable left ventricular assist device insertion: analysis of 245 patients. Circulation 2002; 106: I198–I202.
21. Matthews JC, Koelling TM, Pagani FD et al. The right ventricular failure risk score a pre‑operative tool for assessing the risk of right ventricular failure in left ventricular assist device candidates. J Am Coll Cardiol 2008; 51 : 2163–2172.
22. Weitkemper HH, El‑Banayosy A, Arusoglu L et al. Mechanical circulatory support: reality and dreams experience of a single center. J Extra Corpor Technol 2004; 36 : 169–173.
23. Chumnanvej S, Wood MJ, MacGillivray TE et al. Perioperative echocardiographic examination for ventricular assist device implantation. Anesth Analg 2007; 105 : 583–601.
24. Špinar J, Vítovec J. Intravenózní léčba akutního srdečního selhání. Vnitř Lék 2007; 53 : 412–419.
25. Nussmeier NA, Probert CB, Hirsch D et al. Anesthetic management for implantation of the Jarvik 2000 left ventricular assist system. Anesth Analg 2003; 97 : 964–971.
26. Missant C, Rex S, Segers P et al. Levosimendan improves right ventriculovascular coupling in a porcine model of right ventricular dysfunction. Crit Care Med 2007; 35 : 707–715.
27. Kasikcioglu HA, Uyarel H, Tartan Z et al. Do calcium sensitizers affect right ventricular functions in patients with chronic heart failure? Int J Cardiol 2007; 118 : 246–248.
28. Kerbaul F, Gariboldi V, Giorgi R et al. Effects of levosimendan on acute pulmonary embolism‑induced right ventricular failure. Crit Care Med 2007; 35 : 1948–1954.
29. Kavarana MN, Pessin‑Minsley MS, Urtecho J et al. Right ventricular dysfunction and organ failure in left ventricular assist device recipients: a continuing problem. Ann Thorac Surg 2002; 73 : 745–750.
30. Komoda T, Hetzer R, Lehmkuhl HB. Destiny of candidates for heart transplantation in the Eurotransplant heart allocation system. Eur J Cardiothorac Surg 2008; 34 : 301–306.
31. Patel ND, Weiss ES, Schaffer J et al. Right heart dysfunction after left ventricular assist device implantation: a comparison of the pulsatile HeartMate I and axial‑flow HeartMate II devices. Ann Thorac Surg 2008; 86 : 832–840.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Nádorová onemocnění a žilní tromboembolie – editorial
- Vliv 6měsíčního podávání exenatidu na kompenzaci diabetes mellitus 2. typu, antropometrické a biochemické parametry
- Pilotní registr akutního infarktu myokardu – hodnocení kvality péče v non‑PCI nemocnicích v průběhu 5 let
- Dysfunkce pravé komory po implantaci levostranné mechanické srdeční podpory
- Nemocní starší 80 let s de novo akutními myeloidními leukemiemi bez dysplazie v erytroblastické a/nebo megakaryocytární řadě dosahují kompletní remise a delšího přežití po klasické chemoterapii 3+7
- Prekancerózní stavy v gastroenterologii a jejich molekulární genetika z pohledu klinické praxe
- Paraneoplastický tromboembolický syndróm ako prvý príznak zhubného ochorenia
- Pravostranné selhání po implantaci levostranné mechanické srdeční podpory – editorial
- Epidemiológia cievnych chorôb
- Intervenční zákroky u jedinců s myeloproliferativními chorobami – prevence a léčba poruch hemostázy
- Pacientka s AL‑amyloidózou a závažným deficitem faktoru X je po vysokodávkované chemoterapii již 7 let v kompletní hematologické remisi s normální aktivitou faktoru X. Popis případu a přehled literatury
- Tumor srdce u gravidní pacientky
- Paraneoplastický tromboembolický syndrom jako první příznak zhoubného onemocnění – editorial
- Profesor MUDr. Jozef Zimáček, CSc., zomrel*26. januára 1933 †19. mája 2009
- Prof. MUDr. Pavol Schweitzer, CSc., významný reprezentant internistickej školy prof. MUDr. Františka Póra – osemdesiatročný
- Recenze
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nemocní starší 80 let s de novo akutními myeloidními leukemiemi bez dysplazie v erytroblastické a/nebo megakaryocytární řadě dosahují kompletní remise a delšího přežití po klasické chemoterapii 3+7
- Paraneoplastický tromboembolický syndróm ako prvý príznak zhubného ochorenia
- Paraneoplastický tromboembolický syndrom jako první příznak zhoubného onemocnění – editorial
- Dysfunkce pravé komory po implantaci levostranné mechanické srdeční podpory
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání







