-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dnešný pohľad na riziká umelej pľúcnej ventilácie
Current view on the risks of artificial pulmonary ventilation
There is no doubt that artificial ventilation of lungs seems to be proven as life-saving manoeuvre, whereas a growing amount of evidence is presented and published recently that artificial ventilation cause damage to patient by so far unexplained mechanism – by conversion of mechanical stress to biochemical signals inducing local and systemic inflammatory response, which is wide spreading and causing multiple organ dysfunction syndrome (MODS). Higher mortality of patients with acute lung injury on MODS rather than acute respiratory failure itself can be explained just by these findings. The article is brief summary of recent opinions of mechanism of ventilator induced lung and systemic injury. There is also evidence that the process of implementation of these finding into clinical practice is exceedingly slow.
Keywords:
artificial lung ventilation – ventilator induced lung injury – multiorgan dysfunction syndrome (MODS)
Autoři: R. Kula 1; P. Sklienka 1; V. Chýlek 1; P. Szturz 1; J. Neiser 2
Působiště autorů: Anesteziologicko-resuscitační klinika FN Ostrava, přednosta prim. MUDr. Jan Jahoda 1; Oddělení pediatrické intenzívní a resuscitační péče FN Ostrava, přednosta doc. MUDr. Michal Hladík, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2007; 53(12): 1319-1324
Kategorie: Přehledný referát
Souhrn
Dnes niet pochybností o tom, že umelá pľúcna ventilácia (UPV] je život zachraňujúcim liečebným postupom. Na druhej strane v súčasnosti narastá počet dôkazov o tom, že UPV môže poškodiť pacienta doteraz nepoznaným spôsobom - konverziou mechanického signálu na signál biochemický, indukciou pľúcnej zápalovej odpovede s jej následnou systémovou propagáciou a vývojom multiorgánového zlyhávania (MODS]. Práve tieto poznatky umožňujú vysvetliť, prečo pacienti s akútnym pľúcnym poškodením zomierajú častejšie za príznakov MODS a nie na akútne respiračné zlyhanie. Článok je stručným prehľadom súčasných názorov na mechanizmy ventiláciou indukovaného pľúcneho a systémového poškodenia. Súčasne sa konštatuje, že proces zavádzania nových poznatkov do klinickej praxe je príliš pomalý.
Kľúčové slová:
umelá pľúcna ventilácia - ventiláciou indukované pľúcne poškodenie - multiorgánové zlyhanieÚvod
V priebehu posledného desaťročia sa významne rozšíril rozsah poznania v oblasti patofyziológie a patobiochémie nežiadúcich účinkov umelej pľúcnej ventilácie (ďalej UPV). Dnes je zrejmé, že tieto nemusia spočívať len v interferencii s činnosťou kardiovaskulárneho aparátu (napr. pokles krvného tlaku), či v anatomickom pľúcnom poškodení (napr. pneumotorax), ktoré majú obvykle zreteľné klinické prejavy a jednoduché liečebné riešenie. Omnoho záludnejším je riziko transformácie cyklicky sa opakujúceho mechanického pľúcneho stresu na signál biochemický (tzv. biotrauma). Výsledky klinických a experimentálnych štúdií skutočne ukázali, že UPV je schopná vyvolať v pľúcach zápalovú odpoveď, ktorej intenzita závisí od použitej ventilačnej stratégie. Výskum naviac ukázal, že táto odpoveď nemusí byť obmedzená len na pľúcny kompartment, ale môže súčasne dôjsť k jej systémovej propagácii. Podľa dnešných predstáv zohráva tento mechanizmus najvýznamnejšiu úlohu pri vývoji syndrómu multiorgánového zlyhávania (MODS - multiple organ dysfunction syndrome) u pacientov s akútnym pľúcnym poškodením [3]. Tiež umožňuje vysvetliť, prečo väčšina pacientov s ALI/ARDS (ALI - acute lung injury, ARDS - acute respiratory distress syndrome) zomiera práve za príznakov MODS a nie v súvislosti s akútnou poruchou výmeny krvných plynov, ktorá v počiatočnom štádiu ochorenia vždy dominuje [7].
Koncepcia mechanického pľúcneho stresu
Pred viac ako 40 rokmi bolo ukázané, že grafický priebeh inflácie a deflácie vypreparovaných pľúc pokusného zvieraťa má charakter hysteréznej krivky, znázornenej na obr. 1 - 3 [30]. Prvá fáza inflácie (obr. 1) je charakteristická malým prírastkom pľúcneho objemu napriek vysokému inflačnému tlaku a to až po dosiahnutie tzv. dolného inflekčného bodu (bod A). Je to spôsobené otváraním kolabovaných alveolov a je spojené so značným napínacím stresom pľúcneho parenchýmu. Mead et al zistili, že veľkosť tohoto napínania na rozhraní zdravého a poškodeného pľúcneho tkaniva (napr. ložisko atelektázy) môže dosiahnuť až 150 cm H2O [20]. V priebehu druhej fázy inflácie (obr. 2) je prírastok objemu úmerný prírastku inflačného tlaku, pľúca sú postupne úplne otvorené, dobre poddajné a mechanický stres je minimálny. Táto fáza končí horným inflekčným bodom (bod B). V ďalšom priebehu inflácie sa prírastok objemu opäť znižuje v porovnaní s prírastkom tlaku, pľúca sa stávajú málo poddajnými a tento jav je spôsobený ich postupným objemovým preťažením (hyperinflácia). Podobne ako v priebehu prvej fázy inflácie, je i táto spojená so značným napínacím stresom.
Obr. 1. Grafický priebeh prvej fázy inflácie pľúc. Prírastok objemu je malý napriek vysokému inflačnému tlaku. Bod A – dolný inflekčný bod. 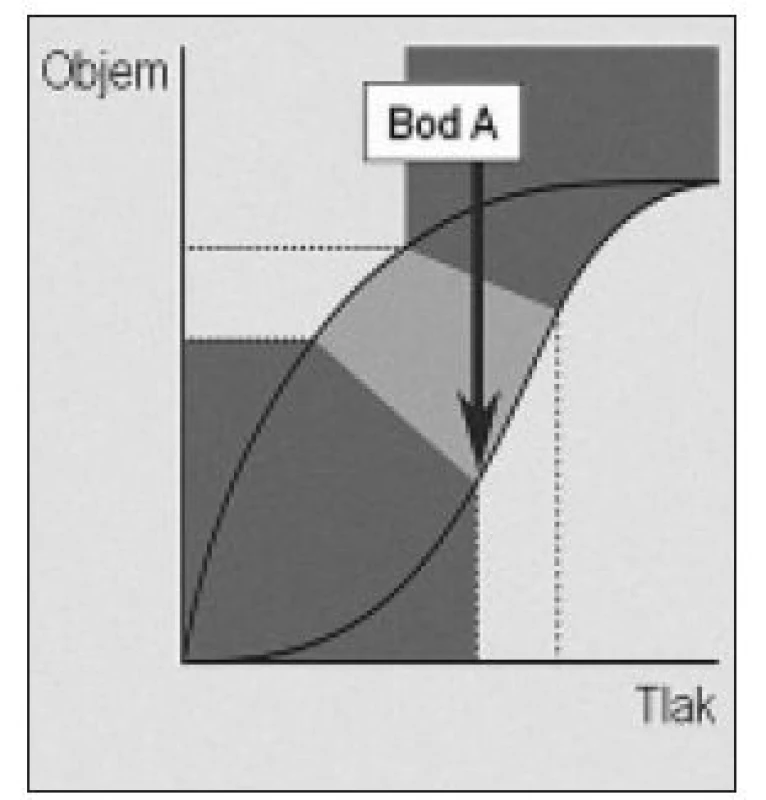
Obr. 2. Grafický priebeh druhej fázy inflácie pľúc. Prírastok objemu je úmerný prírastku inflačného tlaku. Bod B – horný inflekčný bod. 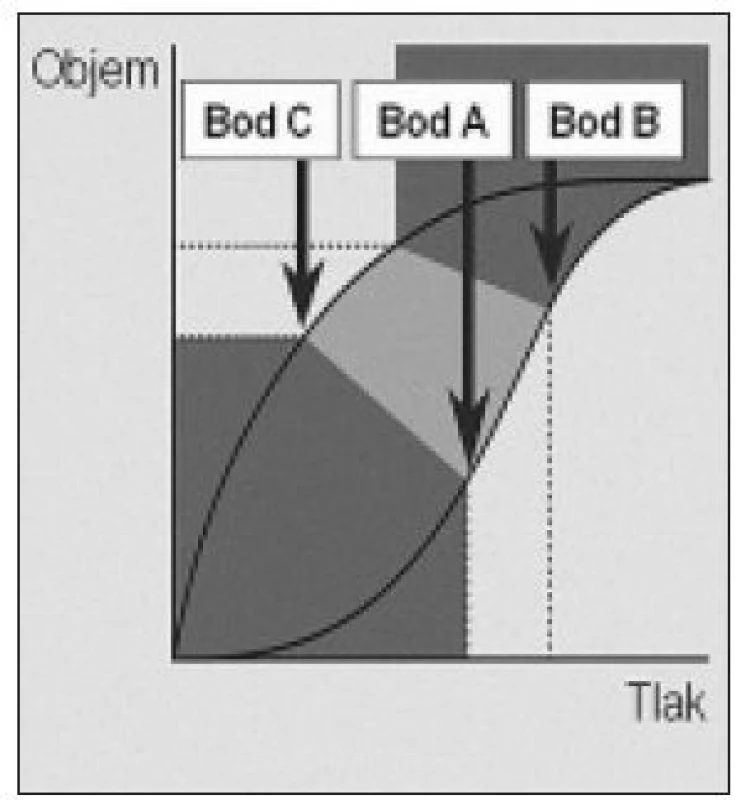
Priebeh procesu deflácie (obr. 3) má v grafickom vyjadrení krivky tlak/objem iný charakter. Krivka je posunutá doľava, má plynulejší priebeh a je zrejmé, že hodnota tlaku, pri ktorej začínajú alveoly opäť kolabovať (bod C) je nižšia než hodnota tlaku potrebného na otvorenie kolabovaných alveolov (bod A). Tento jav je odrazom fyzikálnych princípov zhrnutých v známom Laplaceho zákone.
Obr. 3. Grafický priebeh deflácie pľúc. Krivka deflácie je posunutá doľava. Hodnota tlaku, pri ktorej začínajú alveoly opäť kolabovať (bod C) je nižšia než hodnota tlaku potrebného na otvorenie kolabovaných alveolov (bod A). 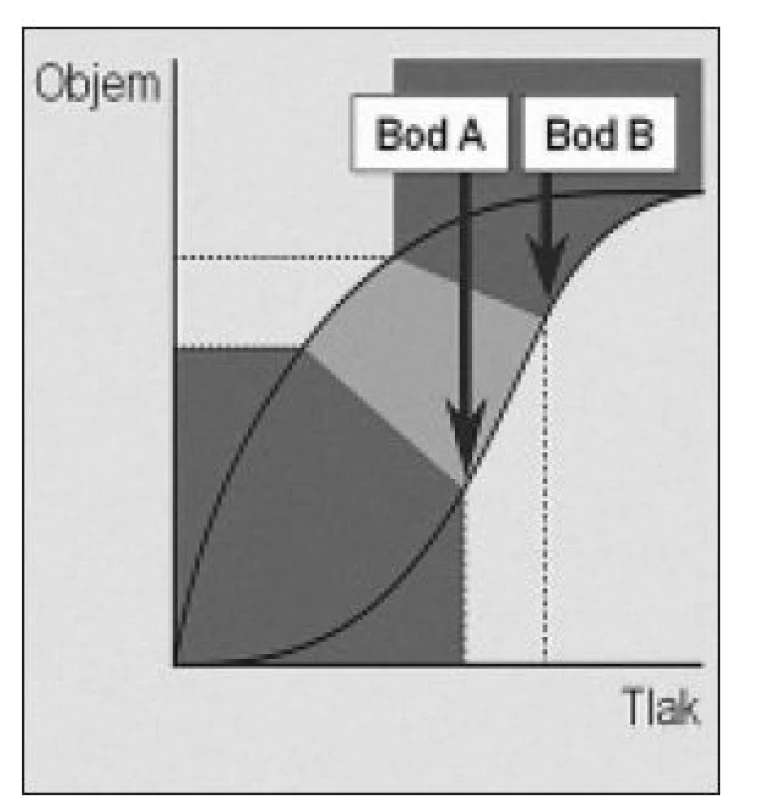
Aký je praktický odkaz vyššie uvedeného experimentu? CT obraz pľúcneho poškodenia u pacientov s ALI/ARDS (obr. 4) vykazuje, okrem tzv. „D - disease“ zóny (poškodená zóna, ktorá je zatvorená v priebehu celého dychového cyklu a teda úplne vyradená z možnosti podieľať sa na výmene krvných plynov) tiež zónu „R - recruitable“ (rozhranie medzi poškodeným a zdravým pľúcnym tkanivom) a zónu „H - healthy“ (zdravá zóna) [10]. Obe posledne menované predisponujú k mechanickému pľúcnemu stresu. Alveoly v zóne „R“ na konci exspíria kolabujú a na začiatku inspíria sú „násilne“ otvárané. Alveoly v zóne „H“ sú sice otvorené v priebehu celého pľúcneho cyklu, avšak ich objem je zásadne redukovaný v porovnaní s celkovým objemom zdravých pľúc. Tým sa vytvára priestor pre jej traumatizáciu stresom z hyperinflácie, ak sa u pacienta s ALI/ARDS použije neoptimálne veľký dychový objem. Je nutné podotknúť, že i normálny dychový objem môže byť v tejto situácii neoptimálny. Vyplýva to zo zistenia, že vzdušnosť pľúc u dospelého pacienta s ťažkou formou ARDS sa rovná približne vzdušnosti pľúc u 5ročného dieťaťa. Použitie „dospelého“ dychového objemu bude teda v tejto situácii spojené s významným rizikom mechanicky stresujúcej hyperinflácie. Uvedený fakt je podstatou „baby lung“ ventilačnej stratégie a s ňou úzko súvisí praktické rešpektovanie hyperkapnie pri ventilačnej podpore pacientov s ALI/ARDS (tzv. permisívna hyperkapnia) [11].
Obr. 4. CT pľúc u pacienta s ARDS. Zóna H (healthy) je otvorená v priebehu celého dychového cyklu. Zóna R (recruitable) je otvorená na konci inspíria a na konci expíria kolabuje. Zóna D (disease) je zatvorená v priebehu celého dychového cyklu a nepodieľa sa na výmene krvných plynov. 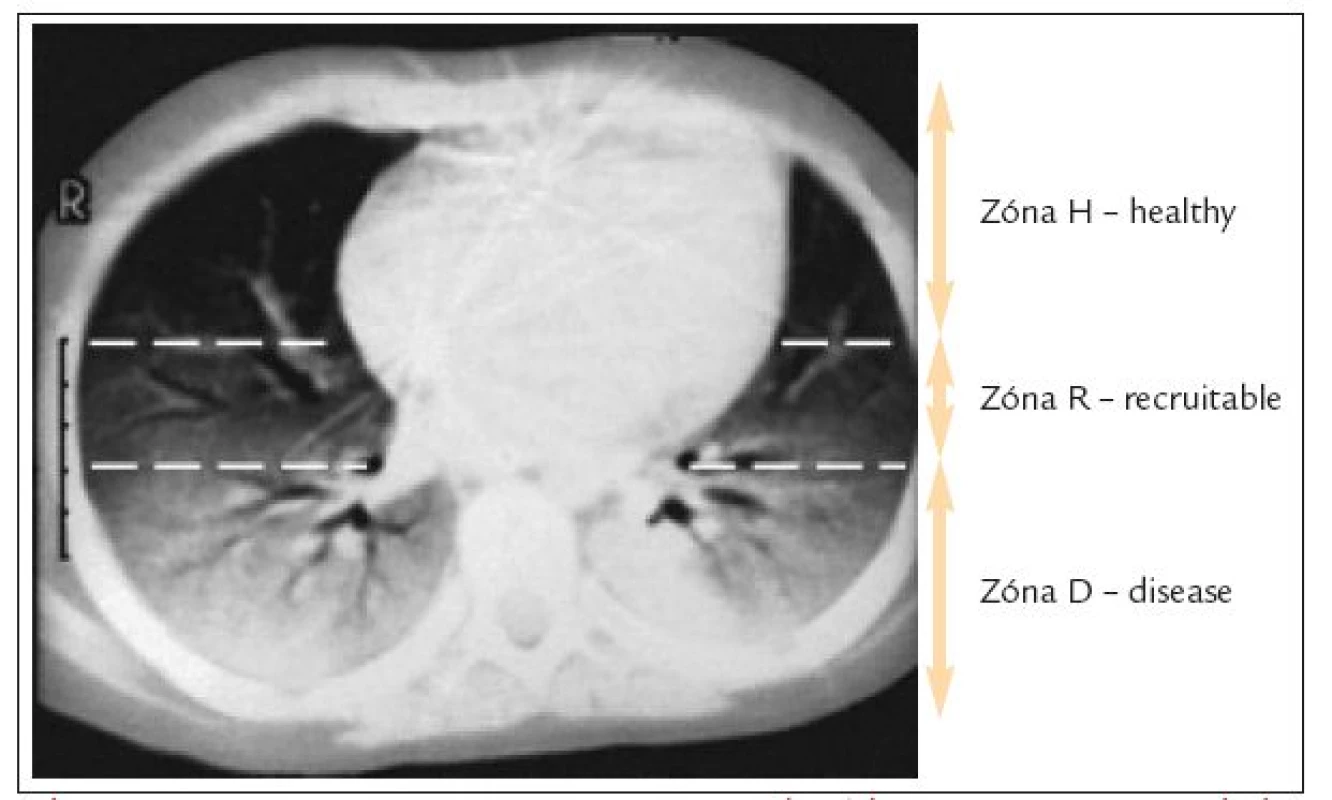
Cyklický end-expiračný kolaps a inspiračné otváranie alveolov v „R“ zóne, ako aj cyklická hyperinflácia „H“ zóny sú dnes považované za základné mechanizmy ventiláciou indukovaného mechanického pľúcneho stresu [8]. Naviac sú zrejme zodpovedné za horší klinický vývoj u pacientov s ALI/ARDS. Dokladuje to niekoľko randomizovaných štúdií, ktoré použitím stratégií „open lung and keep lung open“ (tj. otvor zónu „R“ a udrž ju otvorenú) a „baby lung“ (tj. pri voľbe veľkosti dychového objemu rešpektuj redukovanú vzdušnosť „H“ zóny) dokázali štatistický významne znížiť ich úmrtnosť[2,40].
Koncepcia mechanotransdukcie
Pod pojmom „mechanotransdukcia“ sa rozumie konverzia mechanického signálu na signál biochemický [5]. Pľúca majú k mechanotransdukcii veľmi blízko, čo zrejme vyplýva z poznania že rast pľúc u detí je determinovaný rastom hrudníka a nie naopak. Inými slovami, mechanický ťah rastúceho hrudníka je schopný vyvolať v pľúcnom parenchýme transkripciu genetického materiálu zodpovedného za následnú syntézu proteínov, potrebných pre rast pľúc. Podobne sú dnes dobre dokladované membránové zmeny v pľúcnych bunkách (tak štrukturálnych, ako aj bunkách patriacich k imunitnému systému) po aplikácii mechanického stresu. Okrem obyčajného porušenia integrity bunkovej membrány bolo popísané napr. otvorenie tzv. „stretch-sensitive chanels“ (na napätie citlivé kanály), či zmeny konformácie „membrane-associated molecules“ (s bunkovou membránou spojené molekuly) s následnou aktiváciou vnútrobunkových procesov, vedúcich k syntéze proinflamatórnych cytokínov [7]. Tieto mechanizmy tak spájajú mechanický stres so stresom biochemickým (vyvolaný lokálným či systémovým pôsobením proinflamatórnych cytokínov), a sú podstatou posunu dnešného vnímania traumatizujúcich účinkov UPV vyjadreného vetou: „from barotrauma to biotrauma“ [36].
Lokálne a systémové dôsledky traumatizujúcej UPV
Indukcia zápalovej odpovede a systémová translokácia proinflamatórnych cytokínov
Experimentálne a klinické štúdie ukázali, že mechanický stres vyvolaný traumatizujúcim spôsobom UPV či priamo aplikovaný na izolované pľúcne bunkové štruktúry vedie k zápalovej odpovedi. V elegantnej experimentálnej štúdii zistili Pugin et al, že už 7% elongácia polomeru pľúcnych makrofágov vedie k produkcii proinflamatórnych cytokínov. Súčasne bola zistená aktivácia nukleárneho faktoru-κB, synergický efekt mechanického stresu a endotoxinu na produkciu proinflamatorných cytokínov a inhibícia produkcie cytokínov dexamethasonom [29]. Podobne pľúcnym makrofágom reagujú na mechanický stres aj epiteliálne a endoteliálne pľúcne bunky [24,37]. Tremblay et al ukázali, že traumatizujúci spôsob UPV (veľký dychový objem - Vt a súčasne nulový tlak na konci výdychu - PEEP = 0 cm H2O) aplikovaný na vypreparované pľúca experimentálneho zvieraťa vedie už pod dvoch hodinách ventilácie k nárastu lokálnej produkcie tumor necrosis factor α (ďalej TNFα) so vzostupom jeho koncentrácie v bronchoalveolárnej laváži (ďalej BAL) [38]. Podobne Ranieri et al zistili, že použitie „tradičných“ ventilačných parametrov (Vt 11 ml/kg telesnej hmotnosti, PEEP 6,7 cm H2O) u pacientov s ARDS je spojené s významným nárastom pľúcnej a systémovej koncentrácie pro-inflamatórnych cytokínov (TNFα, interleukin-1β, interleukin-6, interleukin-8) v porovnaní s „protektívnym“ spôsobom ventilácie (Vt 7,6 ml/kg telesnej hmotnosti, PEEP 14,8 cm H2O) [31]. Konečne, Plötz et al zistili, že tradičný ventilačný režim (Vt 10 ml/kg, PEEP 4 cm H2O) už po dvoch hodinách aplikácie vedie k nárastu TNFα a IL-6 v bronchoalveolárnej laváži u detí bez predchádzajúceho pľúcneho poškodenia [27]. Tento nález tak definitívne potvrdil možnosť poškodenia i zdravých ľudských pľúc nesprávne nastaveným ventilačným režimom (tzv. VILI - ventilator-induced lung injury) s rizikom vyústenia do klinického obrazu nerozoznateľného od ARDS [25]. K podobnému záveru dospeli Gajic et al pri štúdii databázy ventilovaných pacientov bez známok akútneho pľúcneho poškodenia, kde okrem iného zistili, že použitie dychového objemu > 700 ml je spojené so signifikantným zvýšením výskytu následného vývoja ARDS [9]. Aj keď diskusia na tému optimálnej veľkosti dychového objemu u pacienta so zdravými pľúcami nie je dnes definitívne ukončená, určitá miera protekcie je plne oprávnená. Všeobecne sa má za to, že veľkosť Vt by nemala presiahnuť 10 ml/kg ideálnej telesnej hmotnosti [34].
Aké môžu byť dôsledky up-regulácie pľúcnej proinflamatórnej odpovede indukovanej traumatizujúcim spôsobom ventilácie? Po prvé, pľúcna plocha s veľkosťou približne tenisového kurtu je ventiláciou traumatizovaná viac ako 17tisíckrát za deň, z čoho plynie, že množstvo vytvorených pro-inflamatornych cytokínov môže byť enormné. Po druhé, relativný nedostatok pľúcnych cytokínových receptorov pri nadmernej lokálnej produkcii cytokínov môže viesť k pľúcnemu poškodeniu (VILI), či úniku cytokínov do systémovej cirkulácie [26]. Ich biologický efekt na tejto úrovni je dobre známy (vazoparalýza na úrovni makrocirkulácie, porucha vazorelaxácie, mikrotrombotizácia a kapilárny leak na úrovni mikrocirkulácie, porucha dýchacieho reťazca na úrovni mitochondrií) a predpokladá sa, že zohráva dôležitú úlohu v patogenéze MODS [4]. V spomínanej štúdii u pacientov s ARDS zistili Ranieri et al, že „tradičný“ ventilačný režim viedol už po 96 hodinách aplikácie k 3násobne vyššej incidencii MODS. Naviac bola nájdená významná korelácia medzi systémovou koncentráciou proinflamatórnych cytokínov a počtom zlyhávajúcich orgánov [32]. Podobné výsledky boli zistené v ARDSNet study, kde pri použití dychového objemu 6 ml/kg ideálnej telesnej hmotnosti bol zaznamenaný signifikantný pokles sérovej hladiny IL-6 a o 22 % nižšia mortalita v porovnaní so skupinou pacientov, u ktorých bol použitý dychový objem 12 ml/kg hmotnosti [37]. Po tretie, vysoká lokálna koncentrácia proinflamatórnych cytokínov paradoxne stimuluje rast baktérií [21]. Ak keď presný mechanizmus tohoto javu nie je dnes známy, môže vysvetliť vyšší výskyt ventilátorových pneumónií (VAP - ventilator associated pneumonia) u pacientov s ALI/ARDS [15]. Po štvrté, pľúcna proinflamatórna odpoveď vedie k systémovej (kompenzačnej) antiinflamatórnej odpovedi [22]. Výsledkom môže byť deaktivácia tkanivových imunokompetentných buniek v iných orgánov (spojená so zvýšenou vnímavosťou voči infekcii), či únik baktérií/cytokínov z týchto tkanív, pokiaľ sú už infekciou postihnuté [13]. Podobne bola v experimente dokázaná tiež zvýšená permeabilita črevnej steny so systémovou translokáciou luminálnych baktérií pri traumatizujúcom spôsobe UPV [12].
Systémová translokácia baktérií a endotoxínu
Testovanie traumatizujúcej pľúcnej ventilácie (veľký Vt a súčasne nulový PEEP, ďalej HVZP = high volume, zero PEEP) na pokusných zvieratách po predchádzajúcej intratracheálnej instilácii baktérií či endotoxínu ukázalo, že tento postup je spojený s ich translokáciou do systémovej cirkulácie. Verbrugge et al použili intratracheálnu aplikáciu Klebsiella pneumoniae a po 180 min HVZP-ventilácie dosiahla v tejto skupine zvierat incidencia bakteriémie takmer 70 %. Súčasne zistili, že pridanie PEEP bolo schopné incidenciu bakteriémie štatisticky významne znížiť (12,5 % vs 68,8 %) [41]. Podobne, Murphy et al zistili, že HVZP-ventilácia signifikantne zvyšuje systémovú translokáciu intratracheálne aplikovaného endotoxínu [23]. Aký to má praktický význam? Epidemiologické štúdie výskytu nozokomiálnych infekcií na jednotkách intenzívnej starostlivosti ukazujú, že práve postihnutie respiračného traktu je najčastejšie zistenou nákazou, naviac spojenou s horšou prognózou takto postihnutých pacientov [39]. Je pravdepodobné, že za týmto zistením sa skrýva nešetrná ventilačná stratégia s indukciou zvýšenej vnímavosti pľúc k infekcii a jej následnou systémovou propagáciou.
Pro-apoptotický efekt
Apoptóza je geneticky naprogramovaný proces bunkového umierania. Kľúčovým mediátorom spúšťania apoptózy sú kaspázy. Tie môžu byť aktivované substanciami s názvom Fas a Fas-ligand. Miestom ich tvorby je zápalom zmenené tkanivo, kde indukujú apoptózu leukocytov, epiteliálnych a iných parenchymatóznych buniek. V súvislosti so zápalovými pľúcnymi zmenami vyvolanými traumatizujúcou ventiláciou sa predpokladá, že Fas a Fas-ligand sú tvorené v pľúcnom tkanive odkiaľ následne prenikajú do systémovej cirkulácie [28]. Solubilné formy Fas-ligand boli skutočne nájdené v štatisticky vyššej sérovej koncentrácii u pacientov s ARDS, ktorí zomreli v porovnaní s pacientmi, ktorí prežili [19). Podobne bolo zistené, že tekutina získaná BAL u pacientov s ARDS stimuluje apoptózu, a tomuto procesu sa dá zabrániť použitím látok blokujúcich Fas [1]. Významným pokrokom poznania v tejto oblasti bola experimentálna štúdia Ymai et al, ktorá ukázala, že traumatizujúci spôsob UPV viedol k štatisticky významne vyššiemu počtu apoptotických buniek v obličkách a črevnej sliznici v porovnaní s protektívnou ventiláciou [16]. Zdá sa teda, že indukcia apoptózy vo „vzdialených“ orgánoch je jedným z ďalších vážnych dôsledkov nesprávne nastaveného ventilačného režimu.
Záver
Zavedenie UPV do klinickej praxe zahájilo modernú éru intenzívnej medicíny a niet pochybností o tom, že UPV je život zachraňujúcim liečebným postupom [17]. Na druhej strane v súčasnosti narastá počet dôkazov o tom, že UPV môže poškodiť pacienta doteraz nepoznaným spôsobom - konverziou mechanického signálu na signál biochemický, indukciou pľúcnej zápalovej odpovede s jej následnou systémovou propagáciou a vývojom MODS. Tento mechanizmus umožňuje vysvetliť, prečo pacienti s akútnym pľúcnym poškodením zomierajú častejšie za príznakov MODS a nie na akútne respiračné zlyhanie. Ak sa teda po napojení pacienta na UPV zlepší jeho oxygenácia, to potom ešte neznamená, že musí nakoniec prežiť. Naopak, pre jeho ďalší vývoj má podstatne väčší význam miera šetrnosti ventilačnej stratégie a jej posudzovanie i niekoľkokrát denne je základom modernej ventilačnej podpory. V súvislosti s často pozorovaným zlepšením oxygenačnej schopnosti pľúc po zahájení UPV je treba podotknúť, že tento parameter nie je spoľahlivým kritériom pre posudzovanie miery šetrnosti ventilačnej podpory. Dokladuje to niekoľko experimentálnych a klinických štúdií, ktoré zistili, že vhodnejším ukazovateľom je sledovanie poddajnosti respiračného systému. Tento parameter totiž pozitívne koreluje tak s pľúcnou vzdušnosťou, ako aj so systémovou dodávkou kyslíka do periférnych tkanív [14,18,35] (Obr. 5).
Obr. 5. Grafický vzťah medzi oxygenačnou schopnosťou pľúc (paO2/FiO2), poddajnosťou respiračného systému (CRS) a systémovou dodávkou kyslíku (DO2). CRS – poddajnosť respiračného systému (ml/cm H2O), paO2/FiO2 – pomer medzi parciálnym tlakom kyslíka v arteriálnej krvi a inspiračnou frakciou kyslíka (mm Hg), DO2 – systémová dodávka kyslíka (šrafovaná plocha, ml/min × kg), PEEP – pozitívny tlak na konci výdychu (cm H2O). 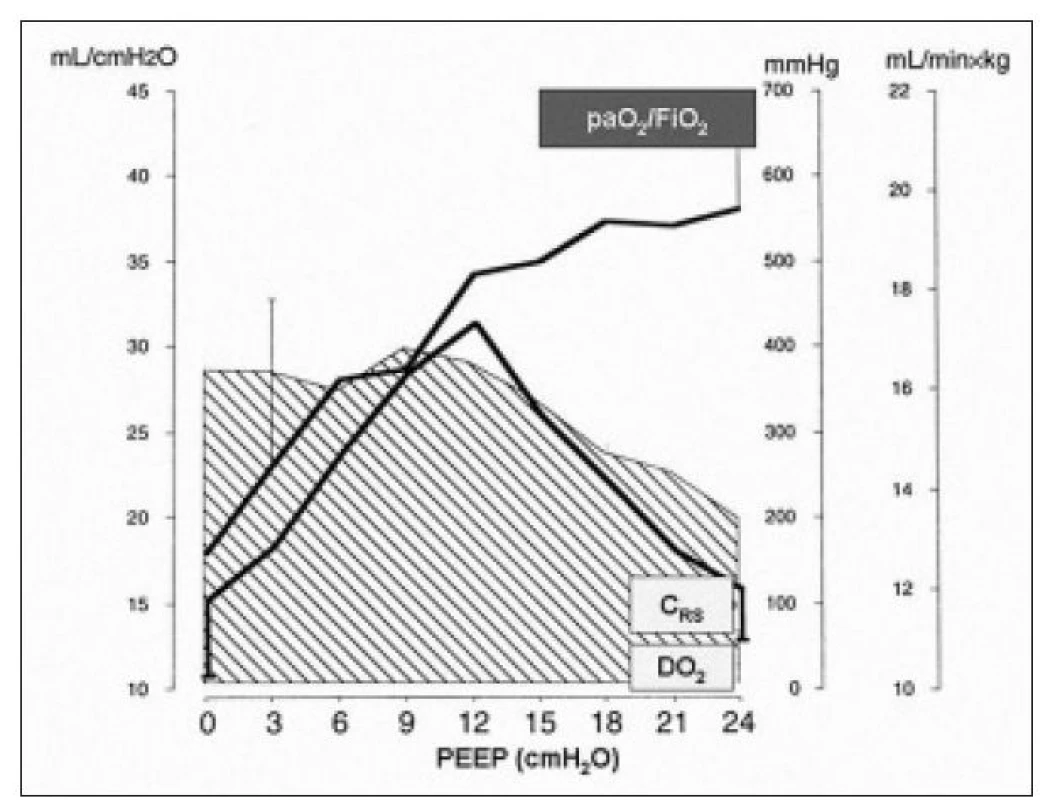
Voľne spracované podľa: Lichtwarck-Aschoff M, Mols G, Hedlund AJ et al. Compliance is nonlinear over tidal volume irrespective of positive end-expiratory pressure level in surfactant-depleted piglets. Am J Respir Crit Care Med 2000; 162: 2125-2133 (18). Aké majú všetky tieto poznatky praktický dopad? V každom prípade sme sa „fascinujúcim“ spôsobom posunuli dopredu v poznaní nežiadúcich účinkov UPV. Na druhej strane sa dnes jedným dychom konštatuje, že napriek tomuto pokroku sa v praxi neustále používajú traumatizujúce ventilačné režimy [6,33,43-45]. Napríklad Esteban et al v multicentrickej prevalenčnej štúdii, do ktorej bolo zaradené viac ako 1 600 pacientov na umelej pľúcnej ventilácii, zistili priemernú hodnotu dychového objemu (ďalej Vt) až 9 ml/kg telesnej hmotnosti a v 31 % prípadov dokonca úplnú absenciu použitia PEEP. Autori konštatovali len minimálnu snahu zo strany lekárov o protektivnosť ventilačnej podpory [6]. Podobne Wolthouis et al vo svojom prieskume zistili, že frekvencia nastavenia Vt v skupine pacientov s ALI /ARDS bola až v 85 % všetkých prípadov vyššia ako 8 ml/kg telesnej hmotnosti. Autori konštatovali potrebu systematickej edukácie lekárov v problematike protektivnej pľúcnej ventilácie [44]. Konečne, tiež v česko-slovenskom jednodennom prieskume umelej pľúcnej ventilácie bola zistená takmer 40% incidencia použitia Vt > 8 ml/kg telesnej hmotnosti v skupine pacientov splňujúcich kritériá pre ALI/ARDS (Kula et al, nepublikované údaje). Všetky uvedené údaje sú v rozpore s výsledkami klinických štúdií, ktoré ukázali signifikantne nižšiu úmrtnosť u pacientov s ALI/ARDS pri použití Vt ≤ 6 ml/kg ideálnej telesnej hmotnosti a nastavení PEEP nad hodnotu dolného inflekčného bodu [2,37]. Paradoxne, všetky uvedené údaje boli zistené potom, čo boli výsledky týchto štúdií publikované. Pre túto situáciu, súvisiacu nesporne s našou poučiteľnosťou, sa anekdotálne zaviedol termín PILI (physician-induced lung injury) a otázka „ventilator or physician-induced lung injury?“ sa tak stala veľmi aktuálnou [42].
MUDr. Roman Kula, CSc.
www.fnspo.cz
e-mail: roman.kula@fnspo.cz
Doručeno do redakce: 16. 7. 2007
Přijato po recenci: 8. 9. 2007
Zdroje
1. Albertine KH, Soulier MF, Wang Z et al. Fas and fas ligand are up-regulated in pulmonary edema fluid and lung tissue of patients with acute lung injury and the acute respiratory distress syndrome. Am J Pathol 2002; 16 : 1783-1796.
2. Amato MB, Barbas CS, Medeiros DM et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med 1998; 338 : 347-354.
3. Carlon GC, Combs AH. Mechanical ventilation and the diseased lung. Crit Care Med 2000; 28 : 2662-2664.
4. Cohen J. The immunopathogenesis of sepsis. Nature 2002; 420 : 885-891.
5. Dos Santos CC, Slutsky AS. Mechanisms of ventilator-associated lung injury. J Appl Physiol 2000; 89 : 1645-1655.
6. Esteban A, Anzueto A, Alia A et al. How is mechanical ventilation employed in the intensive care unit? Am J Respir Crit Care Med 2000; 161 : 1450-1458.
7. Ferring M, Vincent JL. Is outcome from ARDS related to the severity of respiratory failure? Eur Respir J 1997; 10 : 1297-1300.
8. Frank JA, Matthay MA. Science review: mechanism of ventilator-induced lung injury. Critical Care 2003; 7 : 233-241.
9. Gajic O, Frutos-Vivar F, Esteban A et al. Ventilator settings as a risk factor for acute respiratory distress syndrome in mechanically ventilated patients. Intensive Care Med 2005; 31 : 893-895.
10. Gattinoni L, Chiumello D, Cressoni M et al. Pulmonary computed tomography and adult respiratory distress syndrome. Swiss Med Wkly 2005; 135 : 169-174.
11. Gattinoni L, Pesenti A. The concept of “baby lung”. Intensive Care Med 2005; 31 : 776-784.
12. Guery BPH, Welsh DA, Viget N et al. Ventilation-induced lung injury is associated with an increase in gut permeability. Shock 2003; 19 : 559-563.
13. Haitsma JJ, Uhlig S, Göggel R et al. Ventilator-induced lung injury leads to loss of alveolar and systemic compartmentalization of tumor necrosis factor-alpha. Intensive Care Med 2000; 26 : 1515-1522.
14. Henzler D, Pelosi P, Dembinski R et al. Respiratory compliance but not gas exchange corelates with changes in lung aeration after a recruitment maneuver: an experimental study in pigs with saline lavage lung injury. Crit Care 2005; 9: R471-R482.
15. Chastre J, Trouillet JL, Vuagnat A et al. Nosocomial pneumonia in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 1998; 157 : 1165-1172.
16. Imai Y, Parodo J, Kajikawa O et al. Injurious mechanical ventilation and end-organ epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome. JAMA 2003; 289 : 2104-2112.
17. Lassen HC. A preliminary report on the 1952 epidemic of poliomyelitis in Copenhagen with special reference to the treatment of acute respiratory insufficiency. Lancet 1953; 1 : 37-41.
18. Lichtwarck-Aschoff M, Mols G, Hedlund AJ et al. Compliance is nonlinear over tidal volume irrespective of positive end-expiratory pressure level in surfactant-depleted piglets. Am J Respir Crit Care Med 2000; 162 : 2125-2133.
19. Matute-Bello G, Liles WC, Steinberg KP et al. Soluble Fas ligand induces epithelial cell apoptosis in humans with acute lung injury (ARDS). J Immunol 1999; 163 : 2217-2225.
20. Mead J, Takishima T, Leith D et al. Stress distribution in lungs: a model of pulmonary elasticity. J Appl Physiol 1970; 28 : 596-608.
21. Meduri GU. Clinical review: A paradigm shift: the bidirectional effect of inflammation on bacterial growth. Clinical implications for patients with acute respiratory distress syndrome. Crit Care 2002; 6 : 24-29.
22. Munford RS, Pugin J. Normal responses to injury prevent systemic inflammation and can be immunosuppressive. Am J Respir Crit Care Med 2001; 163 : 316-321.
23. Murphy DB, Cregg N, Tremblay LN et al. Adverse ventilatory strategy causes pulmonary-to-system translocation of endotoxin. Am J Respir Crit Care Med 2000; 162 : 27-33.
24. Nagel T, Resnick N, Dewey CF et al. Vascular endothelial cells respond to spatial gradients in fluid shear stress by enhanced activation of transcription factors. Arterioscler Thromb Vasc Biol 1999; 19 : 1825-1834.
25. Parker JC, Hernandez LA, Peevy KJ. Mechanisms of ventilator-induced lung injury. Crit Care Med 1993; 21 : 131-143.
26. Pinski MR. Sepsis and Inflammation: The process of dying from critical care. In: Vincent JL (eds). Yearbook of Intensive care Medicine 1996; München: Springer-Verlag 1996, 3-10.
27. Plötz FB, Vreugdenhil HA, Slutsky AS et al. Mechanical ventilation alters the immune response in ventilated children without lung pathology. Int Care Med 2002; 28 : 486-492.
28. Plötz FB, Slutsky AS, van Vught AJ et al. Ventilator-induced lung injury and multiple system organ failure: a critical review of facts and hypotheses. Int Care Med 2004; 30 : 1865-1872.
29. Pugin J, Dunn I, Jolliet P et al. Activation of human macrophages by mechanical ventilation in vitro. Am J Physiol 1998; 275: L1040-L1050.
30. Radford EP. Static mechanical properties of mammalian lungs. In: Fenn WO, Rahn H (eds). Handbook of Physiology. Section 3: Respiration, Vol. I. Washington (DC): American Physiological Society; 1964, Vol. 1/3 : 429-449.
31. Ranieri VM, Suter PM, Tortorella C et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA 1999; 282 : 54-61.
32. Ranieri VM, Giunta F, Suter PM et al. Mechanical ventilation as a mediator of multisystem organ failure in acute respiratory distress syndrome JAMA 2000; 284 : 43-44.
33. Rubenfeld GD, Caldwell E, Hudson L. Publication of study results does not increase use of lung protective ventilation in patients with acute lung injury. Am J Respir Crit Care Med 2001; 163: A295
34. Schultz MJ, Haitsma JJ, Slutsky AS et al. What tidal volumes should be used in patients without acute lung injury? Anesthesiology 2007; 106 : 1226-1231.
35. Suter PM, Fairley B, Isenberg MD. Optimum end-expiratory airway pressure in patients with acute pulmonary failure. N Engl J Med 1975; 292 : 284-289.
36. Tremblay LN, Slutsky AS. Ventilator-induced injury: from barotrauma to biotrauma. Proc Assoc Am Physicians 1998; 110 : 482-488.
37. Tremblay LN, Miatto D, Hamid Q et al. Injurious ventilation induces widespread pulmonary epithelial expression of tumor necrosis factor-alpha and interleukin-6 messenger RNA. Crit Care Med 2002; 30 : 1693-1700.
38. Tremblay LN, Valenza F, Ribeiro SP et al. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest 1997; 99 : 944-952.
39. Vincent JL, Bihari D, Suter PM et al. The prevalence of nosocomial infection in intensive care units in Europe: result of the European Prevalence of Infection in Intensive Care (EPIC) Study. JAMA 1995; 274 : 639-644.
40. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000; 342 : 1301-1308.
41. Verbrugge SJ, Sorm V, van’t Veen A et al. Lung overinflation without positive end-expiratory preassure promotes bacteriemia after experimental Klebsiella pneumoniae inoculation. Int Care Med 1998; 24 : 172-177.
42. Villar J. Ventilator or physician-induced lung injury? Minerva Anestesiol 2005; 71 : 255-258.
43. Weinert CR, Gross CR, Marinelli WA Impact of randomized trial results on acute lung injury ventilator therapy in teaching hospitals. Am J Respir Crit Care Med 2003; 167 : 1304-1309.
44. Wolthuis E, Spronk P, Kuiper M et al. Dutch intensivists do not use small tidal volume in mechanical ventilation. Critical Care 2004; 8(Suppl 1): P26.
45. Young MP, Manning HL, Wilson DL et al. Ventilation of patients with acute lung injury and acute respiratory distress syndrome: has new evidence changed clinical practice? Crit Care Med 2004; 32 : 1260-1265.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Dobutamínová záťažová echokardiografia vs SPECT pri diagnostikovaní ischemickej choroby srdcaČlánek Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemociČlánek II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně oslavuje 60. výročí svého vznikuČlánek XI. kongres o ateroskleróze
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Vztah mezi osteoporózou a celiakií - editorial
- Celiakie a osteoporóza - je vazba natolik těsná, že vyžaduje akci? - editorial
- Srovnání zátěžové echokardiografie a SPECT myokardiální perfuze - editorial
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Bakteriální infekce ve vztahu ke vzniku a průběhu varikózního krvácení
- Stresová odezva prolaktinu u nemocných se systémovým lupus erythematodes (SLE), revmatoidní artritidou (RA) a u zdravých kontrol
- Léčba hyperglykemie u kriticky nemocných pacientů: srovnání standardního protokolu a počítačového algoritmu
- Příčiny akutního krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Vliv etiologie syndromu diabetické nohy na lokalizaci defektů
- Sledování funkčních poruch mikrocirkulace laser dopplerem u pacientů s chronickou žilní nedostatečností třídy 2 dle CEAP klasifikace před a po operaci varixů
- Celiakia - častá príčina „idiopatickej osteoporózy“ premenopauzálnych a včasne postmenopauzálnych žien
- Dobutamínová záťažová echokardiografia vs SPECT pri diagnostikovaní ischemickej choroby srdca
- Diabetes mellitus a mikroalbuminurie
- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně oslavuje 60. výročí svého vzniku
- O ztrátách a nálezech s odstupem
- XI. kongres o ateroskleróze
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- Diabetes mellitus a mikroalbuminurie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



