-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
GUIDELINES EAU PRO LAPAROSKOPII
Autoři: JD. Doublet; G. Janetschek; A. Joyce; A. Mandressi; J. Rassweiller; D. Tolley
Vyšlo v časopise: Urol List 2005; 3(3): 61-80
VĚNOVÁNO: MJ. COPCOAT
OBSAH
- Úvod 62
- 1.1 Metody vytváření guidelines 62
- 1.2 Úroveň důkazů a stupeň doporučení 62
- 1.3 Literatura 62
- TECHNICKÉ ASPEKTY 62
- 2.1 Úvod 62
- 2.2 Vybavení (1-3) 63
- 2.3 Instrumenty 63
- 2.3.1 Přístup a vytvoření pracovního prostoru 63
- 2.3.2 Disekce 63
- 2.3.3 Hemostáza 63
- 2.3.4 Techniky sutury 64
- 2.3.5 Odstraňování vzorků (4) 64
- 2.4 Techniky přístupu (1, 3, 5, 6) 64
- 2.4.1 Retroperitoneoskopie 64
- 2.4.2 Transperitoneální laparoskopie horních cest močových 65
- 2.4.3 Transperitoneální přístup do pánve 65
- 2.4.4 Extraperitoneální přístup do pánve 65
- 2.5 Řešení komplikací (7-14) 66
- 2.5.1 Úvod (tab. 2.1 - 2.5) 66
- 2.5.2 Umístění trokarů 66
- 2.5.3 Cévní poranění 66
- 2.5.4 Vaskulární poranění 67
- 2.5.5 Poranění okolních orgánů 67
- 2.6 Speciální trénink 67
- 2.7 Skórovací systém obtížnosti laparoskopických výkonů 68
- 2.7.1 Kritéria 68
- 2.7.2 Skórovací systém 69
- 2.8 Literatura 69
- LAPAROSKOPICKÉ VÝKONY 71
- 3.1 Adrenalektomie 71
- 3.2 Kolposuspenze 71
- 3.3 Léčba kryptorchizmu 71
- 3.4 Rekonstrukce hernie 72
- 3.5 Nefrektomie 72
- 3.5.1 ‑Jednoduchá nefrektomie (benigních onemocnění) (tab. 3.6) 72
- 3.5.2 Radikální nefrektomie (tab. 3.7) 72
- 3.5.3 Parciální nefrektomie (tab. 3.8) 73
- 3.5.4 Nefroureterektomie (tab. 3.9) 73
- 3.5.5 Nefrektomie živého dárce (tab. 3.10) 73
- 3.6 Nefropexe (tab. 3.11) 73
- 3.7 Pyeloplastika (tab. 3.12) 74
- 3.8 Disekce lymfatických uzlin v pánvi (tab. 3.13) 74
- 3.9 Radikální prostatektomie (tab. 3.14) 74
- 3.10 ‑Disekce retroperitoneálních lymfatických uzlin (u karcinomu varlat) (tab. 3.15) 74
- 3.11 Léčba renálních cyst (tab. 3.16) 75
- 3.12 Ureterolitotomie (tab. 3.17) 75
- 3.13 Varikokelektomie (tab. 3.18) 75
- 3.14 Literatura 75
- DOPORUČENÍ 80
- POUŽITÉ ZKRATKY 80
1. ÚVOD
Skupina evropských urologů se speciálním zaměřením na laparoskopii studovala publikovanou literaturu pro vytvoření guidelines pro tuto subspecializaci. Pokud považujeme laparoskopickou operaci jako alternativu k otevřené operaci, je třeba uvést, že často existují pouze minimální důkazy podporující užití, historicky nazýváno, otevřené operace. Tato skupina proto vytvořila nové standardy kvality. Navzdory nedostatku důkazů level one nebo doporučení grade A, se Laparoscopy Working Group of the EAU domnívá, že má laparoskopie v praktické urologii signifikantní roli. Laparoskopie je oblast, která se neustále vyvíjí, a to jak po stránce technologické, tak i metodologické, což znamená, že se zabýváme výkony, které si zaslouží zvláštní pozornost.
V těchto guidelines se termín laparoskopie užívá pro popis takové operační techniky, která se provádí v uzavřeném prostoru, zvětšeném nebo vytvořeném bez ohledu na to, zda je technika prováděna uvnitř nebo vně peritonea.
The Laparoscopy Working Group studovala veškerou dostupnou literaturu týkající se laparoskopie, publikovanou v letech 1990 až 2000, i v roce 2001. Literatura je citována dle kritérií popsaných v kapitolách 1.1 a 1.2 (viz níže).
1.1 Metody vytváření guidelines [1]
Woolf (1992) popsal tři hlavní metody tvorby guidelines: informální konsenzus, formální konsenzus a vznik guidelines spojený s důkazy [2].
Informální konsenzus znamená, že pro rozhodování v průvodci Laparoscopy Working Group byla dostupná špatně definovaná kritéria. Formální konsenzuální metody, které jsou užívány na mnoha konferencích týkajících se konsenzu tvorby guidelines a Delphi groups, poskytují lepší strukturu analytického procesu, ale stále neposkytují explicitní vztah mezi doporučením a kvalitou důkazů [2]. Vývoj guidelines související s důkazy vyžaduje explicitní souvislost mezi doporučením a kvalitou podpůrných důkazů [3].
To umožňuje uživateli kvalifikovaně si vybrat, zda se řídit individuálním doporučením v rámci guidelines s tím, že vezme v úvahu úroveň podpůrných důkazů. Kliničtí lékaři proto potřebují velmi dobrý důvod (který by měl být adekvátně zaznamenán) pro volbu neřídit se doporučením založeným na klinicky randomizované relevantní studii nebo metaanalýze, avšak mají větší flexibilitu při užívání doporučení založených na důkazech nižší úrovně.
1.2 Úrovně důkazů a stupeň doporučení guidelines
Úrovně důkazů jsou shrnuty v tab. 1.1, a v tab. 1.2 je popsána bodovací škála doporučení.
Tab. 2. Stupně doporučení guidelines [3]. ![Stupně doporučení guidelines [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1fc8ce18067998a32932d0475e34dae0.png)
1.3 Literatura
1. Grimshaw J, Eccles M, Russell I. Developing clinically valid practice guidelines. J Eval Clin Prac 1995; 1 : 37-48.
2. Woolf SH. Practice guidelines, a new reality in medicine. II. Methods of developing guidelines. (Review.) Arch Intern Med 1992; 152 : 946-952.
3. Agency for Health Care Policy and Research. Clinical Practice Guidelines Development, Methodological Perspectives. US Department of Health and Human Services, Public Health Service, Washington DC,1992; 115-127.
2. TECHNICKÉ ASPEKTY
2.1 Úvod
Laparoskopie je operační metoda, která umožňuje provedení operačních procedur při minimalizaci traumatu organizmu. Následující body jsou nezbytné pro provedení jakékoliv laparoskopické procedury:
- základní povinné vybavení
- speciální základní instrumenty
- základní přístupové techniky
- řešení komplikací
- speciální trénink.
2.2 Vybavení [1-3]
Pohled na operační pole poskytuje videokamera, která představuje oko operatéra. Je zbytečné připomínat, že správné videovybavení má obrovský význam. Základní vybavení nezbytné pro videozáznam zahrnuje:
- alespoň 1 CCD (charge-coupled device), ale nejlépe 3 CCD videokamery
- alespoň 1, ale nejlépe 2 monitory
- věž s videorekordérem.
Dále by mělo vybavení zahrnovat:
- vysokoprůtokový insuflátor
- xenonový zdroj osvětlení
- vysokofrekvenční generátor, mono - i bipolární
- odsávací a irigační zařízení.
(Další zařízení pro disekci a kontrolu krvácení mohou být také užitečné, jako například ultrazvukový disektor nebo radiofrekvenční koagulátor).
2.3 Instrumenty [1-3]
Spolu s instrumenty umožňujícími přístup k vytvoření pracovního prostoru vyžaduje operatér state-of-the-art instrumenty pro optimální provedení laparoskopických procedur zahrnující:
- disekci
- hemostázu
- suturu
- odstranění vzorků.
2.3.1 Přístup a vytvoření pracovního prostoru
Nezbytné instrumenty pro přístup a vytvoření pracovního pole zahrnují:
- Veressovu jehlu (pouze pro transperitoneální přístup)
- Hassonův trokar
- 10mm trokar s bezpečnostní pochvou
- 10mm trokar s ventilační chlopní a redukcí na 5 mm
- 0° a 30° 10mm teleskopy.
Volitelným instrumentem je:
- balonový dilatátor (pouze pro extraperitoneální přístup).
V zásadě nejsou mezi provedením transperitoneální nebo extraperitoneální laparoskopické operace žádné větší rozdíly. Avšak vzhledem k tomu, že je peritoneum již existující dutina, je pouze nezbytné ho naplnit plynem pro vytvoření pracovního prostoru. Ovšem vzhledem k tomu, že retroperitoneum ani pánev nejsou dutinami, je nezbytné nejprve vypreparovat tuk, který vyplňuje retroperitoneální prostor, abychom vytvořili pracovní pole.
Proto je v případě transperitoneálního přístupu břišní dutina insuflována pomocí Veressovy jehly a provedením punkce 10mm trokarem s bezpečnostním krytem nebo pomocí otevřené Hassonovy techniky.
Při retroperitoneálním přístupu začneme vytvořením otevřeného kanálu (15–20 mm širokého v průměru) směrem do retroperitoneálního prostoru následovaným disekcí prstem (s nebo bez balonové disekce). Veressova jehla není požadována.
2.3.2 Disekce
Základními instrumenty nezbytnými pro laparoskopickou preparaci jsou:
- zahnuté endoskopické nůžky s rotačními břity
- zahnutý endoskopický disektor
- odsávací a irigační sonda.
Volitelným, ovšem užitečným instrumentem je:
- ultrazvukový disektor.
Je možné provést několik preparačních technik:
- tupá a ostrá disekce s endonůžkami
- tupá disekce pomocí malých endotamponů
- tupá disekce pomocí pravoúhlého disektoru (5 mm, 10 mm)
- tupá disekce pomocí špičky odsávací a irigační sondy
- ostrá disekce pomocí ultrazvukového skalpelu.
2.3.3 Hemostáza
Hemostáza je jedním z hlavních témat při jakékoliv operaci. Při laparoskopické operaci existuje několik guidelines, která zajišují disekci bez ztráty krve. Je velmi důležité provádět disekci zeširoka s optimální expozicí orgánu, spíše než hlubokou disekci. Pro minimalizaci ztráty krve je lepší předem řešit cévní zásobení orgánu, než provádět disekci celého orgánu a ponechat disekci cév jako poslední krok při operaci.
Základními nástroji nezbytnými pro laparoskopickou hemostázu jsou:
- 5mm monopolární koagulační pinzeta/disektor
- 5mm bipolární pinzeta
- 10mm aplikátor endoklipu
- Endo-GIA® stapler (pouze u velkých žil)
- volitelné instrumenty
- bipolární koagulační pinzeta/disektor
- ultrazvukový disektor
- radiofrekvenční koagulační 5mm sonda.
2.3.4 Techniky sutury
Laparoskopická sutura vyžaduje speciální trénink vzhledem k tomu, že je odlišná od sutury při otevřené operaci při šití i uzlení. Existuje několik metod. Zásadně je třeba jeden jehelec (někdy dva) a malé jehly s krátkým vláknem (tj. vlákno dlouhé 15–20 cm a jehly, které snadno projdou 10mm trokarem).
Jehly speciálně konstruované pro laparoskopii jsou užitečné, ovšem nikoliv nezbytné.
2.3.5 Odstranění vzorků [4]
Nakonec je pro odstranění vzorků nezbytný sáček na odstranění orgánů. Nejlépe testovaným sáčkem je LapSac®, který poskytuje nejbezpečnější materiál. To je velmi důležité, pokud je nutná morcelace tkáně, avšak manipulace se sáčkem je obtížná. Lze užít jiné sáčky z méně odolných materiálů, ale s lepším otvíracím mechanizmem (např. Endobag® nebo Endocatch®).
2.4 Přístupové techniky [1,3,5,6]
2.4.1 Retroperitoneoskopie
Indikace pro provedení retroperitoneoskopie zahrnují:
- nefrektomii
- radikální nefrektomii
- nefrektomii od živého dárce
- heminefrektomii
- operaci ledviny šetřící nefrony
- resekci renálních cest
- pyeloplastiku
- adrenalektomii
- disekci retroperitoneálních lymfatických uzlin
- ureterolitotomii
- nefropexi.
V celkové anestezii je pacient umístěn do polohy typické pro operaci ledviny. V lumbálním (Petitově) trojúhelníku je mezi 12. žebrem a hřebenem kosti ilické na předním okraji m. sacrospinalis provedena 15–18mm incize. Pomocí tupé disekce je proveden tunel směrem do retroperitoneálního prostoru. Tento tunel je dilatován, dokud není ukazovák schopen posunout peritoneum směrem dopředu, a tím vytvořit retroperitoneální prostor. Poté je provedena disekce prostoru mezi lumbální aponeurózou a renální fascií (Gerotovou fascií). Provádí se buï výhradně pomocí ukazováku (obr. 1) nebo pomocí disekčního balonu. Počáteční rána (Port I) je uzavřena kolem portu pomocí matracové sutury, abychom zabránili unikání vzduchu (obr. 2).
Obr. 1. Retroperitoneoskopie. Disekce retroperitoneálního prostoru prsty (2) mezi lumbodorzální aponeurózou (3) a Gerotovou fascií (1). 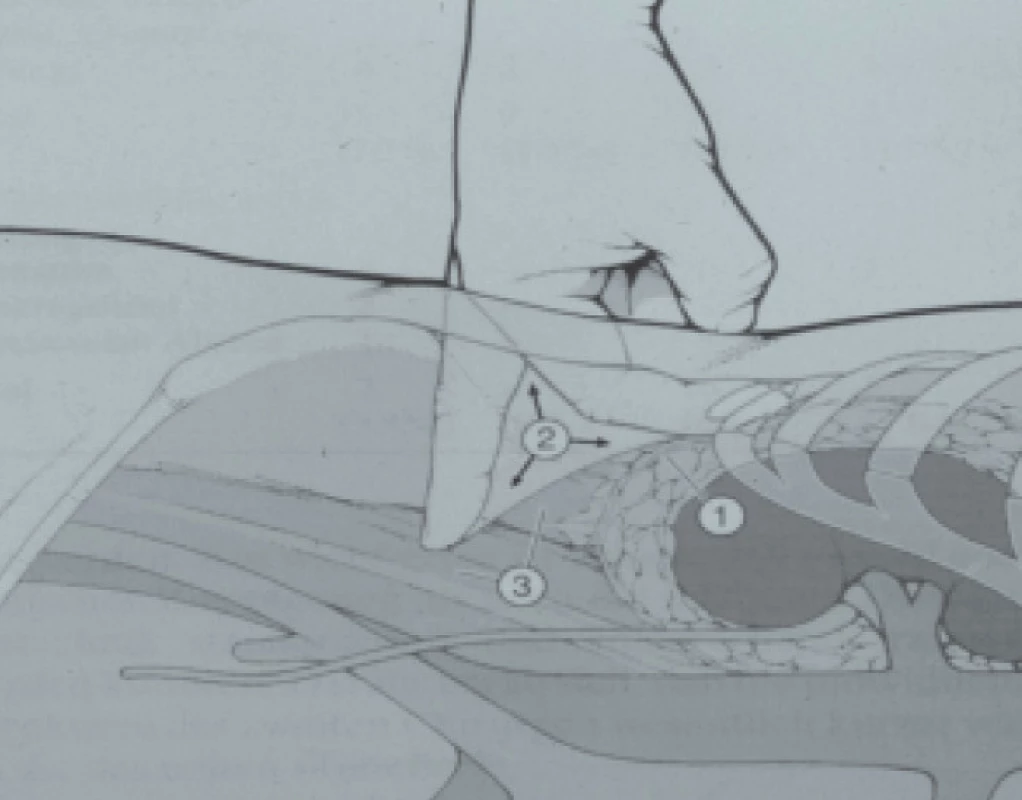
Obr. 2. Retroperitoneoskopie. Uspořádání trokarů na pravé straně. 1 = m. obliquus externus, 2 = m. latissimus dorsi, 3 = m. rectus, 4 = lumbální trojúhelník. 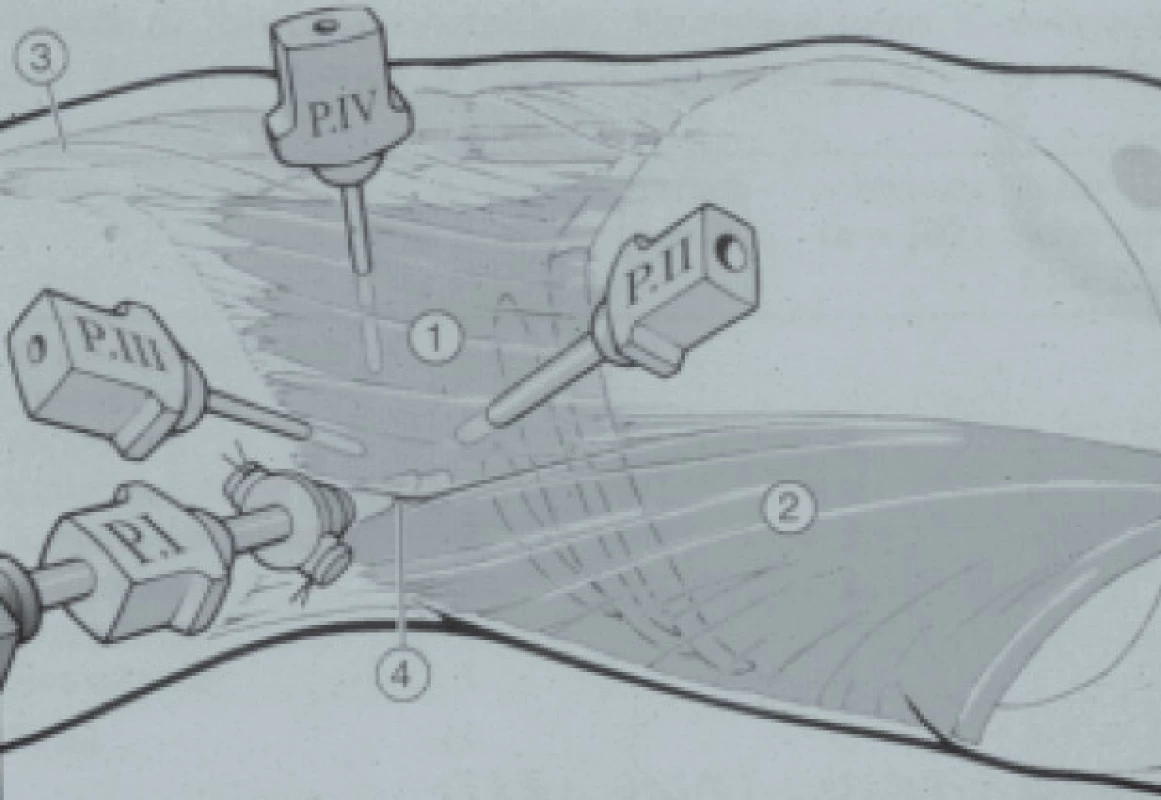
Prostor je poté naplněn oxidem uhličitým až do maximálního tlaku 12 mm Hg a přehlédnut. Následně jsou pod endoskopickou kontrolou zavedeny dva sekundární trokary (Port II a III). Reziduální srůsty jsou disekovány a renální fascie je otevřena podélně z důvodu expozice m. psoas, který představuje orientační strukturu pro retroperitoneoskopii.
V případě nezbytnosti je zaveden další 5mm trokar (Port IV). Může být vyžadován například při retrakci ledviny při disekci.
2.4.2 Transperitoneální laparoskopie horních cest močových
Indikacemi pro provedení transperitoneální laparoskopie horních cest močových jsou:
- nefrektomie
- radikální nefrektomie
- nefrektomie od živého dárce
- heminefrektomie
- operace ledviny šetřící nefrony
- resekce renálních cest
- pyeloplastika
- adrenalektomie
- disekce retroperitoneálních lymfatických uzlin.
Před vytvořením pneumoperitonea je zavedena nazogastrická sonda a pacient je umístěn do typické polohy na boku v úhlu 30° (Trendelenburgova poloha). Operatér a jeho asistent stojí na ventrální straně pacienta. Pneumoperitoneum je vytvořeno pomocí Veressovy jehly zavedené do peritoneální dutiny, v místě, kde přední axilární čára kříží transverzální čáru v rovině pupku. Poté jsou zavedeny trokary ventrální břišní stěnou následovně (obr. 3):
- Port I: 10mm trokar, periumbilikální (laterální okraj m. rectus abdominis).
- Port II: 10mm trokar na pravé straně, 5mm na levé straně, přímo pod žeberním okrajem (mamilární čára).
- Port III: 5mm trokar na pravé straně, 10mm na levé straně nad kostí pánevní (mamilární čára).
Obr. 3. Transperitoneální laparoskopie v horním retroperitoneu. Uspořádání trokarů na pravé straně. 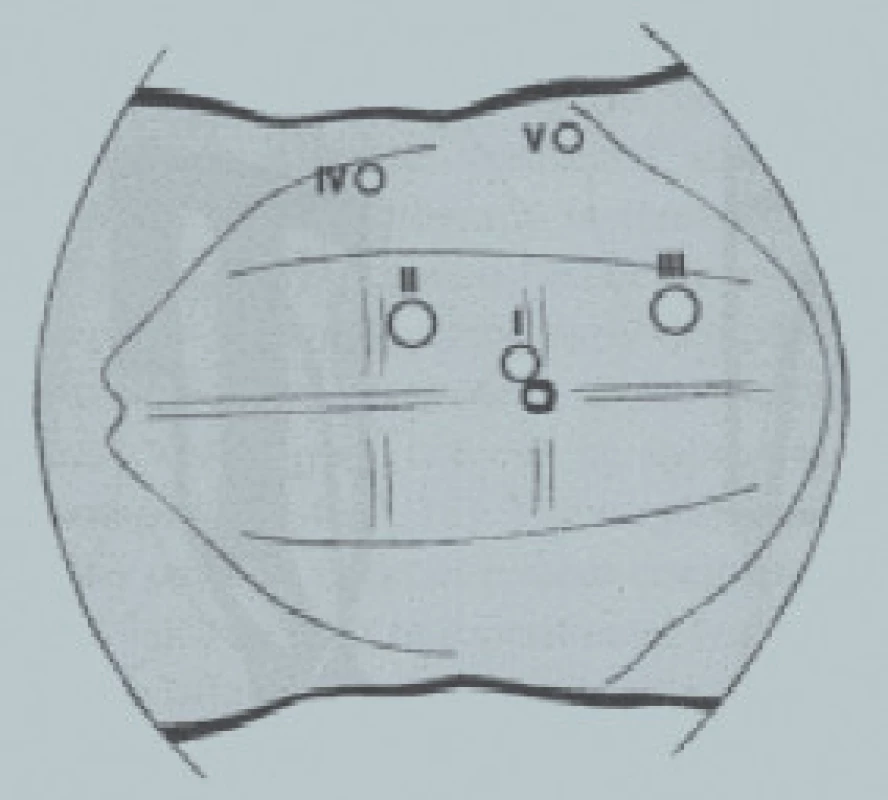
Laparoskop je zaveden do portu I a užit pro kontrolu zavedení trokarů do portu II a III. Porty jsou fixovány ke kůži. Po celkovém přehlédnutí intraabdominálního prostoru musí být sestupné kolon mobilizováno pro umožnění přístupu do retroperitonea na levé straně. Na pravé straně musí být mobilizováno vzestupné kolon. Vzhledem k tomu, že laterální břišní stěna je volná, může být nově obnaženým retroperitoneem zaveden další port:
- Port IV: 5 mm podél posteriorní axilární čáry mezi porty II a III.
2.4.3 Transperitoneální přístup do pánve
Indikacemi pro transperitoneální přístup do pánve jsou:
- kryptorchizmus
- kolposuspenze
- disekce pánevních lymfatických uzlin
- radikální prostatektomie
- varikokelektomie
- hernioplastika.
Pacient je umístěn do deflektované polohy na zádech s 30° Trendelenburgovým sklonem. Před zavedením trokaru je do močového měchýře zaveden 14F Foleyho katétr z důvodu drenáže měchýře. Pro umístění prvního trokaru v úrovni pupku existují dvě techniky:
- vytvoření pneumoperitonea pomocí Veressovy jehly
- otevřená miniincize uzavřená pomocí tupého trokaru (Hassonova technika).
Veressova jehla je zavedena v úhlu 45° do prázdného peritonea v úrovni pupku. Poloha by měla být zkontrolována aspirací, infuzí 5 ml solného roztoku a intraabdominální tlak pozorně sledován, aby se pohyboval při insuflaci mírně pod 12 mm Hg (zpočátku pod 5 mm Hg). Veressova jehla na jedno použití s ochrannou pochvou je bezpečnější než jehly na více použití. Jako alternativa zejména u dětí může být užita malá jehla s pochvou pro zavedení miniaturního teleskopu.
Předchozí operace břicha je kontraindikací pro slepé zavedení jehly a pro zavedení prvního portu by měla být provedena Hassonova cut down technika. Uspořádání pracovních portů závisí na typu operace (obr. 4). Všechny sekundární trokary musí být zavedeny za endoskopické kontroly. S výjimkou kryptorchizmu představuje první krok operace expozici Retziova prostoru. To může být zabezpečeno incizí laterálně od laterálního umbilikálního ligamenta, např. jako při disekci pánevních lymfatických uzlin nebo po vysokém přerušení urachu a obou laterálních umbilikálních ligament, např. jako u radikální prostatektomie nebo kolposuspenze.
Obr. 4. Laparoskopická radikální prostatektomie: uspořádání trokarů. 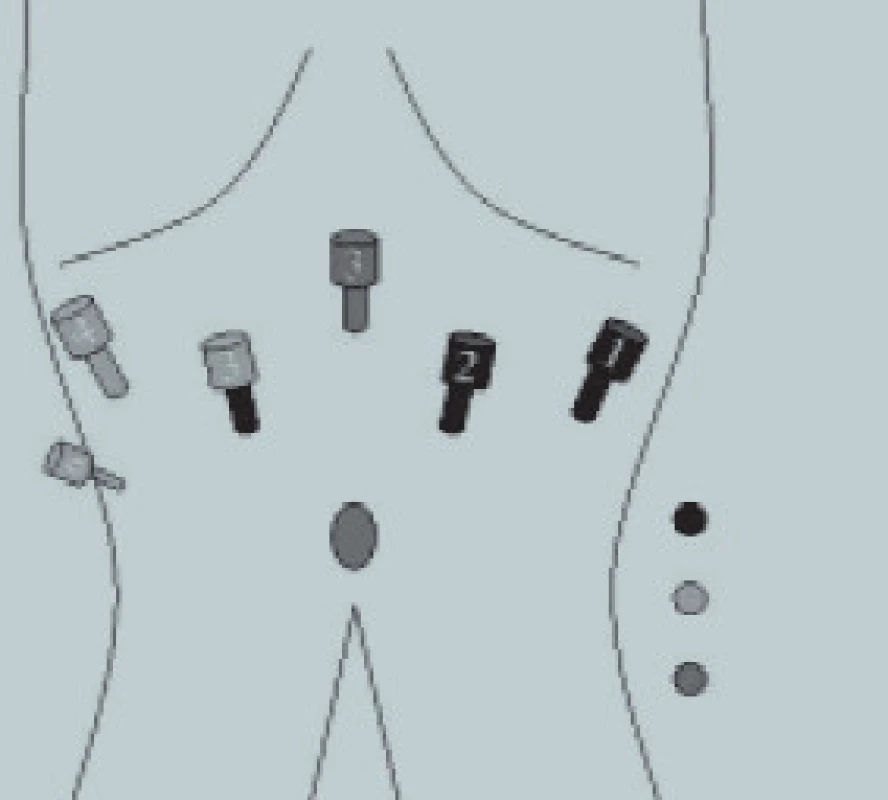
2.4.4 Extraperitoneální přístup do pánve
Indikacemi pro extraperitoneální přístup do pánve jsou:
- kolposuspenze
- disekce pánevních lymfatických uzlin
- radikální prostatektomie
- varikokelektomie
- hernioplastika
Existují dvě techniky:
Balonová disekce
Po provedení 15mm incize pod pupkem je obnažena tupou preparací ve střední čáře transverzální fascie. Pro předběžnou disekci extraperitoneálního prostoru může být užit ukazovák nebo teleskop. Poté je zaveden balonový trokarový systém a disekční balon je naplněn 1000–1200 ml fyziologického roztoku, dle velikosti pacienta. Balonová disekce může být monitorována endoskopicky laparoskopem zavedeným v pochvě trokaru s balonkem. Balonek je ponechán nafouknutý po dobu 5 minut z důvodu zabezpečení adekvátní hemostázy. Po desuflaci a odstranění balonového katétru je zaveden 12 mm trokar (Hassonův trokar) a fixován vzduchotěsným matracovým stehem a připojen k insuflátoru (maximální tlak 15 mm Hg). Poté je možné zavést pracovní trokary podobně jako u transperitoneálního přístupu.
Disekce prstem
Ukazovák je zaveden incizí v suprapubické oblasti. Digitální disekce umožňuje adekvátní expozici Retziova prostoru. Poté jsou za pohmatové kontroly zavedeny trokary (např. 10mm pod pupkem, 5mm pararektálně).
Extraperitoneální přístup do pánve umožňuje přímý přístup k pánevním orgánům, ale má nevýhodu malého pracovního prostoru.
2.5 Řešení komplikací [7-14]
2.5.1 Úvod (tab. 2.1-2.5)
Tab. 2.1. Frekvence výskytu komplikací při různých laparoskopických operacích s pomocí kombinovaných údajů ze 4 laparoskopických center. 
Tab. 2.2. Incidence komplikací v souvislosti s obtížností 10 nejčastějších laparoskopických operací uvedených v tab. 2.1 [7]. ![Tab. 2.2. Incidence komplikací v souvislosti s obtížností 10 nejčastějších laparoskopických operací uvedených v tab. 2.1 [7].](https://pl-master.mdcdn.cz/media/image/42760c7fbfdf1959b7404098ff0975e2.png?version=1537793664)
Tab. 2.3. Komplikace 2047 laparoskopických operací provedených ve 4 laparoskopických centrech v Německu [7]. ![Tab. 2.3. Komplikace 2047 laparoskopických operací provedených ve 4 laparoskopických centrech v Německu [7].](https://pl-master.mdcdn.cz/media/image/492b9b0a3c6d3a4f5cf98c383119e5b0.png?version=1537793787)
Tab. 2.4. Frekvence komplikací spojených s různými kroky laparoskopické operace, které se objevily u 2047 operací [7]. ![Tab. 2.4. Frekvence komplikací spojených s různými kroky laparoskopické operace, které se objevily u 2047 operací [7].](https://pl-master.mdcdn.cz/media/image/5604e3bef02ea39e8899b34071069154.png?version=1537794061)
Tab. 2.5. Nejčastější komplikace při urologické laparoskopii a metody jejich prevence. 
Procento komplikací závisí na složitosti operace a zkušenosti operatéra a pohybuje se v rozmezí 0,8 % až 13,6 %. Je třeba zdůraznit, že ve srovnávacích studiích se procento výskytu komplikací nelišilo od odpovídajících otevřených operací. V každém případě je třeba zabránit výskytu komplikací důkladným naplánováním výkonu.
2.5.2 Zavedení trokarů
Abychom předešli komplikacím způsobeným zaváděním trokaru, je důležité standardizovat užívané přístupové techniky, a transperitoneální nebo retroperitoneální. Zatímco retroperitoneoskopie je velmi vzácně spojena s komplikacemi během zavádění trokarů, transperitoneální přístup přináší některá specifická rizika. Předoperační ultrazvukové vyšetření horní části břicha může poskytnout informaci týkající se velikosti jater a sleziny, a může také ukázat možné adheze mezi střevem a břišní stěnou. V případě podezření na adheze mezi střevem a břišní stěnou (např. po operaci nebo kvůli hnisavým procesům v břiše) by měl být přístup nad a laterálně od pupku.
Po zavedení Veressovy jehly do dutiny břišní by se měla špička jehly pohybovat zcela volně.
Pokud zaznamenáme následující, je třeba vzít v úvahu podezření poranění:
- aspirace intestinální nebo gastrické tekutiny nebo krve
- intraabdominální tlak při nízkém průtoku plynu přesáhne 15 mm Hg.
V obou situacích je třeba upravit polohu Veressovy jehly, pokud dále přetrvává podezření z perforace, měla by být provedena laparotomie. Případně musí být po vytvoření pneumoperitonea a zavedení optického trokaru podezření na perforaci vyloučeno důkladným prohlédnutím místa zavedení trokaru.
Pokud je diagnostikována perforace velkých cév, je nezbytné okamžité provedení laparotomie. Je mnohem obtíž-nější detekovat poranění střeva nebo žaludku. Zavedení prvního trokaru se obvykle provádí naslepo incizí provedenou Veressovou jehlou v oblasti pupku. Z tohoto důvodu se doporučuje použití trokaru s bezpečnostním krytem pro minimalizaci rizika poranění. Další pracovní trokary jsou zavedeny stěnou břišní pod laparoskopickou kontrolou s pomocí transiluminace.
Trokary vybavené mechanizmem ochranného krytu jsou designovány pro zabránění poranění cév a nitrobřišních orgánů. Neposkytují však záruku úplné bezpečnosti. Adheze mezi orgány dutiny břišní a anteriorní abdominální stěnou zvyšují riziko poranění způsobeného prvním trokarem. V této situaci by měla být provedena technika otevřeným přístupem (např. Hassonův trokar) nebo použit 2mm jehlový endoskop.
Ke konci výkonu by měly být všechny instrumenty pečlivě zkontrolovány, zda jsou v pořádku a nepoškozené.
Po ukončení laparoskopické operace by měly být všechny trokary odstraněny pod přímou zrakovou kontrolou. Rána může být poté uzavřena pod laparoskopickou kontrolou sešitím fascie a následným uzavřením kůže. Pokud není provedeno uzavření fascie v místech zavedení 10mm trokaru, může dojít ke vzniku hernie.
2.5.3 Insuflace oxidem uhličitým
Insuflace oxidem uhličitým (CO2) vyžadovaná pro udržení pneumoperitonea, způsobí částečnou absorpci použitého plynu pacientem při operaci. To vede ke zvýšení arteriálního parciálního tlaku a parciálního tlaku CO2 při konci výdechu. Dojde také k poklesu pH krve. Anesteziolog může ovlivnit tuto situaci zvýšením ventilace, zatímco operatér může aplikovat CO2 šetrně. Nižší intraabdominální tlak (např. 10–12 mm Hg) vede k nižšímu procentu absorpce CO2. Vzhledem k tomu, že se procento absorpce CO2 zvyšuje spolu s dobou trvání výkonu, je také důležitá doba trvání operace.
Zejména u obézních pacientů se může vyskytnout kožní emfyzém způsobený insuflovaným CO2 v závislosti na délce trvání operace. Tento emfyzém je rychle resorbován během několika hodin po operaci. Avšak absorpce CO2 může způsobit další narušení srdeční a pulmonární funkce u pacientů se závažnou srdeční nedostatečností nebo poruchami pulmonární funkce. U těchto pacientů by měl být laparoskopický přístup hodnocen v souvislosti s benefity a riziky pro pacienta.
2.5.4 Vaskulární poranění
Vaskulární poranění je nejčastějším poraněním, k němuž dochází při urologických laparoskopických operacích. Nepředvídatelné krvácení se může objevit v kterékoliv fázi laparoskopické operace, stejně jako u otevřené operace. Ovšem při laparoskopické operaci je mnohem obtížnější kontrolovat zdroj krvácení. Prevence krvácení pomocí pečlivé preparace je tedy hlavní prioritou u laparoskopické operace.
Krvácení z cév v břišní stěně, způsobené buï zavedením Veressovy jehly nebo optického trokaru může být obvykle kontrolováno koagulací portu druhým trokarem nebo použitím cirkulární sutury pro uzavření krvácejících cév a portu trokarem.
Během zavádění pracovních trokarů bychom měli zabránit poranění větších cév pomocí transiluminační a laparoskopicky kontrolované techniky. Poškození epigastrických cév v dolní části břicha lze zabránit vyhnutím se oblasti, v níž se nalézají.
Vždy je lepší raději kontrolovat poranění cévy pomocí svorky nebo sutury než extenzivní endokoagulací.
Poranění velkých abdominálních cév vede k rozsáhlému krvácení. Ve většině případů by tedy měla být provedena okamžitá laparotomie.
2.5.5 Poranění orgánů
Poranění orgánů způsobené při laparoskopických operacích může postihnout všechny intraabdominální a retroperitoneální orgány. Vedle komplikací způsobených krvácením poraněných orgánů tvoří nejzávažnější potenciál komplikací u laparoskopických výkonů. Frekvence perforace orgánů se pohybuje v rozmezí od 0,3 % do 1,5 %. K viscerálním lézím dochází častěji při transperitoneálním přístupu než při retroperitoneoskopii.
Existuje několik cest způsobujících poškození orgánů, kdy hlavními příčinami je přímé poranění instrumenty a důsledky koagulace užívané při hemostáze. Před užitím je nutné zkontrolovat, zda všechny instrumenty používané při výkonu mají intaktní izolaci. Pokud je to možné, raději se doporučuje užití bipolární ultrazvukové nebo radiofrekvenční koagulace než monopolární koagulace.
Pokud je detekována léze orgánu, ke které došlo během operace, musí operatér rozhodnout, zda je pro korekci léze lepší volbou laparoskopická nebo otevřená operace. Nebezpečí způsobené poraněním může být obvykle omezeno okamžitou vhodnou léčbou. Léze, které nebyly detekovány během operace, jsou obvykle závažnější a prokáží se po latentním období 2–3 dnů.
2.6 Speciální trénink
Existují publikované důkazy, které potvrzují koncept, že předtím, než dojde k plateu v incidenci komplikací, je nezbytné provedení 50 laparoskopických operací. Proto by se neměl operatér do této doby považovat za odborníka na laparoskopii. Pacienti by také měli být informováni o počtu speciálních výkonů, které již operatér provedl, a o malém, ale přesto možném riziku přechodu k otevřené operaci (méně než 5 %) a vzácných, ovšem život ohrožujících komplikacích vážného vaskulárního poškození (0,2 %), poranění střev (0,2 %) a embolii CO2 (0,1 %), které mohou vyžadovat akutní operaci.
Trénink je vyžadován u lékařů všech úrovní znalostí a doporučuje se, aby všichni urologové prodělali progresivní sérii kurzů. Doufáme, že všichni endourologové zváží absolvování kurzu A (tab. 2.6). Složitější výkony, zejména ty, které zahrnují rekonstrukci, jsou obtížné a vyžadují absolvování teoretických i praktických kurzů a jistý stupeň přirozeného vnímání.
Tab. 2.6. Standardizované výcvikové kurzy laparoskopie a retroperitoneoskopie v urologii. 
2.7 Skórovací systém obtížnosti laparoskopických výkonů [15]
Skóre v jakékoliv oblasti byly vždy předmětem kontroverze a diskuze, a ani toto skóre není výjimkou. Avšak může sloužit jako základ pro diskusi, tento návrh jistě není bez významu.
Je důležité zdůraznit, že navrhované skóre je pouze prostředkem klasifikace učební křivky. Poskytuje začátečníkovi v laparoskopii celou škálu zlepšení a perspektivu progrese. Není designováno pro klasifikaci lékařů. Naštěstí není operace pouze technickou procedurou, ale přesto je operační výkon důležitou částí chirurgie.
2.7.1 Kritéria
Technická obtížnost. Prvním kritériem je zjevně technická obtížnost, neb co může být odlišnějšího než ligace spermatické žíly u varikokély a pyeloplastika s resekční suturou podle Küsse, kdy musí být operatér zručný v provádění laparoskopické sutury, pokračovací a jednotlivé sutury a musí být schopen provádět funkční operaci, jejíž konečný výsledek bude hodnocen z dlouhodobého hlediska.
Technická obtížnost je hodnocena od 1 do 7. Skóre 1 odpovídá technické obtížnosti diagnostické laparoskopie nehmatných varlat, skóre 7 odpovídá nejvyšší technické obtížnosti (např. radikální prostatektomie).
Operační rizika [7,13]. Druhé hodnotící kritérium se týká operačního rizika spojeného s jistým stupněm nebezpečí při operaci. Operace mírně engaged je výkon spojený s minimálním rizikem mortality, kdy lze snadno provádět konverzi, bez rizika pro pacienta a bez ohrožení konečného výsledku operace. Pyeloplastika je mírně engaged operací s nízkým rizikem, vzhledem k tomu, že v případě technických obtíží, umožňuje konverzi k běžnému otevřenému přístupu a umožňuje, aby bylo dosaženo cíle (rekonstrukce ureteropelvické junkce). Proto zde existuje pro operatéra „úniková cesta“, aniž by byl ohrožen konečný výsledek operace.
Naopak operace je engaged s vysokým rizikem, pokud může špatně provedený výkon nebo určitá anatomická či patologická situace způsobit smrt pacienta. Proto tedy operace zahrnující cévy (prostá nebo radikální nefrektomie, lumboaortická lymfadenektomie etc) patří k operacím s vysokým rizikem, nebo poškození velkých cév (iliakálních cév, vena cava nebo aorty) může způsobit extrémně těžkou morbiditu nebo dokonce smrt pacienta, i pokud rychle rozhodneme o konverzi. Tento stupeň engagement je hodnocen na škále od 1 do 7. Skóre 1 odpovídá minimálnímu engagement (např. řešení varikokély), zatímco stupeň 7 odpovídá lumboaortické lymfadenektomii reziduálních mas po chemoterapii neseminomatózního tumoru z germinálních buněk.
Charakter operace. Třetí (a nejsubjektivnější) kritérium hodnotí charakter operace (tj. stupeň pozornosti a koncentrace vyžadované při operaci). Některé operace, jako například radikální prostatektomie, vyžadují permanentní pozornost kvůli existenci technických obtíží a/nebo operačního rizika při každém kroku výkonu, zatímco jiné operace, jako například adrenalektomie, zůstávají „obtížné“ pouze po omezenou dobu, dokud není identifikována renální stopka a zaklipována adrenální žíla. Charakter operace se boduje na stupnici od 1 do 7.
2.7.2 Skórovací systém
Každé urologické operaci je uděleno celkové skóre, které je součtem jednotlivých skóre udělených různým kritériím - technické obtížnosti, operačnímu riziku a udržitelné pozornosti, kdy je každé kritérium hodnoceno od 1 do 7 (tab. 2.7). Celkové skóre těchto 3 kritérií je poté užito pro klasifikaci každé operace dle jednoho ze 6 stoupajících stupňů celkové obtížnosti (tab. 2.8). Byly popsány pouze operace prováděné v současné době a akceptované v urologické komunitě, dle osobních zkušeností EAU Laparoscopic Working Group a na základě mezinárodních údajů.
Tab. 2.7. Klasifikace a obtížnost laparoskopické operace. 
Tab. 2.8. Skóre nejčastěji prováděných laparoskopických operací podle jejich technické obtížnosti, operačního rizika a stupně pozornosti (každé kritérium je skórované od 1 do 7). Ke klasifikaci každé operace je použit součet 3 kritérií podle zvyšujícího se stupně obtížnosti. 
E (snadné) - SD (mírně obtížné) - FD (spíše obtížné) - D (obtížné) - VD (velmi obtížné) - ED (extrémně obtížné) 2.8 Literatura
1. Janetschek G, Rassweiler J, Gill IS. Laparoscopic Surgery in Urology. Stuttgart, New York: Thieme 1996.
2. Rassweiler J, Fornara P, Weber M, Janetschek G, Fahlenkamp D, Henkel T, Beer M, Stackl W, Boeckmann W, Recker F, Lampel A, Fischer C, Humke U, Miller K. Laparoscopic nephrectomy: the experience of the laparoscopic working group of the German Urological Association. J Urol 1998; 160 : 18-21.
3. Eden CG. Extraperitoneal Laparoscopic Surgery. Oxford: Blackwell, 1997.
4. Rassweiler J, Stock C, Frede T, Seemann O, Alken P. Organ retrieval systems for endoscopic nephrectomy: a comparative study. J Endourol 1998; 12 : 325-333.
5. Gill IS, Rassweiler JJ. Retroperitoneoscopic renal surgery: our approach. Urology 1999; 54 : 734-738.
6. Gill IS, Albala DM, Aso Y, Chiu AW, Clayman RV, Das S, Donovan JF, Fuchs G J, Gaur DD, Go H, Gomella LG, Grune MT, Harewood LM, Janetschek G, Knapp PM, McDougall EM, Nakada SY, Preminger GM, Puppo P, Rassweiler JJ, Royce PL, Thomas R, Urban DA, Winfield HN. Retroperitoneal and pelvic extraperitoneal laparoscopy: an international perspective. Urology 1998; 52 : 566-571.
7. Fahlenkamp D, Rassweiler J, Fornara P, Frede T, Loening SA. Complications of laparoscopic procedures in urology: Experience with 2,407 procedures at 4 German centers. J Urol 1999; 162 : 765-771.
8. Gill IS, Kavoussi LR, Clayman RV, Ehrlich R, Evans R, Fuchs G, Gerham A, Hulbert JC, McDougall EM, Rosenthal T, Schuessler WW, Shepard T. Complications of Laparoscopic Nephrectomy in 185 Patients. New York: Raven 1994 : 257-266.
9. Griffith D, Wong HY, H'Doubler WZ. Laparoscopy: lasers and electrosurgery. In: Janetschek G, Rassweiler J, Griffith D. (eds.) Laparoscopic Surgery in Urology. Stuttgart, New York: Thieme 1996 : 33-39.
10. Kavoussi LR, Sosa E, Chandhoke P, Chodak G, Clayman RV, Hadley HR, Loughlin KR, Ruckle HC, Rukstalis D, Schuessler W, Segura J, Vancaille T, Winfield HN. Complications of laparoscopic pelvic lymph node dissection. J Urol 1993; 149 : 322-325.
11. Odell RC. Laparoscopic electrosurgical issues: problems and solutions. In: Gomella LG, Kozminski M, Winfield HN. (eds.) Laparoscopic Urologic Surgery. New York: Raven 1994 : 257-266.
12. Raatz D. Gynecological laparoscopy: complications in 23,000 laparoscopies - analysis, frequency, and management. In: Fahlenkamp D, Loening SA, Winfield HN. (eds.) Advances in Laparoscopic Urology. Oxford: Blackwell 1995 : 166-174.
13. Rassweiler JJ, Seemann O, Frede T, Henkel TO, Alken P. Retroperitoneoscopy: experience with 200 cases. J Urol 1998; 160 : 1265-1269.
14. Semm K. Pelviscopic surgery. In: Janetschek G, Rassweiler J, Griffith D. (eds.) Laparoscopic Surgery in Urology. Stuttgart, New York: Thieme 1996 : 256-265.
15. Guilloneau B. The difficulty scoring system of laparoscopic procedures. Progres en Urologie 1999; 9 : 993-995.
16. Enquist EG, Stratakis CA, Rushton HG, Walther MM. Laparoscopic diagnosis and clinical management of a solitary nonpalpable cryptorchid testicle in a postpubertal male. J Urol 2000; 163 : 959-960.
17. Radmayr C, Corvin S, Studen M, Bartsch G, Janetschek G. Cryptorchidism, open processus vaginalis, and associated hernia: laparoscopic approach to the internal inguinal ring. Eur Urol 1999; 36 : 631-634.
18. Lindgren BW, Franco I, Blick S, Levitt SB, Brock WA, Palmer LS, Friedman SC, Reda EF. Laparoscopic Fowler-Stephens orchiopexy for the high abdominal testis. J Urol 1999; 162 : 990-994.
19. Mandressi A, Buizza C, Antonelli D, Chisena S. Is laparoscopy a worthy method to treat varicocele? Comparison between 160 cases of two-port laparoscopic and 120 cases of open inguinal spermatic vein ligation. J Endourol 1996; 10 : 435-441.
20. Jahnsen JU, Solhaug JH. Extirpation of benign renal cysts with laparoscopic technique. Tidsskr Nor Laegeforen 1992; 112 : 3552-3554.
21. Keeley FX, Gialas I, Pillai M, Chrisofos M, Tolley DA. Laparoscopic ureterolithotomy: the Edinburgh experience. BJU Int 1999; 84 : 765-769.
22. Doublet J, Belair G. Retroperitoneal laparoscopic nephrectomy is safe and effective in obese patients: a comparative study of 55 procedures. Urology 2000; 56 : 63-66.
23. Thompson GB, Grant CS, Van Heerden JA, Schlinkert RT, Young WF Jr, Farley DR, Ilstrup DM. Laparoscopic versus open posterior adrenalectomy: a case-control study of 100 patients. Surgery 1997; 122 : 1132-1136.
24. Gasman D, Droupy S, Koutani A, Salomon L, Antiphon P, Chassagnon J, Chopin DK, Abbou CC. Laparoscopic adrenalectomy: the retroperitoneal approach. J Urol 1998; 159 : 1816-1820.
25. Mancini F, Mutter D, Peix JL, Chapuis Y, Henry JF, Proye C, Cougard P, Marescaux J. Experiences with adrenalectomy in 1997. Apropos of 247 cases. A multicenter prospective study of the French-speaking Association of Endocrine Surgery. Chirurgie 1999; 124 : 368-374.
26. Suzuki K, Ushiyama T, Ihara H, Kageyama S, Mugiya S, Fujita K. Complications of laparoscopic adrenalectomy in 75 patients treated by the same surgeon. Eur Urol 1999; 36 : 40-47.
27. Rassweiler J, Coptcoat M, Frede T. Laparoscopic radical nephrectomy and nephroureterectomy for treatment of renal cell and transitional cell carcinoma: Current status. Urol Integr Invest 1999; 4 : 225-237.
28. Hobart MG, Gill IS, Schweizer D, Sung GT, Bravo EL. Laparoscopic adrenalectomy for large-volume (> or = 5 cm) adrenal masses. J Endourol 2000; 14 : 149-154.
29. Puppo P, Perachino M, Ricciotti G, Bozzo W, Pezzica C. Retroperitoneoscopic treatment of ureteropelvic junction obstruction. Eur Urol 1997; 31 : 204-208.
30. Chen RN, Moore RG, Kavoussi LR. Laparoscopic pyeloplasty. Indications, technique, and long-term outcome. Urol Clin North Am 1998; 25 : 323-330.
31. Janetschek G, Daffner P, Peschel R, Bartsch G. Laparoscopic nephron sparing surgery for small renal cell carcinoma. J Urol 1998; 159 : 1152-1155.
32. Janetschek G, Jeschke K, Peschel R, Strohmeyer D, Henning K, Bartsch G. Laparoscopic surgery for stage T1 renal cell carcinoma: radical nephrectomy and wedge resection. Eur Urol 2000; 38 : 131-138.
33. Cadeddu JA, Ono Y, Clayman RV, Barrett PH, Janetschek G, Fentie DD, McDougall EM, Moore RG, Kinukawa T, Elbahnasy AM, Nelson JB, Kavoussi LR. Laparoscopic nephrectomy for renal cell cancer: evaluation of efficacy and safety: a multicenter experience. Urology 1998; 52 : 773-777.
34. Dunn MD, Portis AJ, Shalhav AL, Elbahnasy AM, Heidom C, McDougall EM, Clayman RV. Laparoscopic versus open radical nephrectomy: a 9-year experience. J Urol 2000; 164 : 1153-1159.
35. Rassweiler JJ, Seemann O, Henkel TO, Stock C, Frede T, Alken P. Laparoscopic retroperitoneal lymph node dissection for nonseminomatous germ cell tumors: indications and limitations. J Urol 1996; 156 : 1108-1113.
36. Janetschek G, Hobisch A, Peschel R, Hittmair A, Bartsch G. Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous testicular carcinoma: long-term outcome. J Urol 2000; 163 : 1793-1796.
37. Rassweiler JJ, Frede T, Lenz E, Seemann O, Alken P. Long-term experience with laparoscopic retroperitoneal lymph node dissection in the management of low-stage testis cancer. Eur Urol 2000; 37 : 251-260.
38. Leventhal JR, Deeik RK, Joehl RJ, Rege RV, Herman CH, Fryer JP, Kaufman D, Abecassis M, Stuart FP. Laparoscopic live donor nephrectomy - is it safe? Transplantation 2000; 70 : 602-606.
39. Jacobs SC, Cho E, Dunkin BJ, Flowers JL, Schweiter E, Cangro C, Fink J, Farney A, Philosophe B, Jarrel B, Bartlett ST. Laparoscopic live donor nephrectomy: the University of Maryland 3-year experience. J Urol 2000; 164 : 1494-1499.
40. Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris technique. J Urol 2000; 163 : 1643-1649.
41. Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris experience. J Urol 2000; 163 : 418-422.
42. Abbou CC, Salomon L, Hoznek A, Antiphon P, Cicco A, Saint F, Alame W, Bellot J, Chopin DK. Laparoscopic radical prostatectomy: preliminary results. Urology 2000; 55 : 630-634.
3. LAPAROSKOPICKÉ OPERACE
3.1 Adrenalektomie
Již od počátků laparoskopie poskytovala laparoskopická adrenalektomie opravdu výhodný přístup, při kterém se vyhneme provedení velké incize a extenzivní manipulaci s orgány při odstraňování malých žláz [1-8]. Transperitoneální i retroperitoneoskopický přístup se osvědčily jako efektivní. Ve skutečnosti je již po několika letech klinické zkušenosti [9-14] laparoskopie považována ve srovnání s otevřenou operací za minimálně invazivní přístup, se stejnou úspěšností i bezpečností při odstraňování nadledvin [15-19]. Po komparativní zkušenosti z multicentrických studií [20-21] bylo prokázáno, že laparoskopická adrenalektomie je proveditelná a bezpečná s nízkým poměrem ceny vzhledem k benefitu, bez ohledu na patologický nález. Pouze řešení velkých tumorů (> 6 cm) je stále ve stadiu výzkumu [14].
Z důvodu odlišné anatomie levé nadledviny od nadledviny pravé je retroperitoneální přístup považován jako přístup volby u levé nadledviny. Přístup pro odstranění pravé nadledviny je volitelný a závisí na preferenci operatéra a jeho zkušeností s použitou technikou [17].
Provedení parciální adrenalektomie je možné, pokud byl již předtím vyšetřen patologický nález léze.
Souhrn současných doporučení pro adrenalektomii je uveden v tab. 3.1.
Tab. 3.1. Adrenalektomie: doporučení. 
3.2 Kolposuspenze
Ve 2 randomizovaných studiích srovnávajících laparoskopickou a otevřenou kolposuspenzi nebyly výsledky konzistentní. Ve studii provedené Fatthym et al (2001) bylo po 18 měsících procento úspěšnosti 88 % ve skupině, kde byla prováděna laparoskopie, a 85 % ve skupině, kde byla prováděna otevřená operace [22]. Ztráta krve byla menší a doba hospitalizace po operaci a doba do návratu do zaměstnání byla významně kratší ve skupině, u níž byla provedena laparoskopie. Ve studii provedené Su et al (1997) byla po 3 měsících úspěšnost 80 % ve skupině s laparoskopií a 96 % ve skupině s otevřenou operací [23]. Proto nelze prokázat nadřazenost laparoskopické operace. Navíc byl počet pacientů v těchto studiích příliš malý.
Na druhou stranu existují čtyři nerandomizované studie, v nichž jsou zaznamenány výsledky srovnatelné v obou větvích [24-27]. Menší pooperační bolest, kratší doba hospitalizace a kratší rekonvalescence jsou zaznamenány ve skupině, kde byl prováděn laparoskopický výkon, ale design těchto studií neumožňuje vyvozovat jakékoliv vědecké závěry.
V záznamech studií [28-47] byl hodnocen transperitoneální i extraperitoneální přístup. Persson prokázal, že dva stehy na každé straně vedou k lepšímu výsledku než pouze jeden [32]. V těchto studiích byl počet léčených pacientů velmi proměnlivý, v rozmezí od méně než 25 pacientů v 11 studiích do více než 50 pacientů v 7 studiích. Parametry úspěšnosti uvedené v přehledných sděleních [48-58] jsou uvedeny v tab. 3.2.
Tab. 3.2. Kolposuspenze: parametry úspěšnosti [48-58]. ![Tab. 3.2. Kolposuspenze: parametry úspěšnosti [48-58].](https://pl-master.mdcdn.cz/media/image/c054b09832690384e1488585c6443058.png?version=1537796389)
Bohužel, na základě vědeckých kritérií je úspěšnost otevřené operace při stresové inkontinenci sama o sobě diskutabilní, přestože je zde tendence považovat Burchovu metodu za srovnávací parametr. Navíc zde také existuje konkurence mezi prováděním laparoskopické operace a dalšími minimálně invazivními procedurami, např. tension free vaginal tape (TVT), přičemž druhá metoda je zřejmě mnohem snazší pro naučení. Proto je velmi obtížné i v budoucnosti provádět prospektivní komparativní studie.
Přehled současných doporučení pro kolposuspenzi je uveden v tab. 3.3.
Tab. 3.3. Kolposuspenze: doporučení. 
3.3 Léčba kryptorchizmu
Po časném laparoskopickém diagnostikování nehmatných varlat [59] si získala na popularitě laparoskopická orchidopexe nesestouplých varlat. Podle polohy nesestouplých varlat je provedena primární laparoskopická orchidopexe nebo dvoufázová Fowler-Stephensova technika [60]. Fázová technika může být prováděna buï úplně laparoskopicky nebo první fáze laparoskopicky a druhá otevřenou operací [61].
Minimální doporučený interval mezi oběma fázemi je 6 měsíců. Vzhledem k rozsahu mobilizace, která může být provedena při laparoskopii, může být primární orchidopexe prováděna u nesestouplých varlat až 3,5 cm nad vnitřním ingvinálním prstencem [62].
Procento úspěšnosti (skrotální poloha varlete a absence atrofie) laparoskopické orchidopexe je v několika studiích 3 až 13 pacientů téměř 100 %, s dobou sledování pohybující se v rozmezí od 3 do 18 měsíců [61,63-65].
Laparoskopie se v současné době doporučuje pro léčbu nesestouplých varlat [66-71]. Avšak pro hodnocení růstu varlat po různých operacích je nutné provedení dlouhodobých studií.
Současná doporučení pro laparoskopickou léčbu kryptorchizmu jsou uvedena v tab. 3.4.
Tab. 3.4. Léčba kryptorchizmu: doporučení. 
3.4 Rekonstrukce hernie
Úspěšnost otevřené hernioplastiky (Lichenstein) je indikována téměř absencí recidivy [72-76]. Podobných výsledků je dosaženo laparoskopickou operací, která je založena na stejném principu [77-86]. Avšak výsledky laparoskopie jsou stále ovlivněny procesem učení se operaci. Ve všech studiích fáze III nebyly zjištěny žádné nevýhody laparoskopického přístupu, byl spojen s menší bolestivostí a kratší dobou rekonvalescence ve srovnání s otevřenou hernioplastikou [87-93]. Co se týče řešení recidivující nebo bilaterální hernie, je laparoskopie lepší než otevřená hernioplastika. Další výhodou jsou dobré socioekonomické aspekty rekonstrukce hernie prováděné laparoskopicky [94].
Současná doporučení pro rekonstrukci hernie jsou uvedena v tab. 3.5.
Tab. 3.5. Rekonstrukce hernie: doporučení. 
3.5 Nefrektomie
Mezi počátečními pokusy provádět urologické výkony laparoskopicky je transperitoneální nefrektomie milníkem [95]. Po počátečních úspěších byly pro laparoskopické odstranění ledviny vytvořeny retroperitoneální přístupy [6, 96]. Výzkumné práce se rychle rozšiřovaly, podníceny těmito počátečními zkušenostmi, umožňujícími urologům s praxí v laparoskopii bezpečně rozšířit indikace pro laparoskopické odstranění ledvin trans - nebo retroperitoneální cestou.
3.5.1 Jednoduchá nefrektomie (u benigních onemocnění) (tab. 3.6)
Tab. 3.6. Prostá nefrektomie: doporučení. 
Laparoskopická nefrektomie je bezpečnou alternativou k otevřené nefrektomii pro odstranění nefunkčních ledvin u benigních onemocnění, s nižší morbiditou a kratší dobou hospitalizace [71,97, 98]. Navíc laparoskopická nefrektomie nabízí lepší kosmetický výsledek, je také cenově výhodnější a nabízí výhody s ohledem na dobu hospitalizace a dobu do návratu k normálním aktivitám. Její provedení je bezpečné i u dětí [99,100]. Procento komplikací závisí na patologickém nálezu postihujícím ledvinu, která má být odstraněna: stav po zánětu má vyšší procento komplikací a konverze [101,102]. Bilaterální nefrektomii jako přípravu na transplantaci ledviny je vhodné provést laparoskopickým přístupem [103].
Užití trans - nebo retroperitoneálního přístupu je otázkou preference operatéra. Přestože definitivní odpověï týkající se výhod a nevýhod obou cest vyžaduje výsledky randomizovaných studií, zdá se, že retroperitoneální laparoskopie je spojena s kratší operační dobou, nižším procentem konverze a kratší dobou hospitalizace [104-106].
3.5.2 Radikální nefrektomie (tab. 3.7)
Tab. 3.7. Radikální nefrektomie: doporučení. 
Laparoskopická radikální nefrektomie se stále provádí v několika centrech po celém světě: operace je obtížná vzhledem k nutnosti odstranění intaktních vzorků a rozsahu. Avšak pouze u tumorů v nižším stadiu (T1-T2) jsou technické výsledky srovnatelné s otevřenou radikální nefrektomií s výhodami minimální invazivity, tj. nízkou morbiditou a vysokou operační úspěšností [107-112]. Výhody laparoskopické nefrektomie byly potvrzeny ve velkých studiích [111-113]. Lze ji provádět trans - i retroperitoneální cestou s nebo bez pomoci ruky. U žádné z cest nebyly demonstrovány jasné výhody, kromě kratší doby operace a doby hospitalizace [107] při retroperitoneálním přístupu, který umožňuje časnou ligaci cévního zásobení ledviny [111]. V jednom případě byla zaznamenána metastáza v místě portu [109], ledvina byla morcelována před odstraněním. Avšak doba sledování je pro potvrzení platnosti laparoskopické radikální nefrektomie jako úspěšné léčby renálního karcinomu stále příliš krátká [114,115], nicméně procento přežití bez onemocnění při střednědobém sledování je srovnatelné s otevřenou operací [113] u T1 a T2 tumorů.
3.5.3 Parciální nefrektomie (tab. 3.8)
Tab. 3.8. Parciální nefrektomie: doporučení. 
Je to zavedená operace u benigních onemocnění, ale je technicky obtížná. Při odstraňování malých renálních tumorů (< 3 cm) je výkon technicky velmi náročný, a je stále experimentální a ještě není standardizován. Byly zaznamenány pouze menší sestavy bez dlouhodobého sledování [111,112,116-119]. Proto se nedoporučuje ji používat v běžné klinické praxi a měla by se provádět pouze v kontrolovaných prospektivních studiích.
3.5.4 Nefroureterektomie (tab. 3.9)
Tab. 3.9. Nefroureterektomie: doporučení. 
Stejně jako prostá nefrektomie je laparoskopická nefroureterektomie zavedenou metodou u benigních onemocnění, tj. odstraňování nefunkční ledviny a ureteru pro ureterohydronefrózu.
Na druhou stranu je laparoskopická nefroureterektomie pro karcinom z přechodných buněk (TCC) horních cest močových technicky náročná, i když proveditelná, ovšem s povinnou technickou podmínkou - vývodný systém by neměl být během operace otevřen [120]. Pro tento účel umožňuje transperitoneální přístup sestupné odstranění ledviny a ureteru „en bloc“ spolu s manžetou močového měchýře. Doporučuje se extrafasciální nefrektomie se zachováním nadledviny [121,122]. Laparoskopický přístup má výhody oproti otevřené operaci (nižší morbidita, kratší doba hospitalizace, lepší kosmetické výsledky) [123]. Avšak z onkologického hlediska zůstává stále kontroverzní. TCC má vysokou frekvenci implantačních metastáz, navíc byly při nefroureterektomii pro TCC horních cest močových zaznamenány metastázy v místě portu [124-135]. Vzhledem k nízkému počtu případů není možno z výsledků dělat závěry. Dobré dlouhodobé výsledky byly zaznamenány pouze u tumorů v nízkém stadiu a jsou podobné výsledkům získaným otevřenou operací.
3.5.5 Nefrektomie u živého dárce (tab. 3.10)
Tab. 3.10. Nefrektomie u živého dárce: doporučení. 
Laparoskopická nefrektomie u živého dárce je proveditelná a představuje alternativu k otevřené operaci, pokud je prováděna v transplantačních centrech zkušeným a školeným laparoskopistou [136-140]. Ve skutečnosti bylo pouze ve 2 centrech provedeno více než 500 operací [141,142].
Všechny komparativní studie, stejně jako retrospektivní analýza literatury (N = 738 laparoskopických versus 3502 nefrektomií provedených otevřenou operací) neprokázaly žádnou nevýhodu laparoskopického přístupu, zatímco laparoskopická nefrektomie byla lepší s ohledem na pooperační morbiditu a rekonvalescenci dárce [143-156]. Někteří autoři se domnívají, že delší doba tepelné ischemie (1,5 versus 2,5 minut) může vést ke kratší životnosti graftu [157,158]. Jiní však dokázali, že zde neexistuje žádný vzájemný vliv [159]. Avšak nejsou k dispozici žádné dlouhodobé výsledky. Navíc je operace velmi technicky náročná a měla by být prováděna zkušeným chirurgem s dobrou laparoskopickou praxí.
3.6 Nefropexe (tab. 3.11)
Tab. 3.11. Nefropexe: doporučení. 
Laparoskopická nefropexe je operace pro léčbu symptomatické nefroptózy. Je to minimálně invazivní alternativa k otevřené nefropexi. Avšak nefropexe je indikována velmi zřídka. Z nefropexe mohou mít užitek pouze pacienti s objektivním narušením renální funkce a jasnou obstrukcí renálního výtoku. U nejasných případů (tj. pokud není jisté, že by nefropexí došlo k úlevě symptomů) může minimálně invazivní přístup, jako například laparoskopická nefropexe, poskytnout rozumné řešení z důvodu nejistoty výsledků [160-169].
3.7 Pyeloplastika (tab. 3.12)
Tab. 3.12. Pyeloplastika: doporučení. 
V přehledných publikacích je laparoskopická pyeloplastika uváděna s výsledky srovnatelnými v obou větvích [170-173]. Při laparoskopickém přístupu byla zaznamenána menší pooperační bolest, kratší doba hospitalizace a kratší rekonvalescence, ale design studií neumožňuje vyvozovat jakékoliv vědecké závěry. Většina publikací [173-190] uvádí studie s počtem méně než 25 pacientů. Doba trvání operace se pohybuje v rozmezí 89 a 300 minut a procento komplikací mezi 10 % a 25 %, s procentem úspěšnosti mezi 75 % a 100 %. Byly popsány resekční i neresekční operace [172,187], je možný transperitoneální a extraperitoneální přístup [182]. Tyto operace lze provádět i u dětí [176,179]. Avšak laparoskopická pyeloplastika je technicky náročná operace vyžadující dobrý trénink, zejména při sutuře.
Názory odborníků ukazují, že tato technika může být nabídnuta, pokud je indikována pyeloplastika, v případě, že operační tým tuto techniku perfektně ovládá. Avšak je zde konkurence mezi prováděním laparoskopické operace a dalšími méně invazivními metodami jako například endopyelotomie, přičemž druhá operace je mnohem snazší. Dlouhodobé výsledky nejsou známy.
3.8 Pánevní lymfadenektomie (tab. 3.13)
Tab. 3.13. Pánevní lymfadenektomie: doporučení. 
Laparoskopická preparace pánevních uzlin má nižší morbiditu a nižší procento komplikací než otevřená operace [191,192] se stejným výsledkem preparace jako u otevřené operace [193-196]. Velké studie ukázaly úspěšnost a bezpečnost tohoto výkonu [197-200], dokazující, že je tato operace pro určení stadia karcinomu prostaty vhodnou alternativou otevřené operace, před operací prostaty nebo radioterapií [201-214]. Klinické výsledky byly potvrzeny experimentální randomizovanou studií na prasatech [215].
3.9 Radikální prostatektomie (tab. 3.14)
Tab. 3.14. Radikální prostatektomie:doporučení. 
Laparoskopická radikální prostatektomie představovala pro vývoj laparoskopie skutečnou výzvu. Proveditelnost a bezpečnost výkonu byla demonstrována v několika studiích [216-222] a byla prováděna různými technikami (transperitoneální, extraperitoneální, sestupná, vzestupná) s podobnými technickými výsledky. Po několika letech klinických zkušeností [223-225] stále zůstává velmi náročnou operací, která vyžaduje značnou laparoskopickou zkušenost s trvalou křivkou učení. Jediná komparativní studie [226] prokázala, že onkologická kontrola laparoskopické radikální prostatektomie je podobná jako u otevřené operace. Největší studie prokázaly dobré funkční výsledky [227]. Avšak nejsou k dispozici žádné dlouhodobé údaje a doposud nebyly provedeny žádné studie fáze III. Vzhledem ke strmější učební křivce je dobrých výsledků dosaženo až po delší době speciální laparoskopické zkušenosti.
3.10 Retroperitoneální lymfadenektomie (u karcinomu varlete) (tab. 3.15)
Tab. 3.15. Retroperitoneální lymfadenektomie (u karcinomu varlete): doporučení. 
Po počáteční zkušenosti u prasat a lidí demonstrující proveditelnost techniky [228-231] představuje v dnešní době retroperitoneální lymfadenektomie první stadium testikulárního karcinomu alternativu ke sledování a chemoterapii nesoucí rizika [232-233]. Má lepší výsledky než otevřená operace s ohledem na morbiditu, má nižší procento komplikací než otevřená operace a vykazuje podobné výsledky úplnosti lymfadenektomie s dlouhodobými výsledky obdobnými jako u otevřené operace [232-244]. Klinická komparativní studie [236] potvrdila údaje experimentálních komparativních studií u prasat [242,243]. Avšak je to složitá operace, která vyžaduje dlouhou učební křivku a dobrou laparoskopickou zručnost.
Excize reziduálního tumoru po chemoterapii u testikulárního tumoru stadia II je experimentální indikací [245].
3.11 Léčba renálních cyst (tab. 3.16)
Tab. 3.16. Léčba renálních cyst: doporučení. 
Laparoskopická léčba renálních cyst představuje snadno proveditelnou minimálně invazivní operaci ve srovnání s alternativní perkutánní skleroterapií. Existuje pouze jedna komparativní studie [246], kde laparoskopické odstranění klenby renálních cyst vykazovalo 5% míru recidivy ve srovnání s 82 % u skleroterapie. Ve 3 studiích [247-249] jsou hodnoceny různé zkušenosti laparoskopické léčby renálních cyst, bohužel u malého počtu pacientů. Byly léčeny kortikální i parapelvické cysty. Indikacemi pro léčbu byly bolest a infekce. Doba operace se pohybovala v rozmezí 50 a 390 minut a míra úspěšnosti v rozmezí 50 a 100 % s do-bou sledování od 6 do 40 měsíců. Hlavními zaznamenanými komplikacemi bylo krvácení a hematomy. Doporučuje se provádět biopsii báze komplikovaných cyst a naplnit uvolněnou dutinu perirenálním tukem.
3.12 Ureterolitotomie (tab. 3.17)
Tab. 3.17. Ureterolitotomie: doporučení. 
Laparoskopická ureterolitotomie je v době litotrypse rázovými vlnami (SWL) a endourologie indikována zřídka. Několik zaznamenaných případů v literatuře představují velmi malé kontrolované nebo komparativní studie bez randomizace. Pouze jeden přehledný článek [247] hodnotí možné indikace: selhání SWL nebo endourologických metod, velké konkrementy vyžadující opakovanou SWL nebo endourologické intervence, dlouhodobě zaklíněné konkrementy, vícečetné ureterické kameny. Vzhledem k riziku úniku moči se po operaci doporučuje zavedení ureterálního stentu. Procento úspěšnosti se pohybuje mezi 90 % a 100 %, zatímco procento konverze je do 15 %.
3.13 Varikokelektomie (tab. 3.18)
Tab. 3.18. Varikokelektomie: doporučení. 
Laparoskopická ligace spermatické žíly je uváděna v počátečních studiích urologické laparoskopie [250-260]. Je to snadno proveditelný výkon, který má nízké procento komplikací (2-12 %). V kontrolovaných studiích bylo dosaženo laparoskopickou ligací spermatické žíly podobných výsledků jako otevřenou operací [261-265], zahrnující 24–47% výskyt gravidity, zlepšení koncentrace spermií o 27–80 %, a procento recidivy 1–20 %. Průměrná doba operace je delší při otevřené operaci (10–170 minut). Přestože poskytuje alternativu k Palomově technice, je dražší a více invazivní, a proto je vhodná pouze pro bilaterální varikokélu.
3.14 Literatura
1. Gagner M, Lacroix A, Bolte E. Laparoscopic adrenalectomy in Cushing's syndrome and pheochromocytoma. (Letter.) N Engl J Med 1992; 327 : 1033.
2. Rassweiler JJ, Henkel TO, Potempa DM, Coptcoat M, Alken P. The technique of transperitoneal laparoscopic nephrectomy, adrenalectomy and nephroureterectomy. Eur Urol 1993; 23 : 425-430.
3. Go H, Takeda M, Takahashi H, Imai T, Tsutsui T, Mizusawa T, Nishiyama T, Morishita H, Nakajima Y, Sato S. Laparoscopic adrenalectomy for primary aldosteronism: a new operative method. J Laparoendosc Surgery 1993; 3 : 455-459.
4. Higashihara E, Tanaka Y, Horie S, Aruga S, Nutahara K, Minowada S, Aso Y. Laparoscopic adrenalectomy: the initial three cases. J Urol 1993; 149 : 973-976.
5. Suzuki K, Kageyama S, Ueda D, Ushiyama T, Kawabe K, Tajima A, Aso Y. Laparoscopic adrenalectomy: clinical experience with 12 cases. J Urol 1993; 150 : 1099-1102.
6. Mandressi A, Buizza C, Antonelli D, Belloni M, Chisena S, Zaroli A, Bernasconi S. Retro-extraperitoneal laparoscopic approach to excise retroperitoneal organs: kidney and adrenal gland. Min Inv Ther 1993; 2 : 213-220.
7. Rassweiler J, Henkel TO, Stock C, Greschner M, Becker P, Preminger GM, Schulman CC, Frede T, Alken P. Retroperitoneal laparoscopic nephrectomy and other procedures in the upper retroperitoneum using a balloon dissection technique. Eur Urol 1994; 25 : 229-236.
8. Mandressi, A, Buizza C, Antonelli D, Chisena S, Servadio G. Retroperitoneoscopy. Ann Urol 1995; 29 : 91-96.
9. Guazzoni G, Montorsi F, Bocciardi A, Da Pozzo L, Rigatti P, Lanzi R, Pontiroli A. Transperitoneal laparoscopic versus open adrenalectomy for benign hyperfunctioning adrenal tumors: a comparative study. J Urol 1995; 153 : 1597-1600.
10. Suzuki K, Fujita K, Ushiyama T, Mugiya S, Kageyama S, Ishikawa A. Efficacy of an ultrasonic surgical system for laparoscopic adrenalectomy. J Urol 1995; 154 : 484-486.
11. Vargas HI, Kavoussi LR, Bartlett DL, Wagner JR, Venzon DJ, Fraker DL, Alexander HR, Linehan WM, Walther MM. Laparoscopic adrenalectomy: a new standard of care. Urology 1997; 49 : 673-678.
12. Suzuki K, Ushiyama T, Ihara H, Kageyama S, Mugiya S, Fujita K. Complications of laparoscopic adrenalectomy in 75 patients treated by the same surgeon. Eur Urol 1999; 36 : 40-47.
13. Gasman D, Droupy S, Koutani A, Salomon L, Antiphon P, Chassagnon J, Chopin DK, Abbou CC. Laparoscopic adrenalectomy: the retroperitoneal approach. J Urol 1998; 159 : 1816-1820.
14. Hobart MG, Gill IS, Schweizer D, Sung GT, Bravo EL. Laparoscopic adrenalectomy for large-volume (> or = 5 cm) adrenal masses. J Endourol 2000; 14 : 149-154.
15. Thompson GB, Grant CS, Van Heerden JA, Schlinkert RT, Young WF Jr, Farley DR, Ilstrup DM. Laparoscopic versus open posterior adrenalectomy: a case-control study of 100 patients. Surgery 1997; 122 : 1132-1136.
16. Tanaka M, Tokuda N, Koga H, Kimoto Y, Naito S. Laparoscopic adrenalectomy for pheochromocytoma: comparison with open adrenalectomy and comparison of laparoscopic surgery for pheochromocytoma versus other adrenal tumours. J Endourol 2000; 14 : 427-431.
17. Takeda M, Go H, Watanabe R, Kurumada S, Obara K, Takahashi E, Komeyama T, Imai T, Takahashi K. Retroperitoneal laparoscopic adrenalectomy for functional adrenal tumours: comparison with conventional transperitoneal laparoscopic adrenalectomy. J Urol 1997; 157 : 19-23.
18. Rayan SS, Hodin RA. Short stay laparoscopic adrenalectomy. Surg Endosc 2000; 14 : 568-572.
19. Gill IS, Hobart MG, Schweizer D, Bravo EL. Outpatient adrenalectomy. J Urol 2000; 163 : 717-720.
20. Mancini F, Mutter D, Peix JL, Chapuis Y, Henry JF, Proye C, Cougard P, Marescaux J.
Experiences with adrenalectomy in 1997. Apropos of 247 cases. A multicenter prospective study of the French-speaking Association of Endocrine Surgery. Chirurgie 1999; 124 : 368-374.
21. Terachi T, Yoshida O, Matsuda T, Orikasa S, Chiba Y, Takahashi K, Takeda M, Higashihara E, Murai M, Baba S, Fujita K, Suzuki K, Ohshima S, Ono Y, Kumazawa J, Naito S. Complications of laparoscopic and retroperitoneoscopic adrenalectomies in 370 cases in Japan: a multi-institutional study. Biomed Pharmacother 2000; 54 (Suppl 1): 211-214.
22. Fatthy H, El Hao M, Samaha I I, Abdallah K. Modified Burch colposuspension: laparoscopy versus laparotomy. J Am Assoc Gynecol Laparosc 2001; 8 : 99-106.
23. Su TH, Wang KG, Hsu CY, Wei HJ, Hong BK. Prospective comparison of laparoscopic and traditional colposuspensions in the treatment of genuine stress incontinence. Acta Obstet Gynecol Scand 1997; 76 : 576-582.
24. Saidi MH, Gallagher MS, Skop IP, Saidi JA, Sadler RK, Diaz KC. Extraperitoneal laparoscopic colposuspension: short-term cure rate, complications, and duration of hospital stay in comparison with Burch colposuspension. Obstet Gynecol 1998; 92 : 619-621.
25. Das S. Comparative outcome analysis of laparoscopic colposuspension, abdominal colposuspension and vaginal needle suspension for female urinary incontinence. J Urol 1998; 160 : 368-371.
26. Miannay E, Cosson M, Lanvin D, Querleu D, Crepin G. Comparison of open retropubic and laparoscopic colposuspension for treatment of stress urinary incontinence. Eur J Obstet Gynecol Reprod Biol 1998; 79 : 159-166.
27. Polascik TJ, Moore RG, Rosenberg MT, Kavoussi LR. Comparison of laparoscopic and open retropubic urethropexy for treatment of stress urinary incontinence. Urology 1995; 45 : 647-652.
28. Doret M, Golfier F, Raudrant D. Laparoscopic retropubic colposuspension (Burch procedure). Techniques and continence results. J Gynecol Obstet Biol Reprod (Paris) 2000; 29 : 650-654.
29. Batislam E, Germiyanoglu C, Erol D. Simplification of laparoscopic extraperitoneal colposuspension: results of two-port technique. Int Urol Nephrol 2000; 32 : 47-51.
30. Bartos P, Zelenka Z. Preperitoneal laparoscopic retropubic colposuspension in the treatment of stress incontinence: the mesh and tacker technique. Ceska Gynekol 1999; 64 : 322-325.
31. Persson J, Bossmar T, Wolner-Hanssen P. Laparoscopic colposuspension: a short term urodynamic follow-up and a three-year questionnaire-25 study. Acta Obstet Gynecol Scand 2000; 79 : 414-420.
32. Persson J, Wolner-Hanssen P. Laparoscopic Burch colposuspension for stress urinary incontinence: a randomized comparison of one or two sutures on each side of the urethra. Obstet Gynecol 2000; 95 : 151-155.
33. Lee CL, Yen CF, Wang CJ, Huang KG, Soong YK. Extraperitoneoscopic colposuspension using CO2 distension method. Int Surg 1998; 83 : 262-264.
34. Huk J, Fryczkowski M, Potyka A, Duda W, Kaletka Z. Results of intraperitoneal, laparoscopic colposuspension using Burch's method for stress incontinence in women. Wiad Lek 1998; 51 (Suppl 3): 16-19.
35. Pelosi MA, Papasakelariou C, Pelosi MA 3rd. Laparoscopic colposuspension with a transvaginal illuminator. J Am Assoc Gynecol Laparosc 1998; 5 : 179-182.
36. Ross JW. Multichannel urodynamic evaluation of laparoscopic Burch colposuspension for genuine stress incontinence. Obstet Gynecol 1998; 91 : 55-59.
37. Kohli N, Jacobs PA, Sze EH, Roat TW, Karram MM. Open compared with laparoscopic approach to Burch colposuspension: a cost analysis. Obstet Gynecol 1997; 90 : 411-415.
38. Foote AJ, Lam A. Laparoscopic colposuspension in women with previously failed anti-incontinence surgery. J Obstet Gynaecol Res 1997; 23 : 313-317.
39. Ross J. Two techniques of laparoscopic Burch repair for stress incontinence: a prospective, randomized study. J Am Assoc Gynecol Laparosc 1996; 3 : 351-357.
40. Gill F, Enzelsberger H. A new surgical aid - the "endo-stitch disposable suture device" - for pelviscopic pre-peritoneal Burch incontinence operation. A pilot study. Gynakol Geburtshilfliche Rundsch 1996; 36 : 75-78.
41. von Theobald P, Guillaumin D, Levy G. Laparoscopic preperitoneal colposuspension for stress incontinence in women. Technique and results of 37 procedures. Surg Endosc 1995; 9 : 1189-1192.
42. Langebrekke A, Dahlstrom B, Eraker R, Urnes A. The laparoscopic Burch procedure. A preliminary report. Acta Obstet Gynecol Scand 1995; 74 : 153-155.
43. Lam AM, Jenkins GJ, Hyslop RS. Laparoscopic Burch colposuspension for stress incontinence: preliminary results. Med J Aust 1995; 162 : 18-21.
44. Ou CS, Presthus J, Beadle E. Laparoscopic bladder neck suspension using hernia mesh and surgical staples. J Laparoendosc Surg 1993; 3 : 563-566.
45. Liu CY, Paek W. Laparoscopic retropubic colposuspension (Burch procedure). J Am Assoc Gynecol Laparosc 1993; 1 : 31-5.
46. Harewood LM. Laparoscopic needle colposuspension for genuine stress incontinence. J Endourol 1993; 7 : 319-322.
47. Liu CY. Laparoscopic retropubic colposuspension (Burch procedure). A review of 58 cases. J Reprod Med 1993; 38 : 526-530.
48. Miklos JR, Kohli N. Laparoscopic paravaginal repair plus Burch colposuspension: review and descriptive technique. Urology 2000; 56 (6 Suppl 1): 64-69.
49. Lawton V, Smith AR. Laparoscopic colposuspension. Semin Laparosc Surg 1999; 6 : 90-99.
50. Paraiso MF, Falcone T, Walters MD. Laparoscopic surgery for genuine stress incontinence. Int Urogynecol J Pelvic Floor Dysfunct 1999; 10 : 237-247.
51. Ross J. Laparoscopy or open Burch colposuspension? Curr Opin Obstet Gynecol 1998; 10 : 405-409.
52. Lose G. Laparoscopic Burch colposuspension. Acta Obstet Gynecol Scand 1998; 168 : 29-33.
53. Mage G, Wattiez A, Pomel C, Canis M, Pouly JL, Bruhat MA. Limitations of laparoscopic management of pelvic static disorders in gynecology. Presse Med 1996; 25 : 2037-2041.
54. Cadeddu JA, Kavoussi LR. Correction of stress urinary incontinence: transperitoneal approach. J Endourol 1996; 10 : 241-245.
55. Grossmann T, Darai E, Deval B, Benifla JL, Sebban E, Renolleau C, Madelenat P. Role of endoscopy in surgery for urinary incontinence. (Review.) Ann Chir 1996; 50 : 896-905.
56. Wallwiener D, Grischke EM, Rimbach S, Maleika A, Stolz W, Noll U, Bastert G. Abdominal colposuspension: a synopsis of various approaches and techniques including endoscopic modifications. Zentralbl Gynakol 1996; 118 : 98-106.
57. Liu CY. Laparoscopic treatment for genuine urinary stress incontinence. Baillieres Clin Obstet Gynaecol 1994; 8 : 789-798.
58. Black NA, Downs SH. The effectiveness of surgery for stress incontinence in women: a systematic review. Br J Urol 1996; 78 : 497-510.
59. Cortesi N, Ferrari P, Zambarda E. Diagnosis of bilateral abdominal cryptorchidism by laparoscopy. Endoscopy 1976; 8 : 33-34.
60. Peters CA, Kavoussi LR. Laparoscopy in childrens and adults. In: Walsh PC, Retik AB, Darracott Vaughan E, Wein AJ. (eds.) Campbell's Urology. 7th ed. Philadelphia: WB Saunders; 1997 : 2890-2895.
61. Jordan GH. Will laparoscopic orchiopexy replace open surgery for the non-palpable undescended testis? (Editorial.) J Urol 1997; 158 : 1956.
62. Docimo SG. Two step laparoscopic Fowler-Stephens orchiopexy. (Editorial.) J Urol 1997; 158 : 1954.
63. Bogaert GA, Kogan BA, Mevorach RA. Therapeutic laparoscopy for intra-abdominal testes. Urology 1993; 42 : 182-188.
64. Caldamone AA, Amaral JF. Laparoscopic stage 2 Fowler-Stephens orchidopexy. J Urol 1994; 152 : 1253-1256.
65. Poppas DP, Lemack GE, Mininberg DT. Laparoscopic orchiopexy: clinical experience and description of technique. J Urol 1995; 155 : 708-711.
66. Docimo SG, Jordan GH. Laparoscopic surgery in children. In: Marshall PF. (ed.) Textbook of Operative Urology. Philadelphia: WB Saunders 1996 : 207.
67. Esposito C, Garipoli V. The value of 2-step Fowler-Stephens orchiopexy for intra-abdominal testes. J Urol 1997; 158 : 1952-1955.
68. Gheiler EL, Barthold JS, Gonzalez R. Benefits of laparoscopy and the Jones technique for the nonpalpable testis. J Urol 1997; 158 : 1948-1951.
69. Docimo SG. The results of surgical therapy for cryptorchidism. A literature review and analysis. J Urol 1995; 154 : 1148-1152.
70. Jordan GH, Winslow BH. Laparoscopic single stage and staged orchiopexy. J Urol 1994; 152 : 1249-1252.
71. Hedican SP. Laparoscopy in urology. Surg Clin North Am 2000; 80 : 1465-1485.
72. Amid PK, Shulman AG, Lichtenstein IL. Lichtenstein herniotomy. Chirurg 1994; 65 : 54-58.
73. Bassini E. Nuovo metodo operative per la cura dell'ernia inguinale. Padova: Prosperini 1989.
74. Nyhus LM. Individualization of hernia repair: a new era. Surgery 1993; 114 : 1-2.
75. Shulman AG, Amid PK, Lichtenstein IL. The safety mesh of repair for primary inguinal hernias: results of 3,019 operations from five diverse surgical sources. Am Surg 1992; 58 : 255-257.
76. Wantz GE. Complications of inguinal hernia repair. Surg Clin North Am 1984; 64 : 287-298.
77. Bogojavlensky S. Laparoscopic treatment of inguinal or femoral hernia. (Abstract.) 18th Annual Meeting AAGL, Washington, DC, 1989.
78. Bittner R, Kraft K, Schmedt CG, Schwarz J, Leibl B. Risks and benefits of laparoscopic hernia-plasty (TAPP). 5 years experience with 3400 hernia repairs. Chirurg 1998; 69 : 854-858.
79. Bittner R, Leibl B, Kraft K, Schwarz J, Schmedt CG. Update: what is left for laparoscopic hernia repair? Dig Surg 1998; 15 : 167-171.
80. Felix EL, Harbertson N, Vartanian S. Laparoscopic hernioplasty: significant complications. Surg Endosc 1999; 13 : 328-331.
81. Fitzgibbons RJ Jr, Camps J, Cornet DA, Nguyen NX, Litke BS, Annibali R, Salerno GM. Laparoscopic inguinal herniorrhaphy. Results of a multicenter trial. Ann Surg 1995; 221 : 3-13.
82. Felix E, Scott S, Crafton B, Geis P, Duncan T, Sewell R, McKernan B. Causes of recurrence after laparoscopic hernioplasty. A multicenter study. Surg Endosc 1998; 12 : 226-231.
83. Liem MSL, Van Vroonhoven TJ. Laparoscopic inguinal hernia repair. Br J Surg 1996; 83 : 1197-1204.
84. Horeyseck G, Roland F, Rolfes N."Tension-free" repair of inguinal hernia: laparoscopic (TAPP) versus open (Lichtenstein repair.) Chirurg 1996; 67 : 1036-1040.
85. Liem MSL, Van der Graaf Y, Van Steensel CJ, Boelhouwer U, Clevers GJ, Meijer WS, Stassen PS, Vente JP, Weidema WF, Schrijvers AJ, Van Vroonhoven TJ. Comparison of conventional anterior surgery and laparoscopic surgery for inguinal-hernia repair. N Engl J Med 1997; 336 : 1541-1547.
86. Rassweiler J, Deglmann W, Renner C, Frede T, Seemann O. Ergebnisse der laparoskopischen extraperitonealen Hernioplastik im Vergleich zur offenen Operation. Akt Urol 2000; 31 : 229-237.
87. Champault G, Benoit J, Lauroy J, Rizk P. Inguinal hernias in adults. Laparoscopic surgery versus the Shouldice method. Controlled randomized study: 181 patients. Preliminary results. Ann Chir 1994; 48 : 1003-1008.
88. Dierksen CD, Beets GL, Go PM, Geisler FE, Baeten CG, Kootstra G. Bassini repair compared with laparoscopic repair for primary inguinal hernia: a randomised controlled trial. Eur J Surg 1998; 164 : 439-447.
89. Heikkinen TJ, Haukipuro K, Koivukangas P, Hulkko A. A prospective randomized outcome and cost comparison of totally extraperitoneal endoscopic hernioplasty versus Lichtenstein hernia operation among employed patients. Surg Laparosc Endosc 1998; 8 : 338-344.
90. Sarli L, Pietra N, Choua O, Costi R, Thenasseril B, Giunta A. Prospective randomized comparative study of laparoscopic hernioplasty and Lichtenstein tension-free hernioplasty. Acta Biomed Ateneo Parmense 1997; 68 : 5-10.
91. Wellwood J, Sculpher MJ, Stoker D, Nicholls GJ, Geddes C, Whitehead A, Singh R, Spiegelhalter D. Randomised controlled trial of laparoscopic versus open mesh repair for inguinal hernia; outcome and cost. Br Med J 1998; 317 : 103-110.
92. Wilson MS, Deans GT, Brough WA. Prospective trial comparing Lichtenstein with laparoscopic tension-free mesh repair of inguinal hernia. Br Surg 1995; 82 : 274-277.
93. Juul P, Christensen K. Randomized clinical trial of laparoscopic versus open inguinal hernia repair. Br J Surg 1999; 86 : 316-319.
94. Frede T, Deglmann W, Hoang-Böhm J, Köhrmann KU, Michel MS, Rassweiler J, Alken P. Hernienchirurgie im Jahre 2000 - eine Übersicht. Akt Urol 2000; 32 : 69-78.
95. Clayman RV, Kavoussi LR, Soper NJ, Dierks SM, Meretyk S, Darcy MD, Roemer FD, Pingleton ED, Thomson PG, Long SR. Laparoscopic nephrectomy: initial case report. J Urol 1991; 146 : 278-282.
96. Gaurr DD, Agarwal DK, Purokhit KC. Retroperitoneal laparoscopic nephrectomy: initial case report. J Urol 1993; 149 : 103-105.
97. Kerbl K, Clayman RV, McDougall EM, Gill IS, Wilson BS, Chandhoke PS, Albala DM, Kavoussi LR. Transperitoneal nephrectomy for benign disease of the kidney: a comparison of laparoscopic and open surgical techniques. Urology 1995; 43 : 607-613.
98. Doublet JD, Barreto HS, Degremont AC, Gattegno B, Thibault P. Retroperitoneal nephrectomy: comparison of laparoscopy with open surgery. World J Surg 1996; 20 : 713-716.
99. Eraky I, El-Kappany HA, Ghoneim MA. Laparoscopic nephrectomy: Mansoura experience with 106 cases. Br J Urol 1995; 75 : 271-275.
100. Keeley FX, Tolley DA. A review of our first 100 cases of laparoscopic nephrectomy: defining risk factor for complications. Br J Urol 1998; 82 : 615-618.
101. Gill IS, Kavoussi LR, Clayman RV, Ehrlich R, Evans R, Fuchs G, Gersham A, Hulbert JC, McDougall EM, Rosenthal T, et al. Complications of laparoscopic nephrectomy in 185 patients: a multi-institutional review. J Urol 1995; 154 : 479-483.
102. Rassweiler JJ, Seemann O, Frede T, Henkel TO, Alken P. Retroperitoneoscopy: experience with 200 cases. J Urol 1998; 160 : 1265-1269.
103. Rassweiler JJ, Fornara P, Weber M, Janetscheck G, Fahlenkamp D, Henkel T, Beer M, Stackl W, Boeckmann W, Recker F, Lampel A, Fischer C, Humke U, Miller K. Laparoscopic nephrectomy: the experience of the laparoscopy working group of the German Urologic Association. J Urol 1998; 160 : 18-21.
104. Fornara P, Doehn C, Fricke L. Laparoscopic bilateral nephrectomy: results in 11 renal transplant patients. J Urol 1997; 157 : 445-448.
105. Moore RG, Chen RN, Hedican SP. Laparoscopic subcapsular nephrectomy. J Endourol 1998; 12 : 263-267.
106. Gill IS. Retroperitoneal laparoscopic nephrectomy. Urol Clin North Am 1998; 25 : 343-360.
107. McDougall EM, Clayman RV, Elashry OM. Laparoscopic radical nephrectomy for renal tumor: the Washington University experience. J Urol 1996; 155 : 1180-1185.
108. Ono Y, Katoh N, Kinukawa T, Matsuura O, Oshima S. Laparoscopic radical nephrectomy: the Nagoya experience. J Urol 1997; 158 : 719-723.
109. Barrett PH, Fentie DD, Taranger LA. Laparoscopic radical nephrectomy with morcellation for renal cell carcinoma: the Saskatoon experience. Urology 1998; 52 : 23-28.
110. Abbou CC, Cicco A, Gasman D, Hoznek A, Antiphon P, Chopin DK, Salomon L. Retroperitoneal laparoscopic versus open radical nephrectomy. J Urol 1999; 161 : 1776-1780.
111. Tierney AC. Laparoscopic radical and partial nephrectomy. World J Urol 2000; 18 : 249-256.
112. Janetschek G, Jeschke K, Peschel R, Strohmeyer D, Henning K, Bartsch G. Laparoscopic surgery for stage T1 renal cell carcinoma: radical nephrectomy and wedge resection. Eur Urol 2000; 38 : 131-138.
113. Cadeddu JA, Ono Y, Clayman RV, Barrett PH, Janetschek G, Fentie DD, McDougall EM, Moore RG, Kinukawa T, Elbahnasy AM, Nelson JB, Kavoussi LR. Laparoscopic nephrectomy for renal cell carcinoma: evaluation of efficacy and safety: a multicentric experience. Urology 1998; 52 : 773-777.
114. Gill IS. Laparoscopic radical nephrectomy for cancer. Urol Clin North Am 2000; 27 : 707-719.
115. Ono Y, Kinukawa T, Hattori R, Yamada S, Nishiyama N, Mizutani K, Ohshima S. Laparoscopic radical nephrectomy for renal cell carcinoma. A five year experience. Urology 1999; 53 : 280-286.
116. Hoznek A, Salomon L, Antipon P, Radier C, Hafiani M, Chopin DK, Abbou CC. Partial nephrectomy with retroperitoneal laparoscopy. J Urol 1999; 162 : 1922-1926.
117. Janetschek G, Seibold J, Radmayr C, Bartsch G. Laparoscopic heminephrectoureterctomy in pediatric patients. J Urol 1997; 158 : 1928-1930.
118. Janetschek G, Daffner P, Peschel R, Bartsch G. Laparoscopic nephron sparing surgery for small renal cell carcinoma. J Urol 1998; 159 : 1152-1155.
119. Rassweiler JJ, Abbou CC, Janetschek G, Jeschke K. Laparoscopic partial nephrectomy. The European Experience. In: Novick A, Gil I. (eds.) Minimally invasive surgery of the kidney: a problem-oriented approach. Urol Clin N Am 2000; 27 : 721-736.
120. Gill IS, Sobel JJ, Miller SD, Sung GT. A novel technique for the management of the en bloc bladder cuff and distal ureter during laparoscopic nephroureterectomy. J Urol 1999; 161 : 430-434.
121. McDougall EM, Clayman RV, Elashry O. Laparoscopic nephroureterectomy for upper tract transitional cell cancer: the Washington University experience. J Urol 1995; 154 : 975-979.
122. Shalhav AL, Elbahnasy AM, McDougall EM, Clayman RV. Laparoscopic nephroureterectomy for upper tract transitional cell cancer: technical aspects. J Endourol 1998; 12 : 345-353.
123. Stephenson RN, Sharma NK, Tolley DA. Laparoscopic nephroureterectomy: a comparison with open surgery. J Endourol 1995; 9 (Suppl 1): 99.
124. Chung HJ, Chiu AW, Chen KK, Huang WJS, Wang BF, HSU YS, Chang LS. Retroperitoneoscopy assisted nephroureterectomy for the management of upper tract urothelial cancer. Min Inv Ther 1996; 5 : 266-271.
125. Dauleh MI, Townell NH. Laparoscopic nephroureterectomy for malignancy: vaginal route for retrieval of intact specimen. Br J Urol 1993; 72 : 667-668.
126. Figenshau RS, Albala DM, Clayman RV, Kavoussi LR, Chandhoke PS, Stone AM. Laparoscopic nephroureterectomy initial laboratory experience. Min Invas Ther 1991; 1 : 93-97.
127. Hetherington JW, Ewing R, Philp NH. Modified nephroureterectomy: a risk of tumour implantation. Br J Urol 1986; 58 : 368-370.
128. Jones DR, Moisey CU. A cautionary tale of modified "pluck" nephroureterectomy. Br J Urol 1993; 71 : 486.
129. Keeley FX, Sharma NK, Tolley DA. Hand-assisted laparoscopic nephroureterectomy. BJU Int 1999; 83 : 504-505.
130. Keeley FX Jr, Tolley DA. Laparoscopic nephroureterectomy: making management of upper-tract transitional-cell carcinoma entirely minimally invasive. J Endourol 1998; 12 : 139-141.
131. McDougall EM, Clayman RV, Fadden PT. Retroperitoneoscopy: the Washington University Medical School experience. Urology 1994; 43 : 446-452.
132. Nakada SY. Hand-assisted laparoscopic nephrectomy. J Endourol 1999; 13 : 9-14; discussion 14-15.
133. Salomon L,Hoznek A, Cicco A, Gasman D, Chopin DK, Abbou C. Retroperitoneoscopic nephroureterectomy for renal pelvic tumors with a single iliac incision. J Urol 1999; 161 : 541-544.
134. Shalhav AL, Dunn MD, Portis AJ, Elbahnasy AM, McDougall EM, Clayman RV. Laparoscopic nephroureterectomy for upper tract transitional cancer: the Washington University experience. J Urol 2000; 163 : 1100-1104.
135. Shichman SJ, Wong JE, Sosa RE, Berlin BB. Hand-assisted laparoscopic radical nephrectomy and nephroureterectomy: a new standard for the 21st century. J Urol 1999; 161 (Suppl): 23: Abstract no. 76.
136. Yang SC, Park DS, Lee DH, Lee JM, Park K. Retroperitoneal endoscopic live donor nephrectomy: report of 3 cases. J Urol 1995; 153 : 1884-1886.
137. Schulam PG, Kavoussi LR, Cheriff AD, Averch TD, Montgomery R, Moore RG, Ratner LE. Laparoscopic live donor nephrectomy: the initial 3 cases. J Urol 1996; 155 : 1857-1859.
138. Suzuki K, Ushiyama T, Kageyama S, Ishikawa A, Mugiya S, Fujita K. Gasless laparoscopy-assisted live donor nephrectomy: the initial 5 cases. Min Invas Ther & Allied Technol 1997; 6 : 77-82.
139. Drehmer I, Rassweiler J, Staehler G, Wiesel M. The retroperitoneoscopic laparoscopic-assisted living donor nephrectomy - first experiences. J Urol 1999; 161 (Suppl): 385: Abstract No. 1494.
140. Suzuki K, Ishikawa A, Ushiyama T, Nobutaka O, Suzuki A. Gasless laparoscopy-assisted live donor nephrectomy: the initial 23 cases. J Urol 1999; 161 (Suppl): 384: Abstract No. 1488.
141. Jacobs SC, Cho E, Dunkin BJ, Flowers JL, Schweitzer E, Cangro C, Fink J, Farney A, Philosophe B, Jarrell B, Bartlett ST. Laparoscopic live donor nephrectomy: the University of Maryland 3-year experience. J Urol 2000; 164 : 1494-1499.
142. Chan DY, Ratner LE, Kavoussi LR. Laparoscopic donor nephrectomy: standard of care or unnecessary risk of organ loss? Curr Opin Urol 1999; 9 : 219-222.
143. Fabrizio MD, Ratner LE, Kavoussi LR. Laparoscopic live donor nephrectomy: pro. Urology 1999; 53 : 665-667.
144. Novick AC. Laparoscopic live donor nephrectomy: con. Urology 1999; 53 : 668-670.
145. Leventhal JR, Deeik RK, Joehl RJ, Rege RV, Herman CH, Fryer JP, Kaufman D, Abecassis M, Stuart FP. Laparoscopic live donor nephrectomy - is it safe? Transplantation 2000; 70 : 602-606.
146. Johnson EM, Remucal MJ, Gillingham KJ, Dahms RA, Najarian JS, Matas AJ. Complications and risks of living donor nephrectomy. Transplantation 1997; 64 : 1124-1128.
147. Waples MJ, Belzer FO, Uehling DT. Living donor nephrectomy: a 20-year experience. Urology 1995; 45 : 207-210.
148. Wiesel M, Carl S, Staehler G. Living donor nephrectomy: a 28-year experience at Heidelberg University. Transplant Proc 1997; 29 : 2769.
149. Ratner LE, Kavoussi LR, Sroka M, Hiller J, Weber R, Schulam PG, Montgomery R. Laparoscopic assisted live donor nephrectomy - a comparison with the open approach. Transplantation 1997; 63 : 229-233.
150. London E, Rudich S, McVicar J, Wolfe B, Perez R. Equivalent renal allograft function with laparoscopic versus open liver donor nephrectomies. Transplant Proc 1999; 31 : 258-260.
151. Nogueira JM, Cangro CB, Fink JC, Schweitzer E, Wiland A, Klassen DK, Gardner J, Flowers J, Jacobs S, Cho E, Philosophe B, Bartlett ST, Weir MR. A comparison of recipient renal outcomes with laparoscopic versus open live donor nephrectomy. Transplantation 1999; 67 : 722-728.
152. Flowers JL, Jacobs S, Cho E, Morton A, Rosenberger WF, Evans D, Imbembo AL, Bartlett ST. Comparison of open and laparoscopic live donor nephrectomy. Ann Surg 1997; 226 : 483-490.
153. Harman PK, Irving LK, McLachlan HD, Freelender AE, Stanton PN. Elevated intra-abdominal pressure and renal function. Ann Surg 1982; 196 : 594-597.
154. Hayry P, Altalo S, Myllarniemi M, Raisanen-Sokolowski A, Lemstrom K. Cellular and molecular biology of chronic rejection. Transplant Proc 1995; 27 : 71-74.
155. Land W. Possible role of postischemic reperfusion injury as initiator of allorecognition/alloactivation. Transplant Proc 1998; 30 : 4269.
156. Opelz G. Cadaver kidney graft outcome in relation to ischemia time and HLA match. Collaborative Transplant Study. Transplant Proc 1988; 30 : 4294-4296.
157. Persijn GG, DeMeester J, Cohen B. Organ shortage: the solutions. In: Touraine JL, Traeger J, Bétuel H, Dubernard JM, Revillard JP, Dupuy C. (eds.) Proceedings of the 26th Conference on Transplantation and Clinical Immunology, 13-15 June, 1994. Transplant Clin Immunol 1994 : 26 : 3-10.
158. Schover LR, Streem SB, Boparai N, Duriak K, Novick AC. The psychosocial impact of donating a kidney: long-term follow-up from a urology based center. J Urol 1997; 157 : 1596-1601.
159. Gill IS, Carbone JM, Clayman RV, Fadden PA, Stone MA, Lucas BA, McRoberts JW. Laparoscopic live-donor nephrectomy. J Endourol 1994; 8 : 143-148.
160. Urban DA, Clayman RV, Kerbl K, Figenshau RS, McDougall EM. Laparoscopic nephropexy for symptomatic nephroptosis: initial case report. J Endourol 1993; 7 : 27-30.
161. Elashry OM, Nakada SY, McDougall EM, Clayman RV. Laparoscopic nephropexy: Washington University experience. J Urol 1995; 154 : 1655-1659.
162. Fornara P, Doehn C, Jocham D. Laparoscopic nephropexy: 3-year experience. J Urol 1997; 158 : 1679-1683.
163. Frede T, Rassweiler J, Hatzinger M, Renner C. Retroperitoneal laparoscopic nephropexy - are there really indications? Eur Urol 1998; 33 (Suppl 1): 37 Abstract no. 147.
164. Hübner WA, Schramek P, Pflüger H. Laparoscopic nephropexy. J Urol 1994; 152 : 1184-1187.
165. Rassweiler JJ, Frede T, Recker F, Stock C, Seemann O, Alken P. Retroperitoneal laparoscopic nephropexy. In: Das S. (ed.) Advanced urologic laparoscopy. Urol Clin North Am 2001; 28 : 137-144.
166. Deming CL. Nephroptosis: causes, relation to other viscera, and correction by a new operation. JAMA 1930; 95 : 25-35.
167. O'Dea MJ, Furlow WL. Nephropexy: fact or fiction? Urology 1976; 8 : 9-12.
168. Temizkan M, Wijmenga LF, Ypma AF, Hazenberg HJ. Nephroptosis: a considerable cause of renovascular hypertension. Neth J Med 1995; 47 : 61-65.
169. Moss SW. Floating kidneys: a century of nephroptosis and nephropexy. J Urol 1997; 158 : 699-702.
170. Soulie M, Thoulouzan M, Seguin P, Mouly P, Vazzoler N, Pontonnier F, Plante P. Retroperitoneal laparoscopic versus open pyeloplasty with a minimal incision: comparison of two surgical approaches. Urology 2001; 57 : 443-447.
171. Bauer JJ, Bishoff JT, Moore RG, Chen RN, Iverson AJ, Kavoussi LR. Laparoscopic versus open pyeloplasty: assessment of objective and subjective outcome. J Urol 1999; 162 : 692-695.
172. Janetschek G, Peschel R, Bartsch G. Laparoscopic Fenger plasty. J Endourol 2000; 14 : 889-893.
173. Chen RN, Moore RG, Kavoussi LR. Laparoscopic pyeloplasty. Indications, technique, and long-term outcome. Urol Clin North Am 1998; 25 : 323-330.
174. Ben Slama MR, Salomon L, Hoznek A, Cicco A, Saint F, Alame W, Antiphon P, Chopin DK, Abbou CC. Extraperitoneal laparoscopic repair of ureteropelvic junction obstruction: initial experience in 15 cases. Urology 2000; 56 : 45-48.
175. Tan HL. Laparoscopic Anderson-Hynes dismembered pyeloplasty in children. J Urol 1999; 162 : 1045-1048.
176. Schier F. Laparoscopic Anderson-Hynes pyeloplasty in children. Pediatr Surg Int. 1998; 13 : 497-500.
177. Moore RG, Averch TD, Schulam PG, Adams JB 2nd, Chen RN, Kavoussi LR. Laparoscopic pyeloplasty: experience with the initial 30 cases. J Urol 1997; 157 : 459-462.
178. Puppo P, Perachino M, Ricciotti G, Bozzo W, Pezzica C. Retroperitoneoscopic treatment of ureteropelvic junction obstruction. Eur Urol 1997; 31 : 204-208.
179. Tan HL, Roberts JP. Laparoscopic dismembered pyeloplasty in children: preliminary results. Br J Urol 1996; 77 : 909-913.
180. Janetschek G, Peschel R, Bartsch G. Laparoscopic and retroperitoneoscopic kidney pyeloplasty. Urologe A 1996; 35 : 202-207.
181. Chen RN, Moore RG, Kavoussi LR. Laparoscopic pyeloplasty. J Endourol 1996; 10 : 159-161.
182. Janetschek G, Peschel R, Altarac S, Bartsch G. Laparoscopic and retroperitoneoscopic repair of ureteropelvic junction obstruction. Urology 1996; 47 : 311-316.
183. Brunet P, Leroy J, Danjou P. Eight cases of pyelo-ureteral junction syndrome treated by laparoscopic surgery. Chirurgie 1996; 121 : 415-417.
184. Danjou P, Leroy J, Brunet P, Lemaitre L. Congenital pyeloureteral junction syndrome in adults treated with laparoscopic surgery. Prog Urol 1995; 5 : 946-950.
185. Brooks JD, Kavoussi LR, Preminger GM, Schuessler WW, Moore RG. Comparison of open and endourologic approaches to the obstructed ureteropelvic junction. Urology 1995; 46 : 791-795.
186. Nakada SY, McDougall EM, Clayman RV. Laparoscopic pyeloplasty for secondary ureteropelvic junction obstruction: preliminary experience. Urology 1995; 46 : 257-260.
187. Schuessler WW, Grune MT, Tecuanhuey LV, Preminger GM. Laparoscopic dismembered pyeloplasty. J Urol 1993; 150 : 1795-1799.
188. Pattaras JG, Moore RG. Laparoscopic pyeloplasty. J Endourol 2000; 14 : 895-904.
189. Janetschek G, Marberger M. Laparoscopic surgery in urology. Curr Opin Urol 2000; 10 : 351-357.
190. Bernardo N, Smith AD. Endopyelotomy review. Arch Esp Urol 1999; 52 : 541-548.
191. Kavoussi LR, Sosa E, Chandhoke P, Chodak G, Clayman RV, Hadley HR, Loughlin KR, Ruckle HC, Rukstalis D, Schuessler W, Segura J, Vancaille T. Complications of laparoscopic pelvic lymph node dissection. J Urol 1993; 149 : 322-325.
192. Burney TL, Campbell EC Jr, Naslund MJ, Jacobs SC. Complications of staging laparoscopic pelvic lymphadenectomy. Surg Laparosc Endosc 1993; 3 : 184-190.
193. Kerbl K, Clayman RV, Petros JA, Chandhoke PS, Gill IS. Staging pelvic lymphadenectomy for prostate cancer: a comparison of open and laparoscopic techniques. J Urol 1993; 150 : 396-399.
194. Parra RO, Andrus CH, Boullier JA. Staging laparoscopic pelvic lymph node dissection: comparison of results with open pelvic lymphadenectomy. J Urol 1992; 147 : 875-878.
195. Schuessler WW, Pharand D, Vancaillie TG. Laparoscopic standard pelvic node dissection for carcinoma of the prostate: is it accurate? J Urol 1993; 150 : 898-901.
196. Mommsen S. Open versus diagnostic pelvic lymphadenectomy. Scand J Urol Nephrol 1995; 172 (Suppl): 23-25.
197. Rukstalis DB, Gerber GS, Vogelzang NJ, Haraf DJ, Straus FH 2nd, Chodak GW. Laparoscopic pelvic lymph node dissection: a review of 103 consecutive cases. J Urol 1994; 151 : 670-674.
198. Lang GS, Ruckle HC, Hadley HR, Liu PD, Stewart SC. One hundred consecutive laparoscopic pelvic lymph node dissections: comparing complications of the first 50 cases to the second 50 cases. Urology 1994; 44 : 221-225.
199. Effert P, Boeckmann W, Wolff J, Jakse G. Laparoscopic lymphadenectomy in prostate carcinoma. Experience in 120 patients. Urologe A 1996; 35 : 413.
200. Guazzoni G, Montorsi F, Bergamaschi F, Bellinzoni P, Centemero A, Consonni P, Rigatti P. Open surgical revision of laparoscopic pelvic lymphadenectomy for staging of prostate cancer: the impact of laparoscopic learning curve. J Urol 1994; 151 : 930-933.
201. Lerner SE, Fleischmann J, Taub HC, Chamberlin JW, Kahan NZ, Melman A. Combined laparoscopic pelvic lymph node dissection and modified belt radical perineal prostatectomy for localized prostatic adenocarcinoma. Urology 1994; 43 : 493-498.
202. Boeckmann W, Effert P, Wolff JM, Jakse G. Laparoscopic pelvic lymphadenectomy. Acta Urol Belg 1994; 62 : 45-50.
203. Schoborg TW. Laparoscopic staging of prostatic carcinoma. Semin Surg Oncol 1994; 10 : 422-430.
204. Maffezzini M, Carmignani G, Perachino M, Puppo P, Montorsi F, Guazzoni G, Gallucci M, DiSilverio F, Morelli M, Muto G. Benefits and complications of laparoscopic pelvic lymphadenectomy for detection of stage D1 prostate cancer: a multicenter experience. Eur Urol 1995; 27 : 135-137.
205. Klan R, Meier T, Knispel HH, Wegner HE, Miller K. Laparoscopic pelvic lymphadenectomy in prostatic cancer: an analysis of seventy consecutive cases. Urol Int 1995; 55 : 78-83.
206. Stone NN, Stock RG. Laparoscopic pelvic lymph node dissection in the staging of prostate cancer. Mt Sinai J Med 1999; 66 : 26-30.
207. Schuessler WW, Vancaillie TG, Reich H, Griffith DP. Transperitoneal endosurgical lymphadenectomy in patients with localized prostate cancer. J Urol 1991; 145 : 988-991.
208. Bowsher WG, Clarke A, Clarke DG, Costello AJ. Laparoscopic pelvic lymph node dissection. Br J Urol 1992; 70 : 276-279.
209. Doublet JD, Gattegno B, Thibault P. Laparoscopic pelvic lymph node dissection for staging of prostate cancer. Eur Urol 1994; 25 : 194-198.
210. Das S, Tashima M. Extraperitoneal laparoscopic staging pelvic lymph node dissection. J Urol 1994; 151 : 1321-1323.
211. Gasman D, Barthelemy Y, Antiphon P, Chopin D, Abbou C. Laparoscopically-controlled lymphadenectomy in localized cancer of the prostate. Prog Urol 1994; 4 : 516-522.
212. Bangma CH, Kirkels WJ, Chadha S, Schroder FH. Cutaneous metastasis following laparoscopic pelvic lymphadenectomy for prostatic carcinoma. J Urol 1995; 153 : 1635-1636.
213. Jarrad DF, Chodak GW. Prostate cancer staging after radiation utilizing laparoscopic pelvic lymphadenectomy. Urology 1995; 46 : 538-541.
214. Herrell SD, Trachtenberg J, Theodorescu D. Staging pelvic lymphadenectomy for localized carcinoma of the prostate: a comparison of 3 surgical techniques. J Urol 1997; 157 : 1337.
215. Herzog TJ, Wu JS, Hovsepian DM, Luttman D, Elbendary A. Randomized comparison of laparoscopic and open lymphadenectomy in pigs. Obstet Gynecol 1999; 93 : 603-606.
216. Schuessler WW, Kavoussi LR, Clayman RV, Vancaille TH. Laparoscopic radical prostatectomy: initial case report. J Urol 1992; 147 : 246.
217. Schuessler W, Schulam PG, Clayman RV, Kavoussi LR. Laparoscopic radical prostatectomy: initial short-term experience. Urology 1997; 50 : 854-857.
218. Raboy A, Ferzli G, Albert P. Initial experience with extraperitoneal endoscopic radical retropubic prostatectomy. Urology 1997; 50 : 849-853.
219. Jacob F, Salomon L, Hoznek A, Bellot J, Antiphon P, Chopin DK, Abbou CC. Laparoscopic radical prostatectomy: preliminary results. Eur Urol 2000; 37 : 615-620.
220. Rassweiler JJ, Seemann O, El-Quaran M, Sentker L. Laparoscopic radical prostatectomy - early results. Eur Urol 2000; 37 : 19.
221. Abbou CC, Salomon L, Hoznek A, Antiphon P, Cicco A, Saint F, Alame W, Bellot J, Chopin DK. Laparoscopic radical prostatectomy: preliminary results. Urology 2000; 55 : 630-634.
222. Rassweiler J, Sentker L, Seemann O, El-Quaran M, Stock C, Frede T. Laparoscopic radical prostatectomy - technique and initial experiences. Akt Urol 2000; 31 : 238-247.
223. Guillonneau B, Cathelineau X, Baret E, Rozet F, Vallancien G. Radical prostatectomy: technical and early oncological assessment of 40 operations. Eur Urol 1999; 36 : 14-20.
224. Bollens R, Vanden Bossche M, Roumeguere T, Damoun A, Ekane S, Hoffmann P, Zlotta AR, Schulman CC. Extraperitoneal laparoscopic radical prostatectomy: results after 50 cases. Eur Urol 2001; 40 : 65-69.
225. Sulser T, Fehr J-L, Hauri D. Laparoscopic radical prostatectomy: experience with the Montsouris Technique in 102 consecutive cases. Eur Urol 2001; 39 (Suppl): 8. Abstract no. 24.
226. Van Velthoven R, Peltier A, Hawaux E, Vandewalle JC. Functional and oncological results with laparoscopic transperitoneal and anatomical radical prostatectomy. Eur Urol 2001; 39 (Suppl): 9. Abstract no. 26.
227. Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris experience. J Urol 2000; 163 : 418-422.
228. Janetschek G, Reissigl A, Peschel R, Bartsch G. Laparoscopic retroperitoneal lymphadenectomy in the pig: initial report. J Endourol 1993; 7 : 243-247.
229. Rukstalis DB, Chodak GW. Laparoscopic retroperitoneal lymph node dissection in a patient with stage 1 testicular carcinoma. J Urol 1992; 148 : 1907-1910.
230. Stone NN, Schlussel RN, Waterhouse RL, Unger P. Laparoscopic retroperitoneal lymph node dissection in stage A nonseminomatous testis cancer. Urology 1993; 42 : 610.
231. Klotz L. Laparoscopic retroperitoneal lymphadenectomy for high-risk stage 1 nonseminomatous germ cell tumour: report of four cases. Urology 1994; 43 : 752-756.
232. Janetschek G, Hobisch A, Peschel R, Hittmair A, Bartsch G. Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous testicular carcinoma: long-term outcome. J Urol 2000; 163 : 1793-1796.
233. Rassweiler JJ, Seemann O, Henkel TO, Stock C, Frede T, Alken P. Laparoscopic retroperitoneal lymph node dissection for nonseminomatous germ cell tumors: indications
and limitations. J Urol 1996; 156 : 1108-1113.
234. Gerber GS, Bissada NK, Hulbert JK, Kavoussi LR, Moore RG, Kantoff PW, Rukstalis DB. Laparoscopic retroperitoneal lymphadenectomy: multi-institutional analysis. J Urol 1994; 152 : 1188-1192.
235. Castillo O, Wohler C, Mayanz M, Van Cauwelaert R, Munoz V, Aguirre C, Onate R, Azocar G, Arellano L. Laparoscopic lumboaortic retroperitoneal lymphadenectomy in testicular neoplasm. Rev Med Chil 1994; 122 : 313-318.
236. Janetschek G, Hobisch A, Höltl L, Bartsch G. Retroperitoneal lymphadenectomy for clinical stage I nonseminomatous testicular tumour: laparoscopy versus open surgery and impact of learning curve. J Urol 1996; 156 : 89-94.
237. Giusti G, Beltrami P, Tallarigo C, Bianchi G, Mobilio G. Unilateral laparoscopic retroperitoneal lymphadenectomy for clinical stage I nonseminomatous testicular cancer. J Endourol 1998; 12 : 561-566.
238. Zhuo Y, Klaen R, Sauter TW, Miller K. Laparoscopic retroperitoneal lymph node dissection in clinical stage I nonseminomatous germ cell tumor: a minimal invasive alternative. Chin Med J 1998; 111 : 537-541.
239. Nelson JB, Chen RN, Bishoff JT, Oh WK, Kantoff PW, Donehower RC, Kavoussi LR. Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell testicular tumors. Urology 1999; 54 : 1064-1067.
240. Rassweiler JJ, Frede T, Lenz E, Seemann O, Alken P. Long-term experience with laparoscopic retroperitoneal lymph node dissection in the management of low-stage testis cancer. Eur Urol 2000; 37 : 251-260.
241. LeBlanc E, Caty A, Dargent D, Querleu D, Mazeman E. Laparoscopic lumbo-aortic lymphadenectomy in early stage non-seminomatous germ cell tumors of the testis: Why? How? Prog Urol 2000; 10 : 379-387.
242. Herzog TJ, Wu JS, Hovsepian DM , Luttman D, Elbendary A. Randomized comparison of laparoscopic and open lymphadenectomy in pigs. Obstet Gynecol 1999; 93 : 603-606.
243. Occelli B, Narducci F, Lanvin D, Coste E, Legoupils E, Castelain B, Querleu D. Comparison of transperitoneal versus extraperitoneal laparoscopic para-aortic lymphadenectomy: randomized experimental study. Ann Chir 2000; 125 : 9-17.
244. Janetschek G. Laparoscopic retroperitoneal lymph node dissection: evolution of a new technique. World J Urol 2000; 18 : 267-271.
245. Janetschek G, Hobisch A, Hittmair A, Holtl L, Peschel R, Bartsch G. Laparoscopic retroperitoneal lymphadenectomy after chemotherapy for stage IIB nonseminomatous testicular carcinoma. J Urol 1999; 151 : 477-481.
246. Consonni P, Nava L, Scattoni V, Bianchi A, Spaliviero M, Guazzoni G, Bellinzoni P, Bocciardi A, Rigatti P. Percutaneous echo-guided drainage and sclerotherapy of symptomatic renal cysts: critical comparison with laparoscopic treatment. Arch Ital Urol Androl 1996; 68 (Suppl 5): 27-30.
247. Gill IS, Clayman RV, McDougall EM. Advances in urological laparoscopy. J Urol 1995; 154 : 1275-1294.
248. Munch LC, Gill IS, McRoberts JW. Laparoscopic retroperitoneal renal cystectomy. J Urol 1994 : 151 : 135-138.
249. Elzinga LW, Barry JM, Bennett WM. Surgical management of painful polycystic kidneys. Am J Kidney Dis 1993 : 22 : 532-537.
250. Mischinger HJ, Colombo T, Rauchenwald M, Altziebler S, Steiner H, Vilits P, Hubmer G. Laparoscopic procedure for varicocelectomy. Br J Urol 1994; 74 : 112-116.
251. Enquist E, Stein BS, Sigman M. Laparoscopic versus subinguinal varicocelectomy: a comparative study. Fertil Steril 1994; 61 : 1092-1096.
252. Ogura K, Matsuda T, Terachi T, Horii Y, Takeuchi H, Yoshida O. Laparoscopic varicocelectomy: invasiveness and effectiveness compared with conventional open retroperitoneal high ligation. Int J Urol 1994; 1 : 62-66.
253. Winfield HN, Donovan JF. Laparoscopic varicocelectomy. Semin Urol 1992; 10 : 152-160.
254. Matsuda T. Varicocelectomy. Nippon Hinyokika Gakkal Zasshi 1993; 84 : 797-813.
255. Matsuda T, Yoshida O. Laparoscopic varicocelectomy. Arch Esp Urol 1993; 46 : 585-590.
256. Janssen T, Schulman C. Laparoscopy: new technique in urology. Rev Med Brux 1994; 15 : 323-327.
257. Musi L, Colombo B, Belloli G. Current trends in the treatment of varicocele. Pediatr Med Chir 1994; 16 : 531-534.
258. Mellinger BC. Varicocelectomy. Tech Urol 1995; 1 : 188-196.
259. Tauber R, Pfeiffer D, Bruns T. "Contra laparoscopy" position in the treatment of testicular varicocele. Urologe A 1996; 35 : 246-250.
260. Musi L, Colombo B, Belloli G. Modern trends in the treatment of varicocele. Pediatr Med Chir 1996; 18 : 31-34.
261. Hirsch IH, Abdel-Meguid TA, Gomella LG. Postsurgical outcomes assessment following varicocele ligation: laparoscopic versus subinguinal approach. Urology 1998; 51 : 810-815.
262. Abdulmaaboud MR, Shokeir AA, Farage Y, Abd El-Rahman A, El-Rakhawy MM, Mutabagani H. Treatment of varicocele: a comparative study of conventional open surgery, percutaneous retrograde sclerotherapy, and laparoscopy. Urology 1998; 52 : 294-300.
263. Ulker V, Garibyan H, Kurth KH. Comparison of inguinal and laparoscopic approaches in the treatment of varicocele. Int Urol Nephrol 1997; 29 : 71-77.
264. Mandressi A, Buizza C, Antonelli D, Chisena S. Is laparoscopy a worthy method to treat varicocele? Comparison between 160 cases of two-port laparoscopic and 120 cases of open inguinal vein ligation. J Endourol 1996; 10 : 435-441.
265. Student V, Zatura F, Scheinar J, Vrtal R, Vrana J. Testicle haemodynamics in patients after laparoscopic varicocelectomy evaluated using colour Doppler sonography. Eur Urol 1998; 33 : 91-93.
POUŽITÉ ZKRATKY
CCD CCD kamera
CO2 oxid uhličitý
RPLND retroperitoneální disekce lymfatických uzlin
Štítky
Dětská urologie Urologie
Článek KVÍZ
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2005 Číslo 3- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Inkontinence jako důsledek operačního zákroku na prostatě
-
Všechny články tohoto čísla
- KARCINOM PROSTATY A LAPAROSKOPICKÁ OPERACE
- PERKUTÁNNÍ ENDOPYELOPLASTIKA: SOUČASNÝ KLINICKÝ STAV
- REKONSTRUKČNÍ LAPAROSKOPIE V UROLOGII
-
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST I - NEFREKTOMIE -
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST II - LEDVINU ŠETŘÍCÍ VÝKONY - LAPAROSKOPICKÁ ADRENALEKTOMIE
- OBECNÉ KOMPLIKACE LAPAROSKOPIE
- ZAČLENĚNÍ ROBOTICKÉ RADIKÁLNÍ PROSTATEKTOMIE DO PRAXE PROVÁDĚNÍ BĚŽNÉ OTEVŘENÉ OPERATIVY
- LAPAROSKOPICKÁ OPERACE V UROLOGII - MOŽNÉ KOMPLIKACE A JEJICH PREVENCE, VČASNÉ ROZPOZNÁNÍ A EFEKTIVNÍ ŘEŠENÍ
- VÍME, CO JE TO ÚMLUVA O LIDSKÝCH PRÁVECH A BIOMEDICÍNĚ?
- GUIDELINES EAU PRO LAPAROSKOPII
- KVÍZ
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- OBECNÉ KOMPLIKACE LAPAROSKOPIE
- VÍME, CO JE TO ÚMLUVA O LIDSKÝCH PRÁVECH A BIOMEDICÍNĚ?
- REKONSTRUKČNÍ LAPAROSKOPIE V UROLOGII
-
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST I - NEFREKTOMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




![Úrovně důkazů [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5bb126179a56afca8f11104f2d06eeac.png)
