-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
Letermovir in patients after allogeneic haematopoietic stem cell transplantation – literature review
Cytomegalovirus (CMV) reactivation after allogeneic haematopoietic stem cell transplantation and its subsequent antiviral treatment is a significant complication leading to increased morbidity and mortality in these patients. Frequent monitoring of CMV viremia with early pre-emptive antiviral treatment in case of CMV reactivation represents the most widely used option to date for preventing CMV disease. While this approach leads to a low incidence of CMV disease, the percentage of CMV reactivations requiring pre-emptive therapy remains high and increased morbidity and non-relapse mortality are thus associated with CMV reactivation per se. Letermovir is a new antiviral drug with anti-CMV activity approved for use in CMV seropositive patients after allogeneic hematopoietic stem cell transplantation. A randomized, placebo-controlled study that led to the introduction of letermovir into clinical practice demonstrated a positive effect in reducing the incidence of clinically significant CMV infection as well as non-relapse mortality compared to placebo, especially in patients at high risk of CMV disease. Although it is already commonly used in primary CMV prophylaxis after allogeneic hematopoietic transplantation, its use is associated with certain unresolved issues such as the optimal duration of prophylaxis or its use in secondary prophylaxis or pre-emptive treatment of CMV reactivation. The following article summarizes currently available data on the use of letermovir in patients after allogeneic hematopoietic stem cell transplantation.
Keywords:
Prophylaxis – cytomegalovirus – letermovir – allogeneic haematopoietic stem cell transplant
Autoři: T. Kabut; B. Weinbergerová; M. Lengerová; F. Folber; J. Mayer
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. 1, p. 7-16.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd20227Souhrn
Reaktivace cytomegaloviru (CMV) po alogenní transplantaci krvetvorných buněk s její následnou antivirotickou léčbou je významnou komplikací vedoucí ke zvýšené morbiditě a mortalitě těchto pacientů. V rámci prevence rozvoje CMV nemoci byl dosud nejrozšířenější preemptivní přístup spočívající ve frekventní monitoraci CMV virémie s časným zahájením preemptivní antivirotické léčby v případě známek CMV reaktivace. Tento přístup na jedné straně vede k nízké incidenci CMV nemoci, na druhé straně však procento CMV reaktivací s nutností nasazení preemptivní léčby zůstává vysoké, přičemž již samotná reaktivace vede ke zvýšení morbidity a nerelapsové mortality. Letermovir představuje nové virostatikum s účinkem na cytomegalovirus, které má schválení SÚKL (Státního ústavu pro kontrolu léčiv) u CMV séropozitivních pacientů po alogenní transplantaci krvetvorných buněk. V registrační, randomizované, placebem kontrolované studii, jež vyústila v uvedení letermoviru do klinické praxe, byl prokázán pozitivní vliv na snížení incidence klinicky signifikantní CMV infekce a zároveň pokles nerelapsové mortality ve srovnání s placebem, především u pacientů v nejvyšším riziku CMV onemocnění. Ačkoli je letermovir v primární profylaxi CMV po alogenní transplantaci krvetvorby již běžné užíván, s jeho použitím se pojí řada nevyjasněných otázek, jako jsou optimální délka trvání profylaxe nebo jeho použití v sekundární profylaxi či preemptivní léčbě CMV reaktivace. Následující práce shrnuje v současnosti dostupná literární data týkající se použití letermoviru u pacientů po alogenní transplantaci krvetvorných buněk.
Klíčová slova:
alogenní transplantace krvetvorných buněk – profylaxe – cytomegalovirus – letermovir
ÚVOD
Lidský cytomegalovirus (CMV) patří mezi viry skupiny herpesviridae způsobující infekční onemocnění s vysokou prevalencí v běžné populaci, často s asymptomatickým nebo minimálně symptomatickým průběhem. Po prodělané infekci přetrvává virus u člověka v latentní formě, mimo jiné v neutrofilech, myeloidních progenitorech nebo T-lymfocytech a za standardních okolností jeho reaktivaci brání imunitní systém hostitele [1,2].
Pacienti po alogenní transplantaci krvetvorných buněk (allogeneic haematopoietic cell transplantation – alo-HSCT) ztrácí vlivem T-imunosupresivní terapie, chránící proti rozvoji reakce štěpu proti hostiteli, přirozenou schopnost imunitního systému držet latentní přítomnost CMV pod kontrolou. U těchto pacientů pak může docházet k endogenní reaktivaci CMV a případně k rozvoji manifestní infekce s možným poškozením cílových orgánů, tzv. CMV nemoci [3]. Rozvoj CMV infekce je u těchto pacientů spojen s významnou morbiditou a nerelapsovou mortalitou [4,5]. Dlouhodobě je popisována řada rizikových faktorů, jejichž význam pro reaktivaci CMV byl zaznamenán v řadě prací. Za nejvýznamnější rizikový faktor popsaný i na velkých souborech pacientů v předchozích několika letech je v současnosti považována CMV séropozitivita příjemce [6–9]. Především kombinace séropozitivního příjemce se séronegativním dárcem je spojena s nejvyšší prevalencí CMV reaktivace, a to i ve srovnání s kombinací séropozitivního dárce i příjemce [7,10–12]. Hlavní příčinou tohoto vysokého rizika reaktivace je opožděná imunitní rekonstituce v případě krvetvorných buněk od séronegativních dárců [13]. Mezi další často popisované rizikové faktory pro rozvoj reaktivace CMV patří přítomnost HLA neshody dárce s příjemcem, zejména v případě haploidentické transplantace (zde přispívá i negativní vliv potransplantačního cyklofosfamidu) [14], dle některých prací také použití myeloablativních přípravných režimů (myeloablative conditioning – MAC) oproti režimům s redukovanou intenzitou (reduced intensity conditioning – RIC) [15,16]. V případě méně toxických RIC je popisováno delší přetrvávání dárcovských T-lymfocytů, jež snižuje riziko progrese do závažných reaktivací CMV, především v časném období po transplantaci [17,18]. V řadě dalších analýz se ale tento trend nepotvrdil nebo bylo použití RIC dokonce spjato s vyšším rizikem CMV reaktivace [12,19,20]. Akutní či chronická reakce štěpu proti hostiteli (graf versus host disease – GvHD) byla ve většině studií spojena s rozvojem CMV reaktivace, a je tak považována za jeden z dalších významných potransplantačních rizikových faktorů [12,21–23]. Negativní efekt GvHD je kombinací imunosupresivního efektu kortikosteroidů užívaných v léčbě GvHD, ale rovněž i imunosupresivního efektu samotné GvHD bez léčby [23].
V éře před zavedením sledování CMV virémie s časnou preemptivní léčbou byla mortalita onemocnění spojena především s rozvojem samotné CMV nemoci. V současnosti se setkáváme s manifestními případy CMV nemoci jen u zlomku pacientů, nicméně i pouhá reaktivace CMV je spojena s vyšší úmrtností ve srovnání s pacienty bez reaktivace. Příčinou jsou v tomto případě nepřímé faktory spjaté s reaktivací cytomegaloviru jako zvýšené riziko sekundárních, zejména mykotických, infekcí a zvýšené riziko rozvoje GvHD. Tyto komplikace jsou všeobecně nejčastější příčinou nerelapsové mortality po HSCT nezávisle na CMV. Jak již bylo uvedeno, akutní či chronická GvHD je významným rizikovým faktorem pro replikaci CMV. V současnosti je ale vztah CMV infekce a GvHD považován za provázaný oboustranný proces a přítomnost CMV zvyšuje pravděpodobnost rozvoje následné GvHD [23–26]. Přesný patofyziologický mechanizmus a detailní aspekty nejsou zatím tak dobře popsány jako v případě opačného vztahu (riziko CMV v důsledku GvHD). Předpokládá se vznik prozánětlivého prostředí indukované CMV specifickými T-lymfocyty v odpovědi na replikaci cytomegaloviru [5] nebo produkce prozánětlivých cytokinů, jako je IL-6, endoteliálními buňkami infikovanými CMV [23]. Toto prozánětlivé prostředí může následně indukovat aloimunní reakci a rozvoj GvHD v cílových orgánech. Druhým faktorem vedoucím k vyšší mortalitě je zvýšené riziko mykotických infekcí, nejčastěji invazivní aspergilózy a pneumocystové pneumonine [27]. Tato asociace již byla historicky popsána v mnoha studiích nejprve u pacientů s rozvinutou CMV nemocí, ale v řadě pozdějších prací byla jako nezávislý rizikový faktor prokázána i samotná CMV virémie [28–31]. Často popisovanou příčinou je nežádoucí myelotoxický efekt užívané preemptivní virostatické léčby vedoucí k následné neutropenii; uvažovaný je také přímý imunosupresivní efekt gancikloviru. Jednoznačně se uplatňuje rovněž imunomodulační efekt cytomegaloviru narušující funkci antigen-specifických cytotoxických T-lymfocytů, neutrofilů a makrofágů [27]. V neposlední řadě je rozvoj cytomegalovirové infekce a invazivních mykotických infekcí vyjádřením hluboké imunosuprese již samo o sobě, a je tak provázáno tímto společným rizikovým faktorem.
PREVENCE CMV PO ALOGENNÍ TRANSPLANTACI KRVETVORNÝCH BUNĚK
V prevenci CMV onemocnění po alo-HSCT se uplatňují dva různé přístupy, a to monitorace CMV virémie s časnou preemptivní terapií v případě CMV reaktivace nebo profylaxe CMV podáváním virostatik, případně jejich vzájemná kombinace [3,32,33]. Prvně zmiňovaný přístup je spojován s častější asymptomatickou reaktivací CMV, ale v případě časného zahájení účinné preemptivní léčby se progrese do pokročilejší fáze CMV infekce vyskytuje u méně než 10 % pacientů [33–35]. Nicméně, jak jíž bylo uvedeno, již samotná reaktivace CMV s následnou preemptivní léčbou bývá dle současných poznatků spojována se signifikantně zvýšenou nerelapsovou mortalitou [6,36], která bývá mimo jiné připisována na vrub toxicitě preemptivní antivirotické terapie. V případě podávání antivirotické profylaxe můžeme snížit riziko rozvoje samotné CMV reaktivace. Problémem zůstává toxicita antivirotické léčby, která je vzhledem k plošnému užití u všech pacientů zvláště významná a vede k preferenci prvního přístupu. V případě gancikloviru nebo valgancikloviru dominuje myelosuprese, vedoucí k opožděnému přihojení v neutrofilech a lymfocytech, a tím zvýšenému riziku mykotických a bakteriálních infekcí [37–40]. Další z dostupných léků, foscarnet, je spojen zejména s vážnou renální toxicitou a deplecí bivalentních iontů [41–43]. Doposud nejednoznačné je v profylaxi CMV postavení acikloviru. Jeho podávání nebývá spojeno se závažnou toxicitou a je běžně užíván v profylaxi jiných herpetických virů. V klinické praxi má řada center zkušenosti s podáváním vysokodávkovaného acikloviru s pozitivním efektem na riziko CMV reaktivací. V minulosti bylo publikováno několik retrospektivních prací, ve kterých se podávání acikoviru u řady pacientů osvědčilo stran prevence CMV reaktivací. Větší prospektivní data ale chybí a některé další práce jednoznačný benefit acikloviru nepotvrdily [44–50]. Lék tak nemá v mezinárodních doporučeních jednoznačné postavení [3].
Změny v zavedené praxi s dlouhodobou preferencí spíše preemptivní léčby CMV reaktivace bez užití CMV profylaxe přináší nově dostupné virostatikum letermovir, kterému je věnován následující přehled.
LETERMOVIR V PRIMÁRNÍ PROFYLAXI PO ALOGENNÍ TRANSPLANTACI KRVETVORNÝCH BUNĚK
Letermovir je nový nenukleosidový inhibitor CMV proliferace, který působí v pozdní fázi virové replikace. Inhibuje proteiny virového terminázového komplexu, který je zodpovědný za sestřih virové DNA do funkčních monomerů a jejich zabalení do virové kapsidy. Konkrétními cíli letermoviru jsou proteiny pUL56 a pUL89 terminázového komplexu [51,52]. Způsob účinku je zcela odlišný od ostatních CMV aktivních virostatik, jež fungují na základě přímé inhibice syntézy virové DNA. Vzhledem k této odlišnosti lze pravděpodobně očekávat nízké riziko zkřížené rezistence s ostatními virostatiky. Mechanizmus účinku a místo působení letermoviru spolu s ostatními užívanými virostatiky je znázorněn na obr. 1.
Obr. 1. Mechanizmus účinku letermoviru a ostatních virostatik na replikaci CMV. 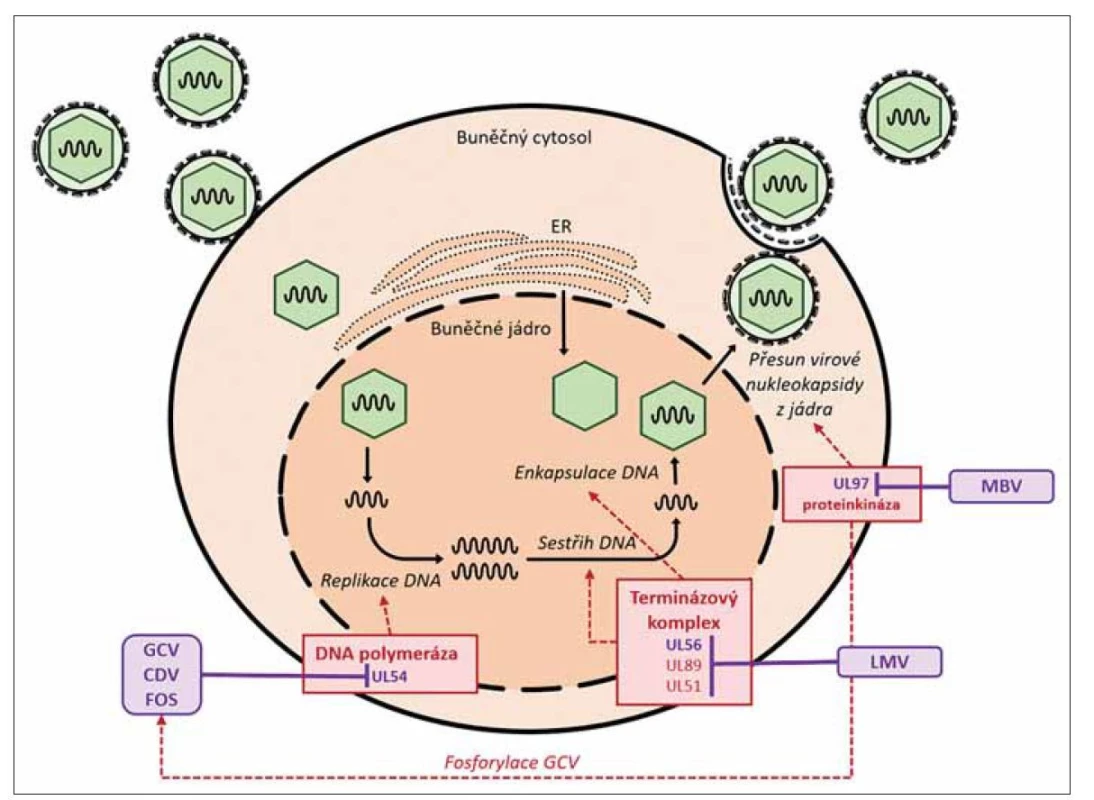
Oblastí působení letermoviru jsou proteiny terminázového komplexu (geny UL56, UL89, UL51), zodpovědné za sestřih nefunkčních DNA „konkatemerů“ na funkční virové monomery DNA a jejich zabalení do virové kapsidy. Nukleosidové analoga (ganciklovir, cidofovir, foscarnet) působí v oblasti DNA polymerázy (gen UL54) zodpovědné za přepis virové DNA při replikaci viru. Maribavir je inhibitor serin/threoninové proteinkinázy (gen UL97) zodpovědné za přesun virové nukleokapsidy z buněčného jádra a řadu dalších funkcí v repliakci CMV. Proteinkináza UL97 je zároveň zodpovědná za fosforylaci gancikloviru, která hraje klíčovou roli v jeho aktivaci.
CDV – cidofovir, CMV – cytomegalovirus, FOS – foscarnet, GCV – gancikovir, LET – letermovir, MBV – maribavirV současnosti je letermovir indikován v primární profylaxi cytomegalovirové infekce u CMV séropozitivních pacientů po alo-HSCT [53]. Mechanizmus účinku letermoviru je čistě selektivní pro replikaci CMV a nedochází k inhibici replikace ostatních herpetických virů [54]. U pacientů po alo-HSCT Je tudíž nutné jeho doplnění o profylaxi viru herpes simplex (HSV) a varicella zoster (VZV) [3]. Profylaxe letermovirem je dle současných doporučení zahajována do 28 dní od alo-HSCT v dávce 480 mg denně (240 mg denně při současném podávání cyklosporinu) a pokračuje do 100. dne po alo-HSCT. K dispozici je perorální i parenterální forma léku [53].
Pozn.: V České republice byl letermovir v daných indikacích hrazen z veřejného zdravotního pojištění, v době sepisování manuskriptu ovšem byla tato úhrada zrušena. Od 1. 12. 2021 tak použití letermoviru není ze systému veřejného zdravotního pojištění standardně hrazeno. Obnovení úhrady je v době sepisování manuskriptu předmětem jednání.
Primární profylaxe CMV – prospektivní klinické studie
Letermovir byl schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) pro profylaxi cytomegaloviru u CMV séropozitivních pacientů po alo-HSCT v roce 2017 a po schválení Evropskou lékovou agenturou (European Medicines Agency – EMA) v roce 2017 byl v roce 2019 přijat i v České republice. Schválení a zavedení léku do běžné klinické praxe bylo založeno především na základě výsledků třetí fáze multicentrické, randomizované, placebem kontrolované studie publikované v roce 2017 [55]. Této práci předcházela studie 2. fáze, publikovaná v roce 2014, srovnávající účinnost 3 různých dávek letermoviru (ve srovnání s placebem) podávaných celkem 131 pacientům po alo-HSCT v období po přihojení v krevním obraze. Studie ukázala benefit zejména v případě nejvyšší testované dávky letermoviru (240 mg), u které došlo ve srovnání s placebem k signifikantní redukci rozvoje CMV reaktivace či nemoci (48 vs. 29 %; p = 0,002), a to bez známek zvýšené toxicity léku oproti placebu [56]. Následovala tedy zmíněná studie 3. fáze, kde byl podáván letermovir nebo placebo po dobu až 14 týdnů u 565 CMV séropozitivních pacientů po alo-HSCT [55]. U všech pacientů byla pravidelně monitorována CMV virémie a případná reaktivace CMV byla v obou skupinách léčena standardní preemptivní léčbou. Profylaxe letermovirem vedla k signifikantně nižší incidenci klinicky signifikantní CMV infekce (cs-CMVi), která byla definována jako CMV reaktivace s nutností zahájení preemptivní léčby, nebo rozvoj CMV nemoci, hodnocené ve 24. týdnu od alo-HSCT (37,5 vs. 60,6 %; p < 0,001). K mírnému vzestupu incidence CMV reaktivace však došlo u pacientů s profylaxí po jejím ukončení, především v podskupině pacientů s GvHD léčenou kortikoidy. Incidence rozvinuté CMV nemoci, tedy s postižením cílového orgánu, se ve studii mezi oběma rameny signifikantně nelišila a byla v obou skupinách nízká (1,5 vs. 1,8 % pacientů, p hodnota neuvedena). Přestože nebyl rozdíl v četnosti rozvoje CMV nemoci, bylo pozorováno signifikantní snížení celkové mortality ve skupině s profylaxí (10,2 vs. 15,9 %; p < 0,03). Těchto výsledků bylo dosaženo u pacientů se standardním i vysokým rizikem CMV reaktivace (definováno jako přítomnost HLA neshody nebo haploidentická transplantace, přítomnost GvHD aj.), přičemž rozdíl v celkové mortalitě byl výrazněji vyjádřen právě u skupiny vysoce rizikových pacientů [55]. V později publikované následné mortalitní analýze, kde byly uvedeny výsledky dalšího sledování až do 48. týdne od alo-HSCT, byl zjišťován vliv na celkovou mortalitu v tomto pozdějším potransplantačním období [57]. Byla taktéž pozorovaná nižší celková mortalita u pacientů s profylaxí, rozdíl zde však nebyl statisticky signifikantní (23,8 vs. 27,6 %; p = 0,21).
Hlavním benefitem profylaxe letermovirem oproti samotné preemptivní léčbě se tak jeví nikoli přímo vliv na incidenci rozvinuté CMV nemoci, ale snížení samotné CMV reaktivace a pravděpodobně nepřímý pozitivní vliv na celkovou mortalitu vysoce rizikových pacientů po alo-HSCT. Již samotná jakákoli reaktivace CMV, jak bylo zmíněno v úvodu, je dle současných poznatků spojena s vyšší celkovou mortalitou nezávisle na progresi onemocnění do CMV nemoci [6,36]. To podporují i data ze samotné registrační studie, kde při subanalýze samotného kontrolního ramene (bez profylaxe) byla CMV reaktivace spojena s podstatně vyšší mortalitou ve srovnání s pacienty, u kterých k CMV reaktivaci nedošlo (31,0 vs. 18,2 %; p = 0,02) [57]. Příčiny této vyšší mortality, jak se domnívají i samotní autoři a jak uvádíme výše v textu, jsou pravděpodobně spojeny s myelotoxicitou preemptivní léčby a imunosupresivním efektem samotného CMV (především v případě reaktivace v časné fázi po alo-HSCT před přihojením v krevním obraze). Na ně navazují sekundární infekční komplikace. Schopnost lépe tolerovat nežádoucí toxicitu preemptivní terapie spolu s lepší kondicí imunitního systému (vč. imunity zaměřené na CMV) v období pokročilejší obnovy krvetvorby v pozdější fázi po alo-HSCT tak mají významný vliv na celkový efekt léčby CMV reaktivace. V případě pacientů s profylaxí letermovirem byl ve studii pozorován časový posun rozvoje cs-CMVi oproti pacientům bez profylaxe (43,9 vs. 94,0 % reaktivací CMV do 14. týdne). Tento efekt tak může být jedním z důvodů, proč nebyl pozorován výraznější rozdíl v mortalitě mezi pacienty s/bez cs-CMVi v rameni s letermovirem (15,8 vs. 19,4 %; p = 0,71), tak jako byl zjištěn u pacientů s placebem. Patrný je i mortalitní rozdíl při srovnání pacientů s cs-CMVi v rameni s placebem nebo letermovirem (31,0 vs. 15,8 %), který je nejspíše možné zdůvodnit obdobným způsobem [57]. Bohužel je uváděný mechanizmus v současnosti pouze hypotézou a data definitivně potvrzující tento mechanizmus redukce mortality zatím chybí. Za zmínku stojí i jiné možné příčiny rozdílné mortality při použití primární profylaxe letermovirem. V nedávné metaanalýze kinetiky CMV virémie v průběhu preemptivní léčby CMV reaktivace výška CMV nálože a její trvání korelovala s mortalitou pacientů [58]. Pokud se podíváme na výsledky z registrační studie, tak mezi pacienty s časnou klinicky signifikantní CMV reaktivací mělo maximální virovou nálož pod 1 000 IU/ml 84 % pacientů s profylaxí letermovirem ve srovnání s 28 % pacientů v rameni s placebem [55,57]. Vliv primární profylaxe letermovirem na virovou kinetiku tak může zlepšovat efektivitu následné preemptivní léčby a může být dalším mechanizmem ovlivňujícím celkovou mortalitu. Popsaný rozdíl v mortalitě pacientů s a bez profylaxe ve 24. týdnu od alo-HSCT se nicméně s postupující dobou od transplantace mezi oběma skupinami téměř vyrovnává, jak bylo ukázáno v dodatečné pozdější analýze [57]. Příčiny tohoto přiblížení křivek celkové mortality mezi oběma skupinami dávají i samotní autoři práce do souvislosti s celkovým poklesem rizika rozvoje CMV reaktivace a infekce v pozdější době, již nezávisle na předchozí CMV profylaxi. Zároveň však nelze vyloučit i negativní vliv již zmíněného nárůstu incidence CMV reaktivace po 14. týdnu po ukončení profylaxe (postprofylaktická reaktivace CMV) s posunem mortality mimo původně analyzované potransplantační období.
Primární profylaxe CMV – data z reálné klinické praxe
K dispozici jsou již také první data efektivity letermoviru v primární profylaxi CMV po alo-HSCT z reálné klinické praxe, většinou formou retrospektivních studií na menších a/nebo specifických, vysoce rizikových (např. alo-HSCT z buněk pupečníkové krve) skupinách pacientů [59–64]. Ve většině těchto prací vedla profylaxe letermovirem k redukci cs-CMVi ve srovnání s historickými soubory v souladu s výsledky uvedené prospektivní studie. Stěžejní vliv na mortalitu pacientů ale nebyl až na několik prací hodnocen. Z větších prací, hodnotících mimo jiné i vliv na mortalitu, uvádíme 2 retrospektivní studie. V multicentrické analýze 685 pacientů po alo-HSCT (114 pacientů s profylaxí letermovirem vs. 571 kontrol bez profylaxe) s převahou vysoce rizikových pacientů pro CMV reaktivaci byla pozorována signifikantní redukce v kumulativní incidenci cs-CMVi 180 dní od alo-HSCT u pacientů s profylaxí (44,7 vs. 72,4 %; p < 0,001) a zlepšilo se celkové přežití (80,4 vs. 73,0 %; p = 0,033), přičemž byl také obdobně popsán posun cs-CMVi do pozdější fáze po alo-HSCT (medián 90 vs. 36 dní; p < 0.001) [65]. Ve druhé retrospektivní studii hodnotící 537 CMV séropozitivních pacientů po alo-HSCT (123 pacientů s profylaxí letermovirem) bylo kromě snížení rizika cs-CMVi a CMV nemoci dokumentováno snížení nerelapsové mortality ve 48. týdnu od alo-HSCT (HR 0,55; 95% CI 0,32–0,93) [66]. V souvislosti s popisovaným vlivem sekundárních komplikací na mortalitu u pacientů s cs-CMVi nabízí ilustrativní data italská retrospektivní studie srovnávající 45 pacientů po alo-HSCT s profylaxí letermovirem s historickou kontrolou 41 pacientů po alo-HSCT bez profylaxe. Kromě redukce incidence cs-CMVi (17 vs. 60 %; p < 0,00001) a CMV nemoci (2 vs. 12 %; p = 0,02) byla zjištěna významná redukce sekundárních infekčních komplikací [67]. Ve skupině s profylaxí letermovirem došlo ke snížení incidence bakteriálních (37 vs. 56 %; p = 0,05) i invazivních mykotických infekcí (8 vs. 19 %; p = 0,09). Přestože vliv na mortalitu v publikované práci není uveden, snížení rizika sekundárních infekcí koresponduje s popsanými mechanizmy vlivu na redukci nerelapsové mortality dokumentovaných v předešlých pracích [55,65,66].
LETERMOVIR – DISKUTOVANÉ OTÁZKY V KLINICKÉ PRAXI
Profylaxe letermovirem po alogenní transplantaci krvetvorby se v současnosti stala na základě publikovaných dat novou alternativou v prevenci CMV infekce, a figuruje tak v současných mezinárodních doporučeních s vysokým stupněm doporučení [3]. Přestože ale jsou tato data pro užití letermoviru v primární profylaxi CMV u rizikových pacientů povzbudivá, některé otázky zatím zůstávají nezodpovězeny.
Délka trvání profylaxe letermovirem
Profylaxe letermovirem vedla v původní letermovirové studii k redukci celkové mortality ve 24. týdnu od alo-HSCT, nicméně v pozdější fázi došlo k přiblížení křivek nerelapsové mortality mezi oběma rameny a rozdíl ve 48. týdnu již nebyl signifikantní. Zvýšení incidence cs-CMVi v postprofylaktickém období, která byla popsána v registrační studii i některých retrospektivních pracích [55,67], může být jednou z příčin poklesu mortalitního benefitu v pozdější fázi po alo-HSCT. Prodloužení profylaxe letermovirem, která je v současnosti indikována pouze do 100 dní od alo-HSCT, tedy může teoreticky vést k dalšímu snížení cs-CMVi vč. pozdní mortality. Délka trvání profylaxe je tak diskutovanou otázkou. V současnosti probíhá randomizovaná multicentrická studie 3. fáze hodnotící efekt prodloužení profylaxe do 200 dní od alo-HSCT (Clinicaltrials.gov: NCT03930615).
Monitorace CMV virémie a zahájení preemptivní léčby
Pravidelná frekventní monitorace CMV virémie metodou PCR z plné krve nebo plazmy, případně vyšetření antigenu v periferní krvi, je všeobecně rozšířenou metodou v preemptivním přístupu a je součástí mezinárodního konsenzu pro prevenci rozvoje CMV nemoci [3]. Hodnoty CMV virémie považované za klinicky signifikantní a vedoucí k zahájení preemptivní terapie však nejsou v mezinárodních doporučeních jednoznačně stanoveny a mezi pracovišti se liší (tyto rozdíly mohou ovlivňovat hodnocení incidence klinicky významné CMV reaktivace a infekce). Podobně je odlišný přístup k jednorázovým pozitivním záchytům virémie bez konfirmace v následujícím kontrolním vzorku (tzv. blips pozitivity). Letermovir, jak už bylo popsáno výše, působí v konečné fázi virové replikace při finálním sestřihu virové DNA a vložení do virové kapsidy. Syntéza dlouhých řetězců virové DNA není na rozdíl od ostatních virostatik inhibujících virovou DNA polymerázu lékem narušena. Ve výsledku dochází ke vzniku dlouhých neinfekčních DNA molekul CMV [68]. V případě poškození buněk může být tato virová neinfekční DNA uvolňována, detekována v krvi pomocí RT-PCR a ve svém důsledku může způsobovat falešnou průlomovou infekci. Recentně publikovaná italská multicentrická práce hodnotící přítomnost cirkulující virové DNA u 75 pacientů po alo-HSCT s profylaxí letermovirem prokázala u 21 pacientů (28 %) přítomnost CMV virémie, která by dle standardních doporučení vedla k přerušení profylaxe a zahájení preemptivní léčby. U těchto pacientů nebyla v rámci dalšího došetření (degradace deoxyribonukleosidázou spolu s kultivací viru) prokázána přítomnost replikujícího se viru a u žádného z pacientů nedošlo k progresi do CMV nemoci [69]. Autoři se tedy domnívají, že se jedná o neinfekční virovou DNA vznikající výše popsaným mechanizmem, a tato pozitivita by neměla automaticky znamenat indikaci k zahájení preemptivní terapie. Význam „neinfekční“ DNA v krvi pacientů s profylaxí letermovirem bude muset být dále osvětlen a bude pravděpodobně nutné zohlednit probíhající profylaxi letermovirem při interpretaci výsledků vyšetření CMV virémie. Již nyní se v některých doporučeních objevují rozdílné cut-off hodnoty pro cs-CMVi v závislosti na přítomnosti rizikových faktorů pro CMV reaktivaci a použití CMV profylaxi [70]. Nicméně pravidelná frekventní monitorace CMV virémie je nadále plně indikována i v případě použití profylaxe letermovirem.
Rezistence CMV vůči letermoviru
Asi polovina reaktivací CMV v původní registrační studii u pacientů dostávajících profylaxi letermovirem odpovídá postprofylaktickým reaktivacím rozvíjejícím se po vysazení letermoviru. U zbylých pacientů došlo k reaktivaci v průběhu podávání profylaxe a důvody těchto průlomových reaktivací zatím nejsou jednoznačně známy [55]. Mezi jednu ze zvažovaných příčin může patřit rezistence CMV k letermoviru, jež bývá nejčastěji způsobena mutacemi v genu UL56, ale také UL89 a UL51, jak bylo popsáno v několika in vitro studiích [71–74]. Klinická data týkající se významu rezistence k letermoviru jsou zatím limitovaná většinou v podobě kazuistik z reálné klinické praxe, a to jak u pacientů s primární profylaxí, tak především u pacientů s off-label použitím letermoviru v sekundární profylaxi [75–78]. Problematika virové rezistence vůči letermoviru byla řešena i v rámci dodatečné analýzy pacientů zařazených do tzv. letermovirové studie. Zde bylo provedeno dodatečné genotypizační vyšetření u 50 pacientů na profylaxi letermovirem, u kterých se rozvinula klinicky významná breakthrough infekce. Z nich pouze u 3 pacientů byla zachycena genetická varianta vedoucí k rezistenci k letermoviru, přičemž u 2 byl rozvoj rezistence dáván do souvislosti s přítomností CMV virémie již v době zahájení profylaxe a se suboptimálním užíváním léku. Výskyt kmenů rezistentních k letermoviru nebyl v práci častý a de facto se nevyskytoval v případech standardně podávané primární profylaxe [79]. Uvedená data naznačují možnou odlišnou situaci s vyšším rizikem rozvoje rezistence v případě podávání letermoviru v podmínkách aktivní infekce nebo v případě sekundární profylaxe, kde byl popsán rychlý vznik rezistentních kmenů i v několika dalších pracích [80–84]. Rovněž některé in vitro analýzy ukazují na pravděpodobně relativně nízkou genetickou bariéru ke vzniku rezistentních kmenů, která v prostředí již aktivní CMV infekce může snadno vést k selekci rezistentních kmenů [71,73,84–86]. Testování rezistence CMV k letermoviru v České republice není zatím všeobecně rozšířeno i vzhledem k absenci komerčních testů. Na některých pracovištích je už vyšetření dostupné ve formě in house metod (např. Centrum molekulární biologie a genetiky interní hematologické a onkologické kliniky FN Brno a LF MU).
Letermovir v sekundární profylaxi a preemptivní léčbě
Nízká toxicita s možností perorální i parenterální formy a odlišný mechanizmus účinku ve srovnání s ostatními CMV virostatiky snižující riziko zkřížené rezistence představuje atraktivní možnost použití letermoviru v sekundární profylaxi nebo preemptivní léčbě, zejména v případě rozvoje rezistence či toxicity vůči ostatním virostatikům. Validní prospektivní data pro zmíněné off-label indikace doposud chybí, publikováno bylo několik menších observačních retrospektivních prací [59,64,87,88]. Zároveň v současnosti probíhá klinická studie 2. fáze hodnotící efektivitu a bezpečnost léčby letermovirem u imunokompromitovaných pacientů s refrakterní nebo rezistentní CMV infekcí či nemocí (Clinicaltrials.gov: NCT03728426). V „letermovirové“ registrační studii byla u části pacientů zpětně zjištěna přítomnost CMV virémie již před zahájením profylaxe, a letermovir tak byl de facto podáván v rámci preemptivní léčby. Tito pacienti byli vyřazeni z primárního hodnocení efektivity a účinnost letermoviru byla u této skupiny hodnocena zvlášť v samostatně publikované analýze. Ze 70 hodnocených pacientů (48 = letermovir, 22 = placebo) se vstupní nízkou hladinou CMV virémie došlo k rozvoji cs-CMVi u 33,1 vs. 86,6 % pacientů (letermovir vs. placebo; p < 0,001), což odpovídá signifikantnímu poklesu nutnosti nasazení preemptivní léčby [55,89]. Dále byla v rámci sekundární profylaxe hodnocena efektivita letermoviru v retrospektivní francouzské analýze 80 pacientů (v rámci „soucitného programu“), kde došlo k opětovnému rozvoji CMV infekce/nemoci u 4/80 pacientů (5,5 %), přičemž u 3 z těchto pacientů byla prokázána mutace UL56 vedoucí k rezistenci k letermoviru [75]. V sekundární profylaxi (40 pacientů), preemptivní léčbě (5 pacientů) i léčbě CMV nemoci (2 pacienti) byl analyzován letermovir v retrospektivní analýze EBMT (European Society for Blood and Marrow Transplantation). V případě sekundární profylaxe došlo k opětovné cs-CMVi pouze u 4/40 pacientů (10 %) a u obou pacientů s CMV nemocí došlo k vymizení známek infekce. Na druhou stranu v případě preemptivní léčby letermovirem nebyl zaznamenán efekt u žádného z 5 pacientů [90]. Ačkoli se tedy z uvedených dostupných dat zdá, že použití letermoviru může být především v rámci sekundární profylaxe účinnou terapeutickou možností, jedná se o malé, heterogenní případy pacientů s limitovaným sledováním. K širšímu použití letermoviru v těchto indikacích je potřeba vyčkat výsledků větších, ideálně prospektivních studií, a to zejména v případě použití v rámci preemptivní léčby, kdy výsledky retrospektivních analýz nebyly tak přesvědčivé a existují již zmiňované obavy ze snadnějšího vzniku rezistence v podmínkách aktivní infekce.
Postavení a přínos letermoviru v běžné klinické praxi
Letermovir v prevenci CMV prokázal řadu benefitů v klinických studiích i reálné klinické praxi. Z tohoto důvodu má dle ECIL (European Conference on Infections in Leukaemia) v současnosti vysoký stupeň doporučení. Postavení v každodenní klinické praxi, i vzhledem k doposud poměrně vysokým finančním nákladům a nadále trvající nutnosti standardní monitorace CMV, zatím není zcela ukotveno. Incidence CMV nemoci je i v případě užívání preemptivní léčby bez profylaxe nízká. Jak již bylo výše uvedeno, hlavním benefitem letermoviru je jeho nepřímý vliv na mortalitu pacientů. Ten je realizovaný snížením rizika reaktivace CMV a na ni navázaných komplikací jako GvHD či mykotických infekcí. Preemptivní léčba reaktivace CMV a rozvoj zmíněných komplikací vedou zpravidla k nutnosti opakovaných hospitalizací a toxicitě snižující rezervy pacienta pro další léčbu a značně zhoršující kvalitu života pacienta. V neposlední řadě vede k zvyšování nákladů na léčbu. Komplexnost těchto dějů s řadou proměnných, jež jsou letermovirem ovlivněny nepřímo, ztěžují jednoznačné zhodnocení významu letermoviru. Důležitým aspektem pro hodnocení dopadu letermoviru na péči o pacienty po HSCT je také trvání benefitu. Postupný pokles rozdílu v přežití v pozdějším období po HSCT pod hranici statistické významnosti, jak byl popsán v registrační studii [57], může snižovat význam jeho vlivu na uváděné faktory. Vzhledem k vysokému zastoupení CMV séropozitivních jedinců v populaci [8,12] je finanční nákladnost léčby, která se tak bude v principu týkat většiny pacientů po HSCT, nezanedbatelným aspektem rozhodování v klinické praxi. Hodnocení nákladové efektivity letermoviru [91–93] srovnává jeho použití v profylaxi s pouhou monitorací CMV a preemptivní léčbou. Tyto analýzy vychází z výsledků dosažených v registrační studii a z dlouhodobých dat o přežití. Kromě nákladů na samotnou CMV profylaxi, monitoraci CMV a preemptivní léčbu byly zohledňovány i náklady spojené s komplikacemi, dodatečnými hospitalizacemi aj. Použity byly standardně užívané parametry jako QALY (tj. získaný rok života v plné kvalitě, quality-adjusted life-year), přímé zdravotní náklady, poměr inkrementálních nákladů a přínosů (incremental cost-effectiveness ratios – ICERs) a další. Použití letermoviru vedlo ke zvýšení QALY pacientů a s tím spojenému zvýšení celkových nákladů na péči oproti samotné preemptivní léčbě. Poměr inkrementálních nákladů v případě letermoviru nepřesahoval všeobecně akceptovatelný práh výdajů (willingness-to-pay) za nárůst o 1 QALY, a je tak v analýzách považován za nákladově efektivní. Jedná se samozřejmě o modelové analýzy plátců zdravotní péče cílené obecně na otázku úhrady letermoviru, tudíž pro rozhodování v klinické praxi jsou použitelné pouze omezeně. Letermovir nicméně jednoznačně doplňuje standardní metody v prevenci CMV. U řady pacientů za akceptovatelnou cenu snižuje rizika části potransplantačních komplikací a nepřímo tak může vést ke zlepšení celkového přežití a kvality života. Největší význam lze očekávat u pacientů s kombinací rizikových faktorů pro rozvoj GvHD, reaktivace CMV a sekundárních infekcí.
ZÁVĚR
Letermovir prokázal účinnost v primární profylaxi rozvoje CMV reaktivace a nemoci u CMV séropozitivních pacientů po alogenní transplantaci krvetvorby, zejména u pacientů ve vysokém riziku CMV infekce. Lék tak představuje léčebnou alternativu k všeobecně používanému postupu na principu časné preemptivní terapie asymptomatické CMV reaktivace. Vzhledem k nízké incidenci rozvinuté CMV nemoci i v případě dosud standardně užívaného preemptivního přístupu bez CMV profylaxe se jako významný jeví především pokles incidence CMV reaktivace vedoucí nepřímým mechanizmem ke snížení celkové mortality. Dostupná data jsou však zatím relativně limitovaná a řada otázek zůstává doposud nezodpovězena. V současnosti chybí exaktní odpovědi týkající se 1) vlivu profylaxe letermovirem na celkovou mortalitu především v pozdní fázi po alo-HSCT, 2) optimální délky trvání profylaxe, 3) užití letermoviru v sekundární profylaxi a preemptivní léčbě. Finální postavení letermoviru v rámci péče o pacienty po HSCT i vzhledem k finančním aspektům jeho použití tak zůstává do jisté míry otevřené budoucím analýzám a zkušenostem.
PODÍL SPOLUAUTORŮ NA PŘÍPRAVĚ RUKOPISU
TK – příprava rukopisu
BW, ML, FF, JM – revize rukopisu
Všichni autoři souhlasí s finální verzí rukopisu.
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 29. 9. 2021.
Přijato po recenzi dne: 3. 1. 2022.
MUDr. Tomáš Kabut
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e-mail: kabut.tomas@fnbrno.cz
Zdroje
1. Crough T, Khanna R. Immunobiology of human cytomegalovirus: from bench to bedside. Clin Microbiol Rev. 2009; 22 (1): 76–98.
2. Bate SL, Dollard SC, Cannon MJ. Cytomegalovirus seroprevalence in the United States: the national health and nutrition examination surveys, 1988-2004. Clin Infect Dis. 2010; 50 (11): 1439–1447.
3. Ljungman P, de la Camara R, Robin C, et al. Guidelines for the management of cytomegalovirus infection in patients with haematological malignancies and after stem cell transplantation from the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect Dis. 2019; 19 (8): e260–e272.
4. Boeckh M, Nichols WG, Papanicolaou G, et al. Cytomegalovirus in hematopoietic stem cell transplant recipients: current status, known challenges, and future strategies. Biol Blood Marrow Transplant. 2003; 9 (9): 543–558.
5. Chan ST, Logan AC. The clinical impact of cytomegalovirus infection following allogeneic hematopoietic cell transplantation: why the quest for meaningful prophylaxis still matters. Blood Rev. 2017; 31 (3): 173–183.
6. Teira P, Battiwalla M, Ramanathan M, et al. Early cytomegalovirus reactivation remains associated with increased transplant-related mortality in the current era: a CIBMTR analysis. Blood. 2016; 127 (20): 2427–2438.
7. Schmidt-Hieber M, Labopin M, Beelen D, et al. CMV serostatus still has an important prognostic impact in de novo acute leukemia patients after allogeneic stem cell transplantation: a report from the Acute Leukemia Working Party of EBMT. Blood. 2013; 122 (19): 3359–3364.
8. Ljungman P, Brand R, Hoek J, et al. Donor cytomegalovirus status influences the outcome of allogeneic stem cell transplant: a study by the European Group for Blood and Marrow Transplantation. Clin Infect Dis. 2014; 59 (4): 473–481.
9. Boeckh M, Nichols WG. The impact of cytomegalovirus serostatus of donor and recipient before hematopoietic stem cell transplantation in the era of antiviral prophylaxis and preemptive therapy. Blood. 2004; 103 (6): 2003–2008.
10. Zhou W, Longmate J, Lacey SF, et al. Impact of donor CMV status on viral infection and reconstitution of multifunction CMV-specific T cells in CMV-positive transplant recipients. Blood. 2009; 113 (25): 6465–6476.
11. Ganepola S, Gentilini C, Hilbers U, et al. Patients at high risk for CMV infection and disease show delayed CD8+ T-cell immune recovery after allogeneic stem cell transplantation. Bone Marrow Transplant. 2007; 39 (5): 293–299.
12. George B, Pati N, Gilroy N, et al. Pre-transplant cytomegalovirus (CMV) serostatus remains the most important determinant of CMV reactivation after allogeneic hematopoietic stem cell transplantation in the era of surveillance and preemptive therapy. Transpl Infect Dis. 2010; 12 (4): 322.
13. van der Heiden P, Marijt E, Falkenburg F, et al. Control of cytomegalovirus viremia after allogeneic stem cell transplantation: a review on CMV-specific T cell reconstitution. Biol Blood Marrow Transplant. 2018; 24 (9): 1776–1782.
14. Goldsmith SR, Abid MB, Auletta JJ, et al. Posttransplant cyclophosphamide is associated with increased cytomegalovirus infection: a CIBMTR analysis. Blood. 2021; 137 (23): 3291–3305.
15. Nakamae H, Kirby KA, Sandmaier BM, et al. Effect of conditioning regimen intensity on CMV infection in allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2009; 15 (6): 694–703.
16. Marty FM, Bryar J, Browne SK, et al. Sirolimus-based graft-versus-host disease prophylaxis protects against cytomegalovirus reactivation after allogeneic hematopoietic stem cell transplantation: a cohort analysis. Blood. 2007; 110 (2): 490–500.
17. Nichols WG, Corey L, Gooley T, et al. Rising pp65 antigenemia during preemptive anticytomegalovirus therapy after allogeneic hematopoietic stem cell transplantation: risk factors, correlation with DNA load, and outcomes. Blood. 2001; 97 (4): 867–874.
18. Dziedzic M, Sadowska-Krawczenko I, Styczynski J. Risk factors for cytomegalovirus infection after allogeneic hematopoietic cell transplantation in malignancies: proposal for classification. Anticancer Res. 2017; 37 (12): 6551–6556.
19. George B, Kerridge I, Gilroy N, et al. Fludarabine-based reduced intensity conditioning transplants have a higher incidence of cytomegalovirus reactivation compared with myeloablative transplants. Bone Marrow Transplant. 2010; 45 (5): 849–855.
20. Piñana JL, Martino R, Barba P, et al. Cytomegalovirus infection and disease after reduced intensity conditioning allogeneic stem cell transplantation: single-centre experience. Bone Marrow Transplant. 2010; 45 (3): 534–542.
21. Ljungman P, Perez-Bercoff L, Jonsson J, et al. Risk factors for the development of cytomegalovirus disease after allogeneic stem cell transplantation. Haematologica. 2006; 91 (1): 78–83.
22. Martino R, Rovira M, Carreras E, et al. Severe infections after allogeneic peripheral blood stem cell transplantation: a matched-pair comparison of unmanipulated and CD34+ cell-selected transplantation. Haematologica. 2001; 86 (10): 1075–1086.
23. Cantoni N, Hirsch HH, Khanna N, et al. Evidence for a bidirectional relationship between cytomegalovirus replication and acute graft-versus-host disease. Biol Blood Marrow Transplant. 2010; 16 (9): 1309–1314.
24. Herling M, Schröder L, Awerkiew S, et al. Persistent CMV infection after allogeneic hematopoietic stem cell transplantation in a CMV-seronegative donor-to-positive recipient constellation: Development of multidrug resistance in the absence of anti-viral cellular immunity. J Clin Virol. 2016; 74 : 57–60.
25. Stevanovic S, van Bergen CA, van Luxemburg-Heijs SA, et al. HLA class II upregulation during viral infection leads to HLA-DP-directed graft-versus-host disease after CD4+ donor lymphocyte infusion. Blood. 2013; 122 (11): 1963–1973.
26. van der Zouwen B, Kruisselbrink AB, Jordanova ES, et al. Alloreactive effector T cells require the local formation of a proinflammatory environment to allow crosstalk and high avidity interaction with nonhematopoietic tissues to induce GVHD reactivity. Biol Blood Marrow Transplant. 2012; 18 (9): 1353–1367.
27. Yong MK, Slavin MA, Kontoyiannis DP. Invasive fungal disease and cytomegalovirus infection: is there an association? Curr Opin Infect Dis. 2018; 31 (6): 481–489.
28. Garcia-Vidal C, Upton A, Kirby KA, Marr KA. Epidemiology of invasive mold infections in allogeneic stem cell transplant recipients: biological risk factors for infection according to time after transplantation. Clin Infect Dis. 2008; 47 (8): 1041–1050.
29. Yong MK, Ananda-Rajah M, Cameron PU, et al. Cytomegalovirus reactivation is associated with increased risk of late-onset invasive fungal disease after allogeneic hematopoietic stem cell transplantation: a multicenter study in the current era of viral load monitoring. Biol Blood Marrow Transplant. 2017; 23 (11): 1961–1967.
30. Atalla A, Garnica M, Maiolino A, Nucci M. Risk factors for invasive mold diseases in allogeneic hematopoietic cell transplant recipients. Transpl Infect Dis. 2015; 17 (1): 7–13.
31. Mikulska M, Raiola AM, Bruno B, et al. Risk factors for invasive aspergillosis and related mortality in recipients of allogeneic SCT from alternative donors: an analysis of 306 patients. Bone Marrow Transplant. 2009; 44 (6): 361–370.
32. Chen K, Cheng MP, Hammond SP, et al. Antiviral prophylaxis for cytomegalovirus infection in allogeneic hematopoietic cell transplantation. Blood Adv. 2018; 2 (16): 2159–2175.
33. Marty FM, Rubin RH. The prevention of infection post-transplant: the role of prophylaxis, preemptive and empiric therapy. Transpl Int. 2006; 19 (1): 2–11.
34. Green ML, Leisenring W, Stachel D, et al. Efficacy of a viral load-based, risk-adapted, preemptive treatment strategy for prevention of cytomegalovirus disease after hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2012; 18 (11): 1687–1699.
35. Erard V, Guthrie KA, Seo S, et al. Reduced mortality of cytomegalovirus pneumonia after hematopoietic cell transplantation due to antiviral therapy and changes in transplantation practices. Clin Infect Dis. 2015; 61 (1): 31–39.
36. Green ML, Leisenring W, Xie H, et al. CMV viral load and mortality after hematopoietic cell transplantation: a cohort study in the era of preemptive therapy. Lancet Haematol. 2016; 3 (3): e119–e127.
37. Goodrich JM, Bowden RA, Fisher L, et al. Ganciclovir prophylaxis to prevent cytomegalovirus disease after allogeneic marrow transplant. Ann Intern Med. 1993; 118 (3): 173–178.
38. Winston DJ, Ho WG, Bartoni K, et al. Ganciclovir prophylaxis of cytomegalovirus infection and disease in allogeneic bone marrow transplant recipients. Results of a placebo-controlled, double-blind trial. Ann Intern Med. 1993; 118 (3): 179–184.
39. Winston DJ, Yeager AM, Chandrasekar PH, et al. Randomized comparison of oral valacyclovir and intravenous ganciclovir for prevention of cytomegalovirus disease after allogeneic bone marrow transplantation. Clin Infect Dis. 2003; 36 (6): 749–758.
40. Ljungman P, de La Camara R, Milpied N, et al. Randomized study of valacyclovir as prophylaxis against cytomegalovirus reactivation in recipients of allogeneic bone marrow transplants. Blood. 2002; 99 (8): 3050–3056.
41. Ordemann R, Naumann R, Geissler G, et al. Foscarnet – an alternative for cytomegalovirus prophylaxis after allogeneic stem cell transplantation? Ann Hematol. 2000; 79 (8): 432–436.
42. Bregante S, Bertilson S, Tedone E, et al. Foscarnet prophylaxis of cytomegalovirus infections in patients undergoing allogeneic bone marrow transplantation (BMT): a dose-finding study. Bone Marrow Transplant. 2000; 26 (1): 23–29.
43. Bacigalupo A, Boyd A, Slipper J, et al. Foscarnet in the management of cytomegalovirus infections in hematopoietic stem cell transplant patients. Expert Rev Anti Infect Ther. 2012; 10 (11): 1249–1264.
44. Prentice HG, Gluckman E, Powles RL, et al. Impact of long-term acyclovir on cytomegalovirus infection and survival after allogeneic bone marrow transplantation. European Acyclovir for CMV Prophylaxis Study Group. Lancet. 1994; 343 (8900): 749–753.
45. Milano F, Pergam SA, Xie H, et al. Intensive strategy to prevent CMV disease in seropositive umbilical cord blood transplant recipients. Blood. 2011; 118 (20): 5689–5696.
46. Nakamura R, Cortez K, Solomon S, et al. High-dose acyclovir and pre-emptive ganciclovir to prevent cytomegalovirus disease in myeloablative and non-myeloablative allogeneic stem cell transplantation. Bone Marrow Transplant. 2002; 30 (4): 235–242.
47. Hazar V, Kansoy S, Küpesiz A, et al. High-dose acyclovir and pre-emptive ganciclovir in prevention of cytomegalovirus disease in pediatric patients following peripheral blood stem cell transplantation. Bone Marrow Transplant. 2004; 33 (9): 931–935.
48. Hazar V, Ugur A, Colak D, et al. Cytomegalovirus antigenemia and outcomes of patients undergoing allogeneic peripheral blood stem cell transplantation: effects of long-term high-dose acyclovir prophylaxis and preemptive ganciclovir treatment. Jpn J Infect Dis. 2006; 59 (4): 216–221.
49. Burns LJ, Miller W, Kandaswamy C, et al. andomized clinical trial of ganciclovir vs acyclovir for prevention of cytomegalovirus antigenemia after allogeneic transplantation. Bone Marrow Transplant. 2002; 30 (12): 945–951.
50. Prentice HG, Gluckman E, Powles RL, et al. Long-term survival in allogeneic bone marrow transplant recipients following acyclovir prophylaxis for CMV infection. The European Acyclovir for CMV Prophylaxis Study Group. Bone Marrow Transplant. 1997; 19 (2): 129–133.
51. Lischka P, Hewlett G, Wunberg T, et al. In vitro and in vivo activities of the novel anticytomegalovirus compound AIC246. Antimicrob Agents Chemother. 2010; 54 (3): 1290–1297.
52. Goldner T, Hewlett G, Ettischer N, et al. The novel anticytomegalovirus compound AIC246 (Letermovir) inhibits human cytomegalovirus replication through a specific antiviral mechanism that involves the viral terminase. J Virol. 2011; 85 (20): 10884–10893.
53. Prevymis., European Medicines Agency. Prevymis. [Online] https: //www.ema.europa.eu/en/medicines/human/EPAR/prevymis. Citováno dne: 15.7.2021
54. Marschall M, Stamminger T, Urban A, et al. In vitro evaluation of the activities of the novel anticytomegalovirus compound AIC246 (letermovir) against herpesviruses and other human pathogenic viruses. Antimicrob Agents Chemother. 2012; 56 (2): 1135–1137.
55. Marty FM, Ljungman P, Chemaly RF, et al. Letermovir prophylaxis for cytomegalovirus in hematopoietic-cell transplantation. N Engl J Med. 2017; 377 (25): 2433–2444.
56. Chemaly RF, Ullmann AJ, Stoelben S, et al. Letermovir for cytomegalovirus prophylaxis in hematopoietic-cell transplantation. N Engl J Med. 2014; 370 (19): 1781–1789.
57. Ljungman P, Schmitt M, Marty FM, et al. A mortality analysis of letermovir prophylaxis for cytomegalovirus (CMV) in CMV-seropositive recipients of allogeneic hematopoietic cell transplantation. Clin Infect Dis. 2020; 70 (8): 1525–1533.
58. Duke ER, Gilbert PB, Stevens-Ayers TL, et al. Viral kinetic correlates of cytomegalovirus disease and death after hematopoietic cell transplant. Biol Blood Marrow Transplant. 2018; 24: S20–S24.
59. Lin A, Maloy M, Su Y, et al. Letermovir for primary and secondary cytomegalovirus prevention in allogeneic hematopoietic cell transplant recipients: Real-world experience. Transpl Infect Dis. 2019; 21 (6): e13187.
60. Chen K, Arbona-Haddad E, Cheng MP, et al. Cytomegalovirus events in high-risk allogeneic hematopoietic-cell transplantation patients who received letermovir prophylaxis. Transpl Infect Dis. 2021: e13619.
61. Lin A, Flynn J, DeRespiris L, et al. Letermovir for prevention of cytomegalovirus reactivation in haploidentical and mismatched adult donor allogeneic hematopoietic cell transplantation with post-transplantation cyclophosphamide for graft-versus-host disease prophylaxis. Transplant Cell Ther. 2021; 27 (1): 85.e1–85.e6.
62. Royston L, Royston E, Masouridi-Levrat S, et al. Letermovir primary prophylaxis in high-risk hematopoietic cell transplant recipients: a matched cohort study. Vaccines (Basel). 2021; 9 (4): 372.
63. Johnsrud JJ, Nguyen IT, Domingo W, et al. Letermovir prophylaxis decreases burden of cytomegalovirus (CMV) in patients at high risk for CMV disease following hematopoietic cell transplant. Biol Blood Marrow Transplant. 2020; 26 (10): 1963–1970.
64. Studer U, Khanna N, Leuzinger K, et al. Incidence of CMV Replication and the Role of letermovir primary/secondary prophylaxis in the early phase after allogeneic hematopoietic stem cell transplantation – a single centre study. Anticancer Res. 2020; 40 (10): 5909–5917.
65. Mori Y, Jinnouchi F, Takenaka K, et al. Efficacy of prophylactic letermovir for cytomegalovirus reactivation in hematopoietic cell transplantation: a multicenter real-world data. Bone Marrow Transplant. 2021; 56 (4): 853–862.
66. Sassine J, Khawaja F, Shigle TL, et al. Refractory and resistant cytomegalovirus after hematopoietic cell transplant in the letermovir primary prophylaxis era. Clin Infect Dis. 2021: ciab298.
67. Malagola M, Pollara C, Polverelli N, et al. Advances in CMV management: a single center real-life experience. Front Cell Dev Biol. 2020; 8 : 534268.
68. Razonable RR. Role of letermovir for prevention of cytomegalovirus infection after allogeneic haematopoietic stem cell transplantation. Curr Opin Infect Dis. 2018; 31 (4): 286–291.
69. Cassaniti I, Colombo AA, Bernasconi P, et al. Positive HCMV DNAemia in stem cell recipients undergoing letermovir prophylaxis is expression of abortive infection. Am J Transplant. 2021; 21 (4): 1622–1628.
70. Einsele H, Ljungman P, Boeckh M, et al. How I treat CMV reactivation after allogeneic hematopoietic stem cell transplantation. Blood. 2020; 135 (19): 1619–1629.
71. Chou S. Rapid in vitro evolution of human cytomegalovirus UL56 mutations that confer letermovir resistance. Antimicrob Agents Chemother. 2015; 59 (10): 6588–6593.
72. Goldner T, Hempel C, Ruebsamen-Schaeff H, et al. Geno - and phenotypic characterization of human cytomegalovirus mutants selected in vitro after letermovir (AIC246) exposure. Antimicrob Agents Chemother. 2014; 58 (1): 610–613.
73. Chou S. A third component of the human cytomegalovirus terminase complex is involved in letermovir resistance. AntivirRes. 2017; 148 : 1–4.
74. Chou S. Comparison of cytomegalovirus terminase gene mutations selected after exposure to three distinct inhibitor compounds. Antimicrob Agents Chemother. 2017; 61 (11): e01325–17.
75. Robin Ch, Thiebaut A, Alain S, et al. Letermovir for secondary prophylaxis of cytomegalovirus infection and disease after allogeneic hematopoietic cell transplantation: results from the French compassionate program. Biol Blood Marrow Transplant. 2020; 26 (5): 978–984.
76. Kilgore JT, Becken B, Varga MG, et al. Letermovir for salvage therapy for resistant cytomegalovirus in a pediatric hematopoietic stem cell transplant recipient. J Pediatric Infect Dis Soc. 2020; 9 (4): 486–489.
77. Knoll BM, Seiter K, Phillips A, et al. Breakthrough cytomegalovirus pneumonia in hematopoietic stem cell transplant recipient on letermovir prophylaxis. Bone Marrow Transplant. 2019; 54 (6): 911–912.
78. Popping S, Dalm VASH, Lübke N, et al. Emergence and persistence of letermovir-resistant cytomegalovirus in a patient with primary immunodeficiency. Open Forum Infect Dis. 2019; 6 (9): ofz375.
79. Douglas CM, Barnard R, Holder D, et al. Letermovir resistance analysis in a clinical trial of cytomegalovirus prophylaxis for hematopoietic stem cell transplant recipients. J Infect Dis. 2020; 221 (7): 1117–1126.
80. Frietsch JJ, Michel D, Stamminger T, et al. In vivo emergence of UL56 C325Y cytomegalovirus resistance to letermovir in a patient with acute myeloid leukemia after hematopoietic cell transplantation. Mediterr J Hematol Infect Dis. 2019; 11 (1): e2019001.
81. Cherrier L, Nasar A, Goodlet KJ, et al. Emergence of letermovir resistance in a lung transplant recipient with ganciclovir-resistant cytomegalovirus infection. Am J Transplant. 2018; 18 (12): 3060–3064.
82. Jung S, MichelM, Stamminger T, et al. Fast breakthrough of resistant cytomegalovirus during secondary letermovir prophylaxis in a hematopoietic stem cell transplant recipient. BMC Infect Dis. 2019; 19 (1): 388.
83. Turner N, Strand A, Grewal DS, et al. Use of letermovir as salvage therapy for drug-resistant cytomegalovirus retinitis. Antimicrob Agents Chemother. 2019; 63 (3): e02337–18.
84. James SH. Letermovir resistance in hematopoietic stem cell transplant recipients: the risks associated with cytomegalovirus prophylaxis. J Infect Dis. 2020; 221 (7): 1036–1038.
85. Chou S, Satterwhite LE, Ercolani RJ. New locus of drug resistance in the human cytomegalovirus UL56 gene revealed by in vitro exposure to letermovir and ganciclovir. Antimicrob Agents Chemother. 2018; 62: e00922–18.
86. Piret J, Goyette N, Boivin G. Drug susceptibility and replicative capacity of multidrug-resistant recombinant human cytomegalovirus harboring mutations in UL56 and UL54 genes. Antimicrob Agents Chemother. 2017; 61 (11): e01044–17.
87. Chiereghin A, Belotti T, Borgatti EC, et al. Off-label use of letermovir as preemptive anti-cytomegalovirus therapy in a pediatric allogeneic peripheral blood stem cell transplant. Infect Drug Resist. 2021; 14 : 1185–1190.
88. Merchant SL, Gatwood KS, Satyanarayana G, et al. Efficacy and pharmacoeconomic impact of letermovir for CMV prophylaxis in allogeneic hematopoeitic cell transplant recipients. Biol Bone Marrow Transplant. 2019; 25: S280.
89. Marty FM, Ljungman PT, Chemaly RF, et al. Outcomes of patients with detectable CMV DNA at randomization in the phase III trial of letermovir for the prevention of CMV infection in allogeneic hematopoietic cell transplantation. Am J Transplant. 2020; 20 (6): 1703–1711.
90. Styczyński J, Tridello G, Xhaard A, et al. Use of letermovir in off-label indications: Infectious Diseases Working Party of European Society of Blood and Marrow Transplantation retrospective study. Bone Marrow Transplant. 2021; 56 (5): 1171–1179.
91. Alsumali A, Chemaly RF, Graham J, et al. Cost-effectiveness analysis of cytomegalovirus prophylaxis in allogeneic hematopoietic cell transplant recipients from a US payer perspective. J Med Virol. 2021; 93 (6): 3786–3794.
92. Chan TS, Cheng SS, Chen WT, et al. Cost-effectiveness of letermovir as cytomegalovirus prophylaxis in adult recipients of allogeneic hematopoietic stem cell transplantation in Hong Kong. J Med Econ. 2020; 23 (12): 1485–1492.
93. Restelli U, Croce D, Pacelli V, et al. Cost-effectiveness analysis of the use of letermovir for the prophylaxis of cytomegalovirus in adult cytomegalovirus seropositive recipients undergoing allogenic hematopoietic stem cell transplantation in Italy. Infect Drug Resist. 2019; 12 : 1127–1138.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek EditorialČlánek Dr. Horská slaví 70 let
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Novinky v léčbě mycosis fungoides a Sézaryho syndromu
- Současný výskyt akutní megakaryoblastické leukemie a germinálního tumoru mediastina – kazuistika a přehled literatury
- Editorial
- Izolovaná infiltrace ledviny suspektními leukemickými buňkami – kazuistika s komplexní diferenciální diagnostikou neobvyklého stavu
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Marcela Lukášová – ušlechtilá dáma české hematologie
- Muž s dýmkou, prof. MUDr. Pavel Klener, DrSc., se v dubnu 2022 dožívá 85 let
- Doc. RNDr. Miroslav Pecka, CSc., slaví 75 let
- Primář MUDr. Vladimír Komrska, CSc., sedmdesátiletý
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Dr. Horská slaví 70 let
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení laboratorní sekce České hematologické společnosti ČLS JEP
- MUDr. Jan Haber, CSc., sedmdesátiletý
- Letermovir u pacientů po alogenní transplantaci krvetvorných buněk – přehled literatury
- Doporučení České společnosti paliativní medicíny ČLS JEP a Společnosti pro transfuzní lékařství ČLS JEP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



