-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Skladování erytrocytů při nestandardní teplotě
Storing red cells at non-standard temperature
Background: Storage conditions of red cell transfusion components are set out by generally binding legal regulations. If these are not observed, the producer´s qualified person decides regarding their further use. The Society for Transfusion Medicine (STL) thus drew up Guideline No. 2015/11 defining the shortening of transfusion component usability according to the severity of non-observance. The aim of this work was to verify the impact of non-standard storage conditions on red cell transfusion components and to confirm whether the limits and their duration have been chosen appropriately.
Materials and methods: The impact of non-standard storage conditions on the quality of red cell transfusion components was verified using a temperature load test. The intensity of the load corresponded to the limits given in the STL guidelines. 40 transfusion units of Red Cells, Buffy Coat Removed in Additive Solution (BCR-AS) were included. On day 22–26, the transfusion components were exposed to the controlled temperature load – group A: 11 units, 15 °C, 6 hours, group B: 9 units, 13 °C, 6 hours and group C: 20 units, 13 °C, 48 hours. Haemolysis markers were measured on days 1, 22–26, 28, 35 and 42: free haemoglobin, K+, lactate dehydrogenase (LDH) and annexin V. In the control group (20 units of Red Cells, BCR-AS), free haemoglobin was determined on day 42.
Results: The level of free haemoglobin at the end of the storage period (day 42) did not exceed 0.8% of red cell mass in all units – on average 0.34% (A), 0.26% (B) 0.26% (C) and 0.26% in the control group. There was no statistically significant difference in the markers free haemoglobin and annexin V among the transfusion components A, B and C exposed to the temperature load. Groups B and C did not differ in the level of free haemoglobin, K+, LDH and annexin V. The level of K+ was statistically higher in group A compared to groups B and C.
Conclusion: The temperature limits given by STL are safe. The temperature load of 13 °C and 15 °C during storage only mildly affects quality and haemolysis after a temperature load was within safe limits. The degree of haemolysis measured using free haemoglobin did not differ among the groups. The level of K+ was influenced more by the temperature of the load than by its duration.
Keywords:
red cells – temperature – haemolysis – storage
Autoři: P. Papoušek 1; S. Škodová 1; C. Andrýs 2
; T. Suchý 3; P. Turek 4; L. Řehořová 1; R. Procházková 1,5
Působiště autorů: Transfuzní oddělení, Krajská nemocnice Liberec, a. s. 1; Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové 2; Oddělení kompozitních a uhlíkových materiálů, Ústav struktury a mechaniky hornin, Akademie věd České republiky, Praha 3; Transfuzní oddělení, Thomayerova nemocnice, Praha 4; Fakulta zdravotnických studií, Technická univerzita v Liberci 5
Vyšlo v časopise: Transfuze Hematol. dnes,26, 2020, No. 2, p. 124-130.
Kategorie: Původní práce
Souhrn
Úvod: Podmínky skladování erytrocytových transfuzních přípravků jsou stanoveny obecně závaznými právními předpisy. V případě jejich nedodržení rozhodne o případném použití přípravků kvalifikovaná osoba výrobce, proto vypracovala Společnost pro transfuzní lékařství (STL) Doporučení č. 2015/11 s definovaným zkrácením použitelnosti transfuzních přípravků podle závažnosti nedodržení. Cílem práce bylo ověřit vliv nestandardních podmínek skladování na erytrocytové transfuzní přípravky a potvrdit, zda jsou stanovené teplotní intervaly a délka jejich trvání vhodně zvolené.
Soubor a metodika: Vliv nestandardních podmínek skladování na kvalitu erytrocytových transfuzních přípravků byl ověřován teplotním zátěžovým testem, velikost zátěže odpovídala mezím stanoveným v Doporučení STL. Do studie bylo zařazeno 40 transfuzních jednotek erytrocytů bez buffy-coatu resuspendovaných (EBR). V den 22–26 byly transfuzní přípravky vystavené kontrolované teplotní zátěži – skupina A: 11 jednotek, 15 °C, 6 hodin, skupina B: 9 jednotek, 13 °C, 6 hodin a skupina C: 20 jednotek, 13 °C, 48 hodin. Ve dnech 1, 22–26, 28, 35 a 42 bylo provedeno měření markerů hemolýzy: volný hemoglobin (vHb), K+, laktát dehydrogenáza (LDH) a annexin V. V kontrolním souboru (20 jednotek EBR) byl stanoven pouze vHb v den 42.
Výsledky: Hladina volného hemoglobinu na konci doby skladování (den 42) nepřesáhla 0,8 % erytrocytové masy u všech jednotek – průměrně 0,34 % (A), 0,26 % (B), 0,26 % (C) a v kontrolním souboru 0,26 %. U jednotek vystavených teplotní zátěži nebyl mezi skupinami A, B a C statisticky signifikantní rozdíl v markerech vHb a annexinu V. Skupiny B a C se statisticky nelišily v hodnotě vHb, K+, LDH a annexinu V. Ve skupině A byla signifikantně vyšší hladina K+ oproti skupinám B a C.
Závěr: Teplotní limity stanovené STL jsou bezpečné. Teplotní zátěž 13 °C a 15 °C při skladování má na jejich jakost jen mírný vliv, hemolýza byla po teplotní zátěži v bezpečném rozmezí. Stupeň hemolýzy měřený vHb se mezi skupinami nelišil, hladinu K+ ovlivnila více teplota zátěže než její délka.
Klíčová slova:
erytrocyty – teplota – hemolýza – skladování
ÚVOD
Erytrocytové transfuzní přípravky jsou standardně skladované při teplotě 2–6 °C podle Vyhl. č. 143/2008 Sb. [1]. Při skladování v mimořádných situacích mohou být erytrocytové transfuzní přípravky vystavené vyšší teplotě. Přitom může dojít k poškození erytrocytů, které je doprovázeno metabolickými změnami, tzv. red cell storage lesion, které se odráží v poklesu pH, zvýšení kalia (K+), laktát dehydrogenázy (LDH), konsumpci glukózy, produkci laktátu a poklesu 2,3-difosfoglycerátu (2,3-DPG) a adenosintrifosfátu (ATP). Současně stoupá hladina volného hemoglobinu (vHb), markeru probíhající hemolýzy [2–4]. V české legislativě (Vyhl. č. 143/2008 Sb.) [1] je určena jeho maximální hodnota 0,8 % erytrocytové hmoty na konci doby použitelnosti transfuzního přípravku. Za moderní ukazatel jakosti transfuzních přípravků je považován annexin V, globální marker apoptózy [5, 6], jehož zvýšená plazmatická hladina odpovídá stupni buněčného poškození. Při současném stanovení K+ a volného hemoglobinu je vhodným markerem buněčného poškození transfuzních přípravků obsahujících erytrocyty [5].
STL stanovila ve svém doporučení, že při vzestupu teploty skladování do 10 °C po dobu maximálně 24 hodin kumulativně se doba použitelnosti nezkracuje, jak je uvedeno v doporučení Rady Evropy [7]. Dále při vzestupu teploty skladování na 11–15 °C na dobu do 6 hodin kumulativně se zkrátí doba použitelnosti o 7 dnů v případě, že byl přípravek odebrán před maximálně 35 dny. V případě působení stejného teplotního výkyvu do 48 hodin se zkrátí doba použití analogicky o 14 dnů [8].
Cílem práce bylo ověřit vliv nestandardních podmínek skladování na erytrocytové transfuzní přípravky a potvrdit správnost mezních hodnot definovaných v doporučení STL.
MATERIÁL A METODIKA
Odběr krve a výroba transfuzních přípravků
Odběr plné krve byl proveden standardním způsobem od dobrovolných bezpříspěvkových dárců v období od června 2017 do dubna 2018. Standardní odběr 460 ± 10 ml plné krve byl proveden do vaků CompoFlowFlex CT32150 (Fresenius KABI, SRN) s antikoagulačním roztokem CPD v poměru 1 : 7. Odebraná plná krev byla následně zpracována na erytrocyty bez buffy-coatu resuspendované (EBR) centrifugací pomocí centrifugy Cryofuge 6000i (Thermo Fisher Scientific, SRN) (při nastavení 14 minut, 3250 ot./min., G 3507, teplota 22 °C, akcelerace 6, brzda 6) s následným oddělením plazmy na lisech Optipress II (Baxter Healthcare Corporation, USA), CompoMat G5 (Fresenius Kabi AG, SRN) a přidáním resuspenze 100 ml SAG-manitolu. Pro studii byly použité EBR ze standardní produkce transfuzního oddělení, které splňovaly standardní parametry kvality (standardní postup výroby, standardní objem, negativní markery infekcí), ale byly nevhodné ke klinickému použití z důvodu přítomnosti nepravidelných anti-erytrocytárních protilátek nebo zvýšeného obsahu leukocytů. Celkem bylo do studie zařazeno 40 jednotek EBR. V kontrolním nezahřívaném souboru bylo 20 jednotek EBR.
Teplotní zátěž
Dopad nestandardního skladování na kvalitu erytrocytových transfuzních přípravků (EBR) byl ověřován teplotním zátěžovým testem, míra zátěže odpovídala zvoleným mezím z Doporučení STL. EBR byly v den 22–26 po odběru vystaveny teplotní zátěži nejprve 6 hodin při 15 °C (skupina A, 11 T.U., inkubátor Termostat BT 120 MR), z provozních důvodů byly zbývající transfuzní přípravky zahřívány v jiném inkubátoru 6 hodin při 13 °C (skupina B, 9 T.U., inkubátor Sanyo MR 153). Další část EBR byla vystavena teplotní zátěži 48 hodin při 13 °C (skupina C, 20 T.U., inkubátor Sanyo MR 153).
Hodnocené parametry
U všech transfuzních přípravků byl v den odběru (den 0) hodnocen objem a v den 1 obsah hemoglobinu a hematokrit. K posouzení stupně hemolýzy byly přípravky vyšetřeny na začátku skladování (den 1), těsně před zátěží (většina v den 22, ostatní v intervalu do dne 26), dále v okamžiku zkrácené exspirace podle Doporučení STL (den 28 a 35) a v okamžiku původně stanovené, nezkrácené exspirace (den 42). Hodnotili jsme vzestup volného hemoglobinu (vHb), kalia (K+), laktát dehydrogenázy (LDH) a annexinu V. V kontrolním souboru byla hodnocena pouze hladina vHb, a to na konci skladování (den 42), jiné parametry nikoliv. Jednalo se o T.U. vyšetřené v rámci standardní kontroly jakosti.
Laboratorní analýza
Laboratorní analýza byla provedena v akreditovaných laboratořích. Obsah hemoglobinu a hematokrit byly stanoveny na analyzátoru Sysmex XN 1000 na Transfuzním oddělení, Krajské nemocnice Liberec (KNL), a.s. Stanovení koncentrace kalia bylo provedeno nepřímou potenciometrií, hodnota LDH byla stanovena spektrofotometricky (vše Cobas 8000, Roche, Švýcarsko) a vyšetření obsahu vHb bylo provedeno spektrofotometricky (Shimadzu UV-2101 PC, Japonsko) vše na Oddělení klinické biochemie, KNL, a.s. Hladina annexinu V byla stanovena v Ústavu klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové metodou ELISA (souprava Annexin V ELISA, IBL International, Německo, spektrofotometr Labsystems MultiskanRC, Thermo Scientific, USA).
Odběr vzorků
Vzorky ke stanovení hemoglobinu a hematokritu, pro biochemická vyšetření a vyšetření annexinu V (celkem 30 g) byly získány sterilním navařením transfervaku na vak EBR v den vyšetření. Následně byla provedena centrifugace odebraného vzorku (5 minut, 3 400 ot./min.). Vzorky ke stanovení annexinu V byly po odběru ihned zmraženy a uchovávány při teplotě –25 oC.
Statistické zpracování
Základní statistická analýza byla provedena v programu Excel 2016 (Microsoft Corporation, USA). Testování statistické významnosti bylo uskutečněno v programu Statgraphics Centurion XVII (Statpoint, USA). Normalita byla testována Shapirovým-Wilkovým testem. Shoda rozptylů byla zjišťována F-testem a Levenovým testem. V případě normálního rozdělení a shody rozptylů byl použit parametrický Fisherův test nejmenšího významného rozdílu (LSD) pro vícenásobné porovnání, v ostatních případech neparametrický Kruskalův-Wallisův test s Bonferroniho korekcí pro vícenásobné porovnání. Vše testováno na hladině spolehlivosti α = 95 %.
Protokol studie odpovídal Helsinské deklaraci z roku 1975 a její revizi z roku 2000.
VÝSLEDKY
EBR vystavené teplotní zátěži měly standardní parametry jakosti: průměrný objem ± SD 273,5 ± 14,3 ml, průměrné množství hemoglobinu ± SD 52,7 ± 5,1 g/T.U. a hematokrit ± SD 0,59 ± 0,02.
Předepsaný stupeň hemolýzy (< 0,8 % erytrocytové masy na konci skladování) byl splněn ve všech sledovaných skupinách vystavených teplotní zátěži. Průměrná hodnota hemolýzy na konci skladování byla ve skupině A 0,34 %, ve skupině B 0,26 % a ve skupině C 0,26 %. Aritmetický průměr vHb ± SD byl u kontrolního souboru EBR (n = 20) 0,26 % ± 0,16 %, min-max 0,13–0,85 % v den 42, tj. bez statisticky signifikantního rozdílu v porovnání se skupinou B a C, avšak v jednom případě byl překročen povolený procentuální limit hemolýzy vHb. Jiné parametry nebyly u kontrolního souboru hodnoceny.
Ve všech sledovaných skupinách došlo v průběhu skladování ke vzestupu všech markerů: vHb, K+, LDH a annexinu V. Výsledky uvádí tabulky 1, 2, 3 a 4.
Tab. 1. Výsledky markerů hemolýzy – volný hemoglobin 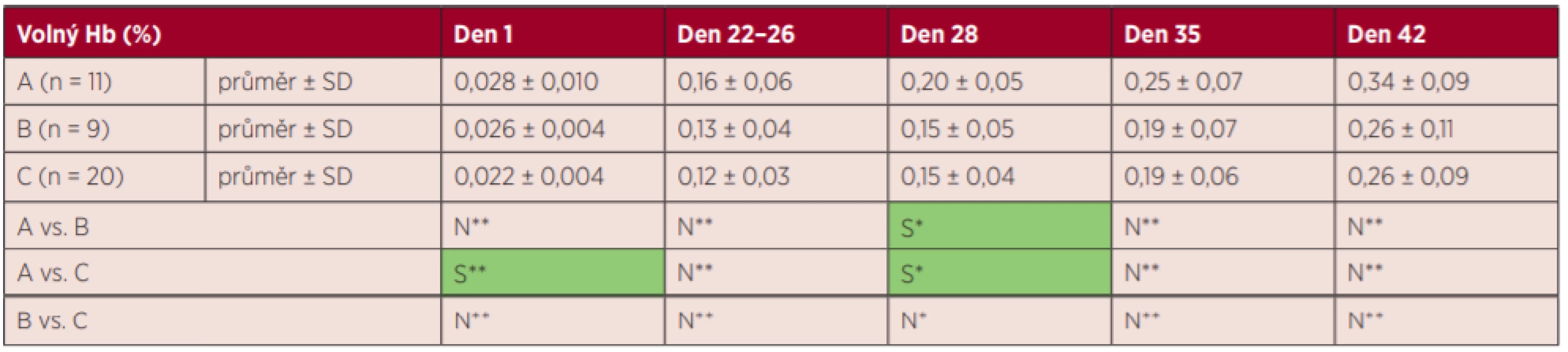
S – statisticky signifikantní, N – statisticky nesignifikantní, *Fisherův LSD test, ** Kruskalův-Wallisův test s Bonferroniho korekcí Tab. 2. Výsledky markerů hemolýzy – kalium 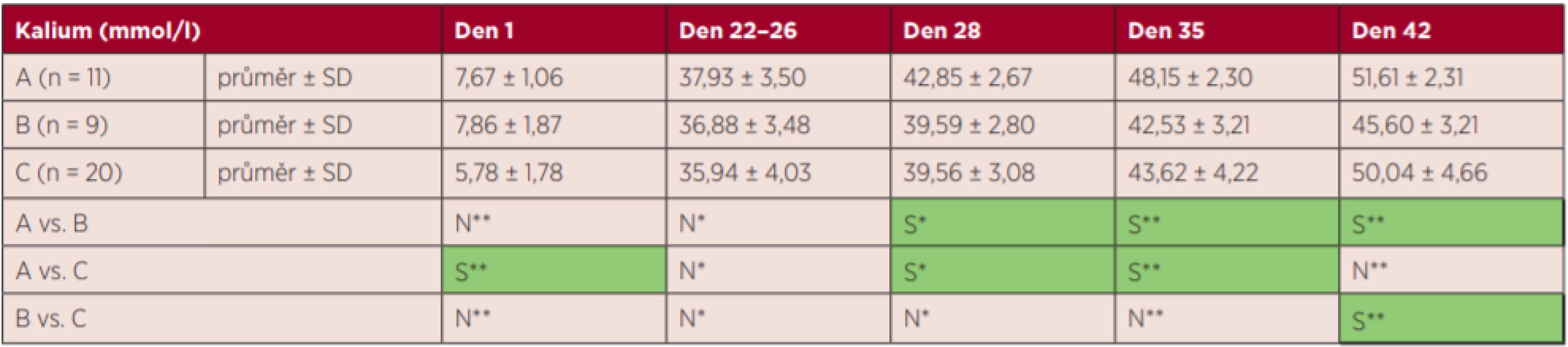
S – statisticky signifikantní, N – statisticky nesignifikantní, *Fisherův LSD test, **Kruskalův-Wallisův test s Bonferroniho korekcí Tab. 3. Výsledky markerů hemolýzy – LDH 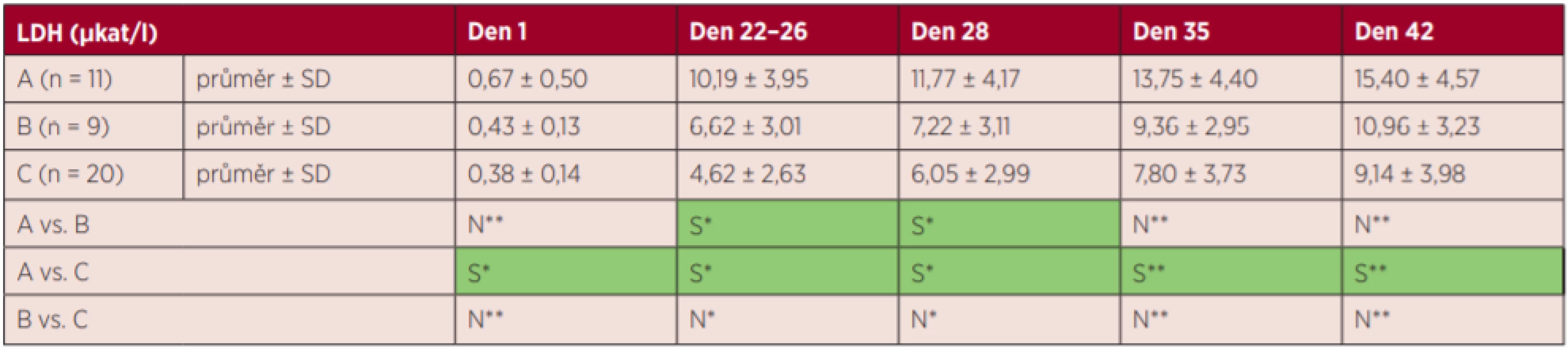
S – statisticky signifikantní, N – statisticky nesignifikantní, *Fisherův LSD test, **Kruskalův-Wallisův test s Bonferroniho korekcí Tab. 4. Výsledky markerů hemolýzy – annexin V 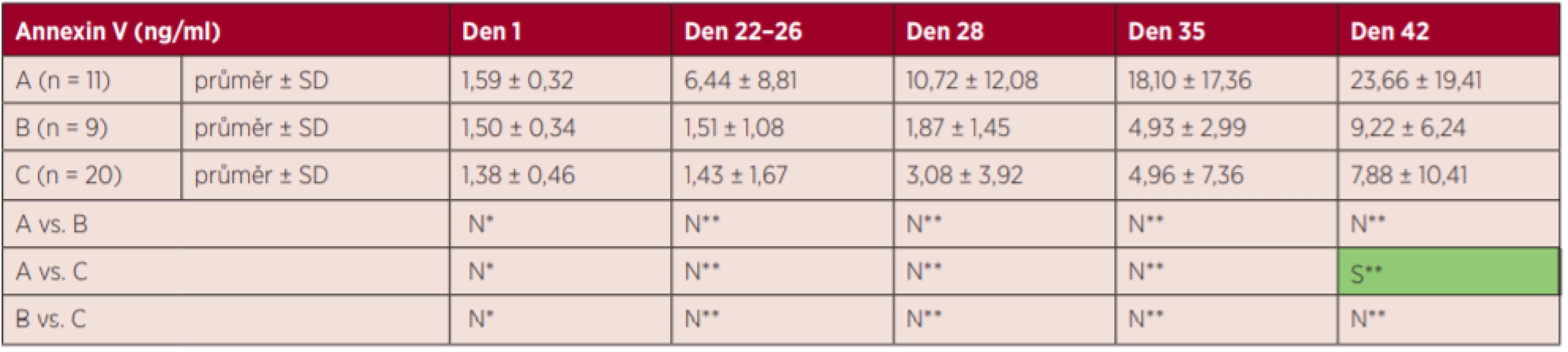
S – statisticky signifikantní, N – statisticky nesignifikantní, *Fisherův LSD test, **Kruskalův-Wallisův test s Bonferroniho korekcí Nejvyšší zvýšení markerů hemolýzy K+ a LDH bylo zjištěno ve skupině A. Hodnota vHb a LDH stoupala plynule s dobou skladování, tj. ve dnech 1–42 (grafy 1 a 3), hladina K+ stoupala nejvíce v prvních 22 dnech (graf 2), tj. již před zátěží, a hladina annexinu V se zvyšovala nejvíce ke konci skladování (den 35 a den 42) (graf 4).
Graf 1. Závislost hladiny volného hemoglobinu na době skladování v podskupinách. Spočítáno jako aritmetický průměr s rozmezím minimální a maximální změřené hodnoty. 
Graf 2. Závislost hladiny kalia na době skladování v podskupinách. Spočítáno jako aritmetický průměr s rozmezím minimální a maximální změřené hodnoty. 
Graf 3. Závislosti hladiny LDH na době skladování v podskupinách. Spočítáno jako aritmetický průměr s rozmezím minimální a maximální změřené hodnoty 
Graf 4. Závislost hladiny annexinu V na době skladování v podskupinách. Spočítáno jako aritmetický průměr s rozmezím minimální a maximální změřené hodnoty. 
U EBR skupiny A (T 15 °C, 6 hodin) byly zjištěny statisticky významně vyšší hodnoty K+ v porovnání se skupinou B a C (T 13 °C, 6/48 hodin) ve dny 28 a 35. Ve 42. dnu nebyl rozdíl v hodnotě K+ mezi skupinou A a C již statisticky signifikantní. U EBR skupiny A (T 15 °C, 6 hodin) byly vůči skupině C (T 13 °C, 48 hodin) naměřeny statisticky signifikantně vyšší hodnoty LDH ve všech dnech. Hodnota vHb se statisticky významně nelišila mezi skupinami A, B, C ve všech dnech kromě dne 28. Skupina B (T 13 °C, 6 hodin) nebyla ve všech dnech statisticky odlišná od skupiny C (T 13 °C, 48 hodin) v hodnotách vHb, K+, LDH a annexinu V. Výjimkou byl K+ v den 42, kdy bylo vyšší ve skupině C.
Hladina annexinu V stoupala s dobou skladování ve všech skupinách, ale nebylo dosaženo statisticky významného rozdílu mezi všemi sledovanými skupinami. V den 42 jsme zaznamenali statisticky významný rozdíl, kdy u skupiny A došlo k většímu vzestupu v porovnání se skupinou C.
Mezi některými z parametrů byly zjištěny přímé korelace. Hladina K+ v supernatantu EBR korelovala s obsahem Hb (R2 = 0,128, p = 0,024) u všech EBR měřených v den 1 po odběru. U všech EBR korelovaly hodnoty: (a) K+ s vHb (R2 = 0,604, p < 0,001), s LDH (R2 = 0,490, p < 0,001) a s annexinem V (R2 = 0,100, p < 0,001), (b) LDH s vHb (R2 = 0,426, p < 0,001) a s annexinem V (R2 = 0,447, p < 0,001), (c) vHb s annexinem V (R2 = 0,103, p < 0,001). Tedy nejtěsnější korelace byla zjištěna mezi K+ a vHb. Annexin V nejvíce koreloval s hladinou LDH, a to nejsilněji v případě dnů 28–42 (R2 = 0,487, p < 0,001).
Variační koeficient volného hemoglobinu stoupal s dobou skladování, avšak variační koeficient K+ s dobou skladování klesal (grafy 5 a 6), méně výrazná změna variačního koeficientu byla zjištěna u LDH – minimálně klesal, avšak u annexinu V mírně stoupal.
Graf 5. Závislost hladiny variačního koeficientu volného hemoglobinu na době skladování v podskupinách 
Graf 6. Závislost hladiny variačního koeficientu kalia na době skladování v podskupinách 
DISKUSE
Hladina vHb na konci doby skladování byla u všech zkoumaných zahřívaných EBR pod hranicí, která je stanovená Vyhl. č. 143/2008 Sb. [1].
Všechny markery hemolýzy stoupaly kontinuálně se skladováním, avšak teplotní zátěž působila odlišně na jednotlivé markery. Hladiny volného hemoglobinu a annexinu V byly srovnatelné mezi zahřívanými skupinami EBR, avšak v hodnotách K+ a LDH se T.U. lišily.
U skupiny EBR A (15 °C, 6 hodin) byly zjištěny vyšší hodnoty K+ než u skupiny EBR C s delší zátěží (13 °C, 48 hodin), což dokumentuje, že hladinu K+ ovlivnila více teplota než délka zátěže.
Ve většině dnů nebyl mezi skupinami zjištěn statisticky významný rozdíl v hodnotě hemolýzy stanovené procenty vHb a annexinem V, což ukazuje na srovnatelný vliv různých teplotních zátěží na uvolňování vHb a annexinu V.
Skupiny B a C (stejná teplota, avšak rozdílná délka expozice) se statisticky nelišily v žádných parametrech, což dokumentuje, že rozdílné testované zátěže (6 hodin a 48 hodin) mají stejný vliv na hemolýzu konkrétně při 13 °C.
Skupiny A a B se jednoznačně lišily v hladině K+, takže vyšší teplota očekávaně zvýšila jeho uvolňování, avšak v případě LDH nevyšel tento efekt konstantně.
V Hancockově studii byl testován vliv teploty 10 °C na transfuzní přípravky erytrocytů (10 °C, 5 hodin a 10 °C, 12 hodin). U žádné jednotky nedošlo k překročení limitu vHb 0,8 % v den 42 [9].
Ve výzkumu vedeném Wagnerem byl hodnocen vliv 13 °C po celou dobu skladování erytrocytů resuspendovaných deleukotizovaných (ERD) a byla zjištěna vyhovující průměrná hodnota vHb 0,63 % (95% interval spolehlivosti 0,47–1,02) v den 35, avšak v den 42 již nebyla kvalita transfuzních přípravků dostatečná, neboť došlo k překročení stanoveného limitu vHb na 2,01 % (95% interval spolehlivosti 1,31–2,51) [10].
Ve studii řešené Gullikssonem, kde byl vyšetřován vliv teplotní zátěže 6 hodin při pokojové teplotě na deleukotizované erytrocyty resuspendované v SAG-manitolu, nebyla překročena povolená hranice hemolýzy 0,8 % [11]. Také v Eckerově studii, kde byly erytrocyty resuspendované v CPDA-1 zahřívané 6 hodin při 20 °C [12], nebyla překročena povolená hranice hemolýzy 0,8 %.
Ve studii Procházkové byla zjišťována hladina annexinu V u ERD. Na začátku skladování (D0) byla zjištěna průměrná hodnota ± SD 0,3 ± 0,5 ng/ml, v den 40 1,5 ± 1,0 ng/ml [14], což jsou nižší hodnoty a s menším rozptylem než v naší studii. Rozdíl lze vysvětlit použitím odlišných vyšetřovacích souprav.
Nárůst variačního koeficientu volného hemoglobinu s dobou skladování ukazuje, že na konci skladování je mezi transfuzními přípravky větší rozdíl v hodnotách volného hemoglobinu než na počátku doby skladování. Naopak transfuzní přípravky se na začátku skladování liší více v hladině K+, než je tomu na konci doby skladování, což je novým poznatkem, který pravděpodobně vysvětlí jiné studie.
Ve studii byly zkoumány markery poškození erytrocytů pouze in vitro. Otázkou je, jak skladování v nestandardních podmínkách ovlivní funkci a přežití erytrocytů in vivo.
ZÁVĚR
Teplotní limity pro skladování erytrocytů uvedené v Doporučení STL jsou bezpečné. Teplotní zátěž 13 °C a 15 °C při skladování má na jejich jakost jen mírný vliv, hemolýza byla v bezpečném rozmezí. Stupeň hemolýzy měřený procenty vHb se mezi skupinami nelišil, hodnotu K+ ovlivnila více teplota než délka zátěže.
Legislativním požadavkem pro zařízení transfuzní služby je zajistit kvalitu a bezpečnost transfuzních přípravků a současně správně postupovat při mimořádných situacích (výpadek techniky, mimořádné organizační stavy). Pro pochopení vlivu nestandardních podmínek na kvalitu transfuzních přípravků, přežívání a funkci erytrocytů budou potřebné další studie. Maximální využití skladovaných erytrocytů lze zajistit i organizačními úpravami procesů, spoluprací s klinickými pracovišti, s jinými zařízeními transfuzní služby apod.
Použité zkratky
CPDA-1 – antikoagulační roztok: citrát, fosfát, dextróza, adenin
EBR – erytrocyty bez buffy-coatu resuspendované
KNL, a.s. – Krajská nemocnice Liberec, a.s.
LDH – laktát dehydrogenáza
SAG – chlorid sodný, adenin, glukóza
SD – směrodatná odchylka
STL – Společnost pro transfuzní lékařství
T.U. – transfuzní jednotka
vHb – volný hemoglobin
Podíl autorů na přípravě rukopisu
PP – design a provedení studie, zpracování výsledků a rukopisu
SŠ – provedení studie
CA – provedení studie, revize rukopisu
TS – statistické zpracování, revize rukopisu
PT – design studie, revize rukopisu
LŘ – provedení studie
RP – design a provedení studie, revize rukopisu
Poděkování
Projekt byl finančně podpořen z Fondu podpory vědeckých projektů Vědecké rady Krajské nemocnice Liberec, a.s., VR 170304.
Autoři děkují RNDr. P. Škrabálkovi z Oddělení klinické biochemie, KNL, a.s., za spolupráci při vyšetřování biochemických markerů a laborantkám z Transfuzního oddělení, KNL, a.s., za odběry a zpracování vzorků z transfuzních přípravků.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 18. 10. 2019.
Přijato po recenzi dne 28. 2. 2020.
MUDr. Petr Papoušek
Transfuzní oddělení, Krajská nemocnice Liberec, a.s.
Baarova 15
460 63 Liberec 1
e-mail: petr.papousek@nemlib.cz
Zdroje
1. Vyhláška č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi), ve znění pozdějších předpisů.
2. Procházková R. Markery poškození krevních buněk. Transfuze Hematol Dnes. 2013;19 : 240–243.
3. Hess JR. Measures of stored red blood cell quality. Vox Sang. 2014;107 : 1–9.
4. Putter JS, Seghatchian J. Cumulative erythrocyte damage in blood storage and relevance to massive transfusions: selective insights into serial morphological and biochemical findings. Blood Transfus. 2017;15 : 348–356.
5. Seghatchian J, Krailadsiri P. Red cell storage lesion assesed by the levels of potassium, hemoglobin and annexin V in supernatantant. Transfus Apher Sci. 2002;26 : 121–127.
6. Sparrow RL, Healey G, Patton KA, et al. Red blood cell age determines the impact of storage and leukocyte burden on cell adhesion molecules, glycophorin A and the release of annexin V. Transfus Apher Sci. 2006;34 : 15–23.
7. Guide to the preparation, use and quality assurance of blood components. 19th ed. Strasbourg: Council of Europe, 2017; 302.
8. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2015_11 ze dne 2. 11. 2015 verze 1 [on-line]. Dostupné na: https://www.transfuznispolecnost.cz/doporucene-postupy/skladovani-a-preprava-krve-krevnich-slozek-suroviny-pro-dalsi-vyrobu-transfuznich-pripravku-231. Staženo: 17. 2. 2020.
9. Hancock V, Beard M, Naik F, et al. Effects of deviations in the recommended storage temperatures of RBCs on their invitro quality. Transfus Med. 2009;19(s1)(21):PO4.
10. Wagner T, Pabst MA, Leitinger G, et al. Impact of constant storage temperatures and multiple warming cycles on the quality of stored red blood cells. Vox Sang. 2014;106 : 45–54.
11. Gulliksson H, Nordahl-Källman AS. Effect of transient warming of red blood cells for up to 24 h: in vitro characteristics in CPD/saline-adenine-glucose-mannitol environment. Vox Sang. 2014;106 : 61–67.
12. Ecker T, Hitzler WE. Effect of 6-hour exposure to 20 degrees C on the ATP content and other biochemical measures of CPDA-1 packed red cells. Clin Lab. 2000;46 : 291–293.
13. Procházková R. Multikomponentní aferetické odběry krve. 1. vyd. Brno: Tribun EU, 2009; 51.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2020 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
- Závěr života nemocných s nehodgkinským lymfomem, analýza souboru zemřelých během šesti let (2012–2017) na jednom pracovišti, integrace paliativní péče
- Skladování erytrocytů při nestandardní teplotě
- Theralite a mnohočetný myelom – známe už odpověď na efektivitu léčby nefrologa s hematologem?
- Překvapivý nález v kostní dřeni: co za ním je?
- Životní jubileum pana profesora Jiřího Mayera
- Editorial
- Trombotické mikroangiopatie
- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Trombotické mikroangiopatie
- Překvapivý nález v kostní dřeni: co za ním je?
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



