-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
Prevention of infection in haematological patients after splenectomy and those suffering from hypersplenism: recommendations of the CzEch Leukemia Study Group for Life (CELL
Asplenic patients are at significant risk of infectious complications. The most prevalent pathogens causing infections in this high-risk group include encapsulated bacteria, especially Streptococcus pneumonia. The most serious form of infection in asplenic patients is septic syndrome, commonly referred to as “overwhelming post-splenectomy infection”. All asplenic patients are at the risk of this infection characterised by a highly dramatic clinical course. However, patients splenectomised for haematological diseases are those at greatest risk in this group. Moreover, the risk of infection is increased by ongoing oncological treatment or immunosuppressive therapy. The risk of infection can be reduced by simple preventive measures: adequate patient education and emergency antibiotics, vaccination against selected pathogens according to current recommendations and antibiotic prophylaxis in indicated cases. Based on the updated international recommendations, especially in the field of vaccination, new recommendations of the CzEch Leukemia Study Group for Life (CELL) for the prevention of infectious complications in haematological patients after splenectomy have been drawn up and are presented in this paper.
Key words:
splenectomy – infectious prevention – overwhelming post-splenectomy infection – post-splenectomy septic syndrome – post-splenectomy education – post-splenectomy vaccination – post-splenectomy antibiotic prophylaxis
Autoři: T. Kabut 1; B. Weinbergerová 1; I. Kocmanová 2; P. Žák 3; A. Zavřelová 3; M. Kouba 4; L. Drgoňa 5; M. Navrátil 6; P. Múdrý 7; J. Štěrba 7; P. Sedláček 8; P. Keslová 8; J. Haber 9; N. Mallátová 10; D. Tanušková 11; J. Novák 12; E. Faber 13; J. Mayer 1; Z. Ráčil 1
Působiště autorů: Interní hematologická a onkologická klinika, FN Brno a LF MU, Brno 1; Oddělení klinické mikrobiologie, FN Brno, Brno 2; IV. interní hematologická klinika, FN Hradec Králové, Hradec Králové 3; Ústav hematologie a krevní transfuze, Praha 4; Národní onkologický ústav, Bratislava 5; Klinika hematoonkologie, FN Ostrava, Ostrava 6; Klinika dětské onkologie, FN Brno, Brno 7; Klinika dětské hematologie a onkologie, FN v Motole, Praha 8; Klinika hematologie, Všeobecná fakultní nemocnice, Praha 9; Pracoviště parazitologie a mykologie, Nemocnice České Budějovice, a. s., České Budějovice 10; Transplantačná jednotka kostnej drene – Klinika detskej hematológie a onkológie, Detská fakultná nemocnica, s poliklinikou, Bratislava 11; Interní hematologická klinika, FN Královské Vinohrady, Praha 12
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 4, p. 304-313.
Kategorie: Doporučené postupy
Souhrn
Aspleničtí pacienti jsou ve významném riziku infekčních komplikací. Dominantními patogeny způsobující infekce této rizikové skupiny jsou opouzdřené bakterie, především Streptococcus pneumonie. Nejzávažnější formou infekce asplenických pacientů je septický syndrom, běžně označovaný specifickým termínem „overwhelming postsplenectomy infection“. Ohroženi touto dramaticky probíhající infekcí jsou všichni aspleničtí pacienti. V největším riziku jsou ale pacienti splenektomovaní v důsledku hematologického onemocnění, u kterých navíc často probíhající onkologická léčba či imunosupresivní terapie dále zvyšuje riziko infekce. Riziko vzniku infekce u této skupiny pacientů lze snížit jednoduchými preventivními opatřeními: důkladná edukace pacientů a vybavenost pohotovostními antibiotiky, očkování proti nejvýznamnějším rizikovým patogenům podle platných doporučení a užívání antibiotické profylaxe v indikovaných případech. Na základě aktualizace mezinárodních doporučení v posledních letech, především v oblasti vakcinace, byla vytvořena nová doporučení České leukemické skupiny – pro život (CzEch Leukemia Study Group for Life, CELL) pro prevenci infekčních komplikací u hematologických pacientů po splenektomii, která jsou tématem této práce.
KLÍČOVÁ SLOVA:
splenektomie – prevence – overwhelming postsplenectomy infection – postsplenektomický septický syndrom – edukace po splenektomii – vakcinace po splenektomii – antibiotická profylaxe po splenektomii
ÚVOD
Slezina patří mezi významné orgány imunitního systému a její důležitou funkcí je podíl na obraně proti bakteriálním infekcím či některým parazitárním onemocněním. V obraně organismu proti infekcím je ve slezině uplatňováno několik různých mechanismů. Jeden z nejdůležitějších je její funkce mechanického filtru. Slezinou protékající krev je filtrována systémem fenestrovaných endotelií v sinusech červené pulpy sleziny. Tímto mechanismem jsou ve slezině zachytávány mnohé cirkulující částice. Pro obranyschopnost je nejvýznamnější odstraňování některých cirkulujících bakterií, odstraňovány jsou ale také například nedeformovatelné nebo jinak poškozené erytrocyty nebo imunokomplexy. Především opouzdřené bakterie, které díky polysacharidovému pouzdru unikají opsonizaci komplementem a dalšími opsoniny, jsou při průchodu slezinou účinně označeny IgM protilátkami a následně odstraněny ve slezinném filtru. Tyto časné IgM protilátky jsou produkovány přímo slezinnými B-lymfocyty po expozici splenických antigen-prezentujících buněk a aktivací T-lymfocytů v bíle pulpě sleziny intravenózními bakteriemi. Ve slezině jsou také produkovány četné opsonizační faktory a lymfokiny a je součástí mnoha dalších komplexních imunitních mechanismů [1–4].
Za asplenismus označujeme stav se zcela zaniklou funkcí sleziny, nejčastěji z důvodu chirurgického odstranění sleziny (splenektomie). Méně častý je pak funkční hyposplenismus až asplenismus, kdy je slezina přítomna, ale její funkce je významně snížena nebo zcela chybí. Všeobecně nejčastější příčinou provedení splenektomie je zranění sleziny v důsledku traumatu, které tvoří asi 75 % indikací k provedení splenektomie [5–7]. Druhou významnou skupinou pacientů jsou ti, kteří byli splenektomování v souvislosti s hematologickým onemocněním. Díky možnostem moderní terapie u mnoha těchto onemocnění se indikace ke splenektomii stává v posledních letech stále méně častá [8]. Nejčastějšími hematologickými onemocněními, pro která v dnešní době bývá prováděna splenektomie, jsou refrakterní formy imunitní trombocytopenie (ITP), autoimunní hemolytické anémie (AIHA), trombotické trombocytopenické purpury (TTP) nebo například va - riantní vlasatobuněčná leukemie (HCL) nebo například hereditární sférocytóza u dětských pacientů [6, 8–12]. Další skupinou pacientů, u kterých je slezina anatomicky přítomna, ale její funkce je výrazně snížena nebo zcela zaniklá, jsou nemocní s funkčním hyposplenismem až asplenismem. Tento stav bývá nejčastěji spojen s chronickou reakcí štěpu proti hostiteli po alogenní transplantaci krvetvorby, těžkou celiakií nebo neléčenou HIV infekcí [13].
Všichni pacienti jsou v důsledku zaniklé funkce sleziny ve významném riziku infekčních komplikací. Infekce u této rizikové populace může probíhat pod obrazem rychle progredující fulminantní sepse či meningitidy s vysokým rizikem fatálních komplikací. Tento septický syndrom je v anglické terminologii označován specifickým termínem „overwhelming postsplenectomy infection“ (OPSI). Přestože rozvojem OPSI jsou ohrožení všichni aspleničtí pacienti, včetně pacientů splenektomovaných z potraumatické příčiny, ve větším riziku závažnějších infekčních komplikací jsou pacienti splenektomovaní z důvodu hematologického onemocnění [6, 9, 13]. U těchto pacientů bývá navíc přídatným rizikovým faktorem probíhající chemoterapie, radioterapie či imunosupresivní léčba. K dalším rizikovým faktorům pro rozvoj OPSI patří například nízký věk v době splenektomie (pod 5 let), doba od provedení splenektomie nebo předchozí invazivní pneumokokové infekce [2, 6, 13].
Přestože se incidence OPSI v různých zdrojích liší, pohybuje se kolem 0,23–0,42 % [14, 15]. Riziko OPSI je nejvyšší v prvních 2 letech po provedení splenektomie, jsou ale popsány i epizody OPSI několik let po splenek - tomii a celoživotní riziko zůstává asi 5 %. Mortalita rozvinuté sepse může u těchto pacientů dosahovat více než 50 % [2, 14]. Dominantním původcem OPSI je Streptococcus pneumonie, který způsobuje více než polovinu sepsí [1, 2, 14, 16]. Zvýšené riziko pneumokokových infekcí ukazuje například německá multicentrická studie, která srovnává etiologii sepse u běžné a sple - nektomované populace. U splenektomovaných pacientů byl pneumokok významně častějším původcem sepse oproti běžné populaci (42 % vs. 12 %, p < 0,001) [17]. Mezi další časté patogeny způsobující OPSI patří opouzdřené bakterie Neisseria meningitidis nebo Haemophilus influenzae typu B (HiB), častý především u dětské populace [2, 13, 16, 18]. Možnými původci OPSI mohou však být i kterékoliv jiné bakterie, včetně některých v běžné populaci neobvyklých původců infekcí jako Capnocytophaga canimorsus (přítomný v dutině ústní psů). Zvýšená je také citlivost k infekcím způsobenými parazitickými prvoky napadajícími erytrocyty (Plasmodium spp., Babesia spp [2, 19–21].
Vzhledem k celoživotnímu nebezpečí vzniku OPSI se všemi jeho možnými následky je u splenektomovaných pacientů nezbytné celoživotně rozvoji těchto komplikací předcházet.
V současnosti se prevence infekčních komplikací opírá o tři základní body:
- důkladná edukace pacienta a jeho nejbližšího okolí, včetně informací o užívání pohotovostních antibiotik;
- vakcinace proti hlavním patogenům způsobujících OPSI podle aktuálních doporučení;
- užívání antibiotické profylaxe v indikovaných případech.
Následující text shrnuje současná mezinárodní doporučení a zároveň aktuální doporučení České leukemické skupiny – pro život (CzEch Leukemia Study Group for Life, CELL) z roku 2017.
EDUKACE PACIENTA
Informovanost pacienta hraje zásadní úlohu v prevenci infekčních komplikací po splenektomii [13, 14]. Přestože zvýšené riziko k závažným infekčním komplikacím splenektomovaných pacientů je dobře známo a řádná vakcinace těchto pacientů nebo vybavenost pohotovostními antibiotiky je již dlouhodobě doporučovaným standardem, dodržování těchto doporučení pacienty a lékaři není vždy dostatečné. V retrospektivní studii adherence k preventivním opatřením po splenektomii ze 100 pacientů přes 90 % bylo perioperačně očkováno a u víc než 80 % probíhaly i následné revakcinace a „booster“ dávky (tj. posilující dávky), pouhých 23 % však mělo přístup k pohotovostním antibiotikům [22]. V další analýze 95 splenektomovaných pacientů si pouhých 46 % bylo vědomo rizika vzniku vážné sepse nebo nutnosti revakcinace/„booster“ dávky a pouze 7 % pacientů mělo přístup k pohotovostním antibiotikům [23]. Ve studii zaměřené na pacienty s rozvinutou OPSI bylo proti pneumokokům i přes jednoznačná doporučení očkováno pouhých 42 %. Ještě méně pacientů v této studii bylo očkováno proti ostatním 3 hlavním patogenům (meningokok, HiB, influenza) [17].
Důkladná edukace pacienta je tedy nezbytnou složkou preventivních opatření u splenektomovaných. Mezi nejzásadnější informace pro asplenické pacienty patří:
- samotná informace o zvýšeném celoživotním riziku vzniku závažných infekčních komplikací;
- potřeba řádné vakcinace a pravidelných přeočkování podle aktuálního vakcinačního kalendáře k zvýšení dlouhodobé ochrany proti rizikovým patogenům;
- nutnosti okamžitého nasazení pohotovostních antibiotik a způsobu jejich užívání při jakýchkoliv známkách infekce a okamžitého vyhledání lékařské pomoci (viz dále – pohotovostní antibiotika) [13, 14];
- proběhlá vakcinace, vybavenost pohotovostními antibiotiky a další opatření by měly být důsledně dokumentovány ve speciální informační kartě, kterou by měl být každý pacient vybaven a nosit ji u sebe [24]. Skupina CELL v roce 2017 aktualizovala a připravila tyto karty určené pro hematologické pacienty po splenektomii („KARTA HEMATOLOGICKY NEMOCNÉHO PO SPLENEKTOMII“) a jsou v elektronické podobě dostupné na webu skupiny CELL (http://www.leukemia-cell.org/) nebo v tištěné podobě na vyžádání u skupiny CELL.
Doporučení k edukaci pacienta jsou shrnuta v tabulce 1.
Tab. 1. Edukace asplenických pacientů 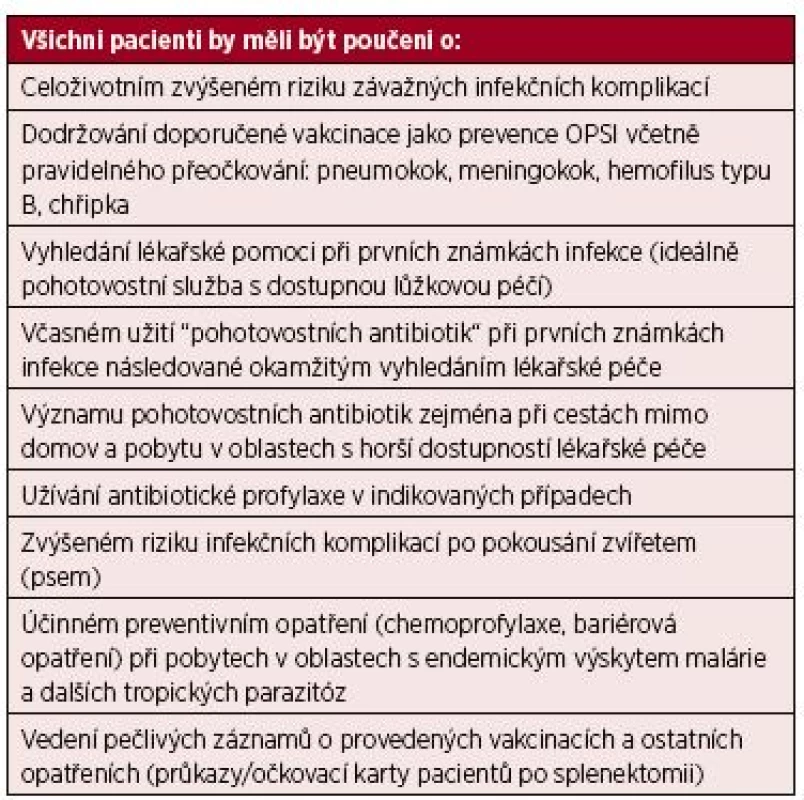
Vysvětlivky: OPSI – „overwhelming postsplenectomy infection“ Edukace pacienta – pohotovostní antibiotika
Pohotovostní antibiotika jsou všeobecně doporučovanou a nezbytnou metodou prevence rozvoje vážné sepse u splenektomovaného pacienta [13, 14, 25]. Jedná se o zásobu širokospektrých antibiotik, vždy s platnou dobou exspirace, které má pacient k dispozici k okamžitému užití v případě rozvoje teplot nebo jiných známek infekce. Jsou zvláště důležitá při cestách mimo domov, především do míst s horší dostupností zdravotní péče. Pohotovostní antibiotika nejsou však určena k definitivní léčbě infekce, ale pouze k překlenutí doby do vyhledání odborné lékařské péče. Tato péče musí neprodleně následovat k definitivnímu rozhodnutí o finální antibiotické terapii a další léčbě. Volba konkrétních antibiotik by měla být přizpůsobena mikrobiologické situaci a výskytu rezistentních bakteriálních kmenů v komunitě. Na základě konsenzu skupiny CELL je doporučován na prvním místě amoxicilin klavulanát (1 g á 8 hodin) se stále dobrou citlivostí pro respirační patogeny, eventuálně v případě alergií co-trimoxazol nebo klarithromycin (tab. 2). Další možností u pacientů s alergií na penicilinovou řadu antibiotik je užití moxifloxacinu, který je dobře účinný rovněž i u kmenů rizikových bakterií s rezistencí k penicilinům a makrolidům [26–28]. Dříve doporučovaný cefuroxim axetil byl vzhledem k častému výskytu neúčinnosti v případě Haemophilus influenzae [29] z aktuálních doporučení CELL 2017 vyřazen. Toto doporučení vychází především z dat EUCAST (European Committee on Antimicrobial Susceptibility Testing) u hemofilových infekcí (FAQ EUCAST z roku 2018, dostupné na webu http://www.eucast.org/frequently_asked_questions_faq/) a také z doporučení EUCAST, která doporučují u H. influenzae s rezistencí k betalaktamům podmíněnou mutacemi v proteinech vážících penicilin (PBP penicilin binding protein) interpretovat cefuroxim axetil vždy jako rezistentní.
Tab. 2. Pohotovostní antibiotika a antibiotická profylaxe 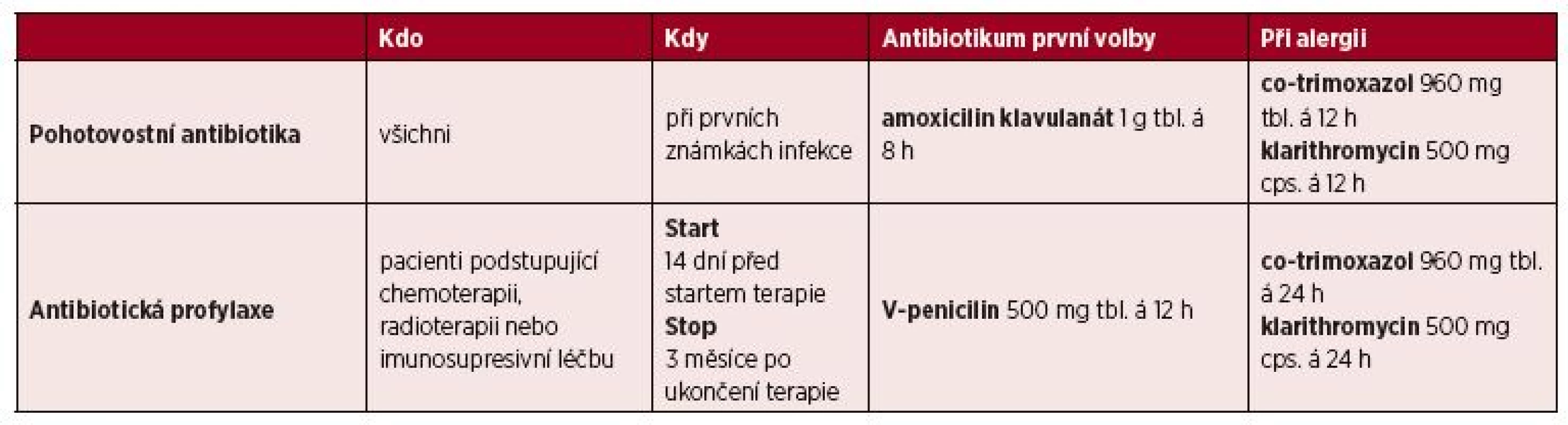
Vakcinace
Všichni splenektomovaní pacienti by podle současných mezinárodních doporučení měli být očkovaní proti třem hlavním patogenům způsobujícím invazivní infekce u této skupiny imunokompromitovaných pacientů a proti chřipce [3, 13, 14, 30–32]. Pro dostatečnou efektivitu vakcinace by mělo očkování proběhnout minimálně 14 dní před provedením splenektomie, i když ideální odstup by podle většiny autorů měl být až 4–6 týdnů před splenektomií. V případě urgentních splenektomií, kdy vakcinaci před výkonem není možné provést, by mělo očkování proběhnout alespoň 14 dní po provedení splenektomie [3, 14, 30]. Komplikovaná situace může být právě u hematologických pacientů, u kterých může odstranění sleziny předcházet nebo po něm následovat chemoterapie, radioterapie či imunosupresivní léčba. Tato terapie snižuje účinnost očkování a zároveň zvyšuje náchylnost pacienta k infekčním komplikacím [33, 34]. V takovém případě je doporučováno provedení vakcinace minimálně 14 dní před zahájením této léčby (chemoterapie, radioterapie, imunosuprese) nebo s odstupem alespoň 3 měsíců od ukončení imunokompromitující terapie [14, 32]. Ještě komplikovanější je situace u pacientů léčených jakoukoliv anti-CD20 protilátkou. Data pro tuto specifickou skupinu splenektomovaných chybí, ale obecně v důsledku protahované deplece zdravých B-lymfocytů po léčbě anti-CD20 protilátkami dochází k výraznému oslabení protilátkové odpovědi po očkování minimálně po dobu 6–12 měsíců [33–35]. V těchto případech je o to důležitější užívání antibiotické profylaxe až do provedení účinné vakcinace (viz dále). Jednoznačná data o účinnosti vakcinace u hematologických pacientů po splenektomii léčených kortikosteroidy nejsou dostupná. V případě nehematologických pacientů léčených kortikoidy pro chronická zánětlivá onemocnění nebyl popsán závažný pokles imunitní odpovědi po inaktivovaných vakcínách, nicméně riziko zhoršení imunitní odpovědi u vyšších dávek kortikoidů lze pravděpodobně očekávat [30]. Dávky prednisonu nad 20 mg denně (nebo ekvivalentní dávky ostatních kortikoidů) po dobu 14 a více dní jsou obecně považovány za vysokou úroveň imunosuprese, nicméně dostupná doporučení se v tomto případě nijak neliší od pacientů léčených nižšími dávkami kortikosteroidů [30]. Stejně komplikovaná je situace i u pacientů na jiné dlouhodobé udržovací imunosupresivní či imunomodulační léčbě. Jedná se o různorodou populaci pacientů s různou mírou imunosuprese nebo základní diagnózou a hodnocení efektivity vakcinace stejně jako konkrétní doporučení pro každou rizikovou skupinu zvlášť v současné literatuře nejsou. Obecně lze ale v případě obavy o dostatečnou účinnost vakcinace u těchto pacientů stanovit hladinu protektivních protilátek v krvi po vakcinaci a při nedostatečných hladinách zvážit nasazení antibiotické profylaxe.
Zajištění samotné vakcinace splenektomovaných pacientů je dle regionální zvyklosti různé. U většiny splenektomovaných pacientů v souvislosti s hematologickým onemocněním lze pravděpodobně očekávat nutnost pravidelných kontrol na hematologické ambulanci. Především v případě zajištění prvních dávek a časných „booster“ dávek veškerých potřebných vakcín je v tomto případě vhodné zajistit vakcinaci cestou hematologické ambulance v rámci běžných kontrol. Eventuálně je možné dle doporučených schémat zajistit vakcinaci cestou očkovacích center. Pravidelné pozdní „booster“ dávky a každoroční očkování proti chřipce lze již v rámci dlouhodobé péče realizovat cestou praktického lékaře. Zcela zásadní je ve všech případech důsledné zaznamenávání podaných vakcín v dokumentaci pacienta, především v očkovací průkazce pacienta po spelenektomii (např. „Karta hematologicky nemocného po splenektomii“).
Vakcinace – Streptococcus pneumoniae
V současnosti jsou používány 2 typy vakcín proti pneumokoku. Novější pneumokoková 13valentní konjugovaná vakcína (Prevenar 13®; PCV13; pro asplenické pacienty v ČR k 1. 1. 2018 hrazena ze zdravotního pojištění podle zákona č. 48/1997 Sb.) chrání proti 13 nejčastějším sérotypům působícím pneumokoková invazivní onemocnění (sérotypy 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F). Zvýšená imunogenicita vakcíny je způsobena konjugací kapsulárních polysacharidů těchto 13 sérotypů s proteinem CRM197. Druhou vakcínou je starší 23valentní polysacharidová vakcína (PPSV23), obsahující purifikované kapsulární polysacharidy 23 různých sérotypů Streptococcus pneumonie (sérotypy 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, 33F). U dříve dostupné vakcíny PNEUMO23® byla k 9/2017 ukončena výroba a v ČR není ekvivalentní vakcína běžně dostupná. Nicméně ekvivalentní vakcína Pneumovax23® je v zahraničí v současnosti dostupná a měla by být zajistitelná ve větších zdravotnických centrech na speciální dovoz. V tomto případě ale není vakcína hrazena ze zdravotního pojištění. Ve srovnání s polysacharidovou vakcínou byla prokázána schopnost konjugované vakcíny indukovat silnou T-dependentní imunitní odpověď s dlouhou imunitní pamětí [36]. Rovněž v případě opakovaných dávek PCV13 je zachována dobrá imunogenicita vakcíny, na rozdíl od polysacharidové vakcíny, kde dochází opakovaným podáváním k vyčerpávání a oslabování imunitní odpovědi na další dávky [37]. Použití polysacharidové vakcíny je spojeno pouze s T-independentní krátkodobou imunitní odpovědí, bez indukce dostatečné imunitní paměti a s rizikem úplného selhání této vakcíny [3, 14, 36]. Bylo také popsáno zhoršení již preexistující imunitní paměti po podání PPSV23, jež je dáno indukcí dozrávání paměťových B-buněk [38]. Dřívější obavy v souvislosti se zaváděním konjugované vakcíny z nárůstu incidence vážných invazivních pneumokokových infekcí (IPI) způsobených nevakcinačními sérotypy nebyly v běžné populaci zcela potvrzeny [39]. Ve většině evropských zemí došlo po zavedení konjugované vakcíny do širší populace k poklesu incidence invazivních pneumokokových onemocnění, bylo ale prokázáno zvýšení diverzity sérotypů způsobujících pneumokokové infekce s nárůstem incidence některých nevakcinačních sérotypů [39, 40–42]. Většinou se jedná o méně invazivní sérotypy [39], ale byly zaznamenány i případy vážných pneumokokových infekcí u splenektomovaných pacientů těmito nevakcinačními kmeny [43].
Podle většiny současných světových doporučení [3, 14, 32, 44] by všichni splenektomovaní pacienti měli být vždy vakcinováni jednou dávkou PV13. „Booster“ dávka PCV13 není v současnosti rutinně doporučována, i když někteří autoři považují podání druhé dávky PCV13 po roce za vhodné za účelem obnovení množství paměťových B-buněk [45, 46, 47]. Za účelem rozšíření spektra ochrany proti non-PCV13 vakcinačním sérotypům je současně doporučováno provést očkování polysacharidovou vakcínou PPSV23. Polysacharidová vakcína by měla být podána nejdříve 8–12 týdnů po aplikaci PCV13. Pro posílení imunitní odpovědi je vhodná jedna „booster“ dávka PPSV23 s odstupem 5 let od první dávky a druhá „booster“ dávka pak eventuálně v 65 letech věku (ne dříve než 5 let po 1. „booster“ dávce). Dříve prováděný pravidelný „booster“ PPSV23 každých 5 let vzhledem k vyčerpávání imunitní odpovědi a zhoršování již vytvořené imunitní paměti není již v současnosti doporučován. U starších pacientů splenektomovaných po dovršení 65 let věku by měla být podána dávka PCV13 a jedna dávka PPSV23 s odstupem 8–12 týdnu bez dalších „booster“ dávek.
Pacienti očkovaní již v minulosti před splenektomií konjugovanou vakcínou z jiné indikace jsou indikováni k podání PPSV23 s 2 „booster“ dávkami podle předchozího doporučení. V případě předchozí vakcinace polysacharidovou vakcínou je nutné podání dávky konjugované vakcíny PCV13, ta by ale měla být podána nejdříve 1 rok po posledním podání PPSV23. U těchto pacientů je možné i podání „booster“ dávky PPSV23 5 let po první dávce vakcíny, ale pouze v případě, že nebyly „booster“ dávky podávány již v minulosti. Názory na dříve doporučované měření titru protilátek se různí z důvodu obtížné interpretace a omezeného klinického výstupu (doživotní ATB profylaxe), a není tak plošně doporučováno [3, 14, 30, 32, 44]. Vakcinační schéma pro očkování proti pneumokoku je shrnuto v tabulce 3.
Tab. 3. Vakcinace Streptococcus pneumonie 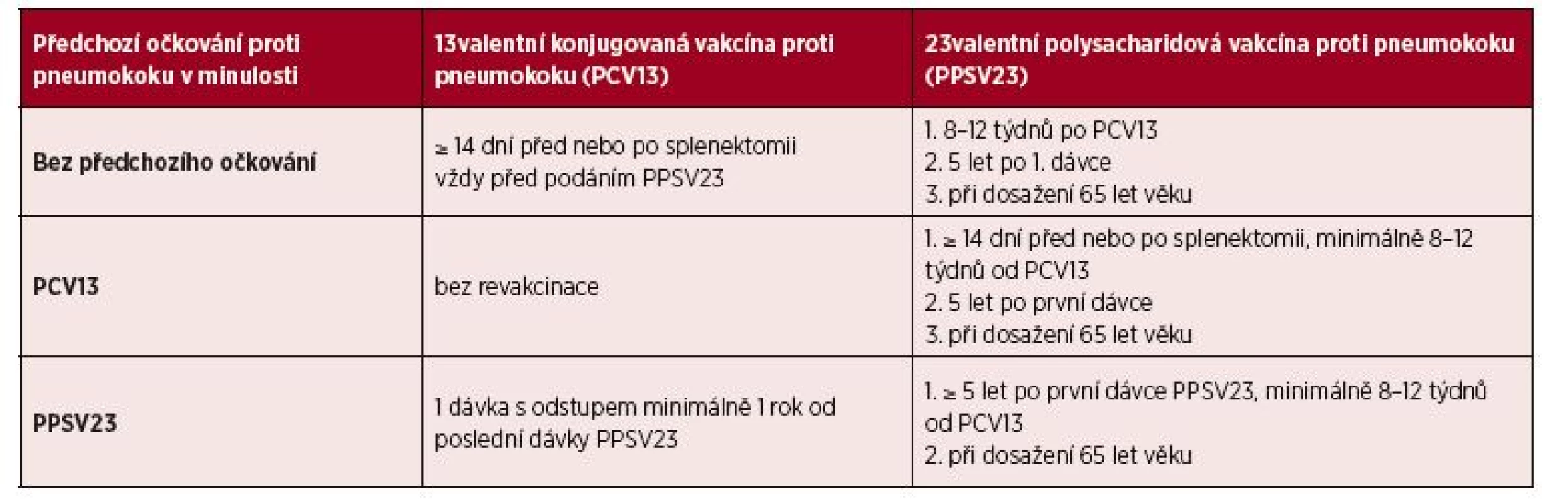
Vakcinace – Neisseria meningitidis
Dalším vysoce rizikovým patogenem u splenektomovaných pacientů je opouzdřená bakterie Neisseria meningitidis. Je známo několik sérotypů způsobujících meningokoková onemocnění (především A, B, C, W, X, Y) s rozdílným epidemiologickým zastoupením podle geografické lokace [48]. V Evropě mezi dominantní sérotypy způsobující meningokoková onemocnění patří sérotyp B a C, nicméně v posledních letech bylo popsáno i rozšíření některých ostatních sérotypů (W, Y) [49, 50, 51]. Riziko nákazy těmito v Evropě méně častými sérotypy se zároveň zvyšuje s lepšími možnostmi cestování do oblastí s rozdílnou epidemiologickou situací. Pro očkování proti meningokoku jsou v současnosti používány konjugované vakcíny proti meningokoku typu A, C, W, Y, v České republice dostupné ve dvou typech podle typu konjugátu – konjugovaná s toxinem Corynebacterium diphtheriae (Menveo®) nebo s tetanickým toxoidem (Nimenrix®). Starší typ konjugované vakcíny pouze proti sérotypu C nebo polysacharidové vakcíny již téměř nejsou v dnešní době využívány. V posledních letech je rovněž dostupná vakcína proti meningokoku typu B. K dispozici jsou dva typy této rekombinantní vakcíny – 2dávková rekombinantní vakcína (BEXSERO®) nebo 3dávková rekombinantní vakcína (Trumenba®). Oba typy vakcín (konjugovaná a rekombinantní) jsou v ČR k 1. 1. 2018 dostupné a v níže uvedených dávkovacích schématech pro asplenické pacienty hrazené ze zdravotního pojištění.
Vakcinační schéma u imunokompromitovaných pacientů je složeno z jedné dávky tetravalentní konjugované vakcíny proti meningokoku ACWY a rekombinantní vakcíny proti meningokoku B. Obě vakcíny mohou být aplikovány najednou a současně s konjugovanou pneumokokovou vakcínou. Pro obě vakcíny je doporučován „booster“ s odstupem 8–12 týdnů. V případě tetravaletní konjugované vakcíny by měl být „booster“ opakován každých 5 let za účelem udržení vysokého protektivního titru protilátek [52]. Pro rekombinantní vakcínu proti meningokoku B v současnosti zatím nejsou dlouhodobá data, a není tak zatím doporučováno provádění dalších „booster“ dávek [3, 14, 32, 53]. Vakcinační schéma pro meningokoky je shrnuto v tabulce 4.
Tab. 4. Vakcinace Neisseria meningitidis 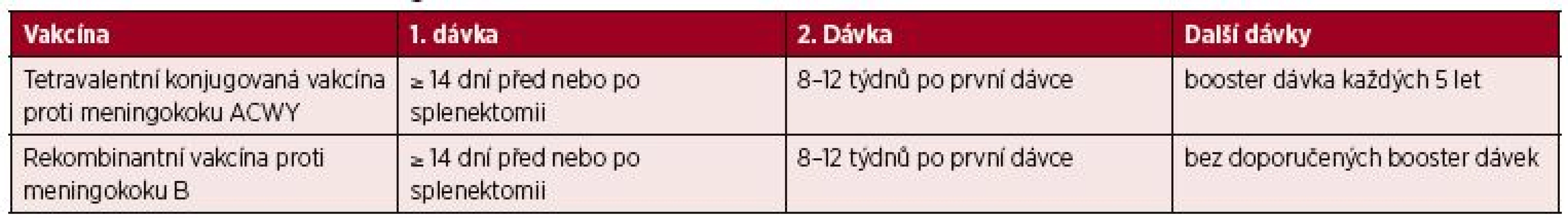
Vakcinace – Heamophilus influenzae typu B (HiB)
Proti invazivním infekcím způsobenými bakterií Heamophilus influenzae jsou k dispozici pouze vakcíny proti typu B. Vyráběno je několik typů konjugovaných vakcín lišících se podle typu konjugátu (v České republice dostupná vakcína Hiberix, k 1. 1. 2018 hrazená pro asplenické pacienty ze zdravotního pojištění). U všech konjugovaných vakcín proti HiB je u splenektomovaných pacientů popisována vysoká imunogenicita vakcíny [53, 55–57] a ačkoliv je znám postupný pokles hladiny protektivních protilátek v čase, tak nemusí být tento pokles nutně doprovázen i zvýšeným rizikem pro invazivní HiB infekce. Klinická efektivita vakcinace je v běžné populaci udávána až 95 %, specifické hodnocení efektivity u pacientů se zvýšeným rizikem ovšem chybí [54, 55, 57].
Podle aktuálních světových doporučení je dostatečná jedna dávka kterékoliv konjugované HiB vakcíny u všech pacientů s negativní nebo neznámou historií HiB vakcinace [3, 14, 30, 32, 56]. V případě pacientů, kteří prokazatelně dokončili vakcinaci HiB v dětství podle vakcinačního kalendáře, se jednotlivá doporučení mírně liší – zatímco například americká doporučení Centra pro kontrolu nemocí a prevenci (Centers for Disease Control and Prevention) nepovažují v tomto případě přeočkování za nutné [3, 57], podle italských doporučení publikovaných v roce 2017 v Human Vaccines & Immunotherapeutics je vzhledem ke známému postupnému poklesu protektivních protilátek a dobré dostupnosti vakcíny s minimem nežádoucích účinků vhodné u pacientů podstupujících splenektomii revakcinaci provést [14]. Data podporující nutnost jiné revakcinace nebo „booster“ dávek nejsou k dispozici a v současnosti nejsou doporučovány [3, 14].
Vakcinace – Influenza
Přestože splenektomovaní pacienti nejsou ve zvýšeném riziku nákazy chřipkou, je chřipková infekce považována za rizikový faktor vzniku sekundární bakteriální pneumonie. V retrospektivní populační studii asplenických pacientů bylo prokázáno zhruba poloviční riziko úmrtí ve srovnání s neočkovanou skupinou [56]. U všech pacientů po splenektomii je tak výrazně doporučováno každoroční, sezonní očkování proti chřipce vakcínou připravovanou podle aktuální epidemiologické situace. Toto očkování by mělo probíhat před zahájením chřipkové sezony, ideálně v období října [3, 14, 30, 32]. Dostupné vakcíny pro danou sezonu jsou u asplenických pacientů taktéž hrazeny ze zdravotního pojištění.
Antibiotická profylaxe
Antibiotická profylaxe u splenektomovaných pacientů spočívá v dlouhodobém až celoživotním užívání antibiotika, a to bez známek přítomnosti jakékoliv infekce. Přestože dříve patřila mezi standardní preventivní opatření, v dnešní době jsou názory na profylaktické užívání antibiotik rozdílné [1, 13, 14, 59]. Dřívější studie zaměřené na posouzení efektivity antibiotické profylaxe jsou zaměřené pouze na úzké spektrum dětských pacientů a jednoznačná data pro dospělé pacienty tak chybí [60, 61]. Používání rutinní dlouhodobé profylaxe navíc bylo zaváděno a hodnoceno v době před rozšířením vakcinace konjugovanými vakcínami proti pneumokoku [62] a zároveň před nárůstem kolonizací a infekcí penicilin rezistentními pneumokoky. Dlouhodobé užívání antibiotika navíc může být spjato s možnými nežádoucími účinky antibiotické terapie a zhoršenou „compliance“ (tj. spolupráce) pacienta. S ohledem na tato fakta používání antibiotické profylaxe není ve většině mezinárodních doporučení jednoznačně doporučováno, ale mělo by být zváženo u splenektomovaných pacientů s přidruženými rizikovým faktory rozvoje OPSI, jako jsou probíhající chemoterapie, radioterapie nebo imunosupresivní léčba [1, 2, 13, 14]. Tito pacienti navíc nemohou být řádně očkovaní před provedením nebo těsně po provedení splenektomie, což dále zvyšuje nebezpeční rozvoje OPSI. Z tohoto důvodu je skupinou CELL doporučováno použití antibiotické profylaxe u všech pacientů bez řádného očkování v souvislosti se splenektomií, kteří podstupují imunosupresivní léčbu, chemoterapii či radioterapii. Délka profylaxe by měla být po celou dobu této léčby až do provedení řádného očkování (nejdříve 3 měsíce po skončení chemoterapie, radioterapie, imunosuprese). Antibiotikem volby nadále zůstává orální penicilin (V-penicilin 500 mg á 12 h), v případě alergie pak co-trimoxazol nebo klarithromycin (viz tab. 2).
ZÁVĚR
Septický syndrom u asplenických pacientů je vážnou infekční komplikací s možnými fatálními následky rozvinuté sepse i přes maximální intenzivní léčbu. Nejčastějším mikroorganismem způsobujícím tuto život ohrožující komplikaci je bakterie Streptococcus pneumonie, ale objevit se mohou i infekce způsobené mnoha jinými bakteriemi a mikroorganismy. Zvláště rizikovou skupinou jsou pacienti splenektomovaní v souvislosti s hematologickým onemocněním, u kterých navíc může být situace zhoršována probíhající chemoterapií, radioterapií nebo imunosupresí. Přestože množství pacientů splenektomovaných z hematologické indikace s rozvojem moderní onkologické léčby ubývá, nadále existuje skupina pacientů, u kterých je provedení splenektomie nezbytné. Vzhledem k vysokému riziku těžkých infekcí s vysokou mortalitou je potřebné nadále zlepšovat preventivní opatření u všech splenektomovaných pacientů. Tato poměrně jednoduchá preventivní opatření mohou snížit nebezpečí vzniku těchto infekčních komplikací, jak u pacientů splenektomovaných z hematologické indikace, tak splenektomovaných v důsledku traumatu či z jiné nehematologické příčiny. Současná doporučení se stejně jako v minulosti opírají o 3 základní body:
- edukaci pacienta,
- vakcinaci proti rizikovým infekčním agens,
- antibiotickou profylaxi v indikovaných případech.
Přestože v posledních letech došlo ke zvýšení účinnosti některých preventivních opatření, např. zavedením účinnějších konjugovaných a jiných moderních vakcín do běžné praxe, nadále zůstává dostatek prostoru pro zlepšování preventivních opatření i v budoucnu. Zlepšení edukace pacientů a zdravotnického personálu zajišťující dobrou „compliance“ s dodržováním preventivních doporučení, další vývoj účinných vakcín proti dosud nepokrytému spektru některých bakterií a jejich sérotypům (pneumokok) nebo vyjasnění otázky účinnosti antibiotické profylaxe u nejrizikovějších pacientů v době narůstajících antibiotických rezistencí zůstávají možnými oblastmi výzkumu v problematice asplenických a hyposplenických pacientů.
Podíl autorů na rukopisu
TK – hlavní autor
BW – spoluautor a revize
IK – spoluautor a revize
PŽ – spoluautor a revize
AZ – spoluautor a revize
MK – spoluautor a revize
LD – spoluautor a revize
MN – spoluautor a revize
PM – spoluautor a revize
JŠ – spoluautor a revize
PS – spoluautor a revize
PK – spoluautor a revize
JH – spoluautor a revize
NM – spoluautor a revize
DT – spoluautor a revize
JN – spoluautor a revize
EF – spoluautor a revize
JM – spoluautor a revize
ZR – spoluautor a finální kontrola
Prohlášení o konfliktu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce dne 29. 3. 2018.
Přijato po recenzi dne 11. 7. 2018.
MUDr. Tomáš Kabut
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
62500 Brno
Tel.: 532233573
e-mail: Kabut.Tomas@fnbrno.cz
Korespondenční autor:
prof. MUDr. Zdeněk Ráčil, Ph.D.
Interní hematologická a onkologická klinika FN Brno a LF MU
Jihlavská 20
625 00 Brno
e-mail: racil.zdenek@fnbrno.cz
Zdroje
1. Di Sabatino A, Carsetti R, Corazza GR. Post-splenectomy and hyposplenic states. Lancet 2011;378(9785):86–97.
2. Serio B, Pezzullo L, Giudice V, et al. OPSI threat in hematological patients. Transl Med UniSa 2013;6 : 2–10.
3. Hammerquist RJ, Messerschmidt KA, Pottebaum AA, Hellwig TR. Vaccinations in asplenic adults. Am J Health Syst Pharm 2016;73(9):220–228.
4. Tennenberg AM, Sepkowitz KA. Postsplenectomy infections in oncology patients. Complications in Surgery 1998;15 : 16–18.
5. Katz SC, Pachter HL. Indications for splenectomy. Am Surg 2006;72(7):565–580.
6. Bisharat N, Omari H, Lavi I, Raz R. Risk of infection and death among post-splenectomy patients. J Infect 2001;43(3):182–186.
7. Khamechian T, Alizargar J, Farzanegan M. Pattern of splenectomy indications in kashan shahid-beheshti hospital: a 5-year study. Arch Trauma Res 2013;1(4):180–183.
8. Bonnet S, Guédon A, Ribeil JA, Suarez F, Tamburini J, Gaujoux S. Indications and outcome of splenectomy in hematologic disease. J Visc Surg 2017;154(6):421–429.
9. Bagrodia N, Button AM, Spanheimer PM, Belding-Schmitt ME, Rosenstein LJ, Mezhir JJ. Morbidity and mortality following elective splenectomy for benign and malignant hematologic conditions: analysis of the American College of Surgeons National Surgical Quality Improvement Program data. JAMA Surg 2014;149(10):1022–1029.
10. Kvapil F, Doubek M, Brychtová Y, Kala Z, Vorlíček J, Mayer J. Splenektomie v diagnostice a léčbě hematologických onemocnění – indikace, komplikace a výsledky z jednoho pracoviště. Transfuze Hematol dnes 2006;12(3):146–152.
11. Kozák T, Čermák J, Červinek L, et al. Doporučení ČHS pro diagnostiku a léčbu imunitní trombocytopenie (ITP). Transfuze Hematol dnes 2017;23(3):158–169.
12. Bolton-Maggs PH, Langer JC, Iolascon A, Tittensor P, King MJ. Guidelines for the diagnosis and management of hereditary spherocytosis – 2011 update. Br J Haematol 2012;156(1):37–49.
13. Rubin LG, Schaffner W. Clinical practice. Care of the asplenic patient. N Engl J Med 2014;371(4):349–56.
14. Bonanni P, Grazzini M, Niccolai G, et al. Recommended vaccinations for asplenic and hyposplenic adult patients. Hum Vaccin Immunother 2017;13(2):359–368.
15. Castagnola E, Fioredda F. Prevention of life-threatening infections due to encapsulated bacteria in children with hyposplenia or asplenia: a brief review of current recommendations for practical purposes. Eur J Haematol 2003;71(5):319–326.
16. Cadili A. Encapsulated bacterial infections following splenectomy. Rev Med Microbiol 2010;21 : 7–10.
17. Theilacker C, Ludewig K, Serr A, et al. Overwhelming postsplenectomy infection: A prospective multicenter cohort study. Clin Infect Dis 2016;62(7):871–878.
18. William BM, Thawani N, Sae-Tia S, Corazza GR. Hyposplenism: a comprehensive review. Part II: clinical manifestations, diagnosis, and management. Hematology 2007;12(2):89–98.
19. Rosner F, Zarrabi MH, Benach JL, Habicht GS. Babesiosis in splenectomized adults. Review of 22 reported cases. Am J Med 1984;76(4):696–701.
20. Lion C, Escande F, Burdin JC. Capnocytophaga canimorsus infections in human: Review of the literature and cases report. Eur J Epidemiol 1996;12(5):521–533.
21. Boone KE, Watters DA. The incidence of malaria after splenectomy in Papua New Guinea. BMJ 1995;311(7015):1273.
22. Boam T, Sellars P, Isherwood J, et al. Adherence to vaccination guidelines post splenectomy: a five year follow up study. J Infect Public Health 2017;10(6):803–808.
23. Carrico RM, Goss L, Wojcik J, et al. Postsplenectomy vaccination guideline adherence: opportunities for improvement. J Am Assoc Nurse Pract 2017;29(10):612–617.
24. Jones AD, Khan M, Cheshire J, Bowley D. Postsplenectomy prophylaxis: A persistent failure to meet standard? Open Forum Infect Dis 2016;3(4):197.
25. O‘Neal HR Jr, Niven AS, Karam GH. Critical illness in patients with asplenia.Chest 2016;150(6):1394–1402.
26. Kuzman I, Bezlepko A, Topuzovska IK. Efficacy and safety of moxifloxacin in community acquired pneumonia: a prospective, multicenter, observational study (CAPRIVI). BMC Pulm Med 2014;14 : 105.
27. Fogarty C, Torres A, Choudhri S. Efficacy of moxifloxacin for treatment of penicillin-, macrolide - and multidrug-resistant Streptococcus pneumoniae in community-acquired pneumonia. Int J Clin Pract 2005;59(11):1253–1259.
28. Baxter M, Jacobson K, Albur M. Moxifloxacin should not be discounted in the treatment of bacterial meningitis. J Infect 2016;73(2):173–174.
29. Skaare D, Lia A, Hannisdal A, et al. Haemophilus influenzae with non-beta-lactamase-mediated beta-lactam resistance: easy to find but hard to categorize. J Clin Microbiol 2015;53(11):3589–3595.
30. Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014;58(3):309–318
31. Centers for Disease Control and Prevention. Principles of vaccination: epidemiology and prevention of vaccine-preventable diseases. Dostupné na www: https://www.cdc.gov/vaccines/pubs/pinkbook/index.html (December 30, 2016).
32. Esposito S, Bonanni P, Maggi S, et al. Recommended immunization schedules for adults: clinical practice guidelines by the Escmid Vaccine Study Group (EVASG), European Geriatric Medicine Society (EUGMS) and the World Association for Infectious Diseases and Immunological Disorders (WAidid). Hum Vaccin Immunother 2016;12(7):1777–1794.
33. de Lavallade H, Garland P, Sekine T, et al. Repeated vaccination is required to optimize seroprotection against H1N1 in the immunocompromised host. Haematologica 2011;96(2):307–314.
34. de Y, Imamura Y, Ohfuji S, et al. Immunogenicity of a monovalent influenza A(H1N1)pdm09 vaccine in patients with hematological malignancies. Hum Vaccin Immunother 2014;10(8):2387–2394.
35. Yri OE, Torfoss D, Hungnes O, et al. Rituximab blocks protective serologic response to influenza A (H1N1) 2009 vaccination in lymphoma patients during or within 6 months after treatment. Blood 2011;118(26):6769–6771.
36. Jackson LA, Gurtman A, van Cleeff M, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults.Vaccine 2013;31(35):3577–3584.
37. Jackson LA, Gurtman A, van Cleeff M, et al. Influence of initial vaccination with 13-valent pneumococcal conjugate vaccine or 23-valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older. Vaccine 2013;31(35):3594–3602.
38. Clutterbuck EA, Lazarus R, Yu LM, et al. Pneumococcal conjugate and plain polysaccharide vaccines have divergent effects on antigen-specific B cells. J Infect Dis 2012;205(9):1408–1416.
39. Tin Tin Htar M, Christopoulou D, Schmitt HJ. Pneumococcal serotype evolution in Western Europe. BMC Infect Dis 2015;15 : 419.
40. Galanis I, Lindstrand A, Darenberg J, et al. Effects of PCV7 and PCV13 on invasive pneumococcal disease and carriage in Stockholm, Sweden. Eur Respir J 2016;47(4):1208–1218.
41. Waight PA, Andrews NJ, Ladhani SN, Sheppard CL, Slack MP, Miller E. Effect of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort study. Lancet Infect Dis 2015;15(5):535–543.
42. Van der Linden M, Perniciaro S, Imöhl M. Increase of serotypes 15A and 23B in IPD in Germany in the PCV13 vaccination era. BMC Infect Dis 2015;15 : 207.
43. Singer J, Testori C, Schellongowski P, et al. A case report of septic shock syndrome caused by S. pneumoniae in an immunocompromised patient despite of vaccination. BMC Infect Dis 2017;17 : 442.
44. Centers for Disease Control and Prevention. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). Morb Mortal Wkly Rep 2012;62(25):521–524.
45. Rosado MM, Gesualdo F, Marcellini V, et al. Preserved antibody levels and loss of memory B cells against pneumococcus and tetanus after splenectomy: tailoring better vaccination strategies. Eur J Immunol 2013;43(10):2659–2670.
46. Elizabeth A. Clutterbuck, Rajeka Lazaru, et al. Pneumococcal conjugate and plain polysaccharide vaccines have divergent effects on antigen-specific B cells. J Infect Dis 2012;205(9):1408–1416.
47. Papadatou I, Piperi C, Alexandraki K, Kattamis A, Theodoridou M, Spoulou V. Antigen-specific B-cell response to 13-valent pneumococcal conjugate vaccine in asplenic individuals with β-thalassemia previously immunized with 23-valent pneumococcal polysaccharide vaccine. Clin Infect Dis 2014;59(6):862–865.
48. Crum-Cianflone N, Sullivan E. Meningococcal vaccinations. Infect Dis Ther 2016;5(2):89–112.
49. Harrison LH, Trotter CL, Ramsay ME. Global epidemiology of meningococcal disease. Vaccine 2009;27 Suppl 2:B51–63.
50. Ladhani SN, Beebeejaun K, Lucidarme J, et al. Increase in endemic Neisseria meningitidis capsular group W sequence type 11 complex associated with severe invasive disease in England and Wales. Clin Infect Dis 2015;60(4):578–585.
51. European Centre for Disease Prevention and Control. Surveillance of invasive bacterial diseases in Europe 2008/2009. ECDC; 2011.
52. Brady MT, Bernstein HH, Byington CL, et al. Meningococcal conjugate vaccines policy update: booster dose recommendations. Pediatrics 2011;128(6):1213–1218.
53. Cohn AC, MacNeil JR, Clark TA, et al. Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2013;62(RR-2):1–28.
54. Mikoluc B, Motkowski R, Käyhty H, Heropolitanska-Pliszka E, Pietrucha B, Bernatowska E. Antibody response to Haemophilus influenzae type-b conjugate vaccine in children and young adults with congenital asplenia or after undergoing splenectomy. Eur J Clin Microbiol Infect Dis 2012;31(5):805–809.
55. Cimaz R, Mensi C, D‘Angelo E, et al. Safety and immunogenicity of a conjugate vaccine against Haemophilus influenzae type b in splenectomized and nonsplenectomized patients with Cooley anemia. J Infect Dis 2001;183(12):1819–1821.
56. Hamborsky J, Kroger A, Wolfe S, et al. Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. 13th ed. Washington D.C.: Public Health Foundation, 2015. Chapter 8 Haemophilus influenza. Dostupné na www: http://www.cdc.gov/vaccines/pubs/pinkbook/hib.html.
57. Briere EC, Rubin L, Moro P, et al. Prevention and control of haemophilus influenzae type b disease: recommendations of the advisory committee on immunization practices (ACIP). MMWR Recomm Rep 2014;63(RR-01):1–14.
58. Langley JM, Dodds L, Fell D, Langley GR. Pneumococcal and influenza immunization in asplenic persons: a retrospective population-based cohort study 1990–2002. BMC Infect Dis 2010;10 : 219.
59. Davies JM, Lewis MP, Wimperis J, Rafi I, Ladhani S, Bolton-Maggs PH. British Committee for Standards in Haematology. Review of guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen: prepared on behalf of the British Committee for Standards in Haematology by a Working Party of the Haemato-Oncology Task Force. Br J Haematol 2011;155(3):308–317.
60. Gaston MH, Verter JI, Woods G, et al. Prophylaxis with oral penicillin in children with sickle cell anemia. A randomized trial. N Engl J Med 1986;314(25):1593–1599.
61. Rankine-Mullings AE, Owusu-Ofori S. Prophylactic antibiotics for preventing pneumococcal infection in children with sickle cell disease. Cochrane Database Syst Rev 2017;10:CD003427.
62. Pilishvili T, Lexau C, Farley MM, et al. Active bacterial core surveillance/emerging infections program. Sustained reductions in invasive pneumococcal disease in the era of conjugate vaccine. J Infect Dis 2010;201(1):32–41.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2018 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Vplyv nádorového metabolizmu na terapiu detských leukémií
- Registr dárců plné krve – srovnání dat 12 zařízení transfuzní služby v letech 2008 a 2016
- Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Nové poznatky o mechanismech opravy DNA po poškození alkoholem
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Životní jubileum prof. MUDr. Radima Brdičky, DrSc.
- Prim. MUDr. Josef Nedvěd
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- EMA schválila první imunoterapii pomocí CAR T-lymfocytů
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



