-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMutácie génu F8 u pacientov s ťažkým stupňom hemofílie A a výskyt inhibítorov FVIII
Mutations of the F8 gene in patients with severe haemophilia A and occurrence of FVIII inhibitors
Recent advances in molecular diagnosis of haemophilia have enabled the study of genotypic and phenotypic relationships and of the effect of gene mutations on the occurrence of serious disease complications, such as inhibitors. We present the first results of the National Genetic Haemophilia Program, established in 2014. So far, we have investigated 173 haemophilia A patients, of which 141 have severe haemophilia, representing 60% of the population of severe haemophiliacs in Slovakia. In severe haemophiliacs, we identified 39 different mutations, including 18 new mutations not yet listed in the international mutation database. The proportion of mutations in our population of 141 severe haemophiliacs is consistent with literature: inversions of introns 22 and 1 in 59 (42%), nonsense mutations in 16 (11%), large deletions in 4 (3%), frame shift/stop codon mutations in 38 (27%), splice site mutations in 5 (4%) and missense mutations in 19 (13%) of patients. Analysis of gene mutations in 34 inhibitor patients confirmed a comparable risk of inhibitor development in patients with inversions (27%), nonsense mutations (25%) and frame shift/stop codon mutations (29%), with a higher risk of mutations localized in parts of the F8 gene encoding the light chain of FVIII molecule compared to heavy chain mutations – OR: 2.57 (0.85–7.77). Evaluation of the success rate of immune tolerance induction (ITI) in 22 patients (26 ITI courses) according to the gene defects in inhibitor patients showed complete and partial remission in 75% and 88–100% of patients with inversions and other gene mutations, respectively. These results are influenced by the small number of patients and this issue requires further study.
Key words:
F8 gene mutations – haemophilia A – factor FVIII inhibitors – immune tolerance induction
Autoři: T. Prigancová 1; D. Jankovičová 1; A. Kyselová 1; J. Chandoga 2; R. Petrovič 2; P. Jungová 2; M. Juhosová 2; M. Fischerová 2; M. Mistrík 1; A. Bátorová 1
Působiště autorů: Národné hemofilické centrum Kliniky hematológie a transfuziológie LF UK, SZU, Univerzitná nemocnica Bratislava, Slovenská republika 1; Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK, Univerzitná nemocnica Bratislava, Slovenská republika 2
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 3, p. 194-206.
Kategorie: Původní práce
Souhrn
Nedávne pokroky v molekulovej diagnostike hemofílie položili základy pre štúdium genotypových a fenotypových súvislostí a štúdium vplyvu génových mutácií na výskyt komplikácií choroby, akými sú inhibítory FVIII. V práci prezentujeme prvé výsledky Národného genetického hemofilického programu, založeného v r. 2014. Geneticky sme doteraz vyšetrili 173 pacientov s hemofíliou A, z nich 141 s ťažkým stupňom hemofílie, čo predstavuje 60 % populácie ťažkých hemofilikov na Slovensku. V súbore ťažkých hemofilikov sme identifikovali 39 rôznych mutácií, z nich 18 nových, doposiaľ neevidovaných v medzinárodnej mutačnej databáze. Zastúpenie mutácií v našej populácii 141 pacientov s ťažkým stupňom hemofílie je v zhode s literatúrou, inverzie intrónov 22 a 1 u 59 (42 %), nonsense mutácie u 16 (11 %), veľké delécie u 4 (3 %), frame shift/stop kodón mutácie u 38 (27 %), splice site mutácie u 5 (4 %) a missense mutácie u 19 (13 %) pacientov. Analýza génových mutácií u 34 pacientov s inhibítormi potvrdila porovnateľné riziko vzniku inhibítora pri inverziách (27 %), nonsense mutáciách (25 %) aj pri frame shift/stop kodón mutáciách (29 %), pričom vyššie riziko inhibítorov nesú mutácie ľahkého oproti mutáciám ťažkého reťazca – OR:2,57(0,85–7,77). Hodnotenie efektu imunotolerančnej indukcie (ITI) u 22 pacientov (26 ITI kúr) podľa typu mutácie ukázalo kompletnú a parciálnu remisiu v 75 % pri inverziách a v 88–100 % pri ostatných génových mutáciách. Výsledky sú ovplyvnené malou početnosťou súboru, problematika si vyžaduje ďalšie štúdium.
Klíčová slova:
mutácie génu F8 – hemofília A – inhibítory FVIII – indukcia imunotolerancie
ÚVOD
Hemofília A je vrodené krvácavé ochorenie podmienené mutáciami génu F8, ktoré spôsobujú kvantitatívny alebo kvalitatívny defekt faktora VIII (FVIII). Genetická diagnostika hemofílie je náročná pre veľký počet a heterogenitu kauzálnych mutácií distribuovaných naprieč celým veľkým génom F8 [1, 2]. Medzinárodná mutačná databáza EAHAD-CFDB (European Asociation for Haemophilia and Allied Disoders-Cogulatin Factors Variants Database, http://www.factorviii-db.org) eviduje pri hemofílii A až 2015 unikátnych mutácií, identifikovaných u 5480 jedincov [3]. Významný pokrok molekulovej diagnostiky hemofílie zaznamenaný v poslednom desaťročí zlepšil dostupnosť spoľahlivých vyšetrení, možnosti štúdia vzťahu genotypu k fenotypu i k výskytu komplikácií hemofílie [4–8]. Vplyv mutácií na klinický stupeň hemofílie potvrdzuje skutočnosť, že až u 88 % pacientov s ťažkou hemofíliou sa zistí prítomnosť tzv. „nulových mutácií“ s chýbajúcou tvorbou proteínu FVIII. Za nulové mutácie sa všeobecne považujú veľké delécie (delécie > 200 párov báz), inverzie intrónu 22 a intrónu 1 a nonsense mutácie, ktoré bránia tvorbe génového produktu [1]. K nemerateľnej hladine FVIII v cirkulácii však vedú aj malé delécie, duplikácie alebo inzercie spôsobujúce posun čítacieho rámca a vznik predčasného stop kodónu (frame shift/stop) a niektoré splice site mutácie [1, 4]. Zámenné missense mutácie predstavujú len 16 % mutácií pri ťažkom stupni hemofílie, ale pri strednom stupni sú prítomné až v 68 % a pri ľahkom stupni u viac ako 80 % pacientov [1, 4]. Dobrá korelácia medzi genotypom a fenotypom má význam aj pre genetické poradenstvo, interpretáciu však môže sťažovať pomerne častý výskyt a neznámy význam nových, najmä missense mutácií [1].
Najzávažnejšou komplikáciou hemofílie je v súčasnosti vytvorenie inhibičných protilátok proti exogénnemu FVIII, ktoré sa zisťujú v 10–30 % pacientov s ťažkým stupňom hemofílie A [9–11]. Príčina vzniku inhibítorov FVIII je komplexná a zahŕňa celý rad endogénnych a enviromentálnych faktorov, pričom veľký význam sa pripisuje práve mutáciám génu F8 [12–17]. Oldenburg et al. pozorovali najvyššie riziko inhibítorov pri multi-doménových génových mutáciách (88 %) a veľkých deléciách (25–41 %), ktoré označili ako “vysokorizikové“ mutácie. Pri inverzii intrónu 22, najčastejšej mutácii pri ťažkom stupni hemofílie A, sa inhibítor vyskytol v 21 %, zatiaľ čo pri malých deléciách len v 16 %, splice site mutáciách v 17 % a pri missense mutáciách len v 5 % pacientov [18]. Doteraz najväčšia meta-analýza 151 publikovaných štúdií o výskyte inhibítorov pri jednotlivých typoch mutácií génu F8 zahŕňajúca kohortu 5383 pacientov však demonštruje oveľa širší rozptyl výskytu inhibítorov pri rôznych mutáciách, ako uvádzajú Oldenburg et al. [18], čo je podmienené rozdielmi vo veľkosti hodnotených súborov pacientov [19].
Inhibítory znemožňujú špecifickú profylaxiu a liečbu krvácaní, zhoršujú kvalitu života a zvyšujú morbiditu a mortalitu jedincov s touto komplikáciou, preto primárnym cieľom manažmentu týchto pacientov je navodenie opätovnej tolerovateľnosti exogénneho FVIII. Zatiaľ jediným akceptovaným postupom na eradikáciu inhibítorov je indukcia imunotolerancie (ITI) aplikáciou koncentrátu FVIII v rôznych, vysokých alebo nízkych dávkovacích režimoch [9, 20, 21]. Viacerí autori predpokladajú vplyv genetických faktorov aj na výsledok ITI, pričom opäť platí, že najmä veľké génové mutácie (veľké delécie a inverzie) by mohli súvisieť s horšou prognózou liečby [22].
Od r. 2014 naše pracovisko vedie Národný hemofilický genetický program (NHGP), ktorého cieľom je zmapovanie génových mutácií v celej slovenskej hemofilickej populácii [23]. V prvej fáze projektu sa zameriavame predovšetkým na pacientov s ťažkým stupňom hemofílie a na pacientov s inhibítormi FVIII. V práci prezentujeme prvé výstupy slovenskej databázy génových mutácií pri hemofílii A a analýzu mutácií u pacientov s inhibítormi vrátane tých, ktorí sa podrobili imunotolerančnej indukcii.
MATERIÁL A METÓDY
Súbor pacientov
V Národnom registri hemofílie SR aktuálne evidujeme 520 jedincov s hemofíliou A (234 s ťažkým, 85 so stredne ťažkým a 201 jedincov s ľahkým stupňom choroby). V rámci NHGP v prvej fáze projektu postupne vyšetrujeme pacientov s ťažkým stupňom hemofílie A a pacientov, ktorí v niektorej fáze svojho života vyvinuli inhibítor. Pacienti dispenzarizovaní na iných pracoviskách sú na vyšetrenie predvolávaní v spolupráci s lekármi hematologicko-transfuziologických oddelení (HTO). Zatiaľ sme vyšetrili len časť pacientov so stredným a ľahkým stupňom choroby, sledovaných v našom centre. U všetkých pacientov aktualizujeme rodokmeň hemofílie a revidujeme zdravotnú dokumentáciu so zameraním na rodinnú a osobnú anamnézu inhibítora FVIII.
Vyšetrenie inhibítora
U všetkých pacientov v čase odberu vzoriek na genetické vyšetrenie overujeme aj prítomnosť inhibítora použitím štandardnej Bethesda metódy [24] a Nijmegen modifikácie [25]. Hodnotenie anamnézy inhibítora sa zakladá na výsledkoch pravidelných vyšetrení inhibítorov podľa štandardných postupov [9, 26]. Ako „high responderov“ (HR) označujeme pacientov s aktuálnym alebo historickým titrom inhibítora ≥ 5 BU/ml, „low responderi“ (LR) majú titer < 5 BU/ml. Ako tranzitórny sme označili inhibítor v nízkom titri ≤ 1,9 BU/ml, ktorý pri pokračujúcej substitučnej liečbe spontánne vymizol do 6–12 mesiacov. Klinicky významný je inhibítor, pri ktorom je potrebné zvýšené dávkovanie FVIII alebo spôsobuje neúčinnosť liečby koncentrátom FVIII a teda vyžaduje liečbu bypasovými aktivitami.
Imunotolerančná liečba
ITI indikujeme u všetkých pacientov s novo vzniknutým, klinicky významným inhibítorom. Zo skupiny jedincov s dlhotrvajúcim inhibítorom dostáva ITI zatiaľ len 1 dospelý pacient. U HR preferujeme Bonnský protokol (FVIII 100 IU/kg 2 krát denne), profylaxiu bypasovými aktivitami indikujeme len pri krvácavom fenotype. U LR používame modifikovaný intermediárny protokol s iniciálnou intenzívnou liečbou (50 IU/kg 2 krát denne 3–4 týždne) s pokračovaním dávky 50 IU/kg (u niektorých detí až do 100 IU/kg) denne, neskôr obdeň. Kompletnú remisiu (KR) definujeme opakovanou negativitou inhibítora, in vivo recovery (IVR) ≥ 66 % a biologickým polčasom (T1/2) ≥ 6 hod. Ako parciálnu remisiu (PR) hodnotíme negativitu inhibítora s normalizáciou jedného ďalšieho parametra, IVR alebo T1/2. Ako zlyhanie ITI hodnotíme absenciu poklesu východiskového titra inhibítora o 50 % po 6 mesiacoch ITI a neúspech eradikácie inhibítora po 36 mesiacoch ITI. Relaps inhibítora je návrat klinicky významného titra inhibítora, ktorý vyžaduje ďalšiu ITI na jeho eradikáciu.
Vyšetrenie mutácií génu F8
Vyšetrenie mutácií génu F8 sa vykonáva v Ústave lekárskej biológie, genetiky a klinickej genetiky Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Bratislave. DNA sa izoluje z venóznej EDTA krvi. V prvom stupni sa robí vyšetrenie LD-PCR (long distance polymerase chain reaction) na detekciu veľkých génových rekombinácií, inverzie intrónu 22 [27] a intrónu 1 [28]. Po vylúčení inverzií sa pokračuje vyšetrením MLPA (multiplex ligation–dependent probe amplification) na detekciu veľkých delécií a duplikácií, t.j. delečno-duplikačný skríning (Salsa MLPA kit P178–B2 F8 probemix, MRC Holland, Amsterdam, Holandsko) a nakoniec priama sekvenčná analýza všetkých kódujúcich oblastí génu F8 (vyšetrenie exónov a ich priľahlých intrónových sekvencií) [29]. Zistené mutácie sú označené podľa aktuálnej nomenklatúry odporúčanej HGVS (Human Genome Variation Society, http://www.HGVS.org/varnomen), pri ktorej je číslom +1 označený nukleotid „A“ ATG iniciačného translačného kodónu kódujúcej DNA (cDNA) a na úrovni proteínu FVIII je prvou číslovanou aminokyselinou + 1 metionín (NP_0001123.1) [30]. U každého pacienta bol definovaný typ mutácie a jej dopad na prepis genetickej informácie a tvorbu molekuly proteínu FVIII. V prípade vyšetrenia pacientov z rodiny s už známou mutáciou sa postupnosť vyšetrovacích metód prispôsobuje typu zistenej mutácie. Všetky vyšetrené mutácie sme porovnali s medzinárodnou databázou EAHAD–CFDB [3]. Pri už evidovaných mutáciách sledujeme, či je v mutačnej databáze opísaný aj súvis konkrétnej mutácie s výskytom inhibítora. Genetické vyšetrenie jedincov s hemofíliou a spracovávanie údajov je ošetrené súhlasom etickej komisie Univerzitnej nemocnice Bratislava a informovaným súhlasom pacienta.
Hodnotenie
V súbore vyšetrených pacientov sme hodnotili výskyt mutácií podľa aktuálnej nomenklatúry odporúčanej HGVS: na úrovni cDNA boli mutácie definované ako delécie, inzercie, duplikácie, inverzie, substitúcie. Podľa efektu na prepis genetickej informácie a na génový produkt sme hodnotili mutácie ako nonsense (nezmyselné), missense (meniace zmysel), frame shift mutácie spôsobujúce posun čítacieho rámca (fs), prípadne aj s predčasným ukončením prepisu (stop kodón, označovaný ako *), a splice site mutácie, spôsobujúce poruchu zostrihu [30]. Vyhodnotili sme zastúpenie jednotlivých typov mutácií pri rôznom stupni hemofílie, porovnali sme ich výskyt u pacientov bez inhibítora a s inhibítorom. Vyhodnotili sme výskyt inhibítora pri „vysokorizikových mutáciách“ pre vznik inhibítorov (veľké delécie, inverzie a nonsense mutácie) a pri „mutáciách s nižším rizikom“ (malé delécie, splice site a missense mutácie) [18]. Sledovali sme aj možnú súvislosť medzi typmi mutácií a výsledkom imunotolerančnej liečby u pacientov s inhibítormi.
Štatistické hodnotenie
Kvantitatívne parametre sú vyjadrené počtom, mediánom s dolným a horným kvartilom (M, IQR) a rozptylom minimálnej a maximálnej hodnoty. Kategorické dáta vyjadrujeme ako početnosti, prípadne ako percento z celkového počtu. Pre testovanie kvalitatívnych rozdielov v sledovaných súboroch sme použili testy kontingenčných tabuliek a Fischerov test.
VÝSLEDKY
Súbor pacientov
V rokoch 2015–2017 sme vykonali genetické vyšetrenie u 173 pacientov s hemofíliou A z 95 rodín. Tabuľka 1 prezentuje charakteristiky pacientov podľa stupňa hemofílie. U 173 pacientov sme odhalili 49 typov mutácií, z nich 21 nových mutácií, zatiaľ neuvedených v mutačnej databáze. V skupine 25 pacientov so stredne ťažkým stupňom hemofílie mali prevahu missense mutácie (22/88 %), u 3 pacientov (12 %) sa vyskytli splice site mutácie. V doteraz vyšetrenom malom súbore 7 hemofilikov s ľahkým stupňom choroby boli prítomné len missense mutácie.
Tab. 1. Súbor pacientov podľa stupňa hemofílie 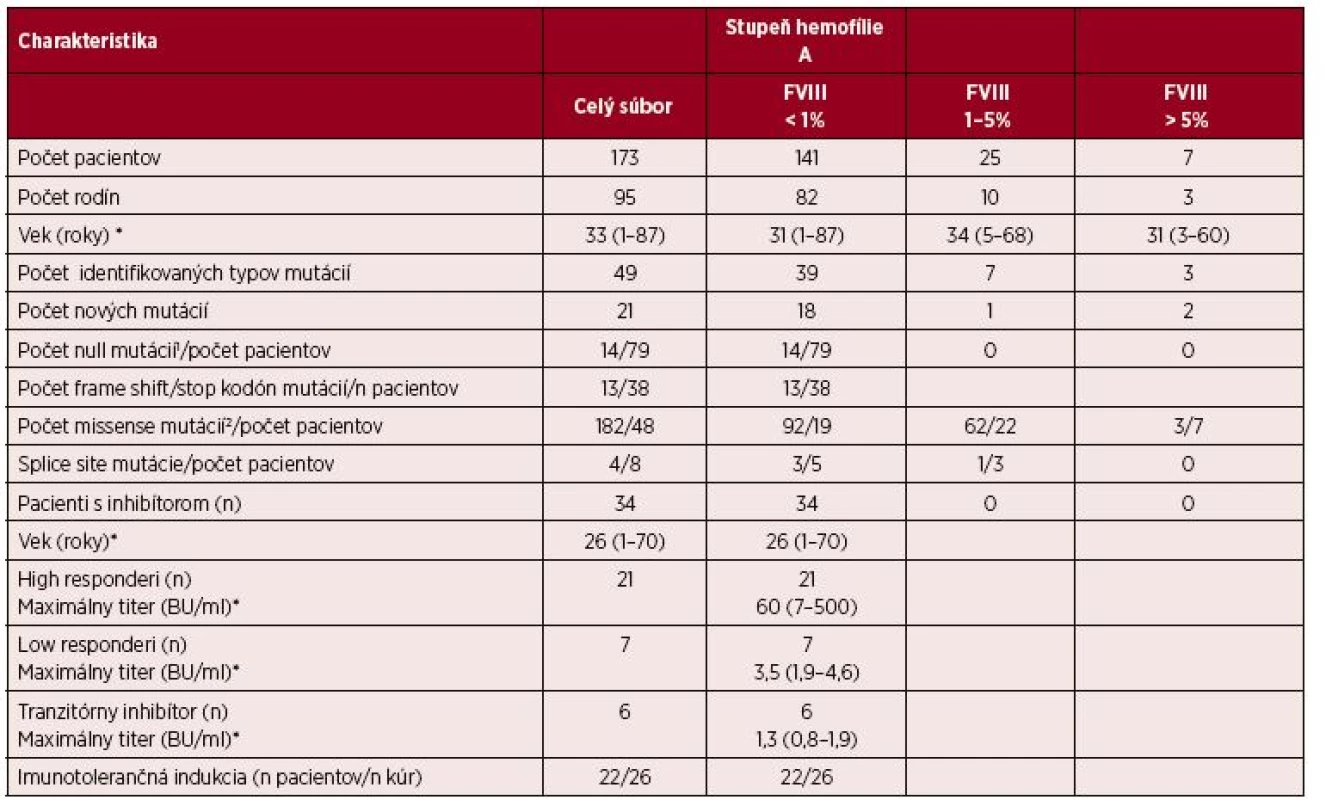
1 Null mutácie: Inverzia intrónu 22, Inverzia intrónu 1, nonsense mutácie, veľké delécie, veľké duplikácie. 2 Mutácia c.6544C>T; Arg2182Cys sa vyskytla u 3 pacientov s ťažkým a u 2 pacientov so stredne ťažkým stupňom hemofílie. *hodnoty vyjadrené mediánom (rozptyl) Výskyt génových mutácií u pacientov s ťažkým stupňom hemofílie
Analyzovali sme súbor 141 ťažkých hemofilikov, pochádzajúcich z 82 rodín. Graf 1 a tabuľka 2 prezentujú zastúpenie typov mutácií v celom súbore pacientov: inverziu intrónu 22 má 52 pacientov (37 %) a inverziu intrónu 17 pacientov (5 %). Veľké delécie sa vyskytli u 4 pacientov (3 %), malé delécie/duplikácie spôsobujúce frame shift/stop mutácie u 38 pacientov (27 %), nonsense mutácie u 16 pacientov (11 %), splice site mutácie u 5 (4 %) a missense mutácie u 19 pacientov (13 %). Pri hodnotení súboru 82 indexových pacientov bol oproti celému súboru ťažkých hemofilikov rozdiel len vo výskyte inverzie intrónu 22, ktorá sa vyskytla u 37/82 pacientov (45 %), nižšie zastúpenie mali inverezie intrónu 1 (2/82; 2,4 %) a frame shift/stop mutácie (17/82; 20,7 %), výskyt ostatných mutácií sa medzi skupinami nelíšil.
Graf 1. Typy génových mutácií v súbore 141 pacientov s ťažkým stupňom hemofílie A (počet a % pacientov s daným typom mutácie)
Inverzia int 22: inverzia intrónu 22; Inverzia int 1: inverzia intrónu 1; frame shift/stop: malé delécie/ duplikácie spôsobujúce posun čítacieho rámca a predčasný stop kodón; spice site: zostrihové mutácie.
Tab. 2. Proporcia mutácií v 82 nepríbuzných rodinách a v celej skupine 141 pacientov s ťažkým stupňom hemofílie a počet pacientov s inhibítormi 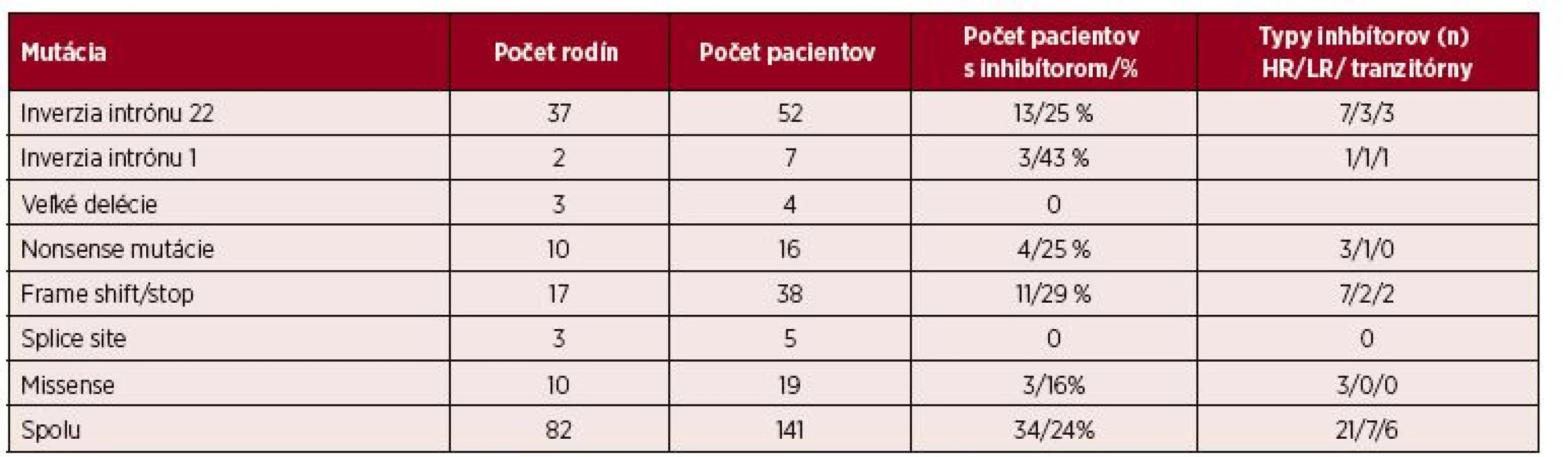
HR: High responder; LR: Low responder Lokalizácia mutácií génu F8 pri ťažkom stupni hemofílie
Lokalizáciu 39 jedinečných typov mutácií a počet pacientov s mutáciou v príslušnej lokalite génu F8 demonštruje graf 2. Na 5 intrónoch cDNA sa vyskytlo 5 rôznych mutácií, ktoré boli prítomné u 64 pacientov, z nich najväčší počet (52 pacientov) má inverziu intrónu 22. U 77 pacientov sme zistili 34 rôznych mutácií lokalizovaných na 15 exónoch v celom priebehu génu F8. Až 55/77 pa-cientov (59 %) má mutácie exónov determinujúcich ťažký reťazec molekuly FVIII (domény A1, A2 a B) a 22/77 (29 %) mutácie exónov ľahkého reťazca (domény A2, C1, C2), pri ktorých sa predpokladá spojenie s vyšším rizikom inhibítorov. Najvyšší počet, až 11 jedinečných typov mutácií je lokalizovaných na exóne 14. Mutácie tohto exónu sa vyskytli v 13 rodinách u 23 pacientov, z nich u 18 pacientov má mutácia charakter frame shift/stop, u 2 pacientov ide o nonsense a u 1 pacienta o missense mutáciu. Treťou lokalitou génu F8 s najpočetnejšou skupinou 12 pacientov je exón 9 s 2 jedinečnými mutáciami. Mutácia typu frame shift/stop (c.1311delG; p.Ile438Leufs*44) sa vyskytla až v 5 rodinách u celkom 11 pacientov, nonsense mutácia exónu 9 bola prítomná len u 1 pacienta.
Graf 2. Lokalizácia 39 unikátnych mutácií génu F8 na intrónoch a exónoch a počet pacientov s danou lokalizáciou mutácií v súbore 141 ťažkých hemofilikov
IVS: Inter Vening Sequence, intrón; Inv int 1: inverzia intrónu 1, Inv int 22: inverzia itrónu 22
Analýza nových mutácií génu F8
U pacientov s ťažkou hemofíliou sme zistili 18 doteraz nepublikovaných mutácií u 30 pacientov z 18 rodín. Medzi novými mutáciami je 6 mutácií charakteru frame shift/stop lokalizovaných na exónoch 7,10 a 14, 3, tri nonsense mutácie na exónoch 7, 18 a 20, jedna veľká delécia exónov 2–22, jedna splice site mutácia lokalizovaná na exóne 20 a 7 nových missense mutácií na exónoch 1, 7, 14, 18, 20 a 22. Z 18 nových mutácií desať postihlo exóny determinujúce ťažký a 8 ľahký reťazec molekuly FVIII, najviac nových mutácií (5) sa opäť vyskytlo na exóne 14.
Génové mutácie u pacientov s ťažkým stupňom hemofílie a inhibítormi
V celom súbore geneticky vyšetrených pacientov s ťažkým stupňom hemofílie A sme identifikovali 34 jedincov s inhibítorom z 30 rodín. Z nich malo 21 pacientov (62 %) vysoký titer s mediánom (M) 60 BU/ml, rozptyl 7–500 BU/ml), 7 (20 %) titer < 5 BU/ml (M:3,5 BU/ml; 1,9–4,6 BU /ml) a 6 pacientov (18 %) tranzitórny inhibítor s mediánom titra 1,3 BU/ml; 0,8–1,9 BU/ml.
Graf 3 demonštruje proporciu pacientov s inhibítormi pri jednotlivých typoch mutácií. 79 pacientov malo „vysoko rizikové mutácie“ z hľadiska vzniku inhibítorov. Inhibítor bol prítomný u 16/59 (27 %) pacientov s inverziami, u 4/16 (25 %) pacientov s nonsense mutáciami, ale u žiadneho zo štyroch pacientov s veľkými deléciami. Proporcia inhibítorov u pacientov s mutáciami frame shift/stop (11/38; 29 %) bola porovnateľná s výskytom pri „vysokorizikových“ mutáciách. Pri spoločnom hodnotení všetkých mutácií, ktoré môžu spôsobiť absenciu syntézy molekuly FVIII (veľké delécie, nonsense mutácie, inverzie, frame shift/stop) činí výskyt inhibítorov 31/117 (26,5 %) oproti skupine 24 pacientov s mutáciami s „nižším rizikom“ (missense a splice site mutácie) [18], kde sa inhibítor vyskytol len u 3 pacientov (12,5 %). Pomer šancí – OR (Odds Ratio) pre vznik inhibítora pri „vysokorizikových“ mutáciách oproti „mutáciám s nižším rizikom“ je v našom súbore pacientov 2,57 (95% KI 0,70–9,05; p = 0,15). Porovnanie zastúpenia mutácií u pacientov s inhibítormi a bez inhíbítrov ukázalo u 34 pacientov s inhibítormi vyšší podiel inverzií ako u 107 pacientov bez inhibítora [16/34 (47 %) verzus 40/107(40 %)] a vyšší podiel frame shift/stop mutácií [11/34 (32 %) verzus 27/107 (25 %)] a naopak nižší počet missense mutácií [3/34 (9 %) verzus 16/107(15 %)]. Uvedené rozdiely však nie sú štatisticky významné. Zastúpenie nonsense mutácií sa medzi obidvomi skupinami nelíšilo [4/34 (12 %) verzus 12/107 (11 %)].
Graf 3. Výskyt inhibítora pri rôznych mutáciách génu F8 v súbore 141 ťažkých hemofilikov A (n = počet pacientov s danou mutáciou)
Inverzie Int 22/1: inverzie intrónov 22 a 1.
Lokalizácia a charakteristika mutácií u pacientov s inhibítormi
Graf 4 prezentuje lokalizáciu mutácií na géne F8 a počet pacientov s inhibítorom pri konkrétnej lokalite mutácie. Inhibítory sa vyskytli u 8/22 (36 %) pacientov s mutáciami lokalizovanými na exónoch ľahkého reťazca molekuly FVIII a menej často, u 10/55 (18,1 %) pacientov s mutáciami exónov ťažkého reťazca; OR pre mutácie ľahkého reťazca je 2,57 (0,85–7,77; p = 0,09). Výraznejší rozdiel sme pozorovali pri nonsense mutáciách, pri ktorých vznikol inhibítor u 3/8 (38 %) pacientov s mutáciami na exónoch pre ľahký reťazec (exóny 18 a 20) a len u 1/8 (12,5 %) pacientov s mutáciami exónov pre ťažký reťazec (exóny 1, 9, 8, 12, 14), malá početnosť súboru však nedovolila štatistické hodnotenie. Ďalej sme hodnotili výskyt inhibítora vo vzťahu k doménam molekuly FVIII. Inhibítor sa vyskytol až u 7/14 pacientov (47 %) s mutáciami exónov domény A2, ale len u 1/8 pacientov (9 %) s mutáciami domény C1, mutácie domény C2 v našom súbore neboli prítomné. Inhibítor nevyvinul žiaden z 20 pacientov s mutáciami exónov na doméne A1, ale až 6/14 (38 %) pacientov s mutáciami domény A2 a 4/21 (19 %) pacientov s mutáciami B domény.
Graf 4. Výskyt inhibítora (n = 34) podľa lokalizácie mutácií génu F8
IVS: InterVening Sequence, intrón; Inv int 1: inverzia intrónu 1, Inv int 22: inverzia itrónu 22.
Vzťah mutácií génu F8 k typu inhibítora
Pri analýze mutácií u pacientov s inhibítormi sme nezistili jednoznačnú súvislosť medzi typom inhibítora (HR, LR, tranzitórny inhibítor) a typom mutácie (graf 4), a to ani v rámci jednej rodiny. Inverzie a frame shift/stop mutácie boli prítomné pri všetkých troch typoch inhibítora. V 3 rodinách sa vyskytli 2–3 pacienti s inhibítormi: z dvoch bratrancov s inverziou intrónu 1 bol jeden HR a jeden LR, z dvoch bratov s mutáciou c.5160delT;p.Ala1721Glnfs*10 boli obidvaja HR a z troch bratrancov s mutáciou c.1311delG; p.Ile438Leufs*44 boli 2 HR a 1 LR.
U pacientov s inhibítorom sme zistili celkom 14 rôznych mutácií génu F8, z nich 3 mutácie u 4 pacientov boli nové, zatiaľ neevidované v mutačnej databáze. Súvislosť so vznikom inhibítora už bola v mutačnej databáze referovaná pri 6 zo 14 mutácií zistených v našom súbore, ale pri 8 mutáciách (9 pacientov) inhibítor doteraz nebol pozorovaný (tab. 3), pri všetkých 8 mutáciách išlo o inhibítory vo vysokom titri. Zaujímavým nálezom je už spomenutá mutácia c.1311delG; p.Ile438Leufs*44 na exóne 9 (doména A2), ktorá sa vyskytla až v 5 nepríbuzných rodinách. Z celkového počtu 11 jedincov s touto mutáciou až 5 (45 %) vyvinulo inhibítor FVIII (3 HR, 1 LR a 1 tranzitórny inhibítor). V jednej rodine je 7 hemofilikov s touto mutáciou, inhibítor sa vyskytol u troch z nich (2 HR, 1 LR).
Tab. 3. Mutácie u pacientov s ťažkou hemofíliou a inhibítorom, pri ktorých doteraz nebol uvedený výskyt inhibítora v medzinárodnej mutačnej databáze 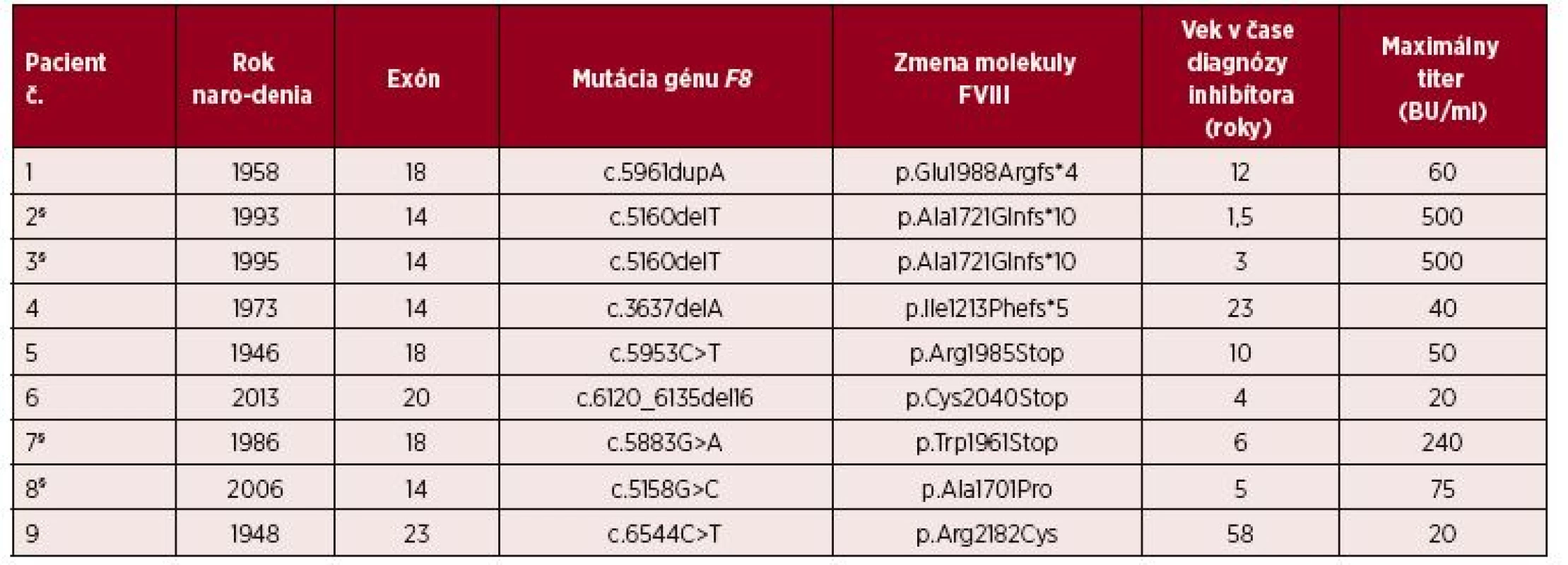
§ Nové mutácie, zatiaľ neevidovné v mutačnej database.
Pacienti č. 2 a č. 3 sú z jednej rodinyMutácie génu F8 a efekt imunotolerančnej indukcie
Imunotolerančnú indukciu absolvovalo 22 (15 HR a 7 LR) z celkového počtu 34 pacientov s inhibítorom. U 6 pacientov s tranzitórnym inhibítorom, ktorý spontánne vymizol pri pokračujúcej substitučnej liečbe koncentrátom FVIII nebola ITI potrebná, u 6 HR s dlhoročnou anamnézou inhibítora sa ITI neuskutočnila pre absenciu adherencie pacientov k ITI. U 22 pacientov sme vykonali 26 imunotolerančných kúr, z nich 16 podľa vysokodávkovaného protokolu a v 10 prípadoch sme použili modifikovaný intermediárny protokol. Dva pacienti absolvovali 1 a tri opakované ITI kúry pre relaps inhibítora. Výsledky ITI v rôznych skupinách pacientov podľa typu mutácie prezentuje tabuľka 4. Jediný pacient s inverziou intrónu 1 bol liečený vysoko dávkovanou ITI, liečba však nebola dokončená pre úmrtie pacienta po operácii vrodenej srdcovej chyby. Pri inverzii intrónu 22 sme dosiahli KR u 5/8 pacientov (63 %) a PR umožňujúcu profylaktickú liečbu faktorom VIII u jedného pacienta (12,5 %). U dvoch pacientov z tejto skupiny ITI pokračuje 6 a 12 mesiacov s postupnou redukciou titra inhibítora, zatiaľ bez dosiahnutia kritérií PR. Úspech ITI sme do-siahli u 2/2 pacientov s nonsense mutáciou a u 3/3 pacientov s missense mutáciami. Jeden pacient s missense mutáciou c.6544C>T; p.Arg2182Cys, ktorý vyvinul nízky titer inhibítora až vo veku 57 rokov, po prvej úspešnej ITI však mal 3 relapsy inhibítora so stúpajúcim titrom až do 22 BU/ml. Všetky relapsy sme úspešne zvládli opakovanými kúrami ITI v kombinácii s anti-CD 20 protilátkami. ITI bola úspešná vo vysokom percente aj u 8 pacientov s frame shift/stop mutáciami. V tejto skupine má 5/8 jedincov rovnakú mutáciu c.1311delG; p.Ile438Leufs*44, štyria z nich s historickým titrom inhibítora v rozpätí 4,6–17 BU/ml dosiahli KR, ale s rôznym trvaním do jej dosiahnutia (6–24 mesiacov). U posledného pacien-ta s rovnakou mutáciou a s najvyšším historickým titrom inhibítora až 500 BU/ml a titrom počas ITI až 2800 BU/ml, sa po 24 mesiacoch Bonnského protokolu inhibítor javí ako rezistentný na ITI. U tohto pacienta je protilátka namierená proti dvom epitopom, proti epitopu na A2 doméne ťažkého reťazca a na C2 doméne ľahkého reťazca FVIII. Jeden pacient s frame shift/stop mutáciou (c.5160delT; p.Ala1721Glnfs*10) mal 1 relaps inhibítora, ktorý bol úspešne zvládnutý opakovanou ITI. Z 22 pacientov podrobujúcich sa ITI dokončilo liečbu 18 pacientov, u 1 pacienta sa ITI nedokončila pre úmrtie z príčiny nesúvisiacej s inhibítorom, a u 3 pacientov ITI pokračuje. Z 18 pacientov s ukončenou ITI dosiahlo KR 16 pacientov (89 %) a parciálnu remisiu umožňujúcu profylaxiu 2 pacienti (11 %). Úspešnosť liečby vyjadrená celkovým počtom KR a PR na počet aplikovaných ITI kúr predstavuje 22/25 (88 %), 3 ITI kúry (12 %) ešte pokračujú. Pri ukončených kúrach bol medián času do dosiahnutia negativity inhibítora 5 mesiacov, IQR (interkvartilový rozptyl) je 2,3–12 mesiacov; rozptyl 1–24 mesiacov. Medián času do dosiahnutia výsledného efektu ITI (KR a KR).
Tab. 4. Imunotolerančná indukcia (ITI) u 22 pacientov s inhibítormi a úspešnosť liečby (kompletná a parciálna remisia) pri jednotlivých typoch mutácií génu F8 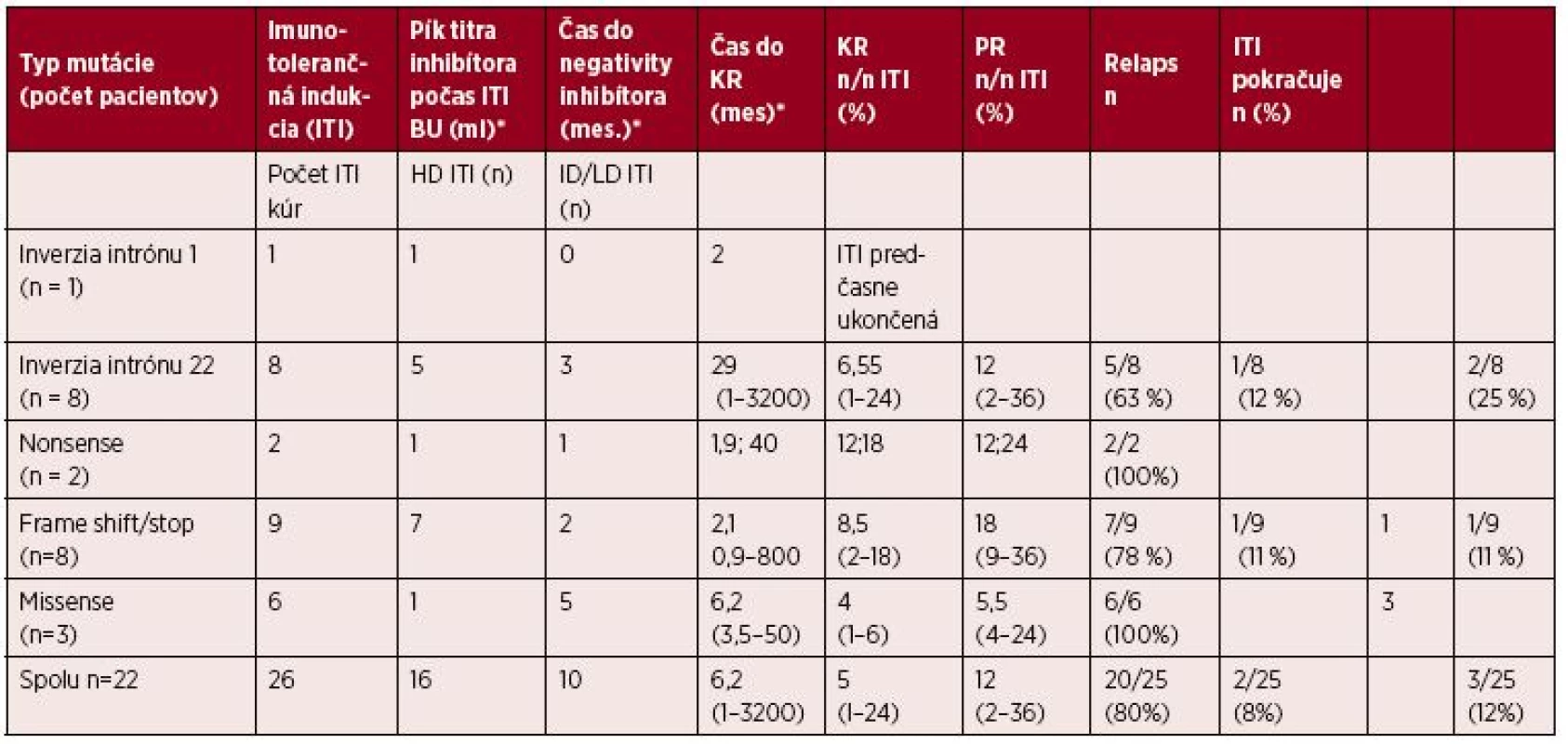
HD ITI - vysoko dávkovaný protokol (Bonnský); ID/LD ITI – ITI s intermediárnymi alebo nízkymi dávkami
KR: kompletná remisia, PR: parciálna remisia
*údaje vyjadrené mediánom a rozptylomDISKUSIA
Pokroky molekulovej analýzy a zlepšenie možností a spoľahlivosti genetického vyšetrenia hemofílie viedli k založeniu projektu Národného genetického programu na Slovensku. Cieľom tejto iniciatívy je zmapovať génové mutácie v celej hemofilickej populácii, zlepšiť možnosti genetického poradenstva a umožniť štúdium genotypových a fenotypových súvislostí pri tejto vrodenej krvácavej chorobe i vzťahu genotypu k niektorým komplikáciám choroby. V prvej časti projektu sme sa zamerali predovšetkým na pacientov s ťažkým stupňom hemofílie A a pacientov s inhibítormi FVIII, ktoré v súčasnosti predstavujú najzávažnejšiu komplikáciu liečby hemofílie. V práci prezentujeme prvé výsledky Národného genetického programu. Súbor doteraz vyšetrených 173 pacientov (141 s ťažkým stupňom, 25 so stredne ťažkým a 7 pacientov s ľahkým stupňom hemofílie A) zatiaľ nereprezentuje kompletnú populačnú štúdiu, ale skupina 141 pacientov predstavuje už 60 % populácie jedincov s ťažkým stupňom hemofílie na Slovensku. Detekčný mutačný pomer genetického laboratória pri hemofílii A je 100 %. Veľkú heterogenitu mutácií spôsobujúcich hemofíliu A potvrdzuje nález celkom 49 rôznych mutácií, z nich 21 nových mutácií, nereferovaných v medzinárodnej mutačnej databáze http://www.factorviii–db.org. V súlade s literatúrou sme pri strednom stupni hemofílie potvrdili len prítomnosť missense a splice site mutácií a pri ľahkom stupni len missense mutácie [31–33].
V skupine 141 ťažkých hemofilikov z 82 rodín sme zistili 39 mutácií s ich difúznym rozložením v celom rozsahu génu F8, nález 18 nových mutácií v tejto skupine pacientov potvrdzuje, že génová analýza hemofílie vedie neustále k objavovaniu nových mutácií [31].
V celom súbore ťažkých hemofilikov sme zistili podobné zastúpenie jednotlivých typov mutácií ako v iných referovaných databázach [5, 8, 32, 33]. Celková proporcia inverzií v našom súbore (42 %) bola o niečo nižšia ako 47,5 % v súbore 753 ťažkých hemofilikov prezentovanom Oldenburgom a Pavlovou (2006) [18] a 56 % v súbore 318 hemofilikov referovanom autormi Gouw et al. (2011) [17], čo možno vysvetliť menšou početnosťou nášho súboru. Zastúpenie inverzie intrónu 22 (37 %) a inverzie intrónu 1 (5 %) v našom súbore bolo pritom porovnateľné s pozorovaním Greena et al. (2008), ktorí uvedené inverzie zistili v 38 % a 3,2 % ťažkých hemofilikov [32]. Všeobecne sa akceptuje, že mutácie veľkého rozsahu, ako sú veľké delécie/duplikácie, nonsense mutácie a inverzie intrónov 1 a 22 spôsobujú úplné chýbanie tvorby cirkulujúcich polypeptidov FVIII, sú všeobecne označované ako nulové mutácie a sú spojené s ťažkým stupňom hemofílie [16, 19]. Ale aj malé delécie a duplikácie, ktoré po navodení posunu čítacieho rámca so vznikom predčasného stop kodónu môžu odstrániť veľkú časť proteínu, sú extrémne závažné a vždy spojené s ťažkým stupňom choroby [1, 19]. V našom súbore ťažkých hemofilikov bol podiel malých delécií/duplikácií 27 % oproti 16 % v štúdii Oldenburga a Pavlovej (2006) [18] a 17 % v súbore Gouw et al. (2012) [19], všetky mali charakter frame shift/stop mutácií a boli spojené s ťažkým stupňom hemofílie. Green et al. (2008) zistili frame shift mutácie u 65 zo 778 vyšetrených hemofilikov, z nich 61 pacientov malo ťažký stupeň, 3 pacienti stredný a 1 pacient ľahký stupeň hemofílie [32]. Splice site mutácie môžu byť spojené so všetkými stupňami hemofílie. My sme splice site mutácie zistili len u 8 pacientov, v 5 prípadoch viedli k ťažkému stupňu hemofílie a v 3 prípadoch k stredne ťažkej hemofílii.
V tejto súvislosti vzniká aj otázka, aký je vzťah medzi typom génových mutácií a vznikom inhibítorov FVIII. Súvislosť medzi mutáciami veľkého rozsahu a výskytom inhibítorov už dávnejšie referovali Schwab et al. (1995) [34] a potvrdili ho aj ďalšie práce [35, 36], ktoré demonštrovali výskyt inhibítora až u 88 % pacientov s multidoménovými mutáciami génu F8, v 41 % pri veľkých deléciách, v 31 % pri nonsense mutáciách (z nich 40 % pri mutáciách ľahkého a 17 % pri mutáciách ťažkého reťazca) a v 21 % pri inverzii intrónu 22 [18]. Plauzibilným vysvetlením pre vyššie riziko inhibítora pri týchto nulových mutáciách je absencia proteínu FVIII v cirkulácii a zlyhanie navodenia imunologickej tolerancie voči časti FVIII. Missense a splice site mutácie, prípadne aj niektoré malé delécie môžu viesť k prítomnosti minimálneho, i keď nefunkčného množstva časti proteínu FVIII, čo teoreticky môže stačiť na navodenie tolerancie [37].
V rámci nášho projektu sme vyšetrili 34 pacientov s anamnézou alebo súčasne prítomným inhibítorom FVIII. Proporcia pacientov s inhibítormi v súbore 141 geneticky vyšetrených pacientov s ťažkou hemofíliou však nepredstavuje kumulatívnu incidenciu inhibítorov na Slovensku, nakoľko sme prednostne vyšetrili všetkých jedincov s inhibítormi. Aj hodnotenie rizika inhibítora preto v našom – zatiaľ nekompletnom – súbore ťažkých hemofilikov má značné limitácie. Proporcia pacientov s inhibítormi bola porovnateľná u pacientov s inverziami, nonsense mutáciami aj s mutáciami frame shift/stop, ale nepozorovali sme inhibítor u žiadeneho zo 4 pacientov s veľkými deléciami a žiadneho z 5 pacientov so splice site mutáciami. Pri splice site mutáciách udáva väčšina investigátorov nízke riziko inhibítorov [18, 19], len v jednej štúdii bol pozorovaný inhibítor až v 44 % [36]. Gouw et al. (2012) prezentovali doteraz najrozsiahlejšiu metaanalýzu publikovaných prác o vzťahu génových mutácií ku vzniku inhibítorov, v ktorej uvádzajú oveľa širšie rozptyly výskytu inhibítorov pri jednotlivých typoch mutácií [19] ako pozorovali Oldenburg a Pavlova (2006) [18]. Je to dané rozmanitou početnosťou súborov a publikovaných pozorovaní. Ukazuje sa, že frame shift/stop mutácie majú pravdepodobne vyšší výskyt inhibítorov, ako sa uvádzalo donedávna. To je v zhode aj s naším pozorovaním porovnateľného výskytu inhibítorov pri tomto type mutácií (29 %) ako pri inverziách (27 %) a nonsense mutáciách (25 %). S ohľadom na lokalizáciu mutácií sme najvyšší počet inhibítorov pozorovali pri inverziách (16/59; 27 %), pri mutáciách na 14 exóne bol výskyt 6/23; 26 %, ale pri frame shift/stop mutácii c.1311delG; p.Ile438Leufs*44 na 9 exóne až u 5/11 pacientov (45 %) pacientov. Je známe, že riziko inhibítorov je vyššie pri mutáciách postihujúcich domény ľahkého reťazca (A3, C1 a C2) [19]. V našom súbore sme pozorovali najvyšší výskyt inhibítorov u pacientov s mutáciami na exónoch determinujúcich doménu A3 (47 %), ale pri mutáciách domény C1 bol výskyt nízky (9 %), mutácie domény C2 neboli prítomné. Vyšší výskyt inhibítorov sme zistili aj pri mutáciách domény A2 (38 %), pri mutáciách domény B bl výskyt 19 %. V súlade s literatúrou sme ani my nepotvrdili jednoznačný vzťah medzi titrom inhibítora a typom mutácie (viď graf 5) [19, 33].
Graf 5. Zastúpenie mutácií pri rôznych titroch inhibítorov u 34 pacientov s ťažkou hemofíliou A podľa typu inhibítora
Inverzie Int 22/1 = inverzie intrónov 22 a 1
Inhibítory znamenajú veľmi závažnú komplikáciu hemofílie s limitovanými možnosťami prevencie a liečby krvácaní, významne zhoršenou kvalitou života a zvýšenou morbiditou i mortalitou. Je preto prvoradou snahou pokus o eradikáciu inhibítora pomocou imunotolerančnej indukcie [9, 21, 22]. V literatúre sa objavili správy o možnom vplyve génovej mutácie na výsledok ITI [22, 38]. V našom súbore 22 pacientov s inhibítormi absolvovalo celkom 26 ITI kúr (u 2 pacientov sa uskutočnili 4 ďalšie kúry pre relapsy inhibítora). Vyhodnotili sme efekt 25 ITI kúr, keďže 1 kúra bola predčasne ukončená pre úmrtie 8 mesačného pa-cienta po operácii Fallotovej teratrógie. Dosiahli sme vysokú úspešnosť ITI, KR a PR umožňujúcu profylaktickú liečbu sme dosiahli po 22/25 (88 %) kúrach, u 3 pacientov ITI zatiaľ pokračuje. Coppola et al. (2009) [22] referovali najvyššiu úspešnosť ITI pri malých deléciách (71 %), malých inzerciách (87 %) a missense mutáciách až 100 %, ale pri nonsense mutáciách len 64 %, inverziách 48 % a pri veľkých deléciách len 17 %. V našom súbore sme pri inverzii intrónu 22 dosiahli KR v 63 % a PR v 12 %, ale pri ostatných mutáciách, vrátane 2 nonsense mutácií bol úspech ITI až 89–100 %. Najrýchlejší efekt ITI sme dosiahli pri missense mutácii, a to aj pri 3 opakovaných ITI kúrach pre relaps inhibítora. Pri inverzii intrónu 22, nonsense mutá-ciách a frame shift/stop mutáciách pozorujeme pomerne dlhý čas do dosiahnutia negativity inhibítora i do KR (viď tab. 3) s hornou hranicou až do 36 mesiacov. Podobne Oldenburg et al. (1999) [39] pozorovali dlhšie trvanie liečby u pacientov s inverziami oproti iným mutáciám. Aj ďalší autori uvádzajú, že pri mutáciách veľkého rozsahu je úspešnosť ITI menej ako 40 % [40] alebo je vysoké riziko zlyhania ITI [41]. Naopak Rocino et al. (2006) dosiahli rovnaký úspech i trvanie ITI pri inverziách a iných nulových mutáciách [42]. Vzťahom genetických predispozícií k výsledku ITI sa zaoberá aj súčasne prebiehajúca štúdia OBSITI (Observation ITI), na ktorej participuje aj naše centrum. Táto štúdia potvrdila vysoké percento úspešnosti ITI aj u pacientov s nepriaznivými prognostickými ukazovateľmi [43]. Vzhľadom na malé národné súbory pacientov s inhibítormi sú dôležité medzinárodné projekty s účasťou všetkých pacientov, ktorí sa podrobujú ITI, aby bolo možné vyvodiť relevantné závery.
ZÁVER
V práci prezentujeme prvé výstupy z Národného hemofilického genetického registra. Národná databáza spektra mutácií v slovenskej hemofilickej populácii položila základ pre výskum vzťahu medzi genotypom a fenotypom hemofílie A. V súbore vyšetrených pacientov sme potvrdili veľkú heterogenitu mutácií génu F8 a odhalili sme veľký počet nových mutácií, zatiaľ neuvedených v medzinárodnej mutačnej databáze. Vykonali sme prvú analýzu súvislostí medzi génovými mutáciami a vznikom inhibítorov v slovenskej hemofilickej populácii i vzťahu génových mutácií k úspešnosti imunotolerančnej indukcie. Limitáciou našej štúdie je zatiaľ malá početnosť súborov, v genetickom programe aktívne pokračujeme s cieľom vytvoriť kompletnú mutačnú databázu pacientov s hemofíliou. To umožní ďalšie systematické štúdium tejto problematiky.
Podiel autorov na príprave rukopisu
TP, AB – návrh štúdie
TP – revidovanie Národného registra hemofílie, predvolávanie pacientov, vypracovanie rodokmeňa, revidovanie dokumentácie pacientov, zabezpečenie odberov vzoriek na genetické vyšetrenie
DJ, AB, AK, MM – participácia na vyšetrení pacientov
JCH, RP, PJ, MJ., MF – vykonávanie molekulovej analýzy génu F8
TP – zber a hodnotenie výsledkov, spísanie rukopisu
AB – hodnotenie výsledkou, revidovanie a korigovanie rukopisu
Všetci spoluautori potvrdili finálnu verziu rukopisu.
Prehlásenie autorov
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou spoločnosťou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Doručeno do redakce dne 19. 3. 2018.
Přijato po recenzi dne 4. 5. 2018.
MUDr. Tatiana Prigancová
Klinika hematológie a transfuziológie LF UK, SZU, UNB
Antolská 11
85107 Bratislava
Slovenská republika
e–mail: tatiana.prigancova@gmail.com
Zdroje
1. Bowen DJ. Hemophilia A and hemophilia B: molecular insights. Mol Pathol 2002;55(2):127–144.
2. Swystun LL, James PD. Genetic diagnosis in hemophilia and von Willebrand disease. Blood Rev 2017;31(1):47–56.
3. http://www.factorviii-db.org
4. Goodeve AC, Williams I, Bray GL, Peake IR. Relationship between factor VIII mutation type and inhibitor development in a cohort of previously untreated patients treated with recombinant factor VIII (Recombinate) Recombinate PUP Study Group. Thromb Haemost 2000;83 : 844–848.
5. Rydz N, Leggo J,Tinlin S, et al. The Canadian “National Program for Hemophilia Mutation Testing” database: A ten–year review. Am J Hematol 2013;88 : 1030–1034.
6. Carcao MD, van den Berg HM, Ljung R, Mancuso ME. Correlation between phenotype and genotype in a large unselected cohort of children with severe hemophilia A. Blood 2013;121(19):3946–3952.
7. Nair PS, Shetty S, Ghosh K. Factor VIII antigen, activity, and mutations in hemophilia A. Clin Appl Thromb Hemost 2016;22(4):381–385.
8. Johnsen JM, Fletcher SN, Huston H, et al. Novel approach to genetic analysis and results in 3000 hemophilia patients enrolled in the My Life, Our Future initiative. Blood Advances 2017;13(1):824–834.
9. Collins PW, Chalmers E, Hart DP, et al. Diagnosis and treatment of factor VIII and IX inhibitors in congenital haemophilia: (4th edition). Br J Haematol 2013;160 : 153–170.
10. Astermark J, Altisent C, Batorova A, et al. Non-genetic risk factors and the development of inhibitors in haemophila: a comprehensive review and consensus report. Haemophila 2010;16 : 747–766.
11. Batorova A, Jankovicova D, Morongova A, et al. Inhibitors in severe hemophilia A: 25-year experience in Slovakia. Semin Thromb Hemost 2016;42(5):550–562.
12. Oldenburg J, Brackmann HH, Schwaab R. Risk factors for inhibitor development in hemophilia A. Haematologica 2000;85 : 7–13.
13. Astermark J, Oldenburg J, Escobar M, et al. The Malmo International Brother Study (MIBS). Genetic defects and inhibitor development in siblings with severe hemophilia A. Haematologica 2005;90 : 924–931.
14. Gouw SC, van der Bom JG, van den Berg HM. Treatment–related risk factors of inhibitor development in previously untreatedpatients with hemophilia A: the CANAL cohort study. Blood 2007;109 : 4648–4654.
15. Eckhardt CL, Menke LA, van Ommen CH, et al. Intensive peri–operative use of factor VIII and the Arg593 fi Cys mutation arerisk factors for inhibitor development in mild/moderate hemophilia A. J Thromb Haemost 2009;7 : 930–937.
16. Bardi E, Astermark J. Genetic risk factors for inhibitors in hemophilia. Eur J Haematol 2015;94(S77):7–10.
17. Gouw SC, van der Bom JG, van den Berg HM, et al. Influence of the type of F8 gene mutation on inhibitor development in a single centre cohort of severe haemophilia A patients. Haemophilia 2011;17 : 275–281.
18. Oldenburg J, Pavlova A. Genetic risk factors for inhibitors to factor VIII and IX. Haemophilia 2006;12(Suppl 6):15–22.
19. Gouw SC, van den Berg M, Oldenburg J, et al. F8 gene mutation type and inhibitor development in patients with severe hemophilia A: systematic review and meta-analysis. Blood 2012;119(12):2922–2934.
20. Hay CR, DiMichele DM; International Immune Tolerance Study. The principal results of the International Immune Tolerance Study: a randomized dose comparison. Blood 2012;119(6):1335–1344.
21. Valentino LA, Kempton CL, Kruse–Jares R, et al. US Guidelines for immune tolerance induction in patients with haemophilia a and inhibitors. Haemophilia 2015;21 : 559–567.
22. Coppola A, Margaglione M, Santagostino E, et al. for the AICE PROFIT Study Group. Factor VIII gene (F8) mutations as predictors of outcome in immune tolerance induction of hemophilia A patients with high–responding inhibitors. J Thromb Haemost 2009;7 : 1809–1815.
23. Prigancová T, Bátorová A, Jankovičová D, et al. Aktualizácia Národného hemofilického genetického programu. Vask Med 2016;S1 : 49.
24. Kasper CK, Aledort L, Aronson D, et al. Proceedings: a more uniform measurement of factor VIII inhibitors. Thromb Diath Haemorrh 1975;34 : 612–614.
25. Verbruggen B, Novakova I, Wessels H, et al. The Nijmegen modification of the Bethesda assay for factor VIII:C inhibitors: improved specificity and reliability. Thromb Haemost 1995;73 : 247–251.
26. Bátorová A, Jankovičová D, Žarnovičanová M, et al. za Slovenskú hemofilickú pracovnú skupinu SHaTS SLS. Národné štandardné postupy pre liečbu hemofílie a iných vrodených koagulopatií v Slovenskej republike. Lek Obz 2008;56(7–8):330–340.
27. Poláková H, Zmetáková I, Kádasi Ľ. Long distance PCR in detection of inversion mutations of F8C ggene in hemophilia A patients. Gen Physiol Biophys 2003;22 : 243–253.
28. Bagnall RD, Waseem N, Green PM, Giannelli F. Recurrent inversion breaking intron 1 of the factor VIII gene is a frequent cause of severe hemophilia A. Blood 2002;99 : 168–174.
29. Sirocova N, Tsourea V, Vicol M, et al. Factor VIII mutations in 42 Moldovan haemophilia A families, including 12 that are novel. Haemophilia 2009;15 : 942–951.
30. Dunnen JT, Dalgleish R, Maglott DR, et al. HGVS recommendations for the description of sequence variants: 2016 update. Human Mutation 2016;37(6):564–569.
31. Al–Allaf FA, Taher MM, Abduljaleel Z, et al. Molecular analysis of factor VIII and factor IX genes in hemophilia patients: identification of novel mutations and molecular dynamics studies. J Clin Med Res 2017;9(4):317–331.
32. Green PM, Bagnall RD, Waseem NH, Giannelli F. Haemophilia A mutations in the UK: results of screening one–third of the population. Br J Haematol 2008;143 : 115–128.
33. Miller CH, Benson J, Ellingsen D, et al. and The Hemophilia Inhibitor Research Study Investigators. F8 and F9 mutations in US haemophilia patients: correlation with history of inhibitor and race/ethnicity. Haemophilia 2012;18 : 375–382.
34. Schwaab R, Brackmann HH, Meyer C, et al. Haemophilia A: mutation type determines a risk of inhibitor formation. Thromb Haemost 1995;74 : 1402–1406.
35. Goodeve AC, Peake IR. The molecular basis of hemophilia A: genotype-phenotype relationships and inhibitor development. Semin Thromb Hemost 2003;29 : 23–30.
36. Boekhorst J, Lari GR, D’Oiron R, et al. Factor VIII genotype and inhibitor development in patients with haemophilia A: highest risk in patients with splice site mutations. Haemophilia 2008;14 : 729–735.
37. Reipert BM, van Helden PM, Schwarz HP, Hausl C. Mechanisms of action of immune patients with congenital haemophilia A and factor VIII inhibitors. Br J Haematol 2007;136 : 12–25.
38. Di Minno G and Coppola A. Management of patients with long–term inhibitors: is immune tolerance an underestimated life–long solution? Haemophilia 2013;19(Suppl. 1):18–23.
39. Oldenburg J, Schwaab R, Brackmann HH. Induction of immune tolerance in haemophilia A inhibitor patients by the Bonn Protocol: predictive parameter for therapy duration and outcome. Vox Sang 1999;77(Suppl. 1):49–54.
40. Salviato R, Bellini D, Radossi P, et al. F8 gene mutation profile and ITT response in a cohort of Italian haemophilia A patients with inhibitors. Haemophilia 2007;13 : 361–372.
41. Rocino A, Santagostino E, Mancuso ME, Mannucci PM. Immune tolerance induction with recombinant factor VIII in haemophilia A patients with high responding inhibitors. Haematologica 2006;91 : 558–561.
42. Grenninger DA, Saint–Remy JM, Jacquemin M, et al. The use of factor VIII/von Willebrand factor concentrate for immune tolerance induction in haemophilia A patients with high–titre inhibitors: association of clinical outcome with inhibitor epitope profile. Haemophilia 2008;14 : 295–302.
43. Kreuz W, Escuriola Ettingshausen C, Vdovin V, et al. First prospective report on immune tolerance in poor risk haemophilia A inhibitor patients with a single factor VIII/von Willebrand factor concentrate in an observational immune tolerance induction study. Haemophilia 2016;22(1):87–95.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Nejistoty výsledků měřeníČlánek Základní bioinformatické pojmy a postupy využívané pro analýzu DNA pomocí sekvenování nové generaceČlánek Význam fyzické aktivity pro přežití a kvalitu života u pacientů s lymfoproliferativním onemocněním
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2018 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Nejistoty výsledků měření
- Neinfekční a nemaligní lymfadenopatie – idiopatická (HHV-8 negativní) multicentrická forma Castlemanovy nemoci
- Neinfekční nemaligní lymfadenopatie – sinusová histiocytóza s masivní lymfadenopatií, nemoc Rosaiova-Dorfmanova
- Základní bioinformatické pojmy a postupy využívané pro analýzu DNA pomocí sekvenování nové generace
- Význam fyzické aktivity pro přežití a kvalitu života u pacientů s lymfoproliferativním onemocněním
- Mutácie génu F8 u pacientov s ťažkým stupňom hemofílie A a výskyt inhibítorov FVIII
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) – 2018
- G3 Sympozium 2018 – Remise bez nutnosti terapie (TFR) u chronické myeloidní leukemie
- Klonální kretvorba může stratifikovat riziko nemocných s cytopeniemi a kardiovaskulárním onemocněním
- K 75. jubileu prof. MUDr. Jana Kvasničky, DrSc.
- Prof. MUDr. Emanuel Nečas, DrSc., a jeho okénko do atomového věku
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neinfekční nemaligní lymfadenopatie – sinusová histiocytóza s masivní lymfadenopatií, nemoc Rosaiova-Dorfmanova
- Základní bioinformatické pojmy a postupy využívané pro analýzu DNA pomocí sekvenování nové generace
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) – 2018
- Neinfekční a nemaligní lymfadenopatie – idiopatická (HHV-8 negativní) multicentrická forma Castlemanovy nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



