-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dysfibrinogenemie a afibrinogenemie v České republice
Dysfibrinogenaemia and afibrinogenaemia in the Czech Republic
Fibrinogen is a key glycoprotein of blood coagulation. During haemocoagulation fibrinogen is converted to fibrin. Congenital dysfibrinogenemia is a disease wherein an inherited abnormality in the fibrinogen molecule results in defective fibrin clot formation. Hereditary hypofibrinogenemia is a disease wherein an inherited abnormality in the fibrinogen molecule results in low fibrinogen level in plasma.
36 unrelated families in the Czech Republic suspected with either dysfibrinogenemia or afibrinogenemia were examined. Four patients presented with thrombosis, eight patients presented with bleeding tendencies and others were asymptomatic. Heterozygous point mutations Aα Arg16Cys (Fibrinogen Nový Jičín, Ostrava I), Aα Arg16His (Fibrinogen Praha II, Ostrava II), Aα Asn106Asp (Fibrinogen Plzeň), γ Tyr363Asn (Fibrinogen Praha III), γ Tyr262Cys (Fibrinogen Liberec) and γ Arg275His (Fibrinogen Brno) were found to be the direct causes of dysfibrinogenemias in the carriers.
Molecular genetics experiments revealed inherited mutations in 13 unrelated families causing hereditary dysfibrinogenemia. In one case acquired dysfibrinogenemia secondary to multiple myeloma was found.Key words:
fibrinogen – dysfibrinogenaemia – afibrinogenaemia – coagulation
Autoři: R. Kotlín; E. Ceznerová; J. Loužil; J. Štikarová; O. Pastva; J. Suttnar; P. Salaj; J. E. Dyr
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 8-19.
Kategorie: ZVLÁŠTNÍ VYDÁNÍ SUPLEMENTU K 65. VÝROČÍ ÚHKT
Souhrn
Fibrinogen je klíčový glykoprotein krevní koagulace, během níž je přeměňován na fibrin. Vrozená dysfibrinogenemie je choroba charakterizovaná funkční poruchou molekuly vedoucí k abnormální tvorbě fibrinu. Vrozená hypofibrinogenemie je vzácné onemocnění charakterizované sníženou hladinou funkčního i celkového fibrinogenu v plazmě.
Vyšetřili jsme 36 nepříbuzných rodin z celé České republiky s diagnózou suspektní dysfibrinogenemie či afibrinogenemie. Čtyři pacienti měli trombotické komplikace, osm pacientů se manifestovalo krvácivě a ostatní byli asymptomatičtí.
Genetické vyšetření odhalilo vrozenou mutaci u třinácti nepříbuzných rodin, u nichž způsobuje vrozenou dysfibrinogenemii. Pomocí genetických, proteomických a funkčních vyšetření bylo odhaleno osm případů dysfibrinogenemie v Aα řetězci, konkrétně se jedná o mutace Aα Arg16Cys; Aα Arg16His; Aα Gly13Glu; Aα Phe98Ile; Aα Asn106Asp; a kombinovanou mutaci Aα Gly13Glu a Aα Ser314Cys. Jeden případ byl nalezen v Bβ řetězci – Bβ Arg237Ser a čtyři případy byly odhaleny v γ řetězci – γ Ser313Gly, γ Tyr262Cys, γ Tyr363Asn a γ Arg275His.
V jednom případě byla identifikována molekulární příčina vrozené afibrinogenemie. V jednom případě byla zjištěna příčina získané dysfibrinogenemie v souvislosti s produkcí autoprotilátek proti fibrinogenu u pacienta s mnohočetným myelomem.KLÍČOVÁ SLOVA:
fibrinogen – dysfibrinogenemie – afibrinogenemie – koagulaceÚVOD
Hemokoagulace je součástí hemostázy, komplexního procesu, jehož fyziologickou úlohou je zabránit ztrátě krve při poškození krevních cév. Klíčovým dějem hemokoagulace je přeměna plazmatického glykoproteinu fibrinogenu na fibrin. Tento děj je výsledkem kaskádovité aktivace koagulačních faktorů, z nichž klíčové místo zaujímá trombin katalyzující hydrolytické štěpení fibrinogenu na fibrinový monomer. Vznikající fibrinové monomery spontánně polymerují a vytvářejí fibrinový klot (z anglického clot – výraz nejlépe vystihující strukturu fibrinu jako polymerního gelu tvořeného fibrinovými vlákny, vodou a dalšími složkami), který je součástí hemostatické zátky.
Vrozená dysfibrinogenemie je vzácná choroba koagulace, u níž mutace v některém z genů FGA, FGB či FGG způsobuje funkční poškození molekuly fibrinogenu. V závislosti na umístění mutace a funkčnímu poškození se může vrozená dysfibrinogenemie klinicky manifestovat rozdílně – protromboticky, hemoragicky, či asymptomaticky. Vrozená afibrinogenemie je vzácná choroba koagulace charakterizovaná sníženou koncentrací fibrinogenu v cirkulaci pod 0,5 g/l. Mírnější podobou této choroby je vrozený nedostatek fibrinogenu – hypofibrinogenemie, charakterizovaná hladinou fibrinogenu v rozpětí 0,5–2 g/l.
U získaných forem dysfibrinogenemie je typické, že se vyskytují nejčastěji v souvislosti jaterními chorobami, mnohočetným myelomem, či užíváním některých léků.
Prevalence vrozených forem dysfibrinogenemie se udává 1 : 1 000 000 a jsou řazeny jako vzácné choroby. Klinická závažnost některých mutací může být až život ohrožující (trombózy, závažné krvácivé projevy).
Celosvětově bylo popsáno více než 600 vrozených afibrinogenemií, dysfibrinogenemií nebo hypofibrinogenemií. Z tohoto počtu bylo více než 350 případů zjištěno v genu FGA, 82 případů v genu FGB a více než 170 případů v genu FGG. V České republice se nám podařilo zjistit příčinu poruchy fibrinogenu u 35 pacientů a jejich rodinných příslušníků. Z tohoto počtu bylo diagnostikováno 23 pacientů s vrozenou dysfibrinogenemií, jeden pacient s vrozenou afibrinogenemií, 9 pacientů s vrozenou hypofibrinogenemií a dva pacienti se získanou dysfibrinogenemií.
MATERIÁL A METODIKA
Odběr vzorků krve
Vzorky krve byly získány od informovaných zdravých dárců nebo od vybraných pacientů s jejich souhlasem. Krev byla odebírána do 3,8% roztoku citrátu sodného v objemovém poměru 1 : 9.
Koagulační vyšetření plazmy
Základní koagulační vyšetření bylo prováděno na automatickém koagulometru STA-R v Laboratoři pro poruchy hemostázy Ústavu hematologie a krevní transfuze (ÚHKT).
Imunoturbidimetrické stanovení hladiny fibrinogenu
K imunoturbidimetrickému stanovení koncentrace fibrinogenu v plazmě byl použit komerční kit Fibrinogen K-Assay obsahující kozí polyklonální protilátku proti lidskému fibrinogenu.
Měření fibrinových polymeračních křivek
Pro získání informací o rychlosti a průběhu polymerace fibrinu byla měřena optická hustota (OD) vzorků při vlnové délce 350 nm. Polymerace fibrinogenu v chudé plazmě pacientů a zdravých dárců byla iniciována trombinem nebo reptilázou. Pro měření byly použity roztoky trombinu se dvěma různými aktivitami. Při výsledné aktivitě trombinu 0,1 U/ml lze z průběhu polymerizačních křivek posuzovat funkční vlastnosti fibrinogenu. Toto stanovení však může být ovlivněno vysokou koncentrací nízkomolekulárních inhibitorů trombinu přítomných v plazmě. Abychom vyloučili vliv inhibitorů, použili jsme trombin s výslednou aktivitou 0,9 U/ml. Turbidimetrické křivky fibrinogenu byly měřeny při 37 °C, po každých 20 s byla odečítána a zapisována optická hustota. Reakce byla sledována 40 minut. Jednotlivá měření každého vzorku byla vždy provedena v dubletu. Výsledek byl vyjádřen jako průměr.
Měření kinetiky odštěpování fibrinopeptidů
Reakční směs obsahující plazmu, TRIS pufr a o-fenan-trolin hydrát byla promíchána a vzorky byly inkubovány s trombinem s aktivitou 10 U/ml (výsledná aktivita ve vzorku byla 0,9 U/ml) při 25 °C. Jednotlivé reakce byly zastaveny přídavkem 20% kyseliny trichloroctové ve zvolených časech 0; 0,5; 1; 3; 5; 10; 20; 30; 60 a 120 min. Množství uvolněných fibrinopeptidů A a B v supernatantu bylo stanoveno pomocí kapalinové chromatografie [1].
DNA analýza
Jednotlivé exony genů FGA, FGB a FGG byly namnoženy pomocí PCR a následně byly produkty přečištěny pomocí kitu ExoSAP IT podle návodu výrobce. Sekvenace přečištěných produktů PCR probíhala Sangerovou dideoxysekvenační metodou pomocí DTCS kitu (Beckman Coulter, USA). Sekvence byly čteny pomocí sekvenátoru CEQ 8000 Genetic Analysis System (Beckman Coulter, USA).
Klotabilita
Ke vzorku plazmy byl přidán TRIS pufr pH 7,4 a EDTA. Polymerace fibrinu byla spuštěna přídavkem trombinu (2 U/ml finální koncentrace). Polymerace probíhala 120 minut při laboratorní teplotě. Vytvořený fibrinový klot byl promyt 5krát v TRIS pufru pH 7,4 a rozpuštěn v 5 mol/l močovině. Koncentrace fibrinových monomerů byla určena spektrofotometricky při λ = 280 nm a εfbg, 1% = 15,1. Klotabilita byla vypočtena jako poměr změřené koncentrace fibrinových monomerů k celkové koncentraci fibrinogenu zjištěné imunoturbidimetrickou metodou.
Fibrinolýza
Pro získání informací o rychlosti a průběhu fibrinolýzy byla měřena optická hustota (OD) vzorků při vlnové délce 350 nm. Turbidimetrické křivky fibrinu byly měřeny při 37 °C, po každých 20 s byla odečítána a zapisována optická hustota. Reakce byla sledována 40 minut. Jednotlivá měření každého vzorku byla vždy provedena v dubletu a výsledek byl vyjádřen jako průměr.
Skenovací elektronová mikroskopie (SEM)
Ke vzorku plazmy byl přidán trombin (výsledná koncentrace 2 U/ml) a polymerace probíhala 2 hodiny ve vlhké komůrce. Fibrinový klot byl promyt 3krát 5 min Q vodou, dehydrován etanolovou řadou (25 %, 50 %, 75 %, 100 % etanolu po 30 minutách) a dosušen metodou CO2 kritického bodu. Takto upravené vzorky byly potaženy vrstvou platiny o tloušťce 8 nm a morfologie fibrinové sítě byla sledována ve skenovacím elektronovém mikroskopu VEGA Plus TS5135 (Tescan, ČR).
Konfokální laserová mikroskopie
Ke vzorku plazmy byl přidán trombin (výsledná koncentrace 2 U/ml) a polymerace probíhala 2 hodiny při laboratorní teplotě. Po promytí PBS pufrem byly vzniklé sítě barveny fluorescenčním barvivem FITC po dobu 60 minut. Nenavázaný FITC byl odstraněn několikadenním promýváním pomocí PBS. Struktura fibrinové sítě byla sledována na mikroskopu Olympus Fluoview FV1000 a výsledky vyhodnoceny v programu ImageJ. Průměry vláken byly statisticky porovnány s průměrem kontrolního vzorku na hladině významnosti 0,05.
Agregace krevních destiček
Měření agregace v plazmě bylo prováděno na čtyřkanálovém agregometru PAP-4 optickou metodou. Po přidání aktivátoru agregace k míchané plazmě narůstá se vznikem agregátů intenzita světla procházející vzorkem. Výstupní signál je úměrný diferenci v průchodu světla mezi testovaným a referenčním vzorkem. Vzorky byly vloženy do měrné cely a nástřikem aktivátorů (20 μmol/l ADP či 10 μmol/l TRAP (peptid SFLLRNP aktivující trombinový receptor)) byla spuštěna agregační reakce v agregometeru PAP-4. Doba měření byla 6 minut.
Statistická analýza
Šířka vláken byla naměřena pomocí programu ImageJ a statisticky vyhodnocena pomocí dvouvýběrového t-testu rovnosti středních hodnot dvou základních souborů s nulovou hypotézouH0: S12 =S2 2. V každém vzorku byla naměřena šířka 100 vláken a pomocí nástroje Analýza dat v excelu byl proveden dvouvýběrový t-test s rovností rozptylů na hladině významnosti α = 0,05.
K výpočtům byly použity následující vzorce:
kde n je počet naměřených hodnot, S2 je rozptyl, S je směrodatná odchylka, R je testovací statistika, Wα je kritický obor testu, tα je kritická hodnota Studentova t-rozdělení [2] (pro 100 měření a hladinu významnosti α = 0,05 je t0,05 (198) = 1,985).
Izolace fibrinogenu
Fibrinogen byl z plazmy izolován precipitací 25% saturovaným síranem amonným. Po přídavku síranu amonného se fibrinogen srážel 30 minut při 4 °C, následně byl oddělen odstřeďováním. Peleta byla dvakrát promyta 25% síranem amonným a odstředěna. Izolovaný fibrinogen byl rozpuštěn v TRIS pufru pH 7,4 a šokově zmražen.
Elektroforéza v polyakrylamidovém gelu v přítomnosti dodecylsíranu sodného (SDS PAGE)
SDS PAGE byla provedena v uspořádání podle Laemliho [3] v redukujícím i neredukujícím prostředí a obarvena Coomasie Blue.
Western blotting
Gely po SDS PAGE byly ponořeny na 5 minut do blotovacího pufru. PVDF membrány byly ekvilibrovány 5 min v metanolu. Blotování probíhalo v semi-dry uspořádání. Membrány byly následně obarveny koloidním stříbrem.
Imunoblotting
Membrány byly pasivovány buď 5% roztokem mléka, nebo 5% roztokem Tweenu 20 přes noc. Následně byly membrány promyty 3 x 10 minut v roztoku 0,1% Tween 20/PBS. Reakce s primární protilátkou proti fibrinogenu probíhala 30 min a poté byly membrány promyty 3 x 10 minut v roztoku 0,1% Tween 20/PBS. Sekundární protilátka byla na membrány aplikována na 30 min a poté byla odmyta 3 x 10 minut roztokem 0,1% Tween 20/PBS. Membrány byly následně vizualizovány přídavkem substrátu pro fosfatázou značenou protilátku.
Hmotnostní spektrometrie
In-gel digest jednotlivých řetězců fibrinogenu po SDS PAGE byl proveden podle Shevchenka et al. [4]. Před vlastním měřením byly vzorky přečištěny pomocí mikrokolonek s reverzní fází. Vzorky na MALDI-TOF byly smíchány s matricí a spotovány na desku. Po vykrystalizování matrice s peptidy byla deska umístěna do hmotnostního spektrometru Biflex IV (Bruker Daltonics, Německo) a hmotnostní spektrum bylo získáno v reflexním modu.
ELISA
Lidský fibrinogen byl imobilizován na povrch jamek mikrotitrační destičky po dobu 1 hodiny a zbývající povrch byl blokován 1% sérovým albuminem po dobu jedné hodiny. Byly přidány plazmy pacienta, popř. kontroly a jamičky byly 10krát promyty TRIS pufrem pH 7,4 po hodinové inkubaci. Kozí protilátka proti lidským IgG konjugována s alkalickou fosfatázou byla přidána do jamiček a po hodinové inkubaci byl přidán 4-nitrofenylfosfát. Množství uvolněného 4-nitrofenolu bylo sledováno po 30 minutách při vlnové délce 405 nm.
Molekulární modelování
Molekulární modelování bylo provedeno s využitím softwaru Vector NTI 10 (Informax, USA), a Deepview/Swiss-PDBViewer 3.7 a dostupných rentgenostrukturálních dat pro jednotlivé oblasti fibrinogenu.
VÝSLEDKY A DISKUSE
Nejdůležitější fyziologickou úlohou fibrinogenu je jeho participace v hemostáze. Během poranění dochází k poškození cévního endotelia a expozici proteinových struktur, které aktivují krevní destičky a další faktory účastnící se hemostázy. Postupnou aktivací jednotlivých koagulačních faktorů dochází k tvorbě velkého množství trombinu, který katalyzuje hydrolytické štěpení fibrinogenu. Vzniká tak fibrinová síť, která se spolupodílí na zástavě krvácení a zároveň poskytuje dočasnou degradovatelnou podpůrnou matrici pro následné prorůstání buněk. Současně s tím jsou aktivovány krevní destičky, které agregují prostřednictvím molekul fibrinogenu.
Vrozené dysfibrinogenemie
Vrozená dysfibrinogenemie je vzácné onemocnění, které se vyznačuje vrozenou abnormalitou v některém z genů kódujících jednotlivé polypeptidové řetězce fibrinogenu resultující v poruše fyziologické funkce molekuly fibrinogenu. V případě dysfibrinogenemií jsou molekuly se zaměněnými aminokyselinovými zbytky sekretovány do krevního řečiště. Dědičné záměny aminokyselinových zbytků bývají nejčastěji lokalizovány v FGA genu, který kóduje Aα řetězec fibrinogenu [5]. Druhým nejčastěji mutovaným genem je FGG, který kóduje γ řetězec. Nejméně mutací bylo doposud popsáno v FGB genu, který kóduje Bβ řetězec. Nejvíce frekventované jsou záměny aminokyselinového zbytku argininu v pozici Aα 16.
Záměny v Aα řetězci
Záměny v Aα řetězci jsou celosvětově nejčastější. Nejvíce zastoupená je mutace Aα 16 arginylu za cysteinyl, histidyl, popř. seryl. V české populaci se jedná také o nejrozšířenější molekulární příčinu vrozených dysfibrinogenemií. Záměnu Aα 16Arg se nám podařilo prokázat u devíti nepříbuzných rodin. Ve dvou případech se jednalo o záměnu arginylu za cysteinyl a v sedmi případech o záměnu arginylu za histidyl. Záměna za cysteinyl způsobuje konformační změnu zodpovědnou za neschopnost trombinu katalyzovat hydrolytické štěpení peptidové vazby Aα 16Arg-Aα 17Gly. Výsledkem je prodloužení lag fáze polymerace fibrinu a abnormální kinetika odštěpování fibrinopeptidů podobně jako v případě fibrinogenu Nový Jičín [6] a Ostrava II [7].
Klinická manifestace této záměny může být asymptomatická, jako v případě fibrinogenu Bergamo I [8] a Ostrava II, nebo krvácivá jako v případě fibrinogenu Kaiserslautern III [9] a Nový Jičín [6]. Hemoragické projevy jsou dány tím, že molekuly fibrinogenu s touto záměnou nejsou schopny odkrýt polymerační místo. Argininový zbytek na C-konci fibrinopeptidu A je silně konzervován a záměna Aα Arg16Cys je nejčastější záměnou v Aα řetězci. U sedmi nepříbuzných rodin se nám podařilo zjistit mutaci Aα Arg16His. V tomto případě jde o nejčastější mutaci v české populaci vůbec. Jedním z případů je fibrinogen Praha II [6]. Pacientem byl v tomto případě jedenatřicetiletý muž z Prahy, u něhož se v roce 1995 objevila hematurie s podezřením na glomerulonefritidu. Mutace byla prokázána také u jeho jedenáctileté dcery, která udává větší krvácení při drobných poraněních.
Druhým pacientem, o němž se zde zmíníme, je dvouletý asymptomatický chlapec se stejnou mutací [7]. Jeho matka udává snadnou tvorbu hematomů po úderu. Sledování kinetiky tvorby fibrinové sítě indukované jak trombinem, tak reptilázou ukázalo prodlouženou lag fázi a sníženou celkovou turbiditu u obou pacientů v porovnání se zdravou kontrolou. Průběh kinetiky odštěpování fibrinopeptidů byl podobný jako u pacientů s mutací Aα 16 Arg → Cys. Výsledné množství odštěpených fibrinopeptidů B z fibrinogenu Praha II, Praha II D1 a Ostrava I bylo signifikantně vyšší než množství odštěpených fibrinopeptidů A.
Pomocí hmotnostní spektrometrie na principu MALDI-TOF byla v plazmě pacienta s fibrinogenem Praha II prokázána přítomnost obou forem Aα řetězce – normálního (peptid GGGVRGPRVVE o hmotnosti 1082,60 Da) a zaměněného (peptid GGGVHGPRVVE o hmotnosti 1063,65 Da) – obrázek 1.
Obr. 1. MH+ spektrum peptidů fibrinogenu Nový Jičín (štěpeno endopeptidasou Glu-C) odpovídající sekvenci Aα 12 – 22 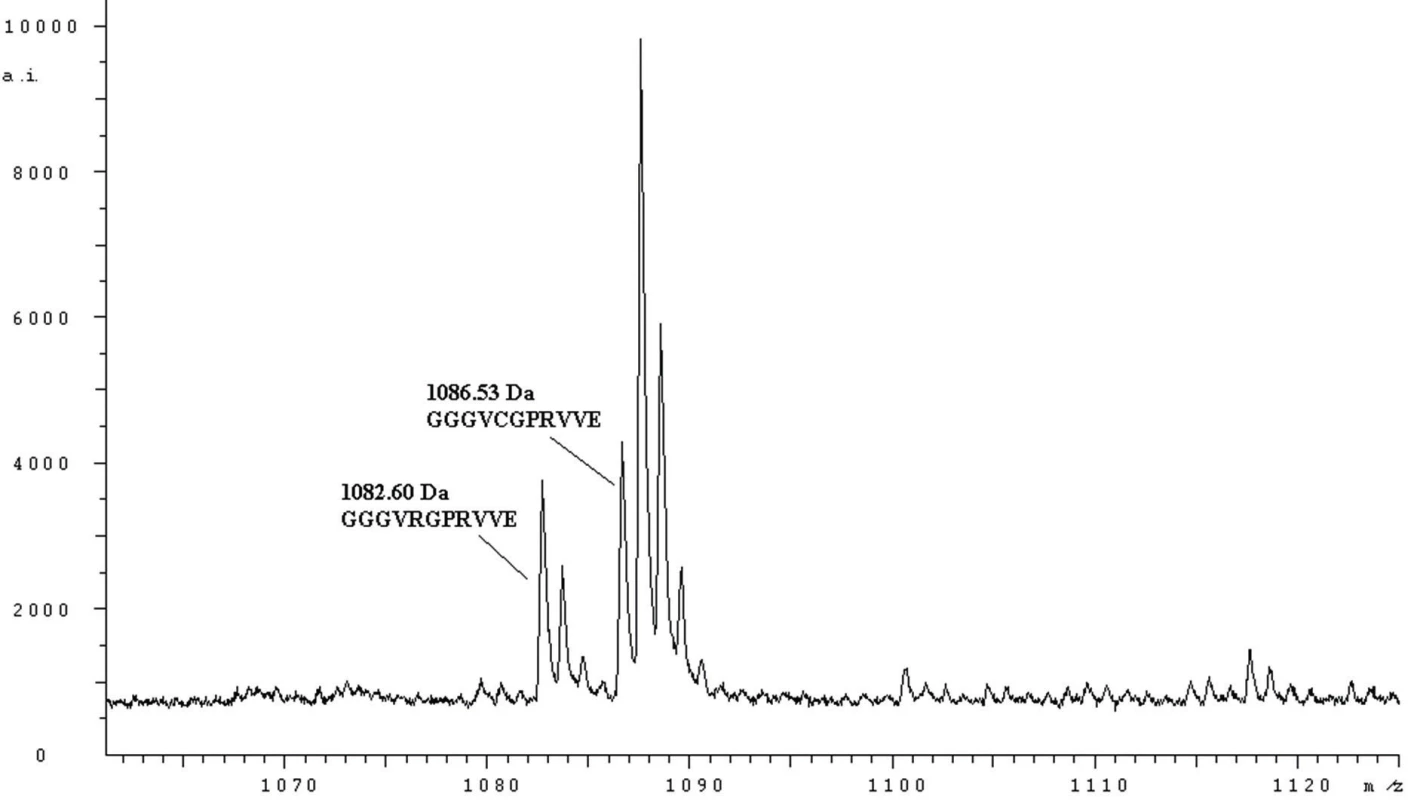
Jsou zobrazeny píky normálního (1082,60 Da, GGGVRGPRVVE) a abnormálního S-karboxamidomethylovaného (1086,53 Da, GGGVCGPRVVE) peptidu. Záměna Aα Arg16His je celosvětově druhou nejčastější záměnou v Aα řetězci. Aα 16Arg se nachází na C-konci fibrinopeptidu A. Trombin štěpí peptidovou vazbu mezi arginylem 16 a glycylem 17 a štěpení této vazby je esenciální pro následnou polymeraci fibrinu. Záměna arginylu 16 histidylem sice neznemožňuje trombinu tuto vazbu štěpit, ale výrazně zpomaluje kinetiku odštěpování fibrinopeptidu A. Klinická manifestace této záměny může být asymptomatická, jako v případě fibrinogenu Tahiti, Poissy III [10], Bern IV [11] a Ostrava I nebo krvácivá jako v případě fibrinogenu Giessen I [12] a Praha II.
Další mutací ve fibrinopeptidu A, kterou se nám podařilo nalézt, je záměna glycylu 13 za glutamyl [13]. Šestatřicetiletá pacientka s touto mutací prodělala závažné gynekologické krvácení v šestém týdnu prvního těhotenství. Dítě však úspěšně porodila. V letech 2007 a 2008 prodělala dva spontánní aborty s masivním krvácením a hematomem v děložní stěně. Podobně jako v předchozích případech byla mutací ovlivněna kinetika odštěpování fibrinopeptidů a polymerace fibrinu.
Mutace se nachází v místě, které zapadá do aktivního katalytického místa trombinu. V důsledku pozměněné konformace této části fibrinopeptidu A dochází k ovlivnění interakcí mezi fibrinopeptidem A a aktivním místem trombinu, což ovlivňuje katalytickou aktivitu trombinu a vede k poruše odštěpování fibrinopeptidu A.
Velice vzácně se objevují kombinované záměny. Nám se podařilo odhalit u jedné pacientky kombinaci dvou mutací Aα Gly13Glu a Aα Ser314Cys [14]. Dvaapadesátiletá pacientka trpěla krvácivými projevy od dětství (tvorba hematomů, purpura, menoragie). Operační výkony u pacientky byly komplikovány velkým krvácením, stejně jako těhotenství. Díky masivnímu krvácení pacientka potratila první plod v třetím týdnu těhotenství. Druhé těhotenství bylo komplikováno šestitýdenním krvácením, porod byl ale úspěšný; při třetím těhotenství již byla připravována koncentráty fibrinogenu. Její matka a babička trpěly krvácivými projevy, stejně jako obě její děti. U pacientky byla zjištěna jak porucha polymerace fibrinu, tak kinetiky odštěpování fibrinopeptidů. Navíc měla pacientka také poruchu fibrinolýzy, kde byla zjištěna prodloužená lytická fáze.
Zatímco mutace Aα Gly13Glu byla již dříve popsána, tak mutace Aα Ser314Cys byla zjištěna poprvé. Geneticky byl z rodiny pacientky vyšetřen ještě její bratr, u kterého byla prokázána pouze mutace Aα Gly13Glu. Bratr pacientky měl také krvácivé projevy, porušenou polymeraci fibrinu a kinetiku odštěpování fibrinopeptidů, avšak měl normální průběh fibrinolýzy. Morfologie fibrinové sítě u obou členů rodiny se také lišila. Zatímco u bratra měla síť normální parametry, síť pacientky byla rigidnější a vlákna byla širší. Kombinace těchto dvou mutací tedy měla za následek jak ovlivnění prvotní fáze polymerace, tedy odštěpení fibrinopeptidů A, tak laterální agregaci protofibril.
Další dříve nepopsanou mutací v Aα řetězci je záměna Aα Phe98Ile [15]. Tato mutace byla nalezena u dvaačtyřicetileté ženy s dvěma aborty. U pacientky byla zjištěna abnormální polymerace fibrinu, fibrinolýza, morfologie fibrinové sítě a agregace krevních destiček.
Mutace se nachází v helikální oblasti coiled-coil regionu fibrinogenu, která je důležitá pro správnou laterální agregaci protofibril. Mutace se také nachází v RGDF sekvenci (Aα 95-98), která zprostředkovává interakci s krevními destičkami a endotheliálními buňkami. Pomocí agregace krevních destiček bylo zjištěno, že v přítomnosti aktivátorů TRAP, ADP a kolagen dochází vlivem mutace ke zvýšené agregaci krevních destiček. To má zřejmě za následek tvorbu mikrotrombů, které způsobily aborty u pacientky.
Poslední mutací v Aα řetězci, kterou jsme doposud popsali, je záměna Aα Asn106Asp [16]. Mutace byla objevena u jedenašedesátiletého pacienta, který prodělal plicní embolii, hlubokou žilní trombózu a několik tromboflebitů. U pacienta byla zjištěna abnormální morfologie fibrinové sítě, fibrinolýza (obr. 2) a agregace krevních destiček (obr. 3). Fibrinová síť pacienta byla velmi rigidní s velkým počtem volných konců.
Obr. 2. Fibrinolytické křivky pacientů s trombózami. 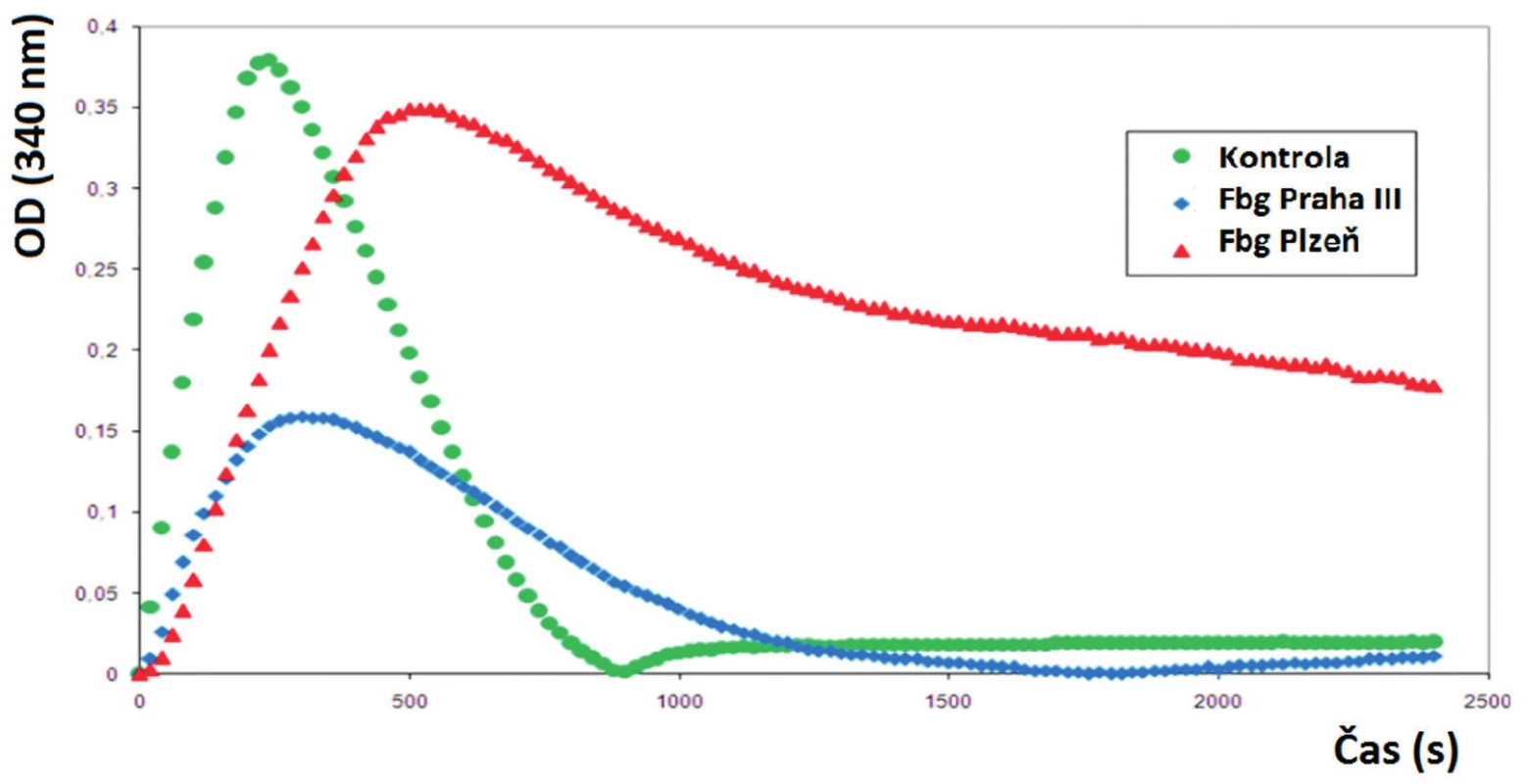
Jak u pacienta s mutací Praha III, tak i u pacienta s mutací Plzeň je patrná prodloužená lytická fáze. Obr. 3. Agregace krevních destiček v přítomnosti různých aktivátorů 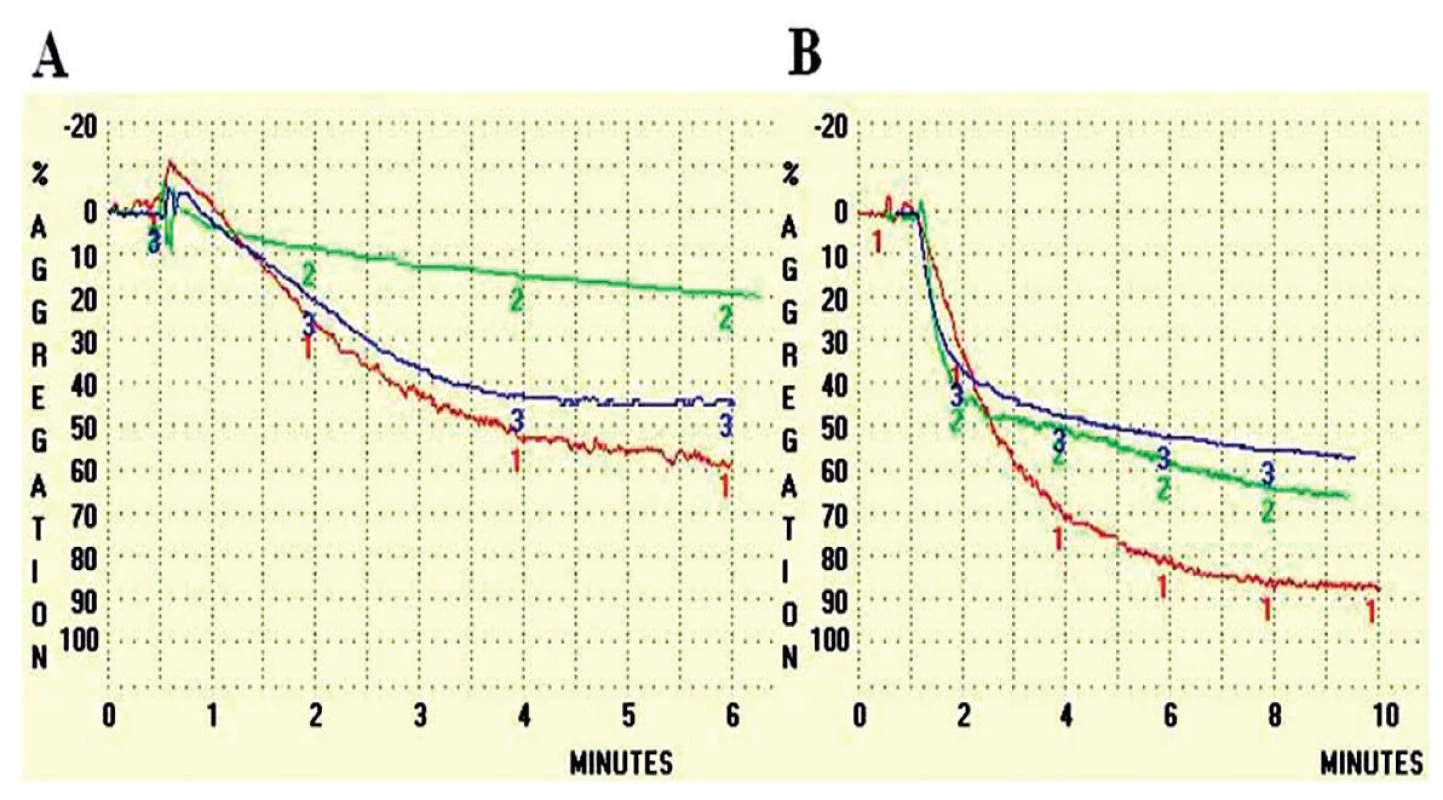
V případě obou aktivátorů (A – 20 μM ADP, B – 10 μM TRAP) byla zjištěna snížená agregace v přítomnosti jak fibrinogenu Plzeň (zeleně) tak fibrinogenu Praha III (modře) v porovnání s kontrolním fibrinogenem.
To je zřejmě způsobeno změnou konformace coiled-coil oblasti, která vede k poruše laterální agregace protofibril a následné poruše fibrinolýzy způsobující prodloužení lytické fáze fibrinolýzy a rozvoj trombotických komplikací u pacienta.
Záměny v Bβ řetězci
Záměny v Bβ řetězci jsou nejméně časté. Doposud se nám podařilo nalézt jeden případ dysfibrinogenemie způsobený záměnou v Bβ řetězci. Jedná se o záměnu Bβ Arg237Ser, kterou jsme identifikovali u pětapadesátiletého pacienta, který prodělal hlubokou žilní trombózu a plicní embolii [17]. U pacienta byla porušena fibrinolýza a morfologie fibrinové sítě. Záměna arginylu za seryl zřejmě změnila konformaci části molekuly fibrinogenu, která způsobila poruchu správné tvorby protofibril spojenou s poruchou fibrinolýzy a zapříčinila trombotické komplikace u pacienta. Tato mutace nebyla dosud popsána, avšak bylo popsáno několik mutací v jejím okolí, které také způsobují trombózy. Například Morris et al. popsali mutaci Bβ Pro235Leu, která je zodpovědná za chronickou trombotickou plicní hypertenzi [18], či Hanss et al. popsali záměnu Bβ Tyr236Stop způsobující žilní trombózu [19].
Záměny v γ řetězci
V γ řetězci fibrinogenu se nám podařilo identifikovat několik mutací způsobujících dysfibrinogenemii. První z nich je nejčastější záměna v řetězci γ Arg275His [20]. Tato mutace byla objevena u pětadvacetileté pacientky se silnou menoragií. U pacientky byla mutací ovlivněna polymerace fibrinu; fibrinolýza, morfologie fibrinové sítě i odštěpování fibrinopeptidů byly normální. Dříve již bylo popsáno 11 případů záměny Arg275His, 16 případů záměny Arg275Cys, a jeden případ záměny Arg275Ser [5]. Arginyl v pozici 275 je silně konzervován. Během polymerace fibrinu dochází ke spontánní asociaci koncových D-domén různých molekul fibrinogenu. Pro tuto interakci je důležitá přítomnost γ 275Arg, neboť guanidinová skupina jedné molekuly fibrinogenu tvoří vodíkovou vazbu s hydroxylovou skupinou γ 300Ser druhé molekuly fibrinogenu, γ 275Arg druhé molekuly fibrinogenu tvoří vodíkovou vazbu s hydroxylovou skupinou γ Tyr280 první molekuly fibrinogenu [21]. Tyto interakce se tvoří na rozhraní dvou sousedních koncových domén protofibril, nezávisle na interakci centrální domény s koncovou [22]. Záměna Arg275His způsobuje tedy poruchu tvorby protofibril.
Dalším případem γ dysfibrinogenemie je fibrinogen Praha III [16]. Nositelkou mutace γ Tyr363Asn byla šestadvacetiletá žena z Prahy. V roce 2003 prodělala plicní embolii s akutní dysfunkcí pravé komory, od té doby je na antikoagulační terapii. V roce 2004 u ní byla zjištěna hluboká žilní trombóza v oblasti třísla vlevo. Polymerace fibrinu i fibrinolýza byly porušeny (viz obr. 2). Kinetika odštěpování fibrinopeptidů měla normální průběh, u pacientky však bylo zjištěno vyšší zastoupení fosforylovaného fibrinopeptidu A (42 %) oproti kontrole (22 %). Fosforylovaný fibrinopeptid A tvoří přibližně 25 % všech fibrinopeptidů zdravého člověka [23]. Jeho zvýšené množství bylo zjištěno u fetálního fibrinogenu [24] a po některých operacích [25]. Bylo zjištěno, že fosfoserinový zbytek na pozici Aα 3 může moderovat interakci Aα řetězce s trombinem, avšak nemá vliv na polymeraci fibrinu [26].
Tyrosylový zbytek γ 363 je situován v polymeračním místě „a“ γC domény [27] a je součástí γ ohybu Tyr363-Asn365 inverzního typu (obr. 4). Polymerační prohlubeň je tvořena zbytky D297, E323, N325, Q329, D330, K338, C339, H340, H343, Y363, D364, G366 a R375 g Yetzce [27]. Tyr363 netvoYí s GPRP peptidem (tetrapeptid vázající se do polymeračního místa „a“, má stejnou sekvenci jako první čtyři aminokyselinové zbytky Aα řetězce po odštěpení FPA, které se váží do polymeračního místa „a“) vodíkovou vazbu. Záměna Tyr363 za Asn363 vytváří nové vodíkové vazby v polymeračním místě „a“, Asn363 tvoří vodíkovou vazbu s Gln329 a s arginylovým zbytkem GPRP peptidu.
Obr. 4. Krystalografická struktura γC domény s GPRP peptidem navázaným v polymeračním místě „a“ γ Tyr363 (černě) je součástí polymerační prohlubně „a“ γC domény. 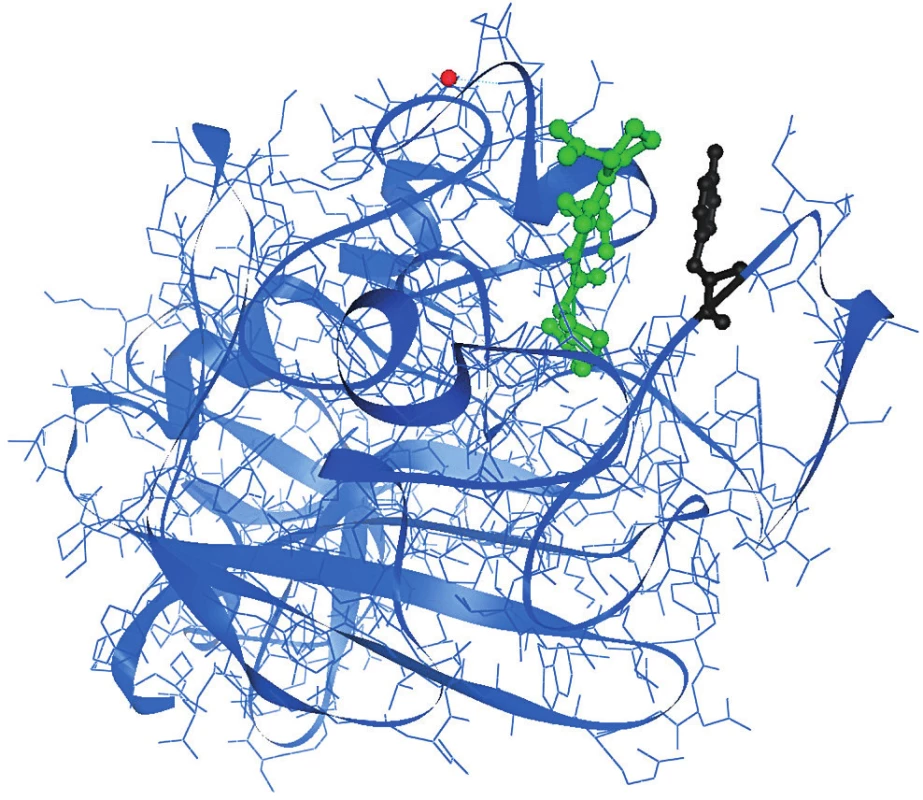
GPRP peptid je znázorněn zeleně. Červeně je zvýrazněn ion Ca2+. Přítomnost Asn363 v polymeračním místě mění konformaci polymeračního místa, což během polymerace není ideální a má to nejspíše za následek pomalejší polymeraci a vznik menšího počtu širších fibrinových vláken. To zřejmě vede k pomalejší a nedokonalé fibrinolýze. Na druhou stranu přítomnost nové vodíkové vazby s GPRP peptidem indikuje pevnější vazbu fibrinu. To zřejmě způsobuje vznik trombů u pacientky.
Fibrinogen Liberec je dalším případem dysfibrinogenemie, která nebyla dosud publikována [28]. V tomto případě se jedná o mutaci γ Tyr262Cys, která byla nalezena u dvaadvacetileté ženy během předoperačního vyšetření. Pacientka udávala snadnou tvorbu hematomů a silnou menoragii. U pacientky byla zjištěna porucha polymerace fibrinu. Tyrosinový zbytek 262 se nachází v β-ohybu typu IV γ262-265 (sekvence YAMF), blízko polymeračního i vápenaté ionty vázajícího místa. Pomocí elektronové mikroskopie bylo zjištěno, že fibrinová síť z fibrinogenu Liberec má signifikantně tlustší vlákna a je více porézní. Tyto parametry hrají klíčovou úlohu ve viskoelastických vlastnostech klotu. V případě fibrinogenu Bicêtre II (γ 308Asn/Lys) bylo zjištěno, že klot má větší póry a širší vlákna, což vedlo ke snížení storage modulu (odráží elasticitu klotu), zvýšení loss tangentu (odráží neelastické vlastnosti klotu) a zvýšení Darcyho konstanty (odráží permeabilitu klotu) a to vedlo k trombotickým epizodám [29]. Vlákna fibrinu Bicêtre měly průměrnou šířku 357 nm, která je podobná šířce vláken fibrinu Liberec (443 ± 98 nm).
Tyrosin 262 je lokalizován uvnitř γC domény. Hydroxylová skupina Tyr262 tvoří vodíkovou vazbu s Asp288. V případě Cys262 nebyla nalezena žádná potencionální vodíková vazba. Protože Tyr262 má aromatický postranní řetězec, může být zapojen do π-π interakcí s aromatickými aminokyselinovými zbytky v okolí. Oba typy interakcí jak vodíkové vazby, tak π-π interakce mohou hrát důležitou roli ve správné konformaci celé domény. Záměna ve fibrinogenu Liberec může alosterickým efektem indukovat konformační změny v polymeračním místě.
Posledním případem vrozené dysfibrinogenemie v γ řetězci je fibrinogen Praha IV [30]. V případě tohoto fibrinogenu byla nalezena mutace γ Ser313Gly u dvaačtyřicetiletého pacienta, který prodělal hlubokou žilní trombózu po běžkování a také uvádí častou tvorbu hematomů. Polymerace i fibrinolýza byly normální. Elektronovou a konfokální mikroskopií byla zjištěna abnormální morfologie fibrinové sítě, která je zřejmě zodpovědná za trombotické projevy u pacienta (obr. 5).
Obr. 5. Struktura fibrinových sítí připravených z kontrolního fibrinogenu (A, C) a fibrinogenu Praha IV (B, D) sledovaných elektronovou mikroskopií a konfokální mikroskopií s flourescenčním barvením 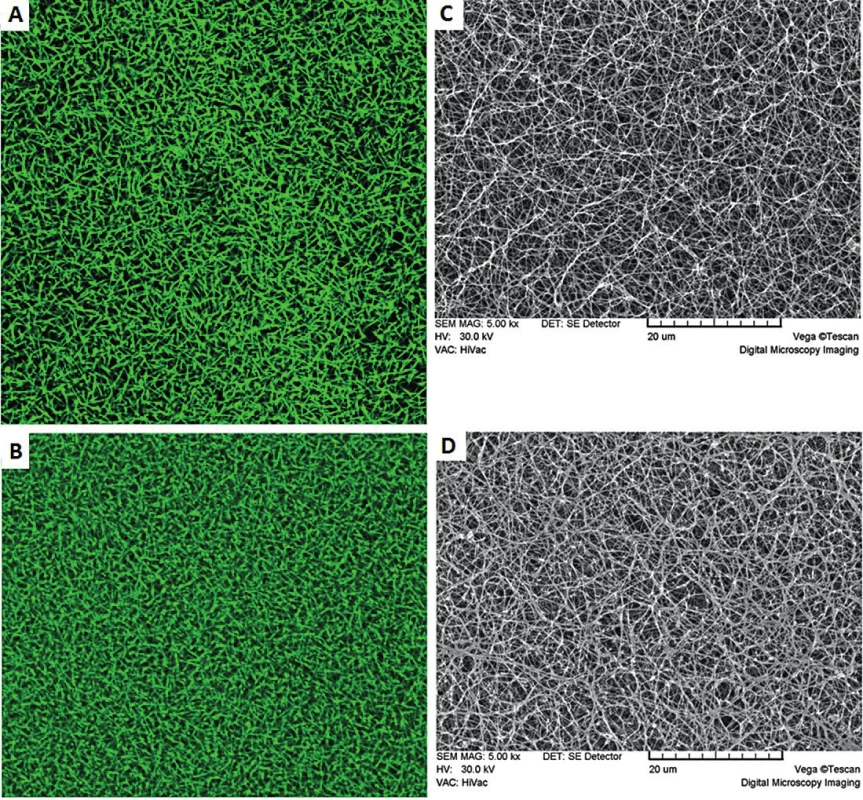
V místě mutace byly dříve popsány jiné záměny. Meyer et al. popsali mutaci γ 313 Ser → Asn, která se projevovala jako hypofibrinogenemie [31]; Brennan et al. popsali mutaci γ 313 Ser → Arg, která se projevovala jako hypodysfibrinogenemie [32]. Je zřejmé, že postranní řetězec má zásadní vliv na klinické projevy záměny.
Vrozené afibrinogenemie
Vrozená afibrinogenemie je vzácné onemocnění charakterizované sníženou hladinou celkového fibrinogenu pod 0,5 g/l. V České republice se nám zatím podařilo identifikovat jeden případ afibrinogenemie.
Vrozenou afibrinogenemii se nám podařilo popsat u chlapce narozeného v roce 2011 [33]. Koagulační vyšetření u tohoto chlapce ukázalo neměřitelné hladiny funkčního a celkového fibrinogenu. Od narození prodělával různě závažná krvácení. V 11 měsících života byl pro poruchy vědomí přijat na dětské oddělení, odkud byl urgentně letecky transportován na klinické oddělení, kde byl pomocí CT zjištěn rozsáhlý hematom v okcipitální oblasti se známkami nitrolební hypertenze. Neurochirurgicky mu byl evakuován epidurální hematom a pacient se stabilizoval [35]. Genetické vyšetření odhalilo u pacienta homozygotní deleci v FGA genu 6477delA, která měla za následek zkrácení Aα řetězce a novou C-koncovou sekvenci. S ohledem na celkové chybění fibrinogenu, které bylo prokázáno také pomocí HPLC nebylo možné provézt další funkční vyšetření. Zkrácení Aα řetězce a nová C-koncová sekvence mají evidentně za následek poruchu v biosyntéze či sekreci fibrinogenu pacienta.
Získané dysfibrinogenemie
Získané dysfibrinogenemie se projevují jako sekundární onemocnění vyvolané primárním onemocněním. Nejčastěji se získané dysfibrinogenemie vyskytují u pacientů s poruchami funkce jater, ve kterých dochází k biosyntéze fibrinogenu a kde vlivem jaterní choroby dochází nejčastěji k poruše biosyntézy sacharidické složky fibrinogenu.
Na ÚHKT jsme vyšetřili pacienta se získanou dysfibrinogenemií v souvislosti s mnohočetným myelomem [36]. Při koagulačním vyšetření byla zjištěna porucha koagulace (tab. 1). Jaterní testy pacienta byly v normě, byla však zjištěna vysoká hladina paraproteinu. Pacient byl léčen kombinací prednisonu a melfalanu. Po půl roce léčení došlo ke snížení hladiny paraproteinu a částečné normalizaci koagulace (viz tab. 1).
Tab. 1. Výsledky koagulačního vyšetření u získané dysfibrinogenemie 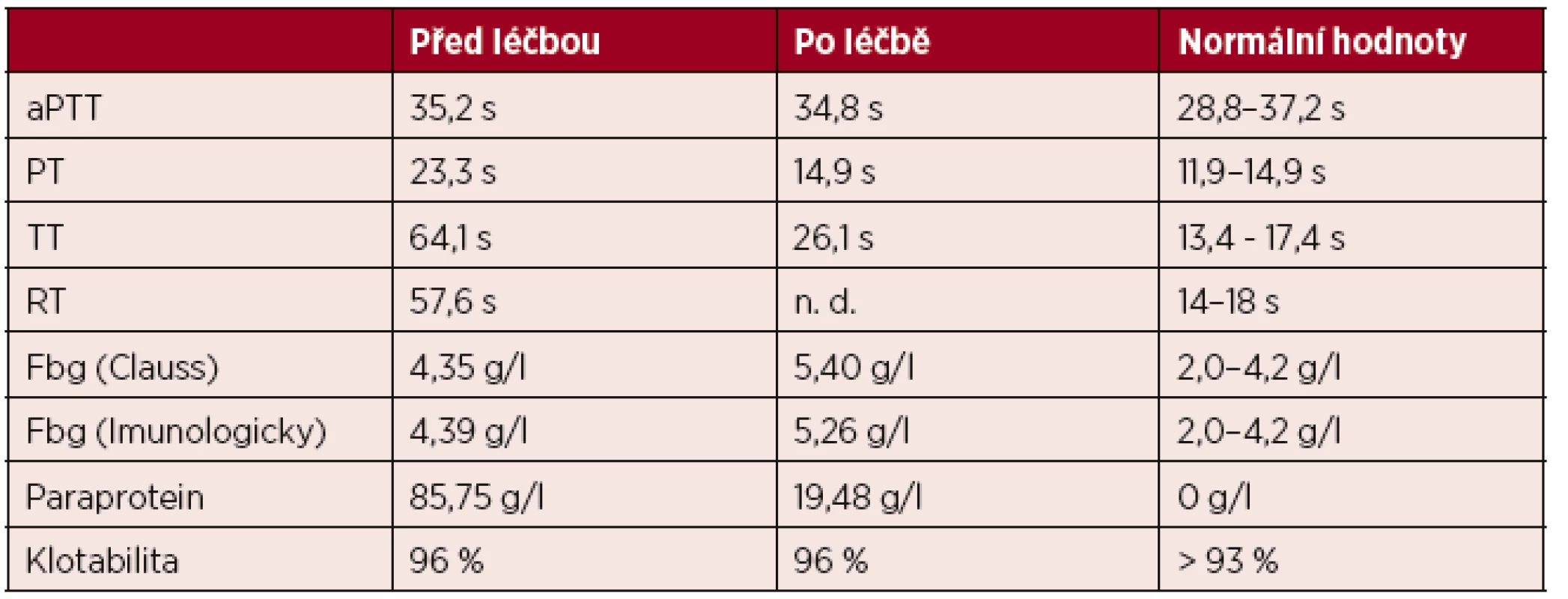
Vysvětlivky: aPTT – aktivovaný parciální tromboplastinový čas; PT – protrombinový čas; TT – trombinový čas; RT – reptilázový čas; Fbg (Clauss) – funkční hladina fibrinogenu stanovená metodou podle Clausse; Fbg (Imunologicky) – celková hladina fibrinogenu stanovená imunologicky Sledováním kinetiky polymerace fibrinu bylo zjištěno, že před léčbou nedocházelo k polymeraci fibrinu. Po léčbě došlo k normalizaci polymerace. Skenovací elektronová mikroskopie odhalila amorfní, houbovitou fibrinovou síť připravenou z plazmy pacienta před léčbou. Po léčbě došlo k normalizaci morfologie fibrinové sítě. Imunoblot izolovaných řetězců fibrinogenu na PVDF membráně odhalil interakci γ řetězce fibrinogenu se sérem pacienta a následnou interakcí s protilátkou proti lidským IgG konjugovanou s alkalickou fosfatázou, která ukazuje na interakci paraproteinu s γ řetězcem fibrinogenu.
Mnohočetný myelom je zhoubné nádorové onemocnění vycházející z patologického klonu plazmocytů, charakterizované nadprodukcí monoklonálního imunoglobulinu (paraproteinu), nejčastěji třídy IgG, dále IgA, IgM eventuálně jiné (Bence-Jonesova bílkovina) [37]. Příčina onemocnění není známá, vyskytuje se spíše ve vyšším věku, častěji u mužů. Paraproteiny mohou inhibovat koagulaci buď zabráněním polymerace fibrinu, nebo interakcí s krevními destičkami [38].
U pacienta byla zjištěna získaná dysfibrinogenemie v souvislosti s produkcí monoklonálních protilátek proti γ řetězci fibrinogenu. Ty zřejmě bránily polymeraci tím, že se vázali na γ řetězec a stericky bránili interakci s další molekulou fibrinogenu. Vznikala tak amorfní síť, která nebyla schopna stabilizovat primární fibrinovou zátku. K tomuto vysvětlení inhibice polymerace fibrinu působením paraproteinu se přiklání i O’Kane et al. [39]. Ruiz-Arguelles popsal případ získané dysfibrinogenemie způsobené autoprotilátkami proti fibrinogenu s podobným mechanismem účinku na polymeraci fibrinu [40].
ZÁVĚR
Fibrinogen plní mnoho fyziologických funkcí, z nichž nejdůležitější je jeho účast v hemostáze (hemokoagulaci a interakci s krevními destičkami). Molekulární záměny ve struktuře fibrinogenu mohou vést k různě závažným poruchám jeho biosyntézy, sekrece, degradace nebo funkce.
Vyšetřili jsme 36 různých rodin s podezřením na dysfibrinogenemii či afibrinogenemii. Popsali příčiny vrozených dysfibrinogenemií u 13 pacientů. Pomocí genetických, proteomických a funkčních vyšetření bylo odhaleno osm případů dysfibrinogenemie v Aα řetězci, konkrétně se jedná o mutace Aα Arg16Cys (fbg Nový Jičín, fbg Ostrava II); Aα Arg16His (fbg Praha II, fbg Ostrava I); Aα Gly13Glu (fbg Olovnice); Aα Phe98Ile (fbg Vizovice); Aα Asn106Asp (fbg Plzeň); a kombinovanou mutaci Aα Gly13Glu a Aα Ser314Cys (fbg Šumperk II). Jeden případ byl nalezen v Bβ řetězci – Bβ Arg237Ser (fbg Znojmo) a čtyři případy byly odhaleny v γ řetězci – γ Ser313Gly (fbg Praha IV), γ Tyr262Cys (fbg Liberec), γ Tyr363Asn (fbg Praha III) a γ Arg275His (fbg Brno). Dále jsme specifikovali jeden případ vrozené afibrinogenemie – FGA 6477delA (fbg Poděšín). V jednom případě byla zjištěna příčina získané dysfibrinogenemie v souvislosti s produkcí autoprotilátek proti fibrinogenu u pacienta s mnohočetným myelomem.
Klinicky se nalezené mutace projevovaly různě, většina pacientů byla asymptomatická a k vyšetření byli indikováni na základě rutinního vyšetření koagulace. Čtyři pacienti prodělali trombotické komplikace, osm pacientů vykazovalo hemoragické projevy. U jedné pacientky se objevily jak hemoragické, tak trombotické komplikace.
Studium vrozených i získaných poruch fibrinogenu nám přináší mnoho užitečných dat o struktuře a funkci molekuly fibrinogenu a pomáhá zlepšovat péči o pacienty s těmito vzácnými onemocněními hemostázy. Studiem abnormálních fibrinogenů se nám podařilo potvrdit některá dřívější data, především strukturně důležité části molekuly fibrinogenu potřebné pro správnou biosyntézu a sekreci fibrinogenu z hepatocytů.
Protože stále neznáme příčinu u zhruba 50 % trombotických příhod pacientů (idiopatické trombofilie), otevírá studium fibrinogenu další možná vysvětlení některých život ohrožujících komplikací. Jak bylo v této práci popsáno, nalezli jsme nové mutace v molekule fibrinogenu, které mohou být odpovědné za trombotické příhody u pacientů, u nichž nebyl nalezen žádný běžný trombotický marker. Běžné koagulační testy jsou primárně zaměřeny na sledování krvácivých příznaků, přičemž trombotické komplikace jsou laboratorně většinou nezachycené a mohou být v mnoha případech závažnější než komplikace hemoragické.
Podíl autorů na rukopisu
RK – provádění vyšetření, napsání rukopisu
EC – provádění vyšetření, revize rukopisu
JL – léčba nemocných, revize rukopisu
JŠ – provádění vyšetření, revize rukopisu
PO – provádění vyšetření, revize rukopisu
JS – provádění vyšetření, revize rukopisu
PS – léčba nemocných, revize rukopisu
JED – revize rukopisu
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Rádi bychom na tomto místě poděkovali všem lékařům, kteří nám dodávají vzorky pacientů, dr. Ingrid Hrachovinové za provádění koagulačních vyšetření a dr. Tomáši Riedelovi za elektronovou mikroskopii.
Tato práce vznikla za podpory grantů Ministerstva Zdravotnictví ČR pro konceptuální rozvoj číslo 00023736, grantem GAČR P205/12/G118 a grantem ERDF OPPK CZ.2.16/3.1.00/28007.
doc. Mgr. Ing. Bc. Roman Kotlín, Ph.D., MHA
Oddělení biochemie
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: roman.kotlin@uhkt.cz
Zdroje
1. Suttnar J, Dyr JE, Fořtová H, Pristach J. Determination of fibrinopeptides by high performance liquid chromatography. Biochem Clin Bohemoslov 1989;18 : 17–25.
2. Pavlík J, Jaroš F, Loučka M, Veselý P. Aplikovaná statistika, Vydavatelství VŠCHT Praha, Praha, 2005.
3. Laemmli, UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970;227 : 680–685.
4. Shevchenko A, Wilm M, Vorm O, Mann M. Mass spectrometric sequencing of proteins from silver-stained Polyacrylamide Gels. Anal Chem 1996;68 : 850–858.
5. Hanss M, Biot F. A database for human fibrinogen variants. Ann New York Acad Sci 2001;936 : 89–90.
6. Kotlín R, Chytilová M, Suttnar J, et al Fibrinogen Nový Jičín and Praha II: Cases of hereditary Aα 16 Arg → Cys and Aα 16 Arg → His dysfibrinogenemia. Thromb Res 2007;121 : 75–84.
7. Kotlín R, Blažek B, Suttnar J, Kvasnička J, Dyr JE. Dysfibrinogenemia in childhood: two cases of congenital dysfibrinogens. Blood Coagul Fibrinolys 2010;21 : 640–648.
8. Reber P, Furlan M, Beck EA, Finazzi G, Buelli M, Barbui T. Fibrinogen Bergamo I (A alpha 16Arg→Cys): susceptibility towards thrombin following aminoethylation, methylation or carboxamidomethylation of cysteine residues. Thromb Haemost 1985;54 : 390–393.
9. Loreth RM, Meyer M, Albert FW. Fibrinogen Kaiserslautern III: a new case of congenital dysfibrinogenemia with Aalpha 16 Arg→Cys substitution. Haemostasis 2001;31 : 12–17.
10. Mathonnet F, Peltier JY, Roda L, et al. Three new cases of dysfibrinogenemia: Poissy III, Saint-Germain I and Tahiti. Thromb Res 2001;103 : 201–207.
11. Stucki B, Zenhäusern R, Biedermann B, et al. Fibrinogens Bern IV, Bern V and Milano XI: three dysfunctional variants with amino acid substitutions in the thrombin cleavage site of the Aalpha-chain. Blood Coagul Fibrinolysis 1999;10 : 93–99.
12. Alving BM, Henschen AH. Fibrinogen giessen I: a congenital homozygously expressed dysfibrinogenemia with A alpha 16 Arg→His substitution. Am J Hematol 1987;25 : 479–482.
13. Kotlín R, Zichová K, Suttnar J, et al. Congenital dysfibrinogenemia Aα Gly13Glu associated with bleeding during pregnancy. Thromb Res 2011;127 : 277–278.
14. Kotlín R, Suttnar J, Čápová I, Hrachovinová I, Urbánková M, Dyr JE. Fibrinogen Šumperk II: Dysfibrinogenemia in an individual with two coding mutations. Am J Hematol 2012;87 : 555–557.
15. Riedelová-Reicheltová Z, Kotlín R, Suttnar J, et al. A novel natural mutation AαPhe98Ile in the fibrinogen coiled-coil affects fibrinogen function. Thromb Haemost 2014;111 : 79–87.
16. Kotlín R, Reicheltová Z, Malý M, et al. Two cases of congenital dysfibrinogenemia associated with thrombosis: Fibrinogen Praha III and Fibrinogen Plzen. Thromb Haemost 2009;102 : 479–486.
17. Kotlín R, Reicheltová Z, Suttnar J, et al. Two novel fibrinogen variants in the C-terminus of the Bbeta-chain : fibrinogen Rokycany and fibrinogen Znojmo. J Thromb Thrombolys 2010;30 : 311–318.
18. Morris TA, Marsh JJ, Chiles PG, et al. High prevalence of dysfibrinogenemia among patients with chronic thromboembolic pulmonary hypertension. Blood 2009;114 : 1929–1936.
19. Hanss MML, Ffrench PO, Mornex JF, et al. Two novel fibrinogen variants found in patients with pulmonary embolism and thein families. J Thromb Haemost 2003;1 : 1251–1257.
20. Kotlín R, Reicheltová Z, Sobotková A, et al. Three cases of abnormal fibrinogens: Šumperk (Bbeta His67Leu), Uničov (Bbeta Gly414Ser), and Brno (gammaArg275His). Thromb Haemost 2008;100 : 1199–1200.
21. Spraggon G, Everse SJ, Doolittle RF. Crystal structures of fragment D from human fibrinogen and its crosslinked counterpart from fibrin. Nature 1997;389 : 455–462.
22. Olexa SA, Budzynski AZ. Evidence for four different polymerization sites involved in human fibrin formation. Proc Natl Acad Sci USA 1980;77 : 1374–1378.
23. Blombäck B, Blombäck M, Edman P, Hessel B. Human fibrinopeptides. Isolation, characterization and structure. Biochim Biophys Acta 1966;115 : 371–396.
24. Witt I, Müller H. Phosphorus and hexose content of human foetal fibrinogen. Biochim Biophys Acta 1970;221 : 402–404.
25. Seydewitz HH, Kaiser C, Rothweiler H, Witt I. The location of a second in vivo phosphorylation site in the A alpha-chain of human fibrinogen. Thromb Res 1984;33 : 487–498.
26. Maurer MC, Peng JL, An SS, Trosset JY, Henschen-Edman A, Scheraga HA. Structural examination of the influence of phosphorylation on the binding of fibrinopeptide A to bovine thrombin. Biochemistry 1998;37 : 5888–5902.
27. Pratt KP, Côté HCF, Chung DW, Stenkamp RE, Davie EW. The primary fibrin polymerization pocket: three-dimensional structure of a 30-kDa C-terminal gamma chain fragment complexed with the peptide Gly-Pro-Arg-Pro. Proc Natl Acad Sci USA 1997;94 : 7176–7181.
28. Kotlín R, Sobotková A, Suttnar J, et al. A novel fibrinogen variant – Liberec: dysfibrinogenaemia associated with gamma Tyr262Cys substitution. Eur J Haematol 2008;81 : 123–129.
29. Marchi R, Loyau S, Angles-Cano E, Weisel JW. Structure and pro-perties of clots from fibrinogen Bicêtre II (gamma 308 Asn→Lys). Increased permeability due to larger pores, thicker fibers, and decreased rigidity. Ann New York Acad Sci 2001;936 : 125–128.
30. Kotlín R, Pastva O, Štikarová J, et al. Two novel mutations in the fibrinogen γ nodule. Thromb Res 2014;134 : 901–908.
31. Meyer M, Bergmann F, Brennan SO. Novel fibrinogen mutation (γ 313 Ser → Asn) associated with hypofibrinogenemia in two unrelated families. Blood Coagulation and Fibrinolysis 2006;17 : 63–67.
32. Brennan SO, Davis RL, Chitlur M. New fibrinogen substitution (γSer313Arg) causes diminished γ chain expression and hypodysfibrinogenaemia. Thromb Haemost 2010;103 : 478–479.
33. Štikarová J, Blatný J, Kotlín R, et al. Novel homozygous fibrinogen Aa chain truncation causes severe afibrinogenemia with life threatening complications in a two-year-old boy. Thromb Res 2013;132 : 490–492.
34. Zapletal O, Blatný J, Köhlerová S, Fiamoli V, Kotlín R, Dyr JE. Závažné spontánní intrakraniální krvácení u 11měsíčního chlapce s vrozenou afibrinogenemií. Čes Slov Pediat 2014;69 : 291–294.
35. Kotlín R, Sobotková A, Riedel T, et al. Acquired dysfibrinogemia secondary to multiple myeloma. Acta Haematol 2008;120 : 75–81.
37. Vokurka M, Hugo J a kol. Velký lékařský slovník On-line. 5. Vydání. Maxdorf, 2002. Dostupné z: <http://www.maxdorf.cz/maxdorf/vls/index.php?action=detail&id=019178&what=myelom&ctest=1>, staženo: 11. 8. 2017.
38. DiMinno G, Coraggio F, Cerbone AM, et al. A myeloma paraprotein with specificity for platelet glycoprotein IIIa in a patient with a fatal bleeding disorder. J Clin Invest 1986;77 : 157–164.
39. O’Kane MJ, Wisdom GB, Desai ZR, Archbold GPR. Inhibition of fibrin monomer polymerisation by myeloma immunoglobulin. J Clin Pathol 1994;47 : 266–268.
40. Ruiz-Arguelles A. Spontaneous reversal of acquired autoimmune dysfibrinogenemia probably due to an antiidiotypic antibody directed to an interspecies cross-reactive idiotype expressed on antifibrinogen antibodies. J Clin Invest 1988;82 : 958–963.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo Supplementum1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
- Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
- Každý obor potřebuje svůj ústav excelence
- Využití molekulárně cytogenetických technik při analýze chromozomových aberací u hematologických malignit
- Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfuze (1986–2016)
- Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Dysfibrinogenemie a afibrinogenemie v České republice
- Transfuze a imunohematologie v ÚHKT
- Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




