-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Functional consequences of mutations in the nucleophosmin gene in acute myeloid leukaemia
Characteristic mutations in the gene coding for nucleophosmin are found in a third of patients with acute myeloid leukaemia (AML). Due to these mutations, nucleophosmin is translocated from the cell nucleoli to the cytoplasm and a large number of essential cellular processes are affected. Our results suggest that an immune response against mutated nucleophosmin is induced in patients with a suitable HLA type and this lowers the risk of leukaemia development. However, the effect of the immune system can be impeded by various inhibitory mechanisms, which are currently being intensely explored mainly in solid tumours, but are probably also active in haemato-oncological diseases.
KEY WORDS:
AML – nucleophosmin – HLA – immune response
Autoři: K. Kuželová; B. Brodská; P. Soukup
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 26-32.
Kategorie: ZVLÁŠTNÍ VYDÁNÍ SUPLEMENTU K 65. VÝROČÍ ÚHKT
Souhrn
Charakteristické mutace v genu pro nukleofosmin jsou nalézány zhruba u třetiny pacientů s akutní myeloidní leukemií (AML). Jejich následkem dochází k přemístění nukleofosminu z jadérek do cytoplazmy a tím k ovlivnění celé řady životně důležitých buněčných procesů. Naše výsledky mimo jiné naznačují, že proti mutovanému nukleofosminu se vytváří imunitní reakce, která u jedinců s vhodným HLA typem snižuje riziko rozvoje AML. Zásah imunitního systému proti leukemickým buňkám může ovšem být blokován inhibičními mechanismy, které jsou v současné době intenzivně zkoumány především u pevných nádorů, ale pravděpodobně působí i u hematoonkologických onemocnění.
KLÍČOVÁ SLOVA:
AML – nukleofosmin – HLA – imunitní odpověď
Akutní myeloidní leukemie (AML) je nejčastější formou akutní leukemie u dospělých, její příčiny a prognóza jsou poměrně heterogenní a vyléčení se daří dosáhnout v průměru asi u 30 % pacientů. Značná část buněk AML vykazuje cytogenetické abnormality, u ostatních byla také již identifikována řada rekurentních mutací, které se mohou vyskytovat i současně. Nejčastější jsou mutace v genu pro nukleofosmin (NPM1), které jsou nalézány asi u 60 % pacientů s normálním karyotypem a jejichž přítomnost je při absenci dalších mutací spojena s příznivější prognózou [1]. V klasifikaci leukemií vydané Světovou zdravotnickou organizací v roce 2016 je AML s mutovaným NPM1 uvedena jako samostatná kategorie onemocnění [2].
Obecně tato diagnóza patří do velmi široké skupiny AML se středním rizikem dle cytogenetického nálezu.
V Ústavu hematologie a krevní transfuze (ÚHKT) jsou mutace nukleofosminu rutinně vyšetřovány od roku 2011. Četnost výskytu mutace NPM1 se na našem pracovišti pohybuje celkově okolo 35 %, u AML s normálním karyotypem je to přes 50 %. Přítomnost izolované mutace v genu NPM1 u pacientů s normálním karyotypem zvyšuje pravděpodobnost dosažení celkové remise a zlepšuje celkové přežití, čímž řadí tyto nemocné do nižšího rizika v rámci široké skupiny AML se středním rizikem (graf 1). Pacienti jsou v tomto případě léčeni standardní indukční léčbou 3+7 (Dauno 60 mg/m2 D1,2,3 + Cytosar 100 mg/m2 D1-7) a následně čtyřmi cykly konsolidace HIDAC (Cytosar 3g/m2, D1,3,5 à 12 hod). Vzhledem k tomu, že se jedná o molekulární ukazatel, jehož vývoj lze sledovat v čase (jak v periferní krvi, tak v kostní dřeni), používá se NPM1 k monitorování minimální reziduální nemoci (MRN). Při opakovaných vzestupech hodnoty (minimálně ve dvou odběrech po sobě) je brán jako indikátor molekulárního relapsu, který předchází relapsu hematologickému a v ÚHKT je indikací k zahájení záchranné léčby jakož i k transplantaci buněk krvetvorby.
Graf 1. Pravděpodobnost přežití pacientů s AML a normálním karyotypem podle přítomnosti izolované mutace genu NPM1 
Legenda: ------ AML střední riziko s izolovanou mutací NPM1, – AML střední riziko bez izolované mutace NPM1, doba přežití v měsících Charakteristické mutace koncové části genu NPM1 umístěného na dlouhém raménku pátého chromozomu (5q35.1) byly poprvé popsány v roce 2005 jako překvapivý výsledek imunohistochemického barvení vzorků kostní dřeně pacientů s hematologickými malignitami [3], které bylo prováděno se záměrem detekovat produkty fuzních genů vzniklých chromozomálními translokacemi. Autoři studie specificky u primární AML zaznamenali vysoký počet vzorků, u kterých byl nukleofosmin (NPM) přítomen převážně v cytoplazmě (35 % vzorků označených jako NPMc+), ačkoli je tento protein obvykle soustředěn do buněčných jadérek. Výskyt NPM v cytoplazmě byl dále spojen s normálním karyotypem, s vysokou frekvencí výskytu interních tandemových duplikací v genu FLT3 a s dobrou odpovědí na indukční chemoterapii. Podrobná analýza potom ukázala, že abnormální lokalizace nukleofosminu je způsobena insercí malého počtu (většinou čtyř) nukleotidů v posledním exonu NPM1, která způsobí posun čtecího rámce, ztrátu sekvence zajišťující lokalizaci proteinu v jadérku a obvykle také vytvoření přídavného signálu pro export z jádra. Od vydání této průkopnické práce byla popsána řada různých mutací na 3´-konci genu NPM1, z nichž nejčastější (80 % všech mutací) je označována jako typ A [1, 4, 5]. Jejich následky jsou ovšem podobné a vždy zahrnují změnu lokalizace proteinového produktu [6]. Díky tomu je možné diagnostikovat mutaci nejen pomocí genetického vyšetření, ale také histochemickými nebo imunofluorescenčními metodami (obr. 1). Četné statistické analýzy provedené v posledních deseti letech potvrdily vyšší frekvenci mutací v genu FLT3 a odhalily rovněž častější výskyt mutací DNMT3A a IDH2 [7, 8] u pacientů s mutovaným NPM. Jen vzácně se naopak současně s mutací NPM1 objevují mutace v genech RUNX1, CEBPA a TP53 [9-11].
Obr. 1. Vnitrobuněčná lokalizace nukleofosminu 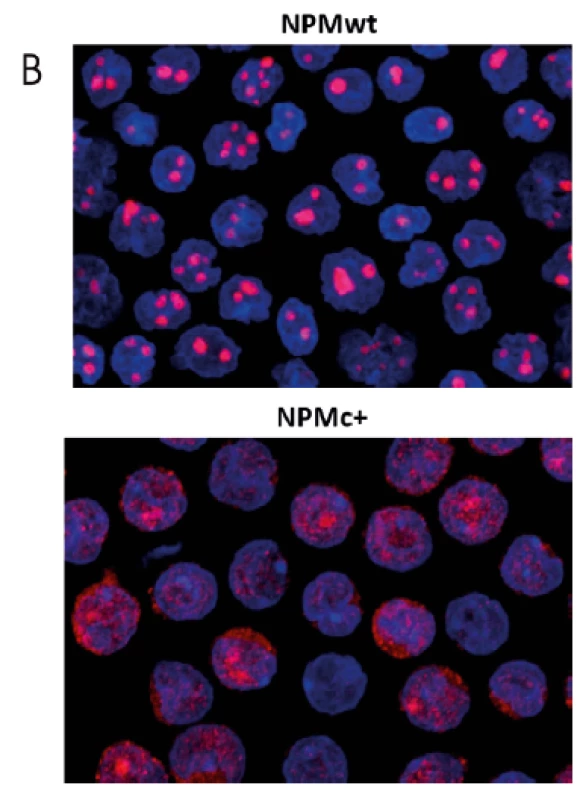
A: Exprese fluorescenčně značených forem nemutovaného (červená) a mutovaného (zelená) nukleofosminu v HEK293T buňkách transfekovaných plazmidy pro expresi obou forem. B: Imunofluorescenční detekce NPM v primárních buňkách AML pacientů. Signál NPM je červený, modře jsou obarvena buněčná jádra. Ve vzorku pacienta s mutací (NPMc+) je patrné obarvení cytoplazmy. Nukleofosmin je multifunkční protein, který se vytváří ve všech buněčných typech a účastní se řady procesů včetně tvorby ribozomů [12], duplikace centrozomu [13], apoptózy [14, 15] a oprav poškozené DNA [16]. Jeho role v hematologických onemocněních je různorodá, může působit jako nádorový supresor i jako onkogen [17]. Na jedné straně NPM zajišťuje sestavení a transport ribozomálních podjednotek [18], podílí se na udržení stability genomu [19, 20], působí jako histonový chaperon [21] a díky interakci s nádorovými supresory p53 a p14ARF zajišťuje odstranění buněk poškozených genotoxickým stresem [22–24]. Na straně druhé je v solidních nádorech často pozorována zvýšená exprese NPM [25] a u hematologických malignit se objevují kromě charakteristických mutací také chromozomální translokace zahrnující gen NPM1 (jejich důsledkem je vznik fuzních proteinů, jako je NPM-ALK [26], NPM--RARalfa [27] nebo NPM-MLF1 [28]). O důležitosti funkce nukleofosminu svědčí i fakt, že homozygotní mutace NPM1 je v myším modelu letální již v embryonálním stadiu [20] a v buňkách AML pacientů je vždy zachována jedna alela divokého typu (NPMwt). Mutace charakteristické pro AML jsou často detekovány již v raných fázích onemocnění a jejich výskyt obvykle přetrvává i v relapsu, takže je NPM i vhodným markerem pro sledování minimální zbytkové nemoci [29].
Přestože mutace NPM pravděpodobně představují iniciační událost ve vývoji AML a vytvářejí proleukemické prostředí, molekulární mechanismy následných změn nejsou známy a jsou jistě složité. Mutovaný NPM si zachovává většinu funkčních domén a lze předpokládat, že i nadále tvoří komplexy s dalšími proteiny [6]. NPM ovlivňuje funkci velkého množství rozličných molekul, pro výsledek jeho působení je zřejmě zásadně důležitá jeho lokalizace a mutovaný protein není ve správný čas na správném místě. Je také možné, že přenášením svých interakčních partnerů do jiných částí buňky brání výkonu jejich přirozené funkce a tím rovněž přispívá k nastolení leukemogenních podmínek. Podobně není dosud známo, proč jsou mutace NPM příznivým prognostickým faktorem pro celkové přežití AML pacientů.
Studiem vlastností nemutovaného i mutovaného nukleofosminu se v ÚHKT dlouhodobě zabýváme. Podrobnou analýzou vnitrobuněčné lokalizace fluorescenčně značených variant NPM jsme například ukázali, že ačkoli izolovaný NPMwt a NPMmut se vyskytují takřka výlučně v jadérku, respektive v cytoplazmě, v AML buňkách s heterozygotní mutací se oba typy navzájem ovlivňují. NPM totiž tvoří oligomery [30], ve kterých se mohou obě formy kombinovat. NPM komplexy se tak vyskytují v jadérku, v cytoplazmě i v nukleoplazmě buněk obsahujících mutovaný NPM. Z našich výsledků i z experimentů dalších autorů plyne, že lokalizace závisí na typu mutace, poměrném množství mutované a nemutované formy a také je například ovlivněna působením léčiv [31–35]. Obrázek 2 ukazuje příklad výrazných změn vyvolaných leptomycinem B (LmB) a aktinomycinem D (actD) na modelových buňkách exprimujících fluorescenčně značené varianty NPMwt (červená) a NPMmut (zelená). LmB je inhibitor proteinu zajišťujícího export z jádra do cytoplazmy a jeho působením se i mutovaný NPM vrací do jader. Naopak actD vyvolává genotoxický stres, rozpuštění jadérek a přesun obou forem NPM do cytoplazmy. V literatuře se objevují návrhy terapeutických postupů založených na zásahu do vnitrobuněčné lokalizace NPM a jeho interakčních partnerů. Látky působící soustředění NPM do jadérka by mohly obnovit normální funkci nemutovaného a možná částečně i mutovaného NPM, včetně proapoptotických účinků, které by zajistily přirozené odstranění transformované buňky. Podobně inhibice interakce mutovaného NPM s dalšími proteiny by mohla do značné míry odstranit jeho vliv na buněčné procesy, což by opět mohlo vést k apoptóze. Na druhou stranu úplné vyřazení funkcí NPM (např. u homozygotních mutantů) buňky nepřežívají a molekuly cílící nemutovaný NPM by mohly při vhodném dávkování selektivně poškozovat transformované buňky s mutovanou alelou, které produkují nemutovaného proteinu méně. Vzhledem ke komplexnosti působení NPM, které zahrnuje pronádorové i protinádorové účinky, je ovšem obtížné předvídat výsledný efekt těchto zásahů, který navíc může záviset na typu buňky. Jak uvidíme dále, cytoplazmatická lokalizace mutovaného NPM může mít i pozitivní následky a její zachování může být důležité pro úspěch léčby.
Obr. 2. Změny lokalizace mutovaného (zelená) a nemutovaného (červená) nukleofosminu v HEK293T buňkách po působení leptomycinu B (LmB) a aktinomycinu D (actD) 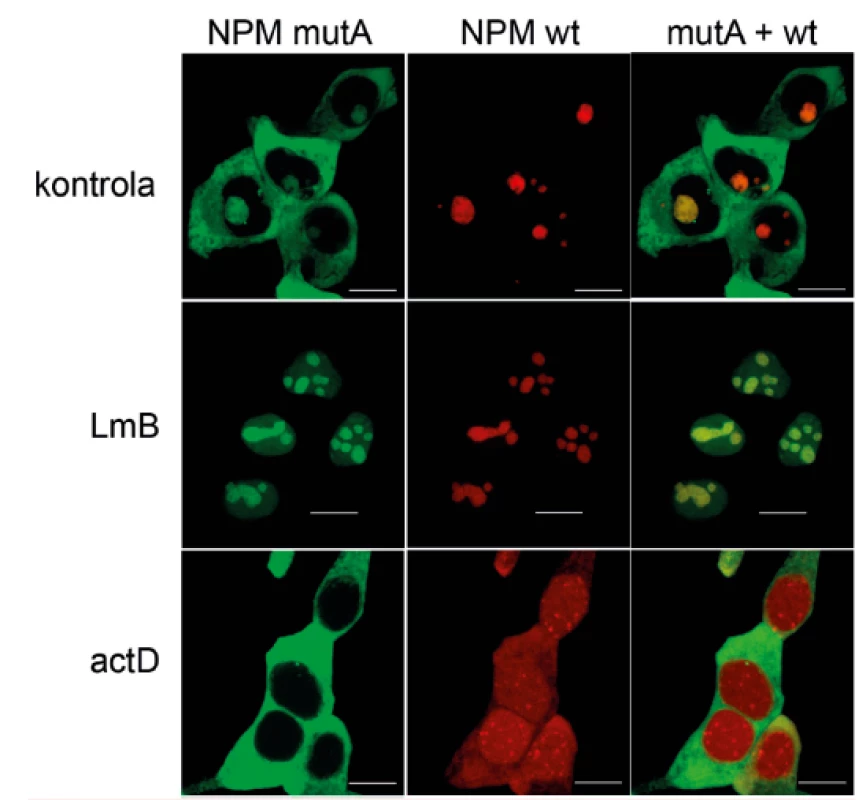
V každém řádku jsou postupně zleva oba signály a jejich překrytí z téhož zorného pole. Úsečka měřítka představuje 10 μm. Možným vysvětlením pozorovaného příznivého vlivu mutace NPM na celkové přežití pacientů je imunitní odpověď namířená proti mutovanému proteinu. Hypotézu, že proti unikátní koncové aminokyselinové sekvenci mutovaného NPM se vytváří spontánní imunitní reakce, jsme se rozhodli otestovat porovnáním frekvence výskytu HLA 1. třídy u pacientů s potvrzenou mutací NPM a u zdravých jedinců. Protože antigeny aktivující specifické cytotoxické lymfocyty jsou vystavovány právě na HLA molekulách 1. třídy, očekávali jsme, že jedinci s vhodným HLA typem by měli být vůči leukemii s mutovaným NPM díky imunitní odpovědi odolnější. Na pilotním souboru pacientů ÚHKT [36] a posléze i na větším souboru z více pracovišť (http://www.bloodjournal.org/content/128/22/5230) jsme pak skutečně nalezli několik alelických skupin HLA 1. třídy se sníženou frekvencí výskytu u NPMmut AML pacientů. Rozdíly mezi pacienty s různým HLA typem se přitom vyskytovaly i v dalším vývoji nemoci. Zajímavý závěr vyplynul z teoretických predikcí možných komplexů HLA molekul s peptidy odvozenými z NPM. Ty totiž ukázaly, že imunitní odpověď s největší pravděpodobností není namířena proti mutované sekvenci jako neoantigenu, ale spíše proti peptidům z nemutovaných částí proteinu. Imunogennost mutovaného NPM tedy zřejmě rovněž souvisí se změnou lokalizace – protein přítomný v cytoplazmě může být snáze zpracován a dopraven do endoplazmatického retikula, kde probíhá navázání imunopeptidů na HLA molekuly.
Naše výsledky ovšem také ukazují, že imunitní odpověď nedokáže rozvoji leukemie zabránit u všech pacientů s vhodným HLA typem, zřejmě v důsledku působení mechanismů podobných těm, které umožňují buňkám pevných nádorů imunitní odpověď potlačit, nebo jí uniknout. Mezi možné scénáře (obr. 3) patří například snížení exprese HLA molekul 1. třídy, snížená schopnost prezentace antigenů, potlačení specifické imunitní odpovědi působením inhibičních receptorů cytotoxických lymfocytů nebo globální utlumení funkce imunitních buněk prostřednictvím chemokinů. V současné době proto vyšetřujeme soubor markerů působení imunosupresivních mechanismů u AML pacientů. Pro určení fenotypu leukemických blastů a různých druhů imunitních buněk průtokovou cytometrií je třeba mít k dispozici čerstvé nebo zamražené intaktní buňky. V některých případech je ale možné použít i alternativní metody, které umožňují retrospektivní vyšetření uchovaných vzorků nukleových kyselin. Takový postup s využitím polymerázové řetězové reakce (PCR) jsme vypracovali pro analýzu povrchové exprese ligandu jednoho z inhibičních receptorů, PD-L1 [37], a použili ho pro vyšetření 55 vzorků AML pacientů se vstupní leukocytózou (http://www.bloodjournal.org/content/128/22/5229). Tato analýza ukázala, že pouze 14 pacientů mělo nízkou hladinu PD-L1 a pouze u pacientů s mutovaným NPM měla nízká exprese PD-L1 příznivý vliv na celkové přežití. Pilotní výsledky našich dalších stanovení jsou také v souladu s představou, že imunosupresivní mechanismy známé především ze studií na pevných nádorech působí i u AML a že u pacientů s mutovaným NPM mají tyto mechanismy vliv na vývoj nemoci.
Obr. 3. Schematické znázornění vybraných mechanismů, kterými nádorové buňky unikají před zásahem imunitního systému 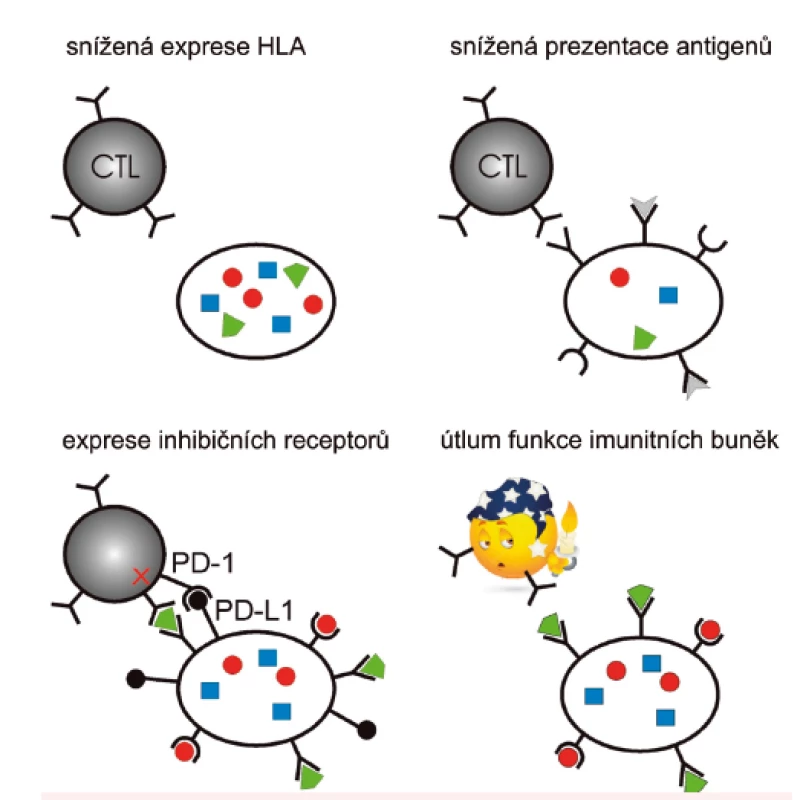
Cytotoxické T-lymfocyty (CTL) rozeznávají na povrchu nádorových buněk antigeny (barevné obrazce) vystavené na HLA molekulách. CTL mohou kromě T-cell receptoru exprimovat také inhibiční receptory, např. PD-1, které po navázání na ligandy na nádorových buňkách brání spuštění cytotoxické akce. Příklad nukleofosminu a jeho specifických mutací poukazuje na význam porozumění molekulárním mechanismům vzniku a perzistence nádorových onemocnění pro možnost jejich individuální léčby. Vzhledem k závažnosti onemocnění AML a vysoké frekvenci výskytu charakteristických mutací NPM může například aplikace vhodné formy imunoterapie významně přispět ke zvýšení účinnosti léčby. Znalost leukemogenních procesů spojených s mutacemi NPM je také potenciálně využitelná pro vývoj nových cílených terapeutik.
Použité zkratky
actD – aktinomycin D
AML – akutní myeloidní leukemie
HLA – human leukocyte antigen
LmB – leptomycin B
MRN – minimální reziduální nemoc
NPM – nukleofosmin
NPM1 – gen pro nukleofosmin
ÚHKT – Ústav hematologie a krevní transfuze
Podíl autorů na přípravě rukopisu
KK – námět a příprava rukopisu
BB – námět a příprava rukopisu
PS – léčba pacientů
Poděkování
Výzkum role imunitní odpovědi proti nukleofosminu ve vývoji AML je podpořen grantem 16-30268A (AZV MZd ČR).
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
RNDr. Kateřina Kuželová, Ph.D.
Oddělení proteomiky
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: kuzel@uhkt.cz
Zdroje
1. Dohner K, Schlenk RF, Habdank M, et al. Mutant nucleophosmin (NPM1) predicts favorable prognosis in younger adults with acute myeloid leukemia and normal cytogenetics: interaction with other gene mutations. Blood 2005;106 : 3740–3746.
2. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127 : 2391–2405.
3. Falini B, Mecucci C, Tiacci E, et al. Cytoplasmic nucleophosmin in acute myelogenous leukemia with a normal karyotype. N Engl J Med 2005;352 : 254–266.
4. Schnittger S, Schoch C, Kern W, et al. Nucleophosmin gene mutations are predictors of favorable prognosis in acute myelogenous leukemia with a normal karyotype. Blood 2005;106 : 3733–3739.
5. Thiede C, Koch S, Creutzig E, et al. Prevalence and prognostic impact of NPM1 mutations in 1485 adult patients with acute myeloid leukemia (AML). Blood 2006;107 : 4011–4020.
6. Bolli N, Nicoletti I, De Marco MF, et al. Born to be exported: COOH-terminal nuclear export signals of different strength ensure cytoplasmic accumulation of nucleophosmin leukemic mutants. Cancer Res 2007;67 : 6230–6237.
7. Yang L, Rau R, Goodell MA. DNMT3A in haematological malignancies. Nat Rev Cancer 2015;15 : 152–165.
8. Papaemmanuil E, Gerstung M, Bullinger L, et al. Genomic classification and prognosis in acute myeloid leukemia. N Engl J Med 2016;374 : 2209–2221.
9. Falini B, Mecucci C, Saglio G, et al. NPM1 mutations and cytoplasmic nucleophosmin are mutually exclusive of recurrent genetic abnormalities: a comparative analysis of 2562 patients with acute myeloid leukemia. Haematologica 2008;93 : 439–442.
10. Gaidzik VI, Bullinger L, Schlenk RF, et al. RUNX1 mutations in acute myeloid leukemia: results from a comprehensive genetic and clinical analysis from the AML study group. J Clin Oncol 2011;29 : 1364–1372.
11. Hou HA, Chou WC, Kuo YY, et al. TP53 mutations in de novo acute myeloid leukemia patients: longitudinal follow-ups show the mutation is stable during disease evolution. Blood Cancer J 2015;5:e331.
12. Itahana K, Bhat KP, Jin A, et al. Tumor suppressor ARF degrades B23, a nucleolar protein involved in ribosome biogenesis and cell proliferation. Mol Cell 2003;12 : 1151–1164.
13. Okuda M. The role of nucleophosmin in centrosome duplication. Oncogene 2002;21 : 6170–6174.
14. Enomoto T, Lindstrom MS, Jin A, Ke H, Zhang Y. Essential role of the B23/NPM core domain in regulating ARF binding and B23 stability. J Biol Chem 2006;281 : 18463–18472.
15. Kurki S, Peltonen K, Laiho M. Nucleophosmin, HDM2 and p53: players in UV damage incited nucleolar stress response. Cell Cycle 2004;3 : 976–979.
16. Vascotto C, Fantini D, Romanello M, et al. APE1/Ref-1 interacts with NPM1 within nucleoli and plays a role in the rRNA quality control process. Mol Cell Biol 2009;29 : 1834–1854.
17. Colombo E, Alcalay M, Pelicci PG. Nucleophosmin and its complex network: a possible therapeutic target in hematological diseases. Oncogene 2011;30 : 2595–2609.
18. Yu Y, Maggi LB, Jr, Brady SN, et al. Nucleophosmin is essential for ribosomal protein L5 nuclear export. Mol Cell Biol 2006;26 : 3798–3809.
19. Wang W, Budhu A, Forgues M, Wang XW. Temporal and spatial control of nucleophosmin by the Ran-Crm1 complex in centrosome duplication. Nat Cell Biol 2005;7 : 823–830.
20. Grisendi S, Bernardi R, Rossi M, et al. Role of nucleophosmin in embryonic development and tumorigenesis. Nature 2005;437 : 147–153.
21. Okuwaki M, Matsumoto K, Tsujimoto M, Nagata K. Function of nucleophosmin/B23, a nucleolar acidic protein, as a histone chaperone. FEBS Lett 2001;506 : 272–276.
22. Colombo E, Bonetti P, Lazzerini Denchi E, et al. Nucleophosmin is required for DNA integrity and p19Arf protein stability. Mol Cell Biol 2005;25 : 8874–8886.
23. Lambert B, Buckle M. Characterisation of the interface between nucleophosmin (NPM) and p53: potential role in p53 stabilisation. FEBS Lett 2006;580 : 345–350.
24. Kurki S, Peltonen K, Latonen L, et al. Nucleolar protein NPM interacts with HDM2 and protects tumor suppressor protein p53 from HDM2-mediated degradation. Cancer Cell 2004;5 : 465–475.
25. Grisendi S, Mecucci C, Falini B, Pandolfi PP. Nucleophosmin and cancer. Nat Rev Cancer 2006;6 : 493–505.
26. Morris SW, Kirstein MN, Valentine MB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in non-Hodgkin‘s lymphoma. Science 1994;263 : 1281–1284.
27. Redner RL, Rush EA, Faas S, Rudert WA, Corey SJ. The t(5;17) variant of acute promyelocytic leukemia expresses a nucleophosmin-retinoic acid receptor fusion. Blood 1996;87 : 882–886.
28. Yoneda-Kato N, Look AT, Kirstein MN, et al. The t(3;5)(q25.1;q34) of myelodysplastic syndrome and acute myeloid leukemia produces a novel fusion gene, NPM-MLF1. Oncogene 1996;12 : 265–75.
29. Dvořáková D, Ráčil Z, Ježíšková I, et al. Monitoring of minimal residual disease in acute myeloid leukemia with frequent and rare patient-specific NPM1 mutations. Am J Hematol 2010;85 : 926–929.
30. Bolli N, De Marco MF, Martelli MP, et al. A dose-dependent tug of war involving the NPM1 leukaemic mutant, nucleophosmin, and ARF. Leukemia 2009;23 : 501–509.
31. Brodská B, Holoubek A, Otevřelová P, Kuželová K. Low-dose actinomycin-D induces redistribution of wild-type and mutated nucleophosmin followed by cell death in leukemic cells. J Cell Biochem 2016;117 : 1319–1329.
32. Brodská B, Kráčmarová M, Holoubek A, Kuželová K. Localization of AML-related nucleophosmin mutant depends on its subtype and is highly affected by its interaction with wild-type NPM. PLoS One 2017;12: e0175175.
33. Chan PK, Bloom DA, Hoang TT. The N-terminal half of NPM dissociates from nucleoli of HeLa cells after anticancer drug treatments. Biochem Biophys Res Commun 1999;264 : 305–309.
34. Martelli MP, Gionfriddo I, Mezzasoma F, et al. Arsenic trioxide and all-trans retinoic acid target NPM1 mutant oncoprotein levels and induce apoptosis in NPM1-mutated AML cells. Blood 2015;125 : 3455–3465.
35. El Hajj H, Dassouki Z, Berthier C, et al. Retinoic acid and arsenic trioxide trigger degradation of mutated NPM1, resulting in apoptosis of AML cells. Blood 2015;125 : 3447–3454.
36. Kuželová K, Brodská B, Fuchs O, Dobrovolná M, Soukup P, Cetkovský P. Altered HLA class I profile associated with type A/D nucleophosmin mutation points to possible anti-nucleophosmin immune response in acute myeloid leukemia. PLoS One 2015;10:e0127637.
37. Brodská B, Otevřelová P, Kuželová K. Correlation of PD-L1 surface expression on leukemia cells with the ratio of PD-L1 mRNA variants and with electrophoretic mobility. Cancer Immunol Res 2016;4 : 815–819.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo Supplementum1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
- Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
- Každý obor potřebuje svůj ústav excelence
- Využití molekulárně cytogenetických technik při analýze chromozomových aberací u hematologických malignit
- Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfuze (1986–2016)
- Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Dysfibrinogenemie a afibrinogenemie v České republice
- Transfuze a imunohematologie v ÚHKT
- Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




