-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
Standard and large volume leukapheresis of peripheral blood progenitor cells using the new Spectra Optia continuous mononuclear cell collection protocol
Background:
The aim of the study was to evaluate and optimize the new protocol for continuous mononuclear cell collection (CMNC) Spectra Optia v. 11 (Terumo) which was used for PBPC collections in patients with haemato-oncological diseases. The results of 159 autologous PBPC collections were evaluated in the case of: (a) well mobilized patients with pre-collection CD 34+ cell concentration in blood higher than 20/μl, (b) only the first collections performed either using CMNC Spectra Optia v. 11 or Cobe Spectra v. 6, v. 7, Terumo (c) collections were performed in the Standard and Large volume Leukapheresis regimen, LVL. Engraftment data from 56 transplanted patients were assessed.Results:
Standard collections were performed in 52 patients. The yield of CD 34+ cells was high, and no significant differences were found between the numbers of CD 34+ cells prepared using Spectra Optia 8.6 (1.3–41) × 106 and Cobe Spectra 10.9 (1.8–45.6) × 106 /kg b. w. (a = 0.05; p = 0.619). The dependence of CD 34+ cell yield on the pre-collection concentration of CD 34+ cells in blood can be considered as linear with high correlation coefficients in CMNC Spectra Optia R = 0.95, and Cobe Spectra R = 0.93.
LVL collections were performed in 107 patients and there were no significant differences between the numbers of CD 34+ cells prepared using CMNC Spectra Optia 10.9 (2-61.2)× 106 and Cobe Spectra 9.3 (2.4-86) × 106 /kg b.w. (a = 0.05; p = 0.35). The relationship between the pre-collection CD 34+ cell concentration in blood and the numbers of CD 34+ cells collected could also be considered as linear with the correlation coefficients in CMNC Spectra Optia R = 0.93, and Cobe Spectra R = 0.78, respectively. In LVL, the median platelet loss was significantly lower in CMNC Spectra Optia (45%) than in Cobe Spectra (57%). Twelve patients were transplanted using PBPC prepared in the standard regimen and 44 using PBPC from LVL. Median time to neutrophil reconstitution in the standard regimen was 11 days for both CMNC Spectra Optia and Cobe Spectra, while platelet reconstitution was 14 days for CMNC and 12 days for Cobe Spectra. The median time to neutrophil and platelets reconstitution in LVL was the same for CMNC Spectra Optia and, corresponding to 11 and 13 days, respectively.Conclusions:
The CMNC Spectra Optia protocol is a modern, efficient and safe system that can be used for both Standard and LVL procedures. In well mobilized patients, a sufficient dose of CD 34+ cells for transplantation could be prepared from one Standard or one LVL procedure. No serious adverse reactions have been observed.KEY WORDS:
PBPC – autologous PBPC transplantation – CD 34+ cells – standard and large volume leukapheresis (LVL) – Optia CMNC
Autoři: Z. Gašová 1,2; B. Vacková 3; Z. Bhuiyan-Ludvíková 1; M. Böhmová 1; M. Slouková 1; I. Marinov 4; P. Pecherková 1
Působiště autorů: Ústav hematologie a krevní transfuze, Praha 1; Ústav klinické a experimentální hematologie, Praha 2; I. interní klinika – klinika hematologie, Všeobecná fakultní nemocnice a 1. LF UK, Praha 3; Ústav hematologie a krevní transfuze, Laboratoř průtokové cytometrie, Praha 4
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 94-104.
Kategorie: ZVLÁŠTNÍ VYDÁNÍ SUPLEMENTU K 65. VÝROČÍ ÚHKT
Souhrn
Úvod:
Cílem práce bylo zavedení a optimalizace nového separačního protokolu pro kontinuální separaci mononukleárních buněk (CMNC) Spectra Optia v. 11 při přípravě štěpů PBPC pro autologní transplantace u pacientů s hematoonkologickými maligními onemocněními. Vyhodnocovali jsme výsledky 159 separací PBPC u:
- a) jen dobře mobilizovaných pacientů s předseparační koncentrací CD 34+ buněk v krvi vyšší než 20 v μl;
- b) pouze prvních separací provedených buď za pomoci CMNC Spectra Optia v. 11, nebo na přístrojích Cobe Spectra v. 6, v. 7;
- c) za použití standardního a velkoobjemového (LVL) režimu;
- d) u následně transplantovaných 56 pacientů jsme sledovali dobu přihojení štěpu v počtu neutrofilních leukocytů a trombocytů.
U 107 pacientů, u nichž se prováděly LVL, nebyly nalezeny významné rozdíly mezi obsahem CD 34+ buněk připravených v LVL režimu na přístrojích Spectra Optia 10,9 (2–61,2) × 106 a Cobe Spectra 9,3 (2,4–86) × 106/kg příjemce (a = 0,05; p = 0,35). Při hodnocení vztahu výtěžku CD 34+ buněk a jejich předseparační koncentrace v krvi byly hodnoty korelačního koeficientu u CMNC Spectra Optia R = 0,93 a u Cobe Spectra R = 0,78. Z výsledků lze uzavřít, že hodnota předseparační koncentrace CD 34+ buněk v krvi je významným ukazatelem účinnosti mobilizace a lze z ní odhadnout pravděpodobný výtěžek buněk ze standardní a LVL separace. U LVL separací byl medián ztráty trombocytů významně nižší u CMNC Spectra Optia (45 %) než u Cobe Spectra (57 %). U 12 pacientů byla provedena autologní transplantace s podáním PBPC připravených v standardním režimu, zatímco ostatním 44 pacientům byly podány buňky připravené technikou LVL. Medián doby přihojení v počtu neutrofilních leukocytů a trombocytů u přípravků ze standardního režimu byl u CMNC Spectra Optia a Cobe Spectra 11 dnů, v počtu trombocytů u CMNC 14 dnů a u Cobe Spectra 12 dnů. U přípravků z LVL režimu byl medián doby přihojení v počtu neutrofilních leukocytů a trombocytů u PBPC u obou přístrojů shodný a činil 11 dnů a 13 dnů.Závěr:
CMNC protokol Spectra Optia v. 11 je moderní, účinný a bezpečný systém, který vyhovuje pro provádění jak standardních tak LVL separací. U dobře mobilizovaných pacientů lze pomocí nového protokolu CMNC připravit potřebnou dávku CD 34+ buněk z jedné standardní nebo z jedné LVL separace. V průběhu výkonů jsme nezaznamenali žádné závažné nežádoucí reakce.KLÍČOVÁ SLOVA:
PBPC – autologní transplantace PBPC – CD 34+ buňky – standardní a velkoobjemové (LVL) separace PBPC – Optia CMNCÚVOD
Krvetvorné buňky z periferní krve (PBPC) se připravují pro terapii závažných genetických a neoplastických onemocnění. Lze je získat jak od zdravých dárců, kteří darují PBPC pro nemocné (PBPC pro alogenní transplantaci), tak i od nemocných, kdy nemocný daruje krvetvorné buňky pro svoji terapii (PBPC pro autologní transplantaci). Autologní PBPC se nejčastěji využívají pro terapii nemocných s Hodgkinovým lymfomem, non-Hodgkinovými lymfomy a s mnohočetným myelomem. Krvetvorné buňky exprimují na svém povrchu glykoprotein CD 34 a podávají se nemocným po vysokodávkované chemoterapii k obnově krvetvorných a imunitních funkcí.
PBPC se připravují technikou hemaferézy (leukocytaferézy) po předchozí mobilizaci CD 34+ buněk z kostní dřeně do krve. Kvalita přípravku krvetvorných buněk závisí na účinnosti mobilizace, na správném načasování separací a na volbě separačního postupu. Optimální separační režim nebyl doposud definován, avšak separace PBPC se provádějí buď ve standardním režimu, při němž se zpracovávají 2–3 celkové objemy krve nemocného, nebo ve velkoobjemovém režimu (LVL), kdy se zpracovávají více než tři objemy krve nemocného [1–12]. Cílem separačních postupů je příprava terapeutické dávky CD 34+ buněk pro transplantaci v hodnotě minimálně 2,5 × 106/kg příjemce, optimálně 5 × 106/kg/příjemce.
V roce 1992 jsme v Ústavu hematologie a krevní transfuze zavedli separace PBPC za pomoci přístrojů Cobe Spectra (Gambro, Caridian, Terumo). U dárců a pacientů jsme nejprve prováděli standardní separace s přípravou vyhovující dávky CD 34+ buněk pro transplantaci. Postupně jsme zavedli účinnější „velkoobjemovou techniku“ (LVL, large volume leukapheresis), která pomohla připravit vyšší dávky CD 34+ buněk než standardní režim, vedla k snížení počtu separací a především umožnila připravit potřebnou dávku buněk i u pacientů s nedostatečnou mobilizací. V průběhu LVL výkonů jsme nezaznamenali žádné závažné komplikace, a proto jsme je začali provádět ve všech situacích, kdy je dárci nebo pacienti mohli tolerovat [9, 13]. LVL jsme prováděli za použití postupu pro poloautomatizovanou kontinuální separaci. V průměru bylo možné připravit potřebnou dávku CD 34+ buněk 5 × 106 vztaženou na kilogram hmotnosti příjemce z jednoho, nanejvýše ze dvou výkonů. U pacientů s nedostatečným efektem mobilizace jsme pomocí LVL režimu mohli připravit alespoň minimální dávku CD 34+ buněk pro transplantaci [11].
V průběhu roku 2015 výrobce ukončil podporu Cobe Spectra a bylo nezbytné zavést přípravu PBPC za pomoci nové techniky. Potřebovali jsme urychleně získat zkušenosti s novými typy přístrojů a připravit minimálně stejně kvalitní štěpy pro transplantace, včetně záruky rychlého a dlouhodobého přihojení transplantovaných buněk. Současně byl v roce 2015 uvolněn nový protokol pro kontinuální poloautomatizovanou separaci mononukleárních buněk „CMNC“ na přístroji Spectra Optia v. 11 [12]. Ve stejném roce jsme proto zahájili separace PBPC za použití nového protokolu „CMNC“. Hodnotili jsme výsledky autologních standardních a LVL separací PBPC, které jsme prováděli v letech 2015–2016 za pomoci protokolu CMNC na přístrojích Spectra Optia v. 11 a za pomoci stávajícího kontinuálního poloautomatizovaného režimu na Cobe Spectra v. 6 a v. 7.
Cíl
Cílem práce bylo zavedení a optimalizace nového separačního postupu CMNC Spectra Optia v. 11 pro přípravu kvalitního štěpu PBPC s vyhovujícím počtem krvetvorných buněk a s jejich dostatečnou funkční kapacitou pro transplantace. Separace jsme prováděli u pacientů s hematoonkologickými maligními onemocněními.
Ověřovali jsme a porovnávali výsledky autologních standardních a velkoobjemových separací PBPC, které jsme prováděli za pomoci protokolu CMNC na separátorech Spectra Optia v. 11 a za pomoci stávajícího poloautomatizovaného režimu pro kontinuální separaci na přístrojích na Cobe Spectra v. 6 a v. 7 (Terumo). Vyhodnocovali jsme výsledky separací PBPC u:
- a) jen dobře mobilizovaných pacientů s předseparační koncentrací CD 34+ buněk v krvi vyšší než 20 v µl;
- b) pouze prvních separací provedených buď za pomoci CMNC Spectra Optia v. 11, nebo Cobe Spectra v. 6, v. 7;
- c) za použití standardního a velkoobjemového režimu ( LVL).
- d) u následně transplantovaných pacientů jsme sledovali dobu přihojení štěpu v počtu neutrofilních leukocytů a trombocytů.
PACIENTI, METODY
Pacienti byli indikováni k autologním separacím PBPC před plánovanou vysokodávkovanou chemoterapií při onemocnění mnohočetný myelom, Hodgkinův lymfom a non-Hodgkinské lymfomy (lymfom z plášťových buněk, difuzní velkobuněčný B lymfom a folikulární lymfom). Mobilizační příprava spočívala nejčastěji v podání kombinací chemoterapie (Cyklofosfamid, Matrix, R-ESHAP, R-IVE, R-HD-AraC) a rh-G-CSF (Neupogen) v dávce 10 µg/kg/den s.c.
V průběhu standardních výkonů jsme zpracovávali 2–2,9 objemů krve pacientů za použití antikoagulace s ACD-A, ratio 14. U velkoobjemových separací jsme zpracovávali 3 a více objemů krve pacientů za pomoci kombinované antikoagulace ACD-A a heparinu, ratio 24, podle postupu, který jsme zavedli a používáme na našem pracovišti.
Pacienti byli indikováni k standardním nebo LVL separacím podle jejich aktuálního klinického stavu, parametrů krevního obrazu, výsledků koagulačních vyšetření, funkce jater, ledvin a stavu kardiorespiračního systému. Velkoobjemové separace se provádějí ve výrazně vyšším rozsahu než standardní výkony a v jejich průběhu může nastat významný pokles hladin K+, Ca2+ , Mg2+ v séru, v počtu trombocytů a může nastat ovlivnění parametrů koagulace. Použití vyšších průtokových rychlostí představuje zvýšenou zátěž pro kardiorespirační systém.
Před provedením LVL měli mít pacienti vyšší počet trombocytů než 50 × 109/l, hodnotu hematokritu vyšší než 28 %, vyhovující parametry mineralogramu, koagulačních testů, funkcí jater, ledvin a kardiorespiračního systému. Pacienti, kteří nemohli splnit doporučená kritéria, byli separováni v standardním režimu. Separace pacientů na jednotlivých typech přístrojů se prováděly podle provozních možností pracoviště. V průběhu výkonů jsme u pacientů monitorovali vitální funkce: tlak krve, tepovou frekvenci, dechovou frekvenci a SpO2.
Do hodnoceného souboru byli vybráni pouze pacienti s účinnou mobilizací, kteří měli hodnoty předseparační koncentrace CD 34+ buněk vyšší než 20/µl. Vyhodnocovali jsme výsledky pouze prvních standardních a prvních velkoobjemových separací PBPC za pomoci buď protokolu CMNC na přístroji Spectra Optia v. 11, nebo za pomoci poloautomatizovaného režimu na přístroji Cobe Spectra v. 6 a 7.
Celkem jsme u 159 pacientů s maligními hematoonkologickými onemocněními provedli a vyhodnotili výsledky 159 separací PBPC (tabulky 1, 2).
Tab. 1. Standardní separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra 
*Věk pacientů je vyjádřen jako medián a interval. Tab. 2. Velkoobjemové (LVL) separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra 
*Věk pacientů je vyjádřen jako medián a interval. Pacienti byli rozděleni do dvou skupin. Do první skupiny jsme zahrnuli 52 pacientů, u nichž jsme provedli 52 standardních výkonů. Na přístroji Spectra Optia jsme vyhodnocovali výsledky 25 výkonů u 25 pacientů, zatímco na přístroji Cobe Spectra jsme hodnotili výsledky 27 výkonů u 27 pacientů (viz tab. 1).
Do druhé skupiny jsme zařadili 107 pacientů, u nichž jsme provedli 107 velkoobjemových separací PBPC. Na přístroji Spectra Optia jsme hodnotili výsledky 63 separací u 63 pacientů a na separátoru Cobe Spectra jsme posuzovali výsledky 44 separací u 44 pacientů (tab. 2).
Stanovení počtu CD 34+ buněk v periferní krvi a v přípravcích a procentuální zastoupení mononukleárních buněk v přípravcích prováděla Laboratoř průtokové cytometrie na přístroji BD FACS Canto. K měření obsahu hemoglobinu, hematokritu a počtu trombocytů v přípravcích jsme použili analyzátor Sysmex XS1000i. V průběhu výkonů jsme sledovali hladiny ionizovaného Ca2+ v séru a frekvenci a závažnost nežádoucích reakcí. U 56 pacientů jsme sledovali doby přihojení štěpů PBPC po autologní transplantaci. Výsledky jsou uváděny v mediánech a jejich intervalech. Statistická hodnocení byla provedena za pomoci Mannova-Whitneyova U testu a F testu, α = 0,05.
VÝSLEDKY
Standardní separace
Ve skupině 52 pacientů separovaných v standardním režimu bylo 13 mužů a 39 žen, ve věku 59 (23–66) let.
Medián předseparační koncentrace CD 34+ buněk v krvi u pacientů separovaných v standardním režimu CMNC Spectra Optia činil 77 (24–376) v µl, zatímco ve skupině pacientů separovaných na Cobe Spectra byl 125 (24–414) – tabulka 3.
Tab. 3. Standardní separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra, předseparační koncentrace CD 34+ buněk v krvi a obsah CD 34+ buněk v přípravku vztažený na kg hmotnosti příjemce 
Výsledky jsou vyjádřeny v mediánech a jejich intervalech. Nebyly nalezeny statisticky významné rozdíly mezi výsledky z CMNC Spectra Optia a Cobe Spectra. Mann-Whitney U test, F test, a = 0,05. U 25 pacientů separovaných na přístroji CMNC Spectra Optia jsme zpracovávali v průběhu jednoho standardního výkonu 13,5 (10,3–17,7) litrů krve, což odpovídalo 2,7násobkům (2,1–2,9) celkového objemu krve pacientů. V průběhu výkonu byl do separačního okruhu aplikován antikoagulační roztok ACD-A 630 (435–1000) ml. U 27 pacientů separovaných na přístroji Cobe Spectra jsme v průběhu jednoho standardního výkonu zpracovali 13,1 (9,3–19,5) litrů krve, což odpovídalo 2,5 (2–2,9) násobkům celkového objemu krve pacientů. Spotřeba ACD-A činila 714 (457–1077) ml. U obou typů přístrojů činily průtokové rychlosti 65 ml/minutu (40–80) – tabulky 1, 4.
Tab. 4. Standardní separace PBPC autologní – separační parametry CMNC Spectra Optia a Cobe Spectra 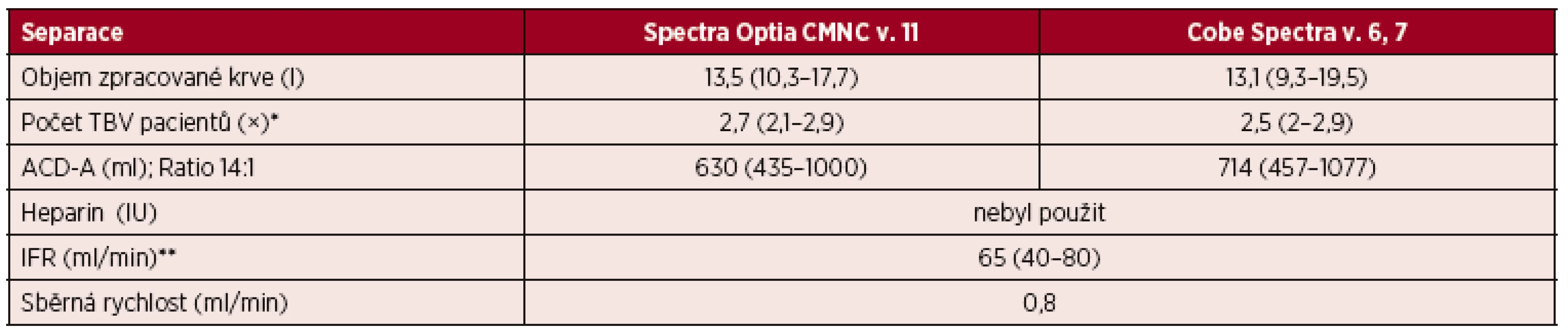
*TBV = Total Blood Volume, tj. celkový objem krve. **IFR = Inlet Flow Rate, tj. vstupní rychlost průtoku krve. Výsledky jsou vyjádřeny v mediánech a jejich intervalech. V standardním režimu jsme připravili u pacientů pomocí CMNC Spectra Optia z jedné separace dávku CD 34+ buněk 8,6 ×106 (1,3–41) vztaženou na kg hmotnosti příjemce, zatímco u Cobe Spectra jsme získali dávku CD 34+ buněk odpovídající 10,9 ×106 (1,8–45,6) vztažených na kg hmotnosti příjemce (viz tab. 3).
Při statistickém porovnávání významnosti rozdílů mezi výsledky předseparačních hodnot CD 34+ buněk v krvi u pacientů separovaných v standardním režimu CMNC Spectra Optia a Cobe Spectra nebyly nalezeny významné rozdíly (α = 0,05; pval = 0,37). Rovněž nebyly nalezeny významné rozdíly mezi obsahem CD 34+ buněk připravených na v standardním režimu na přístrojích CMNC Spectra Optia a Cobe Spectra (α = 0,05; p = 0,619) – viz tabulka 3.
Při hodnocení závislosti výtěžku CD 34 + buněk v přípravcích na předseparační koncentraci CD 34+ buněk v krvi byly u standardních separací u obou typů přístrojů nalezeny vysoké hodnoty korelačních koeficientů, které činily u Spectra Optia R = 0,95 a u Cobe Spectra R = 0,93 (grafy 1 a 2).
Graf 1. Standardní separace PBPC za pomoci protokolu CMNC Spectra Optia v 11 
Závislost výtěžku CD 34+ buněk na předseparační koncentraci CD 34+ buněk v krvi. Graf 2. Standardní separace za pomoci Cobe Spectra v. 6, v. 7 
Závislost výtěžku CD 34+ buněk na předseparační koncentraci CD 34+ buněk v krvi. Velkoobjemové separace
Ve skupině 107 pacientů separovaných ve velkoobjemovém režimu bylo 54 mužů a 53 žen ve věku 59 (19–66) let.
Medián předseparační koncentrace CD 34+ buněk v krvi u pacientů separovaných ve velkoobjemovém režimu CMNC Spectra Optia činil 85 (22–716) v µl, zatímco ve skupině pacientů separovaných na Cobe Spectra byl 78 (21–629) – tabulka 5.
Tab. 5. Velkoobjemové separace PBPC autologní, předseparační koncentrace CD 34+ buněk v krvi a obsah CD 34+ buněk v přípravku vztažený na kg hmotnosti příjemce 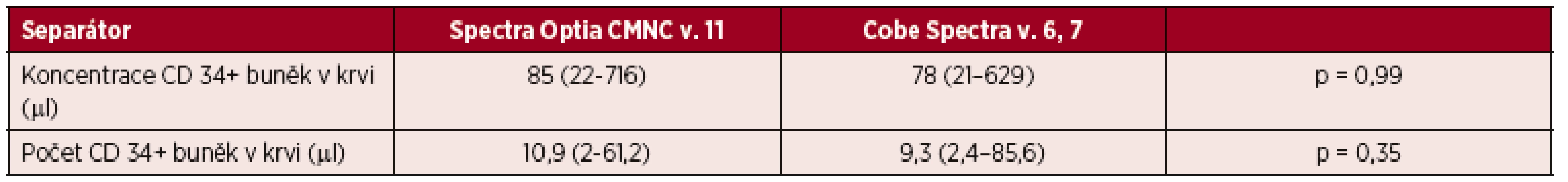
Výsledky jsou vyjádřeny v mediánech a jejich intervalech. Nebyly nalezeny statisticky významné rozdíly mezi výsledky z CMNC Spectra Optia a Cobe Spectra. Mann-Whitney U test, F test, a = 0,05. U 63 pacientů jsme prováděli velkoobjemové separace PBPC za pomoci CMNC Spectra Optia se zpracováním 17,7 l krve (11–21), což odpovídalo 3,5násobkům (3–4,9) celkového objemu krve pacientů. Do separačního okruhu jsme podali ACD-A o objemu 739 ml (435–891) a heparin v dávce 4 122 jednotek (2 094–5 742).
U ostatních 44 pacientů jsme prováděli velkoobjemové separace PBPC na přístroji Cobe Spectra, kdy jsme v průběhu výkonů zpracovali 18 l krve (11–20), což odpovídalo 3,5 násobkům (3–4,5) objemů krve pacientů. Spotřeba ACD-A činila 749 ml (459–893) a heparin byl podán v dávce 4 026 jednotek (3516–5046) – tabulky 2 a 6.
Tab. 6. Velkoobjemové separace (LVL) PBPC autologní – separační parametry CMNC Spectra Optia a Cobe Spectra 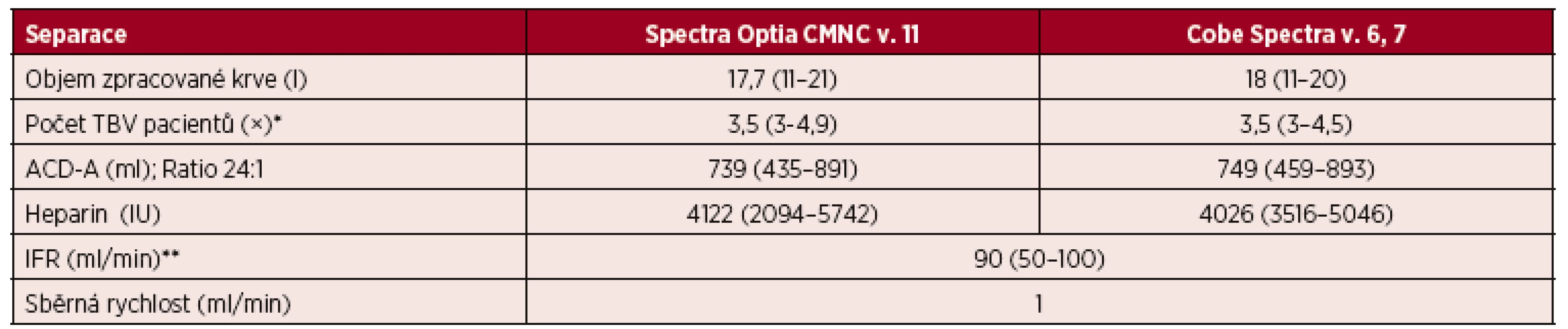
*TBV = Total Blood Volume, tj. celkový objem krve. **IFR = Inlet Flow Rate, tj. vstupní rychlost průtoku krve. Výsledky jsou vyjádřeny v mediánech a jejich intervalech. Ve velkoobjemovém režimu jsme připravili u pacientů pomocí Optia Spectra z jedné separace dávku CD 34+ buněk 10,9 × 106 (2–61,2) vztaženou na kilogram hmotnosti příjemce, zatímco u Cobe Spectra jsme získali dávku CD 34+ buněk odpovídající 9,3 × 106 (2,4–85,6) vztaženým na kilogram hmotnosti příjemce (viz tab. 5).
Při statistickém hodnocení velkoobjemových separací nebyly nalezeny významné rozdíly mezi výsledky předseparačních hodnot CD 34+ buněk v krvi u pacientů separovaných v režimu CMNC Spectra Optia a Cobe Spectra (α = 0,05; p = 0,99), a ani nebyly nalezeny významné rozdíly mezi obsahem CD 34+ buněk připravených na přístrojích CMNC Spectra Optia a Cobe Spectra (α = 0,05; p = 0,35) – viz tab. 5.
Hodnocení závislosti výtěžku CD 34+ buněk v přípravcích na předseparační koncentraci CD 34+ buněk v krvi u velkoobjemových separací vykázalo také vysoké hodnoty korelačních koeficientů, které činily u Spectra Optia R = 0,93 a u Cobe Spectra R = 0,78 (grafy 3 a 4).
Graf 3. Velkoobjemové separace (LVL) PBPC za pomoci protokolu CMNC Spectra Optia v. 11 
Závislost výtěžku CD 34+ buněk na předseparační koncentraci CD 34+ buněk v krvi. Graf 4. Velkoobjemové separace (LVL) za pomoci Cobe Spectra v. 6, v. 7 
Závislost výtěžku CD 34+ buněk na předseparační koncentraci CD 34+ buněk v krvi. Přípravky z velkoobjemových separací obsahovaly nízkou a srovnatelnou příměs erytrocytů. Mediány hodnot hemoglobinu a hematokritu činily pro CMNC Spectra Optia 6 g/l (2–13) a 2 % (0,3–3,6) a pro Cobe Spectra 7 g/l (2–13) a 2 % (0,8–4,5). Procentuální zastoupení MNC v přípravcích z obou typů přístrojů bylo vysoké. U Spectra Optia činil medián MNC buněk 63 % (18–98), zatímco u Cobe Spectra 59 % (20–89) – tabulka 7. Obsah trombocytů v přípravcích z LVL výkonů u Spectra Optia činil 1,6 × 1011 (0,6-8,2) a u Cobe Spectra 1,8 × 1011(0,8–6,3). Tato hodnota se blíží dávce trombocytů v trombocytovém přípravku pro transfuzi (tab. 7). U pacientů separovaných v LVL režimu jsme současně zaznamenali výrazný pokles v počtu trombocytů v cirkulaci. Ztráty trombocytů představovaly u CMNC Spectra Optia 45 % (19–82), zatímco u Cobe Spectra 57 % (34–86). Rozdíly mezi oběma přístroji byly statisticky významné; u CMNC Spectra Optia byly ztráty trombocytů významně nižší než u Cobe Spectra (α = 0,05; pval 0,015) – viz tabulka 7.
Tab. 7. Velkoobjemové (LVL) separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra, složení přípravků PBPC 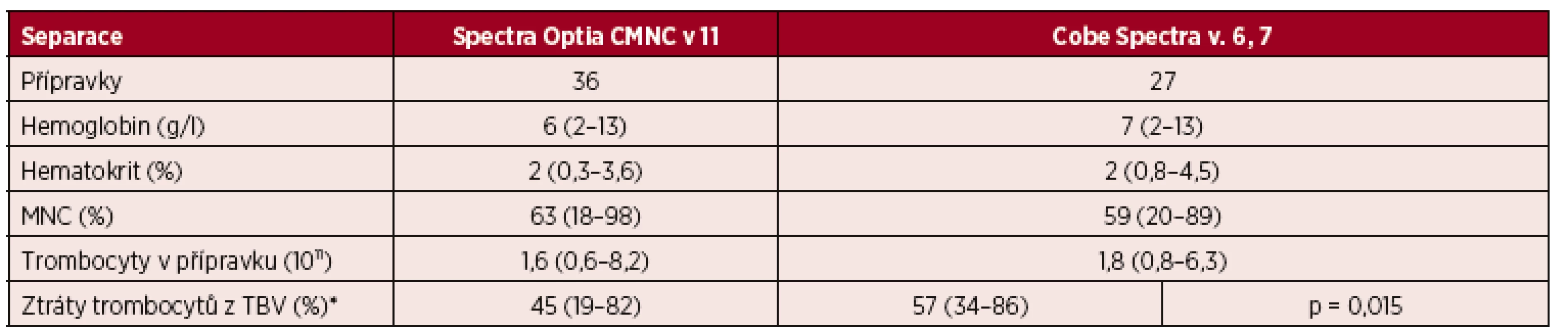
*TBV = Total Blood Volume, tj. celkový objem krve. Výsledky jsou vyjádřeny v mediánech a jejich intervalech. Ztráty trombocytů z TBV vykazují statisticky významné rozdíly mezi CMNC Spectra Optia a Cobe Spectra. Mann-Whitney U test, F test, α = 0,05. V průběhu standardních a LVL separací jsme pacientům profylakticky podávali intravenózní infuzi kalcium glukonicum (10 ml 10% roztoku). U 15 standardních separací CMNC Spectra Optia jsme zaznamenali pokles ionizovaného kalcia (iCa) v séru pacientů o 12 % (4–43), zatímco u 13 výkonů provedených na Cobe Spectra činil pokles 14 % (7–30). V průběhu 39 velkoobjemových výkonů provedených za pomoci CMNC Spectra Optia jsme zaznamenali pokles iCa o 18 % (5–58). U 33 velkoobjemových výkonů na Cobe Spectra došlo k poklesu iCa o 17 % (3–54). Výsledky z obou typů přístrojů jsou u standardních a velkoobjemových separací srovnatelné. U velkoobjemových separací je pokles v hladinách iCa výraznější než u standardních výkonů. Většina pacientů tolerovala uvedený pokles iCa v séru bez klinických obtíží.
Nežádoucí reakce
V roce 2016 jsme sledovali frekvenci a typy nežádoucích reakcí a komplikací v průběhu 137 standardních a velkoobjemových separací PBPC, které jsme provedli u 92 pacientů za použití obou typů přístrojů. U 76 výkonů jsme použili protokol CMNC Spectra Optia a 61 výkonů jsme provedli za použití Cobe Spectra. U 17 pacientů jsme zaznamenali celkem 22 klinicky nezávažných reakcí. V několika případech se u jednoho pacienta současně vyskytly dva typy reakcí nebo komplikací. Některé komplikace byly spíše technické a souvisely s přípravou pacientů k výkonu (omezená funkce centrálního žilního katetru); jiné souvisely spíše s klinickým stavem pacientů (bolesti v kostech, sinusová tachykardie, febrilní stav pacientů a hyposaturace se snížením SpO2). Zbývající reakce vznikly pravděpodobně v souvislosti se zátěží pacientů v průběhu výkonů (hypokalcemie, hypotenze) – tabulka 8. Nežádoucí reakce se podařilo potlačit podáním přípravků kalcia, snížením průtokových rychlostí, podáním O2 a infuze fyziologického roztoku. V průběhu standardních a velkoobjemových separací jsme nepozorovali žádné závažné nežádoucí reakce.
Podání autologních PBPC
U 56 pacientů byla provedena autologní transplantace za pomoci PBPC. Celkem 12 pacientů bylo transplantovaných za pomoci štěpů připravených v standardním režimu na přístrojích CMNC Spectra Optia v. 11 a Cobe Spectra v. 6, v. 7. Podaná dávka CD 34 + buněk činila u CMNC Spectra Optia 7 × 106 (4–21) vztažených na kilogram hmotnosti pacienta a u Cobe Spectra 9 × 106 (4–12) vztažených na kilogram hmotnosti pacienta. Doba přihojení štěpů činila v počtu neutrofilních leukocytů vyšším než 0,5 × 109/l pro CMNC Spectra Optia 11 dnů (9–12) a pro Cobe Spectra 11 dnů (9–12). Doba přihojení štěpu sledovaná vyšším počtem trombocytů než 20, respektive 50 (×109/l) činila u CMNC Spectra Optia 11 (9–13) dnů, respektive 14 dnů (12–16) a pro Cobe 10 dnů (8–13), respektive 12 dnů (10–23) – tabulka 9.
Tab. 8. Nežádoucí reakce v průběhu všech standardních a velkoobjemových (LVL) separací PBPC v roce 2016 – CMNC Spectra Optia v. 11 a Cobe Spectra v. 6, v 7 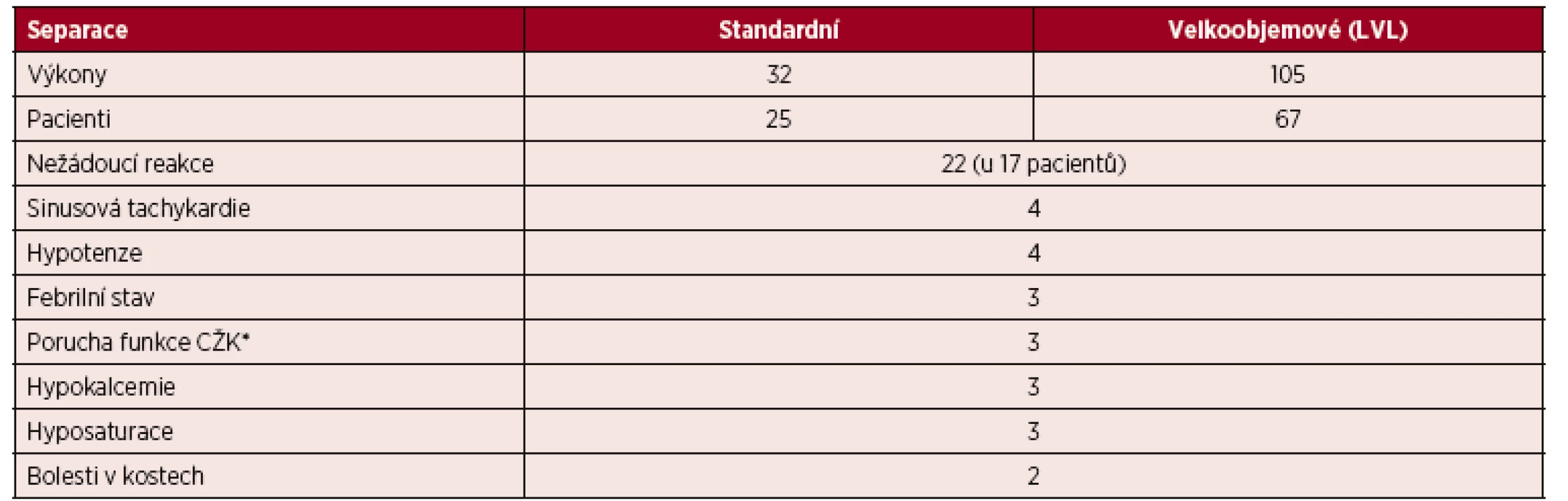
*CŽK=centrální žilní katétr Tab. 9. Standardní separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra, doba přihojení štěpů v počtu neutrofilních leukocytů a trombocytů 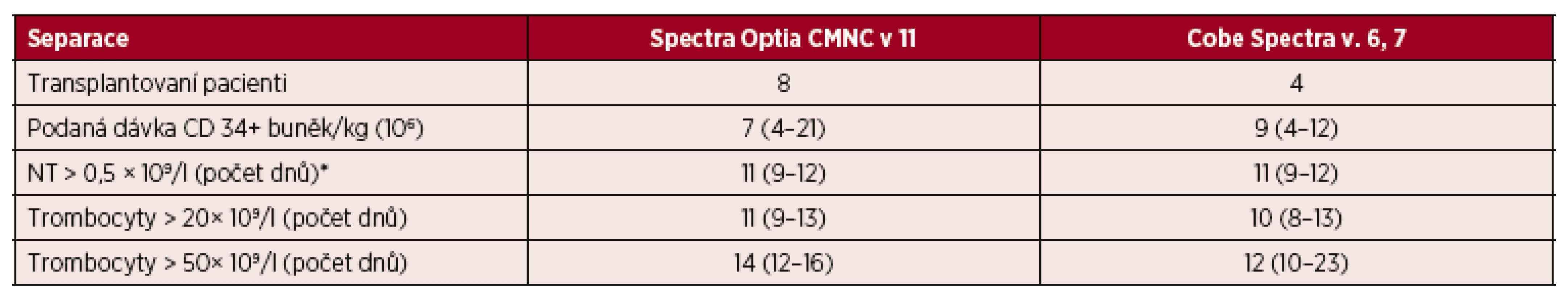
*NT = neutrofilní leukocyty. Výsledky jsou vyjádřeny v mediánech a jejich intervalech. Dalším 44 pacientům byly podány štěpy připravené ve velkoobjemovém režimu pomocí CMNC Spectra Optia v. 11 a Cobe Spectra v. 6, v. 7. Podaná dávka CD 34+ buněk činila u CMNC Spectra Optia 6 × 106 (3–20) vztažených na kilogram hmotnosti pacienta a u Cobe Spectra 8 × 106 (4–41) vztažených na kilogram hmotnosti pacienta. Doba přihojení štěpů v počtu neutrofilních leukocytů vyšším než 0,5×109/l byla pro CMNC Spectra Optia 11 dnů (8–13) a u Cobe Spectra 11 dnů (8–12). Doba přihojení štěpu sledovaná vyšším počtem trombocytů než 20, respektive 50 ×(109/l) činila u CMNC Spectra Optia 11 dnů (9–15) dnů, respektive 13 dnů (9–23) a u Cobe Spectra 11 dnů (9–13), respektive 13 dnů (11–15) – tabulka 10.
Tab. 10. Velkoobjemové separace PBPC autologní – CMNC Spectra Optia a Cobe Spectra, doba přihojení štěpů v počtu neutrofilních leukocytů a trombocytů 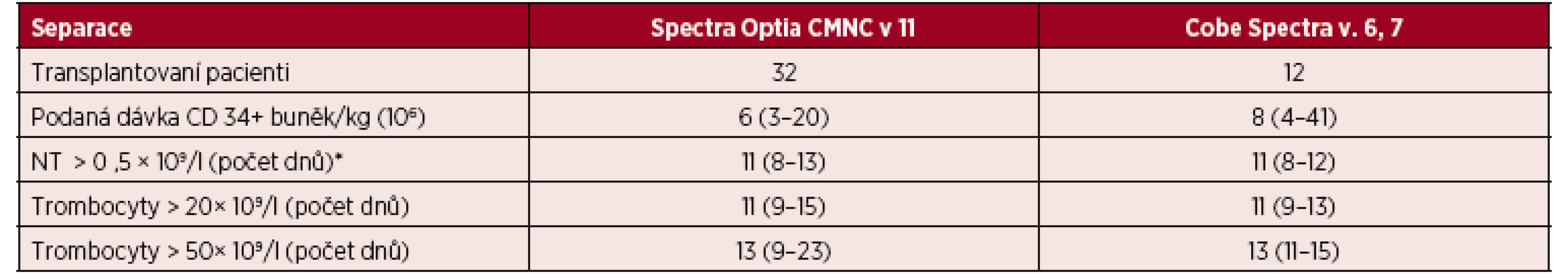
*NT=neutrofilní leukocyty. Výsledky jsou vyjádřeny v mediánech a jejich intervalech. DISKUSE
Autologní transplantace za pomoci PBPC patří již k zavedeným léčebným postupům, které představují terapii první linie u nemocných s mnohočetným myelomem a terapii druhé linie u primárně refrakterního Hodgkinova lymfomu a relabujícího non-Hodgkinova lymfomu [12]. Cílem naší práce bylo ověřit účinnost a bezpečnost nového protokolu CMNC pro separaci PBPC za pomoci Spectra Optia v. 11 a prokázat, že výsledky separací a doby přihojení podaných štěpů přinejmenším odpovídají parametrům buněk připravených na Cobe Spectra v. 6 a v. 7. Hodnotili jsme výsledky 159 standardních a velkoobjemových separací PBPC, které jsme prováděli na přístrojích CMNC Spectra Optia v. 11 a Cobe Spectra v 6 a v. 7.
CMNC postup nepoužívá sběrnou komůrku, která je potřebná pro separaci mononukleárních buněk z periferní krve, program MNC Spectra Optia v. 9. Nový protokol CMNC vychází z modifikace terapeutického postupu pro depleční leukocytaferézu, který umožňuje v průběhu separace upravit úroveň sběru (collection preference) a separovat buffy coat přímo z „kanálu“ centrifugy.
Všichni pacienti v naší studii byli účinně mobilizováni a měli vysoké hodnoty CD 34+ buněk v krvi (viz tab. 3, 5). Těmto nálezům také odpovídaly relativně vysoké výtěžky CD 34+ buněk v přípravcích [8, 14]. Medián obsahu CD 34+ buněk v přípravcích ze standardních i velkoobjemových separací za pomoci CMNC Spectra Optia a Cobe byl vysoký a medián výtěžku buněk z jedné standardní i velkoobjemové separace převyšoval požadovanou dávku 5 × 106 CD 34 + buněk vztažených na kg hmotnosti (viz tab. 3, 5). Z výsledků uvedené pilotní studie vyplývá, že u dobře mobilizovaných pacientů lze získat potřebnou dávku CD 34+ buněk jak z jedné standardní, tak z jedné velkoobjemové separace.
Standardní separace
U pacientů separovaných v standardním režimu jsme neprokázali statisticky významné rozdíly v hodnotách předseparační koncentrace CD 34+ buněk v krvi mezi CMNC Spectra Optia a Cobe Spectra (α = 0,05; pval = 0,37). Obsah CD 34+ buněk v přípravcích byl vysoký a nebyly nalezeny významné rozdíly mezi obsahem CD 34+ buněk připravených na přístrojích Spectra Optia 8,6 × 106 (1,3–41) a Cobe Spectra 10,9 × 106 (1,8–45,6) vztažených na kilogram hmotnosti příjemce (α = 0,05; pval 0,619) – viz tabulka 3.
Při hodnocení vztahu výtěžku CD 34+ buněk a jejich předseparační koncentrace v krvi byly hodnoty korelačního koeficientu vysoké u obou typů přístrojů; u CMNC Spectra Optia činil R = 0,95 a u Cobe Spectra R = 0,93 – viz grafy 1 a 2). Z uvedených výsledků lze uzavřít, že hodnota předseparační koncentrace CD 34+ buněk v krvi je u standardních výkonů významným ukazatelem účinnosti mobilizace a lze z ní odhadnout pravděpodobný výtěžek buněk ze separace [8, 12].
Velkoobjemové separace
U pacientů, u nichž se prováděly separace ve velkoobjemovém režimu, jsme rovněž nenalezli statisticky významné rozdíly v hodnotách předseparační koncentrace CD 34+ buněk v krvi mezi CMNC Spectra Optia a Cobe Spectra (α = 0,05; p = 0,99). Rovněž nebyly nalezeny významné rozdíly mezi obsahem CD 34+ buněk připravených ve velkoobjemovém režimu na přístrojích Spectra Optia 10,9 × 106 (2–61,2) a Cobe Spectra 9,3 × 106 (2,4–86) vztažených na kilogram hmotnosti příjemce (α = 0,05; p = 0,35) – viz tabulka 5.
Při hodnocení vztahu výtěžku CD 34+ buněk a jejich předseparační koncentrace v krvi byly hodnoty korelačního koeficientu také vysoké; u CMNC Spectra Optia činil R = 0,93 a u Cobe Spectra R = 0,78 (viz grafy 3 a 4). Vztah výtěžku CD 34+ buněk a předseparační koncentrace ukazuje obdobně na jejich velmi dobrou závislost, při níž lze z hodnoty předseparační koncentrace CD 34+ buněk v krvi předem odhadnout pravděpodobnou dávku CD 34+ buněk z jedné velkoobjemové separace. U velkoobjemových separací za pomoci CMNC Spectra Optia se však výsledky zdají být více konzistentní než u Cobe Spectra a také hodnota korelačního koeficientu je vyšší při použití Spectra Optia ve srovnání s Cobe Spectra (viz grafy 3 a 4).
Koncentráty PBPC z velkoobjemových separací u obou typů přístrojů obsahovaly vysoké procento mononukleárních buněk a měly přijatelnou příměs erytrocytů a trombocytů. Je však třeba počítat s tím, že v průběhu velkoobjemových separací dochází u pacientů k významnému poklesu počtu trombocytů. Statistická hodnocení našeho souboru ukázala, že ztráty trombocytů jsou významně nižší při použití CMNC Spectra Optia (45 %) než u Cobe Spectra (57 %). Z tohoto hlediska lze CMNC program Spectra Optia považovat za bezpečnější než systém Cobe Spectra (viz tab. 7).
V průběhu velkoobjemových výkonů jsme zaznamenali výraznější pokles hladiny ionizovaného kalcia v séru pacientů ve srovnání se standardními výkony. Většina pacientů však tento pokles tolerovala bez klinických obtíží (viz tab. 8).
U 56 autologně transplantovaných pacientů byly doby přihojení štěpů v počtu neutrofilních leukocytů a trombocytů uspokojivé. Výsledky budou dále sledovány a statisticky vyhodnocovány (viz tab. 9, 10).
Standardní a velkoobjemové separace krvetvorných buněk z periferní krve patří k náročným hemaferetickým postupům. V jejich průběhu se zpracovávají mimořádně velké objemy krve a podávají se vyšší dávky antikoagulačních roztoků. Antikoagulační přípravky působí buď převážně v extrakorporálním okruhu (ACD-A), nebo se do separačního okruhu ještě přidávají látky se systémovým účinkem, jako je heparin. V průběhu výkonů může dojít k významnému poklesu parametrů krevního obrazu, zvláště trombocytů, hladin minerálů v séru a k ovlivnění výsledků koagulace [13, 14, 15, 16]. U pacientů se během výkonů doporučuje monitorování vitálních funkcí.
Výsledky pilotní studie ukázaly, že CMNC protokol Spectra Optia v. 11 je moderní, účinný a bezpečný systém, který vyhovuje pro provádění jak standardních, tak velkoobjemových separací PBPC. V závislosti na předseparační koncentraci CD34+ buněk v krvi bylo možné u dobře mobilizovaných pacientů připravit potřebnou dávku CD 34+ buněk z jedné standardní nebo z jedné velkoobjemové separace. V průběhu standardních a velkoobjemových výkonů jsme neprokázali významné rozdíly v obsahu CD 34+ buněk v přípravcích z CMNC Spectra Optia v. 11 a Cobe Spectra v. 6 a v. 7. V průběhu standardních a LVL výkonů jsme nezaznamenali žádné závažné nežádoucí reakce.
Podíl autorů na přípravě rukopisu
ZG – napsání článku, plán a příprava projektu pro srovnání separačních protokolů, vedení separací krvetvorných buněk, hodnocení výsledků separací
BV – výběr a indikace pacientů, hodnocení doby přihojení štěpů krvetvorných buněk u pacientů po autologní transplantaci
ZBL – vedení separací krvetvorných buněk u pacientů, hodnocení výsledků separací
MB – vedení separací krvetvorných buněk u pacientů, hodnocení výsledků separací
MS – vedení separací krvetvorných buněk u pacientů, hodnocení výsledků separací
IM – analýza obsahu CD 34+ v krvi a v krvetvorných buňkách
PP – zpracování a statistické hodnocení výsledků
Poděkování
Autoři děkují kolektivu pracovníků Aferetického oddělení ÚHKT za jejich obětavou práci a profesionální přístup při rešení projektu
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
doc. MUDr. Zdenka Gašová, CSc.
Aferetické oddělení
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: zdenka.gasova@uhkt.cz
Zdroje
1. Brecher ME, Lasky LC, Sacher RA, Issit LA. Hematopoietic progenitor cells: processing, standards and practice. In AABB, Technical Manual, Bethesda MD: 1995 : 68–86.
2. Roberts GT, Sacher RA. Impact of cell culture technology on transfusion medicine. In: Smit-Sibinga CTh, Das PC, Briet E, editors. Hereditary diseases and blood transfusion. Proceedings of the Nineteenth International Symposium on Blood Transfusion, Groningen, 1994 : 153–164.
3. Lasky LC, Warkentin PI. Marrow and Stem cell Processing for transplantation. In Brecher M. E., Lasky L.C., Sacher R. A, Issit L. A. (ed.): Hematopoietic progenitor cells: processing, standards and practice, AABB Technical Manual, Bethesda, Maryland, 1995. p. 1–33.
4. Dregger P, Schmitz N. Allogeneic transplantation of hematopoietic stem cells: blood versus bone marrow. In Rowe JM, Lazarus HM, Carella AM, editors. Handbook of Bone Marrow Transplantation, UK, M. Dunitz, 2000 : 183–201.
5. Moller AKH et al. Recruitment of CD 34+ cells during large volume leukapheresis. J Haematother Stem Cell Res 2001;10 : 837–853.
6. Burgstaler EA. Current instrumentation for apheresis; In: McLeod B. Apheresis: principles and practice. Bethesda MD: AABB Press, 2010; 71–85; Schwartz J, Padmanabhan A, Francis RO et al. HPC collection by apheresis. In: McLeod B. Apheresis: principles and practice. Bethesda MD: AABB, 2010; 494–496.
7. Comenzo RL, Vosburgh E, Weintraub LR, Tansan S, Arkin CF, Wright DG. Collection of mobilized blood progenitor cells for hematopoietic rescue by large volume leukapheresis. Transfusion 1995;35(6):494–497.
8. Gašová Z, Marinov I, Hrubá A, Benešová K, Turek P. The efficiency of PBPC collections and the relationship to the precollection concentration of CD 34+ cells in blood. Transf Sci 1999;20(3):181–188.
9. Gašová Z, Lerlova A, Vodvarkova S, Marinov I, Böhmova M, Bhuiyan-Ludvikova Z. The dependence of the yield of CD 34+ cells on the precollection and run parameters using the standard and large volume leukapheresis (LVL) in donors and in patients. Transf Sci 2005;32 : 167–176.
10. Lane T. Mobilization of hematopoietic progenitor cells. In Brecher M. E., Lasky L.C., Sacher R. A, Issit L. A. (ed.): Hematopoietic progenitor cells: processing, standards and practice. AABB Technical Manual, Bethesda, Maryland, 1995. p. 68–86, 125, 132–134.
11. Smolowicz AG. LVL apheresis for the harvest of peripheral blood progenitor cells for autologous transplantation. Transfusion 1996;37 : 160–167.
12. Sanderson F, Poullin P, Smith R, Nicolino-Brunet C, Philip P, Chaib A, Costello R. Peripheral blood stem cells on Spectra Optia apheresis system using the continuous mononuclear cell collection protocol: A single center report of 39 procedures. J Clin Apher 2017;32(3):182–190.
13. Gašová Z, Bhuiyan-Ludvíková Z, Böhmová M, et al. PBPC collections: management, techniques and risks. Transf Apher Sci 2010;43 : 237–243.
14. Lee JL, Kim S-B, Lee G-W, et al. Collection of peripheral blood progenitor cells: analysis of factors predicting the yields. Transf Apher Sci 2003;29 : 29–37.
15. Weinstein R. Prevention of citrate reactions during therapeutic plasma exchange by constant infusion of calcium gluconate with the return fluid. J Clin Apher 1996;11 : 204–210.
16. Kankirawatana S, Huang ST, Maerques MB. Continuous infusion of calcium gluconate in 5% albumin is safe and prevents most hypocalcemic reactions during therapeutic plasma exchange. J Clin Apher 2007;22 : 265–269.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo Supplementum1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
- Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
- Každý obor potřebuje svůj ústav excelence
- Využití molekulárně cytogenetických technik při analýze chromozomových aberací u hematologických malignit
- Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfuze (1986–2016)
- Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Dysfibrinogenemie a afibrinogenemie v České republice
- Transfuze a imunohematologie v ÚHKT
- Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



