-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
The first oral proteasome inhibitor in the treatment of relapsed/refractory multiple myeloma
Ixazomib is the first and only oral proteasome inhibitor, indicated for the treatment of multiple myeloma in combination with lenalidomide and dexamethasone in patients who have received at least one prior therapy. The approval is based on the results of the randomized, double-blind, placebo-controlled phase III TOURMALINE-MM1 trial that demonstrated statistically significant improvement in progression-free survival in patients treated with the all-oral triplet combination of ixazomib plus lenalidomide and dexamethasone compared to patients in the lenalidomide and dexamethasone arm (20.6 months vs 14.7 months in the control group; hazard ratio 0.74; p = 0.01; median follow-up 14.7 months). The addition of ixazomib to a regimen of lenalidomide and dexamethasone is generally well tolerated with no negative impact on patient-reported quality of life. In this review, we highlight the efficacy, safety, pharmacokinetics and patient-reported quality of life data of ixazomib. We focus on the role of ixazomib in the treatment of patients with relapsed/refractory multiple myeloma including patients with high-risk cytogenetic features as well as heavily pretreated patients.
Key words:
ixazomib – proteasome inhibitor – multiple myeloma
Autoři: H. Plonková; T. Jelínek; L. Szeligová; R. Hájek
Působiště autorů: Lékařská fakulta, Ostravská univerzita, Ostrava ; Klinika hematoonkologie, Fakultní nemocnice Ostrava
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 4, p. 199-209.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Ixazomib je první perorální inhibitor proteazomu, jenž je v kombinaci s lenalidomidem a dexametazonem indikován k léčbě pacientů s mnohočetným myelomem, kteří podstoupili alespoň jednu předchozí linii léčby. Souhlas ke klinickému užití ixazomibu byl vydán na základě výsledků studie TOURMALINE-MM1, dvojitě zaslepené, placebem kontrolované studie fáze III, která prokázala významné zlepšení přežití bez progrese u výhradně perorálně podávané kombinace ixazomibu a lenalidomidu s dexametazonem proti samotnému lenalidomidu s dexametazonem (medián 20,6 vs. 14,7 měsíce; poměr rizika 0,74; p = 0,01; medián sledování 14,7 měsíce). Doplnění kombinace lenalidomidu s dexametazonem o ixazomib je nemocnými velmi dobře tolerováno a nemá nepříznivý vliv na jejich kvalitu života. V práci hodnotíme účinnost, bezpečnost, farmakokinetiku a údaje o kvalitě života, které lze sledovat u ixazomibu a zabýváme se úlohou této perorální účinné látky v léčbě pacientů s relabujícím/refrakterním mnohočetným myelomem, včetně pacientů s vysoce rizikovými cytogenetickými abnormalitami a léčbou u výrazně předléčených pacientů.
Klíčová slova:
ixazomib – inhibitor proteazomu – mnohočetný myelomÚVOD
Mnohočetný myelom (MM) je maligní onemocnění, které se vyznačuje nekontrolovanou proliferací klonálních plazmatických buněk v kostní dřeni [1, 2]. Jedná se o druhé nejčastější krevní nádorové onemocnění s incidencí 6 případů na sto tisíc obyvatel v ČR. Riziko výskytu MM se zvyšuje s věkem a medián věku při této diagnóze činí 70 let [1].
Značného pokroku v léčbě MM bylo dosaženo v posledních 15 letech díky zavedení imunomodulačních léčiv – thalidomidu, lenalidomidu, pomalidomidu a inhibitorů proteazomu – bortezomibu, nedávno i carfilzomibu [3] a ixazomibu [4]. Medián celkového přežití (OS) se zvýšil ze 4,6 roku u pacientů diagnostikovaných mezi roky 2001–2005 na 6,1 roku u pacientů diagnostikovaných mezi roky 2006–2010 [5].
I přes tyto pokroky jsou u MM obvyklé četné relapsy, které vyžadují opakovanou léčbu. V přirozeném vývoji nemoci další relapsy mívají agresivnější průběh s kratší dobou trvání léčebné odpovědi a ve finále vyústí v refrakterní chorobu [6]. Pacienti refrakterní k bortezomibu a současně k imunomodulačním látkám mají medián OS pouze 9 měsíců [7]. Z klinického hlediska je stále potřeba rozšířit možnosti účinné léčby a zlepšit prognózu pacientů s relabujícím/refrakterním mnohočetným myelomem (RRMM). Zvláště to platí pro skupinu pacientů s MM s nepříznivou prognózou, u nichž jsou výsledky i při současných standardech léčebné péče horší, než je tomu u celkové populace pacientů s MM. Patří sem pacienti s vysoce rizikovými cytogenetickými abnormalitami del(17p), t(4;14) a t(14;16) [8, 9], starší nemocní (ve věku > 75 let) [10], pacienti s poruchou funkce ledvin [11] a polymorbidní pacienti [12].
SOUČASNÉ MOŽNOSTI LÉČBY PRO PACIENTY S MM
Základem léčby MM jsou imunomodulační léčiva – lenalidomid a thalidomid a inhibitor proteazomu bortezomib, obvykle podávaná v kombinaci s kortikosteroidy (např. dexametazonem nebo prednisonem) a alkylačními látkami (např. melfalanem nebo cyklofosfamidem). Tyto účinné látky se používají jako indukční léčba před autologní transplantací kmenových buněk (ASCT) a jako počáteční léčba u nově diagnostikovaných pacientů nevhodných pro ASCT. Tyto léky jsou základem i v léčbě relapsu onemocnění. Existuje stále více důkazů o účinnosti novějších imunomodulačních léčiv a inhibitorů proteazomu – pomalidomidu, carfilzomibu a ixazomibu u pacientů s RRMM [4, 6].
Neustále probíhá hledání optimálních kombinací a léčebných postupů a je zjevné, že větší úspěch přinášejí trojkombinace proti dvojkombinacím [4, 13–18]. Některé studie rovněž prokázaly, že trojkombinace, která obsahuje jak imunomodulační lék, tak i inhibitor proteazomu, např. bortezomib, carfilzomib nebo ixazomib v kombinaci s RD (lenalidomidem – dexametazonem), vyvolávají rychlou a silnou léčebnou odpověď vedoucí k prodloužení doby přežití bez progrese (PFS) a prodloužení OS [4, 13–16]. Dlouhodobá léčba se nyní stává trendem, ačkoliv doposud byla schválena jediná účinná látka – lenalidomid – pro potřeby udržovací léčby po ASCT v primoléčbě [19, 20]. Dlouhodobá léčba se zdá být klíčová zejména u pacientů s vysoce rizikovými cytogenetickými abnormalitami [21], pro něž existuje jen málo možností účinné léčby. Dlouhodobé podávání léků je však omezeno jejich toxicitou – periferní neuropatií (PN) [22] v případě thalidomidu a bortezomibu [6], kardiovaskulární [6, 23] či renální [23] toxicitou. Limitaci představuje i frekvence návštěv kliniky a opakovaně aplikovaných injekcí. Z údajů z reálné klinické praxe doložených retrospektivní studií vyplývá, že medián doby trvání druhé linie léčby je jen 6,9 měsíce [24], což je významný rozdíl proti 15–20 měsícům zaznamenaným v nedávných studiích fáze III u pacientů s RRMM [4, 16, 25]. Využití nových kombinací léčiv tedy může zásadně zlepšit prognózu nemocných v relapsu onemocnění.
Při úspěšné dlouhodobé léčbě přirozeně roste význam kvality života pacientů, především s ohledem na snášenlivost a komfort léčebných režimů. Dlouhodobá a účinná léčba provázená zvladatelnou toxicitou proto hraje v terapii MM důležitou roli.
NOVĚ VZNIKAJÍCÍ MOŽNOSTI LÉČBY RRMM
V nedávné době schválil americký Úřad pro kontrolu potravin a léčiv (FDA) několik účinných látek pro léčbu RRMM, které rozšířily možnosti léčebné péče. Patří mezi ně inhibitor histonové deacetylázy panobinostat [26], monoklonální protilátky elotuzumab [25, 27] a daratumumab [17, 18, 27] a perorální inhibitor proteazomu ixazomib. Léčiva byla schválena jako složky léčebných trojkombinací, které obsahují inhibitor proteazomu nebo imunomodulační látku – s již známou účinností v léčbě RRMM.
Perorální inhibitor proteazomu ixazomib získal v listopadu 2015 od amerického FDA a v listopadu 2016 od Evropské lékové agentury (EMA) souhlas ke klinickému užití v kombinaci s lenalidomidem a dexametazonem (RD) při léčbě pacientů, kteří podstoupili alespoň jednu předchozí linii léčby. Souhlas byl udělen na základě pozitivních výsledků studie fáze III, která prokázala významné zlepšení PFS a obecně zvládnutelný profil toxicity léku [4]. V České republice v současné době ixazomib nemá stanovenou finanční úhradu. Léčba přípravkem zde probíhala od roku 2016 v rámci Specifického léčebného programu. V roce 2017 pokračuje v rámci Named Patient Program nebo v klinických studiích.
V tomto článku hodnotíme úlohu ixazomibu v léčbě RRMM, pozornost zaměřujeme na farmakokinetiku, účinnost a bezpečnost tohoto perorálního inhibitoru proteazomu.
KLINICKÁ FARMAKOLOGIE IXAZOMIBU
Ixazomib je reverzibilní inhibitor proteazomu druhé generace. Jelikož je proteazom zapojen do obratu intracelulárních proteinů, patří mezi primární důsledky jeho inhibice hromadění nefunkčních proteinů a chyby v signálních drahách, které vyúsťují v narušení adheze myelomových buněk, potlačení angiogeneze, zastavení buněčného cyklu, omezení odpovědi na poškození DNA a indukci apoptózy nádorových buněk [28].
Ixazomib prokázal ve srovnání s inhibitorem proteazomu první generace, bortezomibem, vyšší účinek proti buňkám MM in vivo v sérii preklinických studií. Přednostně se váže na 20S proteazom, který inhibuje [29]. Ixazomib se podává jako citrát-esterové proléčivo ixazomib-citrát, který se za fyziologických podmínek rychle a úplně hydrolyzuje na svou biologicky aktivní formu ixazomib. Lék má charakteristickou chemickou strukturu a ve srovnání s bortezomibem kratší disociační poločas [29].
Farmakokinetika
Studie rané fáze zkoumaly schémata dávkování ixazomibu jako jediné účinné látky jedenkrát týdně (1., 8. a 15. den 28denních cyklů) a dvakrát týdně (1., 4., 8. a 11. den 21denních cyklů). Výsledky ukázaly, že ixazomib se rychle absorboval v obou dávkovacích schématech a medián doby dosažení maximální plazmatické koncentrace činil 1 hodinu a dlouhý terminální poločas byl 9,5 dne [30]. Tyto výsledky dokládají relevanci obou schémat dávkování – jedenkrát i dvakrát týdně. Obě studie také prokázaly přímou úměru dávky ixazomibu s koncentrací ixazomibu v plazmě [31, 32].
Ixazomib se z 99 % váže na plazmatické proteiny. Předpokládá se, že hlavním mechanismem clearance ixazomibu je metabolismus cestou většího počtu enzymů cytochromu P450 (CYP) a non-CYP proteinů [30].
Volba dávky a dávkování
Na rozdíl od dávkování podle plochy tělesného povrchu (BSA), které se využívá při podávání bortezomibu a carfilzomibu, se v případě ixazomibu pracuje s jednoduchým fixním dávkovacím schématem, neboť farmakokinetická (PK) analýza prokázala, že ixazomib má vysokou orální biologickou dostupnost a velikost těla nemá na expozici léku žádný vliv [33]. Stanovená maximální tolerovaná dávka (MTD) 2,97 mg/m2 [31] a doporučená dávka 2,23 mg/m2 [34] je rovna fixní dávce 5,5 mg a 4,0 mg. Studie fáze III již pracují s fixní startovací dávkou ixazomibu 4 mg podávanou jedenkrát týdně v kombinaci s RD. Ve studiích fáze III testujících ixazomib v monoterapii v udržovací léčbě u předléčených pacientů je lék pro snížení rizika toxicity podáván ve startovací dávce 3 mg jedenkrát týdně a dávka se zvyšuje na 4 mg týdně, pokud se po 4 cyklech dosáhne přijatelné tolerance.
U pacientů s MM s těžkou poruchou funkce ledvin nebo onemocněním ledvin v konečném stadiu PK studie potvrdila ve srovnání s pacienty s normální funkcí ledvin vyšší expozici ixazomibu o 38 % a 39 % [35]. Na základě těchto zjištění je doporučeno u pacientů s těžkou poruchou funkce ledvin nebo s terminálním ledvinovým selháním podávat nižší dávky ixazomibu 3 mg. V případě lehké až středně těžké poruchy funkce ledvin redukce dávky není nutná [30]. Zvýšená expozice ixazomibu byla prokázána i u nemocných se středně těžkou nebo těžkou poruchou funkce jater (o 27 % a 20 %) [36], což i v těchto případech vedlo ke snížení dávky ixazomibu na 3 mg [30].
Podávání ixazomibu v dávce 4 mg po jídle s vysokým obsahem tuku snižuje rychlost a rozsah perorální absorpce, proto je doporučeno podávat ixazomib alespoň hodinu před jídlem nebo dvě hodiny po jídle [30].
Podobně jako u řady jiných léků se optimální dávka ixazomibu stále ještě vyvíjí. Zvláště pokud je lék mimořádně dobře tolerován. V posledním roce byly zkoušeny intenzivnější režimy s podáním ixazomibu dvakrát týdně se zajímavými výsledky [37]..
Studie interakcí mezi léčivy
Klíčové je, že z hlediska zařazení ixazomibu do kombinovaných režimů nebyla mezi ixazomibem a léčivy používanými v léčbě MM včetně režimu RD prokázána žádná farmakokinetická interakce [34, 38, 39]. S ohledem k PK údajům je však potřebné se u pacientů léčených ixazomibem vyhýbat systémové léčbě silnými induktory CYP3A [30].
KLINICKÁ ÚČINNOST IXAZOMIBU U PACIENTŮ S MM
Ixazomib v monoterapii
Klinická účinnost ixazomibu v monoterapii u pacientů s RRMM byla prokázána ve dvou studiích fáze I, a to u výrazně předléčených pacientů, včetně pacientů dříve exponovaných léčbě bortezomibem a/nebo lenalidomidem [31, 32] (tab. 1). Do každé studie bylo zařazeno 60 pacientů, kterým byl ixazomib jako jediná účinná látka podáván jedenkrát týdně (1., 8. a 15. den 28denních cyklů) nebo dvakrát týdně (1., 4., 8. a 11. den 21denních cyklů). Účinnost byla prokázána v obou léčebných režimech, přičemž u 18 % [31] a 15 % [32] nemocných bylo dosaženo alespoň částečné odpovědi (tab. 1). Některé z těchto odpovědí byly hlášeny u pacientů s RRMM, u nichž předcházela léčba bortezomibem i lenalidomidem.
Tab. 1. Klinická účinnost ixazomibu u pacientů s MM 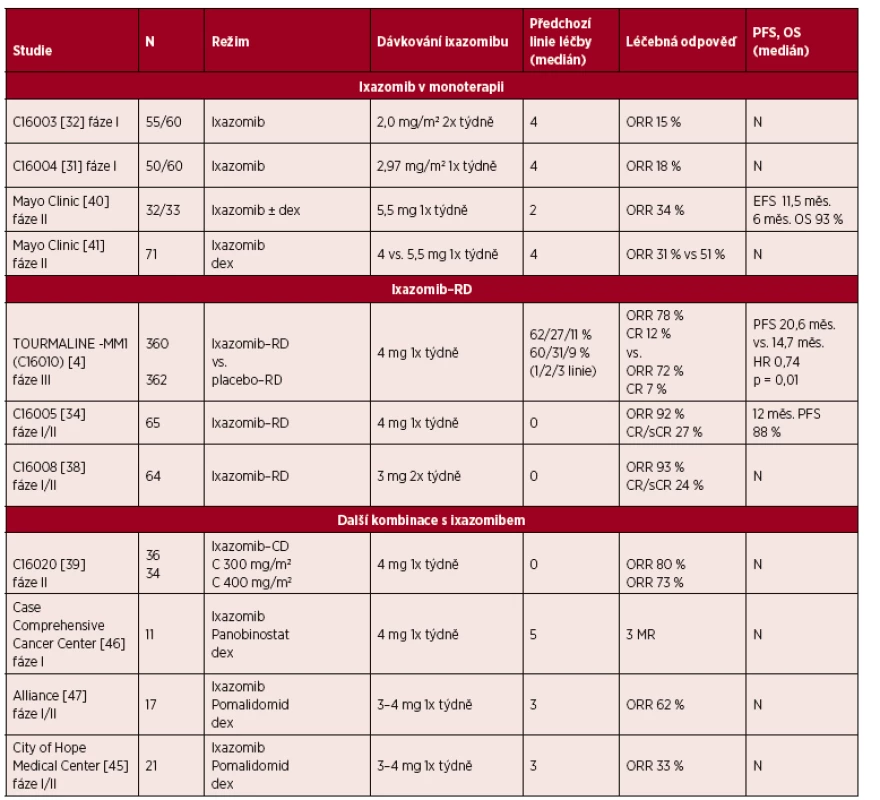
Vysvětlivky: C = cyklofosfamid, CD = cyklofosfamid – dexametazon, CR = kompletní léčebná odpověď (complete response), dex = dexametazon, EFS = přežití bez příhod (event-free survival), HR = poměr rizika (hazard ratio), MR = minimální léčebná odpověď (minimal response), N = neuvedeno, ORR = celková četnost léčebných odpovědí (overall response rate), OS = celkové přežití (overall survival), PFS = přežití bez progrese (progression-free survival), RD = lenalidomid – dexametazon, sCR = stringentní kompletní odpověď (stringent complete response) Účinnost ixazomibu v monoterapii rovněž prokázaly závěry studie Mayo Clinic fáze II [40, 41] (viz tab. 1). V první fázi této studie 33 pacientů s RRMM, kteří absolvovali v mediánu dvě předchozí linie léčby (72 % pacientů dosud neléčených bortezomibem), dostávalo jedenkrát týdně doplňkově k 5,5 mg ixazomibu také dexametazon pro nedostatečnou odpověď [40].
Celková léčebná odpověď (ORR), dosažená u 34 % pacientů, byla vyšší než ve studii fáze I, kdy byl ixazomib podáván jedenkrát týdně, což lze pravděpodobně připsat méně výrazně předléčené populaci pacientů či doplňkovému dexametazonu. Druhá fáze této studie hodnotila účinnost a tolerabilitu dvou dávek ixazomibu podávaného jedenkrát týdně (4,0 mg a 5,5 mg) v kombinaci s dexametazonem u výrazně předléčených pacientů, kteří podstoupili v mediánu čtyři předchozí linie léčby. ORR bylo dosaženo v 31 % při 4,0 mg ixazomibu a 51 % při 5,5 mg ixazomibu [41].
Ixazomib v kombinaci s lenalidomidem a dexametazonem
Ixazomib je schválen v kombinaci s lenalidomidem a dexametazonem (RD) pro pacienty s RRMM, kteří podstoupili alespoň jednu předchozí léčebnou linii, a to na základě výsledků placebem kontrolované, dvojitě zaslepené studie TOURMALINE-MM1 fáze III [4]. Počáteční a pozitivní zkušenost s výhradně perorálně podávanou trojkombinací ixazomib-RD přinesly dvě studie fáze I/II u souboru nemocných s nově diagnostikovaným MM (NDMM). Studie hodnotily jedenkrát týdně podávaný ixazomib v kombinaci s RD (4 mg ixazomibu 1., 8. a 15. den 28denních cyklů, plus RD) a dvakrát týdně podávaný ixazomib v kombinaci s RD (3 mg ixazomibu 1., 4., 8. a 11. den 21denních cyklů, plus RD) pacientům s NDMM, včetně vhodných k provedení ASCT [34, 38]. V obou studiích byli pacienti léčeni fixním počtem indukčních cyklů ixazomib-RD a následně i udržovací léčbou ve formě monoterapie ixazomibem ve stejném dávkovacím schématu. Povzbudivé výsledky byly zaznamenány u obou schémat (viz tab. 1). U 27 % a 24 % pacientů, kterým byl podáván ixazomib jedenkrát a dvakrát týdně spolu s RD, bylo dosaženo kompletní remise (CR). Značný podíl hodnotitelných vzorků byl, pokud se týká reziduálního onemocnění, negativní, a to v obou studiích, což dokládá kvalitu dosažené odpovědi [34, 38]. Výsledky studie fáze I/II s ixazomibem podávaným jednou týdně spolu s RD potvrdily, že léčbu lze vést dlouhodobě. Pacienti pokračovali v léčbě déle než 4 roky a udržovací léčba dále prohloubila léčebnou odpověď [34].
Na základě těchto pozitivních výsledků rané fáze byla kombinace ixazomib-RD hodnocena v rámci randomizované, dvojitě zaslepené, placebem kontrolované studie TOURMALINE-MM1 fáze III u pacientů s RRMM [4]. Celkově bylo 722 pacientů randomizováno k dlouhodobé léčbě režimem ixazomib-RD (ixazomib v dávce 4 mg podávaný jedenkrát týdně) a placebo-RD. Po uplynutí doby sledování, která v mediánu trvala ~15 měsíců (14,8 měsíce v experimentálním rameni a 14,6 měsíce v rameni kontrolním), došlo u primárního cílového ukazatele PFS k významnému zlepšení u pacientů léčených kombinací ixazomib-RD ve srovnání s léčbou režimem RD, s mediánem PFS 20,6 vs. 14,7 měsíce; poměrem rizika (HR) 0,74, p = 0,01, což odpovídá klinicky významnému přínosu v podobě prodloužení doby přežití bez progrese v mediánu o ~6 měsíců [4] (viz tab. 1).
ORR ve studii TOURMALINE-MM1 činily 78 % proti 72 % (p = 0,04) a CR 12 % proti 7 % (p = 0,02) u ixazomibu-RD vs. placebo-RD (viz tab. 1). Odpovědi byly rychlé a trvalé – s mediánem doby odezvy 1,1 měsíce proti 1,9 měsíce a mediánem doby trvání 20,5 měsíce v rameni léčeném kombinací ixazomib-RD proti 15,0 měsícům v rameni léčeném kombinací placebo-RD. Zásadní je, že s prodlužující se dobou trvání léčby se prohlubuje i léčebná odpověď [4], jak je patrné i z dřívější studie fáze I/II [34]. Data o celkovém přežití doposud nejsou k dispozici.
Z pohledu hodnocení HR je relativní přínos kombinace ixazomib-R proti RD u pacientů s RRMM srovnatelný s nedávnými výsledky hodnocení RD v kombinaci s jiným inhibitorem proteazomu – carfilzomib-RD vs. RD (medián PFS 26,3 vs. 17,6 měsíce; HR 0,69; p = 0,0001) [16] i v kombinaci s monoklonální protilátkou – elotuzumab-RD vs. RD (medián PFS 19,4 vs. 14,9 měsíce; HR 0,70; p < 0,001) [25].
Účinnost ixazomibu u specifických populací pacientů
Klinicky významný přínos pro PFS při srovnání kombinací ixazomib-RD a placebo-RD ve studii TOURMALINE-MM1 byl pozorován u všech podskupin pacientů, včetně pacientů s nepříznivou prognózou – s vysoce rizikovými cytogenetickými abnormalitami a u výrazně předléčených nemocných.
Pacienti s vysoce rizikovými cytogenetickými abnormalitami
Pacienti s vysoce rizikovými cytogenetickými abnormalitami mají zvlášť nepříznivou prognózu [8, 9]. Podle konsenzu Mezinárodní myelomové pracovní skupiny z roku 2016 je pro léčbu nově diagnostikovaných pacientů s vysoce rizikovými cytogenetickými abnormalitami doporučen trojkombinační režim, jehož součástí je inhibitor proteazomu a imunomodulační lék [9]. Ačkoli uvedené režimy vykázaly u těchto pacientů lepší výsledky ve srovnání s předchozími standardy léčebné péče, zůstávají ve výsledcích léčby mezi těmito pacienty a pacienty se standardně rizikovou cytogenetikou stále rozdíly.
U 137 pacientů s vysoce rizikovými cytogenetickými abnormalitami del(17p), t(4;14) a/nebo t(14;16) ve studii TOURMALINE-MM1 byl snížen poměr rizika progrese nemoci nebo úmrtí (0,54) a došlo k ~12měsíčnímu prodloužení PFS u kombinace ixazomib-RD proti kombinaci placebo-RD (medián PFS 21,4 vs. 9,7 měsíce; p = 0,02) [4, 42]. Medián PFS u pacientů s obzvláště špatnou prognózou (21,4 měsíce) byl srovnatelný s mediánem PFS u celkové populace s léčebným záměrem (20,6 měsíce) a pacientů se standardně rizikovou cytogenetikou (20,6 měsíce) [42].
Pacienti dříve vystavení účinkům inhibitorů proteazomu/imunomodulačních léčiv
Vzhledem k relabující povaze MM je zásadní, aby léčebný režim prokázal účinnost u předléčených pacientů. Do studie TOURMALINE-MM1 byli zařazeni pacienti, kteří již byli dříve léčeni inhibitory proteazomu a imunomodulačními léčivy, ovšem nikoliv ti, kteří jsou na inhibitory proteazomu nebo lenalidomid refrakterní. Ze 722 pacientů bylo 69 % dříve léčeno inhibitory proteazomu a 55 % podstoupilo předchozí léčbu thalidomidem/lenalidomidem. Výsledky prokázaly srovnatelnou účinnost z hlediska prodloužení PFS u pacientů léčených kombinací ixazomib-RD ve srovnání s pacienty léčenými kombinací placebo-RD, kdy obě skupiny podstoupily 1, 2 nebo 3 předchozí linie léčby (HR kombinace ixazomib-RD proti kombinaci placebo-RD činily 0,83, 0,75 a 0,37 u pacientů s 1, 2 a 3 předchozími liniemi léčby) [4], a to bez ohledu na předchozí expozici inhibitoru proteazomu nebo imunomodulačním lékům (HR 0,70-0,74 u pacientů exponovaných/doposud neléčených inhibitorem proteazomu nebo imunomodulačním lékem) [43].
Ixazomib v jiných kombinovaných režimech
V návaznosti na údaje o bortezomibu v kombinovaných léčebných režimech [14, 15, 44] a vývoji dalšího inhibitoru proteazomu byly publikovány i předběžné údaje o účinnosti ixazomibu v kombinaci s cyklofosfamidem – dexametazonem, melfalanem – prednisonem, panobinostatem – dexametazonem a pomalidomidem – dexametazonem, které potvrzují, že je ixazomib v uvedených režimech vhodnou partnerskou účinnou látkou [39, 45–47] (tab. 1 a 2).
Tab. 2. Bezpečnost ixazomibu v monoterapii nebo kombinované terapii u pacientů s MM 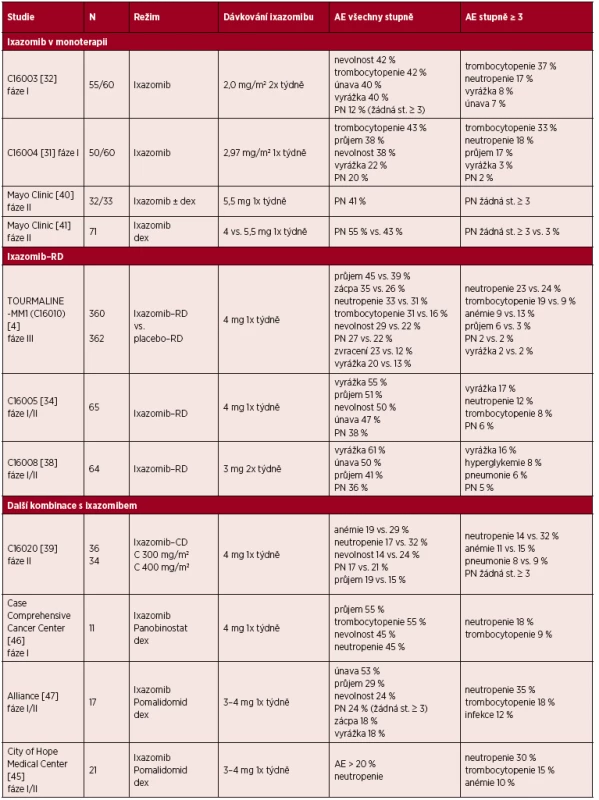
Vysvětlivky: AE = nežádoucí účinek (adverse event), C = cyklofosfamid, CD = cyklofosfamid – dexametazon, dex = dexametazon, PN = periferní neuropatie, RD = lenalidomid – dexametazon. BEZPEČNOST A SNÁŠENLIVOST IXAZOMIBU
Údaje o bezpečnosti léku ze studie fáze III [4] potvrdily obecně zvládnutelný profil toxicity ixazomibu. Obvyklé nežádoucí účinky (AE) ixazomibu, které byly zaznamenány napříč studiemi – v monoterapii, i v kombinovaných režimech – zahrnovaly gastrointestinální toxicitu (průjem, zácpu, nevolnost, zvracení), vyrážku a trombocytopenii. Řada z nich odpovídala nízkému stupni (viz tab. 2). Pro vývoj kombinovaných režimů je pozitivní, že přidání ixazomibu do kombinace RD neprohlubuje toxicitu léčby. Léčba kombinacemi ixazomib-RD a placebo-RD byla spojena s podobnou mírou AE (98 % vs. 99 %), závažných AE (47 % vs. 49 %), úmrtím v době provádění studie (4 % vs. 6 %) a pouze malým zvýšením výskytu AE ve stupni ≥3 (74 % proti 69 %) [4]. Míra ukončení léčby pro AE byla obdobná v obou režimech, což umožňuje dlouhodobé podávání režimu ixazomib-RD.
Klíčové nežádoucí účinky pozorované ve studiích ixazomibu
Trombocytopenie
Ve studiích rané fáze byl výskyt trombocytopenie podobný u dávkování ixazomibu v monoterapii jedenkrát týdně i dvakrát týdně (celkově 43 % a 42 %, včetně stupně ≥ 3 s výskytem 33 % a 37 %) [31, 32] (viz tab. 2). V kombinovaných režimech ixazomib-RD je trombocytopenie částečně se překrývající toxicitou ixazomibu i lenalidomidu. Ve studii TOURMALINE-MM1 bylo patrné přechodné a cyklické snížení počtu krevních destiček jak u skupin s kombinací ixazomib-RD, tak i u skupin s kombinací placebo-RD, což odpovídá výsledkům studie kombinace ixazomib-RD fáze I/II [34] (viz tab. 2). Ačkoli byl výskyt trombocytopenie stupně ≥3 vyšší u kombinace ixazomib-RD proti kombinaci placebo-RD (19 % vs. 9 %), většinu případů bylo možné zvládnout přerušením dávkování a snížením dávky ixazomibu. Zjevné následky ve formě klinicky významných krvácivých příhod (2 % vs. 2 %) nebo nutnosti podání transfuze trombocytů (8 % vs. 6 %) byly v obou skupinách podobné [4]. Trombocytopenie se nejčastěji vyskytla v prvních 3 cyklech a pravděpodobně nedocházelo k dlouhodobé kumulativní toxicitě.
Gastrointestinální nežádoucí účinky
Ve shodě s výsledky studií ixazomibu v monoterapii [31, 32] a kombinace ixazomib-RD [34] byly běžnými AE ve studii TOURMALINE-MM1 průjem (45 % vs. 39 %), zácpa (35% vs. 26%), nevolnost (29% vs. 22%) a zvracení (23% vs. 12%). Gastrointestinální AE odpovídaly ve většině případů nízkému stupni [4] (viz tab. 2). Mezi skupinami s kombinací ixazomib-RD a placebo-RD nebyly žádné zjevné rozdíly komplikací spojených s průjmem. Incidence výskytu gastrointestinálních AE byla nejvyšší během prvních měsíců léčby a postupem času obecně klesala.
Vyrážka
Vyrážka se vyskytovala jako běžný AE ve studiích s ixazomibem v monoterapii i kombinace ixazomib-RD fáze I s incidencí v rozmezí 22–61 %, včetně účinků stupně ≥3 s incidencí 3–17 % [31, 32, 34, 38] (viz tab. 2). Ve studii TOURMALINE-MM byla zaznamenána ve 20 % ve skupině léčené ixazomibem a ve 13 % ve skupině kontrolní, rovněž většinou nízkého stupně [4] (viz tab. 2). Přestože typické intervence zahrnovaly použití antihistaminik nebo topických glukokortikoidů, vyrážka se objevovala během prvních několika cyklů a často se sama hojila.
Periferní neuropatie
Periferní neuropatie je u inhibitoru proteazomu první generace – bortezomibu – poměrně častá [22], a to spíše při intravenózním než při subkutánním podání [48]. Minimální výskyt byl hlášen u carfilzomibu [49]. Nízká incidence PN byla hlášena taktéž ve studiích rané fáze zkoumajících kombinaci ixazomib-RD a ixazomib v monoterapii [31, 32, 34, 38]. Potvrzena je i výsledky studie TOURMALINE-MM1 fáze III [4], ve které byl výskyt PN celkově zaznamenán u 27 % pacientů léčených režimem ixazomib-RD a u 22 % pacientů v kontrolním rameni, s nízkou incidencí PN stupně ≥3 (2 % v obou ramenech) – viz tabulka 2.
Další nežádoucí účinky jako předmět klinického zájmu
Užití některých inhibitorů proteazomu [6, 23] bylo spojeno s výskytem srdečních příhod. Farmakokinetická a farmakodynamická analýza u ixazomibu nepotvrdila, že by lék při klinicky relevantních expozicích způsobil prodloužení intervalu QTc, a měl tedy klinicky významný účinek na srdeční frekvenci [50]. Neexistují tedy obavy týkající se bezpečnosti ixazomibu ve vztahu ke kardiální toxicitě. Ve studii TOURMALINE-MM1 byla podobná incidence srdeční arytmie, srdečního selhání a infarktu myokardu v ramenech léčených kombinací ixazomib-RD a kombinací placebo-RD (16 % vs. 15 %, 4 % vs. 4 %, 1 % vs. 2 %) [4].
A stejně tak se pravděpodobně není třeba obávat snížené bezpečnosti ixazomibu ve vztahu k selhání ledvin nebo tromboembolismu. Ve studii TOURMALINE-MM1 byl celkový výskyt selhání ledvin (9 % vs. 11 %) a tromboembolických příhod (8 % vs. 11 %) obdobný u obou srovnávaných režimů [4].
KVALITA ŽIVOTA NEMOCNÝCH
Díky vyšší pozornosti věnované dlouhodobé léčebné péči je v klinických studiích MM kladen důraz na sledování kvality života nemocných (QoL). Ve studii TOURMALINE-MM1 byla QoL sekundárním sledovaným ukazatelem a byla hodnocena pomocí dotazníků EORTC QLQ-C30 [51] a QLQ-MY20 [52]. Po dobu sledování, která v mediánu trvala 23 měsíců, zůstaly celkové výsledky sledování QoL během léčby kombinacemi ixazomib-RD a placebo-RD obdobné, což dokládá, že přidání ixazomibu do kombinace RD nemělo žádný nepříznivý vliv na kvalitu života nemocných.
AKTUÁLNĚ PROBÍHAJÍCÍ STUDIE FÁZE III S IXAZOMIBEM U MM
Kromě studie TOURMALINE-MM1 v současnosti probíhají tři studie fáze III zkoumající ixazomib u pacientů s MM (tab. 3). Ve studii TOURMALINE-MM2 (NCT01850524) se porovnávají kombinace ixazomib-RD a placebo-RD podávané pacientům s NDMM, u nichž není indikována ASCT. Ve studii TOURMALINE-MM3 (NCT02181413) se srovnává ixazomib s placebem jako udržovací léčba u pacientů s NDMM, kteří odpověděli na indukční léčbu, po níž následuje ASCT. Obdobná je studie TOURMALINE-MM4 (NCT02312258), ve které se ixazomib rovněž srovnává s placebem jako udržovací léčbou pacientů s NDMM, kteří odpověděli na indukční terapii, avšak nepodstoupili ASCT.
Tab. 3. Studie fáze III s ixazomibem u pacientů s MM 
Vysvětlivky: ASCT = autologní transplantace kmenových buněk (autologous stem cell transplant), MM = mnohočetný myelom, PFS = přežití bez progrese (progression-free survival), RD = lenalidomid – dexametazon ZÁVĚR
Inhibice proteazomu je základem léčby mnohočetného myelomu a ixazomib – první perorální inhibitor proteazomu – je v léčbě MM novou slibnou možností. Prokázal klinický přínos u pacientů s RRMM v monoterapii i v kombinovaných léčebných režimech. Studie TOURMALINE-MM1 fáze III potvrdila, že doplnění ixazomibu k režimu lenalidomid-dexametazon u pacientů s RRMM významně prodloužilo dobu přežití bez progrese nemoci, bez prohloubení toxicity léčby. Zvláště povzbudivé jsou výsledky u vysoce rizikových nemocných – u významně předléčených pacientů a zejména u pacientů s nepříznivými cytogenetickými abnormalitami, u kterých kombinace ixazomib-RD snižuje poměr rizika progrese nemoci nebo úmrtí a tím zásadně zlepšuje jejich prognózu. Výhradně perorální režim ixazomib-RD je nemocnými celkově velmi dobře tolerován a zachovává jejich kvalitu života na vysoké úrovni. Poskytuje možnost dlouhodobé a účinné léčby se zvládnutelnou toxicitou a stává se pro pacienty s RRMM novým léčebným standardem. Podobně jako u jiných kombinovaných režimů s drahými léky je finanční zátěž významným faktorem blokujícím rychlé uvedení do běžné praxe.
V současné době probíhá klinické hodnocení ixazomibu v dlouhodobé a udržovací léčbě pacientů s NDMM a v kombinaci s jinými účinnými látkami v léčbě pacientů s RRMM. Na výsledky těchto studií se netrpělivě čeká. Pomohou dále vymezit roli ixazomibu při léčbě MM z hlediska optimálních kombinovaných režimů a léčebných přístupů v relapsu, primoléčbě i udržovací fázi nemoci.
Použité zkratky
- AE – nežádoucí účinky
- ASCT – autologní transplantace kmenových buněk
- BSA – plocha tělesného povrchu
- CR – kompletní remise
- EMA – Evropská léková agentura
- FDA – Úřad pro kontrolu potravin a léčiv
- HR – poměr rizika
- MM – mnohočetný myelom
- MTD – maximální tolerovaná dávka
- NDMM – nově diagnostikovaný mnohočetný myelom
- ORR – celková léčebná odpověď
- OS – celkové přežití
- PFS – přežití bez progrese
- PK – farmakokinetická
- PN – periferní neuropatie
- QoL – kvalita života
- RD – lenalidomid, dexametazon
Podíl autorů na přípravě rukopisu
HP – příprava rukopisu
TJ, LS – revize, korekce rukopisu
RH – revize, korekce, závěrečná kontrola rukopisu
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů.
Poděkování
Autoři děkují za písemnou podporu paní Jane Saundersové ze společnosti FireKite, se sídlem v Ashfieldu, která je součástí společnosti UDG Healthcare plc, při tvorbě tohoto dokumentu. Jeho zpracování bylo financováno společností Millennium Pharmaceuticals, Inc. a je v souladu s etickými zásadami Správné publikační praxe 3 [53].
Doručeno do redakce dne 27. 7. 2017.
Přijato po recenzi dne 7. 9. 2017.
MUDr. Hana Plonková
Klinika hematoonkologie
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
email: hana.plonkova@fno.cz
Zdroje
1. Palumbo A, Anderson K. Multiple myeloma. N Engl J Med 2011;364 : 1046–1060.
2. Röllig C, Knop S, Bornhäuser M. Multiple myeloma. Lancet 2015;385 : 2197–2208.
3. Anderson KC. Oncogenomics to target myeloma in the bone marrow microenvironment. Clin Cancer Res 2011;17 : 1225–1233.
4. Moreau P, Masszi T, Grzasko N, et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016;374 : 1621–1634.
5. Kumar SK, Dispenzieri A, Lacy MQ, et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia 2014;28 : 1122–1128.
6. Dimopoulos MA, Richardson PG, Moreau P, et al. Current treatment landscape for relapsed and/or refractory multiple myeloma. Nat Rev Clin Oncol 2015;12 : 42–54.
7. Kumar SK, Lee JH, Lahuerta JJ, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMIDs and bortezomib: a multicenter International Myeloma Working Group study. Leukemia 2012;26 : 149–157.
8. Bergsagel PL, Mateos MV, Gutierrez NC, et al. Improving overall survival and overcoming adverse prognosis in the treatment of cytogenetically high-risk multiple myeloma. Blood 2013;121 : 884–892.
9. Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. Blood 2016;127 : 2955–2962
10. Palumbo A, Bringhen S, Mateos MV, et al. Geriatric assessment predicts survival and toxicities in elderly myeloma patients: an International Myeloma Working Group report. Blood 2015;125 : 2068–2074.
11. Dimopoulos MA, Delimpasi S, Katodritou E, et al. Significant improvement in the survival of patients with multiple myeloma presenting with severe renal impairment after the introduction of novel agents. Ann Oncol 2014;25 : 195–200.
12. Greipp PR, San MJ, Durie BG, et al. International staging system for multiple myeloma. J Clin Oncol 2005;23 : 3412–3420.
13. Cavo M, Pantani L, Petrucci MT, et al. Bortezomib-thalidomide-dexamethasone is superior to thalidomide-dexamethasone as consolidation therapy after autologous hematopoietic stem cell transplantation in patients with newly diagnosed multiple myeloma. Blood 2012;120 : 9–19.
14. Durie B, Hoering A, Rajkumar SV, et al. Bortezomib, lenalidomide and dexamethasone vs. lenalidomide and dexamehasone in patients with previously untreated multiple myeloma without an intent for immediate autologous stem cell transplant (ASCT): results of the randomized phase III trial SWOG S0777. Blood 2015;126 : 25.
15. Moreau P, Hulin C, Macro M, et al. VTD is superior to VCD prior to intensive therapy in multiple myeloma: results of the prospective IFM2013-04 trial. Blood 2016;127 : 2569–2574.
16. Stewart AK, Rajkumar SV, Dimopoulos MA, et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015;372 : 142–152.
17. Dimopoulos M, Oriol A, Nahi H, et al. An open-label, randomised, phase 3 study of daratumumab, lenalidomide, and dexamethasone (DRD) versus lenalidomide and dexamethasone (RD) in relapsed or refractory multiple myeloma (RRMM): POLLUX [abstract]. Haematologica 2016;101 : 342.
18. Palumbo A, Chanan-Khan AA, Weisel K, et al. Phase III randomized controlled study of daratumumab, bortezomib, and dexamethasone (DVd) versus bortezomib and dexamethasone (Vd) in patients with relapsed or refractory multiple myeloma (RRMM): CASTOR study [abstract]. J Clin Oncol 2016;34: LBA4.
19. Attal M, Lauwers-Cances V, Marit G, et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med 2012;366 : 1782–1791.
20. McCarthy PL, Owzar K, Hofmeister CC, et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med 2012;366 : 1770–1781.
21. Neben K, Lokhorst HM, Jauch A, et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. Blood 2012;119 : 940–948.
22. Richardson PG, Delforge M, Beksac M, et al. Management of treatment-emergent peripheral neuropathy in multiple myeloma. Leukemia 2012;26 : 595–608.
23. Amgen. KYPROLIS® (carfilzomib) for injection, for intravenous use. Prescribing information, 2016. http://pi.amgen.com/united_states/kyprolis/kyprolis_pi.pdf. 2016.
24. Romanus D, Raju A, Yong C, et al. Duration of therapy in U.S. pa-tients treated for relapsed/refractory multiple myeloma (RRMM) in the real-world [abstract]. Haematologica 2016;101(S1): E1301.
25. Lonial S, Dimopoulos M, Palumbo A, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015;373 : 621–631.
26. San-Miguel JF, Hungria VT, Yoon SS, et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: a multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014;15 : 1195–1206.
27. Jelínek T, Všianská P, Hájek R. Monoklonální protilátky v léčbě mnohočetného myelomu. Transfuze Hematol. dnes 2015;21 : 74–83.
28. Kubiczková L, Matějíková J, Sedlaříková L, et al. Inhibitory proteazomu v léčbě mnohočetného myelomu. Klin Onkol 2013;26 : 11–18.
29. Kupperman E, Lee EC, Cao Y, et al. Evaluation of the proteasome inhibitor MLN9708 in preclinical models of human cancer. Cancer Res 2010;70 : 1970–1980.
30. Takeda Pharmaceuticals Limited. NINLARO® (ixazomib) capsules, for oral use. Prescribing information, 2015. Dostupné na www: https://www.ninlarohcp.com/prescribing-information.pdf . 2015.
31. Kumar SK, Bensinger WI, Zimmerman TM, et al. Phase 1 study of weekly dosing with the investigational oral proteasome inhibitor ixazomib in relapsed/refractory multiple myeloma. Blood 2014;124 : 1047–1055.
32. Richardson PG, Baz R, Wang M, et al. Phase 1 study of twice-weekly ixazomib, an oral proteasome inhibitor, in relapsed/refractory multiple myeloma patients. Blood 2014;124 : 1038–1046.
33. Gupta N, Zhao Y, Hui AM, et al. Switching from body surface area-based to fixed dosing for the investigational proteasome inhibitor ixazomib: a population pharmacokinetic analysis. Br J Clin Pharmacol 2015;79 : 789–800.
34. Kumar SK, Berdeja JG, Niesvizky R, et al. Safety and tolerability of ixazomib, an oral proteasome inhibitor, in combination with lenalidomide and dexamethasone in patients with previously untreated multiple myeloma: an open-label phase 1/2 study. Lancet Oncol 2014;15 : 1503–1512.
35. Gupta N, Hanley MJ, Harvey RD, et al. A pharmacokinetics and safety phase 1/1b study of oral ixazomib in patients with multiple myeloma and severe renal impairment or end-stage renal disease requiring haemodialysis. Br J Haematol 2016;174 : 748–759.
36. Gupta N, Hanley MJ, Venkatakrishnan K, et al. Pharmacokinetics of ixazomib, an oral proteasome inhibitor, in solid tumour patients with moderate or severe hepatic impairment. Br J Clin Pharmacol 2016;82 : 728–738.
37. Richardson P, Hofmeister C, Rosenbaum C, et al. Twice-weekly ixazomib plus lenalidomide-dexamethasone in patients with newly diagnosed multiple myeloma: long-term follow-up data for patients who did not undergo stem cell transplantation (SCT) [abstract]. Haematologica 2017;102(S2): S780.
38. Richardson PG, Hofmeister CC, Rosenbaum CA, et al. Twice-weekly oral MLN9708 (ixazomib citrate), an investigational proteasome inhibitor, in combination with lenalidomide (len) and dexamethasone (dex) in patients (pts) with newly diagnosed multiple myeloma (MM): final phase 1 results and phase 2 data [abstract]. Blood 2013;122 : 535.
39. Dimopoulos MA, Grosicki S, Jedrzejczak WW, et al. Randomized phase 2 study of the all-oral combination of investigational proteasome inhibitor (PI) ixazomib plus cyclophosphamide and low-dose dexamethasone (ICd) in patients (pts) with newly diagnosed multiple myeloma (NDMM) who are transplant-ineligible (NCT02046070) [abstract]. Blood 2015;126 : 26.
40. Kumar SK, LaPlant B, Roy V, et al. Phase 2 trial of ixazomib in pa-tients with relapsed multiple myeloma not refractory to bortezomib [abstract]. Blood Cancer J 2015;5: e338.
41. Kumar SK, LaPlant B, Reeder CB, et al. Randomized phase 2 trial of two different doses of ixazomib in patients with relapsed multiple myeloma not refractory to bortezomib [abstract]. Blood 2015;126 : 3050.
42. Avet-Loiseau H, Bahlis N, Chng WJ, et al. Impact of cytogenetic risk status on efficacy and safety of ixazomib-lenalidomide-dexamethasone (IRd) vs placebo-Rd in relapsed/refractory multiple myeloma patients in the global TOURMALINE-MM1 study [abstract]. Haematologica 2016;101(S1): 80.
43. Mateos MV, Masszi T, Grzasko N, et al. Efficacy and safety of oral ixazomib-lenalidomide-dexamethasone (IRd) vs placebo-Rd in relapsed/refractory multiple myeloma patients: impact of prior therapy in the phase 3 TOURMALINE-MM1 study [abstract]. Haematologica 2016;101(S1): 527.
44. San Miguel JF, Schlag R, Khuageva NK et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med 2008;359 : 906–917.
45. Krishnan AY, Kapoor P, Palmer J, et al. A phase I/II study of ixazomib, pomalidomide, dexamethasone in relapsed refractory multiple myeloma: initial results [abstract]. J Clin Oncol 2016;34 : 8008.
46. Reu FJ, Valent J, Malek E, et al. A phase I study of ixazomib in combination with panobinostat and dexamethasone in patients with relapsed or refractory multiple myeloma [abstract]. Blood 2015;126 : 4221.
47. Voorhees P, Mulkey F, Hassoun H, et al. Alliance A061202. A phase I/II study of pomalidomide, dexamethasone and ixazomib versus pomalidomide and dexamethasone for patients with multiple myeloma refractory to lenalidomide and proteasome inhibitor based therapy: phase I results [abstract]. Blood 2015;126 : 375.
48. Moreau P, Pylypenko H, Grosicki S, et al. Subcutaneous versus intravenous bortezomib in patients with relapsed multiple myeloma: subanalysis of patients with renal impairment in the phase III MMY-3021 study. Haematologica 2015;100: e207–e210.
49. Harvey RD. Incidence and management of adverse events in patients with relapsed and/or refractory multiple myeloma receiving single-agent carfilzomib. Clin Pharmacol 2014;6 : 87–96.
50. Gupta N, Huh Y, Hutmacher MM, et al. Integrated nonclinical and clinical risk assessment of the investigational proteasome inhibitor ixazomib on the QTc interval in cancer patients. Cancer Chemother Pharmacol 2015;76 : 507–516.
51. Aaronson NK, Ahmedzai S, Bergman B, et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993;85 : 365–376.
52. Cocks K, Cohen D, Wisloff F, et al. An international field study of the reliability and validity of a disease-specific questionnaire module (the QLQ-MY20) in assessing the quality of life of patients with multiple myeloma. Eur J Cancer 2007;43 : 1670–1678.
53. Battisti WP, Wager E, Baltzer L, et al. Good publication practice for communicating company sponsored medical research: GPP3. Ann Intern Med 2015 : 461–464.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“
- První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
- Epigenetické změny jako nový nástroj pro prognostickou stratifikaci pacientů s chronickou lymfocytární leukemií
- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- 25 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Obsah ročníku 23/2017
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



