-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
Angioimmunoblastic T-lymphoma: overview, single centre experience and case report of the sequential development of difuse large B-cell lymphoma
Angioimmunoblastic T-cell lymphoma is a rare, aggressive lymphoproliferative disease that arises from T-cells derived from the germinal centre. It is usually diagnosed in advanced stages but B-symptoms, oedemas and various skin changes can occur as initial signs of the disease and may be even more significant than lymph node or organ involvement. These general symptoms can mask the lymphoma and delay diagnosis. Remarkably, a B-cell lymphoma may develop during the course of this disease, usually diffuse large B-cell lymphoma. In this article, we present a general overview, single centre experience from the past 16 years and a case report of diffuse large B-cell lymphoma occurring during the treatment of angioimmunoblastic T-cell lymphoma in a single patient.
Key words:
angioimmunoblastic T-cell lymphoma – diffuse large B-cell lymphoma – immunoblasts – EBV
Autoři: J. Michalka 1; A. Janíková 1; J. Soukup 2
; M. Kalinová 2; L. Křen 3; Z. Král 1; M. Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika FN Brno a Lékařská fakulta Masarykovy univerzity v Brně 1; Ústav patologie a molekulární medicíny 2. lékařské fakulty Univerzity Karlovy a FN Motol 2; Ústav patologické anatomie FN Brno a Lékařská fakulta Masarykovy univerzity v Brně 3
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 4, p. 215-222.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Angioimunoblastický T-lymfom je vzácnou agresivní lymfoproliferací vycházející z T-lymfocytů germinálního centra. Obvykle je diagnostikován v pokročilém stadiu, ale B-symptomy, výpotky a kožní změny jsou běžným a často i prvním projevem nemoci, mnohdy výraznější než uzlinové nebo orgánové postižení. Právě celkové nespecifické projevy mohou vést k maskování lymfomu a jeho pozdní diagnostice. Zvláštní zajímavostí je, že v průběhu této nemoci může dojít ke vzniku B-lymfoproliferace, nejčastěji difuzního velkobuněčného B-lymfomu. V tomto článku uvádíme základní přehled problematiky, charakteristiku a výsledky léčby pacientů léčených na naší klinice za posledních 16 let a kazuistiku vzniku difuzního velkobuněčného B-lymfomu během léčby angioimunoblastického T-lymfomu u jedné pacientky.
Klíčová slova:
angioimunoblastický T-lymfom – difuzní velkobuněčný B-lymfom – imunoblasty – EBVÚVOD
Angioimunoblastický T-lymfom (AITL) je maligní lymfoproliferací, která představuje asi 1–2 % všech nehodgkinských lymfomů (NHL) a 15–20 % ze všech periferních T-lymfomů (PTCL) [1, 2]. AITL vychází z folikulárních T-helper lymfocytů germinálního centra, někteří patologové vnímají tuto nemoc i jako krajní nález v kontinuu přechodů od atypické reaktivní lymfoidní hyperplazie k typické rozvinuté lymfoproliferaci [3, 4]. V aktuální revizi WHO klasifikace lymfoidních malignit z roku 2016 se z periferních T-lymfomů dále vyčlenila fenotypově odlišná kategorie nazvaná folikulární T-buněčný lymfom (FTCL), která sice může obsahovat stejné genetické změny jako AITL, ale častěji se prezentuje lokalizovaným postižením s méně častými systémovými projevy. Oba typy můžou od počátku v příměsi obsahovat B-buněčné imunoblasty, typicky EBV pozitivní, u kterých může v průběhu nemoci dojít ke klonální expanzi a vzniku některého z B-lymfomů, nejčastěji difuzního velkobuněčného B-lymfomu (DLBCL) [5]. Přesná incidence tohoto jevu není zcela známa, protože při relapsu či progresi AITL se pokaždé neprovádí rebiopsie s histologickým ověřením diagnózy, ale některé práce naznačují, že se může jednat o relativně častý jev, pozorovaný téměř u čtvrtiny všech případů AITL [6].
Histopatologická charakteristika
U AITL je architektonika lymfatické uzliny typicky setřená nádorovou infiltrací, která zasahuje mimo vazivové obaly. Mezi zbytkovými benigními folikuly je patrna proliferace cévních endotelií. Nádorové lymfocyty jsou pozitivní na CD2, CD3, CD4, CD10, CXCL-13, PD1 a často BCL-6. Roztroušené velké imunoblasty jsou CD20 pozitivní a často obsahují Epsteina-Barrové virovou (EBV) RNA (EBER pozitivní). Přítomna je síť CD21 pozitivních folikulárních dendritických buněk mimo folikuly, převážně kolem cév. Přestavba TCR genu může být až v 10–30 % negativní a asi v 10–30 % případů lze naopak prokázat přestavbu genu pro imunoglobulinové řetězce, většinou z EBV pozitivního B-buněčného klonu [1–3].
Klinická a laboratorní charakteristika
Medián věku nemocných s AITL je 65 let, typicky je většinou přítomna generalizovaná, ale nevýrazná (1,5–3 cm) lymfadenopatie, B-symptomy a extranodální postižení. Častá je hepatomegalie, splenomegalie, výpotky a kožní změny. Možnými projevy současné B-buněčné hyperreaktivity mohou být další klinické a laboratorní změny jako polyklonální hypergamaglobulinemie a autoimunní hemolytická anémie, případně i jiné autoimunitní projevy. Právě celkové nespecifické a systémové projevy přispívají k maskování a svízelné diagnostice AITL. Diagnostické obtíže může dál negativně ovlivňovat probíhající kortikoterapie autoimunitních jevů. Pacienti jsou navíc imunodeficientní a mají zvýšenou predispozici k oportunním infekcím [2, 7, 8, 9, 10].
Průběh a léčba
Průběh AITL je většinou agresivní, léčebné výsledky neuspokojivé a prognóza špatná. Pětileté přežití dosahuje asi jen jedna třetina pacientů, většina se však nedožije 3 let od stanovení diagnózy bez ohledu na způsob léčby [1, 2, 10]. Nejčastější indukční léčbou je stále CHOP (cyklofosfamid, doxorubicin, vincristin, prednison), případně CHOEP (cyklofosfamid, etoposid, doxorubicin, vincristin, prednison) s asi 51–53% pravděpodobností dosažení kompletní remise (CR) [7, 11]. U mladších pacientů je na zvážení konsolidace vysokodávkovanou chemoterapií s autologní transplantací periferních kmenových buněk (ASCT) v rámci léčby 1. linie [7, 12]. Léčba relapsu je obvykle zahájena využitím konvenčních záchranných chemoterapeutických režimů jako ICE [13] (ifosfamid, etoposid, karboplatina), DHAP [14] (cisplatina, cytosinarabinosid, dexamethazon), GDP [15] (gemcitabin, cisplatina, dexamethazon), nebo bendamustin v monoterapii [16]. Prognóza je velmi nepříznivá a medián celkového přežití po relapsu pouze 5,5 měsíců [17]. Potenciálně kurativní léčbou je jedině alogenní transplantace krvetvorných buněk, ovšem tu lze použít pouze pro mladší nemocné s chemosenzitivním lymfomem. Podle dat retrospektivní studie Lymfomové části Evropské skupiny pro transplantaci krvetvorných buněk (EBMT Lymphoma Working Party) je mortalita nesouvisející s relapsem (NRM) po alogenní transplantaci asi 25 % v 12 měsících, 3leté přežití bez progrese (PFS) 53 % a 3leté celkové přežití 64 % [18]. Z novějších léků jsou Federálním úřadem pro kontrolu potravin a léčiv (FDA) v USA schváleny v léčbě relabujících/refrakterních případů PTCL léčiva pralatrexát, romidepsin a belinostat v kontinuální monoterapii. Tyto léky mají relativně nízkou toxicitou a jsou podávany s cílem zachovat kvalitu života, jinak se procento celkových léčebných odpovědí (ORR) pohybuje mezi 25,8–38 %. Medián trvání léčebné odpovědi je ovšem krátký, pohybuje se mezi 1,6–8,9 měsíců. Uvedené léky v současnosti nejsou registrovány Státním ústavem pro kontrolu léčiv (SÚKL) v ČR. O něco lepší léčebné výsledky má u nemocných s AITL brentuximab vedotin (54 % ORR, medián PFS 6,7 měsíců) a cyklosporin (ORR 67 %, medián PFS nestanoven) [7, 19]. Je však nutno říct, že i tato data jsou získána z poměrně malých pacientských souborů, trvání léčebné odpovědi je převážně krátké, a tak ani tyto léky zřejmě nezpůsobí revoluci v léčbě T-lymfomů.
Charakteristika pacientů léčených na Interní hematologické a onkologické klinice FN Brno
Na našem pracovišti evidujeme mezi lety 2000 až 2016 celkem 20 případů nově diagnostikovaných pacientů s AITL, to představuje 16 % ze všech případů periferních T-lymfomů. Poměr mužů a žen je vyrovnaný 10 : 10, medián věku je 64 let (44–74). V 70 % (14/20) případů byly prvním projevem lymfomu celkové příznaky (B-symptomy, výpotky nebo kožní změny), jen v 30 % se v úvodu nemoc projevila lymfadenopatií. V našem souboru 20 pacientů byla indukční léčba v 85 % (17/20) režimem CHOP, CHOEP nebo některou z jejich variant (megaCHOP, miniCHOP). Stojí za pozornost, že téměř všichni pacienti, kteří dokončili indukční léčbu (16/17) dosáhli remise (PR nebo CR). Ovšem, u těch, kteří zrelabovali bylo její trvání krátké (medián PFS 6 měsíců, hodnoceno 8 pacientů). Autologní transplantaci periferních kmenových buněk absolvovalo celkem 5 pacientů. Alogenní transplantaci podstoupila pouze jedna pacientka (věk 44 let), která je dosud v remisi 3 roky po transplantaci. Ve 2 případech jsou zpětně jisté pochybnosti o správnosti diagnózy s ohledem na dlouholeté přežití bez progrese po indukční léčbě (PFS a OS > 13 a 16 let). Bohužel, tyto diagnostické vzorky již nejsou k dispozici pro případné konzultační vyšetření. V době analýzy zemřelo 12/20 pacientů, medián celkového přežití (OS) je u nich 16,5 měsíců (2–71). Tři pacienti jsou krátce po ukončení indukční léčby, a proto z hlediska PFS a OS nehodnoceni, 2 pacienti zemřeli na komplikace v úvodu léčby a jeden pacient zemřel, aniž byl léčen. Podrobná charakteristika našeho souboru je uvedena v tabulkách 1 a 2.
Tab. 1. Klinická charakteristika souboru pacientů s AITL léčených na IHOK v letech 2000–2016 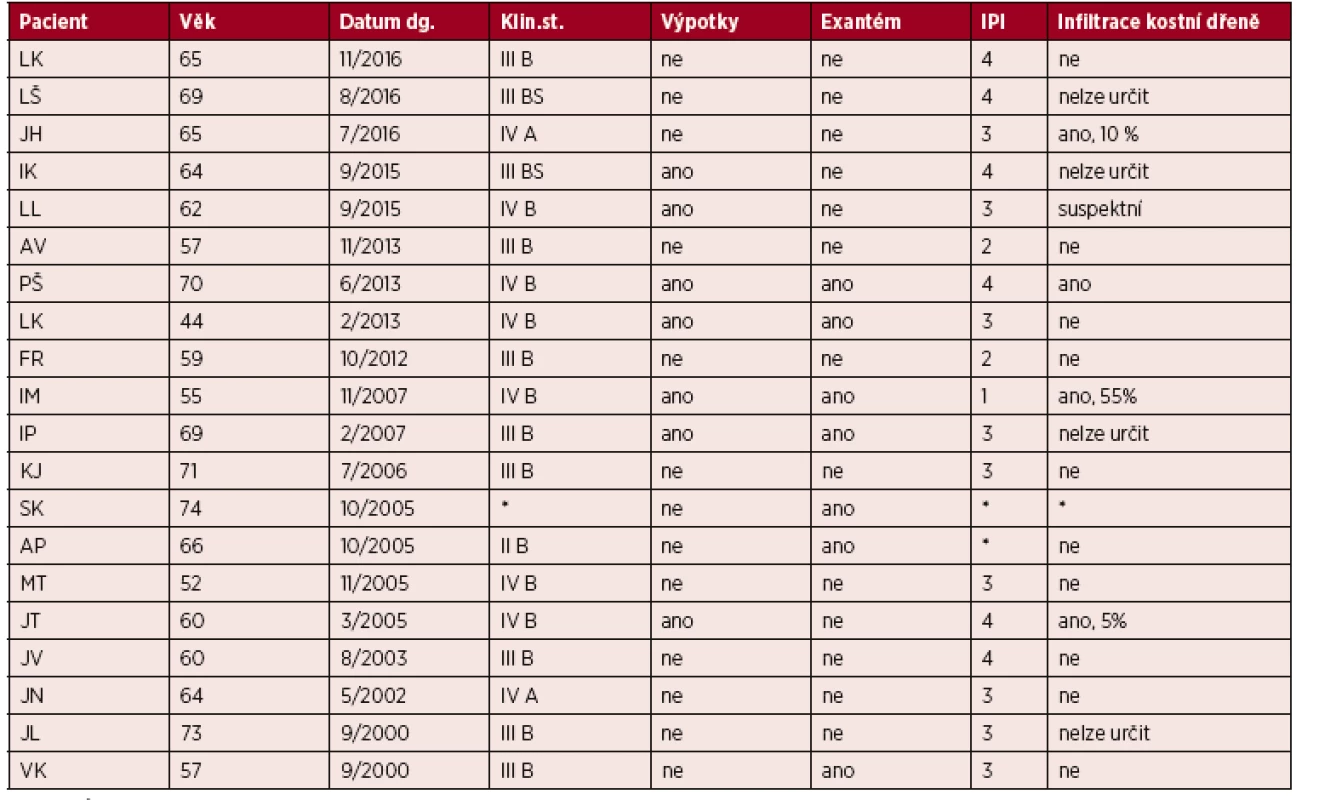
*Údaje nelze dohledat, chybí dokumentace. Tab. 2. Léčba a její výsledky v souboru pacientů léčených na IHOK v letech 2000–2016 Data k 8/2017. 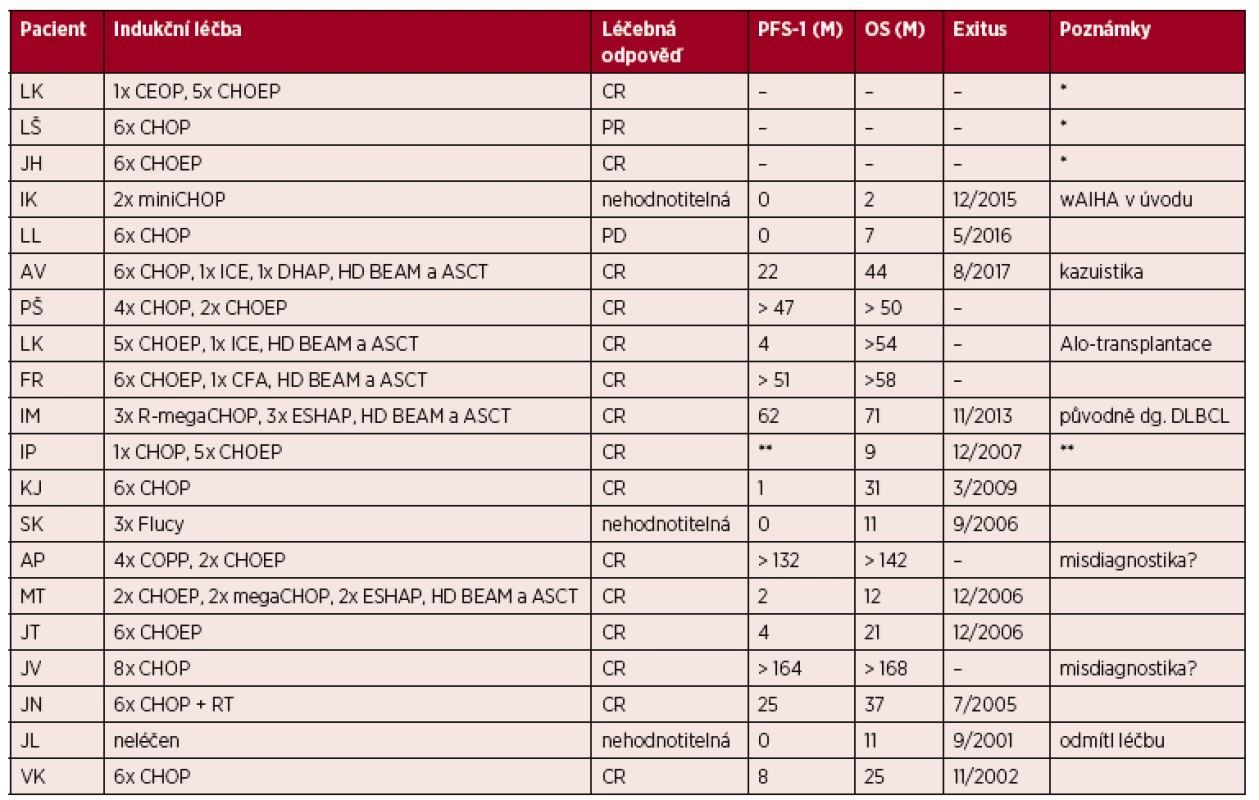
*Nehodnoceno, méně než 1 rok po ukončení indukční léčby. **Stav nemoci a příčina smrti neznámé. CR – kompletní remise, PR – parciální remise, PD – progresivní onemocnění, PFS – přežití bez progrese, OS – celkové přežití, DLBCL – difuzní velkobuněčný B-lymfom KAZUISTIKA
V listopadu 2013 byla na naše pracoviště přijata 56letá pacientka s anamnézou 3–4 měsíců progredujícího generalizovaného uzlinového syndromu, nočních potů a hmotnostního úbytku 11 kg. Z exstirpované krční lymfatické uzliny byl diagnostikován angioimunoblastický T-lymfom (AITL), klinické stadium IIIB podle Ann Arbor klasifikace. Imunohistochemicky byla na nádorových buňkách zjištěna pozitivita CD3, CD5, BCL6 a negativita znaků CD8, CD15, perforin, granzym a TIA. Ki67 bylo pozitivní ve více než 60 % nádorových buněk. V parakortexu byly zastiženy hojné disperzní reaktivní imunoblasty (CD30+, CD20+, PAX5+) – obrázky 1–9.
1. odběr 2013 – AITL
Obr. 1. Vzorek z 1. bioptického odběru z roku 2013 – AITL Barvení hematoxylin-eozin. V okolí proliferujících cév patrna nádorová infiltrace ze středně velkých nádorových buněk, někdy s mírnými atypiemi, často se světlejší plazmou, fokálně příměs eozinofilů. 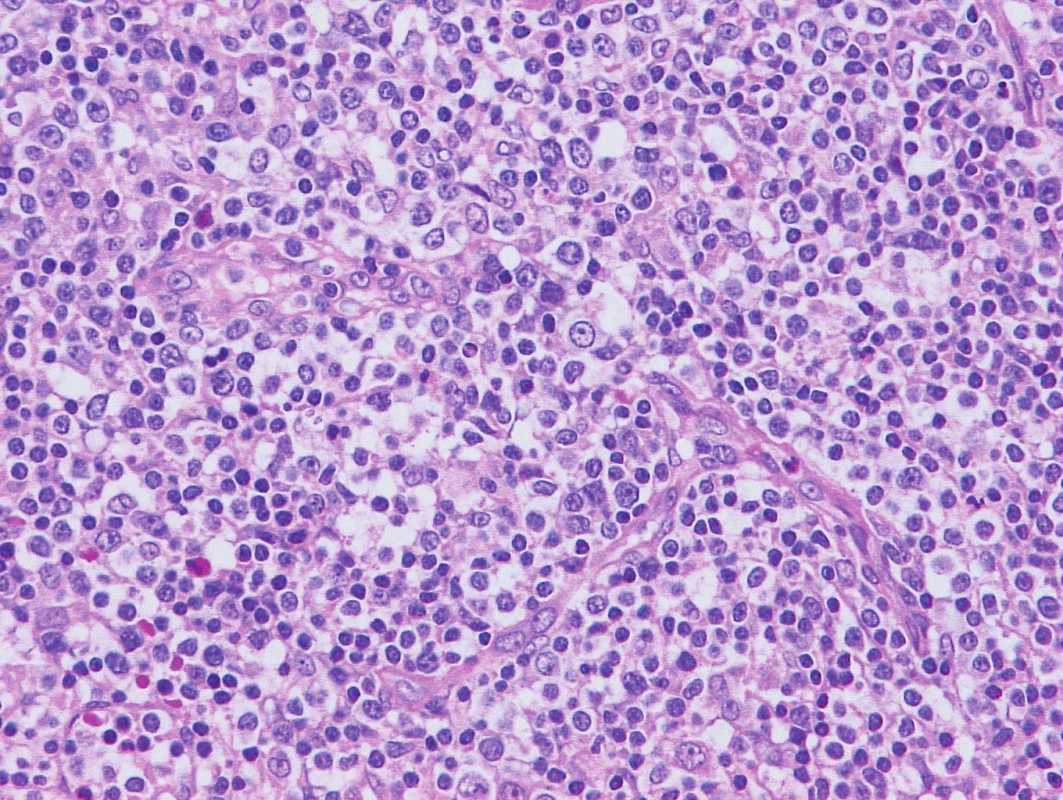
Obr. 2. Vzorek z 1. bioptického odběru z roku 2013 – AITL CD5 pozitivita nádorových buněk, cévy jsou negativní. 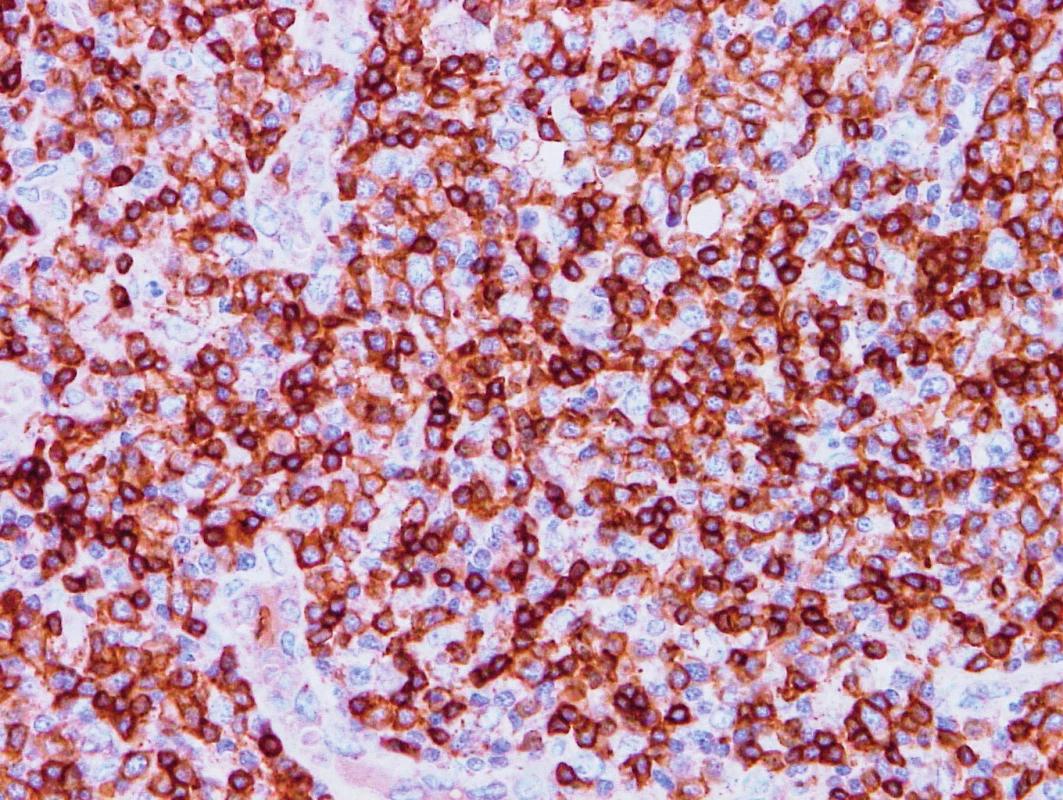
Obr. 3. Vzorek z 1. bioptického odběru z roku 2013 – AITL CD20 pozitivita hojných disperzních velkých nenádorových B-buněk v příměsi nádorové buňky jsou negativní. 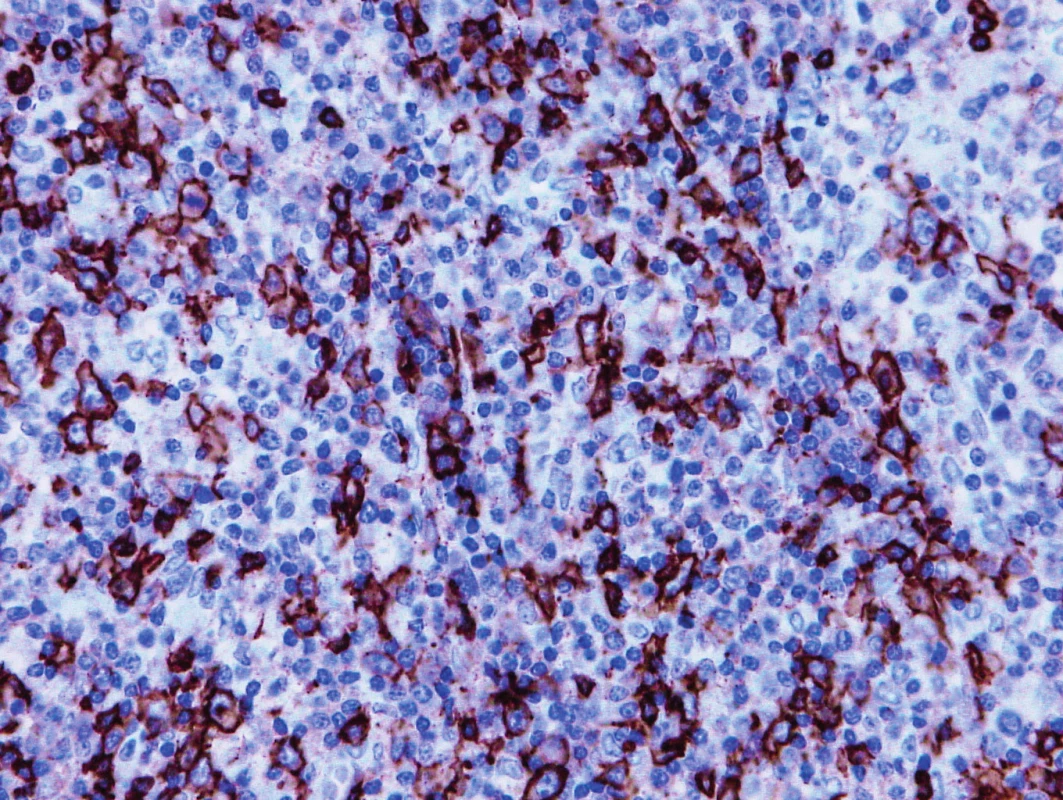
Obr. 4. Vzorek z 1. bioptického odběru z roku 2013 – AITL CD23 pozitivita hyperplastických sítí folikulárních dendritických buněk. 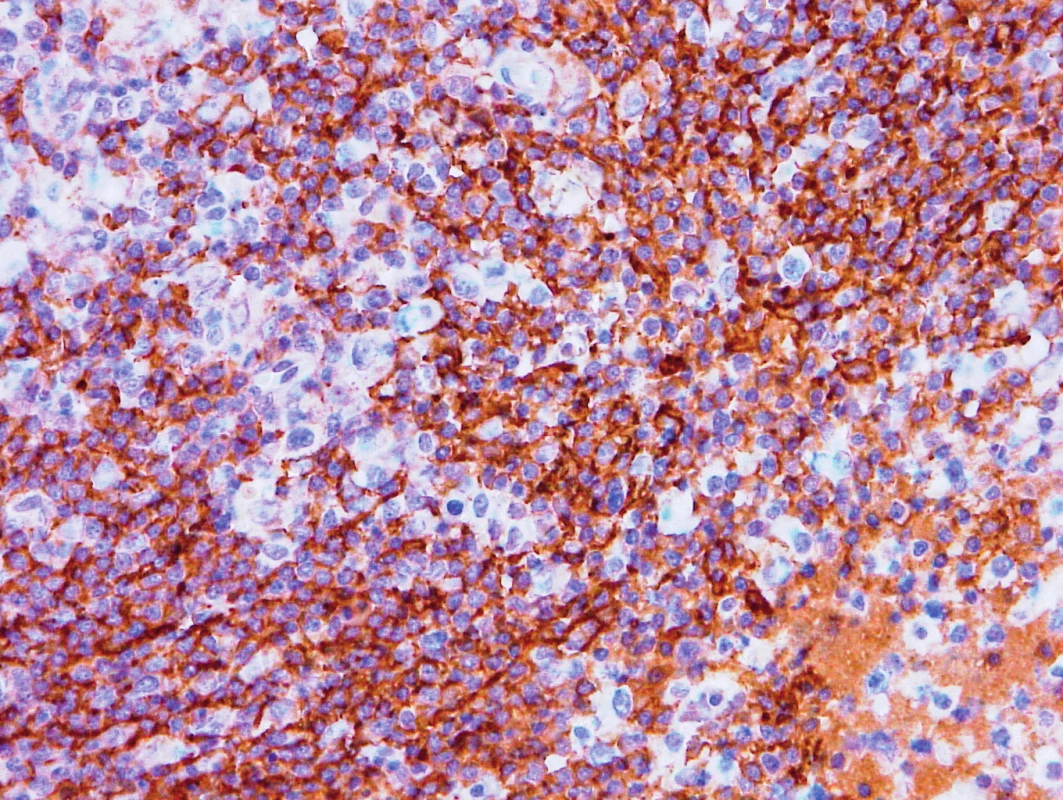
Obr. 5. Vzorek z 1. bioptického odběru z roku 2013 – AITL BCL6 pozitivita nádorových buněk. 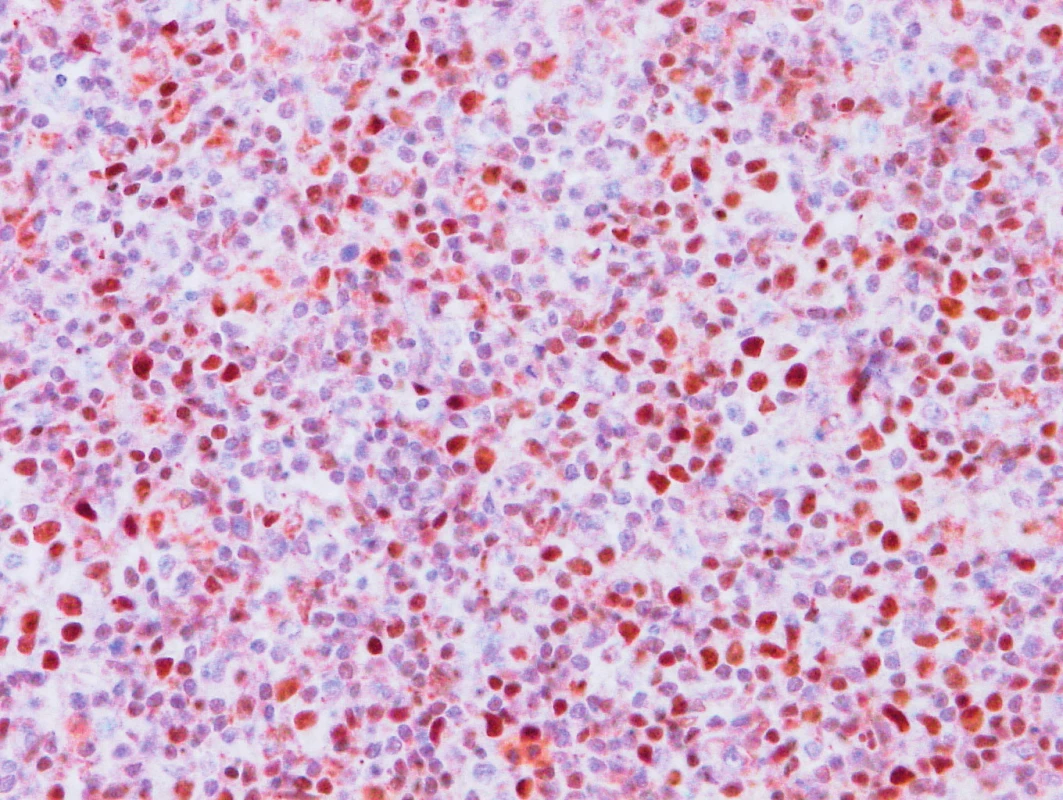
2. odběr DLBCL
Obr. 6. Vzorek z 2. bioptického odběru – DLBCL Barvení podle Giemsy, difuzní lymfom z velkých buněk. 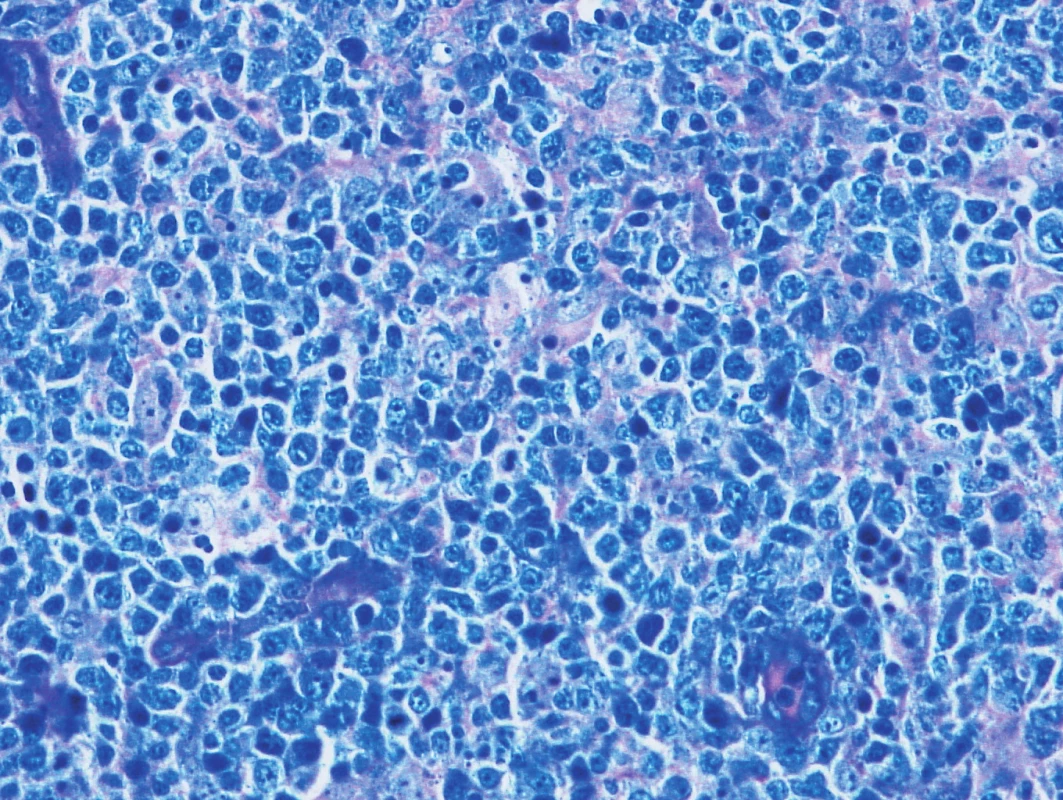
Obr. 7. Vzorek z 2. bioptického odběru – DLBCL CD20 pozitivita velkých buněk. 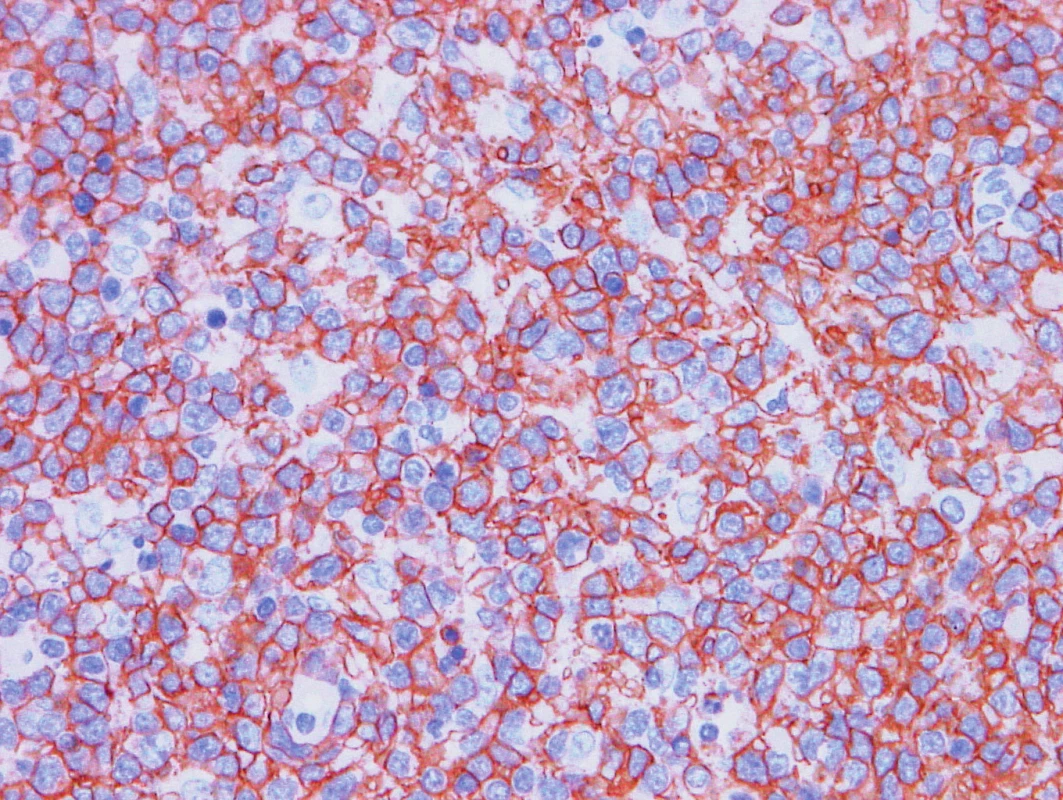
Obr. 8. Vzorek z 2. bioptického odběru – DLBCL CD5 pozitivita minoritních disperzních buněk. 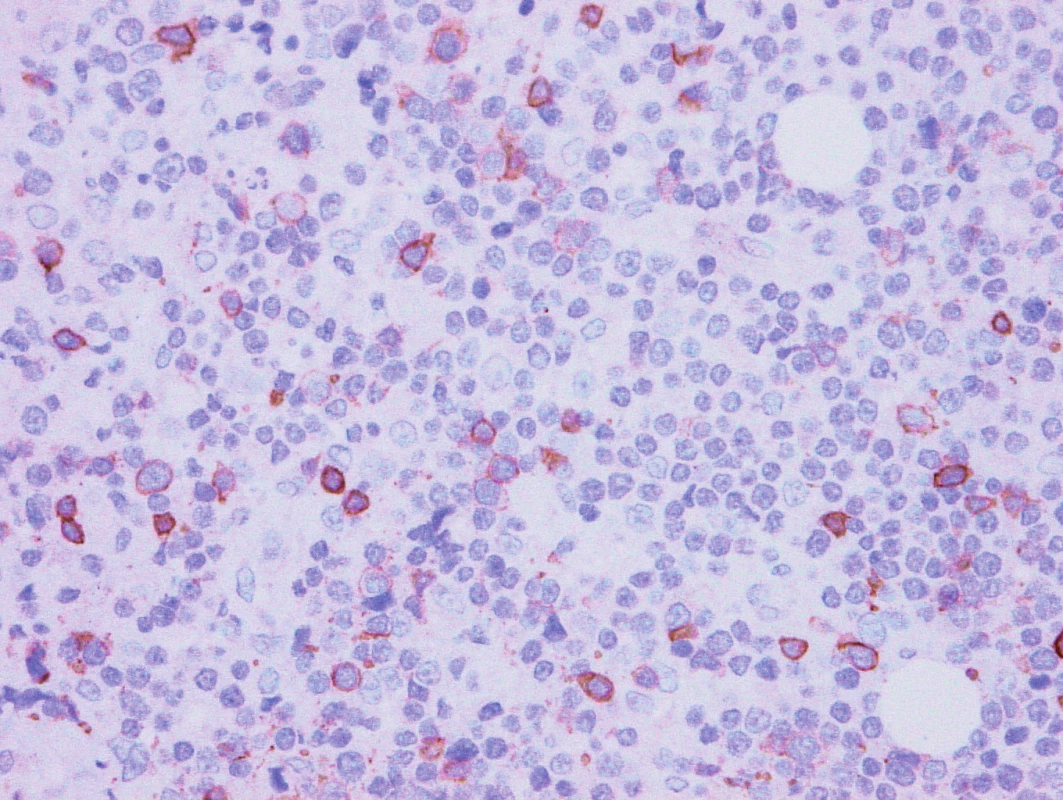
3. odběr AITL
Obr. 9. Vzorek z 3. bioptického odběru – AITL CD5 pozitivita nádorových buněk, cévy jsou negativní, vzhled obdobný jako v prvním odběru. 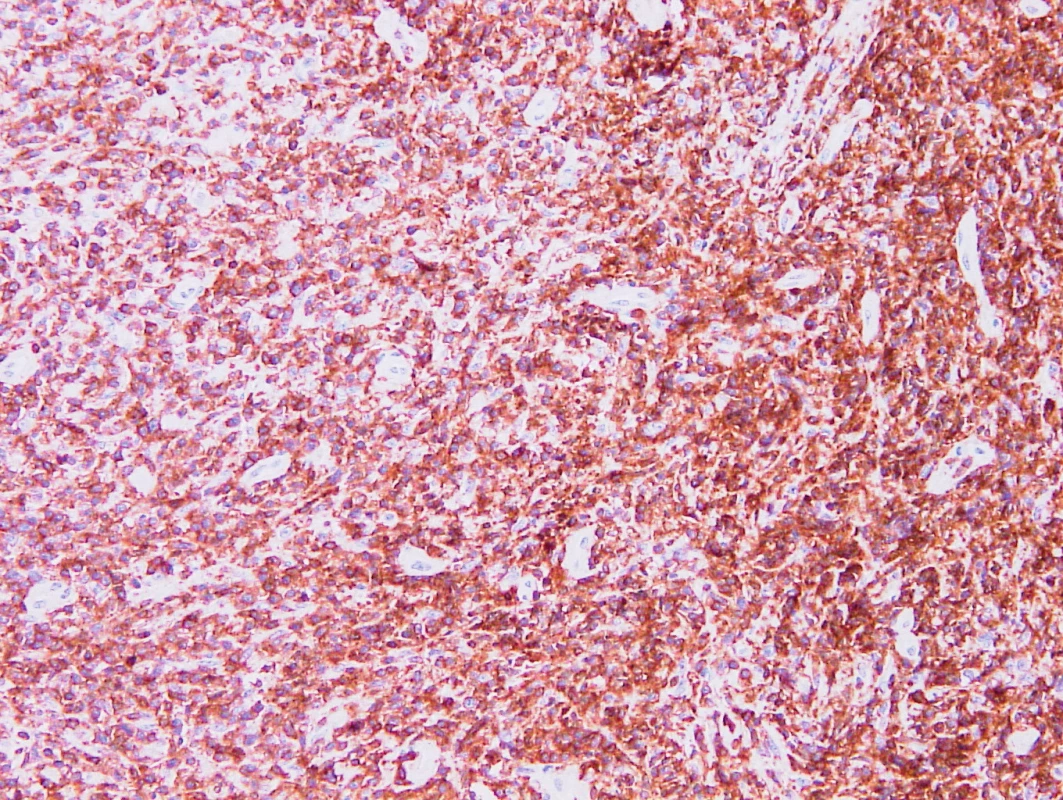
Metodou PCR byla prokázána klonální přestavba TCR a pomocí FISH latentní EBV infekce v nečetných buňkách. Pacientka absolvovala 6 cyklů chemoterapie CHOP, dosáhla kompletní remise (CR) a bylo rozhodnuto pro primární konsolidaci vysokodávkovanou chemoterapií s následným provedením autologní transplantace krvetvorných buněk (ASCT). Po podání 1. cyklu chemoterapie ICE vzniklo podezření na progresi lymfomu v krčních lymfatických uzlinách na základě palpačního nálezu a ultrasonografie, kde byla popsána suspektní uzlina velikosti 40 x 14 mm a v okolí menší, ale kulaté uzliny kolem 2 cm. Než se podařilo zorganizovat exstirpaci, došlo ke spontánní regresi nálezu, která byla potvrzena i na CT vyšetření. Pro nejednoznačnou klinickou odpověď však bylo pokračováno dalším cyklem chemoterapie DHAP, na dalším CT vyšetření potvrzeno trvání remise a léčba byla podle původního plánu zakončena podáním vysokodávkované chemoterapie režimem BEAM (carmustin, etoposid, cytosar, melfalan) s následnou ASCT v červenci 2014. Celý průběh léčby byl doprovázen častými infekcemi, převážně respiračními. Po 22 měsících od dosažení remise indukční léčbou se objevila nová krční lymfadenopatie, provedena exstirpace zvětšené krční uzliny a diagnóza byla na morfologické úrovni uzavřena jako difuzní velkobuněčný B-lymfom (DLBCL), varianta centroblastická, imunofenotyp nonGC-like (CD20+, CD79a+, PAX5+, CD30+, MUM1+, CD10-, BCL6-, Ki67 pozitivita v 90 % nádorových buněk, EBER+. Celkem jednoznačný morfologický nález byl následně potvrzen pomocí PCR, průkazem klonální přestavby imunoglobulinových řetězců. Molekulární vyšetření však navíc prokázalo i minoritní příměs původní populace AITL. V další linii léčby byl zvolen chemoterapeutický režim s rituximabem, konkrétně 4 cykly R-GDP, poslední cyklus komplikován febrilní neutropenií a plicní embolií. Krátce po ukončení posledního cyklu byla zjištěna další progrese v oblasti krční tonzily, z provedené biopsie byl v listopadu 2016 konstatován relaps opět T-lymfomu, vzhledem k BCL6 pozitivitě v souladu s původní diagnózou AITL. Vzhledem k zřejmě limitovanému postižení, předléčenosti a špatné toleranci předchozí léčby byla indikována paliativní radioterapie na oblast Waldayerova mízního okruhu, kterou pacientka ukončila v lednu 2017. Poslední nález na PET/CT z května 2017 svědčí pro další generalizovanou progresi lymfomu. Stav pacientky se postupně zhoršuje, není schopna podstoupit další onkologickou léčbu a v srpnu 2017 umírá na komplikace vyplývající z nezvratné progrese lymfomu.
DISKUSE
Angioimunoblastický T-lymfom je agresivní lymfoproliferací obvykle diagnostikovanou v pokročilém stadiu, doprovázenou četnými systémovými projevy nemoci a neuspokojivými výsledky léčby. Zvláštní variantou průběhu je možný vznik B-lymfomu během léčby AITL [20–23]. Tato situace se vysvětluje EBV infekcí či reaktivací v četných imunoblastech, které jsou v různé míře většinou přítomny v postižené tkáni již od počátku nemoci a dále ovlivněny imunodeficitním mikroprostředím nebo léčbou, rezultující v jejich klonální expanzi. Nejedná se tedy o transformaci z původního T-buněčného klonu, ale vlastně o sekundární malignitu [24]. Odborná publikace od Attygalle et al. popisuje revizi 31 případů AITL a v 7 případech (23 %) vznik EBV asociované B-lymfoproliferace (5x DLBCL, 2x klasický Hodgkinův lymfom) při klinickém relapsu lymfomu, jen jediný případ byl EBV negativní DLBCL [6]. EBV je zřejmě nejčastějším, ale nemusí být nutným etiopatogenetickým faktorem nádorové proliferace. V běžné klinické praxi se při podezření na relaps lymfomu pokaždé rebiopsie neprovádí, a to zejména v případech, kdy je postižená oblast obtížně diagnosticky přístupná. Když však víme, že se v případě klinického relapsu AITL může jednat o nově vzniklý B-lymfom, měla by být maximální snaha o histologické ověření. Terapeuticky pak lze použít cílenou léčbu podle konkrétního typu lymfomu, např. v případě DLBCL některý z režimů obsahujících rituximab. Pro úplnost je potřeba doplnit, že jsou dokumentovány i případy, kdy se AITL a DLBCL vyskytují u jednoho pacienta současně jako kompozitní lymfom, a raritně dokonce i případy, kdy naopak po léčbě DLBCL dojde k relapsu, ale histologicky je prokázán AITL [24–25].
ZÁVĚR
Cílem této práce je poskytnout základní přehled o angioimunoblastickém T-lymfomu včetně charakteristiky a léčebných výsledků u nemocných léčených na našem pracovišti a poukázat na jednu z možných variant jeho průběhu. Dokumentovaný případ sekvenčního vzniku difuzního velkobuněčného B-lymfomu s dopadem na léčebnou strategii by měl zdůraznit potřebu histologické verifikace při klinickém relapsu AITL.
Podíl autorů na přípravě rukopisu
JM – příprava rukopisu, kompletace dat, hlavní autor
AJ – námět a návrh struktury rukopisu, léčba pacienta z kazuistiky, kontrola odborné způsobilosti textu
JS – hodnocení histologických preparátů, poskytnutí obrazové dokumentace a sepsání histopatologických částí textu
MK – laboratorní část diagnostiky vzorků z kazuistiky
LK – hodnocení histologických preparátů, kontrola správnosti části textu týkajících se histopatologické diagnostiky
ZK – celková supervize
JM – celková supervize
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce dne 7. 8. 2017.
Přijato po recenzi dne 8. 9. 2017.
MUDr. Jozef Michalka,
Interní hematologická a onkologická klinika FN Brno
Jihlavská 20
625 00 Brno
Zdroje
1. Federico M, Rudiger T, Bellei M, et al. Clinicopathologic characteristics of angioimunoblastic T-cell lymphoma: analysis of the International Peripheral T-cell Lymphoma Project. J Clin Oncol 2013;31(2): 240–246.
2. Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of tumours of hematopoietic and lymphoid tissues. Lyon, France, IARC Press, 2008.
3. Frizzera, G. Atypical lymphoproliferative disorders. In: Knowles DM, ed. Neoplastic hematopathology. 2nd ed. Philadelphia: Lippincott, Williams & Wilkins;2001 : 569–579.
4. Cortes JR, Palomero T. The curious origins of angioimmunoblastic T-cell lymphoma. Curr Opin Hematol 2016;23(4): 434–443.
5. Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016;127 : 2375–2390.
6. Attygalle AD, Kyriakou C, Dupuis J, et al. Histologic evolution of angioimmunoblastic T-cell lymphoma in consecutive biopsies: clinical correlation and insights into natural history and disease progression. Am J Surg Pathol 2007;31(7): 1077–1088.
7. Lunning MA, Vose JM. Angioimmunoblastic T-cell lymphoma: the many-faced lymphoma. Blood 2017;129(9): 1095–1102.
8. Dogan A, Attygalle AD, Kyriakou C. Angioimmunoblastic T-cell lymphoma. Br J Haematol 2003;121(5): 681–691.
9. Lachenal F, Berger F, Ghesquieres H, et al. Angioimmunoblastic T-cell lymphoma: clinical and laboratory features at diagnosis in 77 patients. Medicine (Baltimore) 2007;86(5): 282–292.
10. Mourad N, Mounier N, Briere J, et al. Groupe d’Etude des Lymphomes de l’Adulte. Clinical, biologic, and pathologic features in 157 patients with angioimmunoblastic T-cell lymphoma treated within the Groupe d’Etude des Lymphomes de l’Adulte (GELA) trials. Blood 2008;111(9): 4463–4470.
11. Simon A, Peoch M, Casassus P, et al. Upfront VIP-reinforced-ABVD (VIP-rABVD) is not superior to CHOP/21 in newly diagnosed peripheral T cell lymphoma. Results of the randomized phase III trial GOELAMS-LTP95. Br J Haematol 2010;151(2): 159–166.
12. Schetelig J, Fetscher S, Reichle A, et al. Longterm disease-free survival in patients with angioimmunoblastic T-cell lymphoma after high dose chemotherapy and autologous stem cell transplantation. Haematologica 2003;88(11): 1272–1278.
13. Zelenetz AD, Hamlin P, Kewalramani T, et al. Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin‘s lymphoma. Ann Oncol 2003;14(suppl 1): i5–10.
14. Olivieri A, Brunori M, Capelli D, et al. Salvage therapy with an outpatient DHAP schedule followed by PBSC transplantation in 79 lymphoma patients: an intention to mobilize and transplant analysis. Eur J Haematol 2004;72(1): 10–7.
15. Crump M, Baetz T, Couban S, et al. Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG). Cancer 2004;101(8): 1835–1842.
16. Reboursiere E, Le Bras F, Herbaux C, et al. Bendamustine for the treatment of relapsed or refractory peripheral T cell lymphomas: A French retrospective multicenter study. Oncotarget 2016;7(51): 85573–85583.
17. Mak V, Hamm J, Chhanabhai M, et al. Survival of patients with peripheral T-cell lymphoma after first relapse or progression: spectrum of disease and rare long-term survivors. J Clin Oncol 2013;31(16): 1970–1976.
18. Kyriakou C, Canals C, Finke J, et al. Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: a retrospective study from the lymphoma working party of the European group for blood and marrow transplantation. J Clin Oncol 2009;27(24): 3951–3958.
19. Advani R, Horwitz S, Zelenetz A, Horning SJ. Angioimmunoblastic T cell lymphoma: treatment experience with cyclosporine. Leuk Lymphoma 2007;48(3): 521–525.
20. Huang J, Zhang PH, Gao YH, Qiu LG. Sequential development of diffuse large B-cell lymphoma in a patient with angioimmunoblastic T-cell lymphoma. Diagn Cytopathol 2012;40(4): 346–351.
21. Ahearne MJ, Allchin RL, Fox CP, Wagner SD. Follicular helper T-cells: expanding roles in T-cell lymphoma and targets for treatment. Br J Haematol 2014;166 : 326–335.
22. Abruzzo LV, Schmidt K, Weiss LM, et al. B-cell lymphoma after angioimmunoblastic lymphadenopathy: a case with oligoclonal gene rearrangements associated with Epstein-Barr virus. Blood 1993;82 : 241–246.
23. Zettl A, Lee SS, Rudiger T, et al. Epstein-Barr virus-associated B-cell lymphoproliferative disorders in angioimmunoblastic T-cell lymphoma and peripheral T-cell lymphoma, unspecified. Am J Clin Pathol 2002;117 : 368–379.
24. Xu Y, McKenna RW, Hoang MP, Collins RH, Kroft SH. Composite angioimmunoblastic T-cell lymphoma and diffuse large B-cell lymphoma. Am J Clin Pathol 2002;118 : 848–854.
25. Wang Y, Xie B, Chen Y, et al. Development of angioimmunoblastic T-cell lymphoma after treatment of diffuse large B-cell lymphoma: a case report and review of literature. Int J Clin Exp Pathol 2014;7(6): 3432–3438.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“
- První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
- Epigenetické změny jako nový nástroj pro prognostickou stratifikaci pacientů s chronickou lymfocytární leukemií
- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- 25 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Obsah ročníku 23/2017
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



