-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
Interferon alpha in the treatment of Philadelphia-negative myeloproliferative neoplasms
Introduction:
Interferon alfa (IFN-α) has been used for over 30 years to treat myeloproliferative neoplasms. Recombinant IFN-α (rIFN-α) and pegylated IFN-α (Peg-IFN-α) have been shown to provide effective therapy for essential thrombocythemia (ET) and polycythaemia vera (PV), as well as early stage primary myelofibrosis (PMF) in several clinical studies.Patients and methods:
This report presents a retrospective analysis of 60 patients with MPN who were treated with rIFN-α or Peg-IFN-α outside clinical trials.Results:
Retrospective stratification at diagnosis included 34 (57%) patients with PV, 5 (8%) with ET and 21 (35%) with PMF. Median age was 43 years (16-70). Median treatment duration was 107.5 months, with 11 patients treated with Peg IFN-α for a median duration of 24 months. Median follow up was 164 months. 24 patients (40%) achieved complete remission, 29 patients (48%) achieved partial remission and 7 patients (12%) failed to achieve partial remission. Toxicities were recorded in 42 patients (70%): chronic „flu-like syndrome“, psychiatric toxicity, hepatotoxicity, dermatotoxicity, ocular and neurotoxicity. Thirteen (22%) patients stopped the treatment because of toxicity.Conclusion:
IFN-α effectively controls disease in a significant proportion of Ph-negative MPN patients. However, its use in clinical practice has unfortunately been limited by side effects. These results support the need for further efficacy studies of IFN-α in this group of patients.Key words:
myeloproliferative neoplasms – polycythaemia vera – essential thrombocythemia – primary myelofibrosis – interferon alpha – pegylated interferon – effect of treatment – treatment toxicity
Autoři: A. Hatalová; K. Slezáková; L. Masákova; M. Mistrík.; A. Bátorová
Působiště autorů: Klinika hematológie a transfuziológie, LF UK , SZU Univerzitná nemocnica Bratislava
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 2, p. 73-81.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Interferón alfa (IFN-α) sa používa viac ako 30 rokov na liečbu myeloproliferatívnej neoplázie. Rekombinantný IFN-α (rIFN-α) a pegylovaný IFN-α (Peg-IFN-α) vo viacerých klinických štúdiách, dokazuje efektivitu v liečbe esenciálnej trombocytémie (ET) a polycytémie vera (PV) ako aj včasného štádia primárnej myelofibrózy (PMF). Cieľom práce bolo retrospektívne hodnotenie efektivity a tolerability IFN-α v bežnej klinickej praxi.Súbor a metody:
Táto práca obsahuje retrospektívnu štúdiu 60 pacientov s myeloproliferatívnou neopláziou, ktorí sa liečili rIFN-α a Peg-IFN-α mimo klinických štúdií.Výsledky:
Skupina 60 pacientov s diagnózou PV 34 (57 %), ET 5 (8 %), PMF 21 (35 %) s vekovým mediánom 43 rokov (16–70). Medián trvania liečby 107,5 mesiacov, v skupine 11 pacientov liečených Peg-IFN-α medián trvania liečby 24 mesiacov. Medián sledovania 164 mesiacov. 24 pacientov (40 %) dosiahlo kompletnú hematologickú odpoveď (KHR), 29 pacientov (48 %) parciálnu hematologickú odpoveď a 7 pacientov (12 %) nesplnilo kritéria pre parciálnu hematologickú odpoveď. 42 pacientov (70 %) malo počas liečby nežiaduce účinky: chronický: „flu-like“ syndróm, psychické, dermatologické, očné, neurologické. 13 pacientov (22 %) ukončilo liečbu z dôvodu toxicity.Záver:
IFN-α je efektívny pri kontrole ochorenia u významnej časti pacientov s Ph negatívnou MPN. Napriek tomu jeho klinické použitie, limitujú nežiaduce účinky. Retrospektívne klinické závery si vyžadujú ďalšie štúdium efektu IFN-α u našich pacientov.KĽÚČOVÉ SLOVÁ:
myeloproliferatívna neoplázia – polycytémia vera – esenciálna trombocytémia – primárna myelofibróza – interferón alfa – pegylovaný interferón – efekt liečby – toxicita liečbyÚVOD
Od objavu interferónu virológmi Isaccom a Lindenmannom pri štúdiu bunkových kultúr uplynulo 60 rokov. Tento cytokín nazvali interferón podľa jeho schopnosti interferencie s rastom vírusu. Postupne sa objavilo viac typov IFN, no iba IFN-α vykazuje antivírusový, antiproliferačný, a teda aj protinádorový efekt [1].
V histórii liečby IFN-α bol kľúčový objav rekombinantnej DNA technológie a jej klinickej aplikácie v r. 1980, keď sa G. Weismannovi podarilo preniesť ľudský gén pre IFN-α do baktérie [2]. To bol základ prípravy a farmakologického použitia štandardizovaných a rekombinantných prípravkov IFN-α, ktoré sa stali objektom viacerých klinických štúdií v 80-tych rokoch minulého storočia. Klinické štúdie s IFN-α pri mnohopočetnom myelóme a iných hematologických malignitách, vlasatobunkovej leukémie (HCL) a chronickej myelocytovej leukémie (CML) umožnili používať IFN-α aj pri Ph negatívnych myeloproliferatívnych neopláziách (Ph-MPN), esenciálnej trombocytémii (ET), polycytémii vera (PV), primárnej myelofibróze (PMF), ako aj hypereozinofilnom syndróme a systémovej mastocytóze [3, 4].Použitie rIFN-α sa prvý raz dokumentovalo pri liečbe ET, v roku 1985, keď sa pozorovala efektívna a rýchla redukcia trombocytov [5, 6]. V roku 1986 profesor Silver publikoval výsledky úspešného použitia IFN-α pri myelofibróze [7]. Na Slovensku Šteruská et al. (1989 a 1994) publikovali prvé úspešné skúsenosti s liečbou rIFN-α u pacientov s ET, na základe priaznivých výsledkov odporúčali tento liek do prvej línie liečby pacientov s MPN, predovšetkým mladších vekových skupín a žien vo fertilnom veku [8, 9]. Nízke dávky IFN-α (max. 9 MIU týždenne) v priebehu niekoľkých mesiacov u väčšiny pacientov s ET, PV a hypercelulárnej fázy PMF vedú k navodeniu hematologickej a molekulovej odpovede, ale aj k redukcii výskytu trombotických komplikácií, častých pri MPN [10]. Existujú však limitácie pri používaní IFN, ktoré sú dané výskytom nežiaducich účinkov. Nespochybniteľný podiel na znižovaní výskytu nežiaducich účinkov a zlepšovaní tolerability liečby mala práve liečba nízkymi dávkami IFN-α, napriek tomu približne 20 % pacientov muselo pre prejavy intolerancie liečbu IFN-α ukončiť [11]. Nežiaduce účinky boli bezprostredné (flu-like syndróm), no vyskytli sa aj neskoré prejavy hematologickej a najmä nehematologickej toxicity.
Snaha o zlepšenie znášanlivosti liečby IFN-α viedla k použitiu pegylovanej formy IFN (Peg-IFN-α). Peg-IFN-α navodil kompletnú hematologickú remisiu v 76 % pri PV a 77 % pri ET. U 18 % pacientov s PV a 17 % pacientov s ET sa pri tom potvrdila aj kompletná molekulová odpoveď (KMR), t. j. nedetekovateľná mutácia JAK 2 V617F [11, 12]. Aj keď IFN-α preukázal dobrú účinnosť pri liečbe Ph-MPN, doteraz nebola schválená jeho indikácia pre MPN, viacerí túto liečbu považujú za experimentálnu [13, 14]. Práve ďalšia generácia Peg-IFN-α, ropeginterferónu (Peg-P-IFN-α) s ukončenou registračnou klinickou štúdiou u pacientov s PV znamená historický míľnik. Peg-IFN-α s pridaním prolínu na N-terminálnom konci získal jedinečné farmakokinetické vlastnosti, ktoré sa v klinickom použití odrážajú v lepšej tolerabilite, bezpečnosti a účinnosti. Ropeginterferón sa vyhodnocoval u pacientov s PV vo fáze I/II prospektívneho klinického skúšania, označeného akronymom PEGINVERA. Nová generácia IFN-α s predĺženým polčasom eliminácie umožňuje potenciálne dávkovanie v rozsahu 2–4 týždňov. Výsledky liečby Peg-P-IFN-α v skupine pacientov s PV boli viac než povzbudivé, 90 % kumulatívnych celkových odpovedí zahŕňali kompletnú hematologickú odpoveď v 47 % a parciálnu odpoveď v 43 % [15]. Ani zmena vo frekvencii podávania, a to z každých 2 na každé 4 týždne, nijako neznižuje efektivitu IFN a pozitívne upravuje toxicitu. Najlepšiu individuálnu molekulovú odpoveď dosiahli pacienti v kompletnej hematologickej remisii. Nepozorovala sa žiadna korelácia medzi dávkou a dosiahnutou odpoveďou a dávkou či dĺžkou dosiahnutej hematologickej odpovede. Hematologická a molekulová odpoveď nezávisela od chromozomálnych aberácií, ani od iniciálnej JAK 2 alelickej nálože [16]. Viacero prác pozoruje koreláciu JAK 2 alelickej nálože a klinickým fenotypom PV, predovšetkým príznakmi (pruritus a splenomegália) ale aj vyšším rizikom prechodu do PMF. Alelická nálož ≥ 75 % sa často spája s vyšším výskytom trombotických, hlavne arteriálnych komplikácií. Aj napriek tomu, že tieto závery sa potvrdili v klinickej praxi, alelická nálož JAK 2 nie je uznaná ako prognostický marker v manažmente PV [17]. Klinická štúdia označená akronymom PROUD-PV sa zameriavala na historicky prvé porovnanie účinnosti a bezpečnosti hydroxyurey a Peg-P-IFN-α. Po uplynutí 12 mesiacov pacienti liečení Peg-P-IFN-α pokračujú v liečbe v klinickom skúšaní CONTINUATION-PV, ak bude liečba účinná a bezpečná, a to až do komerčnej dostupnosti novej generácie IFN. Nová generácia monopegylovaného IFN-α, ropeginterferónu, v porovnaní s konvenčným Peg-IFN-α má výrazne lepšiu tolerabilitu, s menším výskytom prejavov bezprostrednej nehematologickej toxicity po aplikácii, kam patrí zvýšená teplota, horúčka, únava, celková slabosť, nechutenstvo, bolesti svalov a kĺbov. Keďže väčšina týchto príznakov pripomína vírusovú infekciu, označujú sa „flu-like syndróm“. Úplnú elimináciu nežiaducich účinkov však nová generácia IFN-α neprináša, 20 % pacientov ukončilo liečbu práve pre nežiaduce účinky [18].
Aj napriek zlepšenej znášanlivosti liečby IFN-α zostávajú nežiaduce účinky veľkým problémom. Najobávanejšie komplikácie, spojené s liečbou IFN, predstavujú zmeny v centrálnom nervovom systéme, ktoré sa manifestujú výraznou únavou, anhedóniou, depresiou, podráždenosťou a psychickými výkyvmi. Poškodenie periférneho nervového systému sa javí raritnejšie. Pri liečbe Peg-IFN-α sa z neuropsychiatrických príznakov najčastejšie vyskytuje depresia, depresívne symptómy, zmeny nálad a úzkosť. Zásah IFN do imunity sa môže prejaviť aj nežiaducou indukciou autoimunity, a to buď zhoršením už preexistujúceho ochorenia, či indukciou latentného autoimunitného ochorenia. Autoimunitná thyreoiditída patrí k najčastejším autoimunitným nežiaducim efektom liečby IFN-α [15, 16]. Komplikovanejšia je situácia pacientov s PMF vo fibrotickom štádiu. Signifikantná splenomegália a pancytopénia sú známe faktory, ktoré pacienta predisponujú k horšej odpovedi a zlej tolerancii liečby IFN-α. Naproti tomu nízke dávky IFN-α v celulárnej fáze PMF majú schopnosť redukovať splenomegáliu, zmierniť bolesti kostí a redukovať leukocytózu [19]. V prospech intervencie IFN-α pri PMF hovorí aj dôkaz o úprave architektúry kostnej drene (KD), v zmysle výraznej redukcie až vymiznutia fibrotických zmien v KD pri prolongovanom podávaní nízkych dávok IFN-α u pacientov s pravou polycytémiou [20]. Pozoruhodná, kombinovaná klinická účinnosť interferónu je dôsledkom širokého spektra jeho biologických vlastností. Jeho imunomodulačný, proapoptotický a protizápalový efekt mu otvorili priestor v protinádorovej liečbe. V liečbe MPN sa okrem iného využíva jeho antiproliferačný efekt na hematopoetické prekurzory. Protinádorový efekt IFN-α je spôsobený kombináciou priameho antiproliferatívneho pôsobenia a IFN-α vykazuje viaceré, často antagonistické aktivity proti imunitným bunkám [21]. Efekt rIFN-α a Peg-IFN-α na hematopoetickú proliferáciu je dobre známy, avšak jeho biologický efekt na hemostázu a zápal zostáva nejasný. V literatúre sa publikovali menšie klinické pozorovania s limitovanými údajmi o vzostupe prokoagulačných a zápalových markerov počas liečby IFN-α. V prípade záchytu vyššej aktivity týchto prokoagulačných a zápalových biomarkerov sa odporúčalo profylaktické podávanie kyseliny acetylosalicylovej u pacientov s heterozygotnou konštitúciou pre mutácie F V Leiden a F II G202010A [22].
IFN-α preukazuje svoju účinnosť pri manažmente Ph-MPN, a to už od 80-tych rokov minulého storočia. IFN-α má schopnosť indukovať veľkú molekulovú odpoveď redukciou alelickej nálože JAK 2 V617F, znižovať riziko trombózy a hemoragických komplikácií i minimalizovať progresiu ochorenia dosiahnutím normalizácie architektúry kostnej drene. Tento stav „minimálnej reziduálnej choroby“ pretrváva aj niekoľko rokov po prerušení liečby IFN-α [20]. Súčasné vedomosti o potenciálne kuratívnom vplyve IFN-α na priebeh MPN vyústili do konceptu včasnej liečebnej intervencie, v začiatočných štádiách ochorenia PV, ET a prefibrotického štádia PMF [23]. Veľký klinický význam má aj fakt, že doposiaľ chýbajú dôkazy či podozrenia na jeho teratogenicitu a leukemogenicitu. Liečebné použitie IFN-α limituje výskyt nežiaducich účinkov, preto sa pri jeho použití kladie dôraz na nízke dávky. Napriek našim skúsenostiam a vedomostiam o liečbe, benefitoch a bezpečnostnom profile IFN-α v manažmente Ph-MPN nám stále chýba jeho schválenie na liečbu v tejto indikácii. Obdobie renesancie použitia IFN-α v liečbe Ph-MPN prinesie nové stratégie v liečbe pacientov s dôrazom na potrebu včasnej intervencie.
V práci sme sa zamerali na problematiku liečby Ph-MPN s IFN-α a hodnotenie efektivity liečby heterogénnej skupiny pacientov a na hodnotenie dostupných údajov vo vzťahu k pozitívnemu liečebnému dopadu IFN-α.
SÚBOR PACIENTOV A METÓDY
Naša práca vychádza z retrospektívneho hodnotenia 60-členného súboru pacientov s Ph-MPN, liečených na našom pracovisku, v ambulancii zameranej na liečbu MPN, a to v priebehu rokov 1997–2017, mimo klinických štúdií. Do súboru pacientov sme začlenili tých, ktorí mali diagnózu jednotlivých podtypov MPN (PV, ET a PMF), verifikovanú podľa WHO diagnostických kritérií z roku 2008 [24]. Do roku 2013 v liečbe prevažoval rIFN-α. Peg-IFN-α je od roku 2013 dostupný pre pacientov netolerujúcich liečbu konvenčným rIFN-α. Hodnotenie efektivity liečby a hematologickej a molekulovej odpovede sme robili podľa kritérií ELN pre jednotlivé podtypy MPN, PV, ET z roku 2009 a pre PMF z roku 2006 [25, 26]. Vyhodnotili sme komplikácie priebehu MPN, arteriálne a venózne trombózy, progresie ochorenia a výskyt nežiaducich účinkov liečby IFN-α so špeciálnym dôrazom na tie, ktoré viedli k prerušeniu liečby. K vedľajším účinkom liečby patrili: chronický „flu-like syndróm“, psychické účinky (zmeny nálady, poruchy spánku, živé až desivé sny, depresívna nálada, poruchy libida), dermatologické (vypadávanie vlasov, psoriáza, vitiligo, seboroická dermatitída), hepatopatia, hematotoxicita (leukopénia), očné (retinopatia, nekróza optického nervu) a polyneuropatia. Ako chronický „flu-like syndróm“ sme označili výskyt príznakov: únava, horúčka, zimnica, triaška, bolesti svalov a kĺbov, znížená fyzická výkonnosť. Tieto interferónové príznaky pretrvávali dlhodobo s minimálnou možnosťou ovplyvnenia ich intenzity podávaním paracetamolu. U niektorých pacientov s mutáciou JAK 2 V617F bola v priebehu sledovania vyšetrená kvantifikácia JAK 2 V617F alely zo vzorky 5 ml periférnej krvi odobratej do nezrážavého roztoku (EDTA). Na kvantifikáciu JAK2 V617F DNA vzoriek pacientov sa použila metóda absolútnej kvantifikácie, ktorej podstatou je použitie špecifických primerov na identifikáciu polymorfizmov v jednotlivých nukleotidoch (SNP), ktoré umožňujú selektívnu amplifikáciu mutovanej a „wild“ alely s detekciou pozitivity v rozsahu > 0,1–100 %.
Získané údaje v súbore boli sumarizované pomocou základnej popisnej charakteristiky – medián, minimum a maximum.
VÝSLEDKY
Prehľad klinických údajov k charakteristike súboru 60 pacientov uvádza tabuľka 1. Vyhodnotili sme celkom 60 pacientov s Ph-MPN s vekovým mediánom v dobe diagnózy 43 rokov (rozptyl 16–70 rokov), z toho 19 pacientov (32 %) bolo v mladšej vekovej kategórii od 16 do 40 rokov. Skupinu pacientov tvorilo 40 žien a 20 mužov. Medzi najčastejšie zastúpený podtyp Ph-MPN patrila PV (57 %). 34 pacientov s PV, v dobe diagnózy 9 pacientov bolo vo vysokom riziku pre trombotické komplikácie. ET je v našom súbore zastúpená len 5 pacientami (8 %), ktorí v dobe diagnózy mali nízke riziko podľa rizikovej stratifikácie pre trombotické komplikácie [27]. PMF malo 21 (35 %) pacientov. V skupine PMF v dobe diagnózy malo 18 pacientov nízke riziko podľa IPSS skóre a intermediate-1 riziko 3 pacienti [28]. Najčastejšou genetickou zmenou bol pozitívny mutačný stav JAK 2 V617F (n = 41), mutácie v exone 12 sa nevyskytli (n = 0), mutácia calretikulínu (CALR) bola pozitívna u 9 pacientov (n = 9), MPL (exón 10) n = 0, negatívny skríning pre JAK2, MPL a CALR tzv. triplet negatívni pacienti bol zistený u 10 chorých (n = 10). Medián sledovania bol 164 (4–324) mesiacov. Medián trvania liečby IFN-α bol 107,5 (3–202) mesiacov. Medián trvania liečby v skupine 11 pacientov s Peg-IFN-α bol 21 (4–38) mesiacov. Pacienti boli liečení IFN-α v období rokov 1997–2017, mimo klinických štúdií. Všetci pacienti dostávali rIFN-α, 11 pacientov malo v priebehu liečby zmenený na Peg-IFN-α. Dôvodom zmeny bol chronický perzistujúci únavový syndróm. IFN-α dostávalo v prvej línii 65 % pacientov (n = 39) a 35 % (n = 21) ako druhú líniu, po predliečení hydroxyureou alebo anagrelidom. Dávka rIFN-α sa pohybovala v rozmedzí od 500 000 do 9 miliónov IU týždenne v subkutánnej aplikácii, frekvencia podávania od 1–3x týždenne. Pri aplikácii pegylovaného IFN bolo dávkovanie od 45 μg týždenne až 45 μg každý druhý týždeň. Hematologickú remisiu sme posudzovali podľa ELN kritérií z roku 2009 [27]. Vyhodnotením výsledkov sme potvrdili 88 % celkových hematologických odpovedí, z toho 40 % (n = 24) dosiahlo pri liečbe IFN-α kompletnú hematologickú odpoveď (KHR), 48 % (n = 29) dosiahlo parciálnu hematologickú odpoveď. 12 % (n = 7), 3 pacienti s PV a 4 s PMF, nesplnili kritériá ani pre parciálnu hematologickú remisiu (graf 1).KHR v skupine PV dosiahlo 13 pacientov (38 %), nevyžadovali si flebotómie k udržaniu hodnoty hematokritu pod < 45 %, ani kombináciu IFN-α s hydroxyureou alebo s anagrelidom. 18 pacientov s PV (53 %) si v parciálnej remisii vyžadovalo intermitentné flebotómie, a 4 pacienti si vyžadovali kombináciu s hydroxyureou pre progresívnu leukocytózu.
Tab. 1. Charakteristika súboru pacientov liečených IFN-α 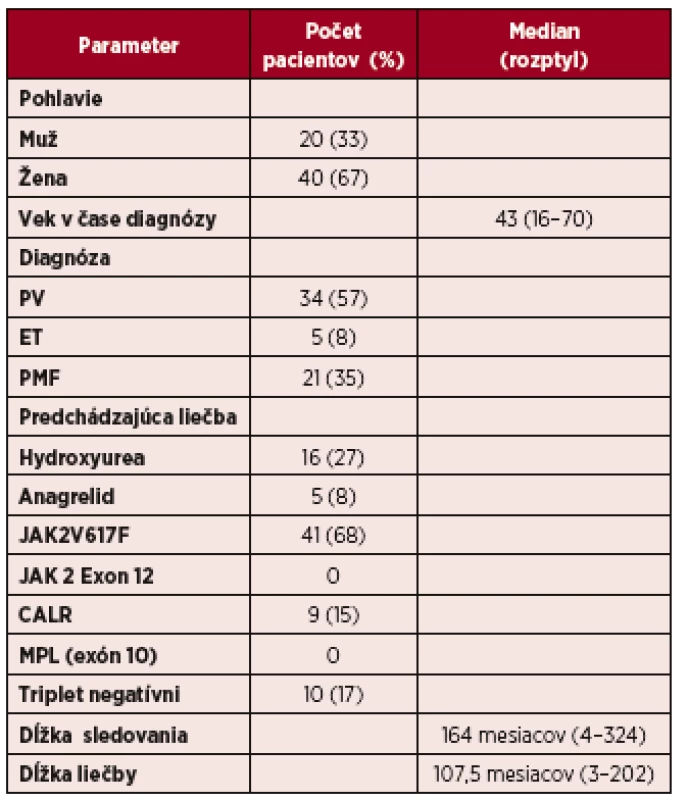
Vysvětlivky: PV – polycytémia vera, ET – esenciálna trombocytémia, PMF – primárna myelofibróza Graf 1. Hodnotenie dosiahnutej hematologickej odpovede KHR – kompletná hematologická odpoveď PHR – parciálna hematologická odpoveď; NR – non responder, bez dosiahnutej hematologickej odpovede 
V skupine pacientov s ET (n = 5) kompletnú hematologickú odpoveď dosiahli 3 pacienti a v skupine PMF (n = 21) prísne kritériá pre KHR spĺnilo 8 pacientov, 9 pacienti dosiahli PHR a 4 nespĺňali kritériá ani pre PHR. Molekulovú odpoveď kvantifikáciou JAK 2 V617F alely sme nehodnotili u všetkých pacientov (n=41), vzhľadom k veľkosti súboru a dĺžke sledovania nám chýbajú vstupné informácie o celkovej kvantite mutovanej alely. Kompletnú molekulovú odpoveď (KMR), pokles alelickej nálože mutácie JAK 2 pod hranicu detekovateľnosti sme však zachytili u dvoch pacientov. Po dosiahnutí KMR sme liečbu rIFN-α prerušili, kompletná molekulová remisia pretrvávala 19 a 58 mesiacov (tab. 2). V našom súbore (n = 60) sme u 4 pacientov konštatovali progresiu ochorenia, u 1 pacienta s PV a 1 pacienta s ET prešlo ochorenie do sekundárnej MF, u týchto pacientov pokračovala liečba ruxolitinibom a u 2 pacientov sa zistila progresia PMF do fibrotického štádia, v jednom prípade sa vykonala alogénna transplantácia krvotvorných buniek. U žiadneho pacienta sme v priebehu sledovania s mediánom 164 mesiacov nezaznamenali transformáciu MPN do akútnej myeloblastovej leukémie (AML). Primárnu antiagregačnú profylaxiu (kyselinu acetylosalicylovú) užívalo 34 pacientov, väčšina (n = 27) pacientov s PV, 2 pacienti s ET a 4 s PMF z dôvodu mikrovaskulárnej symptomatológie. Pacienti s PV v užívani kyseliny acetylosalicylovej pokračovali aj po dosiahnutí kompletnej hematologickej remisie. Nežiaduce účinky liečby IFN-α, prítomné u viacerých pacientov, nadobudli rôznu intenzitu. Nežiaduci efekt liečby sme pozorovali v 70 %, n = 42 (graf 2). Najčastejšie sa vyskytoval chronický „flu like syndróm“, nazývaný aj interferónový syndróm. Ťažkosti chronického „flu like syndrómu“ sme pozorovali v 23 % (n = 14), z toho u 11 pacientov boli spomínané ťažkosti dôvodom zmeniť rIFN-α na Peg-IFN-α-2b, a u všetkých pacientov sme zaznamenali lepšiu tolerabilitu Peg-IFN-α-2b. Negatívne psychické účinky sa prejavili v 13 % (n = 8), pričom k najčastejším patrili: depresívne nálady, poruchy spánku, pacienti udávali živé až desivé sny, nervozitu a podráždenosť, stratu libida. Ani v jednom prípade sme nezistili samovražedné sklony. V 7 prípadoch viedli psychické nežiaduce účinky k prerušeniu liečby. Pomerne časté boli dermatologické nežiaduce účinky u 13 pacientov (22 %). Z nich 8 žien udávalo slabé a stredne silné vypadávanie vlasov, nebolo však potrebné redukovať dávky alebo prerušiť liečbu. U 52-ročnej ženy s diagnózou PV po 14 rokoch liečby rIFN-α vznikla necrobiosis lipoidica na predkolení (obr. 1). Aj keď etiopatogenéza nekrobiózy známa nie je, vzhľadom na rozsah zmien a vek pacientky sme liečbu prerušili. Zhoršenie preexistujúcej psoriázy sme zaznamenali u pacientky po 6 mesiacoch liečby (na dávke INF-α 3 milióny IU týždenne). U 52-ročného muža po liečbe trvajúcej 102 mesiacov došlo k vzniku rozsiahleho vitiliga, u 2 pacientov sa manifestovala seboroická dermatitída. Hepatopatiu sme zistili u 2 pacientov, dávky IFN-α sme upravili, u 22-ročnej pacientky s PV sme liečbu ukončili. Očné komplikácie sa vyskytli u 3 pacientov, dvaja mali progresívnu retinopatiu a jeden neuropatiu nervus opticus. Vo všetkých troch prípadoch sme liečbu IFN-α ukončili. Čo sa týka hematologických vedľajších účinkov, u jednej pacientky sa zistila leukopénia ľahkého stupňa, reverzibilná po úprave dávky. Pokiaľ ide o nežiaduce neurologické účinky, v jednom prípade sme zaregistrovali rozvoj periférnej neuropatie, čo nás prinútilo ukončiť liečbu IFN a začať s liečbou intravenóznymi imunoglobulínmi. Nežiaduce účinky, ktoré viedli k ukončeniu liečby, uvádza tabuľka 3. V celom súbore nežiaduce účinky viedli k ukončeniu liečby rIFN-α u 13 (22 %) pacientov, s mediánom liečby 25 (3–48) mesiacov. Podávanie Peg-IFN-α s mediánom 21 mesiacov, neviedlo ani v jednom prípade k ukončeniu liečby. Trombotické komplikácie malo v celom súbore 13 (22 %) chorých (tab. 4), 10 s diagnózou PV, v jednom prípade ET a dvaja s PMF. Z nich sa pred diagnózou MPN vyskytol u 2 pacientov infarkt myokardu a u 2 pacientov nastala viscerálna trombóza. V priebehu liečby vznikli trombotické komplikácie u 9 pacientov, pričom všetky príhody sa manifestovali v štádiu dosiahnutej hematologickej remisie, u 6 pacientov v kompletnej a u 3 v parciálnej remisii. Pacienti, u ktorých sa trombóza manifestovala počas liečby, boli vo veku < 60 rokov, mali však prítomné rizikové faktory, heterozygotnú formu mutácie pre faktor V-Leiden (n = 1), arteriálnu hypertenziu nekontrolovanú liečbou (n = 5) a ulceróznu kolitídu na biologickej liečbe bez remisie (n = 1). Predpokladáme, že vplyv týchto rizikových faktorov na vznik trombózy bol významný. V celom súbore prevažovali arteriálne komplikácie (17 %). V sledovanom období (medián 164 mesiacov) sme u našich pacientov nemali žiadnu hemoragickú komplikáciu. V celom súbore pacientov sme nezaznamenali žiadne úmrtie.
Graf 2. Výskyt nežiadúcich účinkov v priebehu liečby IFN-α 
Obr. 1. Necrobiosis lipoidica – nežiaduci účinok na koži predkolenia, ktorý vznikol v priebehu liečby IFN-α u 52-ročnej pacientky s polycytémiou vera 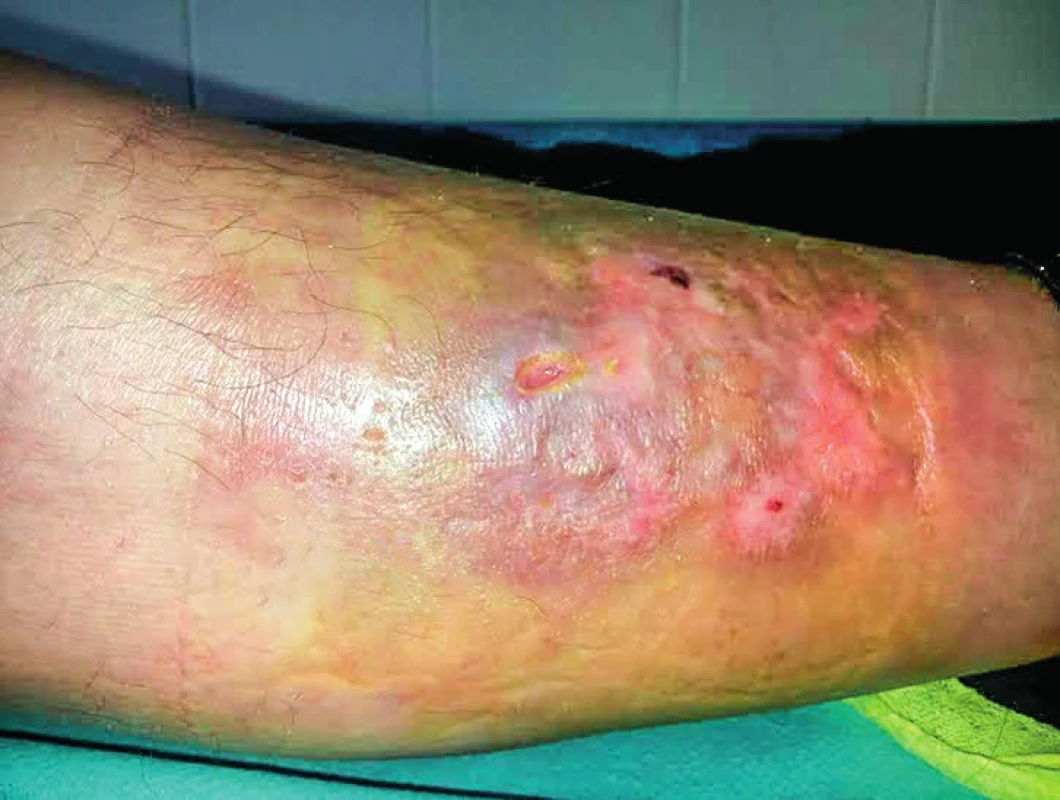
Tab. 2. Charakteristiky 2 pacientov s kompletnou molekulovou odpoveďou na liečbu IFN-α 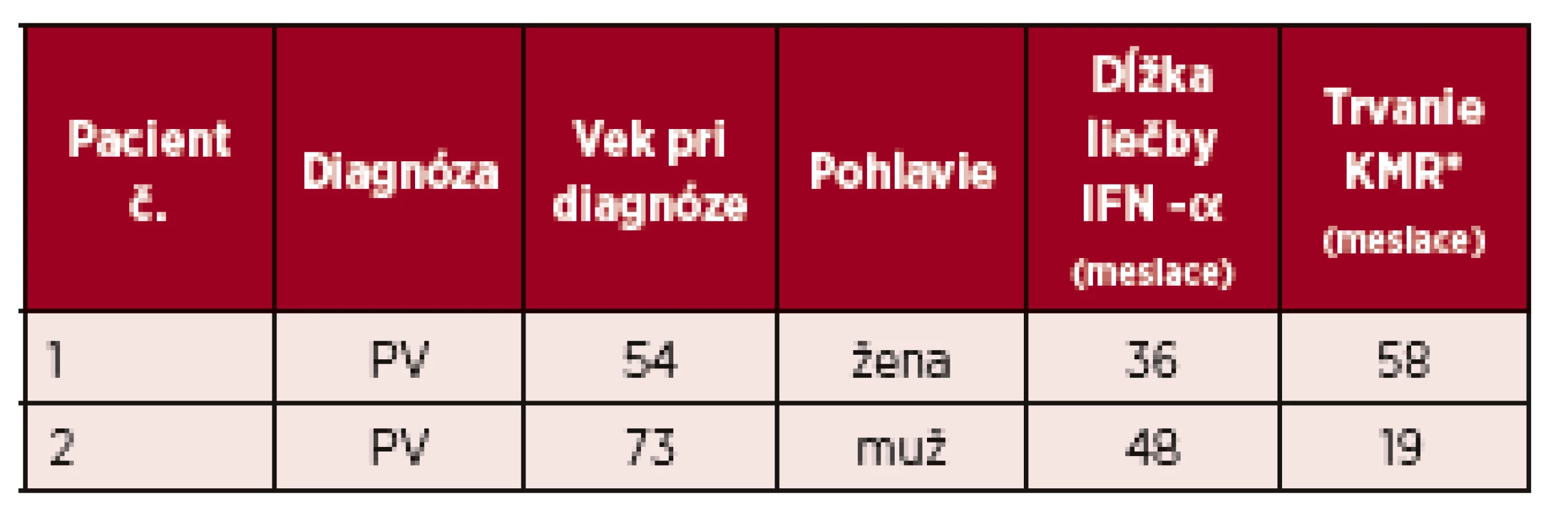
*KMR – kompletná molekulová odpoveď Tab. 3. Nežiaduce účinky vedúce k ukončeniu liečby IFN-α v celom súbore liečených pacientov (n = 60) 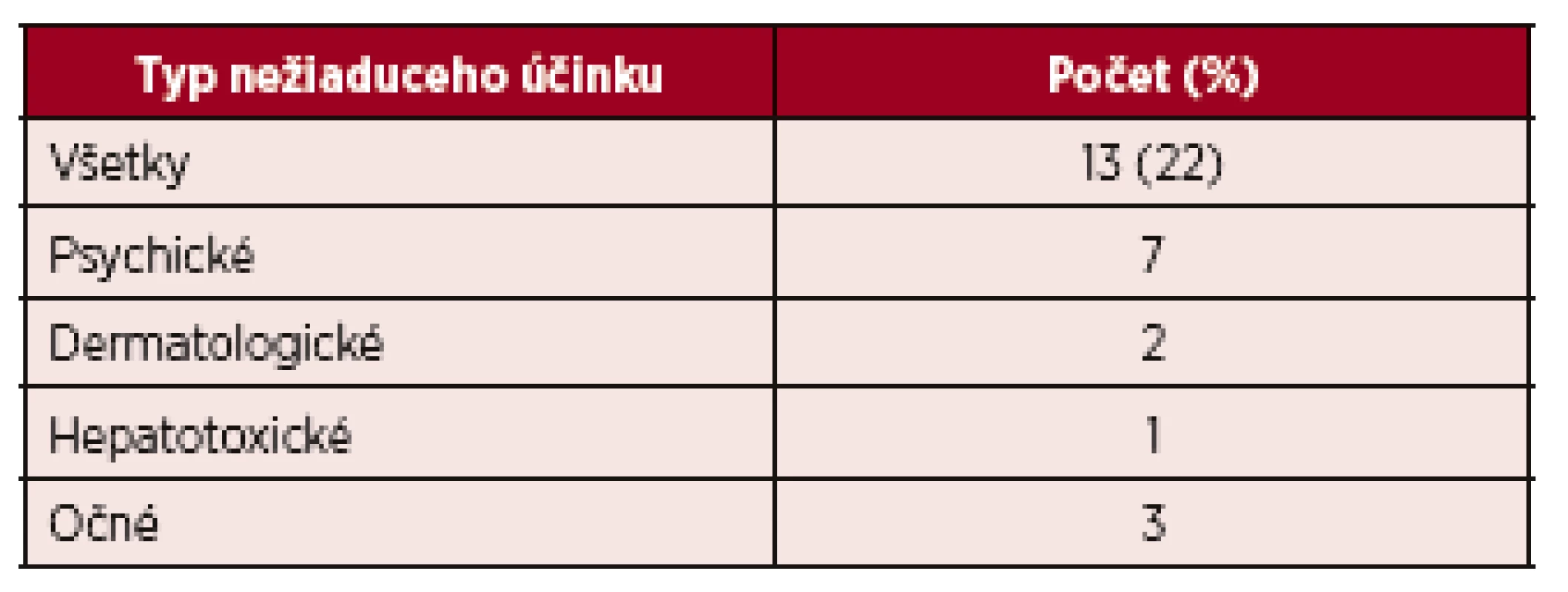
Tab. 4. Prehľad výskytu trombóz v súbore pacientov liečených IFN-α (n = 60) 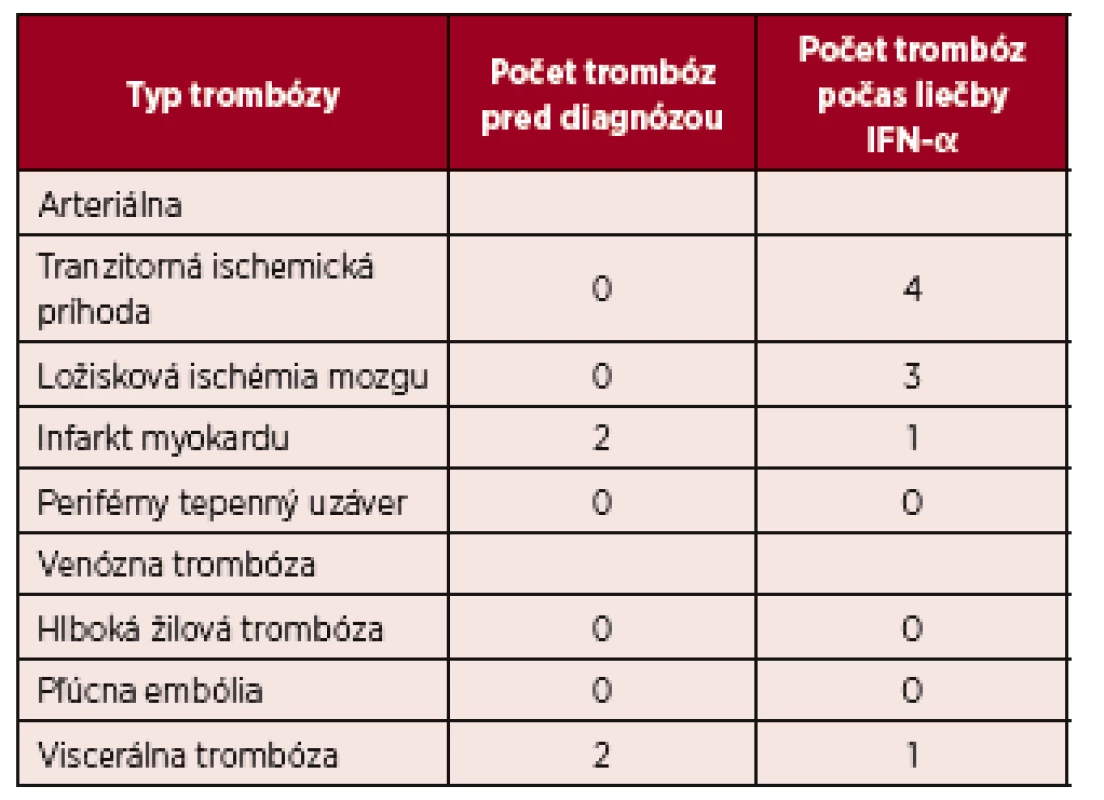
DISKUSIA
Za posledných 30 rokov sa IFN-α v liečbe Ph-MPN etabloval ako efektívna liečba, schopná navodiť klinické, hematologické, molekulové, ale aj histopatologické odpovede, v niektorých prípadoch aj s možnosťou eradikácie patologického klonu. Viaceré prebiehajúce prospektívne randomizované klinické štúdie, porovnávajúce pegylovanú formu IFN-α a HU u rizikových pacientov s MPN, prinesú chýbajúce a potrebné informácie k potvrdeniu významnej úlohy IFN-α v liečbe MPN. V súbore referujeme o dosiahnutom vysokom počte hematologických odpovedí a v dvoch prípadoch sme zaznamenali i úplnú eradikáciu patologického klonu, dosiahnutie JAK 2 negativity s možnosťou prerušiť liečbu. Molekulová remisia bola dosiahnutá nízkymi dávkami IFN-α. Ani v jednom prípade sme u pacientov nezvyšovali dávkovanie IFN-α s cieľom dosiahnuť molekulovú odpoveď. Problémom liečby IFN-α však zostáva jeho toxicita. Tolerabilita IFN-α sa zavedením pegylovanej formy výrazne zlepšila, no aj podľa posledných záverov klinickej štúdie až 53 % pacientov ukončí liečbu IFN-α z dôvodu intolerancie [16]. V našom súbore počet pacientov, ktorí z tohto dôvodu ukončili liečbu, bol nižší (22 %), pravdepodobne z dôvodu nižších dávok, ktoré sme použili v bežnej klinickej praxi v porovnaní s klinickou štúdiou, kde sa dávka IFN-α postupne zvyšovala s cieľom dosiahnutia kompletnej hematologickej odpovede. Až v 70 % evidujeme nežiaduce účinky v rôznom stupni vyjadrenia. Medzi časté nežiaduce účinky IFN-α patria celkové chrípkové príznaky, zahŕňajúce horúčku, zimnicu, triašku, bolesti svalov, kĺbov a hlavy. Chrípkové príznaky sú najintenzívnejšie na začiatku liečby. Bežne odporúčané iniciálne dávkovanie IFN-α predstavuje 9 MIU týždenne, je rozdelené na 3 MIU s. c. 3x týždenne, a my ho považujeme za hlavnú príčinu výskytu vysokého percenta nežiaducich účinkov. Naše súčasné klinické skúsenosti ukazujú, že začatie liečby rIFN-α s výrazne nižšími dávkami, od 500 000 do 1,5 MIU týždenne s postupným zvýšením dávky na dosiahnutie hematologickej odpovede, prináša zmiernenie až úplné odstránenie spomínaných chrípkových príznakov. Ďalším prínosom je aj veľmi dobrá compliance pacienta, keďže začiatok liečby sa nespája s nepríjemnými vedľajšími účinkami. Maximálnu týždennú dávku 9 miliónov IU neprekračujeme. IFN-α navodené psychické poruchy sú rôznorodé a nezávisia od dávky. Ich symptomatológia je pestrá: podráždenosť, nervozita, poruchy spánku, desivé sny, pokles libida, náladovosť, depresívne nálady. Rôzne zdroje uvádzajú incidenciu depresívnych symptómov, navodených liečbou IFN-α od 25 do 56 % [30]. V našom súbore sme psychické problémy pozorovali v 30 %. Preexistujúce psychické poruchy neznamenali pre nás úplnú kontraindikáciu k použitiu IFN-α, pacient bol v intenzívnejšom manažmente, s vyššou frekvenciou kontrol a edukáciou. Vplyv IFN-α na kožu, sliznice a kožné adnexa sa v prípade nášho súboru zväčša spájal s negatívnym kozmetickým efektom, v jednom prípade išlo o necrobiosis lipoidica a zmeny na koži boli také významné, že viedli k prerušeniu liečby. Ľahké až stredne silné vypadávanie vlasov popisovali výhradne ženy, vo všetkých prípadoch to bola reverzibilná alopécia. U jedincov s dispozíciou k autoimunitným ochoreniam môže dôjsť k tvorbe autoprotilátok s klinickými prejavmi vaskulitídy, artritídy, tyreoidálnej dysfunkcie. IFN-α funguje pravdepodobne ako spúšťač subklinicky existujúcich autoimunitných ochorení. Etiopatogenéza psoriázy zostávava naďalej nie celkom objasnená, napriek tomu sa považuje za autoimunitné ochorenie. Liečba IFN-α aj podľa našich skúseností jednoznačne zhorší priebeh psoriázy, preto psoriázu, podobne ako iné autoimunitné ochorenia, pokladáme za relatívne kontraindikácie na začatie liečby IFN-α. Ak potenciálny prínos liečby IFN-α zdôvodní možné riziko zhoršenia autoimunitného ochorenia, liečbu IFN-α možno začať, no treba pravidelne kontrolovať laboratórne a klinické prejavy autoimunitnej poruchy. Arteriálne a venózne trombózy sa signifikantne podieľajú na morbidite a mortalite pri MPN [31]. Arteriálne trombózy predstavujú pri Ph-MPN asi 60–70 % trombotických komplikácií, medzi ne patrí infarkt myokardu, nestabilná angína pektoris, cievna mozgová príhoda, tranzitórna ischemická ataka, periférne arteriálne uzávery. Cievna mozgová príhoda predstavuje 30–40 % všetkých trombotických príhod pri PV [32]. Akútne koronárne syndrómy sú menej časté, no v našom súbore ich popisujeme u 3 mladých pacientov s PV, v dvoch prípadoch akútny infarkt predchádzal diagnostike PV. U 39-ročného muža s PV vznikol akútny koronárny syndróm v priebehu sledovania a kompletnej hematologickej remisie už ako druhá trombotická komplikácia. Prvou komplikáciou bola trombóza lienálnej vény. De Stefano et al. v retrospektívnej klinickej štúdii, zahŕňajúcej 497 pacientov, konštatujú vyššie riziko recidívy trombóz (33,6 %) pacientov, ktorí už prekonali arteriálnu alebo venóznu trombózu pri PV/ET [33]. V našom súbore sme recidivujúce trombózy pozorovali len u jediného pacienta s PV, kde sme okrem prítomnosti JAK 2 V617F mutácie s 16 % alelickou náložou nezistili iný trombofilný marker, ktorý by sa podieľal na zvyšovaní rizika recidívy. Žilové trombózy sú reprezentované hlbokou žilovou trombózou, pľúcnou embóliou, viscerálnymi trombózami (hepatálna, portálna, mezenteriálna) a trombózou mozgových splavov. Prevalencia atypických trombóz v splanchnickej oblasti je pri MPN vysoká, trombóza často predchádza diagnostike MPN. Prevalenia JAK 2 mutácie pri trombózach v splanchnickej oblasti (SVT) je 40–50 % [34]. V súlade s literárnymi údajmi sme SVT popísali u mladých žien, v jednom prípade trombóza predchádzala diagnóze MPN. Povrchové žilové trombózy sú pri MPN časté a recidivujúce, no v našom súbore sme ich v priebehu liečby IFN-α nepozorovali. Poruchy mikrocirkulácie sú pri PV a ET časté. Najčastejšie ide o erytromelalgie, poruchy vízu, sluchu, o rekurentné bolesti hlavy, periférne parestézie [35]. Výskyt trombóz v priebehu liečby IFN-α v literatúre nie je vysoká, v niektorých štúdiách s mediánom sledovania > 30 mesiacov nezaznamenali žiadne trombotické komplikácie [36, 37]. Trombotické komplikácie zachytené v priebehu liečby u 9 pacientov si vyžadujú ďalšiu analýzu, avšak rizikové kardiovaskulárne faktory a komorbidity prítomné u 7/9 pacientov boli významným trombogénnym faktorom. V priebehu sledovania sme v našom súbore nezaznamenali žiadne prejavy krvácania. Pravdepodobne je to spôsobené vyšším percentom hematologických odpovedí s pomerne efektívnou a rýchlou cytoredukciou v prípadoch, ktoré sa manifestovali trombocytémiou. Potenciálne fatálne komplikácie pre pacientov s PV/ET sú transformácia do myelofibrózy (MF) alebo akútnej myeloidnej leukémie (AML). V literatúre sa uvádza frekvencia vzniku post-PV-MF 4,9–6% do 10 rokov sledovania, pre ET je riziko transformácie menšie 0,8–4,9%. Riziko transformácie PV do AML v priebehu 15 rokov rastie od 5,5 do 18,7 %, pre ET opäť výrazne nižšie 2,1–5,3 % v 15-ročnom sledovaní [38]. V našom súbore 93 % pacientov malo diagnózu PV a PMF s potenciálnym rizikom progresie alebo transformácie do AML. Napriek významnému mediánu sledovania sme len v 7 % zaznamenali prechod PV/ET do sekundárnej myelofibrózy. Transformáciu do AML sme v našom súbore nepopísali. Vzhľadom k malému počtu pacientov v našom súbore, nemôžeme posúdiť vzťah medzi absenciou transformácie do AML a liečebným efektom IFN-α.
ZÁVER
V našom súbore pacientov prezentujeme IFN-α konvenčný alebo pegylovaný ako vysoko účinnú liečbu pacientov s MPN. Odvrátenou stranou efektivity IFN-α je jeho toxicita. Znalosť možných komplikácií vrátane možnosti zhoršenia už preexistujúcich autoimunitných ochorení je nevyhnutným predpokladom správneho manažmentu. V priebehu sledovania sme len v 7 % zaznamenali komplikácie v zmysle progresie ochorenia do sekundárnej myelofibrózy, ale žiadny prípad transformácie do akútnej hemoblastózy. IFN-α je liečebná alternatíva pre pacientov s MPN, ktorá má schopnosť priaznivo ovplyvniť priebeh ochorenia.
Podiel autorov na príprave rukopisu
AH – hlavný autor, spracovanie údajov a spísanie rukopisu
KS, LM, MM – participovali na štúdii, vykonávali sledovanie pacientov
AB – revidovala rukopis a potvrdila finálnu verziu
Čestné prehlásenie autora
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nedošlo k žiadnemu stretu záujmov a vznik ani publikáciu článku nepodporila žiadna farmaceutická firma. Toto prehlásenie sa týka aj všetkých mojich spoluautorov.
Doručeno do redakce dne 11. 3. 2017.
Přijato po recenzi dne 5. 4. 2017.
MUDr. Antónia Hatalová
Klinika hematológie a transfuziológie LF UK, SZU UNB
Nemocnica sv. Cyrila a Metoda
Antolská 11
851 07 Bratislava
Slovenská republika
e-mail: hatalova.antonia@gmail.com
Zdroje
1. Isaacs A, Lindenmann J, Valentine RC. Virus interference. II. Some properties of interferon. Proc R Soc B 1957;147 : 268–273.
2. Nagata S, Taira H, Hall A, et al. Synthesis in E. coli of a polypeptide with human leukocyte interferon activity. Nature 1980;284(5754):316–320.
3. Stein BL,Tiu RV. Biological rationale and clinical use of interferon in the classical BCR-ABL-negative myeloproliferative neoplasms. J Interferon Cytokine Res 2013;33 : 145–153.
4. Kiladjian JJ, Chomienne C, Fenaux P. Interferon–alpha therapy in bcr-abl-negative myeloproliferative neoplasms. Leukemia 2008;22 : 1990–1998.
5. Linkesch W, Gisslinger H, Ludwig H, et al. Therapy with interferon (recombinant IFN-alpha-2C) in myeloproliferative diseases with severe thrombocytoses. Acta Med Austriaca 1985;12 : 123–127.
6. Gisslinger H, Ludwig H, Linkesch W, Fritz E, Chott A, Radaskiewicz TH. Long-term interferon therapy for thrombocythosis in myeloproliferative diseases. Lancet 1989;2 : 634–637.
7. Silver RT. Interferon of treatment of myeloproliferative diseases. Semin Hematol 1990;27 : 6–14.
8. Šteruská M. Interferón alfa v liečbe hematologických malígnych ochorení. Vnitř Lek 1989;35 : 1164–1167.
9. Šteruská M, Hrubišková K, Bátorová A, et al. Thrombocytosis in myeloproliferative syndroma – effect of chemotherapy and interpheron alpha. Hematol Transfusiol 1994;2 : 15–21.
10. Gilbert HS. Long term treatment of myeloproliferative disease with interferon-alpha-2b: feasibility and efficacy. Cancer 1998;83 : 1205–1213.
11. Silver RT, Kiladjian JJ, Hasselbalch HC. Interferon and the treatment of polycythemia vera, essential thrombocythemia and myelofibrosis. Expert Rev Hematol 2013;6 : 49–58.
12. Kiladjian JJ, Cassinat B, Turlure P, et al. High molecular - response rate of polycythemia vera patients treated with pegylated interferon alpha-2a. Blood 2006;108 : 2037–2040.
13. Samuelsson J, Hasselbalch H, Bruserud O, et al. A phase II trial of pegylated interferon alpha-2b therapy for polycythemia vera and essential thrombocythemia: Feasibility, clinical and biologic effects, and impact on quality of life.Cancer 2006;106 : 2397–2405.
14. Hasselbalch H. A new era for IFN-α in the treatment of Philadelphia--negative chronic myeloproliferative neoplasms. Expert Rev Hematol 2011;4 : 637–655.
15. Gissslinger H, Kralovics R, Gisslinger B, et al. AOP2014, a novel peg-proline interferon alpha 2b with improved pharmacokinetic properties is safe and well tolerated and shows promising efficacy in patients with polycytemia vera (PV). Blood 2012;120(21):175.
16. Gisslinger H, Zagrijtschuk O, Buxhofer-Ausch V, et al. Ropeginterferon alfa-2b, a novel IFNα 2b, induces high responses rates with low toxicity in patient with polycythemia vera. Blood 2015;126 : 1762–1769.
17. Passamonti F, Rumi E. Clinical relevance of JAK2 (V617F) mutant alele burden. Haematologica 2009;94 : 7–10.
18. Them NCC, Bagienski K, Berg T, et al. Molecular responses and chromosomal aberrations in patients with polycythemia vera treated with peg-proline-interferon alpha-2b. Am J Hematol 2015;90 : 288–294.
19. Silver RT. Long-term effects of the treatment of polycythemia vera with recombinant interferon-alpha. Cancer 2006;107 : 451–458.
20. Larsen TS, Møller MB, de Stricker K, et al. Minimal residual disease and normalization of the bone marrow after long –term treatment with alpha-interferon 2b in polycythemia vera. A report on molecular response patterns in seven patients in sustained complete hematological remission. Hematology 2009;14 : 331–334.
21. Jabbour E, Kantarijian H, Cortes J, et al. PEG-IFN-alpha-2b therapy in BCR-ABL-negative myeloproliferative disorders: Final results of a phase 2 study. Cancer 2007;110 : 2012–2018.
22. Ajzenberg N, Faile D, Lawrani L, et al. Pro-coagulant and pro-inflammatory effect of interferon alfa in myeloproliferative neoplasms. Blood 2016;128 : 1941.
23. Silver RT, Kiladjian JJ, Hasselbalch HC. Interferon and the treatment of polycythemia vera, essential thrombocythemia and myelofibrosis. Expert Rev Hematol 2013;6 : 49–58.
24. Thiele J, Kvasnicka HM. The 2008 WHO Diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis. Curr Hematol Malig Rep 2009;4 : 33 – 40.
25. Barosi G, Birgegard G, Finazzi G, et al. Response criteria for essential thrombocythemia and polycythemia vera: result of European LeukemiaNet consensus conference. Blood 2009;113 : 4829–4833.
26. Tefferi A, Barosi G, Mesa RA, et al. International Working Group (IWG) consensus criteria for treatment response in myelofibrosis with myeloid metaplasia, for the IWG for Myelofibrosis Research and Treatment (IWG-MRT). Blood 2006;108(5):1497–1503.
27. Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2015 update on diagnosis, risk-stratification and management. Am J Hematol 2015;90 : 162–173.
28. Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myeofibrosis Reaserch and Treatment. Blood 2009;113 : 2895–2901.
29. Cerguozzi S. Tefferi A. Blast tranformation and fibrotic progression in polycythemia vera and essential thrombocythemia: literature review of incidence and risk factors. Blood Cancer J 2015;5 : 11.
30. Kraus M. Zvládání nežádoucích psychiatrických účinků navozených interferonem při léčbě chronické hepatitidy C. Innovations in HCV treatment – sborník odborného sympozia České hepatologické Společnosti ČLS JEP 2004;1 : 10–11.
31. Reikvam H, Tiu RV. Venous thromboembolism in patients with essential thrombocythemia and polycythemia vera. Leukemia 2012;26 : 563–567.
32. Teferi A, Barbui T. Polycythemia vera and essential thrombocythemia. 2015 update on diagnosis, risk stratification and management. Am J Hematol 2015;90 : 163–173.
33. De Stefano V, Za T, Rossi E, et al. Recurrent thrombosis in patients with polycythemia vera and essential thrombocythemia: incidence, risk factors, and effect of treatments. Haematologica 2008;93 : 372–380.
34. Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and managements recommendation from European LeukemiaNet, J Clin Oncol 2011;29 : 761–770.
35. Griesshammer M, Gisslinger H, Mesa R, et al. Curent and future treat-ment otions for polycythemia vera. Ann Hematol 2015;94 : 901–910.
36. Kiladjian JJ, Cassinat B, Chevret S, et al. Pegylated interferon-alfa-2a induces complete molecular responses with low toxicity in polycythemia vera. Blood 2008;112(8):3065–3072.
37. Lengfelder E, Berger U, Hehlmann R. Interferon alfa in the treatment of polycythemia vera. Ann Hematol 2000;79 : 103–109.
38. Hasselbalch HC, Larsen TS, Riley CH, Jensen MK. Interferon-alpha in the treatment of Philadelphia-negative chronic myeloproliferative neoplasms Status and perspectives. Curr Drug Targets 2011;12 : 392–419.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
- Výběr z tisku a zprávy o knihách
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Interferón alfa v liečbe Ph negatívnej myeloproliferatívnej neoplázie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017
- Manažment veľkých operácií u pacientov s hemofíliou A kontinuálnou infúziou a bolusovými injekciami FVIII – farmakokinetický prístup k liečbe
- Diagnostika a léčba získané hemofilie – konsenzuální doporučení Českého národního hemofilického programu (ČNHP)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



