-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNeočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
Unsuspected 18F-FDG PET/CT positive findings in the response evaluation or follow-up of non-Hodgkin’s lymphoma patients
2-[18F] fluoro-2-deoxy-D-glucose (18F-FDG) positron emission tomography (PET) is a noninvasive, 3-dimensional imaging modality sufficiently reliable for the diagnosis and initial staging, for the evaluation of therapeutic response and for the detection of recurrence of various types of non-Hodgkin’s lymphoma (NHL). 18F-FDG is not a tracer absolutely specific for lymphoma and its uptake is increased in various benign conditions or malignancies with enhanced glycolysis. Integrated 18F-FDG PET/CT systems provide precise localization of the 18F-FDG-avid lesions and increase sensitivity and specificity of the examination but potential pitfalls and interpretation difficulties still require awareness and close cooperation of radiologist, nuclear medicine physician and hematologist. We report 20 patients with previously treated NHL who presented positive 18F-FDG PET/CT scans during therapy, at the end of therapy or in suspected recurrence of lymphoma, where unsuspected diagnosis was finally confirmed. 14 patients underwent tissue biopsy and subsequent histopathological evaluation. The final diagnosis was based on analysis of PET/CT scans and follow-up only in 6 patients. Causes of increased 18F-FDG accumulation: inflammation or infection in 13 patients, tumors in 5 patients (4 benign, 1 malignant) and other diagnoses in 3 patients (thymus hyperplasia in 2 patients, colloid thyreopathy without functional abnormalities in one patient). We suggest that positive findings on 18F-FDG PET/CT scans during or after therapy in NHL patients must be carefully interpreted by radiologist, nuclear medicine physician and hematologist and in cases of inconclusive results tissue biopsy and histological confirmation should be carried out. Such individual approach may diminish potential diagnostic and therapeutic mistakes.
Key words:
18F-FDG PET, PET/CT, lymphoma, response evaluation, limitations, pitfalls, unsuspected findings
Autoři: T. Papajík 1; M. Mysliveček 2; Z. Šedová 1; E. Buriánková 2; V. Procházka 1
; Z. Kubová 1; Z. Rusiňáková 1; L. Kučerová 3; M. Tichý 3; D. Starostka 4; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika FNOL a LF UP v Olomouci, 2Klinika nukleární medicíny FNOL a LF UP v Olomouci, 3Ústav Patologie FNOL a LF UP v Olomouci, 4Oddělení klinické hematologie Nemocnice Havířov 1
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 1, p. 17-24.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Pozitronová emisní tomografie (PET) s použitím 2-[18F] fluoro-2-deoxy-D-glukózy (18F-FDG) představuje neinvazivní trojrozměrnou vyšetřovací metodu vhodnou ke vstupní diagnostice a stážování ne-hodgkinských lymfomů (NHL), stejně tak jako k hodnocení léčebné odpovědi či k ověření relapsu choroby. 18F-FDG však není látka specificky metabolizovaná pouze buňkami lymfomu, ale její utilizace je zvýšena při různých nenádorových procesech nebo u řady neoplázií s vystupňovanou glykolýzou. Integrované 18F-FDG PET/CT systémy dnes sice umožňují precizní lokalizaci léze akumulující 18F-FDG a zvyšují tak senzitivitu a specificitu vyšetření, ale potenciální omyly nebo obtížnosti v interpretaci nálezů vyžadují zvýšenou pozornost a těsnou spolupráci mezi radiologem, lékařem nukleární medicíny a hematologem. V naší práci popisujeme soubor 20 pacientů s léčeným NHL, kteří měli pozitivní nález při 18F-FDG PET/CT vyšetření v průběhu terapie, po jejím skončení nebo při podezření na relaps choroby a u nichž byla detailní analýzou, delším pozorováním či biopticky prokázána neočekávaná diagnóza. 14 pacientů mělo provedenu tkáňovou biopsii s následným histopatologickým vyšetřením, u 6 nemocných byla diagnóza stanovena kombinací anamnézy, PET/CT snímků, paraklinických vyšetření a popřípadě dalšího sledování nemocného. U 13 pacientů se zvýšenou akumulací 18F-FDG byl nalezen zánět infekčního či neinfekčního původu, u 5 nemocných bylo prokázáno jiné nádorové onemocnění (1 maligní a 4 benigní nádory) a u zbylých 3 nemocných byl popsán jiný nález (hyperplazie thymu u 2 pacientů a koloidní eufunkční struma u 1 nemocné). Pomocí prezentace uvedených případů chceme upozornit na to, že pozitivní nálezy při 18F-FDG PET/CT vyšetření u pacientů v průběhu terapie nebo po jejím skončení musí být velmi pozorně společně interpretovány radiologem, lékařem nukleární medicíny a hematologem a u případů s podezřením na výskyt jiného onemocnění než lymfomu by měla být včas indikována biopsie takovéto tkáně. Tento individuální přístup sníží riziko potencionálních diagnostických a léčebných pochybení.
Klíčová slova:
18F-FDG PET, PET/CT, lymfom, hodnocení léčebné odpovědi, limity, omyly, neočekávané nálezyÚvod
Ne-hodgkinské lymfomy (NHL) představují rozšířené a zároveň velmi dobře léčitelné nádory lidské patologie. Stanovení rozsahu a šíření nádoru v organismu, resp. postižení jednotlivých orgánů a tkání spolu s pečlivým zhodnocením individuálních prognostických faktorů je základním krokem k výběru adekvátní protinádorové terapie a zároveň odrazovým můstkem pro pozdější hodnocení léčebné odpovědi a eventuální rozhodování o dalším léčebném postupu při zjištění zbytkové choroby v organismu (1). Prvotním cílem současné standardní terapie NHL je totiž dosažení kompletní remise choroby (CR), která je předpokladem dlouhodobého přežití, resp. možnosti vyléčení řady podtypů lymfomů (2).
Zobrazovací techniky hrají v popsaném procesu velmi důležitou roli (3). Standardním zobrazovacím vyšetřením pro určení rozsahu postižení organismu lymfomem, zvláště v oblasti hrudníku, břicha, retroperitoneálního prostoru a pánve, se stala výpočetní tomografie (CT), která při použití perorálních a nitrožilních kontrastních látek dokáže přesně popsat anatomické (strukturální) změny ve zmíněných oblastech. Přínos CT vyšetření je však výrazně limitován při hodnocení léčebné odpovědi, kdy tato metoda nedokáže rozlišit, zda případná zbytková tkáň nalezená na tomografických snímcích po léčbě představuje pouhé fibrotické reziduum nebo zda jde o stále aktivní nádorovou masu. Že jde o poměrně častý problém, lze demonstrovat na výsledcích francouzské studie, kdy Coiffier s kolegy zjistili, že u více než čtvrtiny (27 %) intenzivně léčených nemocných s DLBCL zůstává po léčbě reziduum tkáně, k jejíž povaze se nelze pomocí konvenčních zobrazovacích technik (CT) blíže vyjádřit (4). To znamená, že může jít jak o vazivovou tkáň bez zbytků životaschopných nádorových buněk (většina případů), ale také o zbytek aktivního nádorového procesu. Další nevýhodou CT je poměrně nízká schopnost detekce difuzního postižení mimouzlinových tkání a rozhodnutí o tom, zda jsou zmnožené uzliny hraniční velikosti infiltrovány lymfomem či nikoliv. V těchto situacích potřebujeme další doplňující informaci, jež umožní s vysokou pravděpodobností rozhodnout o tom, zda je tkáň či orgán infiltrován buňkami lymfomu či nikoliv. Takovou metodou se dnes zdá být pozitronová emisní tomografie (PET) s použitím analogu glukózy značeného izotopem fluoru - 2-[18F] fluoro-2-deoxy-D-glukózy (18F-FDG) (5, 6, 7). Metoda využívá toho, že nádorové buňky většiny NHL mají významně zvýšený metabolický obrat glukózy (zvýšenou glykolýzu) a proto ve zvýšené míře zpracovávají i podanou 18F-FDG (8). 18F-FDG není nádorově specifická látka a může být zvýšeně fyziologicky metabolizována i některými tkáněmi (mozková, srdeční, střevní) nebo také v oblasti zánětu, jiného nádoru či dalšího podobného procesu v organismu (9, 10). Systematická metaanalýza 20 reprezentativních studií u nemocných s maligními lymfomy zjistila, že medián senzitivity 18F-FDG PET vyšetření u NHL je 87,5 % a medián specificity 93,8 % (11). To znamená zhruba o 15 % vyšší senzitivitu oproti CT vyšetření a zhruba stejnou senzitivitu. Studie se také zabývala počty falešně pozitivních výsledků a dokumentovala jich celkem 11,4 % ze všech vyšetření. Celkově lze konstatovat, že PET vyšetření má u maligních lymfomů pozitivní prediktivní hodnotu zhruba 70–80 %, zatímco negativní prediktivní hodnota se pohybuje kolem 85 % (12).
Výhody obou metod (18F-FDG PET a CT) a jejich určitá komplementarita se staly racionálním důvodem pro integraci obou metod v jednom „hybridním“ přístrojovém PET/CT systému (13). Ten dokáže precizně anatomicky i funkčně lokalizovat patologickou lézi a dále zvýšit senzitivitu i specificitu vyšetření (14). I přesto se zejména v průběhu léčby či po léčbě relativně často dostáváme do situací, kdy lymfom může být maskován fyziologickou distribucí 18F-FDG nebo jiný proces, který vykazuje zvýšený metabolismus glukózy, může patologickou lymfomovou tkáň napodobit (15, 16). Nenádorové procesy se zvýšeným metabolismem glukózy (infekční a zánětlivá ložiska, autoimunitní procesy, granulomatózní choroby, ale i drobná traumata) mohou být při 18F-FDG PET vyšetření jen velmi těžce odlišitelné od nádorové infiltrace a mohou se u pacientů léčených pro lymfom vyskytovat souběžně. Podobně může 18F-FDG PET/CT vyšetření odhalit jiný nádorový proces, který v organismu nemocného probíhá souběžně nebo vzniká jako následek prodělané chemoterapie či radioterapie. Rozhodnutí o původu PET-pozitivní léze je pro další péči o nemocného mimořádně důležité. Proto jsme v našem článku chtěli představit zajímavé vedlejší nálezy zjištěné při 18F-FDG PET/CT vyšetření u našich pacientů léčených pro NHL.
Soubor nemocných a metody
Sledovaná skupina čítala 20 pacientů s NHL (11 žen a 9 mužů) ve věku 28–81 let (medián 51 let), kteří měli provedeno 18F-FDG PET/CT vyšetření v průběhu léčby (tzv. časné PET/CT vyšetření) nebo v různém odstupu po léčbě (v rámci hodnocení léčebné odpovědi nebo při podezření na relaps choroby) na Klinice nukleární medicíny Fakultní nemocnice Olomouc v letech 2006 –2008. Základní charakteristiky nemocných jsou shrnuty v tabulce 1.
Tab. 1. jp_32302_t_1 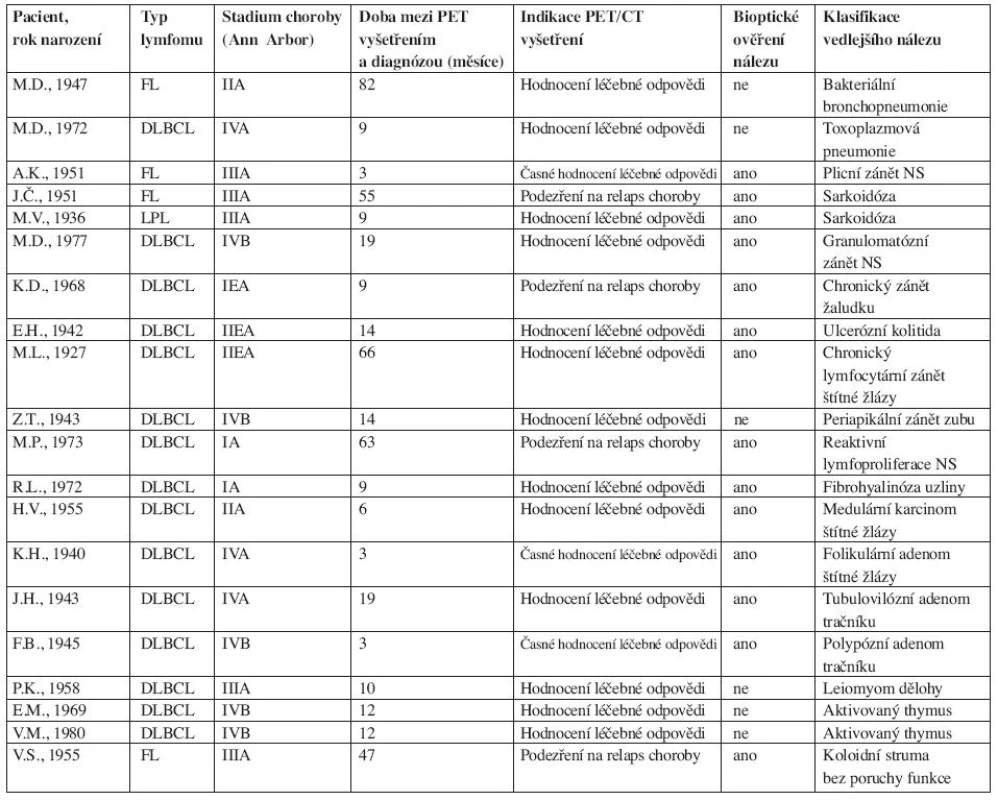
Použité zkratky: DLBCL – difuzní B-velkobuněčným lymfom, FL folikulární lymfom, LPL – lymfoplazmocytární lymfom Pacienti se dostavili k 18FFDG PET/CT vyšetření na Kliniku nukleární medicíny Fakultní nemocnice Olomouc lační (nejméně 6 hodin) a byla jim změřena hladina krevní glukózy. Pokud glykemie nepřesahovala 10 mmol/l, bylo pacientům nitrožilně podáno 400 MBq 2-deoxy-2-[18F] fluoro-D-glukózy (18F-FDG) na 70 kg hmotnosti pacienta s přepočtem aplikované aktivity na hmotnost aktuální. 60 minut po aplikaci 18F-FDG a perorálním podání roztoku kontrastní látky a těsně po vyprázdnění močového měchýře pacientem bylo zahájeno PET/CT vyšetření na skeneru Biograph 16 HI-REZ firmy Siemens. CT snímání bylo prováděno po nitrožilním podání neionické kontrastní látky typicky v rozsahu od báze lební po horní třetinu stehen se vzpaženými horními končetinami. V indikovaných případech byl rozsah snímání dle potřeby modifikován. Oblast plic byla snímána se zadržením dechu pacienta ve výdechové poloze. Následovalo kaudokraniální snímání PET, jejíž data byla zpracována za použití iterativní rekonstrukce. Transmisní korekce na zeslabení záření gama byla provedena pomocí CT. Všechny PET, CT a PET/CT nálezy byly hodnoceny nezávisle radiologem a lékařem nukleární medicíny a výsledky byly prezentovány formou mezioborového semináře. Jako pozitivní byla vizuálně hodnocena léze s fokální nebo difuzní akumulací 18F-FDG vyšší v porovnání s pozadím, respektive se strukturami mediastinálního krevního zásobení. Semikvantitativní hodnocení (standardized uptake value – SUV) nebylo použito. Podle charakteru PET/CT nálezu, anamnézy, klinického stavu a dalších laboratorních a paraklinických údajů bylo rozhodnuto o biopsii 18F-FDG PET pozitivního nálezu nebo o jeho dalším sledování.
Výsledky
V přiložené tabulce 1 shrnujeme výsledky vedlejších nálezů u pacientů léčených pro NHL. U každého nemocného je zároveň uvedeno, zda u něj byla provedena biopsie 18F-FDG PET pozitivního nálezu. Ta byla indikována u 14 z 20 nemocných (70 %). Vedlejší 18F-FDG PET/CT nálezy korelované s výsledky biopsie či klinickým nálezem můžeme rozdělit do 3 kategorií:
- Zánětlivá reakce jako příčina 18F-FDG PET pozitivity
- Benigní a maligní 18F-FDG PET pozitivní nádory nelymfocytárního původu
- Jiné 18F-FDG PET pozitivní nálezy
Do první skupiny 18F-FDG PET pozitivních nálezů zánětlivého (infekčního i neinfekčního) původu bylo možné zařadit 13 nemocných. Nejčastěji zánět postihoval plicní parenchym. U 1 pacienta byla diagnostikována klinicky nevýznamná drobná bakteriální bronchopneumonie, která reagovala na léčbu antibiotiky (vymizení ložiska bylo ověřeno CT kontrolou). U další nemocné byl diagnostikován plicní infiltrát, který byla dále vyšetřen bronchoskopicky a biopticky. Infekční agens nebylo prokázáno, stav byl uzavřen jako nespecifický zánět. U posledního nemocného, který byl vyšetřen s horečkami a symptomy infekce dýchacích cest po ukončení protinádorové léčby (imunochemoterapie s anti-CD20 protilátkou), byla při PET/CT vyšetření nalezena mnohotná oboustranná atypická ložiska plicního parenchymu. Při pátrání po etiologii těchto ložisek byla zachycena pozitivita PCR vyšetření na průkaz Toxoplasma gondii a nemocný byl úspěšně zaléčen razantní cílenou protiinfekční terapií. U 3 nemocných byl na PET/CT snímcích nalezen a biopticky ověřen granulomatózní zánět. U 2 z nich byla prokázána sarkoidóza v oblasti hilových a mediastinálních uzlin (u jednoho z nich vznikla na udržovací terapii interferonem a imitovala relaps choroby, u druhé nemocné byl v anamnéze údaj o léčené sarkoidóze v minulosti) (obr. 1). 1 nemocný s difuzním B-velkobuněčným lymfomem (DLBCL) byl vyšetřen pro podezření na relaps choroby po vysoce dávkované terapii s autologní transplantací kmenových buněk. Na PET/CT skenech byla prokázána 18F-FDG PET pozitivní ložiska v játrech, pozitivita lymfatických uzlin v oblasti portální žíly, sleziny a truncus coeliacus a výrazná difuzní pozitivita byla identifikována v parenchymu sleziny. Pro narůstající bolestivou splenomegalii byla indikována splenektomie a zároveň byly k histopatologickému vyšetření odebrány 2 lymfatické uzliny a vzorek jaterní tkáně. Ve všech tkáních patolog nalezl blíže nespecifický granulomatózní zánět, jehož etiologii se nepodařilo objasnit ani rozsáhlým laboratorně-klinickým vyšetřením nemocného. Pacient i dva roky od tohoto nálezu zůstává v klinicky dobrém stavu, v laboratorních vyšetřeních je přítomen jen obraz lehké hepatopatie s převahou mírné intrahepatální cholestázy, velikost a charakter lymfatických uzlin zůstávají nezměněny. U dalších dvou nemocných byla po skončení imunochemoterapie v rámci hodnocení léčebné odpovědi nalezena 18F-FDG PET pozitivní léze v oblasti trávicího traktu. U prvního z nich byl ověřován PET pozitivní nález lokalizovaný v žaludku, který při endoskopickém vyšetření vykazoval známky nekomplikované chronické gastritidy. Tento nález potvrdilo i histopatologické vyšetření 6 vzorků odebrané tkáně. Infekce Helicobacterem pylori nebyla detekována. U druhého pacienta byla nalezena PET pozitivní tkáň v oblasti vzestupného tračníku. Endoskopicky a biopticky byl v této lokalizaci potvrzen nespecifický střevní zánět typu ulcerózní kolitidy, jejíž lehká forma se vyskytovala i v anamnéze nemocné. Další nemocná měla PET pozitivní nález zachycený v tkáni štítné žlázy, punkční cytologie odhalila lymfocytární thyreoitidu. V dalším případě byly při podezření na relaps lymfomu detekovány 18F-FDG PET pozitivní uzliny na krku a v axile. Chirurgicky byly dvě uzliny vyňaty a histopatologické vyšetření nalezlo jen reaktivní lymfadenopatii nejasné etiologie (obr. 2). Nemocná byla 2 roky po imunochemoterapii s rituximabem a vysocedávkované terapii pro relaps DLBCL, v posledním půlroce před vyšetřením prodělala opakované záněty horních cest dýchacích, které vyžadovaly léčbu antibiotiky a opakované podání imunoglobulinů z důvodů těžkého deficitu všech jejich tříd. Další nemocný s lokalizovaným DLBCL měl po imunochemoterapii nalezenu 18F-FDG PET pozitivní axilární uzlinu o velikosti 20x10 mm. Ta byla extirpována a v histologickém nálezu byla přítomna pouze nespecifická fibrohyalinóza. U poslední pacientky s původně agresivním DLBCL vyrůstajícím z maxilárního sinu 18F-FDG PET/CT odhalilo metabolicky aktivní tkáň lokalizovanou v horní čelisti nemocné. Podrobná analýza snímků, následné cílené rtg vyšetření a drobný stomatologicko-chirurgický zákrok detekoval exacerbovanou chronickou periodontitidu lokalizovanou kolem zubu 15. Nález byl v odstupu kontrolován rentgenologicky a při tomto vyšetření již nebyl zánět přítomen.
Obr. 1. Na fúzovaném koronálním PET/CT řezu lze diferencovat zvýšenou akumulaci <sup>18</sup>F-FDG v lymfatických uzlinách mediastina paratracheálně vpravo, oboustranně bronchopulmonálně, v paketu uzlin subkarinálně a v retroperitoneu v lymfatické uzlině paraaortálně vlevo pod brániční krurou. Vícečetné postižení lymfatických uzlin bylo i v dalších lokalizacích, které nejsou na tomto řezu zastiženy. Biopticky prokázána sarkoidóza. 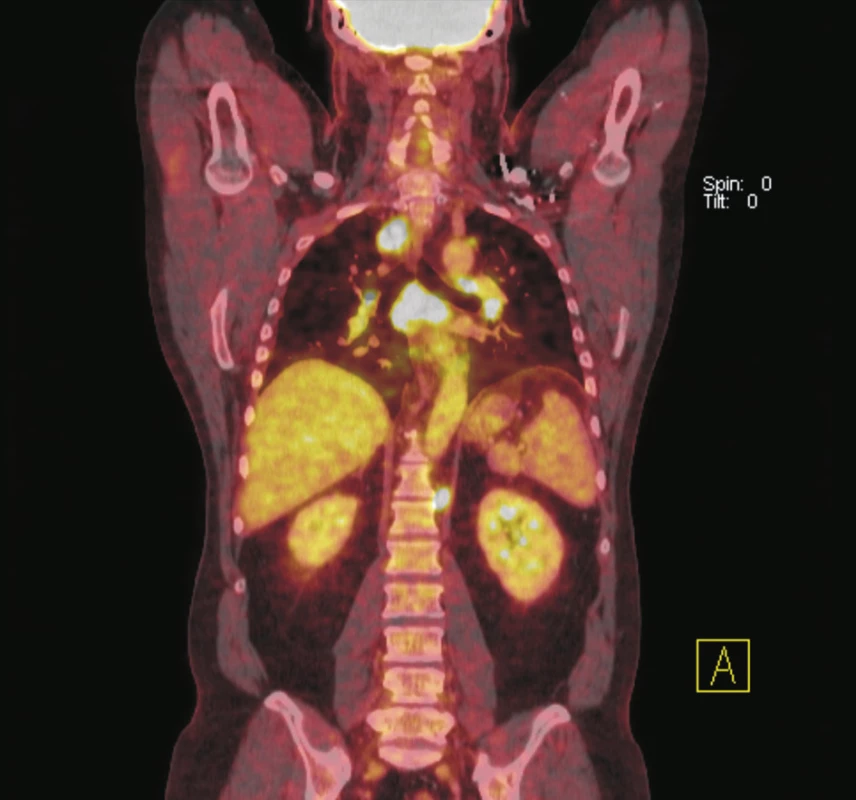
Obr. 2. Fúze PET a CT řezů v koronální rovině. Na krku je v lymfatických uzlinách oboustranně patrná zvýšená akumulace <sup>18</sup>F-FDG. Největší uzlina vpravo dosahuje velikosti 15x13 mm, vlevo 16x13 mm. Biopticky ověřena reaktivní lymfadenitida u imunosuprimované nemocné po imunochemoterapii a autologní transplantaci krvetvorných kmenových buněk pro relabující lymfom. 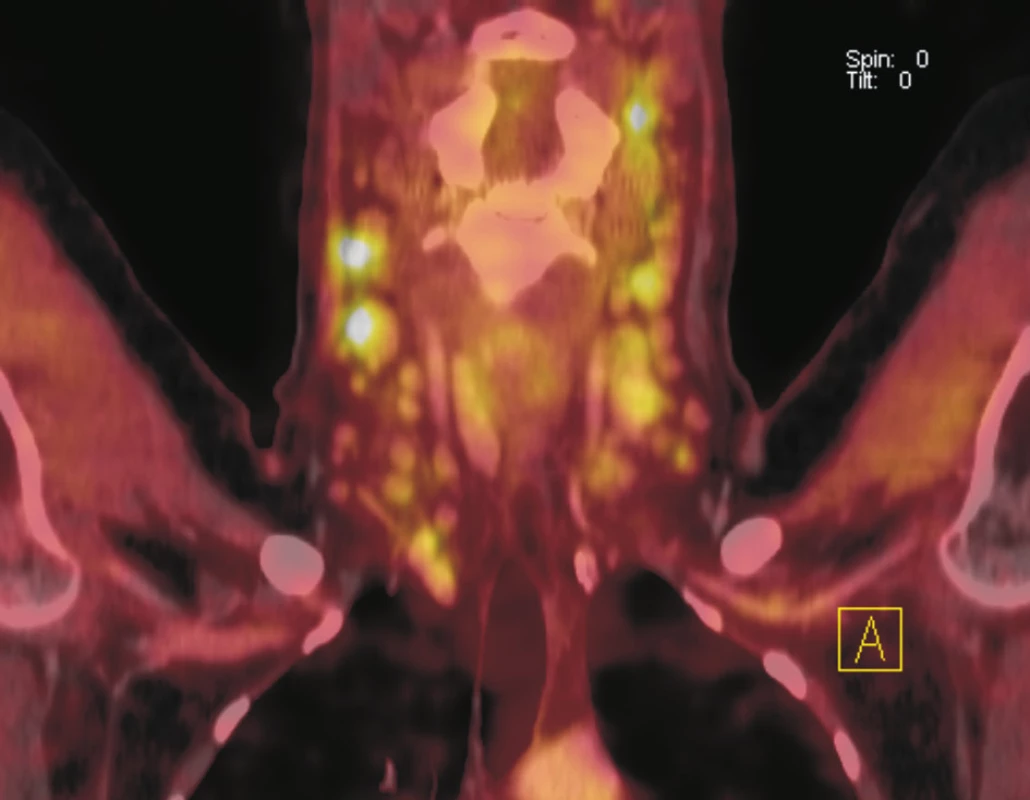
Druhá skupina vedlejších nálezů zahrnovala benigní a maligní 18F-FDG PET pozitivní nádory nelymfocytárního původu. Tento podsoubor čítal 5 vyšetřených nemocných. U 4 nemocných šlo o benigní nádory, u 1 nemocné byl detekován maligní nádor. 2 nemocní měli 18F-FDG PET pozitivní podezřelý nález na štítné žláze. U obou byl indikován bioptický zákrok a histopatologické vyšetření, které odhalilo medulární karcinom v prvním případě a folikulární adenom v případě druhém. U dvou nemocných byly detekovány 18F-FDG PET pozitivní léze v sestupném tračníku. Endoskopické vyšetření verifikovalo střevní polypy u obou vyšetřených, histopatologický nález potvrdil tubuluvilózní a polypózní adenomy (obr. 3). Poslední nemocná měla při vyšetření po léčbě lymfomu, který byl původně lokalizován v retroperitoneu a malé pánvi, výrazně 18F-FDG PET pozitivní nález ve stěně dělohy. U nemocné bylo indikováno kontrolní gynekologické vyšetření. Gynekolog srovnal klinické a ultrazvukové nálezy z posledních 5 let a potvrdil, že se jedná o stacionární leiomyom děložního těla (obr. 4). Pro nejasné potíže a podezření na relaps choroby bylo 18F-FDG PET/CT vyšetření opakováno po roce. Relaps nebyl potvrzen, jako vedlejší nález opět dominoval výrazně 18F-FDG PET pozitivní leiomyom dělohy.
Obr. 3. Fúze sagitálních řezů PET a CT. Je patrná fokálně zvýšená akumulace <sup>18</sup>F-FDG ve dvou krátkých úsecích rektosigmoidea. CT bez jednoznačného strukturálního korelátu. Doporučeno endoskopické došetření, které prokázalo polyp tlustého střeva. Histologicky potvrzen tubulovilózní adenom. 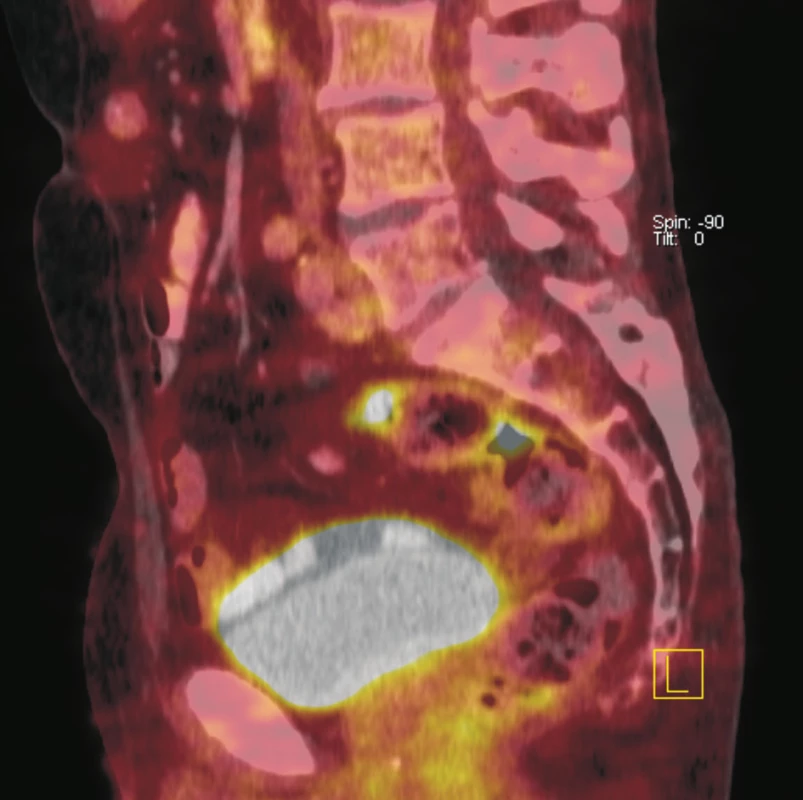
Obr. 4. Fúze PET a CT řezů–sagitální rovina (vlevo), koronální rovina (vpravo). Ve fundu dělohy lze na CT diferencovat hyperdenzní formaci o průměru 36 mm se zvýšenou akumulací <sup>18</sup>F-FDG. Po srovnání klinických a ultrazvukových nálezů z posledních 5 let (gynekolog) a vstupního CT vyšetření bylo konstatováno, že se jedná o stacionární leiomyom děložního těla. Kontrolní <sup>18</sup>F-FDG PET/CT vyšetření o rok později potvrdilo neměnnost nálezu. 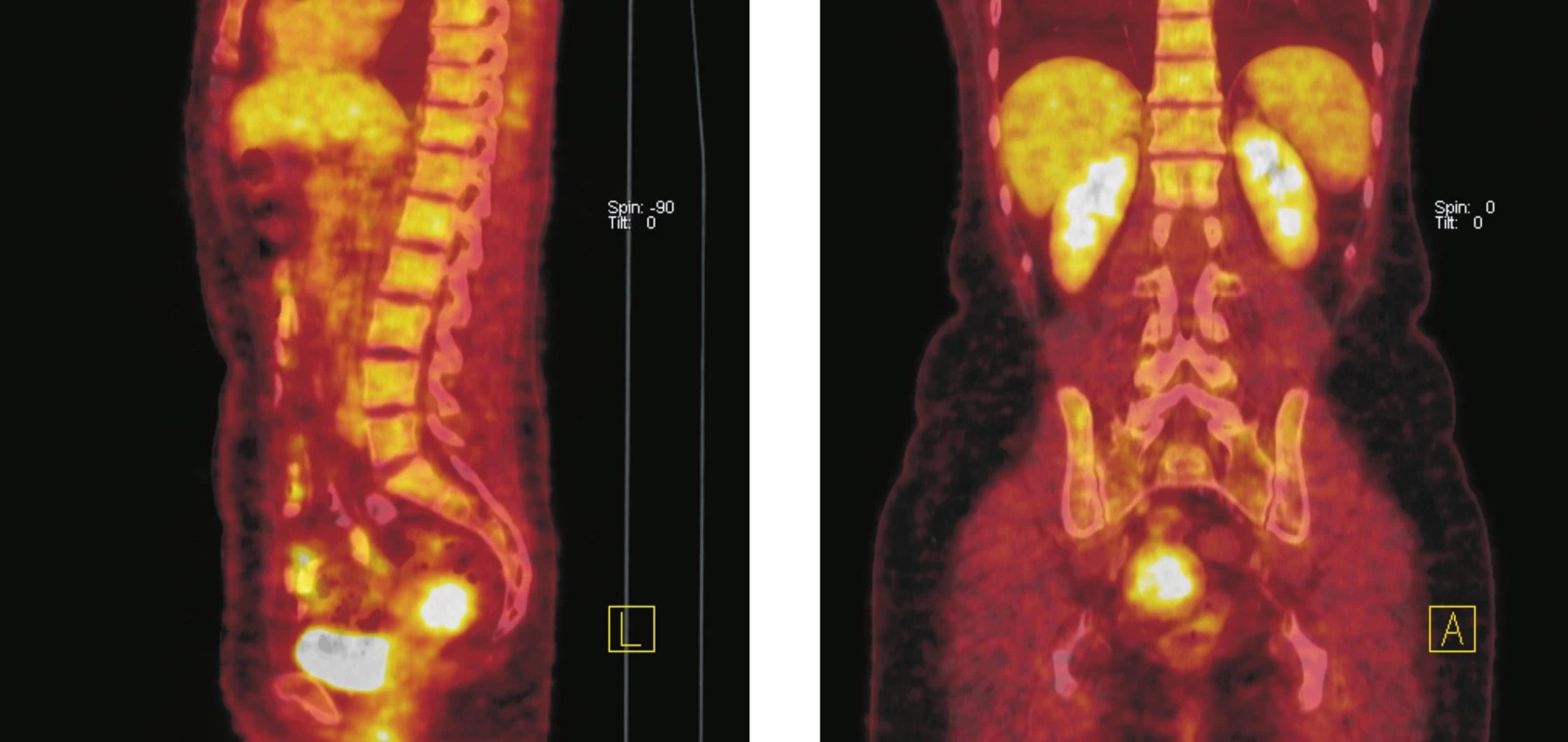
Poslední skupinu tvořily vedlejší nálezy, které nebylo možné zařadit ani do jedné z výše uvedených předchozích skupin. Ve 2 případech byla v předním mediastinu nalezena 18F-FDG PET pozitivní tkáň, která při podrobném zkoumání PET/CT snímků měla typické anatomicko-morfologické znaky aktivovaného thymu (obr. 5). U obou pacientů nebyla navíc tato oblast 18F-FDG PET pozitivní při vyšetření před zahájením léčby. U nemocných byla provedena po půl roce kontrola nálezu, který v časovém odstupu mírně regredoval v prvním případě, resp. neměnil svoji velikost a aktivitu v případě druhém. U poslední nemocné kontrolní 18F-FDG PET/CT vyšetření odhalilo pozitivní tkáň v oblasti štítné žlázy (obr. 6). Opakovanou punkční cytologií nebyl prokázán ani zánět, ani nádorová infiltrace, nemocná byla klinicky, laboratorně a pomocí ultrazvuku dále sledována. Nález byl uzavřen jako koloidní struma bez poruchy funkce žlázy. Při kontrolním vyšetření o 12 měsíců později nebyla zvýšená akumulace 18F-FDG ve štítné žláze již patrná.
Obr. 5. Fúze PET a CT řezů – koronální (vlevo), transverzální (vpravo). Zvýšená akumulace <sup>18</sup>F-FDG v měkkotkáňové struktuře horního předního mediastina, která nebyla patrná při vstupním vyšetření před zahájením imunochemoterapie. Velikost ani charakter popsané struktury se při pozdějším kontrolním vyšetření nezměnily. Nález hodnocen jako aktivace tkáně thymu po chemoterapii. 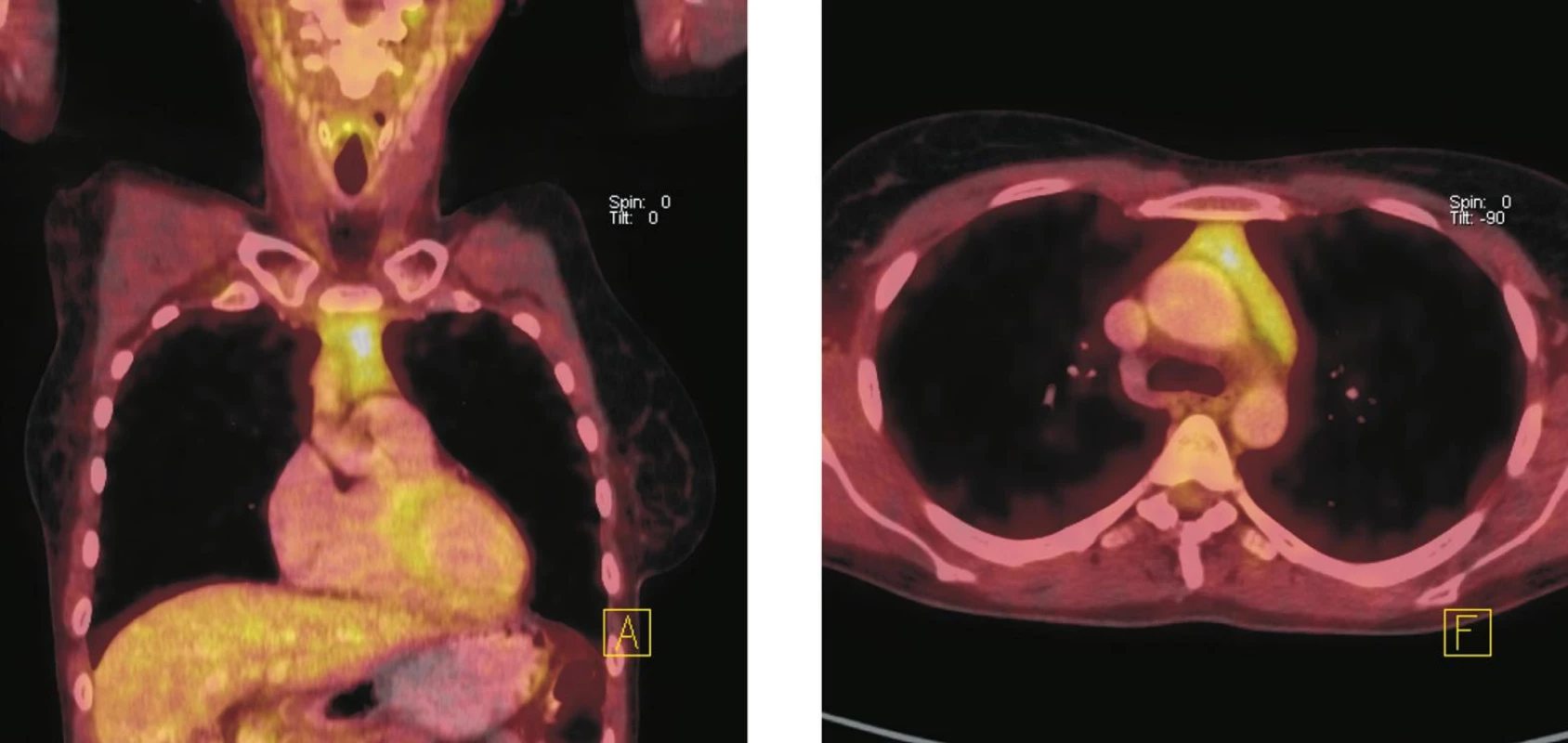
Obr. 6. Transverzální tomografické řezy v úrovni štítné žlázy (a - PET, b - fúze PET/CT, c – CT). Ložisko zvýšené akumulace <sup>18</sup>F-FDG v pravém laloku štítné žlázy velikosti 10 x 10 mm, na CT má nehomogenní strukturu. Opakovanou aspirační cytologií, laboratorním vyšetření, klinickým a ultrazvukovým sledováním prokázána koloidní struma bez poruchy funkce. Při kontrolním vyšetření o 12 měsíců později nebyla zvýšená akumulace <sup>18</sup>F-FDG patrná. 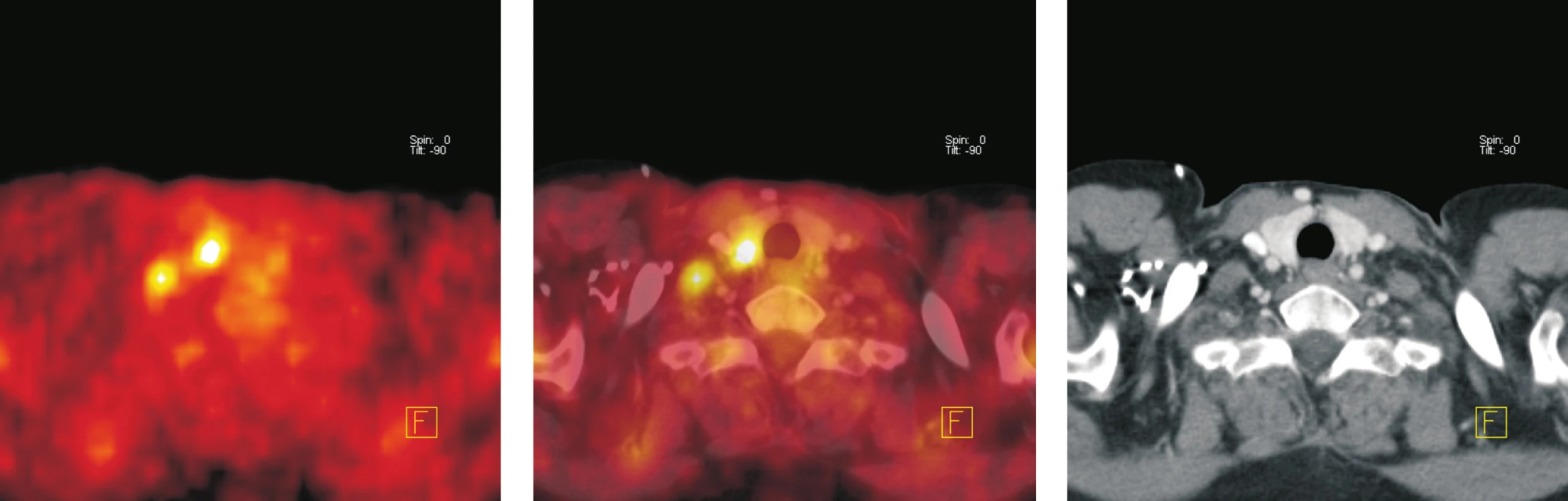
Diskuse
Velmi významný pokrok v možnostech stanovení léčebné odpovědi u pacientů s NHL znamenalo zavedení metody 18F-FDG-PET a později i PET/CT do rutinní klinické praxe (17, 18). 18F-FDG-PET a PET/CT přinesly oproti konvenčním radiologickým a radioizotopickým vyšetřením zjednodušení vyšetřovacího postupu a významné zpřesnění finálních výsledků zobrazení. Publikované studie také potvrdily jednoznačný rozdíl v přežití nemocných, kteří měli po skončení léčby pozitivní reziduální tkáň dle 18F-FDG-PET vyšetření ve srovnání s těmi, kteří dosáhli PET-negativního obrazu (5, 6, 7). Brzy se také objevila řada prací, které hodnotily význam tzv. časného 18F-FDG-PET vyšetření, které bylo prováděno po 1–3 cyklech léčby (19, 20, 21). Všechny prokázaly jednoznačný prediktivní význam časného 18F-FDG-PET vyšetření pro prognózu a přežití nemocných s DLBCL.
I když nástup 18F-FDG-PET/CT hybridních systémů zvýšil specificitu vyšetření a vylepšil naše diferenciálně diagnostické možnosti v hodnocení 18FDG-PET pozitivních lézí při hodnocení léčebné odpovědi nebo při vyšetření pro podezření na relaps choroby, stále jsme v klinické praxi konfrontování s celou řadou nálezů, které pravděpodobně s původním lymfomem nesouvisí a obecně jsou označovány jako nálezy vedlejší, nečekané či překvapivé (10, 15, 16, 22). V souvislosti s takovou možností musíme mít stále na mysli, že molekula 18F-FDG je také metabolizována ve zvýšené míře fyziologicky některými tkáněmi a orgány, resp. jinými nádorovými či nenádorovými procesy, jež mohou v organismu pacientů s NHL v průběhu léčby nebo po jejím ukončení probíhat. A právě odlišení přetrvávající pozitivity 18F-FDG-PET ve viabilní nádorové tkáni především od nenádorových reaktivních, reparativních či zánětlivých změn může činit v hodnocení PET/CT nálezů – ať již v klinických studiích nebo každodenní praxi – významný problém. V literatuře se již objevily samostatné práce, jež na takové nálezy upozorňují (23, 24).
Řada 18F-FDG-PET pozitivních nálezů může vyplývat z intenzivního, i když interindividuálně proměnlivého metabolismu glukózy v řadě tkání. Tyto situace jsou většinou v literatuře dobře zdokumentovány a zkušeným lékařem nukleární medicíny standardně rozpoznány (10–17). Patří sem pravidelná vysoká míra metabolismu 18FDG v mozku, u některých jedinců v myokardu, trávicím systému (žaludku, céku a tračníku), pravidelně ve vývodných cestách močových, jimiž je 18F-FDG vylučována či v hrudní paraspinální oblasti tzv. hnědého tuku, kde může probíhat intenzivní anaerobní glykolýza. U mladších nemocných je zvýšená míra metabolismu 18F-FDG pravidelně nalézána v slinných žlázách, v thymu nebo v kosterním svalstvu po fyzické zátěži nebo při křečích.
Mnohé z nenádorových reaktivních, zánětlivých či reparačních změn, které mohou vzniknout při léčbě či po léčbě lymfomu, již představuje obtížnější diferenciálně-diagnostický problém. Tyto procesy mohou souviset s aplikací léků (aktivace kostní dřeně po filgrastimu, reakce regionální lymfatické uzliny po podkožní či nitrosvalové aplikaci léku), s reparačními tkáňovými procesy (po chirurgickém zákroku, po radioterapii), s infekčními chorobami (virové, bakteriální, plísňové i parazitární) a autoimunitními (vaskulitidy) nebo granulomatózními záněty (sarkoidóza).
Pacienti po léčbě NHL mají také všeobecně vyšší riziko vzniku sekundárního nádorového onemocnění, na jehož výskyt je nutné při podezřelém nálezu v zejména v mimouzlinové orgánové lokalizaci myslet. Případy, kdy při 18F-FDG-PET vyšetření pro podezření na relaps choroby byl objeven druhotný solidní nádor, jsou nyní stále častěji popisovány ve světovém písemnictví a bude jich s jistotou dále přibývat (22, 24). To souvisí zejména se zlepšením výsledků protinádorové terapie u nemocných s NHL a jejich prodlouženým přežitím, resp. vyléčením jejich lymfomu.
Výskyt 18F-FDG-PET pozitivních nálezů, jež nejsou způsobeny aktivní tkání původního lymfomu je při hodnocení léčebné odpovědi nebo při vyšetření s podezřením na jeho relaps odhadován na 15–25 % (22, 23, 24). Tyto údaje pocházejí většinou z retrospektivně hodnocených a nepříliš homogenních souborů nemocných s NHL. Také metodika potvrzení pozitivních nálezů se v souborech liší a počet biopticky či jinak jednoznačně ověřených nálezů v nich kolísá. V našem souboru nemocných jsme z důvodu různorodosti souboru z hlediska doby vyšetření (doba hodnocení léčebné odpovědi, vyšetření při podezření na relaps lymfomu, různá doba od diagnózy či ukončení terapie) četnost výskytu vedlejších nálezů nehodnotili. Primárním cílem naší práce bylo upozornění odborné veřejnosti na tento fenomén, který je spojen s relativně novou vyšetřovací metodou v onkologii a s tím, že nejde o metodu s absolutní specificitou pro detekci lymfomové tkáně, resp. nádorového onemocnění jako takového. Na druhé straně jsme chtěli zmapovat etiologii výskytu nejčastějších vedlejších nebo neočekávaných nálezů při 18F-FDG-PET/CT vyšetření při nebo po léčbě NHL a demonstrovat nutnost bedlivé rozvahy při hodnocení těchto lézí, ať již lékařem PET centra, tak zvláště hemato-onkologem, který rozhoduje o dalším postupu v péči o pacienta. Často totiž až společné posouzení nálezu, další indikovaná vyšetření nebo přímá biopsie podezřelé tkáně odhalí pravou příčinu 18F-FDG-PET pozitivity.
V předkládaném souboru 20 nemocných, vyšetřených pomocí 18F-FDG-PET/CT s pozitivním nálezem metabolicky aktivní tkáně, která nebyla spojena s jejich diagnózou NHL, jasně dominovaly nálezy zánětlivých procesů (65 %). Šlo o záněty infekčního i neinfekčního původu, které byly nejčastěji lokalizovány v oblasti plicní tkáně a zažívacího traktu. 3 z 13 nálezů představovaly granulomatózní procesy, u 2 ze 3 těchto nemocných byla prokázána sarkoidóza. Naše nálezy odpovídají datům, která byla v posledních letech publikována několika pracemi v mezinárodním písemnictví (22, 23, 24). Autoři upozorňují na fakt, že glukóza je jediný energetický zdroj granulocytů a makrofágů během jejich metabolického „vzplanutí“ jako reakce na infekci, nekrózu či jiné poškození tkáně. Zdá se, že spolu s novými léčebnými postupy (imunochemoterapie s použitím monoklonálních protilátek) počet nespecificky 18F-FDG-PET pozitivních nálezů spojených se zánětem spíše poroste (25).
Na druhém místě jsme nalezli 18F-FDG-PET pozitivní nádory benigního i maligního původu, nejčastěji opět v oblasti zažívacího traktu, resp. tkáně štítné žlázy. Z poslední skupiny nálezů je potřebné upozornit na zachycení typického obrazu aktivovaného thymu u 2 mladých žen po autologní transplantaci krvetvorných buněk, které při diagnóze lymfomu neměli v předním mediastinu žádný patologický útvar. U obou nemocných byl nález sledován a při 18F-FDG-PET/CT vyšetření v odstupu pak potvrzena jeho regrese. U 14 z 20 nemocných jsme původ 18F-FDG-PET pozitivního nálezu potvrdili biopsií podezřelé tkáně, u 6 nemocných PET/CT obraz a klinický stav pacienta byl natolik charakteristický, že odběr tkáně nevyžadoval.
Někteří autoři uvádějí, že nález 18F-FDG-PET pozitivního ložiska při hodnocení léčebné odpovědi nebo při vyšetření při podezření na relaps choroby v místě, kde byl lymfom přítomen při diagnóze je spojen s vysokou pravděpodobností s přítomností lymfomové tkáně (22). Detailní srovnání obou nálezů tak může pomoci při hledání etiologie 18F-FDG-PET pozitivního procesu a hovoří pro užitečnost provedení vstupního vyšetření u nemocných, u kterých bude léčba lymfomu probíhat s kurativním záměrem. Na druhé straně pozitivní nálezy mimo tkáň původně postiženou lymfomem, v případech, kdy ostatní lymfomové masy regredovaly či vymizely, zasluhují zvýšenou pozornost a často i bioptické ověření původu procesu. U řady pacientů v našem souboru však z historických důvodů (dostupnost nově zavedené vyšetřovací metody) nebylo vstupní 18F-FDG-PET nebo 18F-FDG-PET/CT provedeno. Samozřejmě ze všech pravidel existují výjimky a nejinak je tomu i v případech zmíněných výše. Zejména 18F-FDG-PET nálezy v oblasti zbytkové tkáně u mediastinálních lymfomů mohou být způsobeny fibrózním či granulomatozním procesem, jenž je následkem prodělané chemoterapie, resp. radioterapie, u vyšetření provedených v odstupu od léčby pak často nálezem odpovídajícím reparačním procesům v zbytkové tkáni (26).
Závěr
18F-FDG-PET/CT vyšetření dramaticky zlepšilo možnosti hodnocení léčebné odpovědi u pacientů s NHL a představuje také velmi účinný nástroj při pátrání po možném relapsu choroby. 18F-FDG-PET však není pro detekci lymfomu metodou absolutně specifickou a řada jak fyziologických, tak patologických procesů může lymfom napodobovat. Nejčastěji jde o reparativní a zánětlivé procesy, s delším odstupem od léčby pak narůstá i výskyt druhotných solidních nádorů vzniklých v důsledku pozdní toxicity protilymfomové terapie. Hybridní 18F-FDG-PET/CT systémy zvyšují specificitu vyšetření a řadu nejednoznačných 18F-FDG-PET nálezů mohou blíže charakterizovat. Detailní nezávislá analýza 18F-FDG-PET a CT zobrazení a jejich následné 18F-FDG-PET/CT fúze radiologem a lékařem nukleární medicíny a společná interpretace výsledku s klinickým hematologem na pozadí znalosti anamnézy, stavu a závěrů dalších vyšetření pomáhají rozhodnout o dalším postupu u konkrétního nemocného. I přesto v řadě případů teprve histopatologické vyšetření bioptického vzorku podezřelé tkáně odkryje povahu procesu, který v ní probíhá.
Práce byla podpořena grantem IGA MZ ČR No. NR/9502-3
Doc. MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Zdroje
1. Jack AS, Burnett AK. Procedures for the primary diagnosis and follow-up of patients with lymphoma. In Mauch PM, Armitage JO, Coiffier B, et al. Non-Hodgkin’s Lymphomas. Lippincott Williams and Wilkins, Philadelphia, 2004; 856 s.
2. Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomnas. J Clin Oncol 1999; 17 : 1244–1253.
3. Barentsz J, Takahashi S, Oyen W, et al. Commonly used imaging techniques for diagnosis and staging. J Clin Oncol 2006; 24 : 3234–3244.
4. Coiffier B, Gisselbrecht C, Herbrecht R, et al. LNH-84 regimen: a multicenter study of intensive chemotherapy in 737 patients with aggressive malignant lymphoma. J Clin Oncol 1989; 7 : 1018–1026.
5. Cremerius U, Fabry U, Neuerburg J, et al. Positron emission tomography with 18F-FDG to detect residual disease after therapy for malignant lymphoma. Nucl Med Commun 1998; 19 : 1055–1063.
6. Zinzani PL, Magagnoli M, Chierichetti F, et al. The role of positron emission tomography (PET) in the management of lymphoma patients. Ann Oncol 1999; 10 : 1181–1184.
7. Spaepen K, Stroobants S, Dupont P, et al. Prognostic value of positron emission tomography (PET) with fluorine-18 fluorodeoxyglucose ([18F]FDG) after first-line chemotherapy in non-Hodgkin’s lymphoma: is [18F]FDG-PET a valid alternative to conventional diagnostic methods? J Clin Oncol 2001; 19 : 414–419.
8. Warburg O. On the origin of cancer cells. Science 1956; 123 : 309 – 314.
9. Bakheet SM, Powe J. Benign causes of 18-FDG uptake on whole body imaging. Semin Nucl Med 1998; 28 : 352–358.
10. Kazama T, Faria SC, Varavithya V, et al. FDG PET in the evaluation of treatment for lymphoma: clinical usefulness and pitfalls. Radiographics 2005; 25 : 191–207.
11. Isasi CR, Lu P, Blaufox MD. A metaanalysis of 18F-2-deoxy-2-fluoro-D-glucose positron emission tomography in the staging and restaging of patients with lymphoma. Cancer 2005; 104 : 1066 – 1074.
12. Seam P, Juweid ME, Cheson BD. The role of FDG-PET scans in patiens with lymphoma. Blood 2007; 110 : 3507–3516.
13. Schulthess GK, Steinert HC, Hany TF. Integrated PET/CT: current applications and future directions. Radiology 2006; 238 : 405–422.
14. Freudenberg LS, Antoch G, Schutt P, et al. FDG-PET/CT in re-staging of patients with lymphoma. Eur J Nucl Med Mol Imaging 2004; 31 : 325–329.
15. Barrington SF, O’Doherty MJ. Limitations of PET for imaging lymphoma. Eur J Nucl Med Mol Imaging 2003; 30 (Suppl. 1): 117 – 127.
16. Blake MA, Singh A, Setty BN, et al. Pearls and pitfalls in interpretation of abdominal and pelvic PET-CT. Radiographics 2006; 26 : 1335–1353.
17. Brepoels L, Stroobants S, Verhoef G. PET and PET/CT for response evaluation in lymphoma: current practice and developments. Leuk Lymphoma 2007; 48 : 270–282.
18. Reske SN. FDG-PET and PET/CT in malignant lymphoma. Recent Results Cancer Res 2008; 170 : 93–107.
19. Spaepen K, Stroobants S, Dupont P, et al. Early restaging positron emission tomography with (18)F-fluorodeoxyglucose predicts outcome in patients with aggressive non-Hodgkin’s lymphoma. Ann Oncol 2002; 9 : 1356–1363.
20. Haioun C, Itti E, Rahmouni A, et al. [18F]fluoro-2-deoxy-D-glucose positron emission tomography (FDG-PET) in aggressive lymphoma: an early prognostic tool for predicting patient outcome. Blood 2005; 106 : 1376–1381.
21. Kostakoglu L, Goldsmith SJ, Leonard JP, et al. FDG-PET after 1 cycle of therapy predicts outcome in diffuse large cell lymphoma and classic Hodgkin disease. Cancer 2006; 107 : 2678–2687.
22. Castellucci P, Zinzani P, Pourdehnad M, et al. 18F-FDG PET in malignant lymphoma: significance of positive findings. Eur J Nucl Med Mol Imaging 2005; 32 : 749–756.
23. Castellucci P, Nanni C, Farsad M, et al. Potential pitfalls of 18F-FDG PET in a large series of patients treated for malignant lymphoma: prevalence and scan interpretation. Nucl Med Commun 2005; 26 : 689–694.
24. Sonet A, Graux C, Nollevaux MC, Krug B, Bosly A, Vander Borght T. Unsuspected FDG-PET findings in the follow-up of patients with lymphoma. Ann Hematol 2007; 86 : 9–15.
25. Han HS, Escalón MP, Hsiao B, Serafini A, Lossos IS. High incidence of false-positive PET scans in patients with aggressive non-Hodgkin’s lymphoma treated with rituximab-containing regimens. Ann Oncol 2009; 20 : 309–318.
26. Zinzani PL, Tani M, Trisolini R, et al. Histological verification of positive positron emission tomography findings in the follow-up of patients with mediastinal lymphoma. Haematologica 2007; 92 : 771–777.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2010 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2010_06 ze dne 1. 3. 2010 verze 2 (2010_04)
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Úvod
- Vzpomínka na prof. James R. McArthura, M.D., čestného člena České hematologické společnosti ČLS JEP
- „Nová protinádorová léčiva a léčebné strategie v onkologii“ autorů prof. MUDr. P. Klenera, DrSc. a MUDr. P. Klenera jr., Ph.D.
- Methotrexate /6-mercaptopurine maintenance therapy influences the risk of a second malignant neoplasm after childhood acute lymphoblastic leukemia: results from the NOPHO ALL – 92 study
- The spectrum of Evans syndrome in adults: new insight into the disease based on the analysis of 68 cases
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



