-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRizikové faktory u chronické lymfocytární leukemie, validace flow-cytometrické detekce ZAP-70 pomocí RT-PCR a imunohistochemie
Risk factors in chronic lymphocytic leukemia, validation of flow cytometric detection using RT-PCR and immunohistochemistry
Individual prognosis in patients with chronic lymphocytic leukemia (CLL) may be specified by biological risk factors, detection of which must however be sufficiently standardized prior to their introduction into clinical practice. In the presented study of 73 patients we have assessed immunoglobulin variable heavy-chain gene (IgVH) status, presence of mutation in p53 gene and with the use of flow cytometry (FCM) expression of CD38 and ZAP-70 tyrosine kinase. Unmutated IgVH status was present in 58 % patients, p53 mutation in 19 %, positive expression of CD38 in 26 % and positive expression of ZAP-70 using FCM in 62 %. Patients with unmutated IgVH, positive expression of ZAP-70 assessed by FCM and p53 mutation had significantly shorter time from diagnosis to initiation of therapy. Overall concordance between ZAP-70 expression and IgVH mutational status was 85 %. Validation of the FCM ZAP-70 detection was performed by comparison to the immunohistochemical analysis on histological sections and quantitative real-time PCR on the mRNA level; overall concordance was 86 %. Expression of ZAP-70 showed to be stable over time; with median time of 12 months from the acquisition of the first sample to the last, qualitative change of ZAP-70 expression was noted in only one patient, who became positive upon disease progression.
Key words:
chronic lymphocytic leukemia, ZAP-70, IgVH mutation status, CD38, p53, prognosis
Autoři: M. Špaček 1; S. Peková 2; L. Bezdíčková 1; T. Kozák 1
Působiště autorů: Oddělení klinické hematologie, 3. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice Královské Vinohrady, Praha, 2Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha 1
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 2, p. 91-96.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Prognóza pacientů s chronickou lymfocytární leukemií (CLL) může být upřesněna některými biologickými rizikovými faktory, jejichž stanovení ale musí být před zavedením do klinické praxe dostatečně standardizováno. V této studii se u 73 pacientů stanovoval mutační stav variabilních segmentů genů pro těžký řetězec imunoglobulinu (IgVH), mutace genu p53 a pomocí flow-cytometrie (FCM) exprese CD38 a tyrozinkinázy ZAP-70. Nemutovaný stav IgVH mělo 58 % nemocných, mutaci p53 19 %, pozitivní expresi CD38 26 % a pozitivní expresi ZAP-70 dle FCM 62 %. Pacienti s nemutovaným IgVH, pozitivní expresí ZAP-70 dle FCM a mutací p53, měli statisticky významně kratší čas od diagnózy do zahájení terapie. Celková konkordance mezi expresí ZAP-70 a mutačním stavem IgVH byla 85 %. Validace FCM analýzy exprese ZAP-70 byla provedena srovnáním s imunohistochemickou detekcí ZAP-70 na histologických preparátech a kvantitativní Real-Time PCR na úrovni ZAP-70 mRNA, kdy celková shoda byla 86 %. Exprese ZAP-70 se ukázala být stabilní v průběhu onemocnění; při mediánu 12 měsíců mezi odběrem prvního a posledního vzorku byla zaznamenána kvalitativní změna exprese ZAP-70 pouze u jednoho pacienta, kdy se stala pozitivní při progresi onemocnění.
Klíčová slova:
chronická lymfocytární leukemie, ZAP-70, mutační stav IgVH, CD38, p53, prognózaÚvod
Chronická lymfocytární leukemie (CLL) je na Západě nejčastější leukemií u dospělých a vyznačuje se velmi variabilním klinickým průběhem. Kromě standardních klinických stážovacích systémů dle Raie a Bineta (1, 2), jsou v současnosti k dispozici různé biologické rizikové faktory, které nám umožňují lépe předpovědět prognózu konkrétního pacienta, což je potřebné zejména v nízkých klinických stadiích. Mezi laboratorní parametry ukazující na aktivitu choroby patří např. elevace laktátdehydrogenázy, zdvojovací čas lymfocytů (3), typ infiltrace kostní dřeně (4); v séru lze měřit β-2-mikroglobulin, solubilní CD23 a tymidin kinázu (5, 6). Mezi genetické markery se řadí zejména cytogenetické aberace (delece 17p13, delece 11q), mutace genů (p53, ATM) a mutační stav variabilních segmentů genů pro těžký řetězec imunoglobulinu (IgVH) (7–9). V souvislosti s objevem mutačního stavu IgVH byl popsán i význam exprese CD38, která je v současnosti považována za nezávislý prognostický faktor, nicméně hladina exprese se může významně měnit v čase (8, 10, 11). Původně jako náhrada za relativně obtížné stanovení mutačního stavu IgVH byl nalezen i další marker – tyrozinkináza ZAP-70 (12, 13). Ukázalo se, že se jedná o nezávislý silný prognostický faktor, avšak jeho stanovení je spojeno s určitými metodickými limitacemi. Analýza se nejčastěji provádí pomocí průtokové cytometrie (FCM), stále však přes velké úsilí chybí standardizovaný protokol a ani stabilita tohoto markeru v čase není zcela jistá (14–16).
Cílem naší studie bylo zaprvé zhodnotit prognostický význam vybraných biologických markerů; zadruhé validovat námi zvolenou FCM metodu měření ZAP-70 pomocí jiné relevantní metody a sledovat stabilitu exprese ZAP-70 v průběhu onemocnění.
Pacienti a metodika
Soubor pacientů
Do studie bylo po podepsání informovaného souhlasu schváleného místní etickou komisí zařazeno 73 pacientů (tab. 1), splňujících diagnostická kritéria pro CLL dle National Cancer Institute Working Group (17). Medián věku při diagnóze byl 59 let (31–79 let). Rozložení pacientů podle klinického stadia (Rai low-intermediate-high risk) bylo 52 %, 30 % a 18 %. Při diagnóze byly odebrány vzorky periferní krve od 32 pacientů (44 %) a celkem od 43 pacientů (59 %) byly vzorky získány před léčbou. Rovněž byly analyzovány vzorky periferní krve od 11 zdravých dárců.
Tab. 1. Charakteristika souboru pacientů. 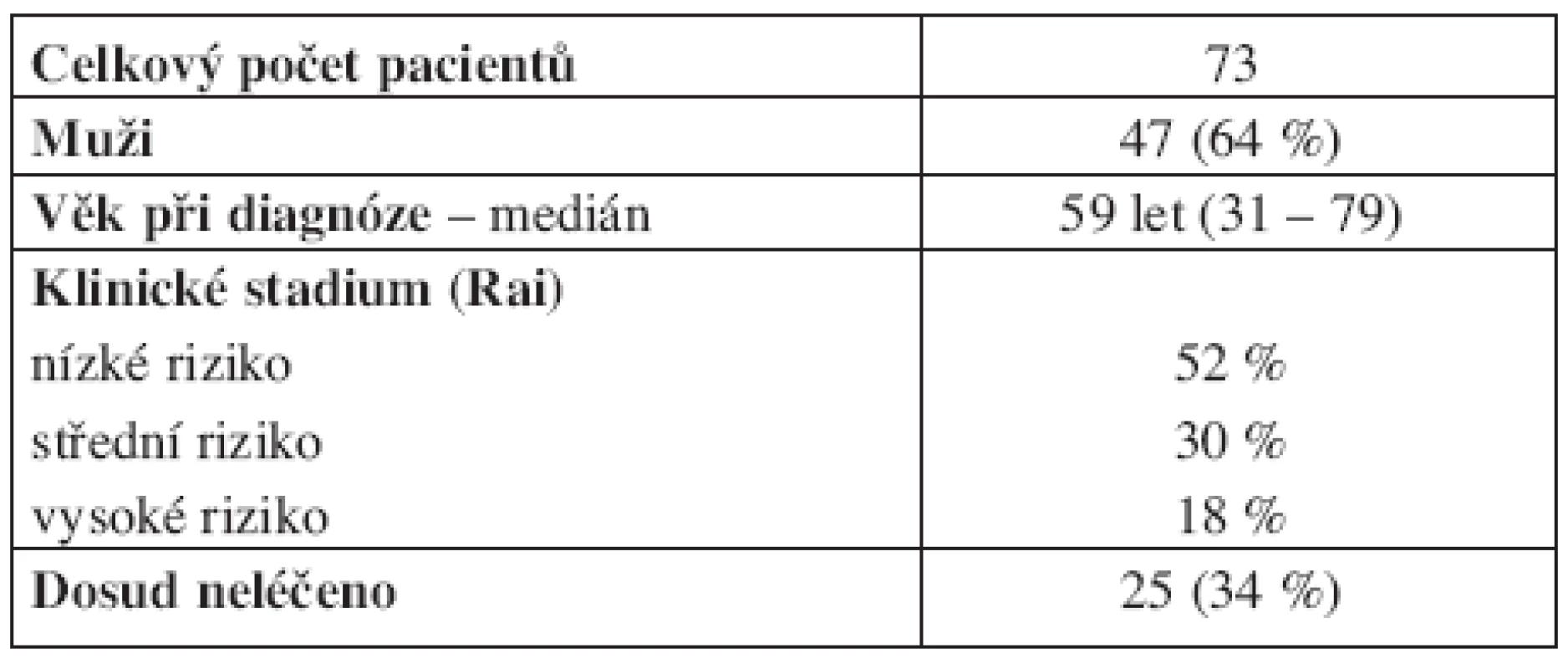
Průtoková cytometrie
Vzorky periferní krve v EDTA byly zpravidla zpracovány do 3 hodin po odběru (první vyšetření u daného pacienta vždy), nejpozději však během 24 hodin (v ojedinělých případech u následných odběrů); 50 μl plné krve obsahující přibližně 5 x 105 leukocytů bylo inkubováno s konjugovanými protilátkami proti CD3-PE, CD16-PE, CD56-PE (Beckman Coulter), CD5-APC, CD19-PerCP-Cy5.5 (BD Bioscience). Poté byl vzorek pomocí Fix & Perm kitu (Caltag) dle instrukcí výrobce intracelulárně značen protilátkou proti ZAP-70 Alexa Fluor 488 (klon 1E7.2, Caltag) a ihned měřen na průtokovém cytometru FACSCanto II (BD Bioscience). Denně byla kontrolována kvalita měření pomocí BD FACS 7-color setup beads (BD Biosciences). Aby byla zaručena validní vnitřní kontrola, bylo naměřeno minimálně 2,000 T-lymfocytů. Výsledky byly vyjadřovány jako poměr střední intenzity fluorescence (MFI) ZAP-70 na T-lymfocytech / CLL buňkách (obr. 1a,b). Vzorek byl označen jako pozitivní, pokud byl poměr < 4 (18, 19).
Obr. 1. a,b. Výstupy analýzy ZAP-70 pomocí FCM. Zobrazeny jsou grafy identifikující populace CLL buněk, T-lymfocytů, NK buněk a reziduální populace normálních B-lymfocytů dle příslušných povrchových antigenů. Poměr MFI T-lymfocytů/CLL buněk je 2,6, což znamená pozitivní expresi ZAP-70 (cut-off = 4). Oproti tomu reziduální populace zdravých B-lymfocytů je pro tento znak negativní (poměr TFI T-lymfocyty/ B-lymfocyty = 6, 7). 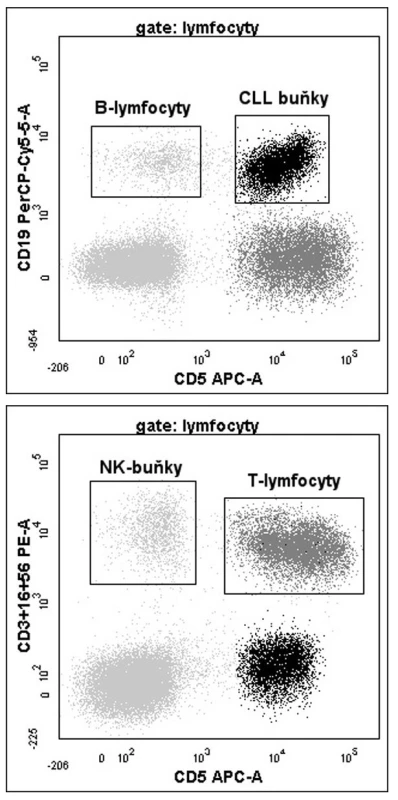
K hodnocení exprese CD38 na B-lymfocytech bylo použito povrchového značení (CD38-PE, BD Pharmingen) a exprese hodnocena jako pozitivní, pokud bylo více než 30 % B-lymfocytů pozitivních dle negativní kontroly isotypovou protilátkou.
Imunohistochemická detekce
K imunohistochemické detekci byly použity běžně zpracované a v parafínu zalité bioptické vzorky lymfatických uzlin a kostní dřeně. Monoklonální protilátka proti ZAP-70 (klon 2F3.2, Upstate) byla při ředění 1 : 400 inkubována 1 hodinu při pokojové teplotě. Detekce primární protilátky byla dle návodu výrobce provedena pomocí LSAB2 kitu (DakoCytomation), který obsahuje sekundární protilátku značenou biotinem a avidin-biotinový komplex s křenovou peroxidázou. Vzorek byl hodnocen jako ZAP-70 pozitivní, pokud se značilo více než 20 % nádorových buněk.
Analýza mRNA ZAP-70
Z periferní krve byly pomocí gradientové centrifugace (Histopaque, Sigma) izolovány mononukleární buňky. B-lymfocyty byly získány pozitivní selekcí navázáním CD19 protilátky pomocí EasySep kitu dle návodu výrobce (Stem Cell Technologies). Čistota každého vzorku byla ověřena na průtokovém cytometru a dosahovala minimálně 98 % CD19+ elementů. RNA byla izolována pomocí TRI Reagentu (Molecular Research Center).
Celková RNA byla reverzně transkribována pomocí Verso™ reverzní transkriptázy (AB-Gene, UK) při 42 °C po dobu 30 minut. Připravená cDNA byla použita jako templát pro kvantitativní Real-Time PCR. Jako kontrolní gen byl použit GAPDH. Reakční podmínky pro kvantifikaci ZAP-70 i GAPDH byly následující: hledaný i kontrolní gen byl amplifikován v tripletu; kalibrační křivka se 3 logaritmickými ředěními byla amplifikována v doubletu. Mastermix pro amplifikaci obou cílů se skládal z: 1 U ThermoStart DNA polymerase (AB-Gene, UK), 4 mM MgCl2, 1x PCR pufr, 200 μmol dNTPs, 200 nmol TaqMan hybridizační sondy, 500 nmol každého primeru. Teplotní profil reakce byl následující: 95 °C 8 min., s cyklováním 95 °C 20 s, 60 °C 30 s, 72 °C 30 s, a snímáním fluorescence v kanálu FAM při 60 °C.
Sekvence primerů a sond použitých v analýzách:
GAPDH forvard: atcttccaggagcgagatcc
GAPDH reverse: cttgaggctgttgtcatact
ZAP-70 forward: caacgcctcaggggctgctgctc
ZAP-70 reverse: gtccatgggcatcggccgcggtt
GAPDH sonda: FAM – atgctggcgctgagtacgtcgtgga – BHQ1
ZAP-70 sonda: FAM – cccagcccacccatccacgttgaccata – BHQ1
Relativní exprese ZAP-70 byla stanovena podle vztahu 2-∆∆Ct. Jako kontrolní vzorky byly použity CD19+ separáty zdravých dárců. Relativní exprese ZAP-70 u CLL pacientů 3x vyšší než relativní exprese ZAP-70 u zdravých dárců byla považována za pozitivní.
Mutační stav IgVH
Mutační stav IgVH byl stanoven jak detailně popsáno (20). Pomocí konsensních primerů pro amplifikaci 7 rodin imunoglobulinových genů byla amplifikována oblast IgVH přestavby. Klonální produkt byl purifikován a přímo sekvenován na kapilárním sekvenátoru ABI3130. Získaná sekvence byla srovnána s databází referenčních germinálních sekvencí, deponovaných na stránkách NCBI, a bylo určeno procento hypermutace.
Mutace p53
Mutační stav genu p53 byl analyzován technikou FASAY (21) a přímého sekvenování kódující sekvence (exon 4 – exon 9).
Statistická analýza
Statistické zpracování výsledků bylo provedeno v programu SPSS (ver. 16.0), asociace mezi proměnnými byla testována v kontingenčních tabulkách za použití Pearsonova chi-kvadrát testu, v případě malých počtů Fischerovým testem. Křivky časů od diagnózy do zahájení terapie byly konstruovány podle Kaplan-Maiera a pro porovnání použit log-rank test.
Výsledky
Jednotlivé rizikové faktory a vztah mezi nimi
Všichni zařazení pacienti byli vyšetřeni na přítomnost znaku ZAP-70 pomocí FCM, hodnoceno jako ZAP-70 pozitivní bylo 45 pacientů (61,6 %). Exprese znaku CD38 byla stanovena u 69 pacientů, jako pozitivní byla hodnocena u 18 (26,1 %) nemocných. Vyšetření mutačního stavu IgVH bylo provedeno u všech pacientů a 42 (57,5 %) bylo hodnoceno jako nemutovaných. Analýza mutace p53 byla provedena u 69 pacientů a funkčně významná mutace byla nalezena u 13 pacientů (18,8 %) (tab. 2).
Tab. 2. Analýza rizikových faktorů. 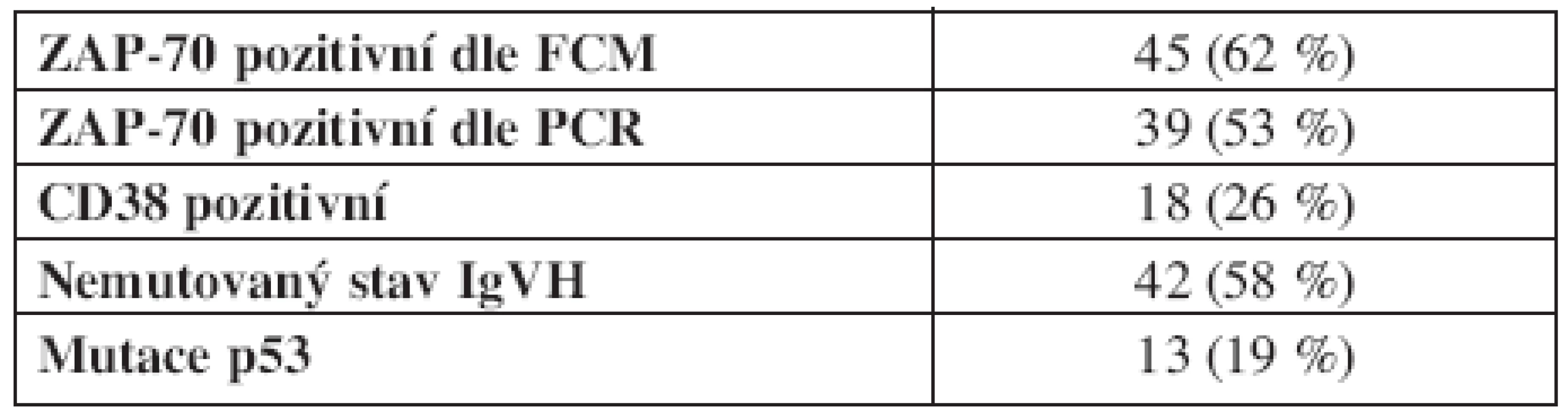
Shoda mezi expresí ZAP-70 a mutačním stavem IgVH byla 84,9 % (p < 0,001), přičemž 7 pacientů s pozitivním ZAP-70 mělo mutovaný stav IgVH a 4 nemocní s negativním ZAP-70 vykazovali nemutovaný stav IgVH.
Statisticky významně rovněž korelovala ZAP-70 pozitivita a CD38 pozitivita (p = 0,027). S vyšším klinickým stadiem dle Raie také rostl podíl ZAP-70 pozitivních pacientů (p = 0,01). Naproti tomu jsme nenašli signifikantní vztah mezi ZAP-70 pozitivitou a mutací p53 (p = 0,11), ani mezi mutačním stavem IgVH a expresí CD38 (p = 0,41), nebo mutačním stavem IgVH a mutací p53 (p = 0,154).
Asociace rizikových faktorů s časem do zahájení léčby
Nemocní byli léčeni na základě klinického stadia, přítomnosti symptomů a v případě aktivity choroby dle kritérií NCIWG. Při mediánu sledování 3,6 roku ze 73 pacientů léčbu zahájilo 48 (65,8 %) a celkem 9 (12,3 %) nemocných zemřelo. Hodnotili jsme vztah mezi jednotlivými rizikovými faktory a časem od diagnózy do zahájení terapie (Treatment Free Interval – TFI).
Exprese ZAP-70 dle FCM se ukázala statisticky významným prediktorem nutnosti zahájení léčby (obr. 2). Pacienti se ZAP-70 negativní CLL měli medián TFI 8,3 roků, zatímco při ZAP-70 pozitivitě to byl 1 rok (p < 0,001). Rovněž jsme prokázali, že nemocní s nemutovaným stavem IgVH měli signifikantně kratší TFI, kdy medián byl 1 rok, než skupina s mutovanou variantou IgVH s mediánem TFI 5,6 roku (p = 0,001) (obr. 3). Podobně i v případě mutace p53 byl shledán signifikantní rozdíl v TFI (p = 0,042) (obr. 4).
Obr. 2. Srovnání TFI: Exprese ZAP-70 dle FCM (p < 0,001). 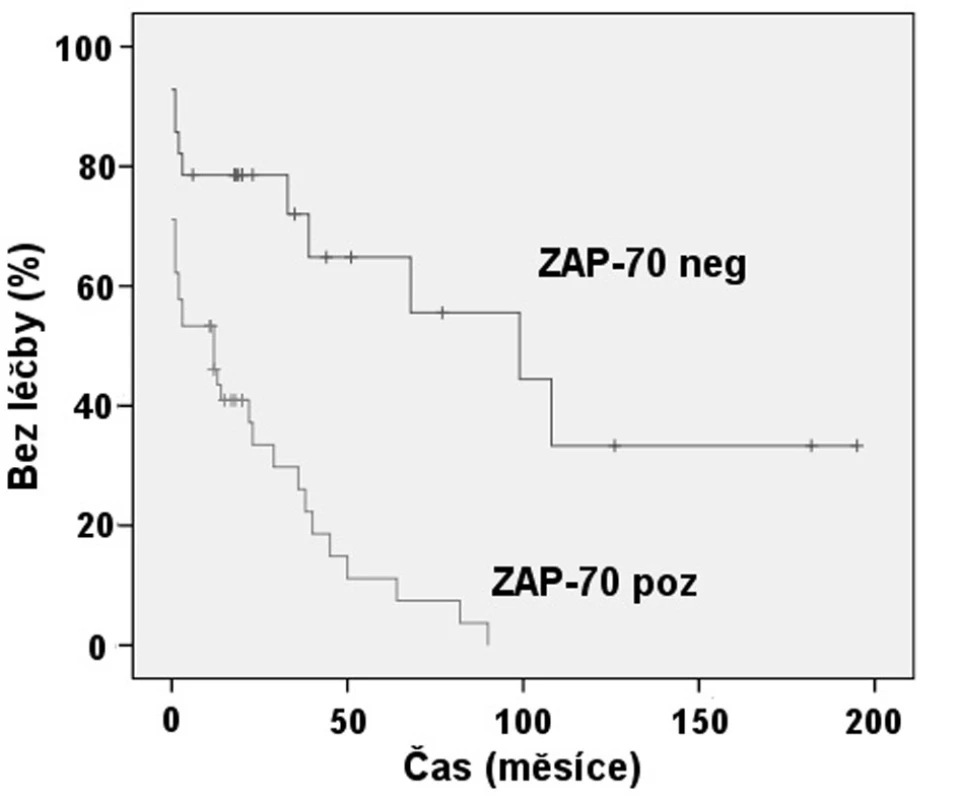
Obr. 3. Srovnání TFI: Mutační stav IgV<sub>H</sub> (p = 0,001). 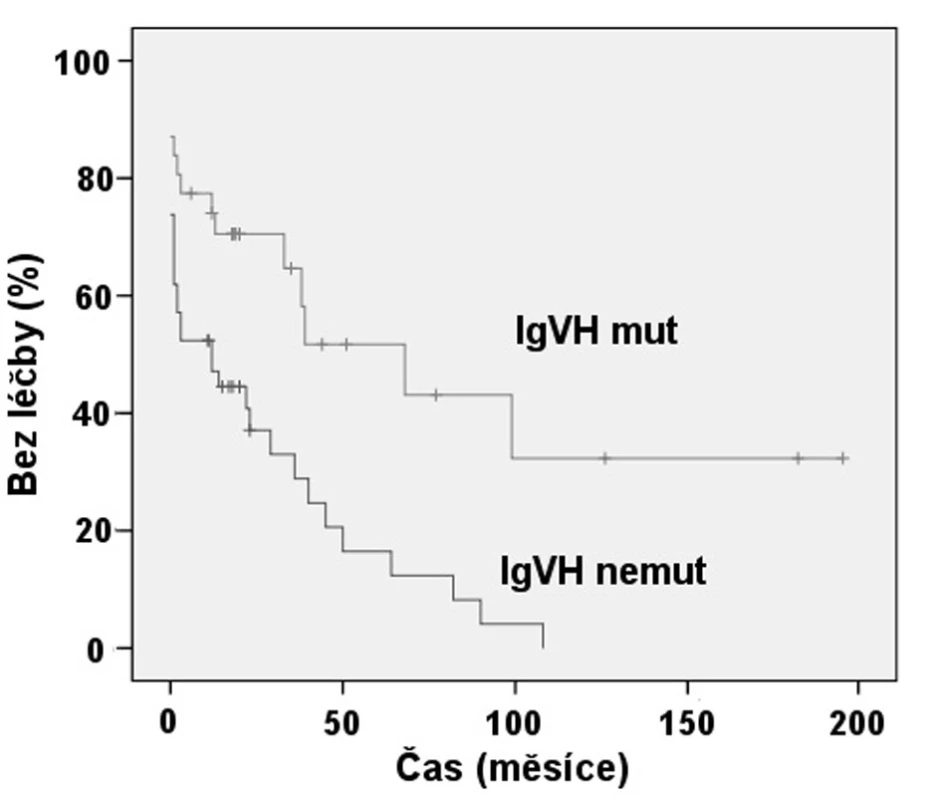
Obr. 4. Srovnání TFI: Mutace genu p53 (p = 0,042). 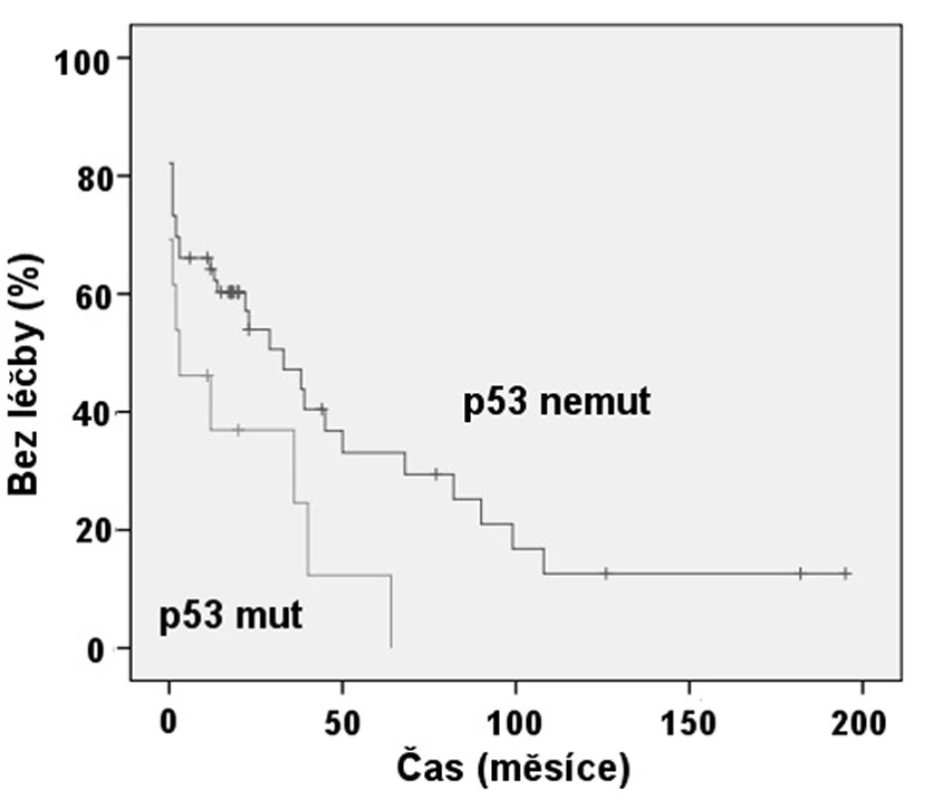
Naproti tomu při hodnocení významu exprese CD38 jsme nenalezli statisticky významný rozdíl v TFI mezi pacienty s CD38 pozitivními B-lymfocyty, kde byl medián TFI 1 rok a skupinou negativní pro tento znak s mediánem TFI 3 roky (p = 0,091) (obr. 5).
Obr. 5. Srovnání TFI: Exprese CD38 (p = 0,091). 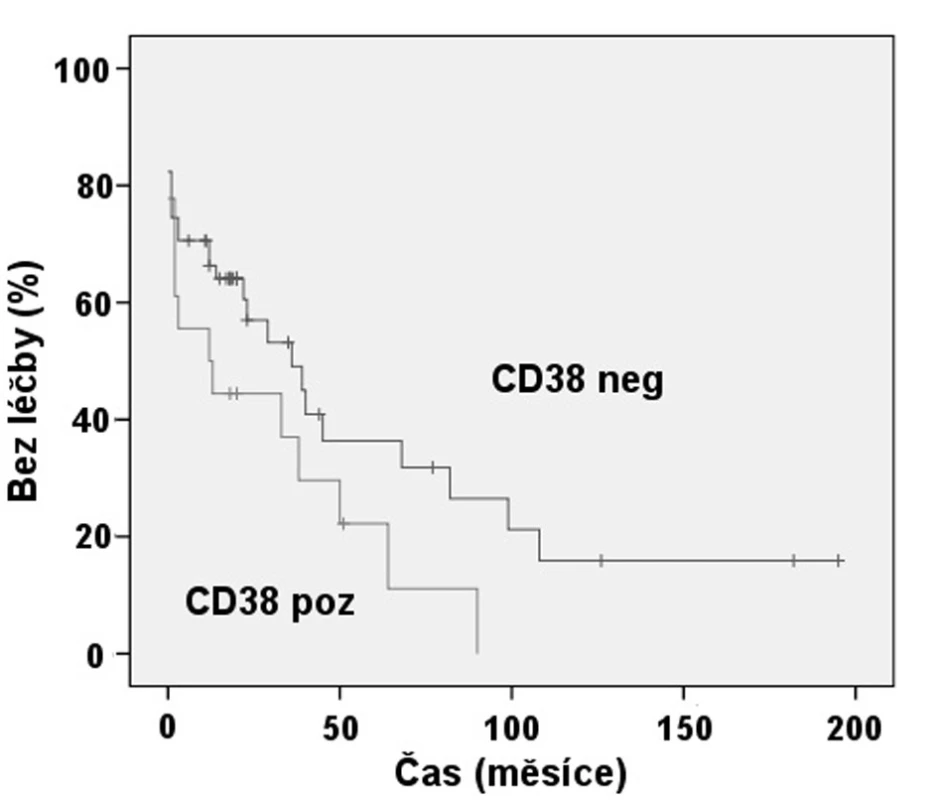
Validace ZAP-70 FCM
U všech pacientů byla zároveň se stanovením exprese proteinu ZAP-70 pomocí FCM analyzována i hladina ZAP-70 mRNA pomocí RT-PCR. Vzhledem ke zjištěné relativně rychlé degradaci mRNA ZAP-70 (data nezobrazena) byly z konečné analýzy vyloučeny vzorky zpracované později než 4 hod od odběru. Celková shoda mezi oběma metodami byla 86,3 % (p < 0,001), přičemž 8 pacientů s PCR negativitou bylo FCM pozitivních a 2 nemocní s PCR pozitivitou byli FCM negativní.
K ověření exprese ZAP-70 zjištěné pomocí FCM jinou metodou přímo na úrovni proteinu, bylo u 8 pacientů provedeno rovněž imunohistochemické vyšetření na histologických preparátech (8 vzorků kostní dřeně a 4 vzorky lymfatické uzliny). Výsledek vyšetření na lymfatické uzlině a v kostní dřeni se shodoval ve všech 4 případech. Shoda FCM a imunohistochemického vyšetření byla ve vzorcích 7 pacientů, přičemž 1 diskordantní byl imunohistochemicky v kostní dřeni negativní a dle FCM hraničně pozitivní.
Stabilita exprese ZAP-70
Ke zjištění stability exprese ZAP-70 v průběhu onemocnění byly opakovaně analyzovány vzorky periferní krve pomocí FCM. Celkem bylo vyšetřeno 200 vzorků, medián 3 vzorky na pacienta (rozptyl 1 – 7). Mezi prvním a posledním měřením uplynulo 12 měsíců (medián) a celkem 18 (24,7 %) pacientů absolvovalo mezi jednotlivými měřeními léčbu. Z celého souboru 73 pacientů byla zjištěna změna exprese ZAP-70 v čase pouze u 1 (1,4 %) nemocného, kde se původně negativní vzorky staly pozitivními, a to při progresi onemocnění (ověřeno i na úrovni ZAP-70 mRNA).
Diskuse
V posledních letech se významně zlepšily terapeutické možnosti u pacientů s CLL. Největším pokrokem bylo zejména zavedení léčebných strategií založených na purinových analozích a monoklonálních protilátkách. K odhadu prognózy se již desítky let používají stážovací systémy (Rai, Binet), které jsou založeny na fyzikálním vyšetření rozsahu lymfadenopatie, splenomegalie a hepatomegalie, a na stupni anémie a trombocytopenie v periferní krvi. Avšak již dlouho je známo, že tyto stážovací systémy nejsou s to dostatečně předpovědět prognózu konkrétního pacienta, a to především u mladých nemocných a v nízkých klinických stadiích. Proto bylo již identifikováno množství biologických rizikových faktorů, s cílem přesněji predikovat vývoj choroby (22). Podle aktuálních doporučení pro diagnózu a léčbu CLL se má stále rozhodnutí o léčbě řídit pouze klinickým stadiem, přítomností symptomů a aktivitou choroby (23). Nicméně již v současnosti probíhají klinické studie, které se snaží prokázat, že nemocní s CLL v nízkém klinickém stadiu, ale s přítomností biologických rizikových faktorů, mohou profitovat z časně zahájené léčby (např. studie CLL7 Německé studijní skupiny pro CLL).
V naší studii jsme ve shodě s publikovanými údaji prokázali významně kratší TFI u pacientů s CLL s pozitivní expresí ZAP-70, nemutovaným stavem IgVH a mutací p53. Oproti tomu v našem souboru pacientů nebyl shledán statisticky významný rozdíl v TFI mezi skupinou s CD38 pozitivními B-lymfocyty a skupinou bez pozitivní exprese CD38. To může být způsobeno nedostatečně velkým souborem pacientů, ale také tím, že část pacientů nebyla vyšetřena při diagnóze, ale až v průběhu nemoci, kdy může docházet ke změnám exprese CD38.
Tyrozinkináza ZAP-70 byla zprvu objevena jako možný surogát za časově i finančně náročné stanovení mutačního stavu IgVH (12, 13). Nyní je již však jisté, že analýza mutačního stavu IgVH nahrazena nebude, a to z několika důvodů. Jednak se jedná o metodu stále dostupnější v běžném provozu, dále korelace se ZAP-70 se ukázala v některých studiích jako nedostatečná (24), a v neposlední řadě se stanovení ZAP-70 potýká s určitými metodickými problémy. Tím hlavním je chybějící standardizovaný a jednotný protokol FCM měření, které je v praxi nejvíce používanou metodou. Mezi limitace patří v současnosti i větší počet komerčně dostupných protilátek proti ZAP-70, konjugovaných s různými fluorochromy, které však mohou dávat při stejném postupu velmi rozdílné výsledky (25–27). Jako zásadní se ale jeví volba strategie gatingu, pozitivní a negativní kontroly a určení hranice pro pozitivitu (28). Ačkoli byla již publikována celá řada prací s cílem optimalizovat metodu FCM analýzy a ujednotit postup i na mezinárodní úrovni (18), nezdá se ani v budoucnosti jako reálné implementování jednotné metody ZAP-70 FCM stanovení v jednotlivých cytometrických laboratořích. Z tohoto důvodu jsme v naší studii pomocí referenční metody kvantitativní RT-PCR i imunohistochemie ověřili vysokou validitu námi použité FCM analýzy, převzaté ze dvou velkých mezilaboratorních harmonizačních studií (18, 19).
Diskutovanou otázkou zůstává stabilita ZAP-70 exprese v průběhu onemocnění. Některé publikace poukázaly na nezanedbatelné procento pacientů se změnou exprese ZAP-70 (29, 30). V naší skupině pacientů byla při zvolené FCM metodě exprese ZAP-70 relativně stálá, a to i po podané léčbě, přičemž jsme zaznamenali pouze v jednom případě kvalitativní změnu (počáteční negativity v pozitivitu), a to jednoznačně v souvislosti s progresí onemocnění.
MUDr. Martin Špaček
Oddělení klinické hematologie
Fakultní nemocnice Královské Vinohrady
Šrobárova 50
100 34 Praha 10
m.spacek@fnkv.cz
Poděkování
Za laskavou spolupráci děkujeme laborantkám M. Hončíkové, P. Salačové a H. Šubrtové, a za statistické zpracování výsledků RNDr. B. Procházkovi, CSc.
Práce byla podpořena grantem GAUK 24107/2007.
Doručeno do redakce: 23. 2. 2009
Přijato do tisku: 23. 3. 2009
Zdroje
1. Rai KR, Sawitsky A, Cronkite EP, Chanana AD, Levy RN, Pasternack BS. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46 : 219–234.
2. Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48 : 198–204.
3. Montserrat E, Sanchez-Bisono J, Vinolas N, Rozman C. Lymphocyte doubling time in chronic lymphocytic leukaemia: analysis of its prognostic significance. Br J Haematol 1986; 62 : 567–575.
4. Rozman C, Montserrat E, Rodriguez-Fernandez JM, et al. Bone marrow histologic pattern – the best simple prognostic parameter in chronic lymphocytic leukemia: a multivariate survival analysis of 329 cases. Blood 1984; 64 : 642–648.
5. Sarfati M, Chevret S, Chastang C, et al. Prognostic importance of serum soluble CD23 level in chronic lymphocytic leukemia. Blood 1996; 88 : 4259–4264.
6. Hallek M, Langenmayer I, Nerl C, et al. Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, nonsmoldering chronic lymphocytic leukemia. Blood 1999; 93 : 1732–1737.
7. Döhner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343 : 1910–1916.
8. Damle RN, Wasil T, Fais F, et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94 : 1840–1847.
9. Hamblin TJ, Davis Z, Gardiner A, Oscier DG, Stevenson FK. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999; 94 : 1848.
10. Ibrahim S, Keating M, Do KA, et al. CD38 expression as an important prognostic factor in B cell chronic lymphocytic leukemia. Blood 2001; 98 : 181–186.
11. Hamblin TJ, Orchard JA, Ibbotson RE, et al. CD38 expression and immunoglobulin variable region mutations are independent prognostic variables in chronic lymphocytic leukemia, but CD38 expression may vary during the course of the disease. Blood 2002; 99 : 1023–1029.
12. Rosenwald A, Alizadeh AA, Widhopf G, et al. Relation of gene expression phenotype to immunoglobulin mutation genotype in B cell chronic lymphocytic leukemia. J Exp Med 2001; 194 : 1639–47.
13. Wiestner A, Rosenwald A, Barry TS, et al. ZAP-70 expression identifies a chronic lymphocytic leukemia subtype with unmutated immunoglobulin genes, inferior clinical outcome, and distinct gene expression profile. Blood 2003; 101 : 4944–4951.
14. Crespo M, Bosch F, Villamor N, et al. ZAP-70 expression as a surrogate for immunoglobulin-variable region mutations in chronic lymphocytic leukemia. N Engl J Med 2003; 348 : 1764–1775.
15. Orchard JA, Ibbotson RE, Davis Z, et al. ZAP-70 expression and prognosis in chronic lymphocytic leukemia. Lancet 2004; 363 : 105–111.
16. Rassenti LZ, Huynh L, Toy TL, et al. ZAP-70 compared with immunoglobulin heavychain gene mutation status as a predictor of disease progression in chronic lymphocytic leukemia. N Eng J Med 2004; 351 : 893–901.
17. Cheson BD, Bennett JM, Grever M, et al. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990–4997.
18. Letestu R, Rawstron A, Ghia P, et al. Evaluation of ZAP-70 expression by flow cytometry in chronic lymphocytic leukemia: A multicentric international harmonization process. Cytometry B Clin Cytom 2006; 70 : 309–314.
19. Le Garff-Tavernier M, Ticchioni M, Brissard M, et al. National standardization of ZAP-70 determination by flow cytometry: the French experience. Clin Cytom 2007; 72 : 103–108.
20. Peková S, Marková J, Pajer P, Dvořák M, Cetkovský P, Schwarz J. Touch-down reverse transcriptase-PCR detection of IgV(H) rearrangement and Sybr-Green-based real-time RT-PCR quantitation of minimal residual disease in patients with chronic lymphocytic leukemia. Mol Diagn 2005; 9 : 23–34.
21. Smardova J, Ksicova K, Binkova H, et al. Analysis of tumor suppressor p53 status in head and neck squamous cell carcinoma. Oncol Rep 2004; 11 : 923–929.
22. Moreno C, Montserrat E. New prognostic markers in chronic lymphocytic leukemia. Blood Rev 2008; 22 : 211–219.
23. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic leukemia updating the National Cancer Institute–Working Group 1996 guidelines. Blood 2008; 111 : 5446–5456.
24. Bosch F, Muntanola A, Giné E, et al. Clinical Implications of ZAP-70 Expression in Chronic Lymphocytic Leukemia. Cytometry B Clin Cytom 2006; 70 : 214–217.
25. Bakke AC, Purtzer Z, Leis J, Huang J. A Robust Ratio Metric Method for Analysis of Zap-70 Expression in Chronic Lymphocytic Leukemia (CLL). Cytometry B Clin Cytom 2006; 70B: 227–234.
26. Chen YH, Peterson LC, Dittmann D, et al. Comparative analysis of flow cytometric techniques in assessment of ZAP-70 expression in relation to IgVH mutational status in chronic lymphocytic leukemia. Am J Clin Pathol 2007; 127 : 182–191.
27. Preobrazhensky SN, Bahler DW. Optimization of flow cytometric measurement of ZAP-70 in chronic lymphocytic leukemia. Cytometry B Clin Cytom 2008; 74 : 118–127.
28. Smolej L, Saudková L, Špaček M, Kozák T. ZAP-70 u chronické B-lymfocytární leukemie: klinický význam a metody detekce. Vnitř Lék 2006; 52 : 1194–1199.
29. Poulain S, Benard C, Daudignon A, Le Baron F, Morel P, Duthilleul P. Is ZAP-70 expression stable over time in B chronic lymphocytic leukaemia? Leuk Lymphoma 2007; 48 : 1219–1221.
30. Smolej L, Vroblova V, Novosad J. Expression of ZAP-70 in patients with chronic lymphocytic leukemia may change significantly during the course of the disease. Int J Lab Hematol 2008; 30 : 259–260.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Oznámení
- Klonální evoluce u chronické lymfocytární leukemie
- Adaptorové molekuly PAG, NTAL a LAT ve fyziologických lymfocytárních prekurzorech a u dětských leukemií
- Novinky v terapii nízce rizikových nemocných s myelodysplastickým syndromem
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Za prim. Jindřiškou Maškovou
- Recenze
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Leukémie u dojčiat
- Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
- Rizikové faktory u chronické lymfocytární leukemie, validace flow-cytometrické detekce ZAP-70 pomocí RT-PCR a imunohistochemie
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Klonální evoluce u chronické lymfocytární leukemie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



