-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce cévních rekonstrukcí v aortoilické oblasti – náš pohled ve světle aktuálních doporučení Evropské společnosti cévní chirurgie − retrospektivní observační studie
Vascular graft infection in the aortoiliac territory – our view in the light of European Society for Vascular Surgery Guidelines − the retrospective observation study
Introduction: Vascular graft infection in the aortoiliac territory (abdominal VGI) is undoubtedly one of the most serious complications in vascular surgery. The treatment is burdened with high mortality and morbidity rates. In 2020, the Guidelines on the Management of Vascular Graft and Endograft Infections were published by the European Society for Vascular Surgery (ESVS). In the light of these guidelines, we decided to review retrospectively all patients who presented to our institution with abdominal VGI.
Methods: Retrospective observational study of patients presented with abdominal VGI treated in our institution between 2011−2019 (9 years). The primary goal was to elucidate the rate of vascular graft infection in aortoiliac reconstructions performed between 2011−2019 and also the mortality rate in the patient cohort operated for this complication. The secondary goals were to evaluate the success rate and the complication rate in different types of reconstructions.
Results: In the defined period between 2011−2019 we performed 363 open aortoiliac reconstructions. During the same period we treated altogether 15 patients with abdominal VGI, whose primary reconstruction was mostly performed before 2011 (11 patients). In our cohort of patients who underwent reconstruction between 2011−2019 we observed a graft infection only in 4 cases (1.1%). In the group of 15 patients with abdominal VGI, the male gender prevailed (14 patients). The mean age at the time of primary reconstruction was 61 years. Most of our reconstructions were performed for occlusive disease (14 cases). All infected grafts were aortobifemoral (1 unilateral aortofemoral). They were all late infections with an average presentation time of 61 months since the primary reconstruction (15−180 months). Early mortality rate was as high as 27% (4 patients) and overall mortality was 40%. The secondary reinfection rate after primary treatment was 33%.
Conclusion: Treatment of abdominal VGI is still burdened with high mortality and morbidity rates. The current ESVS guidelines provide valuable guidance for the diagnosis and management of VGI. It nevertheless remains obvious that the treatment needs to be tailored individually in a multidisciplinary team environment.
Keywords:
abdominal aorta – graft – infection
Autoři: L. Bláha; J. Bulejčík; D. Říha
Působiště autorů: Centrum cévní a miniinvazivní chirurgie, Komplexní kardiovaskulární centrum, Nemocnice AGEL Třinec-Podlesí, a. s
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 7, s. 330-338.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.7.330–338Souhrn
Úvod: Infekce cévních protéz v aortoilické oblasti (abdominální VGI) je jednou z nejzávažnějších komplikací v cévní chirurgii. Řešení je zatíženo vysokou mírou mortality a morbidity. V 2020 vydala the European Society for Vascular Surgery (ESVS) doporučení pro diagnostiku a terapii infekcí vaskulárních graftů a endograftů. I ve světle těchto doporučení jsme se rozhodli retrospektivně prozkoumat pacienty s abdominální VGI, které jsme řešili na našem pracovišti.
Metody: Retrospektivní observační studie pacientů s abdominální VGI, kteří byli řešeni na našem pracovišti v období 2011−2019 (za 9 let). Primárním cílem bylo určit procento infekcí cévních chirurgických rekonstrukcí v aortoilické oblasti provedených v období 2011−2019 a zhodnotit mortalitu u pacientů operovaných pro tuto komplikaci. Sekundárním cílem bylo zhodnotit úspěšnost a rizika různých typů výkonů.
Výsledky: V uvedeném období jsme provedli 363 chirurgických rekonstrukcí v aortoilické oblasti. Ve stejném období jsme řešili celkem 15 pacientů s abdominální VGI, z nichž byla primární aortální rekonstrukce většinou (11×) provedena před rokem 2011. U našeho souboru rekonstrukcí z let 2011−2019 byla abdominální VGI zaznamenána pouze ve 4 případech, tedy u 1,1 %. V souboru 15 řešených abdominálních VGI převažovali muži (14×). Průměrný věk v době původní rekonstrukce byl 61 let. Většinou šlo o ischemickou chorobu dolních končetin (14×). Vždy šlo o infekci aortobifemorálního (1× aortofemorálního) bypassu. Vždy šlo o pozdní infekci s průměrným intervalem 61 měsíců od původní rekonstrukce (15−180 měsíců). Časná mortalita v tomto souboru byla 27 % (4 pacienti). Celková mortalita byla 40 %. Po primárním řešení infekce jsme zaznamenali 33 % reinfekcí.
Závěr: Výsledky řešení infekce graftu v aortoilické oblasti jsou nadále zatíženy vysokou mortalitou a morbiditou. V řešení i diagnostice je užitečné postupovat podle aktuálních doporučení ESVS. Nicméně je zřejmé, že konečné řešení by mělo být individuálně určeno pro každého jednoho pacienta na základě multioborového přístupu.
Klíčová slova:
abdominální aorta – graft – infekce
Úvod
Infekce cévních protéz v aortoilické oblasti je jednou z nejzávažnějších komplikací v cévní chirurgii a chirurgii vůbec. Časná mortalita při řešení této komplikace se pohybuje od 16 až po 35 % při koincidenci AEnF (aortoenterické píštěle), riziko vysoké amputace po operaci je 3−18 %, riziko reinfekce 6−20 % [1,2]. ESVS (European Society for Vascular Surgery) v roce 2020 vydala komplexní doporučení managementu infekcí vaskulárních graftů a endograftů [3] na základě rozsáhlého výzkumu početného týmu specialistů a metaanalýz velkého množství studií. Doporučení se zabývají definicí, epidemiologií, patogenezí, diagnostikou a samozřejmě terapií těchto stavů. Podmnožinou infekcí cévních rekonstrukcí jsou abdominální VGEI (infekce graftů a endograftů v aortoilické oblasti). Udávaná incidence abdominální VGEI je v různých studiích různá. Pohybuje se od 0,2 % ve dvouletém sledování [4] až po 4,5 %, také zde ve dvouletém sledování [5].
My jsme se ohlédli za našimi postupy a výsledky při řešení abdominálních VGI (infekcí cévních protéz v aortoilické oblasti). Do souboru jsme nezahrnuli pacienty s implantovanými endografty v abdominální oblasti. Tuto reflexi jsme provedli právě na popud nedávno vydaných aktuálních doporučení ESVS. Naše sdělení jistě nemá ambici a nemůže postihnout celou tuto složitou problematiku do detailů, ale může snad přispět k další diskuzi o tomto tématu.
Metody
Jde o retrospektivní observační studii souboru pacientů s abdominální VGI řešených na našem pracovišti v období od 1. 1. 2011 do 31. 12. 2019 (tedy za 9 let).
Data jsme získali retrospektivně ze zdravotnické dokumentace pacientů, kteří byli a jsou léčeni a sledováni v našem Centru cévní a miniinvazivní chirurgie.
Primárním cílem bylo určit procento infekcí cévních chirurgických rekonstrukcí v aortoilické oblasti provedených v období 2011−2019. Dále zhodnotit mortalitu (zejména časnou) u pacientů operovaných pro tuto závažnou komplikaci.
Sekundárními cíli bylo zhodnotit úspěšnost a rizika různých typů výkonů a použitých materiálů při řešení těchto komplikací. Zjišťovali jsme také nejčastější mikroby, které způsobily tyto infekce.
Výsledky
V období od 1. 1. 2011 do 31. 12. 2019 jsme na našem pracovišti provedli 363 cévních chirurgických rekonstrukcí v aortoilické oblasti (aortoaortální, aortolilické či aortofemorální bypassy). Ve velké většině případů zde používáme pletené cévní protézy, v menší míře pak ePTFE (expandovaný polytetrafluoroethylen) nebo protézy impregnované stříbrem. Follow up tohoto souboru byl na konci roku 2019 1−108 měsíců. Pacienty pravidelně sledujeme v naší ambulanci jednou ročně.
V období 2011–2019 jsme diagnostikovali a následně komplexně řešili 15 pacientů s abdominální VGI. Primární aortální rekonstrukce u většiny z nich (11×) byla však provedena před rokem 2011 (na našem nebo jiném pracovišti). A pouze 4 infikované bypassy byly ze souboru 363 pacientů primárně operovaných na našem pracovišti v období 2011−2019, což činí 1,1 % abdominálních VGI. Pokud se však podíváme na níže uvedený průměrný interval od primární rekonstrukce do její infekce, tak se pravděpodobně v průběhu dalších měsíců a let ještě některé infekce z tohoto období objeví. Nyní zpět k souboru 15 pacientů s abdominální VGI. Většina z nich byli muži (14×). Průměrný věk v době původní rekonstrukce byl 61 let. Většinou šlo o pacienty s ICHDKK (ischemická choroba dolních končetin), a to ve 14 případech, oproti jednomu pacientovi, který byl původně řešen pro aneurysma abdominální aorty. Ve 14 případech šlo o infekci aortobifemorálního a 1× aortofemorálního bypassu. U aortoaortálních a aortoilických rekonstrukcí jsme infekci nezaznamenali. U dvou pacientů byl původní bypass proveden pro kritickou ischemii s defekty dolních končetin.
Ve všech případech šlo o pozdní infekci s průměrným intervalem 61 měsíců od původní rekonstrukce (15−180 měsíců). Nejčastějším projevem této infekce bylo infikované pseudoaneurysma v oblasti distální anastomózy, a sice u 11 pacientů (73 %).
Nejčastějším agens byl zlatý stafylokok, a to v 6 případech, stafylococcus hominis u 5 případů, MRSA a klebsiela pneumonie ve 3 případech, candida albicans u dvou případů. Další mikroby se objevily vždy u jednoho případu (E. coli, proteus, peptococcus či jiné).
Při chirurgické terapii abdominální VGI jsme využili širokou škálu možných řešení. Od kompletní explantace graftu s in situ nebo extraanatomickou rekonstrukcí (2× také včetně rekonstrukce duodena pro AEnF) až po parciální explantaci protézy s její částečnou náhradou. Použili jsme také různé materiály. Zejména žilní a stříbrné neografty. U jednoho pacienta jsme se k rekonstrukci nedostali, jelikož pro kritický stav byla provedena pouze resekce a podvaz krvácejícího raménka cévní protézy.
Časná mortalita v celém tomto souboru byla 27 % (4 pacienti). Další pacient zemřel při řešení reinfekce za 15 měsíců a další pacient 5 měsíců po operaci bez jasné souvislosti s naším výkonem (krvácení z urotraktu u polymorbidního pacienta). Celková mortalita tedy byla 40 %. U dalších dvou pacientů musela být v průběhu sledování provedena vysoká amputace dolní končetiny, ale to pro progresi ICHDKK, nikoliv pro reinfekci.
Po primárním řešení abdominální VGI jsme zaznamenali 33 % reinfekcí, které jsme museli opět chirurgicky řešit. Téměř vždy se reinfekce projevila až po řadě měsíců či let.
Všichni pacienti byli samozřejmě také adekvátně kryti a dlouhodobě léčeni cílenou antibiotickou terapií.
Zajímavé jsou však také výsledky léčby při různém rozsahu abdominální VGI a radikality řešení! A také dle použitého materiálu. Proto jsme soubor oněch 15 abdominálních VGI retrospektivně rozdělili na dvě podskupiny:
Podskupina s celkovou explantací aortofemorální rekonstrukce zahrnuje 8 pacientů:
V této podskupině jsme po kompletní explantaci protézy (Obr. 1) 4× implantovali žilní bifurkační neograft vytvořený z odebraných VFS, 3× jsme po explantaci implantovali stříbrnou protézu a 1× jsme po explantaci bypassu a rekonstrukci duodena provedli axilobifemorální bypass z ePTFE. U šesti pacientů této podskupiny jsme před výše uvedeným definitivním chirurgickým řešením nejprve provedli takzvanou „bridge“ rekonstrukci. Většinou resekci infikovaného a krvácejícího pseudoaneurysmatu v třísle a interpozit v oblasti distální anastomózy. Po přípravě pacienta a jeho došetření jsme pak provedli definitivní výkon. V této podskupině pacientů s kompletní explantací cévní protézy byla 3 časná úmrtí (38 %), a to u žilních neograftů. 1× pro krvácení z oblasti proximální anastomózy a 1× z anastomózy mezi žilními rameny jeden, resp. dva týdny po operaci, pravděpodobně pro pokračující agresivní infekci. Jeden pacient (s malignitou a závažnými komorbiditami) umřel pro celkově těžký pooperační stav s multiorgánovým selháním. U přeživších pacientů se až na jednoho (s žilním neograftem) projevila v průběhu měsíců až let reinfekce. Zajímavé je, že se reinfekce projevila u všech stříbrných protéz. A to i přesto, že šlo o málo virulentní stafylokoky (hominis, aureus) adekvátně léčené antibiotiky. U reinfekce těchto stříbrných protéz (3×) byla provedena jejich totální reexplantace a našit žilní bifurkační neograft z odebraných VFS (Obr. 2). U dvou pacientů úspěšně, jeden pacient zemřel 10 dní po operaci pro krvácení z proximální části neograftu při pokračující infekci. Pacient po axilobifemorálním bypassu, rovněž s pozdní reinfekcí, je již řadu let (8 let) opakovaně úspěšně řešen opakovanými parciálními explantacemi a rekonstrukcemi (Obr. 3). Celková, tedy časná i pozdní mortalita v této skupině je tedy 50 %.
Obr. 1. Explantovaná protéza ABF bypassu
Fig. 1: Explanted infected aortobifemoral prosthesis
Obr. 2. Autologní neograft pomocí hluboké femorálních žil
Fig. 2: Neoaortoiliac System (NAIS) procedure (VFS)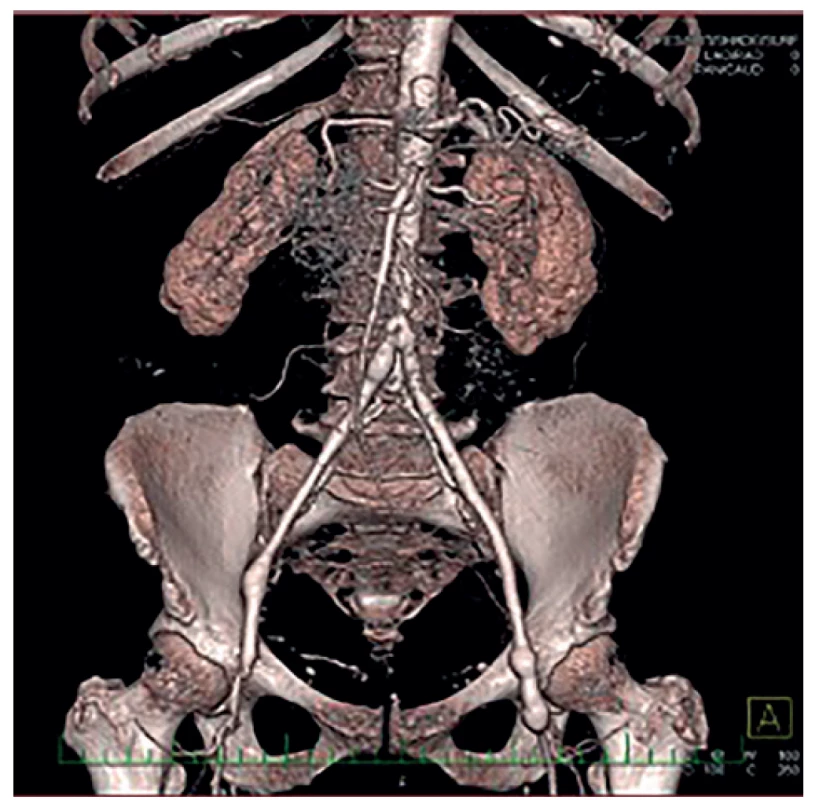
Obr. 3. Bilaterální axilofemorální bypass
Fig. 3: Bilateral axilofemoral bypass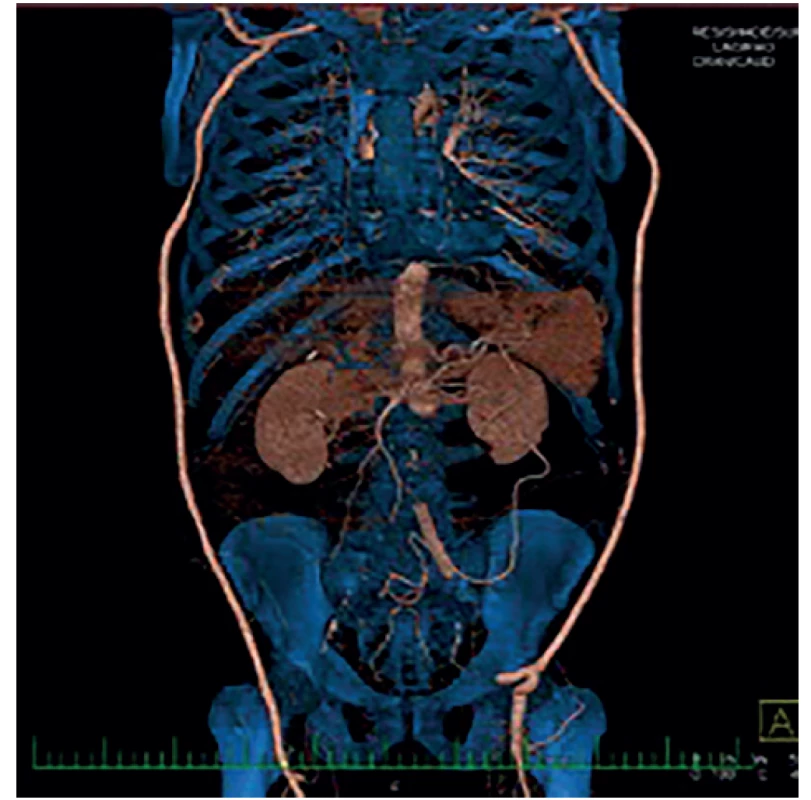
Podskupina s parciální explantací infikované části cévní protézy zahrnuje 7 pacientů:
U těchto pacientů nebyla nikdy zobrazovacími metodami diagnostikována kompletní infekce aortální rekonstrukce. Nedošlo ke kolekci tekutiny kolem celého graftu, na PET CT byla zánětlivá aktivita pouze v určitém místě protézy, a to zejména v oblasti distálních částí ramének a na distálních anastomózách. Také peroperačně bylo patrno dobré vhojení ramének bypassu suprainguinálně. Proto jsme si mohli dovolit provést parciální resekci infikované části bypassu a jeho náhradu buď interpozitem, nebo např. extraanatomickým femorofemorálním bypassem. Jako materiál jsme zde použili buď stříbrnou cévní protézu, nebo autologní žilní materiál.
V této podskupině parciálních explantací pooperačně umřel jeden pacient (14 %) na komplikace hemoragického šoku, u něhož jsme pro celkově kritický stav provedli pouze resekci a podvaz raménka (k rekonstrukci jsme se již nedostali). Jeden člověk zemřel za 5 měsíců bez jasné souvislosti s naším výkonem (krvácení z urotraktu u polymorbidního pacienta). Reinfekce se u této skupiny projevila pouze v jednom případě (17 %) u pacienta s autologní žilní náhradou parciálně resekované protézy, a to po 5 letech. U něj byla následně provedena totální explantace aortobifemorálního bypassu a úspěšně implantován nový stříbrný bifurkační graft, který je dosud bez reinfekce (již 5 let).
Přehledně jsou výsledky řešení abdominálních VGI znázorněny v diagramu (Schema 1).
Schema 1: Diagram řešení abdominální VGI v našem souboru
Diagram 1: Flowchart of abdominal VGI management in our patient cohort
Diskuze
Ve sledovaném období došlo k infekci 1,1 % aortálních náhrad provedených na našem pracovišti v letech 2011−2019. Časná mortalita v souboru patnácti řešených abdominálních VGI byla celkově 27 %. Vyšší byla v podskupině s nutností celkové explantace aortobifemorální protézy (38 %) než ve skupině, kde jsme explantovali pouze část graftu (14 %). Samozřejmě radikalita řešení závisela mimo jiné na rozsahu infekce. U pacientů, u nichž byla provedena při infekci totální explantace protézy a implantace stříbrného neograftu, se u všech projevila pozdní reinfekce s nutností reexplantace stříbrné protézy a implantace nového žilního neograftu. Na druhou stranu, stříbrná bifurkační protéza, kterou jsme použili k řešení reinfekce, již více než 5 let nevykazuje známky nové infekce.
Limitace této retrospektivní observační studie jsou zřejmé. Jednak jde o malý soubor (naštěstí!), takže z něj nelze dělat dalekosáhlé závěry. Dále je limitací, že jde o retrospektivní pohled, nikoliv o prospektivně sbíraná data. Také follow up primárních rekonstrukcí v oblasti abdominální aorty je zejména v posledních sledovaných letech krátký – follow up pro tento článek skončil koncem roku 2019 a pravděpodobně časem ještě k nějaké infekci dojde. Nelze také vyloučit urgentní řešení infekce naší původní rekonstrukce na jiném pracovišti. Nicméně je zajímavé srovnání výsledků a postupů právě s doporučeními ESVS.
Vraťme se nyní krátce k současným pohledům na tuto problematiku ve světle doporučení ESVS:
Patogeneze abdominálních VGEI je multifaktoriální. Časné infekce jsou nejčastěji způsobeny porušením aseptických kautel v perioperačním období nebo přítomností bakterií v trombu výdutě, dále pak protrahovanými, komplikovanými operacemi, reoperacemi, urgentními výkony, neodhaleným infekčním fokusem či imunosupresí pacienta při závažných komorbiditách. Pozdní infekce jsou většinou způsobeny hematogenním rozsevem při bakteriemii (stomatologické výkony, septické stavy) nebo např. při katetrizacích či operačních výkonech v blízkosti cévní protézy. Aortoenterická píštěl může být způsobena například mechanickou erozí střeva výdutí nebo anastomózou při nevhodném umístění právě anastomózy, cévního stehu či nevhodném tvaru protézy v místě anastomózy, porušením serózy střeva při operaci nebo střevní ischemií [3].
K efektivnější diagnostice abdominální VGEI vytvořila pracovní skupina MAGIC (Management of Aortic Graft Infection Collaboration) major a minor kritéria, která diagnostikují infekci protézy. Infekce protézy v aortální oblasti je suspektní v přítomnosti jednoho major kritéria nebo dvou minor kritérií a diagnóza je potvrzena v přítomnosti minimálně jednoho major kritéria a jakéhokoli dalšího kritéria [6] (Tab. 1).
Tab. 1. Klasifikace MAGIC (dle [6])
Tab. 1: The MAGIC Classification (addapted from [6])![Klasifikace MAGIC (dle [6]) <br>
Tab. 1: The MAGIC Classification (addapted from [6])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5a70f3ce3c8c06ca3bb803acdb10515d.png)
CT − computed tomography; FDG-PET/CT − 18F-fluoro-D-deoxyglucose positron emission tomography/computed tomography Klinické příznaky infekcí cévních náhrad kolísají od lehkých, jako jsou například zarudnutí v oblasti distální anastomózy v třísle, neprospívání, chronické subfebrilie, až po těžké příznaky, jako jsou sepse, krvácení a hypovolemický šok. Dalšími symptomy mohou být absces, septické embolizace, meléna, hematurie, ileus. Specifickými příznaky pro oblast abdominální aorty jsou bolesti břicha, horečka a leukocytóza, dále u řady pacientů je přítomný úbytek hmotnosti, únava a generalizovaná slabost. U AEnF pak nejčastěji meléna, následovaná sepsí a hemoragický šok. Jako první známka AEnF se často může objevit tzv. „herald bleeding“.
Mikrobiologické agens může být izolováno v 75−98 % případů abdominální VGEI. V 58 % jde o gram + bakterie (zlatý stafylokok, enterokok, koaguláza negativní stafylokok), ve 34 % gram − bakterie, v 8 % anaeroby. Vyšší virulence mikroorganismů je asociována se zvýšeným rizikem reinfekce po řešení VGEI [1,7]. Důležitá je rovněž technika přímých odběrů vzorků pro mikrobiologické vyšetření. Smysluplné výsledky má zejména odběr přímo z oblasti infikovaných tkání, zejména částí protetického materiálu, tkání z okolí infikovaného graftu nebo minimálně 3 vzorky tekuté kolekce z okolí protézy. Dále to mohou být odběry vzorků pod UZ nebo CT kontrolou z oblasti graftu. Nepřímo získané vzorky (např. z okrajů rány či drénovaných dutin) mohou být kontaminovány (např. kožní flórou) a nemusejí reflektovat infekční agens VGEI [8]. Preoperační hemokultury jsou pozitivní asi v 35 % a s perioperačními vzorky se pak shodují ve 22−30 % případů [7]. Důležité je jak kultivační, tak precizní mikroskopické vyšetření vzorků.
Ze zobrazovacích metod jsou nejčastěji v diagnostice VGEI využívány konvenční zobrazovací techniky jako ultrazvuk (UZ), CT, CT angiografie (CTA), MR angiografie (MRA). Dále pak 18F-FDG-PET/CT nebo WBCS/SPECT/CT.
Ultrazvuk může odhalit pseudoaneurysma, přítomnost plynu, anechogenní tekutinovou kolekci, což mohou být známky VGEI, stejně jako trombóza graftu, nebo může umožnit punkci bakteriologického vzorku. Nepřítomnost těchto UZ známek ale zcela nevyloučí VGEI. Také obezita či střevní náplň limitují využití UZ v aortální oblasti [9,10].
CT angiografie (CTA) je schopna odhalit charakteristické znaky abdominální VGEI, jako jsou ektopický plyn, tekutina, pseudoaneurysma, zesílení střevní stěny či okolních měkkých tkání nebo únik kontrastu z aorty do střev. Tyto známky zvyšují pravděpodobnost přítomnosti abdominální VGEI. Samotná CTA však není dostatečná pro stanovení diagnóz abdominální VGEI – senzitivita je 67 %, specificita 63 %. CTA však může potvrdit diagnózu abdominální VGEI [9,11]. CTA je doporučována jako zásadní zobrazovací metoda při diagnostice abdominální VGEI [11].
MRA – udává se senzitivita 68 % a specificita dokonce 97 %. Ale vzhledem k nižší dostupnosti MRA a délce vyšetření (pohybové artefakty) se příliš v diagnostice VGI nevyužívá [10].
Pozitronová emisní tomografie v kombinaci s CT (18F-FDG-PET/CT) – má udávanou senzitivitu 95 % a specificitu 80 % při abdominální VGEI [11]. Nicméně záleží na správném provedení a zhodnocení tohoto vyšetření.
Scintigrafie značenými leukocyty v kombinaci se SPECT/CT (WBCS/SPECT/CT) má udávanou senzitivitu 99 % a specificitu 82 % při abdominální VGEI. Je to časově náročné a pracné vyšetření a musí být provedeno ve dvou dobách. Vzhledem k těmto limitacím a horší dostupnosti jde až o nástavbové vyšetření podobně jako PET/CT [11].
Jaké jsou možnosti prevence abdominální VGEI? In vivo nebyl zaznamenán signifikantní rozdíl v náchylnosti k infekci mezi pletenými a ePTFE grafty a nebyl zaznamenán ani rozdíl v adherenci bakterií mezi pletenými a ePTFE protézami [12]. V perioperační péči se nejvíce na snížení rizika abdominální VGEI podílejí perioperační normotermie a disciplína v dodržování asepse na operačním sále [13]. Antibiotická intravenózní profylaxe širokospektrými ATB signifikantně redukuje riziko ranné infekce a časné infekce cévní protézy. Profylaxe delší než 24 hodin nepřinesla žádný další benefit. Jako profylaktická ATB se doporučují cefalosporiny 1. nebo 2. generace prvních 24 hodin nebo Vankomycin při alergii na cefalosporiny. Profylaxe je nejefektivnější, pokud je podána před první operační incizí (do 30 min. před incizí) a perioperační další dávka v závislosti na biologickém poločasu antibiotika [14]. Monofilamentní absorbovatelný steh kůže může přinést snížení rizika VGI [15]. Před implantací cévní protézy či endograftu je nutné eliminovat potenciální zdroje sepse, zejména zubního původu. U pacientů po implantací graftu (endograftu) je doporučeno ATB krytí při invazivních stomatologických výkonech [16].
Zajímavou možností může být také tzv. screeningové bakteriologické vyšetření kožních stěrů z oblasti třísel k bezprostřednímu vyloučení kožní kontaminace závažnými patogeny před operací (např. MRSA, Klebsiela, ESBL kmeny) s možností cílenější ATB profylaxe nebo odložení operace.
Antimikrobiální terapie má být nejprve širokospektrá, poté dle citlivosti agens a podle rozsahu chirurgického zásahu se pohybuje od 2 týdnů (např. při výměně protézy za žilní neograft a nízké virulenci agens) až po doživotní ATB terapii u pacientů, kteří nejsou schopni podstoupit rizikovou a komplikovanou explantaci infikované protézy. ATB terapie je však indikována u všech pacientů s abdominální VGEI [17].
Terapie abdominálních VGEI by měla být směrována do specializovaných cévních center (high volume centers) s multidisciplinární zkušeností s abdominální VGEI [3].
Historicky byly základními principy chirurgického řešení abdominální VGI odstranění infikované protézy, debridement tkání a výplach antiseptikem následované extraanatomickou rekonstrukcí, nejlépe ve dvou etapách. Tato možnost však není vždy možná a snadno proveditelná. Nyní většina autorů preferuje in situ rekonstrukce (ISR) materiály rezistentními k infekci spolu s agresivním debridementem a ATB cílenou terapií. V abdominální oblasti by měly být anastomózy kryty viabilními tkáněmi (např. omentum, fascie). Pokud nejsou, pak bovinní perikardiální záplatou [18]. Pokud je infekce i v třísle, pak anastomózu krýt muskulárním flapem.
Konzervativní chirurgická terapie jako drenáž a laváž může být pouze přípravou na definitivní chirurgické řešení v další etapě nebo paliativní terapie u pacienta, který není schopen většího chirurgického výkonu. V terénu abdominální VGEI však téměř nikdy není z dlouhodobého hlediska možná a její komplikace jako krvácení a sepse jsou téměř vždy smrtící [19].
In situ rekonstrukce zahrnují odstranění infikovaného materiálu s následnou rekonstrukcí v infikovaném poli. Může být provedena autologními žilami, kryoprezervovanými (nebo čerstvými) tepennými allografty, rifampicinem napuštěnými protézami nebo protézami krytými stříbrem či xenogenními grafty. Operační technika je náročná a její popis přesahuje možnosti tohoto článku.
Rekonstrukce autologní žilou jsou většinou vytvořené z VFS (vena femoralis superficialis) [20]. Výhodou je nízké riziko reinfekce 2 %, nízké riziko trombózy. Nevýhodou je obtížnost a časová náročnost odběru štěpu zejména v emergentním režimu [21,22]. Vhodná u vysoce virulentních patogenů, naopak u multirezistentních mikrobů a u AEnF je použití žíly sporné [21,23].
Kryoprezervované allografty mají nízké riziko reinfekce 9 %, riziko degenerace graftu až 22 %. Riziko reintervence je až 55 % během 5 let [24]. Lze také zvažovat možnost použití čerstvých tepenných allograftů v řešení abdominální VGI [25].
Rifampicinem napuštěné protézy mají dobré výsledky u málo virulentních patogenů a infekcí nižší závažnosti (zlatý stafylokok nebo koaguláza negativní stafylokoky). Riziko reinfekce je 11,5 %, nízké je i riziko amputace [1,23,26]. Výhodou je také jejich dostupnost a rychlá použitelnost při emergentních výkonech.
Protézy se stříbrem mají riziko reinfekce do 2,5 let 11 %, relativně nízké riziko amputace a vysokou míru dlouhodobé průchodnosti [27].
Použití „rifampicinových“ a stříbrných protéz v řešení abdominálních VGEI je pro mnohé cévní chirurgy kontroverzní, nicméně ESVS ve své zprávě možnost jejich využití za určitých podmínek nevylučuje.
Xenografty mají zatím nejasné výsledky, chybějí větší soubory. Jsou nutné další studie a follow up.
Extraanatomické rekonstrukce (většinou axilobifemorální) – nevýhodou je nízká míra dlouhodobé průchodnosti (64−74 % v 5 letech) a vysoké riziko amputace (až 11 % v 5 letech). Riziko ruptury pahýlu aorty do 27 %. Riziko reinfekce do 0−15 % [23,28]. Třicetidenní mortalita 18 %, pozdní mortalita 32 % do 47 měsíců [2,28]. Výhodnější je provést výkon ve dvou etapách – nejprve 1−5 dní před explantací protézy provést axilobifemorální bypass [28]. Tento postup redukuje mortalitu a počet amputací.
Venózní náhrady by měly být preferovány u mladších pacientů s dlouhou životní expektancí a také u virulentnějších kmenů. Rifampicinové a stříbrné protézy mohou být efektivní spíše u málo virulentních infekcí. U velkých periprotetických abscesů a MRSA infekcí může být zvažována extraanatomická rekonstrukce [1,29,30].
Zajímavou možností může být explantace cévní protézy a rekonstrukce původního arteriálního řečiště bez použití nového protetického materiálu. Příkladem může být autologní žilní záplata na aortu a endovaskulární rekanalizace pánevních tepen. Tuto eventualitu je možno zvažovat ve výjimečných situacích [25].
Pokud je infekce limitována na tříslo a suprainguinální část bypassu je dobře vhojena, pak můžeme za jistých okolností zvažovat parciální resekci infikované části protézy a in situ nebo extraanatomickou rekonstrukci. Zejména u nízko virulentních agens, monomikrobiální flóře s dobrou citlivostí na ATB. Naopak u polymikrobiálních nálezů, mykózních či gramnegativních infekcí je doporučována totální explantace cévní protézy [27].
Uveďme některé specifické momenty u abdominální VGEI s AEnF. Přítomnost aortoenterické píštěle je jedním z nejzávažnějších faktorů, které zhoršují celkovou prognózu pacienta. Při krvácení z AEnF (stejně jako při krvácení abdominální VGEI bez AEnF) by mělo být zváženo emergentní zavedení stentgraftu jako „bridge“ techniky do místa krvácení do doby chirurgické explantace [31,32]. Pokud se urgentně řeší tato situace přímo chirurgicky novou cévní protézou, pak je udávaná mortalita 35 % [33]. Systematické studie preferují při řešení abdominální VGEI s AEnF axilobifemorální bypass s následným odstraněním graftu či endograftu ve druhé etapě [34]. Duodenum může být přímo suturováno nebo musí být provedena komplexní duodenální rekonstrukce (například resekční výkony na duodenu s duodenojejunální anastomózou nebo dokonce Whippleova operace) ve spolupráci s břišním chirurgem.
Těžko lze postihnout všechny aspekty, které hrají roli v řešení abdominální VGI. Jde o rozsah infekce cévní protézy, typ rekonstrukce, přítomnost či nepřítomnost AEnF, urgentnost výkonu, stáří a celkový stav pacienta, přítomnost sepse, druh mikrobiálního agens, typ zvoleného materiálu pro neograft a další. Příběh každého pacienta je jiný a těžko lze najít dva pacienty se stejným průběhem onemocnění, diagnostiky a řešení. Zcela na místě je individuální, komplexní a multioborový přístup k pacientovi. Různí pacienti mohou pravděpodobně profitovat z různých přístupů k řešení infekce a někdy je skutečně na místě, pokusit se o konzervativnější přístup (parciální resekce) tam, kde to rozsah infekce umožňuje. Vyšší riziko infekce mají aortobifemorální bypassy oproti aortoaortálním a aortoilickým náhradám. Do pozornosti dávám četnost reinfekce stříbrných protéz v našem souboru oproti výsledkům publikovaným v ESVS doporučeních. Vyšší riziko mortality mají stavy s nutností kompletní explantace cévní protézy a implantace neograftu.
Závěr
Infekce cévních rekonstrukcí v oblasti abdominální aorty je velmi závažnou komplikací s vysokým rizikem život ohrožujících komplikací při řešení tohoto stavu. Obtížná bývá často již diagnostika, která musí být komplexní, aby pojala všechny aspekty pacientova stavu. V řešení i diagnostice je velmi užitečné postupovat podle aktuálních doporučení ESVS. Nicméně je zřejmé, že konečné řešení by mělo být individuálně určeno pro každého jednoho pacienta na základě multioborového přístupu. I tak jsou výsledky řešení těchto komplikací zatíženy vysokou mortalitou a morbiditou. Proto je třeba dodržovat zásady prevence a profylaxe těchto infekčních komplikací již při primární rekonstrukci.
Seznam zkratek:
Abdominální VGEI − infekce graftů a endograftů v aortoilické oblasti
Abdominální VGI − infekce cévních protéz v aortoilické oblasti
AEnF − aortoenterická píštěl
CTA − CT angiografie
ePTFE − expandovaný polytetrafluoroethylen
ESVS − European Society for Vascular Surgery
ICHDKK − ischemická choroba dolních končetin
ISR − in situ rekonstrukce
MRA − magnetická rezonance a angiografie
UZ − ultrazvuk
VFS − vena femoralis superficialis
Za spolupráci na tomto sdělení děkuji celému kolektivu Centra cévní a miniinvazivní chirurgie.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
prim. MUDr. Lubomír Blaha, MBA
Centrum cévní a miniinvazivní chirurgie
Nemocnice AGEL Třinec-Podlesí, a. s.
Konská 453
739 61 Třinec
e-mail: lubomir.blaha@npo.agel.cz
Zdroje
- Batt M, Feugier P, Camou F, et al. A meta-analysis of outcomes after in situ reconstructions for aortic graft infection. Angiology 2018 May;69(5):370−379. doi: 10.1177/0003319717710114. Epub 2017 Jun 5. PMID: 28578619.
- Batt M, Jean-Baptiste E, O´Connor S, et al. Contemporary management of infrarenal aortic graft infection: early and later results in 82 patients. Vascular 2012 Jun;20(3):129−137. doi: 10.1258/vasc.2011.oa0315. Epub 2012 Jun 1. PMID: 22661612.
- Chakfé N, Diener H, Lejay A. European Society for Vascular Surgery 2020. Clinical practise guidelines on the management of vascular graft nad endograft infection. Eur J Vasc Endovasc Surg. 2020 Mar;59(3):339−384. doi: 10.1016/j.ejvs.2019.10.016.
- Vogel TR, Symons R, Flulm DR. The incidence and factors associated with graft infection after aortic aneurysm repair. J Vasc Surg. 2008 Feb;47(2):264−269. doi: 10.1016/j.jvs.2007.10.030. PMID: 18241747.
- Berger P, De Borst GJ, Moll Fl. Current opinions about diagnosis and treatment strategy for aortic graft infections in The Netherlands. J Cardiovasc Surg. (Torino) 2015 Dec;56(6):867−876. Epub 2013 Nov 27. PMID: 24284939.
- Lyons OT, Baguneid M, Barwick TD, et al. Diagnosis of aortic graft infection: A case definition by the Management of Aortic Graft Infection Collaboration (MAGIC). Eur J Vasc Endovasc Surg. 2016 Dec;52(6):758−763. doi: 10.1016/j.ejvs.2016.09.007. Epub 2016 Oct 19. PMID: 27771318.
- Erb S, Sidler JA, Elzi L, et al. Surgical and antimicrobial treatment of prosthetic vascular graft infections and different surgical sites: a retrospective study of treatment outcomes. PLoS One 2014 Nov 13;9(11):e112947. doi: 10.1371/journal.pone.0112947. PMID: 25393400; PMCID: PMC4231097.
- FitzGerald SF, Kelly C, Humphreys H. Diagnosis and treatment of prosthetic aortic graft infections: confusion and inconsistency in the absence of evidence or consensus. J Antimicrob Chemother. 2005 Dec;56(6):996−999. doi: 10.1093/jac/dki382. Epub 2005 Nov 3. PMID: 16269550.
- Orton DF, LeVeen RF, Saigh JA, et al. Aortic prosthetic graft infections: radiologic manifestations and implications for management. RadioGraphics 2000;20(4). doi.org/10.1148/radiographics.20.4.g00jl12977.
- Spartera C, Morettini G, Petrassi C, et al. Role of magnetic resonance imaging in the evaluation of aortic graft healing, perigraft fluid collection, and graft infection. Eur J Vasc Surg. 1990 Feb;4(1):69−73. doi: 10.1016/s0950-821x(05)80041-6. PMID: 2323422.
- Reinders Folmer EI, Von Meijenfeldt GCI, van der Laan MJ, et al. Diagnosis imaging in vascular graft infection: a systematic review and meta-analysis. Eur J Vasc Endovasc Surg. 2018 Nov;56(5):719−729. doi: 10.1016/j.ejvs.2018.07.010. Epub 2018 Aug 16. PMID: 30122333.
- Rosenman JE, Pearce WH, Kempczinski RF. Bacterial adherence to vascular grafts after in vitro bacteremia. J Surg Res. 1985 Jun;38(6):648−655. doi: 10.1016/0022-4804(85)90088-5. PMID: 3159936.
- van der Slegt J, van der Laan L, Veen EJ, et al. Implementation of a bundle of care to reduce surgical site infections in patients undergoing vascular surgery. PLoS One 2013 Aug 13;8(8):e71566. doi: 10.1371/journal.pone.0071566. PMID: 23967222; PMCID: PMC3742500.
- Stewart AH, Eyers PS, Earnshaw JJ. Prevention of infection in peripheral arterial reconstruction: a systematic review and meta-analysis. J Vasc Surg. 2007 Jul;46(1):148−155. doi: 10.1016/j.jvs.2007.02.065. PMID: 17606135.
- Parizh D, Ascher E, Raza Rizvi SA, et al. Quality improvement initiative: Preventative Surgical Site Infection Protocol in Vascular Surgery. Vascular 2018 Feb;26(1):47−53. doi: 10.1177/1708538117719155. Epub 2017 Jul 14. PMID: 28708024.
- Habib G, Lacellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis. Eur Heart J. 2015 Nov 21;36(44):3075−3128. doi: 10.1093/eurheartj/ehv319. Epub 2015 Aug 29. PMID: 26320109.
- Revest M, Camou F, Senneville E, et al. Medical treatment of prosthetic vascular graft infections: review of the literature and proposals of a working group. Int J Antimicrob Agents 2015 Sep;46(3):254−265. doi: 10.1016/j.ijantimicag.2015.04.014. Epub 2015 Jun 6. PMID: 26163735.
- Jamieson RW, Burns PJ, Dawson AR, et al. Aortic graft preservation by debridement and omental wrapping. Ann Vasc Surg. 2012 Apr;26(3):423.e1−4. doi: 10.1016/j.avsg.2011.07.021. Epub 2012 Feb 8. PMID: 22321485.
- Sharif MA, Lee B, Lau LL, et al. Prosthetic stent graft infection after endovascular abdominal aortic aneurysm repair. J Vasc Surg. 2007 Sep;46(3):442−448. doi: 10.1016/j.jvs.2007.05.027. PMID: 17826231.
- Staffa R, Kříž Z, Vlachovský R, et al. Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy. Rozhl Chir. 2010 Jan;89(1):39−44. PMID: 21351403.
- Dorweiler B, Neufang A, Chaban R, et al. Use and durability of femoral vein for autologous reconstruction with infection of the aortoiliofemoral axis. J Vasc Surg. 2014 Mar;59(3):675−683. doi: 10.1016/j.jvs.2013.09.029. Epub 2013 Dec 15. PMID: 24342063.
- Heinola I, Kantonen I, Jaroma M, et al. Editor´s choice – treatment of aortic prosthesis infections by graft removal and in situ replacement with autologous femoral veins and fascial strengthening. Eur J Endovasc Surg. 2016;51 : 232−239. doi.org/10.1016/j.ejvs.2015.09.015.
- Oderich GS, Bower TC, Cherry KJ, Jr, et al. Evolution from axillofemoral to in situ prosthetic reconstruction for the treatment of aortic graft infections at a single center. J Vasc Surg. 2006 Jun;43(6):1166−1174. doi: 10.1016/j.jvs.2006.02.040. PMID: 16765233.
- Lejay A, Delax C, Girsowicz E, et al. Cryopreserved cadaveric arterial allograft for arterial reconstruction in patients with prosthetic infection. Eur J Vasc Endovasc Surg. 2017 Nov;54(5):636−644. doi: 10.1016/j.ejvs.2017.07.016. Epub 2017 Sep 7. PMID: 28890027.
- Šebesta P, Štádler P, Šedivý P, et al. Radikální operace infekce cévní protézy v aortofemorální pozici pomocí čerstvého tepenního alograftu: naše střednědobé zkušenosti. Rozhl Chir. 2011, Jan;90(1):4−13. ISSN 0035-9351.
- Young RM, Cherry Jr KJ, Davis PM, et al. The results of in situ prosthetic replacement for infected aortic grafts. Am J Surg. 1999 Aug;178(2):136−140. doi: 10.1016/s0002-9610(99)00146-4. PMID: 10487266.
- Mirzaie M, Schmitto JD, Tirilomis T, et al. Surgical management of vascular graft infection in severely ill patients by partial resection of the infected prosthesis. Eur J Vasc Endovasc Surg. 2007 May;33(5):610−613. doi: 10.1016/j.ejvs.2006.11.042. Epub 2007 Feb 2. PMID: 17276101.
- Seeger JM, Pretus HA, Welborn MB, et al. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. J Vasc Surg. 2000 Sep;32(3):451−459; discussion 460−461. doi: 10.1067/mva.2000.109471. PMID: 10957651.
- Bíró G, Szabó G, Fehérvári M, et al. Late outcome following open surgical management of secondary aortoenteric fistula. Langenbecks Arch Surg. 2011 Dec;396(8):1221−1229. doi: 10.1007/s00423-011-0807-6. Epub 2011 May 21. PMID: 21604007.
- O´Connor S, Andrew P, Batt M, et al. A systematic review and meta-analysis of treatments for aortic graft infection. J Vasc Surg. 2006 Jul;44(1):38−45. doi: 10.1016/j.jvs.2006.02.053. PMID: 16828424.
- Chick JFB, Castle JC, Cooper KJ, et al. Aortoenteric fistulae temporization and treatment: lessons learned from a multidisciplinary approach to 3 patients. Radiol Case Rep. 2017 Apr 12;12(2):331−334. doi: 10.1016/j.radcr.2017.03.008. PMID: 28491182; PMCID: PMC5417752.
- Batt M, Jean-Baptiste E, O´Connor S, et al. Early and late results of contemporary management of 37 secondary aortoenteric fistulae. Eur J Vasc Endovasc Surg. 2011 Jun;41(6):748−757. doi: 10.1016/j.ejvs.2011.02.020. Epub 2011 Mar 16. PMID: 21414817.
- Kakkos SK, Antoniadis PN, Klonaris CN, et al. Open or endovascular repair of aortoenteric fistulas? A multicentre comparative study. Eur J Vasc Endovasc Surg. 2011 May;41(5):625−634. doi: 10.1016/j.ejvs.2010.12.026. Epub 2011 Feb 15. PMID: 21324718.
- Bergqvist Björck M. Secondary arterioenteric fistulation--a systematic literature analysis. Eur J Vasc Endovasc Surg. 2009 Jan;37(1):31−42. doi: 10.1016/j.ejvs.2008.09.023. Epub 2008 Nov 12. PMID: 19004648.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Management ran v „době kovidové“
- Infekce v místě chirurgického výkonu a lokální management rány − metaanalýza
- Antibiotická terapie při léčbě kožního abscesu − metaanalýza
- Infekce cévních rekonstrukcí v aortoilické oblasti – náš pohled ve světle aktuálních doporučení Evropské společnosti cévní chirurgie − retrospektivní observační studie
- Léčba ileokolické invaginace v České republice
- Migrace síťky do tlustého střeva po opravě tříselné kýly – kazuistika
- Perforace tlustého střeva u pacientů s pneumonií covid-19 – kazuistiky
- Primární retroperitoneální mucinózní cystadenokarci-nom v těhotenství – kazuistika
- 3D printed custom-made titanium cranioplasty after repeatedly failed cranial reconstructions and surgical site infections
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Infekce v místě chirurgického výkonu a lokální management rány − metaanalýza
- Antibiotická terapie při léčbě kožního abscesu − metaanalýza
- Léčba ileokolické invaginace v České republice
- Perforace tlustého střeva u pacientů s pneumonií covid-19 – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



